Базисное лечение бронхиальной астмы необходимо для подавления воспаления в дыхательных путях, снижения бронхиальной гиперреактивности, уменьшения бронхиальной обструкции.
Терапевтический курс разрабатывается конкретно под каждого больного, с учетом тяжести болезни, возраста и иных индивидуальных особенностей. Больному астмой прописываются лекарства, необходимые для устранения воспалительного процесса, локализованного в дыхательных путях.
Лечение патологии базируется на применении средств, купирующих астматические приступы, а также препаратов базисной терапии. Вторая группа лекарств призвана оказать воздействие на патогенетический механизм болезни.
Бронхиальная астма – хроническая патология, при которой наблюдается развитие воспалительного процесса в дыхательных путях. Астматики сталкиваются с сужением бронхов, вызванным влиянием внешних и внутренних факторов. Патология проявляется в виде:
- одышки;
- головных болей;
- дыхательной недостаточности;
- свистящих хрипов;
- ощущения заложенности в области грудной клетки;
- постоянного кашля.
Всего в мире насчитывается около 230 000 000 астматиков. В развитых странах применяются схожие принципы лечения патологии, позволяющие многим пациентам достичь стадии устойчивой ремиссии при соблюдении всех врачебных рекомендаций.
Астматикам показана базисная терапия, если бронхиальная астма вызывает ухудшение общего состояния больного. Главная цель при лечении заболевания заключается в том, чтобы не допустить перехода патологии в тяжелую форму, когда она выходит из-под контроля, и развиваются осложнения.
Возможные осложнения из-за активного развития болезни: пневмоторакс, эмфизема, беттолепсия, ателектаз.
Болезнь может быть различной степени тяжести – для каждой из них существует своя схема терапии. При лечении бронхиальной астмы врачи должны решить следующие терапевтические задачи:
- оценка состояния больного и воздействие на проявляющиеся симптомы;
- сведение к минимуму количества приступов (вне зависимости от их интенсивности);
- минимизация побочных эффектов от используемых для базисного лечения лекарственных препаратов;
- обучение астматика навыкам самопомощи при развитии приступов;
- контроль реакции организма пациента на использованные препараты, корректировка назначения, если требуется.
Принято выделять 5 основных ступеней развития бронхиальной астмы, в соответствии с которыми разрабатывается схема лечения:
- На начальной стадии развития патологии больному обычно назначаются бета-адреномиметики короткого действия. Это симптоматические препараты. С их помощью расширяются бронхи, благодаря чему снимается приступ.
- На второй ступени, по решению врача, может быть использовано одно или несколько лекарственных средств. Эти лекарства астматик должен принимать систематически, чтобы остановить развитие воспалительного процесса в бронхах. Обычно назначаются глюкокортикостероиды в виде ингаляций и бета-адреномиметики. Лечение начинается с минимальных доз.
- На третьей ступени в дополнение к уже назначенным лекарствам используются бета-адреномиметики продолжительного действия. Эти препараты расширяют бронхи, поэтому больному проще дышать и говорить.
- На четвертой ступени у пациентов заболевание протекает тяжело, поэтому врачи назначают системные гормональные противовоспалительные препараты. Такие лекарства хорошо справляются с астматическими приступами, но их использование приводит к появлению различных побочных эффектов: диабет, нарушения обмена веществ, синдром отмены и т. д.
Для пятой степени характерно крайне тяжелое состояние пациента. Физическая активность больного ограничена, наблюдается сильная дыхательная недостаточность. Лечение практически всегда проводится в стационаре.
Препараты для базисной терапии бронхиальной астмы должны назначаться врачом, запрещено самостоятельно подбирать себе лекарства. Основные принципы лечения бронхиальной астмы: иммунотерапия и фармакотерапия.
Независимо от возраста и тяжести текущего состояния пациента, лечение начинается с приема небольших доз лекарств. Схема лечения обычно корректируется специалистами с учетом следующих факторов:
- наличие хронических патологий легких;
- текущее состояние астматика (на фоне приема препаратов);
- интенсивность приступов удушья ночью;
- наличие характерных астматических проявлений (одышка, хрипы, кашель);
- результаты анализов;
- продолжительность, частота, выраженность дневных приступов.
При персистирующей астме легкой, средней и тяжелой степени проводится базовая и симптоматическая терапия заболевания.
Обязательно используются бета-адреномиметики (их также называют «ингаляционные 2-агонисты») и другие средства, купирующие приступы и снижающие их число.
Базисная терапия при бронхиальной астме предполагает применение ингаляционных глюкокортикостероидов, системных глюкокортикостероидов, стабилизаторов тучных клеток, лейкотриеновых антагонистов.
Эти препараты для лечения бронхиальной астмы необходимы, чтобы контролировать заболевание, не допустить ухудшения состояния больного.
Глюкокортикостероиды крайне важны для купирования приступов. Они обладают противовоспалительным действием. Использование ингаляционных глюкокортикостероидов позволяет снять обструкцию бронхов за короткий промежуток времени.
К основным плюсам таких ингаляций можно отнести:
- устранение воспалительного процесса в бронхах;
- снижение интенсивности симптоматики заболевания;
- возможность приема сравнительно малых доз препарата;
- сведение к минимуму проникновения действующих веществ лекарства в общий кровоток;
- улучшение проходимости в бронхах.
Ингаляционные глюкокортикостероиды позволяют купировать приступы, но для базисной терапии бронхиальной астмы используются системные глюкокортикостероиды в форме таблеток.
Их назначают, если состояние больного оценивается как среднетяжелое и тяжелое. Эти препараты:
- устраняют спазмы в бронхах;
- улучшают проходимость дыхательных путей;
- устраняют воспалительный процесс;
- уменьшают секрецию мокроты.
Системные глюкокортикостероиды могут быть назначены при тяжелых стадиях заболевания, при ухудшении показателей спирометрии, при отсутствии результатов лечения ингаляционными препаратами и дальнейшем развитии проявлений бронхиальной астмы.
Запрещено самостоятельное применение таких лекарственных средств без назначения врача.
Противовоспалительная терапия бронхиальной астмы включает использование стабилизаторов тучных клеток. Эти препараты назначают больным, у которых наблюдается легкая или средняя тяжесть заболевания.
Стабилизаторы тучных клеток помогают:
- предупредить и устранить аллергию;
- предотвратить возникновение спазмов в бронхах;
- уменьшить воспалительный процесс;
- снизить гиперреактивность бронхов.
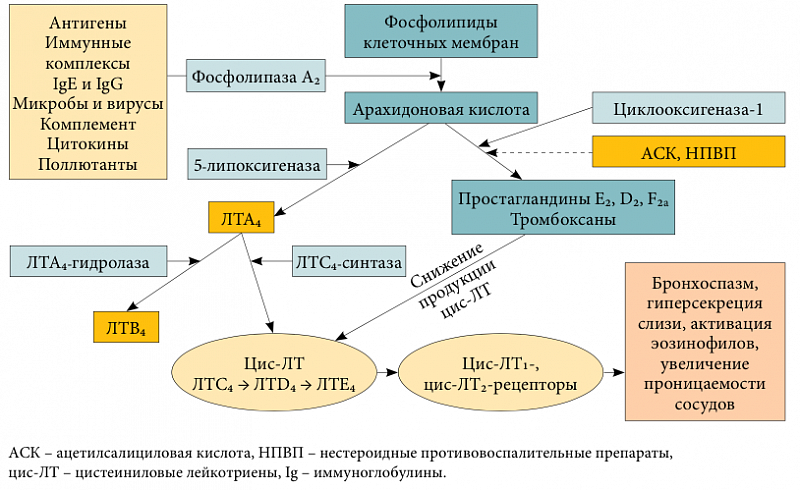
Базовая терапия бронхиальной астмы практически всегда включает в себя использование лейкотриеновых антагонистов. Их основная задача – блокирование лейкотриеновых рецепторов и угнетение активности фермента 5-липоксигеназы.
Из-за этих органических соединений происходит развитие спазмов в бронхах вследствие аллергии на различные раздражители.
Эти препараты обладает сильным противовоспалительным действием, подавляют клеточные и неклеточные компоненты воспаления в бронхах, которое вызывается воздействием антигенов. Также они оказывают следующее действие:
- устранение спазмов в бронхах;
- уменьшение образования мокроты;
- устранение инфильтрации и процесса воспаления в бронхиальных слизистых оболочках;
- увеличение проницаемости мелких сосудов в органах дыхания;
- расслабления гладких мышц в органах дыхания.
Базисная терапия при бронхиальной астме предполагает использование нескольких видов препаратов. Лечение обязательно комплексное.
Врачи, разрабатывая схему лечения, должны решить, как будут устранены у пациента проявления бронхиальной астмы. Не менее важная задача – достижение стойкой ремиссии.
Выбирая тип базисной терапии бронхиальной астмы у детей, специалисты учитывают множество факторов: возраст ребенка, давность появления первых астматических признаков, наличие иных хронических заболеваний, текущее состояние маленького пациента.
Также принимаются во внимание симптомы астмы. Они могут проявляться с разной интенсивностью. У детей, у которых диагностирована бронхиальная астма, наблюдается следующая симптоматика:
- хрипы во время дыхания;
- синюшный оттенок кожи в области носогубного треугольника (при приступе);
- ухудшение общего состояния;
- астматические приступы (при наличии внешнего раздражителя или в ночное время);
- кашель, одышка, проблемы с дыханием.
Для лечения детей используются:
- длительно действующие бронходилататоры;
- лекарственные средства с противовоспалительным эффектом.
- ингаляционные глюкокортикоиды.
Базисная терапия астмы показана всем пациентам, у которых диагностировано заболевание (за исключением больных с интермиттирующей астмой). Но некоторые больные отказываются от приема противовоспалительных средств и от любого другого традиционного лечения бронхиальной астмы, предпочитая народные средства.
Народная медицина в терапии бронхиальной астмы имеет право на существование, однако астматикам ни в коем случае нельзя отказываться от приема противовоспалительных препаратов.
Отказ от лечения и отсутствие контроля со стороны лечащего врача практически в 100% случаев приводит к ухудшению состояния пациента, усилению астматических приступов, развитию осложнений (проблемы с сердцем, головные боли и т.п.).
Поэтому между лечащим врачом и астматиком с самого начала лечения должен быть налажен прямой контакт. Важно, чтобы пациент располагал всей необходимой информацией о своем заболевании:
- Что может спровоцировать развитие астматического приступа?
- Как его можно быстро купировать?
- Какие препараты и в каких дозировках могут быть использованы?
- В каких случаях необходимо вызывать скорую помощь?
Каждый астматик должен знать ответы на эти вопросы. Если лечащий врач не провел соответствующую беседу, больной должен самостоятельно проконсультироваться со специалистом, задав ему интересующие вопросы.
Наличие прямого контакта между врачом и пациентом очень важно в случаях, когда проводится лечение маленького ребенка от бронхиальной астмы. Дети не могут сами принять решение, поэтому их родители должны располагать всей необходимой информацией о заболевании.
Лекарственные средства для лечения бронхиальной астмы, применяемые при базисной терапии, назначают врачом в зависимости от степени тяжести заболевания, частоты и выраженности симптоматики, текущего состояния больного.
Терапия в каждом случае строго индивидуальна, поэтому самолечение при развитии бронхиальной астмы, вне зависимости от ее ступени, исключено.
источник
Проводит: Донецкий национальный медицинский университет
Рекомендован по специальностям: Семейная медицина/Терапия, Аллергология , Пульмонология
Дата проведения: с 01.01.2019 по 31.12.2019
Целью успешного ведения больных бронхиальной астмой (БА) являются:
— устранение и профилактика симптомов заболевания;
— достижение хорошего качества жизни;
— уменьшение потребности в применении b2-агонистов;
— по возможности сохранение легочной функции, близкой к нормальной;
— снижение риска побочных эффектов проводимой терапии;
Каждому пациенту назначают лечение, соответствующее одной из пяти ступеней, или шагов, терапии. Традиционно в русскоязычной среде слово «ступень» использовалось для обозначения тяжести БА и объема необходимой терапии. Однако после 2006 года новый подход к ступенчатой терапии БА перестал быть привязан к тяжести БА. Поэтому во избежание путаницы часто понятие «ступень» используют применительно к тяжести БА, а термин «шаг терапии» — к интенсивности лечения. В данной публикации эти термины используются взаимозаменяемо. На рис. 1 представлена терапия БА на каждом шаге.
На любом шаге терапии пациенты должны использовать по потребности препараты неотложной помощи для быстрого облегчения симптомов, предпочтительнее b2-агонисты короткого действия (БАКД). К альтернативным (менее предпочтительным) препаратам для облегчения симптомов относятся ингаляционные антихолинергические средства, некоторые b2-агонисты длительного действия и теофиллин короткого действия. На шагах 2–5 пациенты дополнительно нуждаются в применении одного или более базисных препаратов.
У большинства больных с впервые выявленной БА или ранее не получавших препаратов базисной терапии следует начинать лечение со 2-го шага терапии (или 3-го — при наличии тяжелых симптомов). Показано, что даже такой мало–интенсивный режим лечения обеспечивает достижение контролируемого состояния заболевания у большинства пациентов. Обычно пациенты посещают врача через 1–3 мес. после первичного визита, затем каждые 3–6 мес. После обострения назначают визит последующего наблюдения в срок от 2 нед. до 1 мес.
Если на фоне текущей терапии БА не контролируется, следует увеличить объем терапии (перейти на следующую ступень). Обычно развернутый эффект от увеличения объема терапии и клинически значимое улучшение наступают в течение 1 мес.
При частично контролируемой БА также следует рассмотреть возможность расширения объема терапии (увеличение на одну ступень). При этом необходимо взвешивать безопасность и стоимость лечения и удовлетворенность пациента достигнутым уровнем контроля над заболеванием.
Если пациент не достигает приемлемого уровня контроля над бронхиальной астмой на фоне лечения, соответствующего 4-му шагу, можно считать, что пациент страдает БА, трудно поддающейся лечению. У таких пациентов допустимо достижение «достаточного» уровня контроля, который обеспечивал бы наилучший возможный контроль над заболеванием при наименьшем риске побочных эффектов терапии.
Если контроль поддерживается в течение 3 мес. и более, следует постепенно уменьшать объем лечения, переходя на более низкий шаг терапии. При этом целью является достижение наименьшего возможного объема лечения, обеспечивающего поддержание контроля над БА.
Даже после достижения контроля необходимо продолжать мониторирование, так как БА представляет собой вариабельное заболевание, при котором периодически требуется коррекция терапии в ответ на утрату контроля, проявляющуюся ухудшением течения заболевания или развитием обострения.
Для достижения целей лечения БА используют как фармакологические, так и нефармакологические лечебные подходы.
Лекарственные препараты, используемые при лечении больных с БА, классифицируются на базисные, обеспечивающие контроль заболевания (от англ. controllers), и симптоматические (от англ. relievers), устраняющие кратковременные ухудшения симптоматики БА.
Базисная терапия характеризуется ежедневным приемом лекарственных препаратов в течение неопределенно длительного времени с целью клинического контроля БА благодаря преимущественно противовоспалительным эффектам; симптоматическая терапия — приемом быстродействующих препаратов для устранения бронхоспазма и связанных с ним симптомов.
Пути введения лекарственных препаратов включают ингаляционные, пер–оральные и парентеральные (внутривенные, подкожные и внутримышечные). Преимущество ингаляционного приема препарата обусловлено его непосредственным поступлением в дыхательные пути и созданием при этом эффективных местных концентраций, что снижает риск развития или уменьшения выраженности побочных эффектов препарата.
Ингаляционные препараты для лечения БА представлены в виде различных доставочных устройств, различающихся по эффективности доставки лекарственного препарата в нижние дыхательные пути, а также простоте и доступности применения. Основные классы доставочных устройств — дозирующие аэрозольные ингаляторы (ДАИ) и их модификации (например, устройства, активируемые вдохом) и дозирующие порошковые ингаляторы (ДПИ). Представляет интерес также новое устройство типа soft mist, которое без использования пропеллента создает «медленное» мелкодисперсное облачко препарата, значительно улучшающее доставку. Достоинством ДАИ является невысокая цена, что делает их хорошим выбором для пациента, способного синхронизировать вдох и нажатие на распылитель. В противном случае могут быть использованы вспомогательные средства (спейсер) или другие типы доставочных устройств. Следует помнить, что у некоторых пациентов с тяжелой БА и снижением инспираторного резерва может снижаться эффективность применения ДПИ.
Эффективность доставки препарата в нижние отделы дыхательных путей зависит от таких факторов, как тип ингалятора и форма лекарственного средства, размер частиц, скорость аэрозольного потока или облачка и простота применения устройства. В связи с этим критически важным является выбор подходящего доставочного устройства, адекватное обучение пациента и регулярная проверка техники ингаляции.
Симптоматическая терапия бронходилататорами направлена на быстрое устранение бронхоконстрикции и обусловленных ею симптомов, что достигается за счет релаксации гладкой мускулатуры дыхательных путей. Бронходилататоры действуют преимущественно на гладкую мускулатуру дыхательных путей, что ведет к быстрому устранению симптомов, оказывая в лучшем случае незначительный противовоспалительный эффект.
В современной практике применяется три класса бронходилататоров: b2-адренергические агонисты, антихолинергические препараты и теофиллин, среди которых наиболее эффективны b2-агонисты.
b2-агонисты короткого действия (БАКД). Короткодействующие b2-агонисты являются средством выбора для устранения бронхоспазма при остром приступе астмы или, в некоторых случаях, для его профилактики. К ним относятся сальбутамол, тер–буталин, фенотерол. Продолжительность их действия составляет 3–6 часов.
b2-агонисты активируют b2-адре-нергические рецепторы, широко представленные в дыхательных путях. При их стимуляции увеличивается внутри–клеточный циклический АМФ, релак–сирующий гладкомышечные клетки и ингибирующий некоторые клетки воспалительного каскада.
Ведущим механизмом действия b2-агонистов является релаксация гладко-мышечных клеток всех дыхательных путей, где они действуют в качестве функциональных антагонистов, устраняя и превентируя бронхоконстрикцию. Такой эффект обусловливает их высокую эффективность в качестве бронходилататоров при астме. Кроме того, b2-агонистам присущ ряд небронходилатирующих эффектов, включающих ингибирование освобождения медиаторов тучных клеток, снижение экссудации плазмы и ингибирование активации сенсорных нервов. В отличие от глюкокортикоидов b2-агонисты не оказывают эффект на воспалительные клетки в дыхательных путях и не снижают их гиперчувствительность.
Эффекты b-адренергических агонистов на дыхательные пути:
— Релаксация гладкой мускулатуры в проксимальных и дистальных отделах дыхательных путей.
— Ингибирование освобождения медиатора тучных клеток.
— Ингибирование экссудации плазмы и развития отека дыхательных путей.
— Увеличение мукоцилиарного кли–ренса.
— Увеличение секреции слизи.
— Не оказывают эффект на хроническое воспаление.
Ингаляции БАКД обычно используются для быстрого устранения симптомов БА. Необходимость в их частом применении свидетельствует о недостаточном контроле БА, требующем коррекции базисной терапии.
Развитие побочных эффектов при использовании ингаляционных b2-агонистов в большинстве случаев не является проблемой. Иногда (более характерно для пожилых) развиваются тремор, тахикардия и аритмии. У части больных наблюдается незначительное снижение плазменного калия. Этот эффект не представляет серьезной клинической проблемы и не требует назначения препаратов калия.
У больных, которые не способны принимать ингаляционные препараты, допустимо применение пероральных БАКД. Однако при этом наблюдается существенное уве–личение частоты и тяжести побочных эффектов.
Антихолинергические препараты. Короткодействующие антихолинергические препараты, используемые при БА, включают ипратропиум бромид и окситропиум бромид. Их способность устранять бронхоконстрикцию уступает таковой БАКД. В метаанализе исследований, где ингаляционный ипратропиум бромид применялся в комбинации с БАКД у больных с обострением БА, было показано, что дополнительное назначение ипратропиума ассоциировалось со статистически значимым, хотя и умеренным улучшением легочной функции и существенным снижением риска повторных госпитализаций. Преимущества ипратропиума над БАКД при длительном применении не установлены. При тяжелом обострении БА антихолинергические препараты следует применять только после БАКД, так как они характеризуются медленным началом бронходилатации. Вместе с тем ипратропиум может служить альтернативным бронходилататором для больных со значительными побочными эффектами от БАКД, включающими тремор, тахикардии и аритмии.
Побочные эффекты ингаляционных ипратропиума и окситропиума включают сухость и горький вкус во рту. У пожилых больных иногда наблюдаются задержка мочи и развитие или усугубление глау–комы.
Теофиллин. В течение длительного времени пероральный теофиллин широко использовался в качестве бронходилататора. В настоящее время ведущую позицию в лечении БА заняли ингаляционные b2-агонисты благодаря своему мощному бронходилатирующему эффекту и меньшей частоте побочных эффектов.
Непролонгированные формы теофиллина у некоторых больных могут быть использованы для устранения симптомов. У лиц, получающих b2-агонисты, они не оказывают никакого дополнительного бронходилатирующего эффекта.
Эуфиллин (растворимая соль теофиллина) ранее широко использовался внутривенно для устранения симптомов у больных с тяжелой БА. Сегодня его применение ограничивается случаями тяжелого обострения астмы, рефрактерного к высоким дозировкам БАКД.
Вопросы дозирования, безопасности и побочных эффектов теофиллина более детально раскрыты ниже в разделе, посвященном базисной терапии.
Системные глюкокортикоиды. Системные ГК не рассматриваются как симптоматические препараты. Они находят применение при тяжелых обострениях БА, что рассматривается в главе, посвященной лечебной тактике при обострениях заболевания.
Ингаляционные глюкокортикоиды (ИГК)
ИГК сегодня рассматриваются как наиболее эффективные противовоспалительные средства в лечении персистирующей БА. В многочисленных исследованиях продемонстрирована их способность уменьшать частоту и интенсивность симптомов астмы, улучшать качество жизни и показатели легочной функции, снижать гиперчувствительность дыхательных путей, контролировать воспалительные процессы в них, снижать частоту и тяжесть обострений и летальность.
Однако важно отметить, что ИГК не излечивают астму и после прекращения их использования у многих больных наблюдается возвращение симптомов и ухудшение течения заболевания (ухудшение качества жизни и показателей легочной функции, увеличение риска обострений и связанных с ними осложнений).
Различные ИГК различаются по их активности и биодоступности. Однако эти различия не ассоциируются с заметными различиями в клинической эффектив–ности.
В табл. 1 показаны приблизительно эквивалентные дозы различных ИГК, базирующиеся на данных исследований.
В большинстве случаев желаемый эффект ИГК у взрослых больных достигается при использовании низких дозировок, эквивалентных 400 мг будесонида в сутки. Увеличение дозировок не всегда улучшает контроль БА, но ассоциируется с увеличением риска побочных эффектов. Следует подчеркнуть довольно широкую вариабельность эффекта ИГК у различных больных, что требует индивидуального подхода к выбору оптимальной дозировки. Часть больных с тяжелой БА нуждается в длительном применении высоких дозировок ИГК, что обеспечивает хороший контроль заболевания.
У курящих больных снижается эффект ИГК, что обычно требует увеличения дозировок.
При недостаточном контроле БА под влиянием низких или умеренных дозировок обычно следует не увеличивать их дозировку, а назначить дополнительно другой класс базисных препаратов.
Побочные эффекты ИГК. Локальные побочные эффекты ИГК включают орофарингеальный кандидоз, дисфонию и реже — кашель, обусловленный раздражением верхних дыхательных путей. Новые доставочные устройства снижают риск этих побочных эффектов. Риск развития орального кандидоза снижается при полоскании рта водой после ингаляции.
Поступающие в легкие ИГК в определенной мере проявляют системную биодоступность. Развитие системных побочных эффектов, их характер и выраженность при лечении ИГК зависят от многих факторов, включающих дозу и активность препаратов, системную биодоступность, конверсию в неактивные метаболиты в печени и периода полувыведения системно абсорбированных глюкокортикоидов. Следовательно, системные побочные эффекты неоднозначны для различных ИГК. В ряде исследований продемонстрированы менее выраженные системные эффекты у будесонида, циклесонида и флутиказона пропионата. Представлены убедительные доказательства, что у взрослых, получающих будесонид в дозе 400 мг и менее в сутки, системные побочные эффекты препарата не являются клинически значимыми.
Системные побочные эффекты, риск развития которых увеличивается у больных, длительно принимающих максимальные дозы ИГК, включают надпочечниковую недостаточность, снижение минеральной костной плотности, остеопороз, повышенный риск переломов, кушингоид и др. Имеются неоднозначные доказательства относительно риска развития катаракты, глаукомы и легочных инфекций, включая туберкулез. Тем не менее считается общепризнанным, что они не противопоказаны больным с активным туберкулезом.
Антилейкотриеновые препараты (АЛП)
АЛП включают антагонисты CysLT1-рецепторов цистеиниловых лейкотриенов (монтелукаст, пранлукаст и зафирлукаст), а также ингибитор 5-липооксигеназы (зилеутон).
АЛП обладают слабым и вариабельным бронходилатирующим эффектом, уменьшают тяжесть симптомов, включая кашель, улучшают показатели легочной функции, снижают воспаление в дыхательных путях и риск обострений БА. Они могут быть альтернативой ИГК для лечения пожилых больных с легкой персистирующей БА, а также для лиц с аспириновой астмой. АЛП менее эффективны в достижении контроля БА, чем низкие дозы ИГК. Не рекомендуется назначать АЛП вместо ИГК, так как это может привести к утрате контроля БА.
У больных с умеренной или тяжелой БА АЛП могут использоваться в качестве дополнительной базисной терапии к ИГК, позволяя при этом снижать высокие дозировки последних. Однако в качестве дополнения к терапии ИГК они уступают в эффективности ингаляционным b2-агонистам продленного действия (БАДД).
Побочные эффекты. АЛП характеризуются хорошей переносимостью, побочные эффекты характеризуются как несущественные.
БАДД, включая формотерол и сальметерол, не рекомендуется использовать в качестве монотерапии при БА, так как они не оказывают противовоспалительный эффект в дыхательных путях. БАДД более эффективны в комбинации с ИГК. Такая комбинация особенно предпочтительна в случаях, когда умеренные дозы ИГК не способны обеспечить достаточный контроль БА.
Комбинация ИГК с БАДД снижает или устраняет клинические проявления астмы, улучшает показатели легочной функции, снижает необходимость в применении b2-агонистов короткого действия, уменьшает риск обострений и частоту госпитализаций, а также позволяет достигать контроля БА у большего числа больных в более короткие сроки при более низких дозах ИГК, чем при их самостоятельном применении.
Представленные выше преимущества комбинированного применения ИГК с БАДД послужили основанием для создания ингаляторов, содержащих фиксированные комбинации ИГК с БАДД (например, флутиказона пропионат с сальметеролом; будесонид с формотеролом; беклометазон с формотеролом). Такие фиксированные комбинации характеризуются более существенным преимуществом по сравнению с самостоятельным применением ИГК и БАДД, повышают приверженность больных к лечению. Кроме того, ингаляторы, содержащие фиксированную комбинацию формотерола и будесонида, могут использоваться одновременно как для купирования симптомов (reliever), так и для регулярной базисной терапии (controller). Такой режим применения одного и того же ингаляционного средства получил название SMART-терапии (Single Inhaler Maintenance and Reliever Therapy).
БАДД, применяемые в комбинации с ИГК, способны эффективно превентировать бронхоспазм, индуцированный физической нагрузкой.
Сальметерол и формотерол обеспечивают примерно равную по продолжительности бронходилатацию. Однако формотерол проявляет бронходилатирующий эффект более быстро, чем сальметерол, что позволяет использовать его как для устранения симптомов БА, так и для их профилактики.
Побочные эффекты. Применение БАДД может быть связано с риском развития ряда побочных эффектов, включающих тахикардию, аритмии, тремор и гипокалиемию. Регулярное использование b2-агонистов (короткого и продленного действия) может привести к снижению чувствительности к ним. В ряде метаанализов показано незначительное увеличение риска смертности у больных БА, получавших БАДД в комбинации с ИГК, по сравнению с лицами, получавшими монотерапию ИГК. Однако способность комбинации ИГК с БАДД надежно контролировать течение БА, снижать частоту обострений и улучшать показатели легочной функции служит важным аргументом в необходимости дополнительного назначения БАДД к ИГК у большинства больных БА.
Тиотропий — ингаляционный антихолинергический препарат продленного действия, ингибирующий констрикцию гладкомышечных клеток и секрецию слизистой бронхов. Кроме того, представлены доказательства способности тиотропия оказывать противовоспалительный эффект в дыхательных путях.
В течение десятилетий антихолинергические агенты широко используются для лечения больных с хроническими обструктивными заболеваниями легких (ХОЗЛ). Многие клиницисты относят антихолинергические средства к бронходилататорам первой линии при ХОЗЛ. В лечении БА антихолинергические препараты менее популярны, что, очевидно, связано с медленным началом их действия и менее выраженным бронходилатирующим эффектом по сравнению с БАДД.
Дополнительное применение тиотропия у больных с тяжелым течением БА, где комбинация ИГК с БАДД не способна обеспечить оптимальный контроль БА, изучено в нескольких небольших исследованиях, результаты которых неоднозначны. В одном крупном исследовании (912 больных с неконтролируемой БА на фоне применения комбинации ИГК с БАДД) продемонстрировано благоприятное влияние дополнительного назначения ингаляционного тио–тропия. В группе пациентов, получавших в дополнение к ИГК/БАДД тиотропий, имела место существенная пролонгация вре–мени до обострения БА и более выраженная бронходилатация, чем в группе лиц, –получавших плацебо.
Теофиллин имеет слабую бронходилатирующую эффективность. При применении в низких дозировках оказывает также небольшое противовоспалительное действие в дыхательных путях. Данные о способности таблетированного теофиллина продленного действия длительно и успешно контролировать БА отсутствуют. Он может применяться дополнительно к терапии ИГК, если не достигается достаточный контроль заболевания. Отмена теофиллина в такой комбинации может сопровождаться ухудшением контроля БА. При комбинации с ИГК теофиллин менее эффективен, чем БАДД.
Побочные эффекты. Применение теофиллина в дозе 10 мкг/кг/сут и более может сопровождаться довольно существенными побочными эффектами. В связи с этим необходим тщательный подбор дозы препарата. Побочные эффекты включают гастроинтестинальные симптомы, тахикардию, различные аритмии. Увеличение плазменных уровней теофиллина часто сопровождается увеличением риска развития побочных эффектов при заболеваниях печени, застойной сердечной недостаточности, одновременном приеме ряда лекарственных препаратов (циметидин, хинолоны, макролиды).
Роль кромогликата натрия и недокромила натрия в лечении БА очень ограничена. Имеются сообщения об их эффективности у больных с легкой астмой и при постнагрузочном бронхоспазме. Их противовоспалительный эффект слабый и значительно уступает ИГК.
Побочные эффекты не существенны и включают кашель, проявляющийся во время ингаляции, и раздражение слизистой оболочки глотки.
Применение анти-IgE-антител (омализумаб) ограничивается больными с тяжелой БА и высокими сывороточными уровнями IgE, у которых использование ИГК не способно обеспечить достаточный контроль заболевания. Применение омализумаба в комбинации с ИГК безопасно.
Длительное применения (более 2 недель) пероральных СГК ограничивается редкими случаями тяжелой БА, не контролируемой общепринятыми лечебными подходами. Длительное применение СГК ограничено развитием тяжелых побочных эффектов, включающих развитие остеопороза, спонтанных переломов, сахарного диабета, артериальной гипертензии, ожирения, мышечной слабости, гипокалиемии, истончение кожи, угнетение гипоталамо-гипофизарно-надпочечниковой системы. Пациентам, вынужденным длительно принимать СГК, следует также принимать препараты для профилактики остеопороза.
С целью уменьшения побочных эффектов глюкокортикоидов делаются попытки их комбинации с препаратами цитотоксического действия (например, метотрексатом). Однако существенные побочные эффекты метотраксата и не подтвержденный в крупных контролируемых исследованиях эффект не позволяют сегодня рекомендовать его в широкой клинической практике.
Эффективность длительного применения макролидов при БА активно изучается. Сделать вывод об обоснованности их применения можно будет только после окончания крупных исследований.
Роль АСИТ в лечении БА у взрослых ограничена. Для проведения адекватной иммунотерапии необходимо знать клинически значимые антигены у конкретного пациента. С целью формирования толерантности вводятся специфические аллергены в нарастающих дозах. По данным крупного Кокрановского метаанализа (75 контролируемых рандомизированных исследований), у больных с БА специфическая иммунотерапия показала благоприятный эффект по сравнению с плацебо, включающий снижение количества и тяжести симптомов, потребности в медикаментах для базисной терапии, а также гиперреактивности дыхательных путей. Однако представленный благоприятный эффект заметно уступает традиционным медикаментозным подходам при лечении БА. Кроме того, применение АСИТ сопряжено с рядом побочных эффектов (местных и системных). Системные побочные эффекты включают анафилактические реакции, тяжелое обострение БА. Описаны летальные исходы у больных с БА при применении АСИТ.
Возможность применения АСИТ может быть рассмотрена у пациентов, у которых тщательная элиминация аллергенов и традиционная базисная терапия с применением ИГК не позволили достигнуть контроля БА.
Современное определение обострений БА приведено в рекомендациях Американского торакального общества и Европейского респираторного общества по определению контроля и обострений астмы (2009) и рекомендациях GINA (2012): «Обострения БА — острые или подострые эпизоды прогрессирования симптомов БА (одышки, кашля, свистящего дыхания, скованности грудной клетки или их сочетания) относительно привычного для пациента уровня. Эти эпизоды принципиально отличаются от неудовлетворительного контроля астмы: при обострении БА обычно отсутствует значительная суточная вариабельность показателей скорости воздушного потока (ключевой маркер неудовлетворительного контроля БА), но наблюдается их снижение по сравнению с состоянием до обострения.»
Можно отметить, что в современных клинических рекомендациях подчеркнута практическая невозможность отличить легкие обострения астмы (ОА) от транзиторной утраты контроля БА.
Алгоритм лечебной тактики при ОА представлен на рис. 2.
Лечение обострений БА преследует следующие цели: 1) поддержание адекватной сатурации кислорода, 2) улучшение функции внешнего дыхания и 3) уменьшение воспаления в бронхах для ускорения разрешения бронхиальной обструкции и предотвращения рецидива обострения. Для достижения этих целей применяют ряд обсуждаемых ниже лечебных подходов.
БАКД занимают ведущее место в терапии ОА. Сальбутамол, применяемый в виде как ДАИ, так и раствора для небулизации, благодаря своей высокой бронходилатирующей эффективности, быстрому началу действия и хорошей переносимости является наиболее часто используемым БАКД во всем мире. Во всех современных рекомендациях подчеркивается, что ингаляционные БАКД должны получать все пациенты с обострениями БА, ввиду того что «…это самый эффективный способ устранения бронхиальной обструкции. Примерно у 60–70 % пациентов наблюдается достаточная бронходилатирующая эффективность и хорошая переносимость повторных доз БАКД уже на начальном этапе оказания помощи при ОА» (GINA, 2012). При купировании ОА используются высокие дозы БАКД. В случае использования небулайзерных ингаляций обычно применяют сначала 5 мг сальбутамола (2 небулы), затем через каждые 20 минут дополнительно по 2,5 мг (по 1 небуле). При использовании сальбутамола в виде ДАИ со спейсером также используют высокие дозы. На начальном этапе терапии обычно применяют до 1200 мкг в течение первого часа. Обученный использованию ДАИ со спейсером медперсонал отмеряет по 1 дозе сальбутамола в спейсер, контролирует правильность вдоха пациентом и повторяет это еще 3 раза до достижения общей дозы 400 мкг. В дальнейшем такая последовательность повторяется каждые 20 минут. На следующих этапах доза сальбутамола может быть увеличена (в зависимости от тяжести обструкции) до 6–10 вдохов через спейсер каждый час.
Использование высоких доз b2-аго-нистов при тяжелой обструкции объясняется необходимостью преодоления –существенных анатомических препятствий (отек слизистой, спазм, скопления слизи в просвете бронхов), а также дозозависимым характером эффективности БАКД. Безопасность таких доз подтверждена длительной клинической практикой и обширной доказательной базой. Убедительно доказано, что даже удвоение рекомендуемой дозы сальбутамола (до 2,4 мг в час, по 4 последовательные дозы через ДАИ + спейсер каждые 10 минут или по 2,5–5 мг каждые 20 минут через небулайзер) обеспечивает низкую сывороточную концентрацию и минимальное количество побочных эффектов.
У пациентов, у которых после начальной терапии сохраняется выраженная бронхиальная обструкция (ОФВ1 и ПСВ чем 75% вопросов.
источник
Втечение последних двух десятилетий достигнуты значительные успехи в ведении пациентов с бронхиальной астмой (БА) благодаря использованию улучшенных стратегий диагностики, терапии и профилактики болезни
Втечение последних двух десятилетий достигнуты значительные успехи в ведении пациентов с бронхиальной астмой (БА) благодаря использованию улучшенных стратегий диагностики, терапии и профилактики болезни. Прогресс был обусловлен внедрением в клиническую практику глобальной инициативы по стратегии лечения и профилактики астмы — GINA [23], Международных (PRACTALL) [6], национальных программ [2]. Несмотря на то, что у детей и взрослых в формирование болезни включаются одинаковые механизмы, существуют определенные отличия течения астмы, ответа на противоастматические препараты у взрослых и детей. Россия является одной из немногих стран, где была принята Национальная программа «Бронхиальная астма у детей. Стратегия лечения и профилактики». Это руководство (в 2008 г. вышло третье издание) существенно повлияло на медицинскую практику и, как следствие, на улучшение результатов лечения пациентов. Однако астма часто дебютирует в раннем детстве, и существуют особые проблемы, связанные с диагностикой и лечением астмы у детей первых пяти лет жизни [28].
Клиническая диагностика
Современное определение астмы сфокусировано на хроническом воспалительном процессе в дыхательных путях, в котором принимают участие многие клетки и клеточные элементы. Для астмы типичны четыре главных компонента:
- симптомы;
- обратимость бронхиальной обструкции;
- бронхиальная гиперреактивность;
- воспаление.
Какой-то один домен не может быть основой для диагноза, но не все исследователи имеют возможность объективно оценивать все четыре компонента, особенно в педиатрии. Поэтому у детей первых пяти лет жизни рекомендуется для постановки диагноза БА использовать тщательный сбор семейного и индивидуального анамнеза, анализ симптомов, физикальное обследование.
Для детей пяти лет и младше, имеющих повторяющиеся респираторные симптомы, предположить диагноз БА позволяет семейный анамнез — указания на наличие астмы у ближайших родственников (особенно матери), и/или атопии (атопический дерматит, экзема), пищевой аллергии, аллергического ринита у кровных родственников или самого ребенка.
К основным симптомам астмы относятся свистящие хрипы, эпизоды одышки, кашель, заложенность в грудной клетке.
Свистящие хрипы
Свистящие хрипы (wheeze) — непрерывные музыкальные звуки, продолжающиеся не менее 250 мс и вызываемые вибрацией противоположных стенок дыхательных путей, что приводит к их сужению вплоть до полного закрытия. Хрипы могут быть высоко- и низкотональными, состоящими из одного или нескольких звуковых оттенков, возникающих как во время вдоха, так и выдоха, создаваемых дыхательными путями любого размера — от крупных экстраторакальных до мелких интраторакальных. К появлению свистящих хрипов может приводить обструкция: верхних и нижних экстраторакальных дыхательных путей, нижних дыхательных путей. Астма не является самой частой причиной свистящих хрипов. У детей, особенно в возрасте младше трех лет, отмечается чрезвычайно широкая распространенность хрипов в грудной клетке и кашля даже в отсутствие БА [18, 29]. Выделяют три типа свистящих хрипов в младшей возрастной группе:
- нередко связаны с недоношенностью и курением родителей;
- дети часто «перерастают» эти хрипы в первые три года жизни.
Персистирующие хрипы с ранним началом (в возрасте до трех лет) у детей без признаков атопии или семейного анамнеза атопии:
- эпизоды хрипов в грудной клетке, обусловленные респираторными вирусными инфекциями: у детей до двух лет с респираторно-синцитиальной вирусной инфекцией; у детей дошкольного возраста старше двух лет — с прочими вирусными инфекциями;
- эти эпизоды, как правило, продолжаются и в школьном возрасте, к 12 годам их можно выявить у значительной части детей.
Хрипы с поздним началом/БА:
- отмечаются в течение всего детства и во взрослом возрасте;
- типична атопия в анамнезе (часто проявляющаяся как атопический дерматит/экзема) и характерные для БА нарушения бронхиальной проходимости;
- для астмы характерны периодически возникающие хрипы, а также хрипы, возникающие во время сна, смеха, при плаче.
Кашель как симптом БА у детей младшей возрастной группы имеет следующие особенности:
- возникает периодически или присутствует постоянно (вне связи с простудой или респираторной инфекцией);
- нередко сопровождается хрипами и затрудненным дыханием, одышкой;
- типично появление кашля в ночное время или перед пробуждением;
- физическая нагрузка, смех, плач усиливают кашель.
Дополнительные методы обследования для подтверждения диагноза астмы
Исследование функции легких нередко является недостаточно надежным методом у детей младшего возраста. Дети в возрасте 4–5 лет могут научиться пользоваться пикфлоуметром, однако для получения точных результатов пикфлоуметрия должна проводиться под наблюдением родителей.
В научных целях в крупных исследовательских центрах используются такие методы, как бодиплетизмография для измерения сопротивления дыхательных путей, определения легочных объемов, методы разведения газов (обычно с использованием гелия) и вымывания инертных индикаторных газов (обычно азот); импульсная осциллометрия, повышение объема форсированного выдоха при торакоабдоминальной компрессии (RVRTC — Raised-Volume Rapid Thoracoabdominal Compression) и др. [5, 30]. Эти исследования требуют сложного оборудования, что затрудняет их применение в рутинной клинической практике. В России был предложен метод бронхофонографии, который позволяет с помощью компьютера анализировать паттерны дыхания и дает дополнительную информацию о характере нарушения дыхательной функции [1].
Эпизодические респираторные симптомы, такие как свистящее дыхание и кашель, часто могут встречаться и у детей без астмы, особенно в первые два года жизни. Поскольку в данной возрастной группе отсутствует возможность оценивать бронхиальную обструкцию и ее обратимость с помощью объективных методов, то дополнительное использование тестов для выявления атопии и обнаружение аллергенспецифических IgE может быть дополнительным аргументом для подтверждения диагноза астмы. Аллергическая сенсибилизация — главный фактор риска для развития астмы, персистенции и тяжести. Наличие атопического дерматита у ребенка и/или пищевой аллергии увеличивает риск сенсибилизации к ингаляционным аллергенам и может быть предиктором развития астмы.
У детей младшей возрастной группы более информативным по сравнению с кожными пробами (prick-test) является обнаружение аллергенспецифических IgE в сыворотке с помощью лабораторных тестов (Phadia: ImmunoCAP System® — «золотой стандарт» диагностики по рекомендации ВОЗ; множественная диагностика аллергии с применением хемилюминесцентного анализа (МАСТ); иммуноблот для диагностики аллергенспецифических IgE-антител в сыворотке крови человека на основе панелей с индивидуальными аллергенами с помощью системы Rida® Allergy Screen; иммуноферментный анализ (ИФА) и др.).
Полезным методом подтверждения диагноза астмы в этой возрастной группе является пробное лечение бронходилятаторами короткого действия и ингаляционными глюкокортикостероидами (ИГКС): выраженное клиническое улучшение на фоне терапии в течение 8–12 недель и ухудшение после ее прекращения говорят в пользу диагноза «бронхиальная астма».
Неинвазивные маркеры воспаления в дыхательных путях (определение оксида азота в выдыхаемом воздухе — NОx или окиси углерода СОx неспецифичны для БА, также требуют специального оборудования и пока не рекомендуются для рутинной практики у детей раннего возраста [25].
Рентгенографическое исследование грудной клетки не играет большой роли в диагнозе БА. Данный метод помогает исключить другие заболевания. У детей чаще всего это структурные аномалии дыхательных путей (например, врожденные пороки развития, врожденная эмфизема долевая, сосудистое кольцо) или другие диагнозы [28].
Таким образом, подходы к диагностике БА у детей в возрасте пяти лет и младше отличаются от других возрастных групп. Диагноз БА обычно основывается только на жалобах, данных анамнеза и осмотра и типичных симптомах.
Признаками вероятной БА у детей в возрасте пяти лет и младше являются:
- частые эпизоды свистящих хрипов в грудной клетке (более одного в месяц);
- кашель или хрипы, вызванные физической нагрузкой;
- кашель по ночам в отсутствие вирусной инфекции;
- отсутствие сезонных изменений хрипов, а также сохранение симптомов после трех лет.
Дифференциальная диагностика
Для окончательного принятия решения о диагнозе БА необходимо исключить заболевания, которые также могут сопровождаться повторными эпизодами свистящих хрипов у детей:
- инфекционные процессы (повторные вирусные инфекции нижних дыхательных путей, хронический риносинусит, туберкулез);
- врожденные аномалии (бронхолегочная дисплазия, синдром первичной цилиарной дискинезии, муковисцидоз, иммунодефицит; пороки развития, обусловливающие сужение внутригрудных дыхательных путей; врожденные пороки сердца, трахеомаляция);
- механические проблемы (аспирация инородного тела, гастроэзофагеальный рефлюкс).
Опыт изучения и практического использования тех знаний и положений доказательной медицины, которые накопили ведущие специалисты при диагностике астмы у детей младших возрастных групп, оказался полезным для оценки прогноза развития БА у детей раннего возраста со свистящими хрипами. У детей в возрасте пяти лет и младше сочетание свистящих хрипов с одним «большим» фактором риска (к большим факторам риска относится БА или экзема у родителя) или двумя-тремя «малыми» факторами риска (к малым факторам риска относится эозинофилия; наличие хрипов в отсутствие простудного заболевания; аллергический ринит) является предиктором развития БА в старшем возрасте. Для оценки прогноза развития астмы разработан индекс прогноза астмы (Asthma Predictive Index — API). Было показано, что дети, у которых было четыре и более эпизодов бронхиальной обструкции в течение года и API от 4 до 10, имеют шанс в возрасте от 6 до 10 лет заболеть астмой, в то время как у 95% детей с отрицательным API астма не развивается [8, 12, 14, 15, 19].
Лечение астмы у детей пяти лет и младше
После верификации диагноза астмы выбираются оптимальные стратегии терапевтических вмешательств с точки зрения доказательной медицины.
Важным компонентом лечения является создание партнерских отношений между врачом и родителями (опекунами), членами семьи больного ребенка. Повышают эффективность терапии образовательные программы.
Определение болезни звучит следующим образом: «Бронхиальная астма — хроническое заболевание дыхательных путей, в котором принимают участие многие клетки и клеточные элементы. Хроническое воспаление обусловливает развитие бронхиальной гиперреактивности, которая приводит к повторяющимся эпизодам свистящих хрипов, одышки, чувства заложенности в груди и кашля, особенно по ночам или ранним утром. Эти эпизоды обычно связаны с распространенной, но изменяющейся по своей выраженности обструкции дыхательных путей в легких, которая часто бывает обратимой спонтанно или под влиянием лечения». Исходя из такого определения, невозможно говорить о выздоровлении от болезни, поэтому целью терапии является достижение контроля. Понятие контроля астмы включает в себя два обязательных компонента — не только текущий контроль (контроль «сейчас» — отсутствие симптомов, минимальную потребность в препаратах скорой помощи, нормальные показатели легочной функции, а также возможность пациента вести активный образ жизни), но и снижение рисков в будущем (контроль «завтра»), как это представлено в новой версии GINA (табл. 1).
Значимость различий между «текущим контролем» (по оценке влияния на симптомы, клинические признаки астмы, их уменьшение или исчезновение в последние несколько недель или месяцев) и «будущими рисками» (вероятность развития осложнений лекарственной терапии, появления обострений, замедление развития легких) и отношения между этими двумя компонентами у маленьких детей изучены в меньшей степени, чем в других возрастных группах. Но, тем не менее, в настоящее время получены убедительные доказательства того, что клинические проявления астмы, симптомы, нарушения сна, ограничения повседневной активности, нарушение функции легких, частота использования бронхорасширяющих препаратов могут хорошо контролироваться соответствующей базисной терапией.
У детей младшей возрастной группы имеются свои особенности в оценке уровней контроля (табл. 2). Они основаны на клинических признаках, отсутствует определение функции внешнего дыхания (ФВД), отличается подход к определению неконтролируемой астмы [2, 6, 27, 28].
Несмотря на то, что терапия ИГКС является краеугольным камнем терапии у детей младшей возрастной группы, предметом дискуссии остается вопрос о том, как рано следует начинать базисную терапию, стоит ли уже после 1–2 эпизодов бронхиальной обструкции включать на регулярной основе ИГКС у детей раннего возраста. Существуют определенные опасения по поводу раннего (после 1–2 эпизодов обструкции) назначения ИГКС у маленьких детей. Сдержанное отношение обусловлено тем, что ИГКС могут оказывать влияние на рост альвеол, есть определенные трудности в прогнозировании хорошей эффективности, продолжительное лечение ИГКС у маленьких детей не всегда влияет на естественное течение заболевания и, кроме того, клеточное воспаление и ремоделирование могут зависеть от других патогенетических механизмов. Поскольку пока нет доказательств, что использование ИГКС в подобных случаях приносит пользу, большинство экспертов считает, что использование ИГКС должно быть ограничено только контингентом детей с атопической экземой, или аллергической сенсибилизацией, или отягощенным по атопии семейным анамнезом с тремя и более эпизодами бронхоспазма, развившегося на фоне вирусной инфекции [7, 9, 24, 28]. Эквипотентные дозы ИГКС для детей этой группы представлены в табл. 3.
Как и в других возрастных группах, у детей пяти лет и младше предпочтение отдается ингаляционной терапии. Выбор ингаляционного устройства проводится на индивидуальной основе [2, 6, 13, 17, 23, 28]. Возможные способы доставки представлены в табл. 4.
При использовании низких доз ИГКС клинически значимых серьезных побочных системных эффектов в клинических испытаниях не установлено и препараты считаются безопасными (уровень доказательности А). Более высокие дозы могут сопровождаться некоторыми системными эффектами [2, 3, 23].
Антилейкотриеновые препараты
Важным вариантом лечения для детей с БА в возрасте ≤ 5 лет кроме ИГКС являются антилейкотриеновые препараты (АЛП). Эта точка зрения базируется на большом количестве данных, доказывающих эффективность антилейкотриенового препарата монтелукаста в отношении улучшения контроля астмы [2, 7, 23, 28, 31]. Было показано, что монтелукаст эффективен в лечении детской астмы, вызванной распространенными триггерами (вирусы, физическая нагрузка, аллергены). Монтелукаст в настоящее время рекомендуется в качестве одного из двух вариантов начала лечения детей с персистирующей БА.
Кроме того, АЛП снижают частоту обострений БА, обусловленных вирусной инфекцией, у детей в возрасте 2–5 лет с интермиттирующей БА в анамнезе.
Роль монтелукаста как альтернативы препаратам первого выбора (ИГКС) для базисной терапии БА еще раз указывает на важность раннего начала лечения воспаления и расширяет возможности врача в отношении индивидуального подбора терапии.
Из всех антилейкотриеновых препаратов при детской астме изучался только монтелукаст (сильнодействующий селективный анатагонист цис-ЛТ-1-рецепторов), который продемонстрировал высокий профиль безопасности у детей раннего возраста.
Кромогликат натрия и недокромил натрия играют небольшую роль в длительной терапии БА у детей [2, 28, 35].
Кромоны обладают очень слабым противовоспалительным эффектом и являются менее эффективными, чем даже низкие дозы ИГКС.
Результаты одного метаанализа показали, что длительная терапия кромогликатом натрия у детей с БА статистически значимо не превосходила по эффективности плацебо. Данные другого метаанализа подтвердили превосходство низких доз ИГКС перед кромогликатом натрия при персистирующей БА.
Показано, что недокромил натрия уменьшает частоту обострений, однако его влияние на другие параметры состояния при БА не отличалось от влияния плацебо.
Однократный прием кромогликата натрия или недокромила натрия уменьшал выраженность бронхоспазма, обусловленного физической нагрузкой или вдыханием холодного воздуха.
Кромоны имеют высокий профиль безопасности. Побочные эффекты — кашель, раздражение глотки и бронхоспазм у небольшой части пациентов, получающих кромогликат натрия. Самыми частыми побочными эффектами недокромила являются неприятный вкус, головная боль и тошнота [28].
В Кохрановском обзоре был сделан вывод, что положительный эффект лечения кромолином натрия у дошкольников не доказан (уровень доказательности А) [35], а недокромил не был изучен у детей дошкольного возраста. Таким образом, кромоны не рекомендуются для лечения БА в этой возрастной группе.
У детей в возрасте пяти лет и младше нет достаточного количества доказательных исследований, но те немногие данные, которые были получены, подтверждают наличие определенного клинического эффекта теофиллина. В нескольких исследованиях у детей пяти лет и младше клинический эффект от регулярного применения теофиллина был невелик и в основном статистически незначим [32]. Эффективность теофиллина меньше, чем низких доз ИГКС, а побочные эффекты распространены (уровень доказательности D).
Длительно действующие бета2-агонисты (ДДБА)
Последний Экспертный совет FDA единогласно проголосовал за то, что у детей риск монотерапии ДДБА перевешивает пользу.
ДДБА не представлены в качестве варианта лечения ни для одной из ступеней терапии в данной возрастной группе [16, 20, 24, 28, 34]. Назначение ДДБА как альтернативы повышению доз ИГКС не рассматривается, предпочтение отдается повышению дозы ГКС.
У детей в возрасте пяти лет и младше эффекты ингаляционных бета2-агонистов длительного действия или комбинированных препаратов (ДДБА/ИГКС) изучены недостаточно [2, 28]. Комбинированные препараты (ДДБА/ИГКС) лицензированы для использования у детей 4–5 лет, однако у детей младше четырех лет доказательных исследований не проводилось.
Подходы к ступенчатой фармакотерапии БА у детей пяти лет и младше с позиций достижения и сохранения контроля представлены в табл. 5. [6, 28].
Бета2-агонисты короткого действия
Как видно из табл. 5, для всех пациентов в качестве бронхорасширяющей терапии могут использоваться ингаляционные бета2-агонисты короткого действия, которые являются наиболее эффективными ситуационными препаратами [2, 6, 28]. Предпочтительным способом доставки для купирования приступа астмы у детей пяти лет и младше является дозируемое аэрозольное устройство со спейсером (уровень доказательности А). Если техника ингаляции не выполнима (из-за отсутствия комплаенса, дистресса или из-за выраженности бронхоспазма и гипоксии), может использоваться небулайзерная терапия. Назначение бронхолитиков per os не рекомендуется из-за медленного начала действия и увеличения частоты системных эффектов. Ингаляционные бета2-агонисты короткого действия являются препаратами выбора, и по сравнению с ними назначение ингаляций ипратропия бромида не играет важной роли в повседневной практике ведения детей пяти лет и младше с БА (уровень доказательности А) [21].
Некоторые дети могут быть нечувствительны к эффектам ИГКС. В таких случаях необходимо вместе с родителями обсудить проблемы комплаенса, проверить технику ингаляции. При соблюдении всех условий правильного лечения следует подумать о фенотипе астмы, трудно поддающейся лечению [4, 10, 22, 24, 26, 33] и пересмотреть назначенную терапию. Важным компонентом контролируемого течения БА является предотвращение острых приступов астмы [11].
При приступах БА не рекомендуется следующая терапия:
- седативные препараты (строго противопоказаны);
- муколитические препараты (могут усилить кашель);
- все виды физиотерапии, включая физиотерапию на грудную клетку (могут усилить дискомфорт пациента);
- гидратация для детей старшего возраста и взрослых большими объемами жидкости (может быть необходима для детей младшего возраста и грудных детей);
- антибиотики (не лечат обострение, однако могут быть показаны для тех, кто имеет сопутствующую пневмонию или другую бактериальную инфекцию, например синусит);
- легкие обострения можно лечить на дому, если ребенок/семья подготовлены для этого и имеется индивидуальный план самоведения, включающий пошаговые мероприятия);
- среднетяжелые обострения, скорее всего, потребуют, а тяжелые — обычно требуют лечения в медицинском учреждении.
Для лечения обострений используются специальные протоколы.
Внедрение в клиническую практику доказательных методов диагностики и терапии астмы у детей пяти лет и младше будет способствовать эффективному и безопасному ведению самых маленьких пациентов.
- Геппе Н. А., Малышев B. C., Лисицын М. Н., Селиверстова Н. А., Поденова Т. А. Бронхофонография в комплексной диагностике бронхиальной астмы у детей //Пульмонология. 2002, № 5, с. 33–39.
- Национальная программа «Бронхиальная астма у детей. Стратегия лечения и профилактика» (3-е изд., испр. и доп. М.: Издательский дом «Атмосфера». 2008. 108 с.
- Чучалин А. Г., Белевский А. С., Огородова Л. М., Петровский Ф. И., Куликов Е. С. Эффективность стратегий достижения и поддержания контроля над бронхиальной астмой в условиях реальной клинической практики: данные многоцентрового исследования СТРЕЛА-АСТ // Пульмонология. 2010. № 1, с. 80–86.
- Arnold D., Jones B. L. Personalized medicine: a pediatric perspective // Curr Allergy Asthma Rep. 2009, Nov; 9 (6): 426–432.
- Assessment & Interpretation of Lung Function in the first years of life ERS School Course. 2007.
- Bacharier L. B., Boner A., Carlsen K. H., Eigenmann P. A., Frischer T., Götz M., Helms P. J., Hunt J., Liu A., Papadopoulos N., Platts-Mills T., Pohunek P., Simons F. E., Valovirta E., Wahn U., Wildhaber J. European Pediatric Asthma Group. Diagnosis and treatment of asthma in childhood: a PRACTALL consensus report // Allergy. 2008, Jan; 63 (1): 5–35.
- Bacharier L. B., Phillips B. R., Zeiger R. S., Szefler S. J., Martinez F. D., Lemanske R. F. Jr., Sorkness C., Bloomberg G. R., Morgan W. J., Paul I. M., Guilbert T., Krawiec M., Covar R., Larsen G., Mellon M., Moss M. H., Chinchilli V.M., Taussig L. M., Strunk R. C. Episodic use of an inhaled corticostero >Н. Г. Астафьева, доктор медицинских наук, профессор
И. В. Гамова, кандидат медицинских наук, доцент
Д. Ю. Кобзев
Е. Н. Удовиченко, кандидат медицинских наук
И. А. Перфилова
СГМУ им. В. И. Разумовского, Саратов
Контактная информация об авторах для переписки: astang@mail.ru
Уровни контроля астмы у детей 5 лет и младше [27, 28]
Подход к лечению астмы, ориентированный на контроль астмы для детей в возрасте 5 лет и младше
источник





.jpg)
.jpg)