Реакцией организма на внешние раздражители становится отечность слизистой, покраснения и высыпания на коже. За это отвечает иммуноглобулин Е.
Выработка данных антител в ответ на появление чужеродных клеток (в том числе бактерий, грибков) происходит в подслизистых слоях системы пищеварения, кожного покрова, миндалин, аденоидов, дыхательных путей.
Показатель иммуноглобулина Е при бронхиальной астме имеет важное значение для диагностики. Данное заболевание связано с удушьем, одышкой и кашлем, вызванными воспалением и реакцией бронхов на раздражители.
Иммуноглобулин Е – это особая разновидность белков, производимых лимфоцитами В группы, которая отвечает за реакцию иммунной системы на проникновение в организм паразитов (токсоплазмы, трихинелл, аскарид) и обладает антигельминтным эффектом.
Также IgE участвуют в процессе развития воспаления при попадании в организм аллергенов.
Часто повышаются иммуноглобулины при атопическом дерматите, бронхиальной астме и крапивнице. У многих людей имеется генетическая расположенность к появлению аллергических антител, к которым и относятся иммуноглобулины IgE.
Различают раннюю и отсроченную фазу аллергии. В первой под воздействием активных веществ увеличивается проницаемость сосудистых стенок, развивается отек тканей , активизируется секреция желез, происходит раздражение нервных окончаний, сокращение мускулатуры в органах.
Под действием биологически активных веществ в область воспаления привлекаются кровяные клетки, выделяющие антивоспалительные медиаторы.
Уровень иммуноглобулина Е определяется в следующих ситуациях:
- при инфекциях, воспалениях или аллергических проявлениях;
- при первичных иммунодефицитах;
- при злокачественных опухолях;
- при симптомах бронхолегочного аспергиллеза;
- при назначении иммуно-специфической терапии. Ее можно проводить при показателях IgE 30-700 IU/ml.
При бронхиальной астме программа исследований начинается со сдачи анализов, после проведения которых определяется причина патологии и назначается правильная терапия.
Кроме общего анализа (на гемоглобин, СОЭ, содержание лейкоцитов и эритроцитов), проводятся иммунологическое и биохимическое исследования крови, анализ мокроты. При необходимости специалист назначает дополнительные обследования.
Перед сдачей анализа нельзя принимать пищу 8 часов, рекомендуется за сутки исключить из рациона жареное, жирное, алкогольные напитки.
Иммунологические исследования направлены на выявление повышения уровня IgE, что важно для дифференциации инфекционно-зависимой и аллергической формы астмы.
При этом также определяют в сыворотке крови объем иммуноглобулина и специфических антител.
Общий уровень иммуноглобулина не является основанием для постановки диагноза , потому что этот показатель может быть одинаковым у здорового и больного пациента.
Определение уровня специфического IgE осуществляется посредством кожных проб, а при высокой опасности анафилактических реакций – при помощи радиоаллергенного теста.
После определения в сыворотке крови специфических иммуноглобулинов выявляются возможные аллергены. Как правило, при этом уровень IgE превышает нормативные показатели, а Т-супрессорные лейкоциты снижены.
В нормальном состоянии уровень общего иммуноглобулина Е в кровяной плазме будет низким, так как нет необходимости в выработке защитного белка при отсутствии атопических антигенов.
У детей показатель общего IgE меняется с возрастом и отличается от норм для взрослых людей. К периоду полового созревания эти цифры устанавливаются и потом не меняются. В пожилом возрасте количество защитных антител снижается – это нормальное явление.
Если содержание IgE у взрослого человека — 3-423 МЕ/мл, то его уровень в норме. При бронхиальной астме эти показатели составляют 120–1200 МЕ/мл.
Но высокие показатели иммуноглобулина не являются основой для диагностических заключений, так как причин для его повышения много, например, поллиноз и аллергический ринит.
Необходимо провести углубленные исследования, чтобы точно определить, почему повышен аллерген-специфический IgE.
Атопическая бронхиальная астма, как и другие болезни аллергической природы, развивается при попадании в организм аллергенов (пищевых добавок, пыли, пыльцы, чужеродного белка, лекарств, химикатов и пр.).
При развитии аллергической реакции выделяются специфические иммуноглобулины. Они дают сигнал о начале воспаления.
С увеличением содержания иммуноглобулинов Е в крови повышается количество рецепторов к данным антителам на поверхности клетках, активирующих аллергические реакции.
В результате выбрасываются медиаторы воспаления, что приводит к развитию тяжелой симптоматики. У людей с тяжелой патологией бронхов намного больше рецепторов к иммуноглобулинам, чем при легкой форме или у здоровых.
Если особое внимание при лечении уделить уменьшению воздействия IgE, то можно исключить или снизить интенсивность воспаления, так как будет меньше выделяться веществ, его провоцирующих.
Также можно связать Е-молекулы в крови до их оседания на клеточных рецепторах с помощью антител, выделенных из организма животных.
Однако чужеродные белки сами могут приводить к развитию аллергических проявлений, особенно у астматиков, поэтому не всем и не всегда разрешена такая терапия.
При астме для выявления реакции, которую вызывает иммуноглобулин, применяют клинические тестирования. При этом на поврежденную кожу наносят аллергены или вводят их подкожно. Начинает выделяться иммуноглобулин, вызывающий воспаление в области контакта.
Получить направление на диагностику можно у аллерголога, который назначит правильное лечение. Раньше терапия бронхиальной астмы проводилась путем снятия сужения бронхов с помощью бронхорасширяющих лекарств. Но у астматиков только облегчались проявления приступа, но предотвратить обострения не удавалось.
В настоящее время врачи достигли прогресса в лечении благодаря изучению природы астмы. У пациентов стало возможным предотвращать обострения и приступы.
Бронхиальную астму часто лечат высокими дозами ингаляционных глюкокортикостероидов в сочетании с бета-2-агонистами или назначают гормональные препараты в форме таблеток.
Но даже при такой усиленной терапии не всегда удается контролировать симптомы. Поэтому ученые занимаются поиском лекарств, оказывающих воздействие на причину заболевания.
При астме тяжелой степени рекомендуется анти-IgE-терапия. Пациентам вводится особое вещество — омализумаб, блокирующее активность иммуноглобулина Е. В результате у астматиков снижается количество обострений, уменьшается необходимость в системных гормонах, улучшается качество жизни.
Препарат имеет высокую эффективность, при его приеме редко появляются признаки аллергии и не выявлены опасные последствия. Назначается омализумаб детям старше 6 лет и взрослым при подтвержденной атопической природе болезни после проведения аллергопроб, выявления повышенного содержания в сыворотке крови общего иммуноглобулина.
Препарат вводят под кожу раз в 2-4 недели, дозировка выбирается, исходя из уровня IgE.
Кроме того, в зависимости от причин заболевания, назначаются следующие препараты:
- Антигистаминные лекарства. Блокируют рецепторы, реагирующие на гистамин, участвующий в развитии аллергической реакции.
- Препараты местного действия (для уменьшения внешних проявлений патологии, предотвращения осложнений) – мази и капли с противовоспалительным действием.
- Противогельминтные средства для борьбы с паразитарной инвазией.
- Стимуляторы иммунной системы, уменьшающие аллергические проявления.
Медикаменты назначаются врачом с учетом особенностей течения бронхиальной астмы, степени тяжести и причин обострений.
Из народных средств часто применяют отвар из листьев зверобоя, травы золототысячника, хвоща полевого, кукурузных рылец, соцветий ромашки, корня одуванчика и ягод шиповника.
Также можно использовать смесь порошка из яичной скорлупы с лимонным соком или сделать отвар из корней лопуха и одуванчика.
До меня недавно докатился слух о том, что будто наши ученые разработали очередную «кремлевскую таблетку» и уже используют ее для лечения людей, болеющих бронхиальной астмой. Будто бы она позволяет справиться с самыми тяжелыми случаями бронхиальной астмы и буквально преображает жизнь людей с любой аллергией. В результате долгих поисков и разговоров с информированными людьми выяснилось, что это не очередная утка.
Новое лекарство действительно есть, и оно действительно помогает при бронхиальной астме, причем самой тяжелой. Правдой оказалось и то, что это лекарство эффективно и при некоторых других видах аллергии.
К сожалению, назвать это лекарство «кремлевской таблеткой» не получится по целым трем причинам. Во-первых, разработали его не отечественные специалисты, а швейцарские, во-вторых, оно вышло за рамки «придворных» медицинских учреждений, и, наконец, это не таблетка. Пожалуй, только последний факт несколько меня опечалил (хотя, конечно, жаль, что не нашим ученым принадлежит приоритет его изобретения), потому что вводят лекарство подкожно — в инъекциях. Впрочем, это не самое главное — лишь бы помогало.
Кстати, может, и к лучшему обойтись без вычурных названий типа «кремлевских таблеток» и громких эпитетов, от которых веет шарлатанством. Современное лечение бронхиальной астмы обрело название «анти-IgE терапия» и не содержит в себе ничего необъяснимого или паранормального, а опирается исключительно на достижения иммунологии и молекулярной технологии. Суть его в том, что ошибку иммунитета исправляют тоже с помощью иммунных механизмов. Но сначала вспомним, что такое иммуноглобулины класса Е (IgE) и зачем с ними надо бороться.
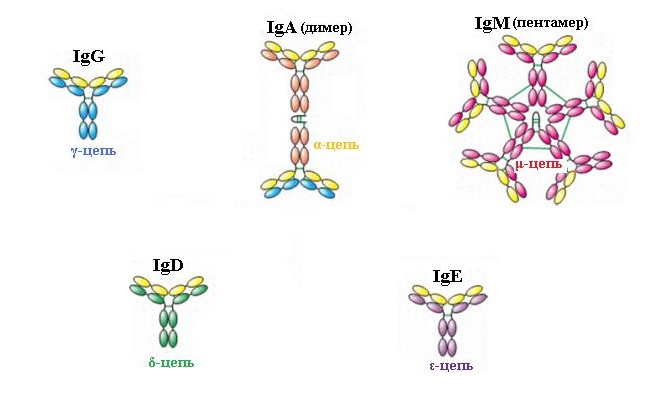
У большинства людей с бронхиальной астмой есть генетическая предрасположенность к выработке аллергических антител, которыми и являются IgE (в отличие от антител классов A, M и G, защищающих организм от различных микробов). Эти антитела вырабатываются лимфоцитами в ответ на определенный аллерген, поступают в кровь и доносятся до тучных клеток, где фиксируются на специальных рецепторах.
Тучные клетки расположены на «пограничных заставах» организма — в коже, конъюнктиве, слизистых оболочках бронхов, носа, желудочно-кишечного тракта, то есть там, откуда могут проникнуть аллергены. Если аллерген, к которому у человека выработались IgE, попадает в организм, эти фиксированные на тучной клетке антитела узнают его и дают клетке сигнал к запуску каскада аллергического воспаления. А в результате человек ощущает симптомы со стороны того органа, где «сидят» IgE, — бронхов (при бронхиальной астме), кожи (при атопическом дерматите или крапивнице), носа (при аллергическом рините) и т.д.
Чтобы не допустить запуска этого аллергического каскада, и были синтезированы специальные антитела для анти-IgE терапии, которые после подкожного введения связывают IgE в крови, не позволяя им «прилепиться» к тучным клеткам.
Кому же проводится анти-IgE терапия? Конечно, решение принимает врач-аллерголог, но и нам надо представлять, есть ли смысл задумываться о таком лечении (ведь средство сильнодействующее, а из пушки по воробьям не стреляют).
Анти-IgE терапия показана людям страдающим тяжелой и среднетяжелой бронхиальной астмой, у которых не удается добиться должного эффекта с помощью высоких доз ингаляционных гормонов и бронхолитиков длительного действия. Обязательно должна быть доказана аллергическая природа заболевания — повышенное содержание IgE в крови, а пациент должен быть старше 12 лет.
Если врач назначил анти-IgE терапию, то один раз в 2 или 4 недели человеку делают подкожную инъекцию (доза и частота введения препарата определяются в зависимости от массы тела пациента и исходного уровня иммуноглобулина Е в крови). Заметим, что бросать то лечение, которое проводилось раньше, нельзя, а можно лишь постепенно уменьшать его объем по рекомендации лечащего врача.
Эффективность анти-IgE терапии была изучена у пациентов с тяжелой и среднетяжелой бронхиальной астмой, у которых не удавалось контролировать заболевание с помощью наиболее действенных препаратов (ингаляционных гормонов и бронхолитиков длительного действия).
Как показали исследования, добавление к лечению анти-IgE уменьшает тяжесть симптомов и частоту обострений и даже позволяет снизить поддерживающую дозу гормонов у пациентов с гормонозависимой формой заболевания. Наряду с облегчением течения бронхиальной астмы анти-IgE терапия помогает справиться и с симптомами сопутствующих аллергических болезней (аллергического ринита, пищевой аллергии). Впрочем, этот «побочный эффект» был вполне предсказуемым — ведь IgE перестают поступать не только в бронхи, но и в другие органы, где возможны аллергические реакции. Побольше бы таких «побочных эффектов».
Вот видите, напрасно говорят: «Не верьте слухам!» Иногда бывает полезно и поверить. Но только — из достоверных источников.
источник
В настоящее время число больных бронхиальной астмой (БА) в мире оценивается в 300 миллионов человек. К 2025 году ожидается увеличение их числа до 400 миллионов человек. С каждым годом регистрируется всё больше больных c тяжёлым течением бронхиальной астмы, в том числе – среди детей [1].
В международном согласительном документе по Глобальной стратегии в лечении и профилактике бронхиальной астмы (Global Initiative for Asthma – GINA) 2006 г. сформулированы основные цели для достижения адекватного контроля над БА. Эти цели включают, в частности, профилактику обострений и предупреждение смертности от БА, а также поддержание повседневной активности и функции внешнего дыхания на уровнях, близких к нормальным. Для оптимального контроля БА рекомендуется применение ступенчатой терапии с постепенным наращиванием объёма базисной противовоспалительной терапии до достижения адекватного контроля над симптомами БА. При этом известно, что почти у 1/3 больных не удаётся достичь желаемой степени контроля над заболеванием с помощью базисной противовоспалительной терапии высокими дозами комбинированных препаратов (ингаляционных глюкокортикостероидов в сочетании с длительно действующими β2-агонистами) [2].
В то же время, ключевая роль в патогенезе БА отводится иммуноглобулину Е (IgE), ответственному за инициацию аллергической реакции при контакте с аллергеном и завершающейся выбросом целого ряда медиаторов, обусловливающих клинические проявления болезни. При этом в ответ на антигенную стимуляцию B-лимфоциты трансформируются в плазматические клетки, которые продуцируют и выбрасывают в кровоток IgE-антитела. Циркулирующие в крови IgE-антитела связываются с высокоаффинными рецепторами (FcеRI) на поверхности тучных клеток в тканях и на поверхности базофилов; при повторном контакте с причинным аллергеном его связывание с молекулами IgE индуцирует выброс медиаторов воспаления, что приводит к обострению БА. Поэтому воздействие на этот механизм аллергии является привлекательной мишенью в плане терапевтических воздействий [3, 4].
С этой целью был разработан оригинальный препарат анти-IgE-антител – омализумаб, созданный на основе каркаса человеческого иммуноглобулина G (IgG), в который имплантирован определяющий комплементарность участок мышиных анти-IgE антител. Омализумаб связывается с определённым участком молекулы IgE, с тем же локусом, который обычно взаимодействует с IgE-рецептором. При этом связывании с IgE омализумаб формирует небольшие по размеру, биологически инертные, не связывающие комплемент комплексы, что препятствует дальнейшему прикреплению IgE к рецептору на эффекторных клетках. Будучи направленным на IgE, омализумаб прерывает сразу несколько ключевых звеньев воспалительного каскада. Он связывает свободно циркулирующие молекулы IgE, значительно снижает экспрессию высокоаффинных рецепторов (FcеRI-рецепторов) на поверхности тучных клеток и базофилов, что сопровождается уменьшением активации тучных клеток и сенсибилизации, а также сокращением притока эозинофилов и их активации. Следствием этих событий является значительное снижение выброса медиаторов и уменьшение воспаления. В итоге снижается выраженность симптомов обострения бронхиальной астмы [5, 6].
Биодоступность этого препарата составляет 62 %, он медленно абсорбируется из места введения (пик концентрации отмечается на 7-8 день после введения), не накапливаясь в органах и тканях; выводится ретикулогистиоцитарной системой печени. Период полувыведения (Т1/2) в среднем занимает 26 дней, кажущийся клиренс составляет около 2,4 ± 1,1 мл/кг/сут, при увеличении массы тела вдвое происходит приблизительно двукратное увеличение кажущегося клиренса, что необходимо учитывать при расчёте вводимой дозы препарата. Оценку эффективности препарата следует производить не ранее, чем через 16 недель от начала лечения. В ходе исследований лекарственных взаимодействий не установлено [7-10].
На сегодняшний день опубликованы многочисленные работы, посвящённые изучению эффективности и безопасности омализумаба у пациентов с бронхиальной астмой, в том числе результаты трёх мета-анализов. Более 93 % пациентов, включённых в исследования, имели установленный диагноз тяжёлой персистирующей бронхиальной астмы (согласно критериям GINA 2006). Во всех случаях омализумаб добавляли к предшествующей терапии, сравнивая эффект с плацебо или с предшествующей терапией. Пациенты получали омализумаб согласно таблице дозирования в зависимости от исходного уровня IgE и массы тела. Количество обострений бронхиальной астмы при применении омализумаба в среднем снизилось на 38 %, незапланированные обращения за неотложной помощью сократились на 47 % по сравнению с группой контроля (как на фоне неизменной дозы ингаляционных глюкокортикостероидов, так и на фоне снижения их суточной дозы) [11, 12]. Сходные результаты были получены у пациентов, постоянно получавших системные глюкокортикостероиды (частота обострений у них снизилась на 34,9 %). А ведь именно эта категория пациентов составляет группу высокого риска по наиболее тяжёлому течению бронхиальной астмы и летальному исходу от неё! Кроме того, количество больных, у которых удалось вдвое сократить объём терапии ИГКС в группе, получавших омализумаб, на 57 % превысило показатели контрольной группы, при этом у них же удалось сократить количество обострений на 51 %. Применение омализумаба позволило большинству больных тяжёлой персистирующей бронхиальной астмой достичь полного контроля или значительного клинического улучшения. На основании этих результатов данный препарат был рекомендован в качестве средства дополнительной терапии для пациентов с плохим контролем бронхиальной астмы, несмотря на применение высоких доз ИГКС в сочетании с длительно действующими β2-агонистами [13]. Последнее положение было подтверждено в исследовании INNOVATE (INvestigatioN of Omalizumab in severe Asthma TrEatment, 2007), в которое были включены больные бронхиальной астмой от 12 до 75 лет, с показателями ОФВ1 40-80 % и сохраняющимися симптомами бронхиальной астмы, несмотря на приём высоких доз комбинированных ИГКС (свыше 1000 мкг/сут по флутиказону), а также имевшими в течение 1 года не менее 2 обострений, потребовавших назначения системных глюкокортикостероидов. Согласно критериям GINA, 67 % участников исследования были отнесены к группе высокого риска смерти от бронхиальной астмы. В группе пациентов, получавших омализумаб, в течение 28 недель количество обострений снизилось в 2 раза по сравнению с таковым в группе плацебо, а общее количество обращений за неотложной помощью снизилось в той же группе на 44 %. Наибольшее снижение частоты обострений при приёме омализумаба отмечалось в группе пациентов с исходно низкими функциональными показателями (ОФВ1 менее 60 %) [14].
В клинических исследованиях частота развития нежелательных реакций среди пациентов, получавших омализумаб, была сравнима с группой плацебо. Из нежелательных явлений наиболее частыми (> 1/100 ÷ > 1/10) были: боль, отёк, эритема и зуд в месте введения препарата, а также – головные боли. Они развивались чаще всего в течение первого часа от момента введения и сохранялись до нескольких дней, однако их выраженность значительно снижалась с каждым последующим введением. Среди серьёзных нежелательных эффектов отмечены анафилактические реакции (Считается, что среди всех критериев эффективности наиболее общим предиктором ответа на приём омализумаба служит уровень общего IgE, так как в исследованиях его низкий исходный уровень (менее 75 МЕ/мл) ассоциировался с незначительным терапевтическим эффектом. Предсказать клиническую эффективность этого препарата, исходя из других индивидуальных показателей бронхиальной астмы, оказалось невозможным [16]. Поэтому решение о дальнейшем использовании данного препарата надо принимать в каждом конкретном случае по истечении 16 недель лечения омализумабом с учётом степени тяжести заболевания до лечения, потребности в дополнительной терапии и динамики частоты обострений. В странах Евросоюза омализумаб назначают в дополнение к получаемой терапии больным с тяжёлой атопической персистирующей бронхиальной астмой, имеющим доказанную сенсибилизацию к аллергенам окружающей среды, снижение показателей ФВД (ОФВ1 менее 80 %) и документированные тяжёлые обострения на фоне приёма высоких доз комбинированных ИГКС (пятая ступень терапии согласно GINA 2006) [17]. В России, согласно инструкции, препарат рекомендован для лечения среднетяжёлой и тяжёлой персистирующей атопической бронхиальной астмы, симптомы которой недостаточно контролируются применением глюкокортикостероидов, у пациентов старше 12 лет.
Отдельных исследований, касающихся применения омализумаба при бронхиальной астме у детей, опубликовано сравнительно немного. Большая их часть касалась детей старше 12 лет, больных бронхиальной астмой, включённых в многоцентровые рандомизированные плацебо-контролируемые исследования совместно со взрослыми пациентами. Имеются сведения об использовании омализумаба у 334 детей в возрасте от 6 до 12 лет, получавших в качестве базисной терапии беклометазон, в течение 28 недель (2001). При этом было установлено, что у большинства детей на фоне терапии омализумабом удалось значительно снизить суточную дозу ИГКС без потери контроля над течением заболевания. Среди побочных эффектов наиболее часто (до 7 %) отмечались гриппоподобные реакции (преимущественно, лёгкие), а также головные боли и крапивница. Ни в одном случае в ходе лечения не удалось обнаружить антитела к омализумабу. Имеются сведения об успешных попытках терапии омализумабом аллергического ринита, поллиноза, атопического дерматита, пищевой аллергии и даже использовании омализумаба при проведении специфической иммунотерапии [18-20].
Опыт лечения омализумабом детей с тяжёлой бронхиальной астмой в нашей стране пока очень невелик. Это объясняется высокой стоимостью препарата и строгими критериями отбора на лечение, которыми руководствуются специалисты, а также необходимостью организации тщательного мониторинга за состоянием здоровья пациентов, получающих терапию омализумабом, и вполне оправданной осторожностью в отношении ко всему новому. Тем не менее, первые попытки лечения данным препаратом были предприняты в клинике пульмонологии МНИИ педиатрии и детской хирургии.
В настоящее время в нашем отделении проходят лечение омализумабом 9 пациентов в возрасте от 12 до 18 лет с тяжёлой бронхиальной астмой, которые ранее уже неоднократно проходили стационарное обследование в условиях нашей клиники. Средний возраст пациентов составил 14,5 лет, при этом продолжительность заболевания была от 5 до 15 лет. У всех пациентов были выявлены сопутствующие аллергические заболевания (аллергический ринит, пищевая аллергия, поллиноз, атопический дерматит). При иммунологическом исследовании отмечалось увеличение уровня общего IgЕ от 39 до 378 МЕ/мл, что подтверждало атопический характер заболевания; выявлена высокая сенсибилизация к бытовым и эпидермальным аллергенам, а в половине случаев – к грибковым и пыльцевым аллергенам. Все пациенты на момент назначения омализумаба в качестве базисной противовоспалительной терапии длительно получали комбинированный ингаляционный глюкокортикостероид Серетид в высоких дозах (500-1000 мкг/с по флутиказону), тем не менее, у них сохранялась низкая степень контроля над заболеванием. С учётом исходного уровня общего IgЕ и массы тела, двум пациентам омализумаб был назначен подкожно 2 раза в месяц, остальным – 1 раз в месяц. Местных и общих реакций на введение препарата отмечено не было, что подтверждает его хорошую переносимость. К настоящему моменту 2 пациентки получают препарат 11 месяцев, одна – 8 месяцев, остальные – от 4 до 6 месяцев. На фоне добавления омализумаба к базисной терапии все пациенты отмечают положительную динамику в течении тяжёлой бронхиальной астмы, что выражается в сокращении потребности в дополнительном использовании бронхолитиков, снижении частоты ночных симптомов, улучшении переносимости физических нагрузок. Данная тенденция прослеживается и при анализе анкет пациентов (АСТ-тест). Тяжёлых обострений, требующих использования небулизированных или парентеральных препаратов, а также вызовов СМП и экстренных госпитализаций по поводу обострений бронхиальной астмы ни у кого из пациентов, получавших лечение омализумабом, не отмечалось. У большей части детей произошло значительное уменьшение выраженности симптомов круглогодичного аллергического ринита, поллиноза и атопического дерматита. Следует отметить, что, поскольку все пациенты длительно получали комбинированные ИГКС, параметры внешнего дыхания у большинства из них значимо не выходили за пределы должных значений. Поэтому отчётливой динамики этих показателей не было. У 1/3 из пациентов отмечено значимое снижение уровня оксида азота в выдыхаемом воздухе. Объём базисной противовоспалительной терапии в большинстве случаев остался прежним (в т. ч. из-за боязни пациентов потерять контроль над заболеванием, а также в связи с высокой степенью сенсибилизации к бытовым и грибковым аллергенам и невозможностью радикального изменения бытовых условий). По истечении года терапии омализумабом планируется повторное стационарное обследование всех пациентов, в ходе которого будут предприняты попытки снижения объёма базисной терапии. Для иллюстрации приводим одно из наших клинических наблюдений успешного применения омализумаба на практике.
Пациентка С., 15 лет, страдающая тяжёлой бронхиальной астмой. Семейный аллергоанамнез отягощён: у старшей сестры – поллиноз, кашель при контакте с животными, у тёти по материнской линии и двух её детей – бронхиальная астма. Из анамнеза заболевания известно, что у ребёнка с первого года жизни отмечались проявления атопического дерматита, пищевой и лекарственной аллергии; с 6 лет – круглогодичный аллергический ринит. С первого года жизни отмечались повторные обструктивные бронхиты, с 3 лет – типичные приступы удушья (круглогодично, ежемесячно). По тяжести состояния девочка 3-6 раз в год госпитализировалась в стационар, получала инфузионную терапию с эуфиллином, преднизолоном, однако диагноз бронхиальной астмы был установлен только в 6 лет. В качестве базисной терапии девочка длительно получала препараты кромонового ряда без выраженного эффекта. С 9 лет получает ИГКС – Фликсотид (250-500-750 мкг/сут), в течение последних 3 лет – Серетид в постоянно возрастающих дозировках. На фоне непрерывной терапии ИГКС в течение 6 лет состояние ребёнка несколько улучшилось: приступы стали повторяться реже, протекают легче и купируются в домашних условиях ингаляциями беродуала через небулайзер, количество госпитализаций сократилось до 2 раз в год. Состояние ребёнка вновь ухудшилось с осени 2007 г.: приступы затруднённого дыхания участились до нескольких раз в сутки, резко возросла потребность в β2-агонистах (до 10 доз/сут.), за 3 мес. дважды была госпитализирована для проведения инфузионной терапии, доза Серетида была увеличена до 1000 мкг/сут по флутиказону, однако в течение 8 мес. лечения стабилизации достигнуть не удалось, течение бронхиальной астмы оставалось плохо контролируемым, сохранялись приступы затруднённого дыхания, ночного кашля и одышка при физической нагрузке, в связи с чем девочка была направлена в нашу клинику.
При поступлении состояние было расценено как тяжёлое: отмечалась одышка при умеренной физической нагрузке, ночной кашель. При осмотре отмечалось вздутие грудной клетки в верхних отделах, перкуторно над лёгкими определялся тимпанит, при аускультации дыхание ослаблено, хрипы не выслушивались. При обследовании в общем анализе крови – без патологических изменений, при иммунологическом обследовании выявлено повышение уровня общего IgЕ до 100 МЕ/мл, специфические IgЕ к бытовым и эпидермальным аллергенам. На рентгенограмме органов грудной клетки отмечались признаки обструктивного синдрома. Поскольку исходные показатели ФВД на фоне приёма комбинированных ИГКС в высоких дозах находились в пределах должных величин, была проведена проба с дозированной физической нагрузкой, выявившая наличие генерализованного постнагрузочного бронхоспазма, уровень оксида азота в выдыхаемом воздухе был увеличен в 2,5 раза (до 50,3 ppb при норме до 20 ppb). Таким образом, на основании данных анамнеза, результатов обследования был установлен диагноз тяжёлой бронхиальной астмы, аллергического ринита. В качестве базисной терапии была назначена комбинация препарата Серетид (100/1000 мкг/сут) и омализумаба подкожно 300 мг 1 р в 4 недели.
Последующее динамическое наблюдение показало, что если до начала терапии омализумабом на фоне комбинированных ИГКС в высоких дозах пациентке не удавалось достичь контроля над тяжёлой бронхиальной астмой (АСТ-тест до лечения омализумабом составил 12 баллов), то спустя 16 недель после назначения терапии АСТ-тест составил уже 20 баллов, что свидетельствовало о хорошей степени контроля. Высокая суточная вариабельность показателей ПСВ до лечения омализумабом свидетельствовала о нестабильном состоянии пациентки; по мере стабилизации состояния на фоне терапии омализумабом график, отражающий изменение ПСВ, приобрёл вид плавной кривой, а суточный разброс показателей ПСВ составил менее 20 % от долженствующего значения. На фоне добавления в комплекс с базисной противовоспалительной терапией инъекций омализумаба, наряду с отчётливым клиническим улучшением, было выявлено отсутствие бронхиальной гиперреактивности в пробе с дозированной физической нагрузкой и нормализация уровня оксида азота в выдыхаемом воздухе (до 18,5 ppb).
Учитывая широкие терапевтические возможности и доказанную высокую эффективность у наиболее тяжёлого контингента больных с трудноконтролируемым течением заболевания, следует полагать, что терапия омализумабом, очевидно, найдёт своё достойное место в арсенале современных противоастматических средств.
источник
Анти-ige-терапия тяжелой бронхиальной астмы у детей: двухлетний опыт Текст научной статьи по специальности « Медицина и здравоохранение»
Аннотация научной статьи по медицине и здравоохранению, автор научной работы — Куличенко Татьяна Владимировна, Намазова-баранова Л. С., Торшхоева Р. М., Лукина О. Ф., Вишнева Е. А.
В статье обобщается двухлетний опыт лечения омализумабом детей и подростков с тяжелой неконтролируемой атопической бронхиальной астмой . Данное лечение позволило добиться полного контроля болезни у 70% больных и частичного контроля бронхиальной астмы у 30% больных. Анти-IgE-терапия способствует снижению частоты обострений бронхиальной астмы на 77%, а также обращений за экстренной медицинской помощью, вплоть до отсутствия потребности в стационарном лечении по поводу астмы. На фоне 2-летнего лечения улучшались показатели функции легких, в том числе у детей с низкими показателями бронхиальной проходимости даже после приема бронхолитиков. Доза ингаляционных глюкокортикостероидов на фоне лечения омализумабом снижена у 75% больных в 1,5-2,5 раза. Переносимость лечения у всех детей удовлетворительная, ни у кого из больных не отмечено серьезных нежелательных явлений, связанных с препаратом, а также каких-либо системных побочных эффектов. Анти-IgE-терапия является хорошей альтернативой применению у детей с тяжелой атопической бронхиальной астмой высоких и сверхвысоких доз ингаляционных глюкокортикостероидов.
Похожие темы научных работ по медицине и здравоохранению , автор научной работы — Куличенко Татьяна Владимировна, Намазова-Баранова Л.С., Торшхоева Р.М., Лукина О.Ф., Вишнева Е.А.,
The article summarizes a two-year experience of treating children and adolescents with severe uncontrolled atopic asthma using Omalizumab. This treatment facilitated to achieve full asthma control in 70% of patients and partial control in 30% of patients. Anti-IgE-therapy contributes to reduce the frequency of asthma relapses 77%, and the number of those seeking emergency medical treatment, particularly no need for in-patient asthma care. Thanks to treatment, lung function parameters improve, particularly in children with low bronchial patency parameters even after administration of broncholytics. Thanks to treatment with omalizumab, the dosage of inhalant glucocorticosteroids is reduced 1.5 to 2.5 times in 75% patients. Treatment tolerance in all children is satisfactory, no serious adverse events associated with the medication or any system side effects are registered in patients. Anti-IgE therapy is a good alternative to use of high and ultra-high doses of inhalant glucocorticosteroids in children with severe atopic asthma.
Т.В. Куличенко, Л.С. Намазова-Баранова, Р.М. Торшхоева, О.Ф. Лукина, Е.А. Вишнева
Научный центр здоровья детей РАМН, Москва
Анти-^Е-терапия тяжелой бронхиальном астмы у детей: двухлетний опыт
Куличенко Татьяна Владимировна, кандидат медицинских наук, врач аллерголог-иммунолог отделения диагностики и восстановительного лечения Научного центра здоровья детей РАМН, доцент кафедры аллергологии и клинической иммунологии ФППО педиатров ММА им. И.М. Сеченова
Адрес: 119991, Москва, Ломоносовский проспект, д. 2/62, тел.: (495) 967-14-21 Статья поступила: 02.02.2010 г., принята к печати: 27.04.2010 г.
В статье обобщается двухлетний опыт лечения омализумабом детей и подростков с тяжелой неконтролируемой атопической бронхиальной астмой. Данное лечение позволило добиться полного контроля болезни у 70% больных и частичного контроля бронхиальной астмы у 30% больных. Анти-^Б-терапия способствует снижению частоты обострений бронхиальной астмы на 77%, а также обращений за экстренной медицинской помощью, вплоть до отсутствия потребности в стационарном лечении по поводу астмы. На фоне 2-летнего лечения улучшались показатели функции легких, в том числе у детей с низкими показателями бронхиальной проходимости даже после приема бронхолитиков. Доза ингаляционных глюкокортикостероидов на фоне лечения омализумабом снижена у 75% больных в 1,5-2,5 раза. Переносимость лечения у всех детей удовлетворительная, ни у кого из больных не отмечено серьезных нежелательных явлений, связанных с препаратом, а также каких-либо системных побочных эффектов. Анти-^Б-терапия является хорошей альтернативой применению у детей с тяжелой атопической бронхиальной астмой высоких и сверхвысоких доз ингаляционных глюкокортикостероидов.
Ключевые слова: омализумаб, анти-^Б-антитела, резистентная к терапии бронхиальная астма, атопическая бронхиальная астма, лечение, дети, подростки, контроль за бронхиальной астмой.
IgE-специфическая иммуномодулирующая терапия уже более 10 лет успешно проводится во многих странах мира. Омализумаб (Omalizumab, Xolair, Novartis Pharma AG, Швейцария) назначается больным среднетяжелой и тяжелой неконтролируемой атопической бронхиальной астмой. Это лечение сегодня рассматривается как альтернатива лечению пероральными глю-
кокортикостероидами (ГКС) и сверхвысокими дозами ингаляционных глюкокортикостероидов (ИГКС). Омализумаб представляет собой препарат гуманизированных моноклональных анти-^Е-антител. При введении омализумаба страдающему атопией больному уровень сывороточного ^Е, иногда определяемый как «свободный ^Е», снижается более чем на 96%, что
T.V. Kulichenko, L.S. Namazova-Baranova, R.M. Torshkhoeva, O.F. Lukina, E.A. Vishneva
Scientific Center of Children’s Health, Russian Academy of Medical Sciences, Moscow
Anti-IgE therapy for severe asthma in children: two-year trial
The article summarizes a two-year experience of treating children and adolescents with severe uncontrolled atopic asthma using Omalizumab. This treatment facilitated to achieve full asthma control in 70% of patients and partial control in 30% of patients. Anti-IgE-therapy contributes to reduce the frequency of asthma relapses 77%, and the number of those seeking emergency medical treatment, particularly no need for in-patient asthma care. Thanks to treatment, lung function parameters improve, particularly in children with low bronchial patency parameters even after administration of broncholytics. Thanks to treatment with omalizumab, the dosage of inhalant glucocorticosteroids is reduced 1.5 to 2.5 times in 75% patients. Treatment tolerance in all children is satisfactory, no serious adverse events associated with the medication or any system side effects are registered in patients. Anti-IgE therapy is a good alternative to use of high and ultra-high doses of inhalant glucocorticosteroids in children with severe atopic asthma.
Key words: omalizumab, anti-IgE-antibodies, treatment-resistant asthma, atopic asthma, treatment, children, adolescents, asthma control.
сопровождается 73%-м снижением экпрессии Fc-RI рецепторов на базофилах [1, 2]. В результате со временем существенно снижается иммунный воспалительный ответ при контакте с аллергеном [3]. Основными показателями эффективности анти-IgE-терапии (практически во всех исследованиях) стали: снижение частоты обострений бронхиальной астмы, снижение потребности в экстренной медицинской помощи и госпитализациях, уменьшение дозы системных и ингаляционных глюкокортикостероидов, улучшение качества жизни пациентов. Существенно, что многие исследователи солидарны в своих позитивных оценках этого нового вида базисной терапии бронхиальной астмы [4-7].
Подростки 12-18 лет были включены практически во все контролируемые исследования эффективности и безопасности омализумаба [4]. Обобщенные данные 5 рандомизированных контролируемых исследований о лечении омализумабом в течение 28-32 недель свидетельствуют о значимом снижении потребности в глюкокортикостероидах и экстренной медицинской помощи, существенном уменьшении частоты обострений астмы и связанных с ними пропусков школы [8]. У подростков отмечено значимое улучшение показателей функции легких, тогда как у взрослых пациентов существенного улучшения функциональных данных достичь не удается [9].
Первый опыт лечения омализумабом детей 6-12 лет был опубликован Н. М1^гот и соавт. еще в 2001 г. [10]. В это исследование были включены дети 6-11 лет, страдающие среднетяжелой и тяжелой бронхиальной астмой, 225 детей получали омализумаб, 109 детей — плацебо. Исследование ставило целью оценить безопасность омализумаба у детей, его влияние на частоту обострений бронхиальной астмы, потребность в ИГКС. После 16 недель стабильной дозы ИГКС на фоне лечения начиналось постепенное снижение дозы стероида до минимально адекватной. В результате оказалось, что дозу ИГКС удалось существенно снизить у большего числа пациентов, получавших омализумаб, чем в группе получавших плацебо. Кроме того, на фоне омализумаба минимально необходимая доза ИГКС была значительно ниже, частота обострений, потребность в экстренной медицинской помощи, количество пропусков школы были меньше, а показатели пикфлоуметрии — выше. Уровень свободного ^Е в сыворотке крови снизился на 95-99%. При этом частота нежелательных явлений в обеих группах не различалась.
В дальнейшем это исследование было продолжено до 52 недель лечения. Результаты были не менее впечатляющими. 81% больных не нуждался в дополнительных противоастматических препаратах на фоне лечения омализумабом. Более 90% тех, кто еще в первые 24 недели исследования смог совсем отказаться от базисной терапии ИГКС, не нуждались в ней и к 52-й неделе лечения. Частота нежелательных явлений не нарастала, анафилактических и иммунокомплексных реакций не было отмечено, уртикарные высыпания имели место у 4,9% больных. Частота обострений бронхиальной астмы оставалась низкой, а 55% детей вообще не имели обострений за весь период анти-^Е-терапии [11].
В мае 2009 г. были опубликованы результаты контролируемого многоцентрового исследования эффективности и безопасности омализумаба в лечении тяжелой и среднетяжелой бронхиальной астмы у детей 6-11 лет. В исследование были включены 576 пациентов, из них 384 получали лечение омализумабом в течение 52 недель. Средняя доза ИГКС в начале исследования составляла 515 мкг в сут по флутиказону. В течение первых 24 недель (доза ИГКС оставалась стабильной у всех больных) отмечено снижение частоты обострений бронхиальной астмы в группе лечившихся омализумабом на 31% по сравнению с группой плацебо. В последующие 28 недель анти-^Е-терапии обострения развивались реже на 43%. В этом исследовании была показана отличная переносимость омализумаба у детей. Профиль его безопасности не отличался от данных, полученных у взрослых и подростков, а частота анафилаксии, кожных высыпаний, в том числе крапивницы, частота местных реакций на инъекции были вдвое ниже, чем в группе плацебо [12, 13]. Полученные результаты исследований позволили сделать выводы об эффективности и безопасности омализумаба у детей с 6 лет.
Возрастные границы применения омализумаба у детей сегодня расширены как в странах Европейского союза, так и в России. Омализумаб может теперь применяться для лечения больных среднетяжелой и тяжелой неконтролируемой атопической бронхиальной астмой, начиная с 6-летнего возраста. Таблица дозирования омализумаба у детей 6-12 лет имеет отличия от рекомендованного режима дозирования для пациентов старше 12 лет (табл. 1 и 2). Доза препарата для подкожного введения рассчитывается, исходя
Таблица 1. Расчет дозы омализумаба (мг) для подкожного введения каждые 4 недели
Исходный уровень (МЕ/мл) Масса тела (кг)
> 20-25 > 25-30 > 30-40 > 40-50 > 50-60 > 60-70 > 70-80 > 80-90 > 90-125 >125-150
^ 30-100 75 75 150 150 150 150 150 150 300 300
>100-200 150 150 150 300 300 300 300 300
> 200-300 150 150 225 300 300
> 400-500 225 300 Назначается каждые 2 недели
> 500-600 300 300 См. таблицу 2
Таблица 2. Расчет дозы омализумаба (мг) для подкожного введения каждые 2 недели
Исходный уровень IgE (МЕ/мл) Масса тела (кг)
> 20-25 > 25-30 > 30-40 > 40-50 > 50-60 > 60-70 > 70-80 > 80-90 > 90-125 >125-150
>100-200 Назначается каждые 4 недели См. таблицу 1 225 300
> 200-300 225 225 225 300 375
> 300-400 225 225 225 300 300
> 400-500 225 225 300 300 375 375
> 800-900 225 225 300 375 Не назначается
из веса и уровня общего ^Е в сыворотке крови больного до начала лечения. Необходимо подчеркнуть, что диапазон уровня ^Е для расчета дозы у детей шире, чем у подростков и взрослых, и составляет в этой возрастной группе 30-1300 МЕ/мл (!). Это очень существенный фактор для отбора детей на анти-^Е-лечение, поскольку уровень ^Е у детей с тяжелой бронхиальной астмой обычно выше, чем у взрослых.
В Научном центре здоровья детей РАМН омализумаб применяется с ноября 2007 г. Анти-^Е-терапию получают подростки с атопической бронхиальной астмой тяжелого персистирующего течения, контроля над которой не удается достичь, несмотря на использование высоких и сверхвысоких доз ингаляционных глюкокортикостероидов в сочетании с длительнодействующими р2-агонистами.
В течение 2-х лет лечение омализумабом было начато у 25 подростков 12-17 лет, из них более одного года препарат сегодня получают 13 пациентов, 5 больных лечатся уже более 2-х лет. В настоящей публикации мы обобщаем имеющийся у нас опыт применения анти-^Е-терапии для лечения подростков с тяжелой, резистентной к стандартному лечению бронхиальной астмой.
Целью данного исследования является анализ эффективности и безопасности омализумаба в лечении тяжелой персистирующей неконтролируемой бронхиальной астмы у подростков.
Дизайн исследования: открытое неконтролируемое исследование.
1. Пациенты мужского и женского пола от 12 до 17 лет.
3. Общий сывороточный ^Е от 30 до 700 МЕ/мл.
4. Атопический характер бронхиальной астмы, подтвержденный клиническими проявлениями, кожными тестами и/или исследованиями in vitro.
5. Обратимый характер бронхиальной обструкции у пациентов.
6. Неадекватный контроль бронхиальной астмы, несмотря на применение ингаляционных глюкокортикостероидов в высоких дозах в сочетании с р2-агонистами (± антилейкотриеновыми препаратами).
Омализумаб назначался подросткам в соответствии с критериями отбора пациентов для проведения анти-IgE-терапии [14]. Через 12 недель от первой инъекции препарата, согласно Формуляру ЕС по увеличению потенциальной пользы и снижению потенциальных рисков при лечении омализумабом, а также с учетом инструкции о применении препарата, принималось решение о целесообразности продолжения лечения.
Дозирование: омализумаб (75-375 мг) назначался подкожно каждые 2 или 4 недели. Индивидуальная доза рассчитывалась в зависимости от веса тела и уровня общего сывороточного IgE при первичном обследовании пациента перед началом лечения [14].
Эффективность омализумаба оценивалась по изменению следующих показателей:
• частота клинически значимых обострений бронхиальной астмы (БА) у подростков (снижение показателей пиковой скорости выдоха (ПСВ) или объема форсированного выдоха (ОФВ1) менее 60% должного; двукратное повышение потребности в р-агонистах в течение не менее 3-х дней; учащение ночных симптомов до 2-х раз в неделю, потребность в системных глюкокортикостероидах);
• частота госпитализаций по поводу БА (в течение года лечения);
i Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Таблица 3. Характеристика больных, получающих омализумаб в Научном центре здоровья детей РАМН (п = 25, март 2010)
Длительность БА 10,6 і 2,4 года
Атопический дерматит 7 (28%)
Круглогодичный аллергический ринит 25 (100%)
Доза ингаляционных ГКС (по ФП) 778,4 і 268,4 мкг
Применение системных ГКС 11 (44%)
БА — бронхиальная астма; ГКС — глюкокортикостероиды; ФП — флутиказона пропионат; АЛТР — антагонисты лейкотриеновых рецепторов.
Рис. 1. Специфическая сенсибилизация у подростков, получающих омализумаб (n = 25)
100-| 96 gG 80 -70 -60 -5G 4G 30 -2G 1G G
Рис. 2. Контроль над бронхиальной астмой на фоне лечения омализумабом
0 мес 3 мес 6 мес 9 мес 12 мес 15 мес 18 мес 21 мес 24 мес n = 25 n = 21 n = 19 n = 14 n = 13 n = 11 n = 8 n = 6 n = 5
I Полный контроль □ Частичный контроль □ Нет контроля
• динамика показателей функции легких (каждые 3 месяца);
• динамика показателей теста по контролю над астмой (АСТ-теста) (каждые 3 месяца);
• снижение дозы ингаляционных глюкокортикостероидов на фоне лечения — по общепринятому стандарту уменьшения объема базисной терапии при поддержании контроля над бронхиальной астмой не менее 3-х месяцев (GINA).
Безопасность омализумаба оценивалась по следующим проявлениям:
• развитие серьезных нежелательных явлений, в том числе системных побочных реакций на препарат;
• развитие местных реакций на введение препарата. Характеристика пациентов. Анти-^Е-лечение получали 16 мальчиков и 9 девочек в возрасте 12-17 лет; у большинства подростков первые симптомы бронхиальной астмы появились уже в первые годы жизни, что характерно для тяжелого течения болезни (табл. 3). Все пациенты имели сочетанную аллергическую патологию: у всех был диагностирован аллергический ринит, у 80% — поллиноз, у трети — атопический дерматит и пищевая аллергия. 5 из 25 подростков имели анафилактические реакции в анамнезе, в основном обусловленные пищевой аллергией или синдромом пищевой аллергии. Все больные получали базисную комбинированную терапию в высоких дозах (не менее 500 мкг в сут по флутиказону пропионату). Средняя доза ИГКС на момент начала анти-IgE-лечения составила 778,4 мкг по флутиказону пропионату. 5 подростков, помимо ингаляционной комбинированной терапии, получали монтелукаст. Почти половина больных получала системные ГКС короткими курсами для купирования обострений бронхиальной астмы в течение года, предшествующего началу лечения омализумабом. Уровень общего IgE в сыворотке крови у большинства больных значительно превышал нормальные показатели, в связи с чем более половины наших пациентов получали омализумаб каждые 2 недели. Все больные имели верифицированную атопическую бронхиальную астму. Спектр специфической сенсибилизации к аллергенам представлен на рис. 1.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
На момент начала лечения омализумабом, согласно критериям включения, бронхиальная астма имела неконтролируемое течение у всех больных. На фоне лечения уже через 12 недель (3 месяца анти-^Е-терапии) полный контроль болезни удалось достичь у 9 больных (43%), частичный контроль — у 9 (43%), астма оставалась неконтролируемой у 3 пациентов (14%). Спустя полгода лечения более половины больных полностью контролировали свою болезнь; при более длительном лечении омализумабом у 2/3 больных сохраняется полный контроль над астмой (рис. 2).
Достижение контроля над бронхиальной астмой можно рассматривать первой задачей анти-^Е-лечения. Несмотря на весьма впечатляющую эффективность данной терапии, не следует завышать ожидания от нее. Мы подчеркиваем, что, прежде всего, — это базисная терапия, которая должна помочь в достижении контроля болезни, чего не было на всех предыдущих этапах лечения. Несомненно, именно объективная оценка степени контроля над болезнью, осуществляемая врачом в динамике, позволяет принимать решение в дальнейшем об измене-
Рис. 3. Частота обострений бронхиальной астмы у подростков, получающих омализумаб (п = 13) в Научном центре здоровья детей РАМН
Рис. 4. Частота госпитализаций по поводу бронхиальной астмы у подростков, получающих омализумаб (п = 13) в Научном центре здоровья детей РАМН
— \ А — 77%, р i Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
1 год до лечения 1 год на фоне лечения
нии объема базисной терапии. Достижение контроля болезни для больных — это возможность не только жить без дополнительных обращений к врачу, но и реализовывать свои социальные, интеллектуальные, творческие и спортивные интересы.
Частота клинически значимых обострений бронхиальной астмы на фоне лечения омализумабом в течение года снизилась на 77% по сравнению с предшествующим лечению годом (рис. 3). На втором году лечения частота обострений астмы оставалась невысокой. Существенно снизилась и частота госпитализаций детей, связанных с обострениями болезни (рис. 4). Дети, получавшие омализумаб, госпитализировались в стационар только в течение первых недель лечения, когда эффект препарата еще нельзя было считать достигнутым. После 12 недель лечения госпитализаций в связи с обострениями болезни у наблюдавшихся нами пациентов не было (рис. 5).
Системные ГКС для купирования обострений бронхиальной астмы в течение года, предшествовавшего лечению омализумабом, эпизодически получали 40% наших пациентов. В первые 12 недель лечения двум больным назначался преднизолон коротким курсом до 3-х дней перорального приема, в дальнейшем же потребности в применении системных ГКС у пациентов не отмечалось (см. рис. 5).
Уменьшение частоты и тяжести обострений бронхиальной астмы на фоне лечения омализумабом способствовало и снижению потребности в экстренной медицинской помощи, в том числе потребности во внеплановых визитах к врачам (см. рис. 5). При лечении омализумабом уменьшается необходимость применения антигистаминных препаратов, топических ГКС, в том числе назальных средств, для купирования обострений поллиноза, аллергического ринита и атопического дерматита. Перечисленные здесь критерии эффективности анти-^Е-терапии, такие как потребность в стационарном лечении, обращение за неотложной медицинской помощью, а также уменьшение
потребности в дополнительных лекарственных средствах, характеризуют экономическую составляющую лечения. Учитывая высокую стоимость омализумаба, вопрос об экономической эффективности остается открытым и нуждается в дополнительном анализе.
Уже после 3-х месяцев лечения омализумабом отмечается достоверный прирост скоростных показателей бронхиальной проходимости (рис. 6). В дальнейшем, как через 6 месяцев лечения, так и через 2 года, функция легких остается стабильной, достоверно более высокой по сравнению с исходной. Отсутствие существенных коле-
Рис. 5. Потребность в медицинской помощи и лекарствах на фоне лечения омализумабом
до лечения лечения лечения
12-18 мес 18-24 мес лечения
□ Внеплановые визиты к врачу
□ Потребность в антигистаминных средствах
□ Потребность в назальных ГКС
i Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
сГКС — системные глюкокортикостероиды.
Рис. 6. Показатели функции легких на фоне лечения омализумабом
Рис. 7. Показатели АСТ-теста и доза ингаляционных глюкокортикостероидов на фоне лечения омализумабом
ОФВ1 — объем форсированного выдоха за 1-ю секунду; %Д — % от должного.
ИГ^ — ингаляционные глюкокортикостероиды; ФП — флутиказона пропионат.
баний показателей бронхиальной проходимости отмечается несмотря на то, что в течение 2-х лет наблюдения многие больные пережили как минимум один период возможного сезонного обострения (напомним, что 80% наших пациентов страдает поллинозом).
Известно, что показатели функции легких у детей значительно выше, чем у взрослых, и хуже коррелируют с частотой и степенью тяжести обострений бронхиальной астмы [15]. По данным ВасИапег и соавт., среднее значение показателя ОФВ1 у детей с легкой астмой составляет 95,1, у детей со среднетяжелой астмой — 90,2, у пациентов с тяжелым течением болезни — 83,8% от должного. У части пациентов в исследуемой группе исходные показатели ОФВ1 также были в пределах нормы, снижение их отмечалось в периоды обострений бронхиальной астмы. У подростков с исходно низкими показателями ОФВ1 прирост абсолютного и относительного значения этого параметра оказался весьма существенным. Интересно, что у некоторых из них в течение многих лет до начала терапии омализумабом никогда не отмечалось нормальных значений скоростных показателей, несмотря на постоянное лечение комбинированными противоастматически-ми препаратами.
Исследования у взрослых пациентов с бронхиальной астмой показали, что наибольшую пользу от анти-^Е-терапии могут получить больные с низкой функцией легких (ОФВ1 i Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Лекарственная форма. Омализумаб. Лиофилизат для приготовления раствора для подкожного введения, 150 мг. 1 флакон содержит 150 мг ома-лизумаба (гуманизированные моноклональные антитела, полученные на основе рекомбинантной ДНК). Показания. Лечение персистирующей атопической бронхиальной астмы среднетяжелого и тяжелого течения, симптомы которой недостаточно контролируются применением ингаляционных глюкокортикостероидов у пациентов 12 лет и старше. Дозы и способ применения. В зависимости от исходной концентрации IgE (МЕ/мл) и массы тела пациента (кг) рекомендуемая доза препарата составляет от 75 до 375 мг 1 раз в 2 или 4 недели. Противопоказания. Повышенная чувствительность к омализумабу или к любому другому компоненту препарата. Предосторожности. Препарат не следует применять для лечения острых приступов бронхиальной астмы, острого бронхоспазма или астматического статуса. После начала лечения Ксоларом не рекомендуется резко отменять системные или ингаляционные глюкокортикостероиды. Соблюдать осторожность при применении у больных с нарушениями функции печени и/или почек, с аутоиммунными заболеваниями или заболеваниями, связанными с накоплением иммунных комплексов, с сахарным диабетом, с риском развития гельминтных инфекций, с синдромом нарушения всасывания глюкозы-галактозы, непереносимостью фруктозы или дефицитом сахаразы-изомальтазы (содержание сахарозы в 150 мг препарата составляет 108 мг, в 75 мг — 54 мг), при развитии системных аллергических реакций (включая анафилактические реакции), при беременности и в период лактации. Побочное действие. В ходе клинических исследований редко отмечались следующие серьезные нежелательные реакции: ангионевротический отек, анафилактические реакции и другие аллергические реакции, бронхоспазм. На фоне терапии Ксоларом в клинической практике наблюдались следующие серьезные нежелательные явления (отдельные сообщения): аллергический грануломатозный ангиит, тяжелая идиопатическая тромбоцитопения. Очень часто (у детей): гипертермия, головная боль. Часто: головная боль, реакции в месте введения препарата, отечность, эритема, зуд и головная боль. Иногда: головокружение, сонливость, парестезии, синкопальные состояния, постуральная гипотензия, приливы, фарингит, кашель, тошнота, диарея, диспепсия, крапивница, сыпь, повышенная фоточувствительность, увеличение массы тела, повышенная утомляемость, отек рук, гриппоподобный синдром. Редко: гельминтные инфекции, отек гортани. При применении Ксолара в клинической практике отмечались: алопеция, артралгия, миалгия и опухание суставов. Форма выпуска. Лиофилизат для приготовления раствора для подкожного введения, 150 мг, в комплекте с растворителем — вода для инъекций. Один флакон с лиофилизатом в комплекте с одной ампулой с растворителем и с инструкцией по применению в картонной пачке. Примечание для врача. Прежде, чем назначить препарат, пожалуйста, ознакомьтесь с инструкцией по применению.
Регистрационное удостоверение ЛСР — 000082 от 29.05.2007
НОВАРТИС ФАРМА АГ, ШВЕЙЦАРИЯ, ПРОИЗВЕДЕНО НОВАРТИС ФАРМА ШТЕЙН АГ, ШВЕЙЦАРИЯ
1. Global Initiative for Asthma. Global strategy for asthma management and prevention. Available at: www.ginasthma.org, 2008.
2. Humbert M, Beasley R, Ayres J, et al. Benefits of omallzumab as add-on therapy In patients with severe persistent asthma who are Inadequately controlled despite best available therapy (GINA 2002 step 4 treatment): INNOVATE. Allergy. 2005;60:309-316.
Полную информацию о препарате КСОЛАР можно получить в ООО «Новартис ФАРМА»
115035, г. Москва, ул. Садовническая, 82, стр. 2; тел.: (7 495) 967 1270; факс: (7 495) 967 1268; www.novartis.ru
Таблица 4. Безопасность лечения омализумабом: собственный 2-летний опыт
Нежелательные явления Количество больных
Серьезные нежелательные явления 0
Эритема > 3 см после инъекции (купировалась через 0,5-3 ч после введения препарата) 3
Зуд, сыпь (высыпания прекратились после повторных введений препарата и вряд ли были связаны с ним) 1
Количество больных — 25 человек. NB! Количество инъекций препарата — более 1500.
ной терапии оказалось необходимым у двух больных
для улучшения контроля в период сезонного обострения
55 Безопасность лечения омализумабом оценивалась
5 по наличию/отсутствию серьезных нежелательных явле-
и ний, связанных с введением препарата, а также с разви-
5 тием местных и общих реакций, вероятно, обусловленных
и препаратом (табл. 4). Мы не отмечали серьезных нежела-
£ тельных явлений на омализумаб в течение всего периода
а применения этого лекарственного средства в нашем цен-
0 тре. Необходимо подчеркнуть, что при общем малом коли-
честве больных, получающих анти-^Е-терапию, общее количество инъекций омализумаба за 2 года работы превысило 1500. Ни у кого из больных не было отмечено анафилаксии, крапивницы, ангионевротического отека, а также общих неблагоприятных реакций. У нескольких больных, особенно у пациентов с избыточной массой тела и хорошо развитой подкожно-жировой клетчаткой, отмечались выраженные местные реакции непосредственно в месте инъекционного введения препарата. Следует заметить, что омализумаб — это вязкий густой раствор, медленно распределяющийся в подкожной клетчатке, вводится в максимальном объеме 1,2 мл, в связи с чем образование небольшой папулы или уплотнения диаметром до 1,5-2 см в месте инъекции и сохранение ее в течение 20-60 минут вряд ли можно считать выраженной местной реакцией. Субъективных неприятных ощущений у больных в связи с этим, как правило, не возникает.
Описание клинического случая
Владислав Д., направлен на лечение омализумабом в возрасте 13 лет в марте 2008 г. Жалобы при обращении на приступы удушья 3-5 раз в неделю, в том числе до 2 раз в неделю по ночам, низкую переносимость физической нагрузки, ежедневную потребность в сальбутамоле от 1 до 3 раз в сутки. В этот период получал комбинированную базисную терапию: Серетид 250/25 мкг 4 инг/сут + Фликсотид 250 мкг + Сингуляр
5 мг/сут. Короткие курсы преднизолоном 2-4 раза в год мальчик получал при обострениях астмы. За 2 месяца до начала лечения в Научном центре здоровья детей РАМН он был госпитализирован в стационар в связи с обострением астмы.
При поступлении установлен диагноз: «Бронхиальная астма, атопическая, тяжелого персистирующего течения, неконтролируемая. Круглогодичный аллергический ринит, поллиноз. Экзогенно-конституциональное ожирение (ИМТ 25 кг/м2)».
Из анамнеза: ребенок от матери, страдающей хроническим гломерулонефритом, у отца круглогодичный аллергический ринит, у дяди по линии отца бронхиальная астма. Перинатальный анамнез не отягощен. Весо-ростовые показатели при рождении средние. С первых месяцев жизни до 1 года у мальчика отмечались проявления атопического дерматита. С 1 года начал рецидивировать обструктивный бронхит на фоне ОРИ; заболевания протекали с дыхательной недостаточностью 1-2 степени; неоднократно был госпитализирован по этому поводу. В 2 года диагностирована бронхиальная астма. Назначались курсы лечения Задитеном, затем Инталом. С 4-х лет начал получать базисную терапию ингаляционными глюкокортикостероидами. В связи с недостаточным контролем болезни с 5 лет к терапии ИГКС был добавлен пролонгированный теофиллин, а с 7 лет — фиксированная комбинация флутиказона пропионата с сальметеро-лом в дозе до 750 мкг в сутки по флутиказону. С 9 лет доза ингаляционного глюкокортикостероида в комбинации была увеличена до 1000 мкг в сутки в связи с отсутствием контроля над бронхиальной астмой. Приступы затрудненного дыхания провоцировались интеркуррентными инфекциями, физической нагрузкой, резкими запахами, контактом с пылью. Тяжелые обострения развивались осенью и весной в период цветения деревьев. При поступлении в стационар доза ингаляционных глюкокортикостероидов в составе комбинированной терапии составляла 1250 мкг по флутиказону пропионату в сутки. Часто пропускал школьные занятия по причине болезни; внеплановые визиты к аллергологу и педиатру по месту жительства — ежемесячные, иногда более 2-х раз в месяц.
При обследовании в клинике: уровень общего 652 МЕ/мл, выявлена сенсибилизация к бытовым, пыльцевым аллергенам ++++/+++. Показатели функции внешнего дыхания: ОФВ1 72% должного, после Сальбутамола — 95% (+550 мл); ИТ — 76%, бронхиальное сопротивление — 277%. Результат АСТ-теста 20 баллов (у мальчика всегда «все хорошо») (рис. 8).
В связи с тяжелой неконтролируемой бронхиальной астмой, несмотря на комбинированную терапию высокими дозами ингаляционных глюкокортикостероидов в сочетании с длительнодействующими р2-агонистами и ингибиторами лейкотриеновых рецепторов, в клинике был назначен омализумаб (Ксолар) в дозе 375 мг каждые 2 недели. Доза рассчитана, исходя из веса пациента (60 кг) и уровня ^Е (652 МЕ/мл).
На фоне лечения омализумабом достоверный прирост функциональных показателей внешнего дыхания был достигнут уже после первых 3 месяцев лечения. Первый сезон весеннего цветения в мае 2008 г. (лечение начато за 8 недель до начала сезона цветения) мальчик перенес с обострением астмы, по поводу чего в течение 3 дней
получал преднизолон перорально. В дальнейшем состояние постепенно стабилизировалось. Через 6 месяцев лечения доза флутиказона пропионата в составе комбинированной терапии была снижена до 1000 мкг, через 1,5 года лечения при хорошем контроле болезни, отсутствии обострений, стабильно высоких показателях функции внешнего дыхания доза флутиказона была снижена до 500 мкг в сутки (см. рис. 8). Мальчик начал заниматься спортом, увлекся хоккеем, посещает тренировки 3-4 раза в неделю, физические нагрузки переносит хорошо. На протяжении последнего полугодия лечения практически отсутствует потребность в сальбутамоле, приступы затрудненного дыхания развиваются не чаще 1-2 раз в месяц, исчезли ночные приступы удушья. Мальчик вырос на 10 см за период наблюдения, индекс массы тела снизился до 19 кг/м2. Побочных реакций на лечение омализумабом не отмечается. Лечение позволило достичь полного контроля над бронхиальной астмой, справиться с ожирением, отказаться от использования сверхвысоких доз ингаляционных глюкокортикостероидов, уменьшить потребность в обращениях к врачам и лекарствам, а также реализовать давнюю мечту — стать хоккейным вратарем.
Приведенные данные собственного опыта применения анти-^Е-терапии у детей и подростков, страдающих тяжелой неконтролируемой атопической бронхиальной астмой, показывают ее высокую эффективность при весьма удовлетворительном профиле безопасности. Омализумаб позволяет решить проблему контроля над болезнью для наиболее тяжелых, резистентных к стандартной терапии пациентов.
Авторы статьи выражают искреннюю признательность и благодарность всему коллективу различных клини-
Рис. 8. Клинический пример. Динамика показателей функции внешнего дыхания, АСТ-теста и дозы ИГКС у пациента на фоне лечения омализумабом в течение 2-х лет
ФВД — функция внешнего дыхания; ФП — флутиказона пропионат; ИГКС — ингаляционные глюкокортикостероиды; АСТ-тест — тест по контролю над астмой; ОФВ±-постБД — объем форсированного выдоха после бронходилататора.
ческих подразделений и лабораторий Научного центра здоровья детей РАМН, терпеливо и кропотливо участвовавших в лечении и обследовании детей, чьи истории болезни и жизни здесь описаны.
1. Djukanovic R., Wilson S., Kraft M. et al. Effects of treatment with anti-immunoglobulin E antibody omalizumab on airway inflammation in allergic asthma // Am. J. Respir. Crit. Care Med. — 2004; 170: 583-593.
2. MacGlashan D., Bochner B., Adelman D. et al. Down-regulation of FceRI expression on human basophils during in vivo treatment of atopic patients with anti-IgE antibody therapy // J. Immunol. — 1997; 158: 1438-45.
3. Soresi S., Togias A. Mechanisms of action of anti-immunoglobulin E-therapy // Allergy Asthma Proc. — 2006; 27: 15-23.
4. Walker S., Monteil M., Phelan K. et al. Anti-IgE for chronic asthma in adults and children (Review). Cochrane Database of Systematic Reviews 2006; Issue 2. Art. No.: CD003559.
5. Busse W., Corren J., Lanier B. Q. et al. Anti-IgE recombinant humanized monoclonal antibody for the treatment of severe allergic asthma // J. of Allergy and Clinical Immunology. — 2001; 108 (2): 184-90.
6. Soler M., Matz J., Townley R., Buhl R. et al. The anti-IgE antibody omalizumab reduces exacerbations and steroid requirement in allergic asthmatics // European Respiratory Journal. — 2001; 18: 254-61.
7. Holgate S., Chuchalin A., Hebert J. et al. Efficacy and safety of a recombinant anti-immunoglobulin E antibody (omalizumab) in severe allergic asthma // Clin. Exp. Allergy. — 2004; 34: 632-638.
8. Pollard S. J. et al. Effect of omalizumab on measures of control in adolescents with moderate-severe persistent asthma // J. Allergy Clin. Immunol. — 2007; 119 (1): 10.
9. Milgrom H. et al. Effect of omalizumab on need for rescue steroid bursts in adolescent asthmatics — a pooled analysis // Ann. Allergy Asthma Immunol. — 2007; 98 (1): 79.
10. Milgrom H., Berger W., Nayak A. et al. Treatment of childhood asthma with anti-immunoglobulin E antibody (omalizumab) // Pediatrics. — 2001; 108: 36.
11. Berger W., Gupta N., McAlary M., Fowler-Taylor A. Evaluation of long-term safety of the anti-IgE antibody, omalizumab, in children with allergic asthma // Annals of Allergy Asthma and Immunology. — 2003; 91: 182-188.
12. Milgrom H. et al. Add-on omalizumab significantly reduces exacerbation rates in children with inadequately controlled moderate-to-severe allergic (IgE-mediated) asthma. — ATS, 2009; PD 06.
13. Milgrom H. et al. Safety of omalizumab in children with inadequately controlled moderate-to-severe allergic (IgE-mediated) asthma. — ATS, 2009; PD 07.
14. Xolair® prescribing information. Genentech., Inc. April, 2006.
15. Bacharier L.B. et al. Effects of treatment with anti-immunoglobulin E antibody omalizumab on airway inflammation in allergic asthma // Am. J. Respir. Crit. Care Med. — 2004; 170(6): 583-93.
16. Bousquet J., Wenzel S., Holgate S. et al. Predicting response to omalizumab, an anti-IgE antibody, in patients with allergic asthma // Chest. — 2004; 125: 1378-86.
источник