До меня недавно докатился слух о том, что будто наши ученые разработали очередную «кремлевскую таблетку» и уже используют ее для лечения людей, болеющих бронхиальной астмой. Будто бы она позволяет справиться с самыми тяжелыми случаями бронхиальной астмы и буквально преображает жизнь людей с любой аллергией. В результате долгих поисков и разговоров с информированными людьми выяснилось, что это не очередная утка.
Новое лекарство действительно есть, и оно действительно помогает при бронхиальной астме, причем самой тяжелой. Правдой оказалось и то, что это лекарство эффективно и при некоторых других видах аллергии.
К сожалению, назвать это лекарство «кремлевской таблеткой» не получится по целым трем причинам. Во-первых, разработали его не отечественные специалисты, а швейцарские, во-вторых, оно вышло за рамки «придворных» медицинских учреждений, и, наконец, это не таблетка. Пожалуй, только последний факт несколько меня опечалил (хотя, конечно, жаль, что не нашим ученым принадлежит приоритет его изобретения), потому что вводят лекарство подкожно — в инъекциях. Впрочем, это не самое главное — лишь бы помогало.
Кстати, может, и к лучшему обойтись без вычурных названий типа «кремлевских таблеток» и громких эпитетов, от которых веет шарлатанством. Современное лечение бронхиальной астмы обрело название «анти-IgE терапия» и не содержит в себе ничего необъяснимого или паранормального, а опирается исключительно на достижения иммунологии и молекулярной технологии. Суть его в том, что ошибку иммунитета исправляют тоже с помощью иммунных механизмов. Но сначала вспомним, что такое иммуноглобулины класса Е (IgE) и зачем с ними надо бороться.
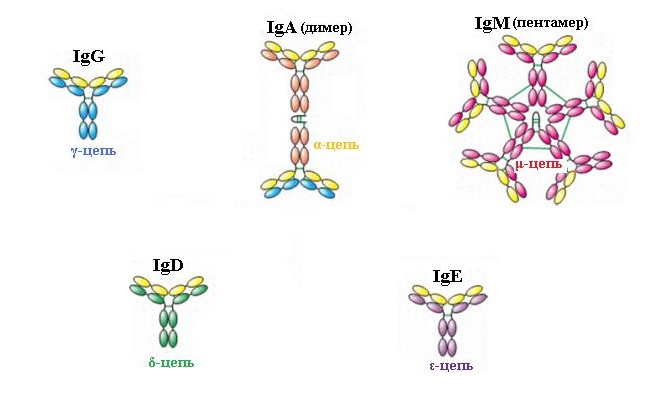
У большинства людей с бронхиальной астмой есть генетическая предрасположенность к выработке аллергических антител, которыми и являются IgE (в отличие от антител классов A, M и G, защищающих организм от различных микробов). Эти антитела вырабатываются лимфоцитами в ответ на определенный аллерген, поступают в кровь и доносятся до тучных клеток, где фиксируются на специальных рецепторах.
Тучные клетки расположены на «пограничных заставах» организма — в коже, конъюнктиве, слизистых оболочках бронхов, носа, желудочно-кишечного тракта, то есть там, откуда могут проникнуть аллергены. Если аллерген, к которому у человека выработались IgE, попадает в организм, эти фиксированные на тучной клетке антитела узнают его и дают клетке сигнал к запуску каскада аллергического воспаления. А в результате человек ощущает симптомы со стороны того органа, где «сидят» IgE, — бронхов (при бронхиальной астме), кожи (при атопическом дерматите или крапивнице), носа (при аллергическом рините) и т.д.
Чтобы не допустить запуска этого аллергического каскада, и были синтезированы специальные антитела для анти-IgE терапии, которые после подкожного введения связывают IgE в крови, не позволяя им «прилепиться» к тучным клеткам.
Кому же проводится анти-IgE терапия? Конечно, решение принимает врач-аллерголог, но и нам надо представлять, есть ли смысл задумываться о таком лечении (ведь средство сильнодействующее, а из пушки по воробьям не стреляют).
Анти-IgE терапия показана людям страдающим тяжелой и среднетяжелой бронхиальной астмой, у которых не удается добиться должного эффекта с помощью высоких доз ингаляционных гормонов и бронхолитиков длительного действия. Обязательно должна быть доказана аллергическая природа заболевания — повышенное содержание IgE в крови, а пациент должен быть старше 12 лет.
Если врач назначил анти-IgE терапию, то один раз в 2 или 4 недели человеку делают подкожную инъекцию (доза и частота введения препарата определяются в зависимости от массы тела пациента и исходного уровня иммуноглобулина Е в крови). Заметим, что бросать то лечение, которое проводилось раньше, нельзя, а можно лишь постепенно уменьшать его объем по рекомендации лечащего врача.
Эффективность анти-IgE терапии была изучена у пациентов с тяжелой и среднетяжелой бронхиальной астмой, у которых не удавалось контролировать заболевание с помощью наиболее действенных препаратов (ингаляционных гормонов и бронхолитиков длительного действия).
Как показали исследования, добавление к лечению анти-IgE уменьшает тяжесть симптомов и частоту обострений и даже позволяет снизить поддерживающую дозу гормонов у пациентов с гормонозависимой формой заболевания. Наряду с облегчением течения бронхиальной астмы анти-IgE терапия помогает справиться и с симптомами сопутствующих аллергических болезней (аллергического ринита, пищевой аллергии). Впрочем, этот «побочный эффект» был вполне предсказуемым — ведь IgE перестают поступать не только в бронхи, но и в другие органы, где возможны аллергические реакции. Побольше бы таких «побочных эффектов».
Вот видите, напрасно говорят: «Не верьте слухам!» Иногда бывает полезно и поверить. Но только — из достоверных источников.
источник
Применение анти – IgE (омализумаб — ксолар) ограничивается пациентами с тяжелым неконтролируемым течением экзогенной БА с повышенным уровнем IgE в сыворотке. Ксолар связывает циркулирующие IgE независимо от их специфичности в биологически инертные комплексы. Российский опыт лечения ксоларом в течение 8 лет свидетельствует о его высоком терапевтическом эффекте и безопасности. Во флаконе 150 мг сухого вещества. Вводится подкожно в 2-4 недели, доза рассчитывается в зависимости от исходного уровня общего IgE и массы тела. Использование этого препарата в широкой практике ограничивается из — за его высокой стоимости
Принцип долгосрочного лечения заключается в назначении терапевтических доз базисного препарата для достижения желаемого эффекта. После стабилизации процесса (не менее 3-х месяцев) дозу постепенно снижают до минимальной поддерживающей, обеспечивающей у больного дыхательный комфорт. При развитии стрессовых ситуаций (ОРВИ, операции, длительное эмоциональное или физическое перенапряжение и т.д.) доза базисного препарата увеличивается. Наиболее предпочтительна форма применения препаратов — ингаляционная.
При интермиттирующей БА базисная терапия не показана, применяются b2-агонисты быстрого действия ситуационно.
К препаратам второй группы относятся быстро действующие адреномиметики (сальбутамол, фенотерол, тербуталин, формотерол), ингаляционные антихолинергические препараты (ипратропия бромид), комбинированные препараты ингаляционных β2-адреномиметиков и ипратропия бромида, теофиллин короткого действия.
При атопической астме легкого течения реже средней степени тяжести в случае верифицированного аллергена при IgE обусловленном варианте проводится аллергенспецифическая иммунотерапия (АСИТ) в условиях аллергологического отделения или кабинета.
При эффективности АСИТ охватываются все патогенетические звенья аллергического процесса. Этот метод обладает длительным профилак-тическим эффектом после завершения лечебных курсов. При этом: снижается тканевая чувствительность к аллергенной экспозиции, уменьшается тканевая гиперреактивность, происходит угнетение признаков аллергического воспаления.
Показания к АСИТ: наличие четко доказанной связи между клиникой заболевания и индуктором — аллергеном при невозможности его элиминации.
Противопоказания к АСИТ: хронические заболевания в стадии декомпенсации, эндокринные заболевания, злокачественные и доброкачественные новообразования, заболевания крови, психические заболевания, хронический вирусный гепатит, туберкулез, диффузные заболевания соединительной ткани.
Относительные противопоказания: острый период любых заболеваний, беременность и период лактации, возраст более 50 лет, наличие паразитоза, астматическая триада с клиническими проявлениями бытовой сенсибилизации.
По материалам взрослого аллергологического отделения ККБ были получены отличные и хорошие результаты после проведения АСИТ у больных с АБА более чем в 80% случаев. Подобные результаты получены аллергологами и других регионов страны.
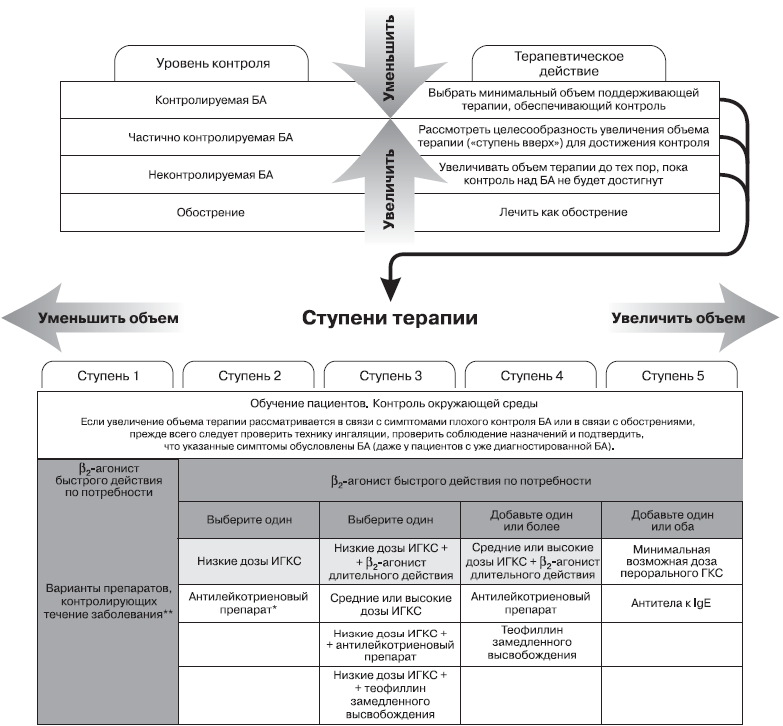
Каждая ступень включает варианты терапии, которые могут служить альтернативами при выборе поддерживающей терапии БА, хотя и не являются одинаковыми по эффективности. Эффективность терапии возрастает от ступени 1 к ступени 5; хотя на ступени 5 выбор лечения зависит также от доступности и безопасности лекарственных препаратов.
У большинства больных с симптомами персистирующей БА, ранее не получавших поддерживающей терапии, следует начинать лечение со ступени 2. Если при первичном осмотре (в случае отсутствии базисной терапии) выявляются выраженные клинические проявления заболевания, то лечение целесообразно, начинать со ступени 3.
На каждой ступени терапии пациенты могут использовать препараты неотложной помощи (β2 агонисты короткого действия). Однако, регулярное использование препаратов неотложной помощи является одним из признаков неконтролируемой БА, и требует изменения объема поддерживающей терапии. Поэтому уменьшение или отсутствие потребности в препаратах неотложной помощи является и важной целью лечения, и критерием его эффективности.
Для ступеней 2–5 имеется множество препаратов, контролирующих течение заболевания.
Ступень 1: препарат неотложной помощи по потребности. Для 1 ступени характерно отсутствие базисной терапии и применение препаратов неотложной помощи по потребности. В случае более частого появления симптомов или эпизодического ухудшения состояния пациентам показана регулярная поддерживающая терапия (ступень 2 или выше) в дополнение к препаратам неотложной помощи по потребности.
Для большинства больных рекомендуемыми препаратами неотложной помощи на ступени 1 являются ингаляционные β2-агонисты быстрого действия. Альтернативными средствами являются ингаляционные антихолинергические препараты, пероральные β2-агонисты короткого действия или теофиллин короткого действия, хотя для этих препаратов характерно более медленное начало действия и более высокий риск побочных эффектов.
Ступень 2: препарат неотложной помощи плюс один препарат для контроля течения заболевания. Ступени 2–5 включают комбинацию препарата неотложной помощи по потребности с регулярной поддерживающей терапией. В качестве начальной поддерживающей терапии БА у больных любого возраста на ступени 2 рекомендуются ИГКС в низкой дозе. Альтернативными средствами для контроля БА являются антилейкотриеновые препараты, в особенности у пациентов, которые не способны или не желают использовать ИГКС, или у пациентов, у которых ИГКС вызывают труднопереносимые побочные эффекты (например, постоянную охриплость голоса), а также у пациентов с сопутствующим аллергическим ринитом.
Ступень 3: препарат неотложной помощи плюс один или два препарата для контроля течения заболевания.
На ступени 3 можно использовать:
· комбинацию низкой дозы ИГКС + ингаляционный β2-агонист длительного действия, прием которой осуществляется с помощью одного ингалятора с фиксированной комбинацией или с помощью разных ингаляторов. Благодаря аддитивному эффекту такой комбинации обычно оказывается достаточно назначения низких доз ИГКС.
· средние или высокие дозы ИГКС
· комбинацию ИГКС в низкой дозе + антилейкотриеновый препарат.
· комбинацию ИГКС в низкой дозе + теофиллин замедленного высвобождения.
Ступень 4: препарат неотложной помощи плюс два или более препаратов для контроля течения заболевания. На ступени 4 используют комбинацию ИГКС в средней или высокой дозе с ингаляционным β2-агонистом длительного действия.
При отсутствии достижения контроля к базисной терапии нужно добавить один или оба из следующих препаратов:
· антилейкотриеновые препараты, особенно у больных с сопутствующим аллергическим ринитом, у курящих пациентов и с ожирением;
· низкие дозы теофиллина замедленного высвобождения, также может повышать эффективность лечения.
Ступень 5: препарат неотложной помощи плюс дополнительные варианты применения средств для контроля течения заболевания. Добавление перорального ГКС к другим препаратам поддерживающей терапии может увеличивать эффект лечения, но сопровождается тяжелыми нежелательными явлениями. Поэтому оно должно рассматриваться как вариант лечения только у больных с тяжелой неконтролируемой БА на фоне терапии, соответствующей ступени 4, при наличии у пациента ежедневных симптомов, ограничивающих активность, и частых обострений.
Показано, что применение антител к иммуноглобулину E (anti-IgE) в дополнение к другим препаратам поддерживающей терапии улучшает контроль над аллергической БА в тех случаях.
источник
Реакцией организма на внешние раздражители становится отечность слизистой, покраснения и высыпания на коже. За это отвечает иммуноглобулин Е.
Выработка данных антител в ответ на появление чужеродных клеток (в том числе бактерий, грибков) происходит в подслизистых слоях системы пищеварения, кожного покрова, миндалин, аденоидов, дыхательных путей.
Показатель иммуноглобулина Е при бронхиальной астме имеет важное значение для диагностики. Данное заболевание связано с удушьем, одышкой и кашлем, вызванными воспалением и реакцией бронхов на раздражители.
Иммуноглобулин Е – это особая разновидность белков, производимых лимфоцитами В группы, которая отвечает за реакцию иммунной системы на проникновение в организм паразитов (токсоплазмы, трихинелл, аскарид) и обладает антигельминтным эффектом.
Также IgE участвуют в процессе развития воспаления при попадании в организм аллергенов.
Часто повышаются иммуноглобулины при атопическом дерматите, бронхиальной астме и крапивнице. У многих людей имеется генетическая расположенность к появлению аллергических антител, к которым и относятся иммуноглобулины IgE.
Различают раннюю и отсроченную фазу аллергии. В первой под воздействием активных веществ увеличивается проницаемость сосудистых стенок, развивается отек тканей , активизируется секреция желез, происходит раздражение нервных окончаний, сокращение мускулатуры в органах.
Под действием биологически активных веществ в область воспаления привлекаются кровяные клетки, выделяющие антивоспалительные медиаторы.
Уровень иммуноглобулина Е определяется в следующих ситуациях:
- при инфекциях, воспалениях или аллергических проявлениях;
- при первичных иммунодефицитах;
- при злокачественных опухолях;
- при симптомах бронхолегочного аспергиллеза;
- при назначении иммуно-специфической терапии. Ее можно проводить при показателях IgE 30-700 IU/ml.
При бронхиальной астме программа исследований начинается со сдачи анализов, после проведения которых определяется причина патологии и назначается правильная терапия.
Кроме общего анализа (на гемоглобин, СОЭ, содержание лейкоцитов и эритроцитов), проводятся иммунологическое и биохимическое исследования крови, анализ мокроты. При необходимости специалист назначает дополнительные обследования.
Перед сдачей анализа нельзя принимать пищу 8 часов, рекомендуется за сутки исключить из рациона жареное, жирное, алкогольные напитки.
Иммунологические исследования направлены на выявление повышения уровня IgE, что важно для дифференциации инфекционно-зависимой и аллергической формы астмы.
При этом также определяют в сыворотке крови объем иммуноглобулина и специфических антител.
Общий уровень иммуноглобулина не является основанием для постановки диагноза , потому что этот показатель может быть одинаковым у здорового и больного пациента.
Определение уровня специфического IgE осуществляется посредством кожных проб, а при высокой опасности анафилактических реакций – при помощи радиоаллергенного теста.
После определения в сыворотке крови специфических иммуноглобулинов выявляются возможные аллергены. Как правило, при этом уровень IgE превышает нормативные показатели, а Т-супрессорные лейкоциты снижены.
В нормальном состоянии уровень общего иммуноглобулина Е в кровяной плазме будет низким, так как нет необходимости в выработке защитного белка при отсутствии атопических антигенов.
У детей показатель общего IgE меняется с возрастом и отличается от норм для взрослых людей. К периоду полового созревания эти цифры устанавливаются и потом не меняются. В пожилом возрасте количество защитных антител снижается – это нормальное явление.
Если содержание IgE у взрослого человека — 3-423 МЕ/мл, то его уровень в норме. При бронхиальной астме эти показатели составляют 120–1200 МЕ/мл.
Но высокие показатели иммуноглобулина не являются основой для диагностических заключений, так как причин для его повышения много, например, поллиноз и аллергический ринит.
Необходимо провести углубленные исследования, чтобы точно определить, почему повышен аллерген-специфический IgE.
Атопическая бронхиальная астма, как и другие болезни аллергической природы, развивается при попадании в организм аллергенов (пищевых добавок, пыли, пыльцы, чужеродного белка, лекарств, химикатов и пр.).
При развитии аллергической реакции выделяются специфические иммуноглобулины. Они дают сигнал о начале воспаления.
С увеличением содержания иммуноглобулинов Е в крови повышается количество рецепторов к данным антителам на поверхности клетках, активирующих аллергические реакции.
В результате выбрасываются медиаторы воспаления, что приводит к развитию тяжелой симптоматики. У людей с тяжелой патологией бронхов намного больше рецепторов к иммуноглобулинам, чем при легкой форме или у здоровых.
Если особое внимание при лечении уделить уменьшению воздействия IgE, то можно исключить или снизить интенсивность воспаления, так как будет меньше выделяться веществ, его провоцирующих.
Также можно связать Е-молекулы в крови до их оседания на клеточных рецепторах с помощью антител, выделенных из организма животных.
Однако чужеродные белки сами могут приводить к развитию аллергических проявлений, особенно у астматиков, поэтому не всем и не всегда разрешена такая терапия.
При астме для выявления реакции, которую вызывает иммуноглобулин, применяют клинические тестирования. При этом на поврежденную кожу наносят аллергены или вводят их подкожно. Начинает выделяться иммуноглобулин, вызывающий воспаление в области контакта.
Получить направление на диагностику можно у аллерголога, который назначит правильное лечение. Раньше терапия бронхиальной астмы проводилась путем снятия сужения бронхов с помощью бронхорасширяющих лекарств. Но у астматиков только облегчались проявления приступа, но предотвратить обострения не удавалось.
В настоящее время врачи достигли прогресса в лечении благодаря изучению природы астмы. У пациентов стало возможным предотвращать обострения и приступы.
Бронхиальную астму часто лечат высокими дозами ингаляционных глюкокортикостероидов в сочетании с бета-2-агонистами или назначают гормональные препараты в форме таблеток.
Но даже при такой усиленной терапии не всегда удается контролировать симптомы. Поэтому ученые занимаются поиском лекарств, оказывающих воздействие на причину заболевания.
При астме тяжелой степени рекомендуется анти-IgE-терапия. Пациентам вводится особое вещество — омализумаб, блокирующее активность иммуноглобулина Е. В результате у астматиков снижается количество обострений, уменьшается необходимость в системных гормонах, улучшается качество жизни.
Препарат имеет высокую эффективность, при его приеме редко появляются признаки аллергии и не выявлены опасные последствия. Назначается омализумаб детям старше 6 лет и взрослым при подтвержденной атопической природе болезни после проведения аллергопроб, выявления повышенного содержания в сыворотке крови общего иммуноглобулина.
Препарат вводят под кожу раз в 2-4 недели, дозировка выбирается, исходя из уровня IgE.
Кроме того, в зависимости от причин заболевания, назначаются следующие препараты:
- Антигистаминные лекарства. Блокируют рецепторы, реагирующие на гистамин, участвующий в развитии аллергической реакции.
- Препараты местного действия (для уменьшения внешних проявлений патологии, предотвращения осложнений) – мази и капли с противовоспалительным действием.
- Противогельминтные средства для борьбы с паразитарной инвазией.
- Стимуляторы иммунной системы, уменьшающие аллергические проявления.
Медикаменты назначаются врачом с учетом особенностей течения бронхиальной астмы, степени тяжести и причин обострений.
Из народных средств часто применяют отвар из листьев зверобоя, травы золототысячника, хвоща полевого, кукурузных рылец, соцветий ромашки, корня одуванчика и ягод шиповника.
Также можно использовать смесь порошка из яичной скорлупы с лимонным соком или сделать отвар из корней лопуха и одуванчика.
Бронхиальная астма – диагноз клинический, то есть врач ставит его на основании прежде всего жалоб, истории заболевания и данных осмотра и внешнего исследования (пальпации, перкуссии, аускультации). Однако дополнительные методы исследования дают ценную, а в некоторых случаях определяющую диагностическую информацию, поэтому они широко применяются на практике.
Диагностика бронхиальной астмы с помощью дополнительных методов включает проведение лабораторных анализов и инструментальных исследований.
Пациенту с астмой могут быть назначены следующие анализы:
- общий анализ крови;
- биохимический анализ крови;
- общий анализ мокроты;
- анализ крови для выявления общего IgE;
- кожные пробы;
- определение в крови аллергенспецифических IgE;
- пульсоксиметрия;
- анализ крови на газы и кислотность;
- определение оксида азота в выдыхаемом воздухе.
Разумеется, не все эти тесты выполняются у каждого больного. Некоторые из них рекомендуются лишь при тяжелом состоянии, другие – при выявлении значимого аллергена и так далее.
Общий анализ крови выполняется у всех пациентов. При бронхиальной астме, как и при любом другом аллергическом заболевании, в крови отмечается увеличение количества эозинофилов (EOS) более 5% от общего количества лейкоцитов. Эозинофилия в периферической крови может возникать не только при астме. Однако определение этого показателя в динамике (повторно) помогает оценить интенсивность аллергической реакции, определить начало обострения, эффективность лечения. В крови может определяться незначительный лейкоцитоз и увеличение скорости оседания эритроцитов, однако это необязательные признаки.
Биохимический анализ крови у больного с астмой часто никаких отклонений не выявляет. У некоторых пациентов отмечается увеличение уровня α2- и γ-глобулинов, серомукоида, сиаловых кислот, то есть неспецифических признаков воспаления.
Обязательно проводится анализ мокроты. В ней находят большое количество эозинофилов – клеток, участвующих в аллергической реакции. В норме их меньше 2% от всех обнаруженных клеток. Чувствительность этого признака высокая, то есть он обнаруживается у большинства больных с астмой, а специфичность средняя, то есть, помимо астмы, эозинофилы в мокроте встречаются и при других заболеваниях.
В мокроте нередко определяются спирали Куршмана – извитые трубочки, образующиеся из бронхиальной слизи при спазме бронхов. В них вкраплены кристаллы Шарко-Лейдена – образования, которые состоят из белка, образующегося при распаде эозинофилов. Таким образом, два этих признака говорят о снижении бронхиальной проходимости, вызванном аллергической реакцией, что часто и наблюдается при астме.
Кроме того, в мокроте оценивается наличие атипичных клеток, характерных для рака, и микобактерий туберкулеза.
Анализ крови на общий IgE показывает уровень в крови этого иммуноглобулина, который вырабатывается в ходе аллергической реакции. Он может быть повышен при многих аллергических заболеваниях, но и нормальное его количество не исключает бронхиальную астму и другие атопические процессы. Поэтому гораздо более информативным является определение в крови специфических IgE – антител к конкретным аллергенам.
Для анализа на специфические IgE используются так называемые панели – наборы аллергенов, с которыми реагирует кровь больного. Тот образец, в котором содержание иммуноглобулина будет выше нормы (у взрослых это 100 ед/мл), и покажет причинно-значимый аллерген. Используются панели шерсти и эпителия разных животных, бытовые, грибковые, пыльцевые аллергены, в некоторых случаях – аллергены лекарств и пищевые.
Для выявления аллергенов применяются и кожные пробы. Их можно проводить у детей любого возраста и у взрослых, они не менее информативны, чем определение IgE в крови. Кожные пробы хорошо себя зарекомендовали в диагностике профессиональной астмы. Однако при этом существует риск внезапной тяжелой аллергической реакции (анафилаксии). Результаты проб могут меняться под действием антигистаминных препаратов. Их нельзя проводить при кожной аллергии (атопическом дерматите, экземе).
Пульсоксиметрия – исследование, проводимое с помощью небольшого прибора – пульсоксиметра, который обычно надевается на палец пациента. Он определяет насыщение артериальной крови кислородом (SpO2). При снижении этого показателя менее 92% следует выполнить исследование газового состава и кислотности (рН) крови. Снижение уровня насыщения крови кислородом свидетельствует о тяжелой дыхательной недостаточности и угрозе для жизни больного. Определяемое при исследовании газового состава снижение парциального давления кислорода и увеличение парциального давления углекислого газа свидетельствует о необходимости искусственной вентиляции легких.
Наконец, определение оксида азота в выдыхаемом воздухе (FENO) у многих больных с астмой выявляет увеличение этого показателя выше нормы (25 ppb). Чем сильнее воспаление в дыхательных путях и больше доза аллергена, тем показатель выше. Однако такая же ситуация бывает и при других болезнях легких.
Таким образом, специальные лабораторные методы диагностики астмы – кожные пробы с аллергенами и определение в крови уровня специфических IgE.
Методы функциональной диагностики бронхиальной астмы включают:
- исследование вентиляционной функции легких, то есть способности этого органа доставлять необходимое количество воздуха для газообмена;
- определение обратимости бронхиальной обструкции, то есть снижения проходимости бронхов;
- выявление гиперреактивности бронхов, то есть их склонности к спазму под действием вдыхаемых раздражителей.
Основной метод исследования при бронхиальной астме – спирометрия, или измерение дыхательных объемов и скоростей воздушных потоков. С него обычно начинается диагностический поиск еще до начала лечения больного.
Главный анализируемый показатель – ОФВ1, то есть объем форсированного выдоха за секунду. Проще говоря, это количество воздуха, которое человек способен быстро выдохнуть в течение 1 секунды. При спазме бронхов воздух выходит из дыхательных путей медленнее, чем у здорового человека, показатель ОФВ1 снижается.
Если при первичной диагностике уровень ОФВ1 составляет 80% и больше от нормальных показателей, это говорит о легком течении астмы. Показатель, равный 60 – 80% от нормы, появляется при астме средней тяжести, менее 60% – при тяжелом течении. Все эти данные применимы только к ситуации первичной диагностики до начала терапии. В дальнейшем они отражают не тяжесть астмы, а уровень ее контроля. У людей с контролируемой астмой показатели спирометрии в пределах нормы.
Таким образом, нормальные показатели функции внешнего дыхания не исключают диагноз «бронхиальная астма». С другой стороны, снижение бронхиальной проходимости обнаруживается, например, при хронической обструктивной болезни легких (ХОБЛ).
Если обнаружено снижение бронхиальной проходимости, то важно выяснить, насколько оно обратимо. Временный характер бронхоспазма – важное отличие астмы от того же хронического бронхита и ХОБЛ.
Итак, при снижении ОФВ1 для выявления обратимости бронхиальной обструкции проводятся фармакологические тесты. Пациенту дают препарат посредством дозированного аэрозольного ингалятора, чаще всего 400 мкг сальбутамола, и через определенное время снова проводят спирометрию. Если показатель ОФВ1 увеличился после использования бронхолитика на 12% и больше (в абсолютных цифрах на 200 мл и больше), говорят о положительной пробе с бронходилататором. Это означает, что сальбутамол эффективно снимает спазм бронхов у данного пациента, то есть бронхиальная обструкция у него непостоянна. Если показатель ОФВ1 увеличивается менее чем на 12%, это признак необратимого сужения бронхиального просвета, а если он уменьшается, это говорит о парадоксальном спазме бронхов в ответ на использование ингалятора.
Прирост ОФВ1 после ингаляции сальбутамола на 400 мл и больше дает практически полную уверенность в диагнозе «бронхиальная астма». В сомнительных случаях может быть назначена пробная терапия ингаляционными глюкокортикоидами (беклометазон по 200 мкг 2 раза в день) в течение 2 месяцев или даже таблетками преднизолона (30 мг/сут) в течение 2 недель. Если показатели бронхиальной проходимости после этого улучшаются – это говорит в пользу диагноза «бронхиальная астма».
В некоторых случаях даже при нормальных показателях ОФВ1 применение сальбутамола сопровождается приростом его величины на 12% и больше. Это говорит о скрытой бронхиальной обструкции.
В других случаях нормальной величины ОФВ1 для подтверждения гиперреактивности бронхов применяют ингаляционную пробу с метахолином. Если она будет отрицательной, это может служить причиной для исключения диагноза астмы. Во время исследования пациент вдыхает возрастающие дозы вещества, и определяется минимальная концентрация, которая вызывает снижение ОФВ1 на 20%.
Применяются и другие пробы для выявления гиперреактивности бронхов, например, с маннитолом или физической нагрузкой. Падение ОФВ1 в результате использования этих проб на 15% и более с высокой степенью достоверности указывает на бронхиальную астму. Проба с физической нагрузкой (бег в течение 5 – 7 минут) широко применяется для диагностики астмы у детей. Применение ингаляционных провокационных проб у них ограничено.
Еще один важнейший метод инструментальной диагностики астмы и контроля за ее лечением – пикфлоуметрия. Пикфлоуметр должен быть у каждого пациента с этим заболеванием, ведь самоконтроль – основа эффективной терапии. С помощью этого небольшого аппарата определяют пиковую скорость выдоха (ПСВ) – максимальную скорость, с которой пациент может выдохнуть воздух. Этот показатель, так же как и ОФВ1, прямо отражает бронхиальную проходимость.
ПСВ можно определять у больных начиная с 5-летнего возраста. При определении ПСВ делается три попытки, записывается лучший показатель. Измеряют величину показателя утром и вечером каждого дня, а также оценивают его вариабельность – разницу между минимальным и максимальным значениями, полученными в течение дня, выраженную в процентах от максимальной величины за день и усредненную за 2 недели регулярных наблюдений. Для людей с бронхиальной астмой характерна повышенная вариабельность показателей ПСВ – более 20% при четырех измерениях в течение дня.
Показатель ПСВ используется преимущественно у людей с уже установленным диагнозом. Он помогает держать астму под контролем. В течение наблюдений определяют максимальный лучший показатель для данного больного. Если отмечается снижение до 50 – 75% от наилучшего результата – это говорит о развивающемся обострении и необходимости усилить интенсивность лечения. При снижении ПСВ до 33 – 50% от лучшего для пациента результата диагностируют тяжелое обострение, а при более значительном уменьшении показателя возникает угроза жизни больного.
Определяемый дважды в день показатель ПСВ нужно записывать в дневник, который приносят на каждый прием к врачу.
В некоторых случаях проводятся дополнительные инструментальные обследования. Рентгенография легких выполняется в таких ситуациях:
- наличие эмфиземы легких или пневмоторакса;
- вероятность воспаления легких;
- обострение, несущее угрозу жизни больного;
- неэффективность лечения;
- необходимость искусственной вентиляции легких;
- неясный диагноз.
У детей младше 5 лет используется компьютерная бронхофонография – метод исследования, основанный на оценке дыхательных шумов, и позволяющий выявить снижение бронхиальной проходимости.
При необходимости дифференциальной диагностики с другими заболеваниями выполняют бронхоскопию (осмотр бронхиального дерева с помощью эндоскопа при подозрении на рак бронхов, инородное тело дыхательных путей) и компьютерную томографию органов грудной клетки.
О том, как проводится исследование функции внешнего дыхания:
источник
Моноклональные антитела против IgE (Ксолар) – новый препарат для достижения контроля бронхиальной астмы. Отбор пациентов и особенности лечения
- КЛЮЧЕВЫЕ СЛОВА: Ксолар, бронхиальная астма, омализумаб, bronchial asthma, monoclonal IgG1 antibodies, omalizumab, Xolair
Омализумаб (препарат Ксолар) относится к принципиально новому классу препаратов, используемых в лечении пациентов с неконтролируемой бронхиальной астмой (БА) аллергической природы. Препарат представляет собой рекомбинантные гуманизированные моноклональные антитела, относящиеся к группе иммуноглобулинов (Ig) G1, которые избирательно связываются с циркулирующим IgЕ – важнейшим медиатором аллергических реакций у пациентов с атопической (аллергической) формой БА. IgG1-каппа-антитело содержит человеческую структурную основу с определяющим комплементарность участком мышиного исходного антитела, который связывается с IgE. Омализумаб связывается с IgE и предупреждает его связывание с Fc-эпсилон-R1-рецептором, имеющим высокое сродство к IgE, снижая таким образом количество свободного IgE, способного запустить аллергический каскад.
В июне 2003 г. омализумаб был одобрен Управлением по контролю качества пищевых продуктов и лекарственных препаратов США (US Food and Drug Administration, FDA) для лечения пациентов с аллергической астмой (IgE-опосредованной) среднетяжелого и тяжелого течения при невозможности достижения контроля ингаляционными глюкокортикостероидами (ИГКС) и комбинированными препаратами, содержащими ИГКС и ингаляционные длительно действующие бета-2-агонисты (ДДБА). Омализумаб является первым, наиболее изученным и до настоящего времени единственным препаратом этого класса в лечении пациентов с БА. Его применение разрешено у взрослых и детей с 6 лет во многих странах мира, в том числе и в России. В 2011 г. в России был расширен способ дозирования препарата: верхняя граница исходного уровня IgE у пациента была изменена со значения 700 МЕ/мл до 1300–1500 МЕ/мл. Теперь диапазон использования препарата (уровень IgE) варьирует от > 30 МЕ/мл до 1300–1500 МЕ/мл [1].
Внедрение Ксолара (омализумаба) в практику российского здравоохранения позволило назначать препарат в условиях реальной клинической практики. Применение инновационного препарата довольно остро ставит вопрос о показаниях к его назначению, прежде всего, при неконтролируемой БА. В последние два десятилетия в лечении БА наблюдается значительный прогресс, тем не менее достижение контроля заболевания остается актуальной проблемой. Внедрение современной высокоэффективной базисной терапии привело к существенному улучшению качества медицинской помощи. Однако, по данным целого ряда наблюдательных исследований, у подавляющего большинства пациентов симптомы тяжелой БА не контролируются. Так, в исследовании INSPIRE (International Asthma Patient Insight Research – Международное исследование отношения пациентов к бронхиальной астме), включившем 3415 пациентов с БА в 11 странах мира, как минимум треть пациентов с тяжелым течением БА не достигали контроля заболевания при использовании наиболее эффективного стандартного лечения комбинированными препаратами [2]. Несмотря на проводимое лечение, 74% пациентов вынуждены ежедневно использовать препараты скорой помощи (бета-2-агонисты короткого действия). Важно понимать, что неконтролируемое течение БА сопряжено с высоким риском обострения БА и даже летального исхода.
Возможность достижения контроля тяжелой атопической БА очень часто осложняется не только течением самой БА, но и наличием ассоциированных с атопией сопутствующих заболеваний: аллергического ринита, синуситов, дерматита, каждое из которых приносит большие страдания пациентам.
Основными триггерами, не позволяющими достигать контроля заболевания, являются аллергены. Установлена прямая корреляционная связь между уровнем IgE и риском развития БА. В опубликованных данных клинических исследований ENFUMOSA (European Network For Understanding Mechanisms Of Severe Asthma – Европейская сеть по изучению механизмов тяжелой астмы) [3] и TENOR (Epidemiology and Natural History of Asthma: Outcomes and Treatment Regimens – Эпидемиология и течение бронхиальной астмы: исходы и схемы терапии) [4, 5] аллергия к различным аэроаллергенам была выявлена более чем у 50% и 90% пациентов с БА соответственно.
Было показано, что у пациентов, умерших от тяжелого астматического приступа, плотность рецепторов к IgE в подслизистом слое бронхов достоверно выше по сравнению с пациентами, умершими от других причин [6–9].
Омализумаб связывается с IgE и предотвращает его взаимодействие с высокоаффинным Fc-эпсилон-R1-рецептором, при этом происходит снижение количества свободного IgE, который является пусковым фактором для каскада аллергических реакций. Ксолар подавляет как раннюю, так и поздние фазы астматического ответа у пациентов. Общий уровень IgE (связанного и несвязанного) в сыворотке крови повышался после первой дозы препарата вследствие образования комплекса «омализумаб – IgE», характеризующегося более медленной скоростью выведения по сравнению со свободным IgE. На 16-й неделе после введения первой дозы омализумаба средний уровень общего IgE в сыворотке был в 5 раз выше по сравнению с таковым до лечения. После отмены Ксолара обусловленное его действием увеличение общего IgE и уменьшение свободного IgE были обратимыми. После полного выведения препарата из организма не наблюдалось увеличения концентрации IgE в сыворотке крови. При применении в рекомендуемых дозах среднее уменьшение свободного IgE в сыворотке составляло более 96%.
Кроме того, было обнаружено, что у пациентов с атопической астмой при лечении омализумабом снижается уровень циркулирующих эозинофилов и их количество в мокроте, полученной в результате стимуляции бронхов. Было также показано, что терапия Ксоларом снижает количество эозинофилов в мокроте и количество Fc-эпсилон-R1+-клеток в верхних дыхательных путях больных с аллергической астмой [10] и достоверно снижает число эозинофилов в подслизистом слое бронхов [11]. В исследовании O. Noga и соавт. наблюдалось более значительное увеличение апоптоза эозинофилов (относительно исходного показателя) к 12-й неделе терапии в группе, принимавшей омализумаб, по сравнению с группой плацебо [12]. В исследовании E.L. van Rensen и соавт. отмечено значительно более выраженное снижение количества эозинофилов (относительно исходного уровня) к 12-й неделе в группе, принимавшей омализумаб, по сравнению с группой плацебо [13].
Таким образом, Ксолар можно рассматривать как препарат, обладающим антиаллергическим и противовоспалительным действием.
- Исследование INNOVATE продемонстрировало, что у пациентов с неконтролируемой тяжелой персистирующей атопической БА добавление Ксолара к лечению (IV ступень терапии согласно рекомендациям GINA) приводит к следующим результатам:
- сокращению числа клинически значимых обострений БА на 26%;
- сокращению числа тяжелых обострений на 50%;
- значительному (на 44%) снижению числа экстренных обращений за медицинской помощью (число госпитализаций, включая госпитализацию в реанимационные отделения, незапланированных визитов к врачу) по сравнению с плацебо.
В подгруппе пациентов, ответивших на лечение омализумабом, частота клинически значимых обострений БА за 28-недельный период лечения снизилась на 60,5% по сравнению с группой плацебо (0,34 против 0,85, p 1/100 ÷ > 1/10) были боль, отек, эритема и зуд в месте введения препарата, а также головные боли. Они развивались чаще всего в течение первого часа от момента введения и сохранялись до нескольких дней, однако их выраженность значительно снижалась с каждым последующим введением.
источник
У больных с аллергическими заболеваниями были обнаружены антитела к IgE [Williams et al., 1972]. При помощи более чувствительного радиоиммуноанализа антитела к IgE были найдены в очень низком титре у 20% аллергиков [Johansson et al., 1974]. Поскольку IgE присутствуют в очень малых количествах, они, возможно, не имеют клинического значения. Однако теоретические перспективы, связанные с существованием такого антиглобулина, весьма интересны.
Такие антитела могли бы реагировать с IgE на поверхности тучных клеток, особенно у лиц с атонией, и стимулировать выброс гистамина без участия обычных аллергеном.
Теперь необходимо обсудить доказательства того, что астматические реакции вызываются ответами типа I и типа III, и попытаться выяснить, в какой мере эти реакции могут объяснить разные типы астмы, с которыми сталкивается врач. Тип I и немедленные реакции при астме. Можно считать, что указания па астму типа I, опосредованную IgE, вполне убедительны, если больной рассказывает о том, что астма индуцируется неиосредствепно после контакта с определенным аллергеном, и если больной реагирует па этот аллерген, т. е.:
1) у него возникает немедленная реакция при уколочном тесте;
2) в сыворотке его содержится специфический IgE; 3) при бронхиальной провокации немедленно повышается сопротивление в дыхательных путях, которое можно заблокировать предварительным введением гликата натрия-хрома [Pepys et al., 1974] (известно, что этот медикамент блокирует выброс гистамина из тучных клеток).
Таким образом, на первый взгляд связь между иммунным ответом типа I и клинически выраженной астмой представляется вполне доказанной. Однако ряд проблем остается неясным и, быть может, не следует слишком легко экстраполировать результаты бронхиальных провокационных тестов, которые ставятся в контролируемых условиях, на клиническую астму, наблюдаемую врачом. Известно, что самая тяжелая астма продолжается несколько дней, а не какое-то время меньше часа, даже если больные, видимо, и не имеют контакта со специфическим антигеном.
Известно также, что именно такие больные часто нуждаются в кортикостероидах для облегчения симптомов. Вместе с тем мы знаем, что кортикостероиды не действуют на реакцию типа I как в коже, так и при провокации путем введения в бронхи. Далее, гликат хрома который, как предполагается, блокирует высвобождение фармакологических медиаторов из тучных клеток, часто не помогает больным, после того как у них развилась тяжелая астма. Если допустить, что более длительные приступы астмы зависят от механизмов, не связанных с ответами типа I, то можно ли считать, что существующие доказательства убедительно свидетельствуют о реакциях типа I в большинстве случаев кратковременных приступов астмы, т. е. продолжительностью менее 1 ч?
Почти без сомнения многие кратковременные приступы могут быть объяснены неиммунологическими пусковыми факторами. Так, например, кратковременные приступы могут быть вызваны просто нервными рефлексами. Если к примеру, на протяжении суток часто измерять сопротивление в дыхательных путях, то у многих больных можно выявить быстрые колебания обратимой обструкции дыхательных путей, видимо, без всякой связи с антигенным контактом. Скорее эти быстрые изменения, происходящие в дыхательных путях, связаны с лабильностью бронхов и обусловлены неврологически или фармакологически.
Таким образом, если при некоторых формах астмы имеются убедительные указания на реакцию типа I, то надо полагать, что не все немедленные реакции зависят от этого механизма.
Изучая клинические формы тяжелой астмы, даже если они, видимо, вызываются широко распространенным аллергеном, можно прийти к выводу, что если реакция типа I служит пусковым механизмом, то дальнейшую более длительную астму, которая значительно чаще встречается в клинической практике, приходится объяснять другими факторами, не зависящими от этого иммунологического события. В поисках других объяснений длительной астмы необходимо обратиться как к другим типам иммунологических тканевых ответов, так и к другим реакциям, вызываемым фармакологическими и неврологическими факторами.
источник
В настоящее время назначение антител к IgE (омализумаб, ксолар) показано больным тяжелой аллергической БА (с повышенным уровнем IgE в сыворотке крови), контроль над которой не достигнут применением ГКС. Препарат выпускается в виде лиофилизата по 150 мг во флаконе, вводится подкожно. Дозу Ксолара и частоту введения препарата определяют на основании исходной концентрации IgE (МЕ/мл), измеренной до начала лечения, а также массы тела пациента (кг). В зависимости от этих показателей рекомендуемая доза препарата составляет от 150 до 375 мг 1 раз в 2 или 4 недели. Ксолар не следует назначать пациентам, у которых исходный уровень IgE или масса тела находятся вне диапазона значений в таблице по дозированию. Оценку эффективности терапии проводят не ранее 12 недель лечения препаратом.Ксолар предназначен для длительной терапии и его отмена как правило, приводит к возврату повышенного уровня свободного IgE и развитию соответствующих симптомов.
Препарат не следует применять для лечения острых приступов БА, острого бронхоспазма или астматического статуса. Следует с осторожностью применять препарат у больных с нарушениями функции печени и/или почек При применении ксолара, как и при использовании любых других протеинсодержащих препаратов, могут возникать местные или системные аллергические реакции, включая анафилактические. Поэтому перед введением необходимо заранее приготовить соответствующее реанимационное оборудование и лекарственные средства, необходимые для купирования реакций гиперчувствительности. Следует проинформировать пациентов о возможности развития анафилактических реакций и обеспечить соответствующее медицинское наблюдение за больными.
8.2. Принципы поддерживающей терапии (табл. 23)
Лечение подразделяется на 5 шагов (ступеней), в зависимости от объема терапии, необходимого для достижения контроля над БА. Начиная со 2-й ступени используются различные схемы поддерживающей терапии. На каждой последующей ступени объем терапии (количество препаратов и/или дозы) увеличивается.
У больных с персистирующими симптомами астмы, ранее не получавших базисной терапии, лечение следует начинать со 2 ступени, а при выраженных симптомах (при неконтролируемой астме) – с 3 ступени.
Препараты для поддерживающей терапии обеспечивают улучшение состояния уже в первые дни лечения, однако полный эффект можно увидеть только спустя 3-4 месяца. Если проводимое лечение в течение 3-4 месяцев не обеспечивает достижения контроля над астмой, объём терапии увеличивают в соответствие со следующей ступенью терапии (step-up). При тяжелом течении БА и длительной неадекватной предшествующей терапии этот период может быть более длительным — до 6-12 месяцев.
После достижения контроля над астмой возможно уменьшение объема терапии (step-down) для достижения минимального объема терапии, позволяющего сохранить контроль над БА. Уменьшение объема терапии можно начинать только в том случае, если контроль над астмой у пациента достигнут и поддерживается не менее 3 месяцев. Всем пациентам следует подбирать минимальные поддерживающие дозы препаратов путем ступенчатого снижения доз и длительного наблюдения.
Уменьшение объема терапии после достижения контроля рекомендуется проводить следующим образом:
• Если контроль достигнут на фоне монотерапии ИГКС в средних или высоких дозах, следует предпринять снижение дозы препарата на 50% с трехмесячными интервалами.
• Если контроль достигнут на фоне терапии низкими дозами ИГКС, у большинства пациентов возможен переход на однократный прием препаратов.
• Если контроль достигнут на фоне терапии комбинацией ИГКС и ДДБА, предпочтительно начинать уменьшение объема терапии со снижения дозы ИГКС примерно на 50% при продолжении терапии ДДБА.
• Если контроль над БА сохранится, следует продолжить снижение дозы ГКС до низкой, на фоне которой возможно прекращение терапии b2-агонистом длительного действия.
Дата добавления: 2015-11-02 | Просмотры: 732 | Нарушение авторских прав
источник
Иммуноглобулин Е – это особый тип белков, которые вырабатывают лимфоциты группы В. Антитела При помощи специальных рецепторов крепятся к поверхности тучных клеток и базофилов – клеток, в которых происходит синтез биологически активных веществ во время развития аллергической реакции немедленного типа. При исследовании крови выделяют иммуноглобулин общий (норма зависит от возраста пациента) и специфический, связанный с определённым видом аллергена, иммуноглобулин Е. В Юсуповской больнице созданы все условия для лечения пациентов, у которых повышен или понижен уровень иммуноглобулина Е.
В клинике терапии работают профессора и врачи высшей категории, являющиеся ведущими иммунологами Москвы. Лаборанты используют для исследования качественные реагенты и современные методики анализа, позволяющие получить точные результаты. Все сложные случаи заболеваний, при которых имеются отклонения концентрации иммуноглобулина Е в сыворотке крови, обсуждаются на заседании экспертного совета. Врачи принимают коллегиальное решение о дальнейшей тактике лечения пациентов.
Тест на общий иммуноглобулин E – это определение суммарной концентрации защитных белков в сыворотке крови. Анализ крови на иммуноглобулин Е врачи Юсуповской больницы назначают при атопических заболеваниях: бронхиальной астме, атопическом дерматите, крапивнице. Иммуноглобулин Е отвечает за иммунный ответ на проникновение в организм паразитов – аскарид, трихинеллы, токсоплазмы.
Иммунологи Юсуповской больницы назначают анализ крови на иммуноглобулин Е при выявлении у пациента кожного зуда, высыпаний на коже, покраснения, появившегося за сутки.
Уровень иммуноглобулина Е определяют при наличии следующих заболеваний:
Исследование уровня иммуноглобулина Е проводят для оценки риска развития аллергии у детей, изучения и оценки состояния иммунной системы в целом, диагностики глистных инвазий. Результаты анализа необходимы для дифференциальной диагностики всех аллергических реакций, имеющих сходную симптоматику. Их учитывают при индивидуальном подборе тактики лечения легочного аспергиллёза (заболевания, вызванного плесневелым грибом рода Аспергилез).
Иммунологи Юсуповской больницы с помощью анализа иммуноглобулина Е проводят мониторинг эффективности лечения аллергических заболеваний. Исследование необходимо для диагностики отдельных состояний, связанных с иммунодефицитом, определения типа и степени сенсибилизации к конкретному аллергену.
У взрослых концентрация общего иммуноглобулина Е в плазме крови очень маленькая. После 18 лет нормальным считается уровень иммуноглобулина Е находится в пределах 0- 100 МЕ/мл крови. Концентрация иммуноглобулина Е меняется в зависимости от времени года. В мае, когда цветут растения, она максимальная, и может достигать 250 МЕ/мл крови. Это не является признаком патологии. В декабре у большинства людей уровень иммуноглобулинов Е минимальный.
Норма общего иммуноглобулина E у детей динамично изменяется с возрастом и отличается от показателей взрослого человека. У детей до года концентрация иммуноглобулина в норме не превышает 29 МЕ/мл, возрасте от 1 до 2 лет – 45 МЕ/мл, от 3 до 9 лет – 53 МЕ/мл и от 9 до 15 лет находится в диапазоне 0-200 МЕ/мл.
Начиная с первого дня жизни ребёнка и до пятнадцатилетнего возраста уровень иммуноглобулина E постепенно возрастает. Ближе периоду половому созреванию нормальные значения устанавливаются окончательно и с годами не меняются. Уменьшение количества антител класса Е у лиц пожилого возраста является нормой.
При проникновении в организм аллергенов на них вырабатываются антитела, что приводит к повышению уровня иммуноглобулинов Е. Высокая концентрация иммуноглобулинов Е в сыворотке крови может говорить об атопических заболеваниях (дерматите, бронхиальной астме, рините, аллергической гастроэнтеропатии). Резкое повышение уровня иммуноглобулинов Е наблюдается при анафилактических заболеваниях – крапивнице (ангионевротическом отёке) и анафилаксии системного характера. Аллергии могут провоцировать следующие факторы:
- пыль;
- чужеродный белок;
- продукты питания;
- пыльца растений;
- лекарственные препараты;
- вещества химического происхождения;
- производные металлов.
В связи с этим при наличии повышенного уровня иммуноглобулинов Е иммунологи Юсуповской больницы проводят тесты с более чем шестьюстами аллергенами.
Превышение нормы общего иммуноглобулина Е возможно и по причине дефектов Т-лимфоцитов, которые отвечают за силу и продолжительность иммунного ответа. В таком случае высокий уровень иммуноглобулина Е может быть свидетельством следующих заболеваний:
- гипериммуноглобулинемии;
- тимусной аплазии;
- дефицита селективного белка IgА;
- врождённого иммунодефицита (экземы, тромбоцитопении);
- миеломы IgE.
Ещё одной причиной повышенного количества суммарных иммуноглобулинов является конфликт клеток хозяина и донора после трансплантации тканей. В таком случае пересаженные клетки воспринимают новый организм в качестве угрожающего фактора и атакуют его.
При бронхиальной астме уровень иммуноглобулинов Е может находиться в диапазоне от 120 до 1200 МЕ/мл, при аллергическом рините – от 120 до 100 МЕ/мл, у пациентов, страдающих иммуноглобулией – 1000- 1400 МЕ/мл. При IgE-миеломе концентрация иммуноглобулинов Е превышает 15000 МЕ/мл, при атопическом дерматите находится в пределах 80-14000 МЕ/мл.
Для того чтобы результаты исследования были достоверными, кровь из вены сдают натощак. Пациенту следует правильно подготовиться:
- не употреблять напитки и пищу до забора биологического материала (можно пить только негазированную воду);
- за 2–3 дня до сдачи анализа крови избегать эмоционального и физического и переутомления;
- за 48 часов до сдачи крови важно не употреблять жаренную, жирную, солёную и острую пищу, исключить спиртные напитки;
- в течение 24 часов, предшествующих исследованию, не курить.
Перед забором материала важно не употреблять любые медикаменты на протяжении 14 дней. Нельзя сдавать кровь на иммуноглобулины в тот день, когда были проведены физиотерапевтические процедуры, рентгенологическое или ультразвуковое исследование.
В настоящее время не существует препаратов, непосредственно понижающих концентрацию иммуноглобулина Е в крови. В основе понижения уровня сывороточного иммуноглобулина лежит устранение аллергена, который вызвал негативную реакцию со стороны иммунной системы. После установления точного диагноза иммунологи Юсуповской больницы назначают медикаментозную терапию.
Она включает антигистаминные лекарства. Противоаллергические препараты подавляют работу тех рецепторов, которые реагируют на непосредственный аллерген. Способствуют устранению внешних симптомов заболевания мази и крема для ухода за кожей.
Пациентам с иммуноглобулинзависимой аллергией повышают иммунитет посредством постепенного увеличения доз аллергенов, которые вводят в организм. Это позволяет добиться длительного затишья аллергических проявлений. При наличии в организме паразитов назначают антигельминтные средства.
Запишитесь на приём к иммунологу, позвонив по телефону клиники. Контакт-центр Юсуповской больницы работает круглосуточно 7 дней в неделю. Врач после осмотра назначит анализ крови на содержание иммуноглобулинов Е, проведёт тесты с аллергенами, установит точный диагноз и назначит лечение.
источник
Первый опыт применения моноклональных антител против иммуноглобулина е у детей с бронхиальной астмой Текст научной статьи по специальности « Медицина и здравоохранение»
Похожие темы научных работ по медицине и здравоохранению , автор научной работы — Галустян А.Н., Пешехонова Ю.В., Желенина Л.А., Графская И.И., Сардарян И.С.,
Текст научной работы на тему «Первый опыт применения моноклональных антител против иммуноглобулина е у детей с бронхиальной астмой»
Первый опыт применения моноклональных антител против иммуноглобулина Е у детей с бронхиальной астмой
А.Н. Галустян, Ю.В. Пешехонова, Л.А. Желенина, И.И. Графская, И.С. Сардарян
Бронхиальная астма (БА) — актуальная проблема педиатрии и клинической медицины в целом. Заболевание, начавшись у ребенка, часто продолжается в зрелом возрасте, приводит к снижению качества жизни, может явиться причиной инвалидизации, а иногда и гибели пациента.
Важную роль в возникновении БА играет наследственность, причем БА относится к числу типичных заболеваний мультифакториальной, полигенной природы [1]. Среди генетических факторов, влияющих на формирование и течение БА, можно выделить “главные” гены и гены-модификаторы, гены-кандидаты, взаимодействие которых определяет фенотипические особенности БА. В многочисленных исследованиях показано, что главными факторами в развитии БА являются атопия — предрасположенность к синтезу иммуноглобулина класса Е (1дЕ) — и гиперреактивность дыхательных путей, причем доказана корреляция между уровнем общего 1дЕ и риском развития БА у взрослых [2].
По данным клинико-генетических исследований у детей с атопической БА можно выделить два фенотипических варианта заболевания: БА вне структуры атопической болезни, где роль атопии менее значима, и БА в структуре атопической болезни, где атопия играет ведущую роль [3]. Для подавляющего большинства детей, у которых БА протекает в структуре атопической болезни, характерны высокие уровни общего 1дЕ в плазме (>200 МЕ/мл), более ранний дебют заболевания в рамках “атопического марша”, наличие сопутствующей аллергической патологии, в том числе атопического дерматита. При данном фенотипическом варианте БА чаще наблюдается отягощенная наследственность по материнской линии по аллергическим заболеваниям и поливалентная сенсибилизация. Для БА в структуре атопической болезни роль генов-модификаторов (глутатион-Э-трансфераз, ангиотензинпревра-
Кафедра аллергологии и клинической фармакологии ФПК и ПП Санкт-Петербургской государственной педиатрической медицинской академии Минздравсоцразви-тия России.
А.Н. Галустян, Ю.В. Пешехонова, Л.А. Желенина, И.И. Графская, И.С. Сардарян.
щающего фермента, эндотелиальной синтазы оксида азота) менее значима, чем для БА вне структуры атопической болезни, а ведущую роль играют “главные” гены, ответственные за реагиновый механизм иммунологического ответа. Подтверждением этому является высокий уровень IgE у 88% больных этой группы, тогда как при БА вне структуры атопической болезни высокий уровень IgE наблюдается у 35% детей. Среди детей, у которых БА протекает в структуре атопической болезни, преобладают больные тяжелой и среднетяжелой персистирующей БА и чаще отмечается неконтролируемое или частично контролируемое течение БА [3].
Haselkorn T. et al. приводят данные о том, что 93,5% больных с тяжелой и плохо поддающейся лечению БА имеют положительные кожные пробы на наиболее распространенные аэроаллергены [4]. По данным Novak N., Bieber T. около 2/3 всех случаев БА предположительно имеют аллергическую природу [5]. Мнение о том, что с возрастом заболеваемость атопическими заболеваниями снижается, в настоящее время пересматривается. По мнению Law M. et al. разница в заболеваемости между младшими и старшими поколениями определяется тем, что вероятность развития атопии у представителей старших поколений в целом ниже, чем у молодых [6].
Атопические реакции относятся к I типу аллергических реакций — реакциям немедленного типа, где ключевую роль играют IgE. Концентрация IgE в сыворотке ниже в сравнении с IgG примерно в 4000 раз, но она возрастает при контакте с аллергеном. Молекулы IgE способны фиксироваться на поверхности тучных клеток, базофилов и дендритных клеток, связываясь с высокоаффинными рецепторами FceRI, расположенными на этих клетках. После связывания с аллергеном IgE стимулирует ряд патохимических реакций, завершающихся выбросом медиаторов воспаления, в том числе гистамина, простагландинов, лей-котриенов и цитокинов. IgE-зависимый выброс медиаторов лежит в основе реакций ранней и поздней фаз аллергического ответа. Реакции поздней фазы при БА обусловлены увеличением синтеза интерлейкинов 4 и 13 и притоком эозинофилов в очаг воспаления, что приводит к
дальнейшему выбросу медиаторов, персистированию воспаления в дыхательных путях и усилению обструкции.
У пациентов с тяжелым течением БА повышена экспрессия рецепторов РоеЯ! [7]. Воспалительный каскад, занимающий центральное место в развитии аллергической реакции, предоставляет несколько потенциальных мишеней для терапевтического воздействия. !дЕ является центральным звеном аллергического каскада и наиболее привлекательной мишенью, поскольку прерывание цепи реакций в этой точке может остановить воспалительную реакцию в самом начале ее развития — на стадии иммунологического ответа, предотвратив реакции патохимической и патофизиологической стадий.
В течение многих лет терапевтические возможности воздействовать на иммунологическую стадию аллергической реакции ограничивались элиминационными мероприятиями и проведением аллергенспецифической иммунотерапии. Разработка моноклональных гуманизированных антител против иммуноглобулина Е (анти-!дЕ терапии) стала большим достижением и открыла новые возможности для лечения больных с частично контролируемой и неконтролируемой БА. Препарат омализумаб (Ксолар) был создан на основе человеческого !д01, в который был имплантирован участок мышиного анти-!дЕ антитела, определяющий комплементарность. Процесс гуманизации гарантирует наличие в составе молекулы омализумаба не более 5% аминокислот мышиного происхождения, что минимизирует вероятность иммунного ответа.
Омализумаб связывается с Се3 участком свободной молекулы !дЕ, препятствуя связыванию !дЕ с рецепторами тучных клеток и базофилов, и таким образом предотвращает дегрануляцию тучных клеток при поступлении аллергена в организм. При связывании с !дЕ омализумаб формирует небольшие, биологически инертные комплексы, не связывающие комплемент, — тримеры и гексамеры, что снижает вероятность синтеза антител к данным комплексам. Омализумаб не взаимодействует с молекулами !дЕ, уже связанными с рецепторами тучных клеток.
Ксолар используют в качестве базисной терапии БА как один из препаратов, направленных на предотвращение или уменьшение воспаления в дыхательных путях. В результате лечения омализумабом сокращается количество рецепторов РоеЯ! на поверхности базофилов [8], значительно уменьшается количество клеток, несущих РоеЯ!, и число эозинофилов в подслизистом слое бронхов по сравнению с исходным уровнем и группой плацебо (р i Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
кокортикостероидов. Согласно приказам Минздравсоц-развития РФ № 812 от 28.12.2007 г. “О государственном задании на оказание высокотехнологичной медицинской помощи гражданам Российской Федерации за счет средств федерального бюджета в 2008 году” и № 786н от 29.12.2008 г. “О порядке формирования и утверждении государственного задания на оказание в 2009 году высокотехнологичной медицинской помощи гражданам Российской Федерации за счет ассигнований федерального бюджета” к высокотехнологичной медицинской помощи по профилю “Педиатрия” была отнесена поликомпонентная терапия с использованием иммунобиологических препаратов при тяжелой форме бронхиальной астмы в сочетании с другими аллергическими болезнями, резистентными к терапии. Включение тяжелой формы БА, резистентной к стандартной терапии, в перечень видов высокотехнологичной медицинской помощи позволило значительно улучшить эффективность терапии БА и качество жизни детей.
В нашей клинике в рамках высокотехнологичной медицинской помощи с июня 2008 г. по август 2009 г. Ксолар получали 9 детей (6 мальчиков и 3 девочки) в возрасте от 12 до 16 лет (средний возраст 14 лет). Пациенты были госпитализированы в плановом порядке для обследования и подбора базисной терапии. До этого все дети находились на диспансерном наблюдении у аллерголога в течение 2-11 лет с диагнозом: бронхиальная астма атопическая, тяжелое пер-систирующее течение. Диагноз был установлен на основании международных критериев диагностики БА [12].
У всех детей анамнестически и клинически отмечалась сенсибилизация к бытовым аллергенам, подтвержденная скарификационными кожными пробами или иммунологическим обследованием (специфические !дЕ), у 7 (78%) имелась также пыльцевая и пищевая аллергия. Наследственность по аллергическим заболеваниям была отягощена по материнской линии у 7 (78%), по отцовской — у 3 (33%). У большинства детей синдром бронхиальной обструкции впервые возник в возрасте 1-3 лет, а диагноз БА был установлен в возрасте 3-9 лет (в среднем в 5,5 лет). Период времени от первого эпизода бронхиальной обструкции до установления диагноза БА составлял от 1,5 до 5 лет, что свидетельствует о поздней диагностике БА и позднем начале базисной терапии.
Атопический дерматит отмечался у 5 детей (56%), аллергический ринит и/или конъюнктивит — также у 5 пациентов. Уровень общего !дЕ у 7 пациентов (77,8%) превышал 200 МЕ/мл, составляя от 70 до 487 МЕ/мл (в среднем 312 МЕ/мл). Таким образом, большинство детей можно отнести к фенотипическому варианту БА в структуре атопической болезни, где значительную роль играют !дЕ-зависи-мые механизмы.
Все пациенты в качестве базисной терапии получали в течение нескольких лет ингаляционные глюкокортикостероиды, на ранних этапах как монотерапию, а затем в комбинации с пролонгированными р2-агонистами — преимущественно флутиказон/салметерол 50/500 мкг/сут или
будесонид/формотерол 18/640 мкг/сут. Для купирования симптомов использовался сальбутамол (2-5 раз в неделю). У всех больных отмечались частые обострения БА, у одной пациентки — ежегодные тяжелые, плохо купируемые обострения в осенний период.
Ксолар вводился строго в соответствии с инструкцией по применению, состояние детей контролировали при регулярном клинико-лабораторном и функциональном обследовании. Доза препарата рассчитывалась в зависимости от массы тела и уровня общего !дЕ в плазме. Все пациенты получали Ксолар в дозе 300 мг, кратность введения -1 раз в 4 нед. В зависимости от сроков начала терапии детям было проведено от 1 до 11 инъекций, причем пяти пациентам — 6 инъекций и более. Серьезных нежелательных реакций на введение Ксолара не наблюдалось, лишь у трех пациентов отмечалась боль в месте инъекции, которая прошла самостоятельно. При последующем наблюдении других нежелательных реакций не выявлено.
В результате лечения была достигнута положительная динамика в виде улучшения контроля БА. У всех пациентов уменьшилось количество обострений и потребность в сальбутамоле. У пациентки, получившей 11 инъекций, осенний период прошел без обострений БА, к 10-й инъекции были отменены ингаляционные глюкокортикостероиды. У пациента с частыми затяжными обострениями БА, у которого присутствовали ранние и поздние реакции, после 10 инъекций отмечено значительное снижение частоты обострений и сокращение их длительности. У третьего больного, которому проведено 9 инъекций Ксолара, отмечается отсутствие обострений, доза серетида снижена вдвое. У остальных детей, получивших до 6 инъекций, также отмечалось снижение частоты обострений и уменьшение потребности в сальбутамоле без изменения исходной базисной терапии.
Таким образом, исходя из нашего первого опыта по использованию омализумаба (Ксолара) в качестве дополнительной базисной терапии у детей, страдающих тяжелой
атопической БА, можно сделать вывод о высокой эффективности и хорошей переносимости этого препарата. Раннее назначение омализумаба при тяжелой атопической БА может быть особенно эффективным у детей с учетом превалирования атопических механизмов в детском возрасте и отсутствия процессов ремоделирования дыхательных путей, более характерных для взрослых больных. Назначение и первые введения Ксолара могли бы проводиться в специализированных стационарах в рамках высокотехнологичной медицинской помощи за счет средств федерального бюджета, а продолжение терапии возможно в районных аллергокабинетах по месту жительства пациента благодаря простоте его введения. Необходимо отметить, что назначение и режим введения Ксолара должны строго соответствовать показаниям и инструкции по применению, чтобы минимизировать риск нежелательных явлений и повысить эффективность терапии. Наличие омализумаба (Ксолара) в списке дополнительного лекарственного обеспечения значительно облегчит амбулаторный этап терапии.
1. Пузырев В.П. // Мед. генетика. 2003. Т. 2. № 12. С. 498.
2. Burrows B. et al. // N. Engl. J. Med. 1989. V. 320. P 271.
3. Сардарян И.С. Фенотипические особенности бронхиальной астмы у детей при различных аллельных полиморфизмах генов “предрасположенности” (GSTT1, GSTM1, ACE, eNOS): Ав-тореф. дис. . канд. мед. наук. СПб., 2009.
4. Haselkorn T. et al. // J. Asthma. 2006. V. 43. P. 745.
5. Novak N., Bieber T. // J. Allergy Clin. Immunol. 2003. V. 112. P 252.
6. Law M. et al. // Br. Med. J. 2005. V. 330. P 1187.
7. Fregonese L. et al. // Amer. J. Respir. Crit. Care Med. 2004. V. 169. P. A297.
8. MacGlashan D.W. Jr. et al. // J. Immunol. 1997. V. 158. P 1438.
9. Djukanovic R. et al. // Amer. J. Respir. Crit. Care Med. 2004. V. 170. P. 583.
10. van Rensen E.L. et al. // Allergy. 2009. V. 64. P 72.
11. Емельянов А.В. // Вопросы современной педиатрии. 2008. Т. 7. № 5. С. 87.
12. Глобальная стратегия лечения и профилактики бронхиальной астмы (пересмотр 2006 г.) / Под ред. Чучалина А.Г. М., 2007.
источник