А.Н. Цой 1 , В.В. Архипов 1 , А.Г. Чучалин 2
1 — ММА им. И.М. Сеченова, г. Москва
2 — НИИ Пульмонологии МЗ РФ, г. Москва
Выбор источников достоверной информации имеет решающее значение для эффективной медицинской деятельности на всех ее уровнях. Качество имеющейся в распоряжении специалиста информации особенно важно при принятии решения относительно каждого конкретного клинического случая, при создании медицинских стандартов и формуляров, а также общем планировании деятельности здравоохранения [12]. Предложенная в начале 90-х гг. концепция доказательной медицины подразумевает добросовестное, точное и осмысленное использование лучших результатов клинических исследований для выбора лечения конкретного больного [2]. Подобный подход позволяет уменьшить уровень врачебных ошибок, облегчить процесс принятия решения для практических врачей, администрации лечебных учреждений и юристов, а также снизить расходы на здравоохранение и претворять в жизнь крупные социально-ориентированные медицинские проекты и инициативы [2].
Прошло почти 10 лет после появления первого международного руководства по диагностике и лечению бронхиальной астмы (БА) [I]. Российские врачи уже в 1996 г. имели возможность познакомиться с этим документом и применять его в своей практике. Имеется опыт создания аналогичных стандартов по лечению БА, ориентированных на отечественные условия и особенности системы здравоохранения в нашей стране [4]. Можно констатировать, что работа с подобными руководствами заставляет нас во многом пересмотреть вопросы обучения и самообразования практических специалистов, стимулирует отказ от рутинных и недостаточно эффективных методов диагностики и лечения и, в конечном счете, повышает уровень медицинской помощи больным БА.
Стандарты и протоколы по клинической практике предназначены, главным образом, для врачей широкого профиля (терапевты поликлиник и стационаров, врачи скорой помощи) и посвящены наиболее общим вопросам диагностики и лечения. Поэтому для этих руководств характерны строго ограниченный объем теоретических сведений и отсутствие описаний редких форм заболевания и новых экспериментальных методов лечения. Но благодаря этому они выполняют свою основную функцию — предоставляют врачам необходимую и точную информацию, позволяют оптимизировать лечебный процесс и обеспечить одинаково высокое качество медицинской помощи в любом из лечебных учреждений.
Первые руководства по клинической практике [1,3] строились по принципу консенсуса группы специалистов, однако в наши дни этого подхода явно недостаточно. Современный врач нуждается в строго взвешенных рекомендациях, основанных на данных наиболее качественно выполненных клинических исследований. Поэтому применение методов доказательной медицины, и в частности рейтинговой системы рекомендаций, на наш взгляд, более перспективно при подготовке будущих руководств по клинической практике и в дальнейшем обещает стать стандартом при подготовке подобных документов.
Цель настоящего обзора — ознакомить практических врачей с результатами использования концепции доказательной медицины на примере рекомендаций по лечению больных БА. При этом обоснование каждой из рекомендаций проводится с учетом уровня доказательности в соответствии с системой, принятой в доказательной медицине.
Уровень доказательности. Удобным механизмом, который позволяет каждому специалисту легко оценить качество каждого клинического исследования и достоверность полученных данных, является предложенная в начале 90-х гг. рейтинговая система оценки клинических исследований. Для непосредственной оценки исследования используются понятия — уровень доказательности. Обычно выделяют от 3 до 7 уровней доказательности [19], при этом с возрастанием порядкового номера уровня (обозначается латинскими числами) качество клинического исследования снижается, а результаты представляются менее достоверными или имеют только ориентировочное значение [II].
К I уровню в доказательной медицине принято относить хорошо разработанные, крупные, рандомизированные, двойные слепые, плацебоконтролируемые исследования. К этому же уровню доказательности принято относить данные, полученные в ходе мета-анализа нескольких рандомизированных, контролируемых исследований [2].
Небольшие рандомизированные и контролируемые исследования (в том случае, когда получить статистически корректные результаты, не удалось из-за малого числа больных, включенных в исследование) относят ко II уровню доказательности, а исследования «случай-контроль» или когортные исследования — к II или III уровню. Наконец, данные, содержащиеся в отчетах экспертных групп или консенсусах специалистов, принято относить к III или IV уровню [2].
В зависимости от мнения составителей (национальные общества доказательной медицины, общества специалистов) одно и то же исследование в различных рейтингах может относиться к разным уровням, однако общий порядок распределения исследований — практически везде одинаков. Так, в каждом из этих рейтингов первое место принадлежит крупным, рандомизированным, двойным слепым, плацебоконтролируемым исследованиям (как наиболее достоверным источникам информации), а завершается каждый рейтинг мнениями отдельных специалистов и данными крупных руководств по клинической практике.
В системе доказательной медицины отдельные практические рекомендации по диагностике и лечению различных заболеваний также имеют свой рейтинг — степень убедительности рекомендаций (обозначаются латинскими буквами). Система рейтинга рекомендаций в англоязычной литературе обозначается как сила рекомендаций (Strength of recommendation). При этом рекомендации, вытекающие из исследований I уровня, обозначаются как А, II уровня — В и т.д. Кроме того, к рекомендациям В относятся экстраполяции из исследований I категории доказательности, а рекомендации С строятся как на основании исследований III уровня доказательности, так и на экстраполяции данных исследований I и II уровня. Таким образом, рекомендации уровня А представляются вполне убедительными, так как опираются на веские доказательства, у рекомендаций уровня В — убедительность относительная, а для рекомендаций уровня С имеющихся доказательств недостаточно, но и эти рекомендации могут использоваться с учетом определенных обстоятельств. Положения, относимые к уровню D и Е, представляются доказанными недостаточно [2, II].
В настоящем обзоре была принята система оценки клинических исследований Canadian asthma consensus report (1999) [8]. При присвоении отдельным рекомендациям того или иного рейтингового уровня авторы опирались на мнение экспертов Великобритании и Канады [7, 18, 25].
Рекомендации по диагностике, оценке состояния больных и лечению бронхиальной астмы
Общие принципы лечения бронхиальной астмы в амбулаторных условиях
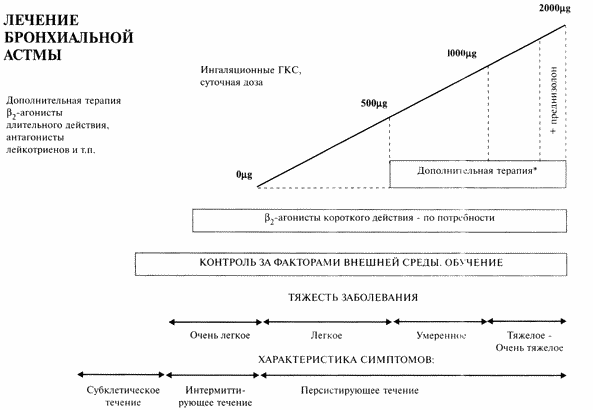
Бронхиальная астма характеризуется значительной вариабельностью тяжести течения. Поэтому для терапии бронхиальной астмы в конце 80-х гг. был предложен ступенчатый терапевтический подход, согласно которому каждой степени тяжести течения заболевания соответствует определенная схема лечения (рис. 1) [I].
Ступенчатый подход к лечению бронхиальной астмы
Первоначально было принято выделять четыре степени тяжести бронхиальной астмы (рис. 2) [ 1, 3]. Впоследствии показалось рациональным выделить группу больных с «очень тяжелым течением БА», т.е. тех, у кого адекватный контроль достигается только при применении пероральных глюкокортикостероидов (ГКС) [8]. К этой категории относят также пациентов с так называемой «трудной /тяжелой/ астмой» (аспириновый вариант астмы, ГКС-зависимая и ГКС-резистентная астма, лабильная астма) [10].
Общий алгоритм лечебного подхода к бронхиальной астме приведен на рис. 2. Он включает диагностический этап, выбор схемы первоначального лечения, подбор долговременной терапии заболевания и последующее наблюдение за больным. Так как бронхиальная астма является хроническим воспалительным заболеванием дыхательных путей [I], эффективность терапии оценивается не как полное излечение, а как адекватный контроль за течением заболевания, предотвращающий обострения ( табл. 1) [8]. Рис. 2
Алгоритм лечения бронхиальной астмы
Диагностика и клиническая оценка бронхиальной астмы
Для подтверждения диагноза бронхиальной астмы и оценки тяжести состояния у всех больных с явлениями бронхообструктивного синдрома следует проводить исследование функции внешнего дыхания (С) [25]. К диагностическим критериям, специфичным для бронхиальной астмы, относятся (D) [1, 3]:
- — увеличение ОФВ1, >12% (предпочтительнее >15%, -т.е. примерно 180 мл) через 15 мин после ингаляции бета2-агониста;
- — увеличение ОФВ1 >20% (около 250 мл) после 10-14 дней лечения преднизолоном;
- — значимая спонтанная вариабельность ОФВ1.
При оценке ОФВ1, и ПСВ следует ориентироваться на среднестатистические нормы для данной популяции, а в идеале — на индивидуальный лучший показатель данного больного, измеренный в период стабильного состояния (С) [З].
Когда проведение спирометрии или бронхопрово-кационного теста недоступны, можно оценить вариа-бельный характер бронхообструкции (> 20%) при многодневном измерении ПСВ в домашних условиях, что также может указывать на наличие бронхиальной астмы (В) [8].
Для установления диагноза бронхиальной астмы используют бронхопровокационный тест с метахолином (С) [8].
Бронхиальная астма и факторы внешней среды
В целом, тяжесть симптомов астмы коррелирует со степенью чувствительности больного к аллергенам [I], хотя у целого ряда пациентов аллергия не играет ведущей роли в течении заболевания. Следует помнить, что увеличение объема медикаментозной терапии не должно заменять предотвращение контактна больного с аллергенами и ирритантами (С) [I].
Больным астмой также следует избегать контакта с табачным дымом (С) [1] и строго воздерживаться от курения (В) [25].
Больным с астмой следует избегать высокой концентрации ирритантов во вдыхаемом воздухе (С) [8], но до сих пор не имеется достаточных данных об эффективности применения для этих целей увлажнителей и других средств очистки воздуха (С) [8].
Все взрослые больные с первично возникшей астмой должны проходить обследования для исключения профессионального характера заболевания (В) [5, 8].
Мониторинг и обучение больных бронхиальной астмой.
Обучение пациентов является обязательным компонентом лечения астмы (А) [З]. Целью обучения является контроль за течением заболевания и выбор правильного поведения больного в различных ситуациях, связанных с заболеванием. Программа обучения не должна строиться только на ознакомлении больных с соответствующей литературой (А), а обучение больных необходимо проводить при каждом личном контакте медицинских работников с пациентами (В) [8], что требует хорошего контакта между медицинским работником и обучаемым (С) [З].
Признаки контроля за течением астмы [8]
| Параметры | Их частота или характеристика |
| Дневные симптомы | 85% от индивидуального лучшего показателя |
| Дневные вариации ПСВ* | 1000 мкг/сут в пересчете на беклометазон дипропионат, показано проведение денситометрии, в том случае если у них имеются факторы риска остеопороза (С) [8]. Больные, регулярно принимающие ингаляционные ГКС, должны после ингаляций полоскать полость рта водой для предотвращения системной адсорбции препарата (А) [З]. Применение спейсера также снижает риск нежелательного действия ингаляционных ГКС (D) [1, З]. Бета2-агонисты короткого действия Бета2-агонисты короткого действия являются наиболее эффективными бронхолитическими средствами для купирования симптомов бронхиальной астмы (А) и профилактики астмы физического усилия (А) [3, 22]. Хотя применение бета2-агонистов короткого действия приводит к эффективному увеличению величины ПСВ (А) [18], эти препараты не должны рекомендоваться для постоянного применения в качестве базисной терапии (А) [I]. Наличие у больного потребности в ежедневном приеме бета2-агонистов является показанием к назначению противовоспалительной терапии (А) [1, З]. Если у больного бронхоспазм провоцируется физической нагрузкой, то до выполнения физических упражнений рекомендуется применять бета2-агонисты короткого действия (А) [I]. Например, сальбутамол более эффективен для предотвращения бронхоспазма, вызванного физической нагрузкой, чем хромогликат натрия (А) [7]. Пероральные бронхолитики следует рассматривать как препараты второго ряда после ингаляционных бронхолитиков (С) [З]. Бета2-агонисты длительного действия Применение бета2-агонистов длительного действия является альтернативой увеличения доз ингаляционных ГКС при недостаточном контроле за течением астмы [13, 23]. Эти лекарственные средства могут применяться в качестве дополнительной терапии при умеренном и тяжелом течении астмы (А) [3, 8]. Не рекомендуется применять бета2-агонисты длительного действия для купирования острых приступов астмы (за исключением формотерола) и применять эти лекарственные средства при отсутствии противовоспалительной терапии (В). На фоне применения бета2-агонистов длительного действия должен быть продолжен прием препаратов с коротким действием для купирования симптомов (В) [З]. У большинства больных, получавших сальметерол, удается достигнуть удовлетворительного контроля за течением БА при назначении его по 50 мкг дважды в сутки (В) [13]. Сальметерол вызывает значимую бронходилатацию в течение 12 ч; при назначении препарата в суточной дозе 100 мкг побочные эффекты не существенны, но при увеличении дозы их риск увеличивается (В) [13]. Применение сальметерола 2 раза в день более эффективно, чем использование препаратов короткого действия 4 раза в течение дня (А) [7]. Назначение сальметерола у больных с недостаточным контролем за течением БА может быть столь же эффективно, как увеличение дозы ингаляционных ГКС в 2 раза [23]. Антагонисты лейкотриеновых рецепторов Антагонисты лейкотриеновых рецепторов (АЛТ) являются альтернативой увеличения доз ингаляционных ГКС при недостаточном контроле за течением астмы. Эти лекарственные средства могут применяться совместно со средними и высокими дозами ингаляционных ГКС (А) [З]. Недостаточно данных, которые позволили бы отнести АЛТ к числу противовоспалительных препаратов первого выбора у больных бронхиальной астмой, однако у пациентов, которые не могут принимать ГКС, АЛТ являются препаратами выбора (D) [8]. Другим показанием к назначению АЛТ является аспириновый вариант бронхиальной астмы (D) [8]. Препараты хрома. Кромогликат натрия и недокромил могут применяться как альтернатива бета2-агонистам для предотвращения астмы физического усилия (А) [З]. Не существует свидетельств, на основании которых можно предпочесть недокромил хромогликату натрия или наоборот (А) [I]. Хотя недокромил более эффективен, чем плацебо, однако степень его эффективности не позволяет рекомендовать препарат в качестве средства первого ряда лечения БА (А), тем не менее у детей младше 12 лет и взрослых с легким течением астмы он может являться альтернативой низким дозам ингаляционных ГКС, не обладая нежелательными эффектами ГКС (А). Теофиллин. Теофиллин не должен применяться при бронхиальной астме в качестве препарата первого ряда (А) [З]. У пациентов с течением астмы, при котором средние дозы ингаляционных ГКС неэффективны, добавление к теофиллина лечению ГКС может улучшить контроль за течением астмы и сократить потребность в ГКС (В) [I]. Дозу теофиллина следует увеличивать постепенно путем титрации (С) [I]. Антихолинэргические средства. Препараты этой группы не рекомендуются в качестве препаратов первого ряда для лечения бронхиальной астмы, за исключением случаев толерантности к действию бета2-агонистов (С) [8]. Кетотифен не рекомендуется для лечения бронхиальной астмы (В) [8]. При лечении бронхиальной астмы ингаляционный путь доставки бронхолитиков и противовоспалительных препаратов является более предпочтительным, чем назначение этих лекарственных средств перорально или парентерально (А) [З]. В последние годы существенно расширился арсенал средств доставки ингаляционных препаратов. Условно принято выделять аэрозольный дозированный ингалятор (применяются со спейсером или без него), порошковые ингаляторы (турбухайлер, дискхайлер, циклохайлер и т.д.) и небулайзер. Существует алгоритм подбора больному адекватного средства доставки (С) [8]. Согласно этому алгоритму, первоначально больным астмой следует назначать лекарственные препараты в виде дозированных аэрозольных ингаляторов. Если при употреблении дозированных ингаляторов у больного возникают трудности, следует дополнительно применять спейсер большого объема (объем > 0,75 л). Если же и при использовании дозированного ингалятора со спейсером больной не справляется с техникой ингаляций или не может применять их в течение всего дня, то ему показано назначение препарата в виде порошкового ингалятора наиболее дешевой модели или дозированного аэрозольного ингалятора «легкое дыхание». Аэрозольный ингалятор со спейсером показан для всех возрастных групп, у пожилых больных и детей можно применять аэрозольный ингалятор со спейсером, оснащенным лицевой маской (В). При использовании любой системы доставки ингаляционных препаратов необходимо периодически оценивать технику ингаляции и проводить обучение больных (А) [З]. Применение ингаляционных ГКС через спейсер позволяет уменьшить риск кандидоза полости рта (А) [б]. При обострении бронхиальной астмы использование спейсера большого объема является эффективной альтернативой применению небулайзера, при этом удается в несколько (до 7-14) раз уменьшить дозы бронхо-литических средств (А) [7]. Аэрозольные ингаляторы со спейсером большого объема (>0,75 л) можно рекомендовать и при тяжелых обострениях астмы (А) [7]. Дозированные аэрозольные ингаляторы столь же эффективны, как порошковые ингаляторы (А), в том числе аутохаллер (А) [3, 21]. Лечение бронхиальной астмы в условиях стационара Признаком нестабильного течения БА на всех ее стадиях является увеличение потребности в ингаляционных бета2-агонистах (С), более частое, чем обычно, появление симптомов бронхообструкции и уменьшение величины ПСВ (А) [2, 8]. Пациенты, у которых величины ОФВ1 и ПСВ, измеренные до начала лечения, меньше 40% от индивидуального лучшего показателя (ИЛП) или должных величин (ПСВ 70% от должного, имеющие доступ к необходимым медикаментам, обладающие адекватной техникой ингаляции и получившие индивидуальный лечебный план, могут быть выписаны из стационара (D) [8]. Asthma is an illness with many variations in cause and severity. Many treatment options are available to control and reverse asthma symptoms. What’s the best treatment? It is important to provide more effective care for asthma from the point of view of evidence-based medicine. While the situations and outcomes varied-to some degree, the morbidity and resource utilization attributable to asthma can be strikingly reduced if moderate and severe asthmatics receive expert care источник Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций. Алла Николаевна Цой Прошло почти 10 лет с появления первого международного руководства по диагностике и лечению бронхиальной астмы (БА) – GINA [1]. Имеется опыт создания аналогичных стандартов по лечению БА, ориентированных на условия и особенности отечественной системы здравоохранения [4]. Подобные руководства подновым углом рассматривают вопросы обучения и самообразования практических специалистов, стимулируют отказ от недостаточно эффективных методов диагностики и лечения, повышая уровень медицинской помощи больным БА. Стандарты и протоколы по клинической практике предназначены, главным образом, для врачей широкого профиля (терапевты поликлиник и стационаров, врачи скорой помощи) и посвящены наиболее общим вопросам диагностики и лечения. Поэтому для этих руководств характерны строго ограниченный объем теоретических сведений, отсутствие описаний редких форм заболевания и новых экспериментальных методов лечения. Но благодаря этому они выполняют свою основную функцию – предоставляют врачам необходимую и точную информацию, позволяют оптимизировать лечебный процесс и обеспечить высокое качество медицинской помощи в любом из лечебных учреждений. Первые руководства по клинической практике [1, 3] строились по принципу консенсуса группы специалистов, однако в наши дни этого подхода явно недостаточно. Современный врач нуждается в строго взвешенных рекомендациях, основанных на данных наиболее качественно выполненных клинических исследований. Поэтому применение методов доказательной медицины, на наш взгляд, более перспективно и в дальнейшем обещает стать стандартом при подготовке клинических руководств. Цель настоящего обзора – ознакомить практических врачей с результатами использования концепции доказательной медицины (ДМ) на примере рекомендаций по лечению больных БА. При этом обоснование каждой из рекомендаций проводится с учетом уровня доказательности – в соответствии с системой, принятой в доказательной медицине. Уровень доказательности Удобным механизмом, который позволяет специалисту легко оценить качество клинического исследования и достоверность полученных данных, является предложенная в начале 90-х годов рейтинговая система оценки клинических исследований. Для непосредственной оценки исследования используется понятие “уровень доказательности”. Обычно выделяют от 3 до 7 уровней доказательности [19], при этом с возрастанием порядкового номера уровня (обозначается римскими цифрами) качество клинического исследования снижается, а результаты представляются менее достоверными или имеют только ориентировочное значение [11]. К уровню I в ДМ принято относить хорошо разработанные, крупные рандомизированные двойные слепые плацебоконтролируемые исследования. К этому же уровню доказательности принято относить данные, полученные в ходе мета_анализа нескольких рандомизированных контролируемых исследований [2]. Небольшие рандомизированные контролируемые исследования (в том случае, когда получить статистически корректные результаты не удалось изза малого числа больных, включенных в исследование) относят к II уровню доказательности, а исследования “случай–контроль” и когортные исследования – к II или III уровню. Наконец, данные отчетов экспертных групп или консенсусов специалистов принято относить к III или IV уровню [2]. Медицина доказательств В зависимости от мнения составителей (национальные общества ДМ, общества специалистов) одно и то же исследование в различных рейтингах может относиться к разным уровням, однако общий порядок распределения исследований практически везде одинаков. Так, в каждом из этих рейтингов первое место принадлежит крупным рандомизированным двойным слепым плацебоконтролируемым исследованиям (как наиболее достоверным источникам информации), а завершается каждый рейтинг мнениями отдельных специалистов и данными крупных руководств по клинической практике. В системе ДМ отдельные практические рекомендации по диагностике и лечению различных заболеваний также имеют свой рейтинг – степень убедительности рекомендаций (обозначается латинскими буквами). Рейтинг (уровень) рекомендаций в англоязычной литературе трактуется как сила рекомендаций (Strength of recommendation). При этом уровень рекомендаций, вытекающих из исследований I уровня, обозначается как А, II уровня – В и т.д. Кроме того, к рекомендациям уровня В относятся экстраполяции исследований I уровня доказательности, а рекомендации уровня С строятся как на основании исследований III уровня, так и на экстраполяциях исследований I и II уровней. Таким образом, рекомендации уровня А представляются вполне убедительными, так как опираются на веские доказательства, у рекомендаций уровня В убедительность относительная, а для рекомендаций уровня С имеющихся доказательств недостаточно, но и эти рекомендации могут использоваться с учетом определенных обстоятельств. Положения, относимые к уровням D и E, представляются недостаточно доказанными [2, 11]. В настоящем обзоре была принята система оценки клинических исследований, предложенная канадскими специалистами [8]. При присвоении отдельным рекомендациям того или иного рейтингового уровня авторы также опирались на мнение экспертов Великобритании и Канады [7, 18, 25]. Рекомендации по диагностике и лечению БА Общие принципы лечения БА в амбулаторных условиях БА характеризуется значительной вариабельностью тяжести своего течения. Поэтому для терапии БА в конце 80-х годов был предложен ступенчатый терапевтический подход, согласно которому каждой степени тяжести течения заболевания соответствует определенная схема лечения (рис. 1) [1]. Первоначально было принято выделять 4 степени тяжести БА [1, 3], но впоследствии показалось рациональным выделить группу больных с очень тяжелым течением БА, у кого адекватный контроль достигается только при применении пероральных глюкокортикостероидов (ГКС) [8]. К этой группе относят также пациентов с “трудной (тяжелой) астмой” (аспириновый вариант БА, ГКС_зависимая и ГКС-резистентная астма, лабильная астма) [10]. Общий алгоритм лечения БА приводится на рис. 2. Он включает диагностический этап, выбор схемы первоначального лечения, подбор долговременной терапии заболевания и последующее наблюдение за больным. Так как БА является хроническим воспалительным заболеванием дыхательных путей [1], эффективность терапии оценивается не как полное излечение, а как адекватный контроль за течением заболевания, предотвращающий обострения (таблица) [8]. Рис. 1. Ступенчатый подход к лечению БА. Признаки контролируемости течения БА [8] Рис. 2. Алгоритм лечения БА. Для подтверждения диагноза БА и оценки тяжести состояния у всех больных с явлениями бронхообструктивного синдрома следует проводить исследование функции внешнего дыхания (С) [25]. Согласно рекомендациям [1, 3] (D), к диагностическим критериям, специфичным для БА, относятся: При оценке ОФВ1 и ПСВ следует ориентироваться на среднестатистические нормы для данной популяции, а в идеале – на индивидуальный лучший показатель данного больного, измеренный в период стабильного состояния (С) [3]. Для установления диагноза БА также можно использовать бронхопровокационный тест с метахолином (С) [8]. Когда проведение спирометрии или бронхопровокационного теста невозможно, следует оценить вариабельность бронхообструкции при многодневном измерении ПСВ в домашних условиях – вариабельность >20% может указывать на наличие БА (В) [8]. БА и факторы внешней среды В целом тяжесть симптомов астмы коррелирует со степенью чувствительности больного к аллергенам [1], хотя у многих пациентов аллергия не играет ведущей роли в течении заболевания. Следует помнить, что увеличение объема медикаментозной терапии не должно заменять меры по предотвращению контакта больного с аллергенами и ирритантами (С) [1]. Больным БА следует строго воздерживаться от курения (В) [25] и избегать контакта с табачным дымом (С) [1]. Больным БА следует избегать высокой концентрации ирритантов во вдыхаемом воздухе (С) [8], но до сих пор не имеется достаточных данных об эффективности применения для этих целей увлажнителей и средств очистки воздуха (С) [8]. Все взрослые больные с впервые выявленной БА должны проходить обследование для исключения профессионального характера заболевания (В) [5, 8]. Мониторинг и обучение больных Обучение пациентов – обязательный компонент лечения астмы (А) [3]. Целью обучения является контроль за течением заболевания и выбор правильного поведения больного в различных ситуациях, связанных с заболеванием. Программа обучения должна строиться не только на ознакомлении больных с соответствующей литературой (А), обучение больных необходимо проводить при каждой встрече медицинских работников с пациентами (В) [8], что требует хорошего контакта между медицинским работником и обучаемым (С) [3]. Наиболее удобные и информативные средства контроля за эффективностью лечения – наблюдение за функцией внешнего дыхания (спирография и пикфлоуметрия) (А) и определение потребности в бронхолитиках (А) [2, 15]; это возможно, если пациент ежедневно фиксирует показатели ПСВ и симптомы своего заболевания в виде дневника (А) [8]. Постоянный мониторинг ПСВ может быть полезен у некоторых пациентов, особенно у больных со сниженным восприятием бронхообструкции (С) [8]. Для улучшения контроля БА для каждого пациента должен составляться письменный индивидуальный план лечения, основанный на самооценке симптомов (В) [3]. Иммунотерапия В общем случае проведение иммунотерапии не может быть рекомендовано для лечения БА (В) [8]. Она не должна заменять соблюдение гипоаллергенного режима (С). Целесообразность иммунотерапии может рассматриваться в тех случаях, когда предотвращение контакта с аллергеном и фармакотерапия не приводят к адекватному контролю заболевания (А). Хорошо контролируемая астма не является противопоказанием к проведению иммунотерапии по поводу аллергического риноконъюнктивита и гиперчувствительности к яду насекомых (С) [8]. Ингаляционные ГКС Ингаляционные ГКС (ИГКС) эффективны при лечении БА (А) [5] и способствуют сокращению применения системных ГКС у больных с ГКС_зависимым течением БА (А) [7]. Назначение ИГКС больным БА позволяет увеличить величину ПСВ и уменьшить потребность в бронхолитиках (А) [6]. Лучший уровень контроля за течением БА быстрее достигается при использовании более высоких доз ИГКС (А) [6]. Позднее начало лечения ИГКС в последующем иногда приводит к более низким результатам функциональных тестов (С) [8]. Все ИГКС в эквивалентных дозах обладают одинаковой эффективностью (А) [3]. Доказана высокая эффективность ИГКС при назначении 2 раза в день; при применении ИГКС 4 раза в день в той же суточной дозе эффективность лечения возрастает незначительно (А) [7]. ИГКС следует рекомендовать тем больным, у которых обычная потребность в применении бета2-агонистов короткого действия составляет 2–3 приема в день и больше (А) [7]. Первоначальная дневная доза ИГКС обычно должна составлять 400–1000 мкг (в пересчете на беклометазон), при более тяжелом течении БА можно рекомендовать более высокие дозы ИГКС или начать лечение системными ГКС (С) [7]. Стандартные дозы ИГКС (эквивалентные 800 мкг беклометазона) при неэффективности могут быть увеличены до 2000 мкг в пересчете на беклометазон (А) [7]. Если при лечении ИГКС достигнут положительный результат, дозу ИГКС следует постепенно снижать до минимальной, обеспечивающей контроль за проявлениями астмы (С) [3]. Снижение доз ИГКС следует осуществлять постепенно, уменьшая дозу на 25–50% от исходной после того, как состояние больного оставалось устойчивым в течение 3 мес (С) [7]. При обострениях БА следует увеличить дозу ИГКС в 2–4 раза (D) [8] или назначить преднизолон в дозе 0,5–1,0 мг/кг/сут (А) [3, 17], повышенная доза ГКС должна поддерживаться в течение 10–14 дней (С) [18]. Существенные опасения больных вызывает безопасность применения ГКС. Между тем, ИГКС в низких и средних дозах сравнительно редко вызывают клинически значимые нежелательные эффекты и обладают очень хорошим (т.е. низким) отношением риск/польза (А) [8]. Пациенты с отягощенной по глаукоме наследственностью или с повышением внутриглазного давления через 5 дней регулярного приема ИГКС должны пройти обследование у окулиста, которое в дальнейшем следует регулярно повторять (D) [8]. Взрослым пациентам, получающим более 1000 мкг/сут ГКС в пересчете на беклометазон, показано проведение денситометрии в случае, если у них имеются факторы риска развития остеопороза (С) [8]. Больные, регулярно принимающие ИГКС, должны после ингаляций полоскать полость рта водой для предотвращения системной абсорбции препарата (А) [3]. Применение спейсера также снижает риск нежелательного действия ИГКС (D) [1, 3]. Бета2-агонисты короткого действия Бета2-агонисты короткого действия являются наиболее эффективными бронхолитическими средствами для купирования симптомов БА (А) и профилактики так называемой астмы физического усилия (А) [3, 22]. Хотя применение Бета2-агонистов короткого действия приводит к эффективному увеличению ПСВ (А) [18], эти препараты не должны рекомендоваться для постоянного применения в качестве базисной терапии (А) [1]. Наличие у больного потребности в ежедневном применении Бета2-агонистов является показанием к назначению противовоспалительной терапии (А) [1, 3]. Если у больного бронхоспазм провоцируется физической нагрузкой, то до выполнения физических упражнений рекомендуется применять .2_агонисты короткого действия (А) [1]: например, сальбутамол более эффективен для предотвращения бронхоспазма, вызванного физической нагрузкой, чем кромогликат натрия (А) [7]. Пероральные бронхолитики следует рассматривать как препараты второго ряда после ингаляционных бронхолитиков (С) [3]. Бета2-агонисты длительного действия Применение Бета2-агонистов длительного действия является альтернативой увеличению доз ИГКС при недостаточном контроле за течением БА [13, 23]; они могут применяться в качестве дополнительной терапии при умеренном и тяжелом течении астмы (А) [3, 8]. Не рекомендуется применять Бета2-агонисты длительного действия для купирования острых приступов БА (кроме формотерола) и применять их без противовоспалительной терапии (В). На фоне применения Бета2-агонистов длительного действия должен быть продолжен прием препаратов короткого действия для купирования симптомов БА (В) [3]. У большинства больных, получавших сальметерол, удавалось достигнуть удовлетворительного контроля за течением БА при назначении сальметерола по 50 мкг дважды в сутки (В) [13]. Сальметерол вызывает значимую бронходилатацию в течение 12 ч; при назначении препарата в суточной дозе 100 мкг побочные эффекты несущественны, но при увеличении дозы их риск увеличивается (В) [13]. Применение сальметерола 2 раза в день более эффективно, чем использование препаратов короткого действия 4 раза в день (А) [7]. Назначение сальметерола у больных с недостаточным контролем за течением БА может быть столь же эффективно, как увеличение дозы ИГКС в 2 раза [23]. Антагонисты лейкотриеновых рецепторов Антагонисты лейкотриеновых рецепторов (АЛ) являются альтернативой увеличению доз ИГКС при недостаточном контроле за течением астмы; АЛ могут применяться совместно со средними и высокими дозами ИГКС (А) [3]. Недостаточно данных, которые позволили бы отнести АЛ к числу противовоспалительных препаратов первого выбора у больных БА, однако у пациентов, которые не могут принимать ГКС, АЛ являются препаратами выбора (D) [8]. Другое показание к применению АЛ – аспириновый вариант БА (D) [8]. Дополнительная терапия Кромогликат натрия и недокромил можно применять в качестве альтернативы Бета2-агонистам для предотвращения астмы физического усилия (А) [3]. Не существует свидетельств, на основании которых можно предпочесть недокромил кромогликату натрия или наоборот (А) [1]. Хотя недокромил более эффективен, чем плацебо, однако степень его эффективности не позволяет рекомендовать препарат в качестве средства первого ряда при БА (А). Тем не менее, у детей младше 12 лет и у взрослых с легким течением БА он может являться альтернативой низким дозам ИГКС, не обладая нежелательными эффектами ГКС (А). Теофиллин не должен применяться при БА в качестве препарата первого ряда (А) [3]. У пациентов с течением БА, при котором средние дозы ИГКС неэффективны, добавление теофиллина к лечению может улучшить контроль за течением БА и сократить потребность в ГКС (В) [1]. Дозу теофиллина следует увеличивать постепенно путем титрования (С) [1]. Антихолинергические средства не рекомендуются в качестве препаратов первого ряда для лечения БА, за исключением случаев толерантности к действию .2_агонистов (С) [8]. Кетотифен не рекомендуется для лечения БА (В) [8]. Средства доставки При лечении БА ингаляционный путь доставки бронхолитиков и противовоспалительных препаратов является более предпочтительным, чем назначение этих лекарственных средств перорально или парентерально (А) [3]. В последние годы существенно расширился арсенал средств доставки ингаляционных препаратов. Условно принято выделять дозированные аэрозольные ингаляторы (ДАИ) (применяются со спейсером или без него), порошковые ингаляторы (турбухалер, дискхалер, циклохалер и т.п.) и небулайзеры. Существует алгоритм подбора больному адекватного средства доставки (С) [8]. Согласно этому алгоритму, первоначально больным БА следует назначать лекарства в виде ДАИ. Если при употреблении ДАИ у больного возникают трудности, следует дополнительно применять спейсер большого объема (>0,75 л). Если же и при применении ДАИ со спейсером больной не справляется с техникой ингаляций или не может применять их в течение всего дня, то ему показано назначение препарата в виде порошкового ингалятора или ДАИ, активируемого вдохом (например, ДАИ “легкое дыхание”). ДАИ со спейсером показан для всех возрастных групп, у пожилых больных и детей можно применять ДАИ со спейсером, оснащенным лицевой маской (В). При применении любой системы доставки ингаляционных препаратов необходимо периодически оценивать технику ингаляции и проводить обучение больных (А) [3]. Применение ИГКС через спейсер позволяет уменьшить риск кандидоза полости рта (А) [6]. При обострении БА применение спейсера большого объема является эффективной альтернативой применению небулайзера, при этом удается в несколько (до 7–14) раз уменьшить дозы бронхолитических средств (А) [7]. Применение ДАИ со спейсером большого объема (>0,75 л) можно рекомендовать и при тяжелых обострениях астмы (А) [7]. ДАИ и порошковые ингаляторыодинаково эффективны (А) [3, 21]. Лечение БА в стационаре Признаком нестабильного течения БА на всех ее стадиях является увеличение потребности в ингаляционных Бета2-агонистах (С), более частое, чем обычно, появление симптомов бронхообструкции и уменьшение величины ПСВ (А) [2, 8]. Пациенты, у которых величины ОФВ1 и ПСВ, измеренные до начала лечения, меньше 40% от индивидуального лучшего показателя или меньше должных величин (ПСВ опубликовано 30/10/2009 13:57 источник Профессор А.Н. Цой, В.В. Архипов Основные принципы доказательной медицины В своей практической деятельности врачу приходится руководствоваться общепринятыми знаниями, собственным опытом, мнением экспертов, консультантов или коллег, стереотипами, подчас прочно укоренившимися в медицинской среде, а также данными, полученными в ходе экспериментальных исследований. Выбор между различными источниками информации при принятии решения иногда может представлять известные психологические трудности, однако большинство специалистов предпочитают использовать в своей работе наиболее достоверный с научной точки зрения материал, который в последние годы широко внедряется в практику, как система доказательной медицины [1]. Под понятием доказательная медицина (ДМ) подразумевается добросовестное, явное и разумное использование наиболее хорошо доказанных положений систематических клинических исследований при принятии решений относительно лечения больных в каждом индивидуальном случае, причем считать доказанным какое-либо положение, касающееся вопросов клинической практики, можно лишь в том случае, если это положение было объектом научного эксперимента или обработки достаточно большого числа наблюдений [2]. В настоящее время далеко не все аспекты диагностики и лечения больных бронхиальной астмой (БА) можно считать изученными с достаточной степенью достоверности. Так, одни рекомендации базируются на данных крупномасштабных многоцентровых исследований, проведенных в соответствии с правилами GCP (Good Clinical Practice), другие опираются на исследования небольших недостаточно репрезентативных групп больных или на отдельные клинические случаи. Для решения этой проблемы необходимо: Далеко не все аспекты диагностики и лечения бронхиальной астмы можно считать изученными с достаточной степенью достоверности. 1. Четко различать степень достоверности исследования. Этого можно достичь, применяя рейтинговую систему достоверности исследований. 2. Обобщать данные большого числа отдельных наблюдений посредством мета-анализа. 3. Использовать в практической деятельности международные или национальные консенсусы и рекомендательные документы, созданные с привлечением ведущих специалистов. Так, Отчет группы экспертов Национального института сердца легких и крови (США) представляет собою анализ более 5000 англоязычных работ, посвященных проблемам БА, вышедших в печати в период с 1991 до середины 1995 г. [3]. 4. Наконец, существует международная система планирования научных исследований, определяющая приоритетные экспериментальные направления. Например, ряд разделов GINA [4] посвящен тематике будущих исследований. Благодаря работе, проводимой специалистами многих стран, и возросшему авторитету ДМ в последние годы стало возможным создание руководств (Guidelines) по клинической практике, т.е. систематически разработанных документов, предназначенных для того, чтобы помочь практикующему врачу, юристу и пациенту в принятии решений по определенным клиническим обстоятельствам. Примером подобных работ в области терапии БА является целый ряд созданных в последние 10 лет национальных и международных руководств — International Consensus Report, 1992 [5]; The British Guidelines on Asthma Management, 1995 [6]; GINA, русская версия, 1996 [4]; Guidelines for the emergency management of asthma in adults, 1996 [7]; EPR-2, 1997; Стандарты диагностики и лечения больных с неспецифическими заболеваниями легких, 1999 [8]. Появление подобных документов в целом способствовало формированию единых представлений о тактике диагностики и лечения БА врачами различных специальностей. Однако рекомендации, построенные по принципу консенсуса, имеют свои специфические недостатки. В качестве примера можно привести существующие между отдельными документами 2-5 кратные различия в рекомендуемых дозах лекарственных средств (ЛС), недостаточный учет региональных различий в структуре и тяжести заболеваемости, общем уровне системы медицинской помощи, запросах и привычках больных. Исследования, проведенные в Великобритании, продемонстрировали, что врачи общей практики далеко не всегда применяют национальные рекомендации в своей работе [9], более того, создание четких систем рекомендаций вызывает критику со стороны специалистов, полагающих, что применение последних ограничивает свободу их клинического мышления. Таким образом, отношение практических врачей к методам ДМ и эффективность применения руководств по клинической практике сами по себе уже стали предметом научных исследований во многих странах Запада [10]. Преодоление этих недостатков, скорее всего, вопрос времени и накопления достаточного количества наблюдений. Поэтому важнейшим механизмом, позволяющим практическому специалисту ориентироваться в огромном количестве экспериментальных и клинических данных, стала предложенная несколько лет назад рейтинговая система оценки научных исследований [2]. Система подразделяет как исследования, так и вытекающие из них выводы на несколько групп. Категорий доказательности исследования может быть несколько (от 3 до 5-7), их обозначают латинскими цифрами, чем меньше цифра, тем большую достоверность имеют данные исследования. Применительно к проблеме БА обычно выделяют 3 категории доказательности исследования: • Категория I — к ней относятся хорошо разработанные, крупные, рандомизированные, контролируемые исследования, данные мета-анализа или систематических обозрений. • К категории II относятся когортные исследования и исследования типа случай-контроль. • К категории III принято относить неконтролируемые исследования и консенсусы специалистов. Практические рекомендации по диагностике и лечению БА опираются как на данные исследований, так и на экстраполяции этих данных. С учетом этого обстоятельства рекомендации подразделяются на 3-5 уровней, которые принято обозначать латинскими буквами — A, B, C, D, E. Для рекомендаций по лечению БА в большинстве стран Западной Европы и Канаде выделяют 3 уровня доказательности — A, B, C [11]. Рекомендации уровня А базируются на результатах исследований, относимых к I категории доказательности и, следовательно, отличаются наиболее высоким уровнем достоверности. Достоверность рекомендаций уровня В также довольно высока — при их формулировании используются материалы исследований II категории или экстраполяции исследований I категории доказательности. Рекомендации уровня С строятся на основании неконтролируемых исследований и консенсусов специалистов (III категории доказательности) или содержат экстраполяции рекомендаций I и II категории. Целью настоящего обзора является попытка анализа основных рекомендаций по ведению больных БА в соответствии с рейтинговой системой ДМ. При формулировке отдельных положений указывается уровень их доказательности (латинские буквы) и/или тип клинических исследований, на которых они базируются (римские цифры). При присвоении отдельным рекомендациям того или иного рейтингового уровня в основном использовалось мнение экспертов North of England evidence based guidelines development project (Великобритания) [11] и British Thoracic Society [2, 6] и авторов Guidelines for the emergency management of asthma in adults (Канада) [7]. Выбор препаратов при стабильном течении БА БА является хроническим воспалительным заболеванием дыхательных путей [4] и, следовательно, требует постоянной повседневной терапии. Основной целью лечения (уровень С) является устранение любых ограничений в повседневной деятельности пациента и обеспечение минимальной выраженности симптомов БА [11]. Осуществление этой цели возможно лишь в том случае, если лечебные мероприятия эффективно противодействуют реализации триггерных механизмов, приводящих к возникновению бронхообструкции (физическая нагрузка, вдыхание холодного воздуха и т.д.). При этом желательно, чтобы потребность больного в использовании бронхолитических средств и нежелательные эффекты от проводимой терапии оставались на минимальном уровне. Критерием эффективности базисной терапии БА является поддержание пиковой скорости выдоха (ПСВ) на уровне его индивидуального лучшего показателя (ИЛП) и отсутствие суточных колебаний пиковой скорости выдоха ( Выбор препаратов при нестабильном течении и обострении БА Признаком нестабильного течения БА на всех ее стадиях является увеличение потребности в ингаляционных b2-агонистах (уровень С), более частое, чем обычно, появление симптомов бронхообструкции и уменьшение величины ПСВ (уровень А). Причины нестабильного течения БА могут быть различными, поэтому существует много направлений профилактики. Следует ограничить контакт больного с аллергенами (например, клещ домашней пыли, домашние животные и пыльца растений) в тех случаях, когда это возможно (уровень А). Образовательные программы могут улучшить знания и положительно изменить поведение больных (I) (уровень А). Больные БА, продолжающие курить, должны знать о необходимости прекращения курения, следует также избегать пассивного курения (уровень С). В последние годы большое внимание уделяется вопросу соблюдения больными БА рекомендаций врача, что является принципиально важным моментом в процессе лечения. В тех случаях, когда не удается достигнуть достаточного контроля за течением болезни и предполагается увеличить объем медикаментозной терапии, в первую очередь следует оценить, насколько точно больной выполнял указания врача (уровень С). Пациенты, у которых величины ОФВ1 (объем форсированного выдоха за 1 с) и ПСВ, измеренные до начала лечения, меньше 40% от ИЛП или должных величин (в среднем ПСВ Средства доставки лекарственных средств В последние годы существенно расширился арсенал средств доставки ингаляционных препаратов. Условно принято выделять аэрозольный дозированный ингалятор (применяется со спейсером или без), порошковые ингаляторы (турбухалер, дискхалер, циклохалер и т.д.) и небулайзер. Существует алгоритм подбора больному адекватного средства доставки (уровень С). Согласно этому алгоритму, первоначально больным БА следует назначать ЛС в виде дозированных аэрозольных ингаляторов. Если при употреблении дозированных ингаляторов у больного возникают трудности, следует дополнительно применять спейсер большого объема (>0,75 л). Если же и при использовании дозированного ингалятора со спейсером больной не справляется с техникой ингаляций или не может применять их в течение всего дня, то ему показано назначение препарата в виде порошкового ингалятора наиболее дешевой модели или автоматического аэрозольного ингалятора (“легкое дыхание”). Контроль эффективности проводимого лечения Наиболее удобными и информативными средствами контроля за эффективностью лечения является наблюдение за функцией внешнего дыхания (спирография и пикфлоуметрия) (уровень А) и определение потребности в бронхолитиках (уровень А). Другие симптомы, часто очень важные с диагностической точки зрения, имеют меньшую ценность при оценке адекватности проводимой терапии. Доказательная медицина охватывает довольно широкий круг проблем, связанных с лечением БА, что позволяет практическому врачу по-новому оценить свою деятельность и, возможно, пересмотреть некоторые ее аспекты. Вместе с тем многие важные вопросы пока еще не нашли отражения в материалах высокодостоверных научных исследований, служащих базой для развития ДМ. В последнем случае приходится опираться на материалы ведущих руководств и национальных стандартов (протоколов) по лечению больных с неспецифическими заболеваниями легких [8]. 1. Доказательная медицина. Клиническая фармакология, 1999; 6: 3-9. 2. Eccles M., Clapp Z., Grimshaw J., Adams P.C., Higgins B., Purves I., Russell I. North of England evidence based guidelines development project: methods of guidelines development. BMJ, 1996; 312: 760-2. 3. Guidelines for the diagnosis and management of asthma. Expert panel report — 2. NIH publication № 97-4051A. Перевод под ред. проф. А.Н. Цой. М., Грантъ, 1998; 50. 4. Бронхиальная астма, глобальная стратегия. Основные направления лечения и профилактики астмы. Всемирная организация здравоохранения, Национальный институт сердце, легкие и кровь. Март 1993. Пульмонология. 1996; Прилож. 165. 5. International Consensus Report on Diagnosis and Treatment of Asthma. National Heart, Lung and Blood Institute, National Institutes of Health. NIH publication N 92-30-91. Eur. Respir. J. 1992; 5: 601-41. 6. The British Guidelines on Asthma Management: 1995 review and position statement. Thorax, 1997; 52 (suppl I): 1-21. 7. Beveridge R.C., Grunfeld A.F., Hodder R.V., Verbeek P.R. Guidelines for the emergency management of asthma in adults. Can. Med. Association J. 1996; 155: 25-37. 8. Стандарты (протоколы) диагностики и лечения больных с неспецифическими заболеваниями легких. Под ред. академика РАМН А.Г. Чучалина. М., Грантъ, 1999; 40. 9. Neville R.G., Hoskins G., Smith B., Clark R.A. How general practitioners manage acute asthma attack. Thorax, 1997; 52: 153-6. 10. McColl A., Smith H., White P., Field J., General practitioners’ perceptions of the route to evidence based medicine: a questionnaire survey. BMJ, 1998; 316: 361-5. 11. North of England evidence based guidelines development project: summary version of methods of evidence based guideline for the primary care management of asthma in adults. BMJ, 1996; 312: 762-6. 12. British Medical Association, Royal Pharmaceutical Society of Great Britain. British National Formulary. No 34. London: BMA, RPSGB, 1997. Опубликовано с разрешения администрации Русского Медицинского Журнала. источник Понятие доказательной медицины Доказательная медицина – это раздел медицины, основанный на доказательствах и предполагающий поиск, сравнение, широкое распространение полученных доказательств для использования в интересах больных. Иными словами, это медицина, предполагающая широкое внедрение только тех методик, полезность которых доказана наиболее надежными и достоверными исследованиями. Так определяет это понятие рабочая группа по доказательной медицине. Термин был введен в 1990 г. Д. Саккетом и его коллегами из Университета Мак-Мастера в Онтарио (Канада). Точнее и яснее, хотя менее звучно, этот термин переводится как «медицина, основанная на доказательствах» – Evidence based Medicine. Что это означает на практике, поясним на примере. После того как исследования покажут несомненную эффективность лекарственного препарата, он пройдет все необходимые процедуры утверждения и появится в практическом здравоохранении, будет изучаться его эффективность в так называемых регистровых исследованиях. Благодаря полной компьютеризации лечебных учреждений в базе данных накапливаются сведения о том, что препарат А получали несколько тысяч пациентов. Получив предварительные данные о том, что новый препарат эффективнее, чем старый и эталонный (например, гепарин, аспирин или витамины), начинают планирование, а затем и претворение в жизнь специального широкомасштабного проекта. Сначала определяют, какой контингент будет получать этот препарат. Для исследования предлагаются два препарата: препарат А и эталонный либо таблетка-пустышка (ее называют плацебо). Пациенту будет назначаться только один из них, причем какой именно не знает ни врач, проводящий исследование, ни пациент. Выбор делает компьютер, используя методику случайных чисел. При этом заранее известно, что пациенту не будет нанесен ущерб, поскольку эффективность или неэффективность препарата нужно еще доказать. Данные стекаются в штаб-квартиру – к исследователю, не имеющему никакого отношения ни к выбору препарата, ни к проводящемуся лечению. Но он имеет возможность оценить эффект лекарственного воздействия. Бывали случаи, когда исследование останавливали ввиду полной неэффективности и, более того, вредности испытуемого препарата, или наоборот, препарат был настолько эффективен, что дальнейшее исследование было бы неэтичным. Но такие случаи бывают крайне редко. В исследовании принимают участие только пациенты, которые дали на это добровольное согласие, о чем подписывают соответствующие документы. В случае отказа они получают обычное лечение. Но и выразивший согласие пациент имеет право на любом этапе выйти из исследования и в дальнейшем получать обычную терапию. Все эти процедуры тщательно расписаны в многотомной документации по исследованию с учетом всех нюансов – научно-медицинских, юридических и этических. Такая методика носит следующее название: «контролируемое многоцентровое двойное слепое рандомизированное исследование». Расшифруем это понятие. Контролируемое – исследование, в котором эффективность одного лекарственного средства либо методика лечения сравнивается с другим лекарственным средством (методикой лечения). Если лекарственный препарат сравнивается с плацебо, то говорят о плацебо-контролируемом исследовании; если – с другим лекарственным средством, то это исследование с активным препаратом сравнения. В качестве такого препарата часто используют «классические» медикаменты, например гепарин, аспирин и т. п. Многоцентровое – в исследовании участвуют тысячи пациентов во многих странах и континентах по единому протоколу. Это означает, что отбор пациентов осуществляется согласно определенным критериям (клиническая картина, лабораторные данные и т. п.). Для большей убедительности сходные исследования могут объединяться, тогда говорят о метаанализе данных. Двойное слепое – ни врач, ни больной не знают, какой из двух препаратов (плацебо или оригинальное лекарство) используется. Эта информация известна лишь в центре, где контролируется проведение всего исследования. Рандомизированное[107] – выбор осуществляется на основе методики случайных чисел. Исследователи учитывают эффективность лекарственного препарата по достаточно простым критериям – «жив – умер», наличию различных тяжелых осложнений, например, частота тяжелых форм бронхиальной астмы (астматический статус) и др. Такой критерий называется первичной конечной точкой и является наиболее убедительным свидетельством преимущества того или иного исследуемого препарата. Существуют также вторичные и даже третичные конечные точки (менее тяжелые и серьезные осложнения). К их учету прибегают в случаях, когда выигрыш по первичной контрольной точке отсутствует. Их значимость не столь высока как первичной конечной точки, однако они являются статистически весомым аргументом в пользу достоверной эффективности препарата. Длятся такие исследования несколько лет (а могут и более десяти). В настоящее время такая методика считается наиболее достоверной, а число исследований в рамках доказательной медицины приближается к миллиону. Если препарат был доказательно эффективен, его вносят в постоянно обновляемые рекомендации американских, европейских и других врачебных ассоциаций, где каждому методу присваивают уровень доказательности и класс рекомендаций. Спектр достоверности находится в диапазоне от полностью доказанного и рекомендуемого до полностью нерекомендуемого и вредного. – уровень доказательности А – данные получены в нескольких рандомизированных клинических исследованиях; – уровень доказательности В – данные получены в одном рандомизированном исследовании или в нерандомизированных исследованиях; – уровень доказательности С – согласованное мнение экспертов. Многие клинические рекомендации экспертов излагаются в определенной последовательности, которая отражает как результаты исследований, так и мнение экспертов. При таком порядке изложения характер рекомендации определен в виде класса. Класс I: имеются достоверные доказательства и (или) единое мнение экспертов о том, что данный вид лечения полезен и эффективен. Класс II: доказательства полезности и эффективности данного вида лечения противоречивы. Класс IIа: большая часть доказательств или мнений склоняется в пользу полезности (эффективности) данного вида лечения. Класс IIb: меньшая часть доказательств или мнений склоняется в пользу полезности (эффективности) данного вида лечения. Класс III: имеются достоверные доказательства и (или) единое мнение экспертов о том, что данный вид лечения бесполезен, неэффективен, а в некоторых случаях может быть вреден. Важно знать. Перед тем как начать принимать какой-либо препарат, узнайте, прошел ли он испытания доказательной медициной. Необходимо подчеркнуть еще раз, что такие «экзамены» для лекарств в рамках доказательной медицины не есть широкомасштабные эксперименты на людях, а наглядная убедительная демонстрация эффективности новых препаратов в сравнении со старыми. Понятно, что никто не допустит медикаменты к серьезным исследованиям (а сейчас таковые проводятся и у нас в стране), предварительно не убедившись иными, безопасными для человека, способами в положительном результате. В рамках таких изысканий ученые получают информацию, пациент – бесплатно современные дорогостоящие лекарственные препараты и тщательное, порой многолетнее, медицинское наблюдение и обследования. В последующих разделах, посвященных лечению бронхиальной астмы, мы будем рассматривать проблему лечения с точки зрения доказательной медицины[108], основываясь на рекомендациях Международной программы «Глобальная стратегия лечения и профилактики бронхиальной астмы» (пересмотр 2007 г.)[109]. источник |