Бронхиальной астмой называют хроническое заболевание дыхательной системы, при котором отмечается сильное сужение бронхов. Гормоны при астме нужны для оказания противовоспалительного и антиаллергического эффекта.
В базисную терапию астмы включены глюкокортикостероиды. Если их не применять для лечения заболевания, сильно возрастает зависимость от симптоматических бронходилататоров. Это является признаком неконтролируемого течения астмы.
Глюкокортикостероиды — это гормоны, производимые корой надпочечников. В организме человека вырабатывается кортизол, кортикостерон.
Разностороннее воздействие на организм этих биологически активных веществ позволило активно использовать их в лечении различных заболеваний, в том числе астмы.
Сейчас существует ряд фторированных и нефторированных синтетических глюкокортикоидов. В отличие от природных, они обладают большей активностью, поэтому действуют более эффективно.
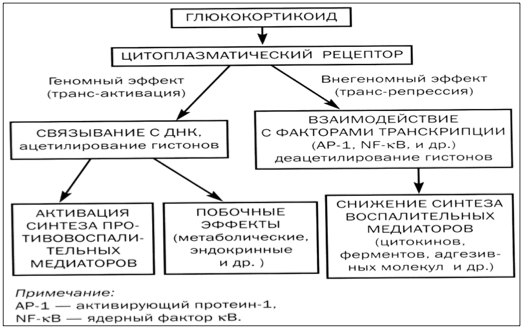
Для полного понимания, почему так активно используют гормоны от астмы, важно знать их механизм действия. В клетках человеческого организма существуют специальные рецепторы, с которыми глюкокортикостероиды связываются, проникая в цитоплазму.
Полученный в результате этого взаимодействия комплекс проникает внутрь ядра, где воздействует непосредственно на ДНК. Это позволяет активировать процесс образования различных белков:
- липокортин-1. Его действие направлено на торможение продукции арахидоновой кислоты, из которой синтезируются медиаторы воспаления;
- нейтральная эндопептидаза. Нужна для разрушения кининовых комплексов, принимающих участие в развитии воспалительного процесса;
- интерлейкин-10, оказывающий противовоспалительное действие;
- ингибитор ядерного фактора. Играет важную роль в торможении воспалительного процесса бронхов.
За счет действия комплекса гормон-рецептор наблюдается выраженное торможение образования активизирующих воспалительный процесс белков.
Глюкокортикоиды благодаря своим свойствам отлично помогают при бронхиальной астме, давая выраженный противовоспалительный эффект.
Применение глюкокортикоидов при бронхиальной астме является традиционным методом лечения данного заболевания. Их использование началось еще в середине 40-х годов ХХ века, после того, как Ф. Хенч и Э. Кендэлл смогли искусственно синтезировать ГКС.
Поняв, что глюкокортикостероиды помогают в контроле воспалительного процесса при гормональной астме, они начали активно тестировать их при лечении заболевания, однако отметили большое количество побочных эффектов и временно прекратили их использование.
В современной медицине астматикам назначается два типа гормональных препаратов: ингаляционные и системные ГКС.
Главные преимущества, объясняющие широкое применение ингаляционных глюкокортикостероидов (ИГКС) для лечения бронхиальной астмы, — высокая липофильность, малый период полувыведения, а также быстрая инактивация.
В клинической практике используются следующие ИГКС:
- беклометазона дипропионат;
- будесонид;
- мометазона фуроат;
- флутиказона пропионат;
- циклесонид.
Механизм действия ИГКС при бронхиальной астме основан на их высокой липофильности. Эпителий человеческих бронхов покрыт незначительным слоем жидкости.
Поэтому не все вещества могут быстро проникнуть сквозь этот барьер. Липофильность позволяет препарату быстро достичь слизистой оболочки бронхов и проникнуть в кровеносную систему.
Эффект от применения ингаляционных глюкокортикоидов напрямую зависит от того, каким методом они были доставлены в организм.
Так, при использовании ингаляторов с аэрозолями большая часть препарата оседает в ротовой полости либо проглатывается. Лишь 10% достигает непосредственно слизистой оболочки бронха.
При вдыхании препарата через спейсер — около 5%. В системный кровоток ИГКС попадают в виде неактивных продуктов обмена, за исключением беклометазона. Также применяется введение препаратов через небулайзер для определенных групп пациентов, а именно:
- дети;
- пожилые люди;
- люди с нарушениями сознания;
- больные с сильной бронхиальной обструкцией.
Согласно ряду клинических испытаний, ингаляционные глюкокортикостероиды крайне эффективны при бронхиальной астме.
Системные глюкокортикостероиды (СГКС) не являются препаратами экстренной помощи при бронхиальной астме, однако они крайне важны для проведения терапевтических мероприятий во время обострений. В целом они нужны для повышения качества жизни пациента и не обладают быстрым эффектом.
Согласно глобальной стратегии ВОЗ, крайне важно применять СГКС при всех обострениях астмы, за исключением самых легких. Особенно это касается следующих случаев:
- после введения ИГКС не отмечается улучшения состояния пациента;
- приступ начался, несмотря на прием ИГКС;
- требуется увеличение дозы ИГКС;
- состояние пациента постоянно ухудшается;
- снижение реакции организма на действие ИГКС;
- снижение пикфлоуметрических показателей (ПСВ ниже 60%)
Отмечается, что для длительной терапии лучше применять СГКС в форме таблеток, внутривенное введение чаще используется при приступе. Основные глюкокортикостероиды, использующиеся для системной терапии при бронхиальной астме, — это преднизолон и гидрокортизон.
При пероральном приеме отмечается крайне высокая биодоступность. Максимальная концентрация препаратов в крови при внутривенном введении достигается менее чем через час после попадания в организм.
В печени данные лекарственные средства метаболизируются, а затем выводятся вместе с мочой.
При лечении больных гормонозависимой бронхиальной астмой важно помнить, что ГКС обладают рядом побочных эффектов, которые можно разделить на две группы:
- Развивающиеся во время терапии заболевания.
- Развивающиеся после прекращения лечения (синдром отмены).
К первой группе можно отнести следующие последствия:
- метаболические нарушения;
- повышение артериального давления;
- снижение иммунного статуса;
- язвенная болезнь;
- миопатия;
- расстройства психики;
- нарушения роста у детей;
- кушингоид.
Метаболические нарушения проявляются в виде гипергликемии, нарушении жирового, а также водно-электролитного обмена. Повышение уровня сахара в крови связано с тем, что на фоне приема ГКС отмечается увеличение устойчивости тканей к действию инсулина.
При этом данное состояние наблюдается достаточно редко, и к нему более склонны люди, которые, помимо гормональной астмы, болеют сахарным диабетом.
Нарушение обмена жиров проявляется в том, что на лице и туловище наблюдается чрезмерное развитие жировой ткани. Развивается так называемый кушингоидный хабитус.
Нарушения водного и минерального обмена проявляются в виде задержки воды в организме и потери кальция и калия.
Артериальная гипертензия при приеме ГКС связана с их воздействием на стенки сосудов. Развивается при длительном лечении большими дозами препаратов.
Еще реже возникает язвенная болезнь. Именно поэтому, все больные, которые применяют в лечении астмы СГКС, должны проходить обследования на предмет наличия язв в желудке.
У некоторых больных, применяющих ГКС, может возникнуть мышечная слабость, вплоть до полной атрофии. Это напрямую связано с влиянием препаратов на минеральный обмен. Также миопатия может наблюдаться при кушингоиде, поэтому ее нельзя называть специфичным побочным эффектом.
Легкие нарушения психического состояния могут наблюдаться в самом раннем начале терапии ГКС. Так, у больных отмечаются нервозность, частая смена настроения, а также нарушения сна. Стероидные психозы развиваются крайне редко.
У детей при использовании СГКС может отмечаться нарушение роста. В особенности этому подвержены мальчики. Считается, что патология связана с нарушением продукции половых гормонов.
При синдроме отмены наблюдается повышенная утомляемость, отсутствие аппетита, лихорадка, тошнота, а также сильные головные боли. В некоторых случаях может проявиться недостаточность надпочечников. Крайне редко наблюдается клиника псевдоопухоли мозга.
Первое, что должны понимать люди, больные гормонозависимой бронхиальной астмой, — нельзя самостоятельно отказываться от применения ГКС. Лечение должно быть системным и проходить под контролем специалиста.
Если говорить о лечении астмы без гормональных препаратов, то нужно вспомнить о такой группе лекарств, как кромоны. Нужно понимать, что данные лекарственные средства в большей мере обладают профилактическим, а не лечебным эффектом.
Их рекомендуется применять в период ремиссии. Существует много форм кромонов, однако лучший эффект достигается при применении при помощи ингаляторов. Они обладают рядом преимуществ:
- простота применения;
- отсутствие привыкания;
- минимальный риск побочных эффектов.
Благодаря своим свойствам препараты кромоглициевой кислоты отлично подходят для профилактики приступов астмы у детей, страдающих легкой формой заболевания. В соответствии с глобальной стратегией ВОЗ, они являются препаратом выбора.
Согласно проведенным исследованиям, если при средней тяжести и тяжелом течении астмы применение ИГКС не вызывает вопросов, то на начальных стадиях их употребление не оправдано.
Лечение астмы без гормонов у взрослого человека, который уже длительное время применял стероиды, практически невозможно.
Медикаментозные средства, такие как ИГКС и СГКС, при лечении бронхиальной астмы важно применять под контролем лечащего врача. Препараты необходимо подбирать индивидуально, а само лечение должно носить системный характер.
При обострениях БА рекомендуется использовать ИГКС для снятия приступа, а затем, при необходимости подключать СГКС. Несмотря на риск развития побочных эффектов, данные средства являются оптимальным вариантом лечения астмы.
источник
Использование ингаляционных форм глюкокортикоидов для лечения бронхиальной астмы (местная глюкокортикоидная терапия)
В настоящее время бронхиальная астма рассматривается как хронический воспалительный процесс в бронхах, приводящий к гиперреактивности и обструкции бронхов. В связи с этим, основным направлением в лечении бронхиальной астмы является противовоспалительная (базисная) терапия. К противовоспалительным средствам, используемым при лечении бронхиальной астмы, относятся глюкокортикоиды (ингаляционные формы) и стабилизаторы тучных клеток (интал, ломудал, недокромил, тайлед, дитек).
Противовоспалительная терапия с использованием ингалируемых глюкокортикоидов рекомендуется как первичная ступень терапии бронхиальной астмы средней и тяжелой степени с добавлением при необходимости Рз-адреномиметиков.
При лечении больных с легким персистирующим течением бронхиальной астмы, в случае отсутствия эффекта от эпизодического использования р-адреномиметиков, рекомендуется регулярно использовать ингаляции глюкокортикоидов.
При тяжелой кортикозависимой бронхиальной астме после достижения ремиссии с помощью глюкокортикоидов, принимаемых внутрь, рекомендуется переходить на ингаляции глюкокортикоидов с использованием больших доз (Salmeron, 1989).
Прием глюкокортикоидов в ингаляциях является важнейшей ступенью лечения бронхиальной астмы, так как ингалируемые глюкокортикоиды оказывают активное местное противовоспалительное действие, при этом системные побочные эффекты практически не развиваются (Utigev, 1993).
Механизм противовоспалительного действия ингаляционных глюкокортикоидов:
• препараты имеют высокое сродство к глюкокортикоидным рецепторам клеток, участвующих в воспалении, и взаимодействуют с этими рецепторами;
• образовавшийся комплекс влияет непосредственно на транскрипцию генов через взаимодействие с молекулой ДНК. При этом угнетается функция мРНК, ответственной за синтез протеинов воспаления, и образуется новая молекула мРНК, отвечающая за синтез противовоспалительных протеинов (липокортин или липомодулин, нейтральная
пептидаза и т.д.). Вновь синтезированные пептиды непосредственно угнетают фосфолипазу Аг, ответственную за продукцию противоспалительных простагландинов, лейкотриенов, фактора агрегации тромбоцитов.
Выделяют два поколения глюкокортикоидов в ингаляциях:
• препараты I поколения: бекотид, бекломет, бекодиск;
• препараты II поколения: будезонид, флюнизолид, флютиказона дипропионат.
Ингаляционные глюкокортикоиды 1-го поколения
Беклометазона дипропионат (бекломет, бекотид) — это 9
• суспензия для использования в небулайзере (в 1 мл 50 мкг);
• дисковые формы (бекодиски по 100 и 200 мкг), ингалируемые с по
мощью дискового ингалятора «Дискхайлер».
Беклометазона дипропионат является «пропрепаратом». Он метаболизируется в более активный метаболит беклометазона монопропионат во многих тканях, в т.ч. в легких и печени.
При вдыхании беклометазона дипропионата 30% его количества попадает в легкие и в них метаболизируется, около 70% осаждается в полости рта, глотки, проглатывается и активируется в печени до беклометазона мо-нопропионата. При применении больших доз беклометазона возможны системные побочные эффекты.
Бекотид (бекломет) в виде аэрозолей для ингаляций предназначается для длительного регулярного применения. Препарат не применяется для купирования приступов бронхиальной астмы, терапевтическое действие его проявляется только через несколько дней после начала лечения. Больные, которым ранее назначалась системная кортикостероидная терапия, должны продолжать ее еще в течение 1 недели после начала применения бекотида, затем можно попытаться постепенно понижать его дозу.
Обычная терапевтическая доза бекотида составляет 400 мкг в день, ее следует разделить на 2-4 разовые дозы (2-4 вдоха). При тяжелом течении бронхиальной астмы можно повысить суточную дозу до 1000-1500 мкг и даже 2000 мкг. Эта доза эффективна и не вызывает системных побочных действий, не угнетает коры надпочечников. При необходимости применять большие дозы бекотида целесообразно воспользоваться препаратом беко-тид-250 (1-2 вдоха 2-3 раза в день).
Поддерживающая доза препарата составляет 200-400 мкг в сутки при двукратном применении (утром и вечером). Снижение дозы до поддерживающей производится постепенно (на 1 ингаляцию каждые 3-7 дней).
При лечении бекотидом (беклометом) возможно осаждение препарата на слизистой полости рта, что способствует развитию кандидомикоза и фарингита. Для профилактики кандидомикоза полости рта ингаляции бекотида производятся с использованием специального дозатора-спейсера, который надевается на ингалятор, в результате чего частицы препарата, оседавшие в полости рта, задерживаются в камере-спейсере. После ингаляции бекотида целесообразно полоскать рот. При применении дозатора-спейсера количество препарата, достигающего легких, увеличивается.
Ингаляции бекотида могут частично заменить дозу глюкокортикоидов, принимаемых внутрь, и снизить кортикозависимость (400 мкг бекотида эквивалентны 6 мг преднизолона).
Бекодиск — в одной дозе содержит 100 и 200 мкг бекотида, в виде сухого вещества ингалируется в суточной дозе 800-1200 мкг (т.е. 1-2 вдоха 4 раза в день) с помощью специального ингалятора.
Беклометазона дипропионат выпускается в виде препарата беклокорт в 2 формах: мите и форте. Беклокортмите применяется в тех же дозах, что и бекотид. Беклокорт-форте, 1 доза которого содержит 250 мкг беклометазона дипропионата, обладает более длительным действием, чем беклокортмите, его следует применять по 1-2 ингаляции 2-3 раза в день.
Беклометазона дипропионат выпускается также в виде препарата альдецин. Он показан для лечения больных, у которых бронхиальная астма сочетается с вазомоторным аллергическим ринитом, полипозом носа. В упаковке препарата имеется сменная насадка для назальных ингаляций белометазона, а также насадка для ингаляций через рот Альдецин применяют по 1 ингаляции (50 мкг) в каждый носовой ход 4 раза в день или через оральную насадку ингалируют через рот (1-2 вдоха 4 раза в день)
Вентид — комбинированный дозированный аэрозоль, содержащий глюкокортикоид и р2-адреномиметик (вентолин) Ингалируется по 1-2 вдоха 3-4 раза в день
Ингаляционные глюкокортикоиды 2-го поколения
Ингаляционные глюкокортикоиды 2-го поколения обладают более значительным сродством к глюкокортикоидным рецепторам в бронхопульмональной системе Считается, что препараты этого поколения более эффективны, чем бекотид, и действуют более длительно
Будесонид (горакорт) — аэрозоль (200 доз по 160 мкг) — препарат продленного действия в капсулах, действует около 12 ч, ингалируется 2 раза по 200 мкг, при тяжелом течении бронхиальной астмы суточная доза повышается до 1600 мкг
Флунисолид (ингакорт) выпускается в виде аэрозоля для ингаляций Одна доза аэрозоля содержит 250 мкг флунисолида Начальная доза препарата составляет 2 вдоха утром и вечером, что соответствует 1000 мкг флунисолида При необходимости дозу можно увеличить до 4 ингаляций 2 раза в день (2000 мкг в сутки)
После ингаляции флунисолида только 39% введенной дозы поступает в общий кровоток При этом более 90% препарата, подвергшегося резорбции в легких, превращается в печени в почти неактивный метаболит — 6р-гидроксифлунисолид Его активность в 100 раз ниже активности исходного препарата
В отличие от беклометазона дипропионата, флунисолид является исходно биологически активным, не подвергается метаболизму в легких, в дозе 2000 мкг в сутки не оказывает угнетающего влияния на гипоталамо-гипофизарно-надпочениковую ось и не имеет системных побочных эффектов Баллончик с флунисолидом оснащен специально разработанным спейсером, который способствует более эффективному и глубокому поступлению препарата в бронхи, уменьшает осаждение его в полости рта и, следовательно, частоту осложнений со стороны рта, глотки (кандидомикоз, охриплость голоса, горечь во рту, кашель)
Флютжазона пропионат (фликсомид) — выпускается в виде дозированного аэрозоля с содержанием в 1 дозе 25, 50, 125 или 250 мкг препарата Применяются ингаляции в дозе от 100 до 1000 мкг 2 раза в день в зависимости от тяжести состояния больного Поддерживающая доза — 100-500 мкг 2 раза в день Препарат практически не дает системных побочных явлений, является наиболее эффективным и безопасным ингаляционным глюкокортикоидом
Флютиказон обладает высокой местной активностью, его аффинность к глюкокортикоидным рецепторам в 18 раз превышает таковую дексаметазона и в 3 раза — будесонида
При ингалировании флютиказона 70-80% препарата проглатывается, но при этом абсорбируется не более 1% При первом прохождении через печень происходит почти полная биотрансформация препарата с образованием неактивного метаболита — деривата 17-карбоксиловой кислоты
Все три препарата (беклометазона дипропионат, флунисолид, флютиказона пропионат) снижают число приступов бронхиальной астмы в дневное и ночное время, потребность в симпатомиметиках и частоту рецидивов Однако названные положительные эффекты более выражены и быстрее наступают при использовании флютиказона, при этом практически отсутствует опасность развития системных побочных действий глюкокортикоидов
При легких и среднетяжелых формах бронхиальной астмы можно использовать любые ингаляционные глюкокортикоиды в дозах 400-800 мкг/сутки При более тяжелом течении заболевания, требующем применения высоких доз ингаляционных глюкокортикоидов (1500-2000 мкг/сутки и (юлее), следует предпочесть флютиказона пропионат
Побочные действия ингаляционной глюкокортикоидной терапии
1 Развитие фарингита, дисфонии вследствие атрофии мышц гортани, кандидомикоза слизистой полости рта Для профилактики этого побочного действия, обусловленного оседанием частиц глюкокортикоида на слизистой оболочке полости рта во время ингаляции, следует полоскать рот после ингаляции, а также пользоваться спейсером (см выше)
2 Системные побочные эффекты Развитие системных побочных явлений обусловлено частичным всасыванием ингалируемых глюкокортикоидов слизистой оболочкой бронхопульмональной системы, желудочно-кишечного тракта (часть препарата проглатывается больным) и поступлением его в кровоток
Всасывание ингалируемого глюкокортикоида через бронхопульмональную систему зависит от степени воспаления бронхов, интенсивности метаболизма глюкокортикоидов в дыхательных путях и количества препарата, поступающего в дыхательные пути во время ингаляции
Системные побочные явления возникают при использовании больших доз ингалируемых глюкокортикоидов (более 2000 мкг бекотида в сутки) и могут проявиться развитием кушингоидного синдрома, угнетением гипофизарно-надпочечниковой системы, снижением интенсивности процессов костеобразования, развитием остеопороза Обычные терапевтические дозы ингалируемых глюкокортикоидов системных побочных явлений не вызывают
Флунисолид (ингокорт) и флюказона дипропионат очень редко проявляют системные побочные действия по сравнению с бекотидом
Таким образом, применение ингаляционных форм глюкокортикоидов является современным и активным методом лечения бронхиальной астмы, позволяющим уменьшить потребность в пероральных глюкокортикоидах, а также р-адреномиметиках (Woolcock)
Целесообразно сочетать ингаляции глюкокортикоидов и бронхолитиков по схеме вначале ингаляция симпатомиметика (беротека, сальбутамола), а через 15-20 мин — ингаляция глюкокортикоида Сочетанное применение ингаляционного глюкокортикоида с другим ингаляционным противовоспалительным средством (интал, тайлед) позволяют у многих больных уменьшить лечебную дозу глюкокортикоидного препарата
Применение глюкокортикоидов внутрь или парентерально (системная глюкокортикоидная терапия)
Системная глюкокортикоидная терапия проводится только по строгим показаниям
· очень тяжелое течение бронхиальной астмы при отсутствии эффекта от всех остальных методов лечения,
• кортикозависимая бронхиальная астма (т.е. когда больной уже длительно лечится глюкокортикоидами и в данный момент отменить их невозможно);
• астматический статус (глюкокортикоиды применяются парентерально);
• кома при бронхиальной астме (глюкокортикоиды применяются парентерально);
Системная глюкокортикоидная терапия обладает следующими механизмами действия:
• стабилизирует тучные клетки, предупреждает их дегрануляцию и выход медиаторов аллергии и воспаления;
• блокируют образование IgE (реагинов);
• подавляют позднюю астматическую реакцию, что обусловлено подавлением клеточной воспалительной реакции вследствие перераспределения лимфоцитов и моноцитов, угнетением способности нейтрофилов к миграции из сосудистого русла, перераспределением эозинофилов. Поздняя астматическая реакция начинается через 3-4 ч после воздействия аллергена, максимум ее наблюдается через 12 ч, продолжается более 12 ч; она отражает механизмы прогрессирования бронхиальной астмы. Гиперреактивность бронхов, сохраняющаяся длительно
(в течение недель и месяцев), связана с поздней астматической реакцией;
• стабилизируют лизосомальные мембраны и уменьшают выход лизосомальных ферментов, повреждающих бронхопульмональную систему;
• подавляют сосудорасширяющее действие гистамина;
• увеличивают количество и чувствительность р-адренорецепторов бронхов к бронхорасширяющим воздействиям адреномиметиков;
• уменьшают отек слизистой оболочки бронхов; повышают активность эндогенных катехоламинов;
После проникновения в клетку глюкокортикоиды связываются со специфическими цитоплазматическими рецепторами, образуя комплекс гормон-рецептор, взаимодействующий в ядре клетки с хроматином. В результате активируется синтез белков, опосредующих эффекты глюкокортикоидов. Весь процесс занимает около 6 ч, поэтому глюкокортикоиды не купируют приступы удушья при обострении бронхиальной астмы, они действуют не ранее 6 ч после их введения
Используются 3 группы глюкокортикоидов:
• группа преднизолона: преднизолон (таблетки по 0.005 г; ампулы по 1 мл с содержанием 30 мг препарата); метилпреднизолон (метипред, урбазон — таблетки по 0.004 г);
• группа триамцинолона: триамцинолон, кенакорт, полькортолон, берликорт (таблетки по 0 004 г);
• группа дексаметазона: дексаметазон, дексон, дексазон (таблетки по
0 0005 г; ампулы для внутривенного и внутримышечного введения по
1 и 2 мл 0.4%-раствора с содержанием препарата 4 и 8 мг соответственно).
Для лечения больных бронхиальной астмой наиболее приемлемы препараты группы преднизолона и триамцинолона.
При очень тяжелом течении бронхиальной астмы и при отсутствии эффекта от остальных методов лечения рекомендуется применять препараты короткого действия (преднизолон, преднизолон, метилпреднизолон).
Методика лечения по М. Э. Гершвину (1984):
• при обострении начинать с высоких доз (например, 40-80 мг преднизолона ежедневно);
• после уменьшения симптомов — медленно снижать дозу (в течение 5-7 дней) до поддерживающей, например, на 50% каждый день;
• для хронического (длительного) лечения применять ежедневную дозу
преднизолона ниже 10 мг;
• принимать препарат в первой половине дня;
• в начале лечения дневную дозу разделить на 2-3 приема;
• если требуется прием более 7.5 мг преднизолона в день, предпринять попытку прерывистой терапии (например, 15 мг преднизолона через день вместо ежедневного приема 7.5 мг);
• для снижения суточной пероральной дозы преднизолона можно заменить часть принимаемого внутрь препарата ингаляцией бекотида, исходя из того, что 6 мг преднизолона равны по активности 400 мг бекотида.
В. И. Трофимов (1996) рекомендует начинать терапию таблетированными глюкокортикоидами с суточной дозы 20-40 мг преднизолона или 16-32 мг метипреда, триамцинолона. 2 /з- 3 /4 суточной дозы больной должен принимать утром после завтрака, остальную часть — после обеда (до 15.00) в соответствии с циркадными ритмами продукции глюкокортикоидов и чувствительности к ним тканей и клеток организма. После значительного улучшения состояния больного (отсутствие приступов удушья в течение 7-10 дней) можно снижать дозу глюкокортикоидов на ‘/2 таблетки в 3 дня, а при достижении дозы 10 мг/сут преднизолона или эквивалентной дозы другого препарата — на ‘/4 таблетки за 3 дня до полной отмены или сохранения поддерживающей дозы (обычно ‘/г»2 таблетки). Если больной получал глюкокортикоиды длительно (более 6 месяцев), снижение дозы нужно производить более медленно: на ‘/V’A таблетки за 7-14 и более дней.
Рекомендуется сочетать прием глюкокортикоидов внутрь с использованием их ингаляционных форм, что позволяет значительно уменьшить лечебную и поддерживающую дозы пероральных препаратов.
При необходимости длительного применения глюкокортикоидов для контроля за астмой тяжелого течения целесообразно использование альтернирующей схемы приема (удвоенной суточной дозы через день 1 раз в сутки утром), что позволяет уменьшить риск угнетения надпочечников и развития системных побочных эффектов. Короткий период полураспада пероральных глюкокортикоидов группы преднизолона и триамцинолона позволяет применять альтернирующую схему. Следует подчеркнуть что альтернирующая схема приема глюкокортикоидов обычно приемлема тогда, когда с помощью ежедневного их приема уже удалось добиться улучшения течения астмы и снизить суточную дозу преднизолона до 5-7.5 мг/день; однако, если наступило ухудшение состояния, необходимо вернуться к ежедневному приему препарата. При очень тяжелом течении астмы альтернирующая схема неэффективна, приходится применять глюкокортикоиды ежедневно и даже 2 раза в день.
Согласно совместному докладу Национального института сердца, легких и крови (США) и ВОЗ «Бронхиальная астма Глобальная стратегия» — короткий курс лечения пероральными глюкокортикоидами (5-7 дней) может быть использован как «максимальная терапия» для достижения контроля течения астмы у больного. Этот курс может применяться или в начале лечения больного с неконтролируемой астмой или в течение периода, когда больной отмечает постепенное ухудшение своего состояния Побочные эффекты при коротких курсах (менее 10 дней), как правило, не наблюдаются, отменять глюкокортикоиды можно сразу после коротких курсов
При наличии противопоказаний к приему глюкокортикоидных препаратов внутрь (эрозивный гастрит, язвенная болезнь желудка и двенадцатиперстной кишки) можно применить кеналог-40 (препарат триамцинолона продленного действия) внутримышечно в дозе 1-2 мл (40-80 мг) 1 раз в 4 недели.
Количество инъекций на курс лечения и интервалы между инъекциями определяются индивидуально, однако, к сожалению, при продолжительном лечении длительность эффекта уменьшается и возникает необходимость более частых введений .Некоторые больные, страдающие кортикозависимым вариантом бронхиальной астмы, вместо систематического перорального приема глюкокортикоидов применяют внутримышечное введение кеналога 1 раз в 3-4 недели
При выраженных обострениях, тяжелых приступах бронхиальной астмы, угрожающих развитием астматического состояния, нередко приходится применять большие дозы глюкокортикоидов внутривенно через короткие интервалы времени Считается, что оптимальная концентрация глюкокортикоидов в плазме достигается при введении гидрокортизона гемисукцината в дозе 4-8 мг/кг или преднизолона в дозе 1-2 мг/кг с интервалами 4-6 ч. Более эффективно внутривенное капельное введение глюкокортикоидов, которое может производиться 1-4 раза в сутки в зависимости от состояния больного. Обычно курс лечения внутривенными капельными вливаниями глюкокортикоидов до достижения оптимального эффекта составляет 3-7 дней, после чего глюкокортикоиды отменяют, постепенно снижая дозу на ‘Д начальной суточной дозы, добавляя ингаляционные глюкокортикоиды.
При глюкокортикозависимой бронхиальной астме отменить полностью глюкокортикоиды невозможно, достаточно активной оказывается суточная доза преднизолона 5-10 мг.
Побочные эффекты системного лечения глюкокортикоидами:
• ожирение, преимущественно в области груди, живота, шейного отдела позвоночника, появление лунообразного гиперемированного лица;
• психозы, эмоциональная лабильность;
• истончение, сухость кожи, багрово-фиолетовые стрии;
• остеопороз, в т.ч. позвоночника (возможны переломы позвоночника);
• гиперсекреция и повышение кислотности желудочного сока, развитие
язв желудка и двенадцатиперстной кишки;
• гипергликемия (стероидный сахарный диабет);
• задняя субкапсулярная катаракта;
• активизация туберкулезного процесса;
• угнетение функции надпочечников.
Внезапная отмена глюкокортикоидов после длительного их применения, особенно в больших дозах, приводит к быстрому появлению синдрома отмены, который проявляется:
• ухудшением течения бронхиальной астмы, возобновлением приступов
удушья, возможным развитием астматического статуса;
• значительным падением артериального давления;
Для уменьшения развития побочных явлений глюкокортикоиднои терапии и для уменьшения кортикозависимости рекомендуется:
• стараться обходиться меньшими дозами препарата;
• сочетать лечение с ингаляциями интала;
• назначать короткодействующие препараты (преднизолон, урбазон, полькортолон) и не применять длительно действующие глюкокортикоиды (кеналог, дексазон и др.);
• назначать глюкокортикоид в первой половине дня, наибольшую часть суточной дозы давать утром, чтобы концентрация препарата в крови совпадала с наибольшим выбросом эндогенного кортизола;
• поддерживающую дозу препарата (1.5-2 таблетки) целесообразно давать прерывистым способом (т.е. удвоенную поддерживающую дозу принимать однократно утром, но через день). При таком приеме уменьшается возможность угнетения надпочечников и развития побочных явлений;
· для уменьшения кортикозависимости в момент снижения дозы преднизолона и перехода на поддерживающие дозы принимать этимизол по 0.1 г 3 раза в день (под контролем артериального давления), глициррам по 0.05 г 2-3 раза в день внутрь. Эти средства стимулируют надпочечники. Для уменьшения кортикозависимости можно применять также настойку диоскореи кавказской по 30 капель 3 раза в день;
• применять РДТ с сочетании с иглорефлексотерапией;
· для предупреждения или уменьшения побочных явлений пероральной глюкокортикоиднои терапии целесообразно часть дозы заменить ингаляциями глюкокортикоидов;
· применять плазмаферез, гемосорбцию.
Одним из наиболее тяжелых осложнений системной глюкокортикоидной терапии является остеопороз. Для его профилактики и лечения применяются препараты, содержащие гормон С-клеток щитовидной железы кальцитонин — калъцитрин, миакалъцик. Калъцитрин назначается по 1 ЕД подкожно или внутримышечно ежедневно в течение месяца с перерывами каждый 7-й день (курс 25 инъекций) или по 3 ЕД через день (курс 15 инъекций). Миакальцик (кальцитонин лосося) вводится подкожно или внутримышечно по 50 ЕД (курс 4 недели). Можно применять также миакальцик в виде спрея интраназально по 50 ЕД через день в течение 2 месяцев с последующим двухмесячным перерывом. Лечение препаратами кальцитонина нужно проводить в сочетании с приемом кальция глюконата внутрь по 3-4 г/сут. Препараты кальцитонина способствуют поступлению кальция в костную ткань, уменьшают явления остеопороза, обладают противовоспалительным действием, уменьшают дегрануляцию тучных клеток и кортикозависимость.
Лечение глюкокортикоидами беременных женщин, страдающих бронхиальной астмой
Большинство пульмонологов считает противопоказанной системную пероральную глюкокортикоидную терапию в первом триместре беременности из-за высокого риска развития уродств у плода. Ингаляционные глюкокортикоиды могут применяться для лечения бронхиальной астмы (в дозе не более 1000 мкг в сутки) в течение всего периода беременности, т.к. их системные побочные эффекты незначительны, а риск гибели плода вследствие гипоксии при приступах астмы велик.
Небольшие дозы глюкокортикоидов при необходимости можно назначать внутрь во П-Ш триместрах в комбинации с ингаляционными глюкокортикоидами. При тяжелом приступе астмы и астматическом статусе показано внутривенное введение глюкокортикоидов.
Лечение цитостатиками (иммунодепрессантами)
Лечение цитостатиками в настоящее время применяется редко.
Механизм действия цитостатиков заключается в угнетении продукции реагинов и противовоспалительном эффекте. В отличие от глюкокортикоидов они не угнетают надпочечников.
• тяжелая форма атопической бронхиальной астмы, не поддающаяся
лечению обычными средствами, в т.ч. глюкокортикоидами;
• кортикозависимая кортикорезистентная бронхиальная астма — с целью уменьшения кортикозависимости;
• аутоиммунная бронхиальная астма.
Методика лечения цитостатиками изложена в разделе «Лечение аутоиммунной бронхиальной астмы».
Иммуномодулирующая терапия нормализует работу иммунной системы. Назначается при затяжном течении бронхиальной астмы, резистентной к терапии обычными средствами, особенно при сочетании атопической формы с инфекцией в бронхопульмональной системе.
Дата добавления: 2015-04-23 ; Просмотров: 1828 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Для лечения больных бронхиальной астмой наиболее приемлемы препараты группы преднизолона и триамцинолона.
При очень тяжелом течении бронхиальной астмы и при отсутствии эффекта от остальных методов лечения рекомендуется применять препараты короткого действия (преднизон, преднизалон, метилпреднизолон).
Системная глюкокортикоидная терапия проводится только по строгим показаниям:
- очень тяжелое течение бронхиальной астмы при отсутствии эффекта от всех остальных методов лечения;
- кортикозависимая бронхиальная астма (т.е. когда больной уже длительно лечится глюкокортикоидами и в данный момент отменить их невозможно);
- астматический статус (глюкокортикоиды применяются парентерально);
- кома при бронхиальной астме (глюкокортикоиды применяются парентерально);

Системная глюкокортикоидная терапия обладает следующими механизмами действия:
- стабилизирует тучные клетки, предупреждает ихдегрануляцию и выход медиаторов аллергии и воспаления;
- блокируют образование IgE (реагинов);
- подавляют позднюю астматическую реакцию, что обусловлено подавлением клеточной воспалительной реакции вследствие перераспределения лимфоцитов и моноцитов, угнетением способности нейтрофи-лов к миграции из сосудистого русла, перераспределением эозинофилов. Поздняя астматическая рекция начинается через 3-4 ч после воздействия аллергена, максимум ее наблюдается через 12 ч, продолжается более 12 ч; она отражает механизмы прогрессирования бронхиальной астмы. Гиперреактивность бронхов, сохраняющаяся длительно (в течение недель и месяцев), связана с поздней астматической реакцией;
- стабилизируют лизосомальные мембраны и уменьшают выход лизосомальных ферментов, повреждающих бронхопульмональную систему;
- подавляют сосудорасширяющее действие гистамина;
- увеличивают количество и чувствительность бета-адренорецепторов бронхов к бронхорасширяющим воздействиям адреномиметаков;
- уменьшают отек слизистой оболочки бронхов;
- повышают активность эндогенных катехоламинов;
После проникновения в клетку глюкокортикоиды связываются со специфическими цитоплазматическими рецепторами, образуя комплекс гормон-рецептор, взаимодействующий в ядре клетки с хроматином. В результате активируется синтез белков, опосредующих эффекты глюкокортикоидов. Весь процесс занимает около 6 ч, поэтому глюкокортикоиды не купируют приступы удушья при обострении бронхиальной астмы, они действуют не ранее 6 ч после их введения.
Используются 3 группы глюкокортикоидов:
- группа преднизолона: преднизолон (таблетки по 0.005 г; ампулы по 1 мл с содержанием 30 мг препарата); метилпреднизолон (метипред, урбазон — таблетки по 0.004 г);
- группа триамцинолона: триамцинолон, кенакорт, полькортолон, берликорт (таблетки по 0.004 г);
- группа дексаметазона: дексаметазон, дексон, дексазон (таблетки по 0.0005 г; ампулы для внутривенного и внутримышечного введения по 1 и 2 мл 0.4%-раствора с содержанием препарата 4 и 8 мг соответственно).
Методика лечения по М. Э. Гершвину (1984):
- при обострении начинать с высоких доз (например, 40-80 мг преднизолона ежедневно);
- после уменьшения симптомов — медленно снижать дозу (в течение 5-7 дней) до поддерживающей, например, на 50% каждый день;
- для хронического (длительного) лечения применять ежедневную дозу преднизолона ниже 10 мг;
- принимать препарат в первой половине дня;
- в начале лечения дневную дозу разделить на 2-3 приема;
- если требуется прием более 7.5 мг преднизолона в день, предпринять попытку прерывистой терапии (например, 15 мг преднизолона через день вместо ежедневного приема 7.5 мг);
- для снижения суточной пероральной дозы преднизолона можно заменить часть принимаемого внутрь препарата ингаляцией бекотида, исходя из того, что 6 мг преднизолона равны по активности 400 мг бекотида.
В. И. Трофимов (1996) рекомендует начинать терапию таблетированными глюкокортиковдами с суточной дозы 20-40 мг преднизолона или 16-32 мг метипреда, триамцинолона 2/3 — 3/4 суточной дозы больной должен принимать утром после завтрака, остальную часть — после обеда (до 15.00) в соответствии с циркадными ритмами продукции глюкокортикоидов и чувствительности к ним тканей и клеток организма. После значительного улучшения состояния больного (отсутствие приступов удушья в течение 7-10 дней) можно снижать дозу глюкокортикоидов на 1/2 таблетки в 3 дня, а при достижении дозы 10 мгДуг преднизолона или эквивалентной дозы другого препарата — на 1/4 таблетки за 3 дня до полной отмены или сохранения поддерживающей дозы (обычно 1,1/2 таблетки). Если больной получал глюкокортикоиды длительно (более 6 месяцев), снижение дозы нужно производить более медленно: на 1/2 — 1/4 таблетки за 7-14 и более дней.
Рекомендуется сочетать прием глюкокортикоидов внутрь с использованием их ингаляционных форм, что позволяет значительно уменьшить лечебную и поддерживающую дозы пероральных препаратов.
При необходимости длительного применения глюкокортикоидов для контроля за астмой тяжелого течения целесообразно использование альтернирующей схемы приема (удвоенной суточной дозы через день 1 раз в сутки утром), что позволяет уменьшить риск угнетения надпочечников и развития системных побочных эффектов. Короткий период полураспада пероральных глюкокортикоидов группы преднизолона и триамцинолона позволяет применять альтернирующую схему. Следует подчеркнуть что альтернирующая схема приема глюкокортикоидов обычно приемлема тогда, когда с помощью ежедневного их приема уже удалось добиться улучшения течения астмы и снизить суточную дозу преднизолона до 5-7.5 мг/день; однако, если наступило ухудшение состояния, необходимо вернуться к ежедневному приему препарата. При очень тяжелом течении астмы альтернирующая схема неэффективна, приходится применять глюкокортикоиды ежедневно и даже 2 раза в день.
Согласно совместному докладу Национального института сердца, легких и крови (США) и ВОЗ «Бронхиальная астма. Глобальная стратегия» — короткий курс лечения пероральными глюкокортикоидами (5-7 дней) может быть использован как «максимальная терапия» для достижения контроля течения астмы у больного. Этот курс может применяться или в начале лечения больного с неконтролируемой астмой или в течение периода, когда больной отмечает постепенное ухудшение своего состояния. Побочные эффекты при коротких курсах (менее 10 дней), как правило, не наблюдаются, отменять глюкокортикоиды можно сразу после коротких курсов.
При наличии противопоказаний к приему глюкокортикоидных препаратов внутрь (эрозивный гастрит, язвенная болезнь желудка и двенадцатиперстной кишки) можно применить кенолог-40 (препарат триамцинолона продленного действия) внутримышечно в дозе 1-2 мл (40-80 мг) 1 раз в 4 недели.
Количество инъекций на курс лечения и интервалы между инъекциями определяются индивидуально, однако, к сожалению, при продолжительном лечении длительность эффекта уменьшается и возникает необходимость более частых введений. Некоторые больные, страдающие кортикозависимым вариантом бронхиальной астмы, вместо систематического перорального приема глюкокортикоидов применяют внутримышечное введение кеналога 1 раз в 3-4 недели.
При выраженных обострениях, тяжелых приступах бронхиальной астмы, угрожающих развитием астматического состояния, нередко приходится применять большие дозы глюкокортикоидов внутривенно через короткие интервалы времени. Считается, что оптимальная концентрация глюкокортикоидов в плазме достигается при введении гидрокортизона гемисукцината в дозе 4-8 мг/кг или преднизолона в дозе 1-2 мг/кг с интервалами 4-6 ч. Более эффективно внутривенное капельное введение глюкокортикоидов, которое может производиться 1-4 раза в сутки в зависимости от состояния больного. Обычно курс лечения внутривенными капельными вливаниями глюкокортикоидов до достижения оптимального эффекта составляет 3-7 дней, после чего глюкокортикоиды отменяют, постепенно снижая дозу на 1/4 начальной суточной дозы, добавляя ингаляционные глюкокортикоиды.
При глюкокортикозависимой бронхиальной астме отменить полностью глюкокортикоиды невозможно, достаточно активной оказывается суточная доза преднизолона 5-10 мг.
Большинство пульмонологов считает противопоказанной системную пероральную глюкокортакоидную терапию в первом триместре беременности из-за высокого риска развития уродств у плода. Ингаляционные глюкокортикоиды могут применяться для лечения бронхиальной астмы (в дозе не более 1000 мкг в сутки) в течение всего периода беременности, т.к. их системные побочные эффекты незначительны, а риск гибели плода вследствие гипоксии при приступах астмы велик.
Небольшие дозы глюкокортикоидов при необходимости можно назначать внутрь во II-III триместрах в комбинации с ингаляционными глюкокортикоидами. При тяжелом приступе астмы и астматическом статусе показано внутривенное введение глюкокортикоидов.
Побочные эффекты системного лечения глюкокортикоидами:
- ожирение, преимущественно в области груди, живота, шейного отдела позвоночника, появление лунообразного гиперемированного лица;
- психозы, эмоциональная лабильность;
- истончение, сухость кожи, багрово-фиолетовые стрии;
- акне, гирсутизм;
- атрофия мышц;
- остеопороз, в т.ч. позвоночника (возможны переломы позвоночника);
- гиперсекреция и повышение кислотности желудочного сока, развитие язв желудка и двенадцатиперстной кишки;
- гипергликемия (стероидный сахарный диабет);
- артериальная гипертензия;
- задержка натрия, отеки;
- задняя субкапсулярная катаракта;
- активизация туберкулезного процесса;
- угнетение функции надпочечников.
Внезапная отмена глюкокортикоидов после длительного их применения, особенно в больших дозах, приводит к быстрому появлению синдрома отмены, который проявляется:
- ухудшением течения бронхиальной астмы, возобновлением приступов удушья, возможным развитием астматического статуса;
- значительным падением артериального давления;
- резкой слабостью;
- тошнотой, рвотой;
- артралгией, миалгией;
- болями в животе;
- головной болью.
Для уменьшения развития побочных явлений глюкокортиковдной терапии и для уменьшения кортикозависимости рекомендуется:
- стараться обходиться меньшими дозами препарата;
- сочетать лечение с ингаляциями интала;
- назначать короткодействующие препараты (преднизолон, урбазон, полькортолон) и не применять длительно действующие глюкокортикоиды (кеналог, дексазон и др.);
- назначать глюкокортикоид в первой половине дня, наибольшую часть суточной дозы давать утром, чтобы концентрация препарата в крови совпадала с наибольшим выбросом эндогенного кортизола;
- поддерживающую дозу препарата (1.5-2 таблетки) целесообразно давать прерывистым способом (т.е. удвоенную поддерживающую дозу принимать однократно утром, но через день). При таком приеме уменьшается возможность угнетения надпочечников и развития побочных явлений;
- для уменьшения кортикозависимости в момент снижения дозы преднизолона и перехода на поддерживающие дозы принимать этимиол по 0.1 г 3 раза в день (под контролем артериального давления), глициррам по 0.05 г 2-3 раза в день внутрь. Эти средства стимулируют надпочечники. Для уменьшения кортикозависимости можно применять также настойку диоскореи кавказской по 30 капель 3 раза в день;
- применять РДТ с сочетании с иглорефлексотерапией;
- для предупреждения или уменьшения побочных явлений пероральной глюкокортикоидной терапии целесообразно часть дозы заменить ингаляциями глюкокортикоидов;
- применять плазмаферез, гемосорбцию.
Одним из наиболее тяжелых осложнений системной глюкокортикоидной терапии является остеопороз. Для его профилактики и лечения применяются препараты, содержащие гормон С-клеток щитовидной железы кальцитонин — кальцитрин, миакалъцик. Кальцитрин назначается по 1 ЕД подкожно или внутримышечно ежедневно в течение месяца с перерывами каждый 7-й день (курс 25 инъекций) или по 3 ЕД через день (курс 15 инъекций). Миакальцик (кальцитонин лосося) вводится подкожно или внутримышечно по 50 ЕД (курс 4 недели). Можно применять также миакальцик в виде спрея интраназально по 50 ЕД через день в течение 2 месяцев с последующим двухмесячным перерывом. Лечение препаратами кальцитонина нужно проводить в сочетании с приемом кальция глюконата внутрь по 3-4 г/сут. Препараты кальцитонина способствуют поступлению кальция в костную ткань, уменьшают явления остеопороза, обладают противовоспалительным действием, уменьшают дегрануляцию тучных клеток и кортикозависимость.

источник
Несмотря на то, что излечить бронхиальную астму (БА) нельзя, современные методы лечения больного в большинстве случаев позволяют достигать и поддерживать контроль над заболеванием.
В ряде клинических исследований доказано, что персистирующая БА любой степени тяжести более эффективно контролируется путем подавления воспаления в дыхательных путях, нежели только устранением бронхоконстрикции и связанных с ней симптомов.
Основными целями ведения больных бронхиальной астмой являются:
1) достижение и поддержание контроля над симптомами болезни (полной ремиссии);
2) предотвращение обострений бронхиальной астмы;
3) поддержание показателей функции вентиляции и уровня активности больного, в том числе физической, близкими к нормальным;
4) исключение побочных эффектов противоастматической терапии;
5) предотвращение развития необратимой бронхиальной обструкции;
6) предотвращение связанной с бронхиальной астмой летальности.
Для реализации этих целей необходимо проведение ряда мероприятий, в которых участвуют как врачи, так и больные и их родственники:
1. Обучение больных для формирования партнерских отношений в процессе их ведения. Этот процесс непрерывный. Пациент, страдающий БА, и члены его семьи должны получить соответствующую информацию о заболевании, его особенностях у данного пациента. Пройти обучение для выработки навыков успешного контроля заболевания, изменения дозы препаратов при смене течения заболевания с целью поддержания удовлетворительного качества жизни. Такое обучение должно проводиться по программам коллективного (астма-школы, астма-клубы, лекции) и индивидуального образования с использованием популярной медицинской литературы.
2. Оценка и мониторирование тяжести бронхиальной астмы по степени выраженности симптомов заболевания (наличие кашля, свистящих хрипов, одышки (удушья), особенно в ночное время, частоты использования в2-адреномиметиков) и измерения показателей функции внешнего дыхания.
Исследования вентиляционной функции легких очень важны для диагностики, оценки степени тяжести и эффективности проводимой терапии у больных БА.
Спирометрия рекомендуется для первоначального обследования большинства больных с подозрением на бронхиальную астму, а также для контроля за течением заболевания в стационарных и, эпизодически, амбулаторных условиях. В домашних условиях в большинстве случаев достаточно определения пиковой скорости выдоха (ПСВ), определяемой с помощью пикфлоуметра. Пациент и/или его родственники должны пройти обучение по правильному проведению процедуры измерения ПСВ с помощью пикфлоуметра.
3. Элиминация (устранение) аллергенов и, по возможности, других факторов риска. Термин элиминация означает исключение, изгнание. Элиминация аллергенов (реже других факторов риска), в том числе профессиональных, является обязательным условием лечения больных БА.
Пищевая аллергия как фактор обострения БА встречается нечасто и, главным образом, у детей младшего возраста. Не следует рекомендовать исключение какого-либо продукта, прежде чем не будет проведена двойная слепая пищевая проба или проведено специфическое аллергологическое тестирование.
Сульфиты (часто используемые как консерванты для пищевых продуктов и лекарств, которые присутствуют в таких продуктах, как картофельные полуфабрикаты, креветки, сухофрукты, пиво и вино) нередко вызывают тяжелые обострения бронхиальной астмы; поэтому такие продукты должны быть исключены из рациона пациентов с повышенной чувствительностью к ним. Не следует также использовать продукты, вызывающие высвобождение гистамина в организме — так называемые либераторы гистамина (цитрусовые, томаты, шоколад, рыба и т.д.).
4. Разработка индивидуальных планов медикаментозной терапии для длительного ведения больных.
Целью медикаментозной терапии БА является контроль над заболеванием, который может и должен достигаться и поддерживаться у большинства пациентов и определяется как:
• минимальная выраженность (или отсутствие) хронических симптомов, включая ночные;
• минимальное количество обострений;
• отсутствие экстренных обращений за медицинской помощью;
• минимальная потребность (или ее отсутствие) в применении в2-агонистов по требованию;
• отсутствие ограничений в повседневной активности, включая физические упражнения;
• вариабельность ПСВ в течение суток менее 20 %;
• (почти) нормальные значения ПСВ;
• минимальное количество (или отсутствие) побочных эффектов лекарственной терапии.
5. Разработка индивидуальных планов купирования обострений.
6. Обеспечение регулярного динамического наблюдения за пациентом.
Лечение экзогенной БА должно начинаться с устранения контакта с предполагаемыми аллергенами (элиминации аллергена). При аллергии к шерсти животных и дафниям этого добиться сравнительно несложно, предложив больному сменить бытовые условия. При повышенной чувствительности к профессиональным факторам рекомендуется рациональное трудоустройство.
Сложнее осуществить элиминацию при аллергии к пыльце растений. В период цветения растения, к пыльце которого имеется повышенная чувствительность, не рекомендуется работать в саду, выезжать в лес или поле, проветривать помещение, выходить на улицу в утренние часы, когда в воздухе находится максимальная концентрация пыльцы. При тяжелом течении поллиноза на период цветения рекомендуется выезд в другие регионы. При аллергии к перу птицы пуховые и перьевые подушки и матрацы заменяют ватными или используют специальные безаллергенные матрацы и подушки.
Наибольшие сложности возникают при аллергии к домашней пыли, которая чаще всего связана с повышенной чувствительностью к клещевым или грибковым аллергенам. При резком обострении заболевания временное улучшение может дать выезд из дома, госпитализация в больницу, особенно в безаллергенные палаты с очистительными устройствами для поступающего воздуха.
Однако основной упор необходимо сделать на снижение в квартире количества клещей и грибков. Из квартиры необходимо удалить ковры, мягкую мебель, тяжелые шторы, ворсовые, шерстяные и ватные одеяла, плюшевые игрушки. Матрацы рекомендуется покрывать моющимся непроницаемым пластиком и не реже 1 раза в неделю протирать влажной тряпкой. Книги должны находиться на застекленных полках. В комнате больного необходимо ежедневно проводить уборку с использованием пылесоса, регулярно мыть обои.
Значительным достижением международного консенсуса является разработка конкретных рекомендаций по лекарственному лечению бронхиальной астмы в зависимости от тяжести течения заболевания. Прежде чем перейти к этим практическим рекомендациям, рассмотрим основные препараты, применяемые при БА.
Они делятся на противовоспалительные (базисные) средства и бронходилататоры. Исходя из воспалительной природы БА, противовоспалительным средствам придается решающее значение в воздействии на патологический процесс. Они не только подавляют воспалительный процесс в стенке бронхов, но и предупреждают так называемую позднюю аллергическую реакцию. Противовоспалительные средства должны применяться уже на ранних стадиях заболевания. Практические врачи часто запаздывают с применением противовоспалительных препаратов, что значительно затрудняет последующее лечение бронхиальной астмы.
К этой группе относятся кромогликат натрия, недокромил натрия и кетотифен (задитен).
Кромогликат натрия (интал, ломудал, кромолин) стал первым противовоспалительным препаратом, вводимым ингаляционным путем непосредственно в легкие. По механизму действия он оказался родоначальником нового фармакологического класса лекарственных средств — стабилизаторов мембран тучных клеток.
Наряду с этим интал предотвращает постнагрузочный бронхоспазм, снижает гиперреактивность бронхиального дерева. Наибольшая эффективность отмечена y больных атопической (аллергической) формой БА, однако препарат оказывает положительный эффект и при неаллергических формах заболевания. Важно подчеркнуть, что интал не обладает бронхорасширяющим действием и не может использоваться для купирования приступов. Эффект от курсового лечения наступает только через 2-4 недели от начала приема препарата.
Применяется чаще в капсулах в виде порошка по 20 мг для вдыхания с помощь турбоингалятора (спинхалера). Имеются и другие лекарственные формы интала: интал-аэрозоль — 1 мг, по 2 вдоха на прием; интал-аэрозоль — 5 мг, по 2 вдоха на прием; интал в ампулах для ингаляций — 20 мг препарата в 2 мл водного раствора, разовая доза — 1 ампула. Ингаляции всех препаратов интала проводятся 3-4 раза в сутки.
При необходимости разовая доза может быть увеличена в 1,5-2 раза, а промежуток между ингаляциями можно сократить до 3-4 часов, например, по 1 капсуле 8 раз в сутки. По мере улучшения состояния, обычно через 1-1,5 месяца, переходят на поддерживающие дозы: 3, а затем 2 капсулы в сутки, в дальнейшем при наступлении ремиссии интал можно давать только перед контактом с аллергеном или неспецифическим раздражителем.
Если приступы удушья наблюдаются в ночное время, то важно, чтобы больной принимал интал перед сном. В тех случаях, когда при уменьшении дозы заболевание обостряется, рекомендуется дозу увеличить. Лечение продолжают 3-4 и более месяцев.
При наличии остаточного бронхоспазма для обеспечения проникновения препарата в мелкие бронхи за 10-15 мин до его применения проводятся ингаляции в2-агонистов. В этих случаях рекомендуется также использовать комбинированные препараты: дитек — комбинацию динатрия кромогликата с фенотеролом (беротеком) и интал плюс — комбинацию кромогликата натрия с сальбутамолом. При БА более тяжелого течения рекомендуется комбинация интала с ингаляционными глюкокортикостероидами.
Интал не имеет серьезных побочных эффектов. У некоторых больных при приеме интала наблюдается першение в горле, кашель, очень редко — бронхоспазм (чаще при ингаляции сухого порошка) как реакция на неспецифическое раздражение. Для уменьшения першения и кашля рекомендуется полоскать горло теплой водой, для профилактики бронхоспазма — предварительная ингаляция бронходилататоров. Существенным преимуществом интала перед ГКС является отсутствие синдрома отмены. Относительным противопоказанием для применения интала является беременность при сроках до трех месяцев. Исключительно редко наблюдается аллергия к инталу.
Недокромил натрия (тайлед) является сравнительно новым противовоспалительным препаратом, напоминающим по механизму действия интал, но совершенно иной химической природы.
Несмотря на то, что механизм действия тайледа еще недостаточно изучен, удалось установить некоторые преимущества его перед инталом:
1) при ингаляционном пути введения тайлед в 4-10 раз превосходит по действию интал, в связи с этим он применяется в меньших дозах — по 4 мг на ингаляцию; в связи с большей продолжительностью действия ингаляции проводят, как правило, 2 раза, в тяжелых случаях — до 4 раз в сутки. Более выраженное противовоспалительное действие связано со способностью тайледа ингибировать практически все этапы воспалительной реакции на клеточном уровне, то есть с более широким спектром противовоспалительной активности;
2) эффект курсового лечения наступает раньше, примерно через неделю от начала лечения;
3) эффект поддерживающей терапии более выражен, чем у интала;
4) при бронхоспазме, индуцированном неврогенными механизмами и неспецифическими раздражителями, тайлед в адекватных дозах оказался эффективнее интала. Это позволяет предполагать наличие у него иных (помимо ингибирования дегрануляции тучных клеток) механизмов действия.
Эффективность лечения увеличивается при сочетании с в2-агонистами, ксантиновыми препаратами (КП) и ГКС. В большинстве случаев тайлед дает возможность отказаться от бронхолитических препаратов, а у больных с тяжелым течением — снизить дозу ГКС, особенно при их ингаляционном введении.
Тайлед выпускается в аэрозольных ингаляторах, содержащих 112 доз недокромила натрия по 2 мг на одну ингаляцию. Лечение проводят длительно — до 6-12 месяцев и более.
Тайлед не рекомендуется назначать детям до 12 лет, беременным и женщинам в период лактации. В качестве побочных реакций отмечены кашель или бронхоспазм в период ингаляции, головная боль, тошнота, боли в животе, очень редко — аллергические реакции.
Задитен (кетотифен), по мнению участников консенсуса, эффективен лишь у небольшой части больных бронхиальной астмы, главным образом при сочетании с внелегочными проявлениями аллергии (аллергический ринит, конъюнктивит, крапивница, атопический дерматит, алиментарные аллергии).
ГКС являются наиболее эффективными противовоспалительными средствами в лечении БА.
Механизм действия ГКС связан с воздействием на различные звенья патогенеза БА. Они оказывают мощный противовоспалительный эффект, снижают проницаемость сосудов, тормозят синтез и высвобождение медиаторов воспаления, уменьшают миграцию эозинофилов за счет повышения уровня циклических аденозинмонофосфатов (цАМФ) и снижения содержания циклических гуанозинмонофосфатов (цГМФ), улучшают функциональную активность нервных симпатических окончаний. При этом первичным является противовоспалительный эффект, с которым связано снижение реактивности бронхов.
ГКС при бронхиальной астме назначаются местно (ингаляционно), парентерально и внутрь.
Ингаляционные глюкокортикостероиды (ИГКС) занимают исключительно важное место в лечении БА и являются препаратами выбора для больных персистирующей астмой любой степени тяжести.
Они оказывают следующие терапевтические эффекты:
• уменьшают выраженность клинических симптомов заболевания (частоту приступов удушья, потребность в в2-агонистах короткого действия и др.);
• повышают качество жизни больных;
• улучшают бронхиальную проходимость и снижают гиперреактивность бронхов к аллергенам (раннюю и позднюю астматические реакции) и неспецифическим раздражителям (физической нагрузке, холодному воздуху, полютантам, гистамину, метахолину, аденозину, брадикинину);
• предупреждают обострения БА и снижают частоту госпитализаций пациентов;
• уменьшают летальность от астмы;
• предупреждают развитие необратимых изменений (ремоделирования) дыхательных путей.
Эффективность лечения ИГКС тем выше, чем раньше они назначены. Дискуссионным является необходимость использования этих препаратов у больных легкой персистирующей астмой. Международные согласительные документы у таких пациентов рекомендуют применять ингаляционные глюкокортикоиды в низких дозах или кромоны (при аспириновой астме — антилейкотриеновые препараты).
Достоинством кромонов является минимальное число побочных эффектов. По-видимому, ингаляционные глюкокортикоиды показаны больным легкой астмой при недостаточной эффективности других препаратов, обладающих противовоспалительной активностью.
В отличие от пероральных глюкокортикоидов, они имеют следующие преимущества, которые обеспечивают их высокую эффективность и минимальное системное действие:
• высокое сродство к рецепторам;
• выраженная местная противовоспалительная активность;
• более низкие (примерно в 100 раз) терапевтические дозы;
• низкая биодоступность.
В настоящее время в клинической практике используют беклометазона дипропионат (БДП), флунизолид (ФЛУ), будесонид (БУД), флютиказона пропионат (ФП), мометазона фуроат (МФ) и триамцинолона ацетонид (ТАА).
Существующие ИГКС несколько различаются по силе действия и биодоступности после ингаляционного введения, однако при использовании в эквивалентных дозах их эффективность приблизительно одинакова (табл. 4) и, в большей степени, зависит от выбора средств доставки (дозирующие аэрозольные ингаляторы, порошковые ингаляторы, небулайзеры) и привычки пациента.
Таблица 4. Расчетные эквивалентные дозы ингаляционных глюкокортикостероидов (мкг)
| Международное название | Ингаляционное устройство | Торговое название | Низкие дозы | Средние дозы | Высокие дозы |
| Беклометазона дипропионат | ДАИ + спейсер | Беклофорте, Бекотид, Беклоджет Беклазон | 200-500 | 500-1000 | >1000 |
| Будесонид* | ДАИ, ПИ Турбохалер | Будесонид форте Пульмикорт Турбохалер | 200-400 | 400-800 | >800 |
| Суспензия для небулайзера | Пульмикорт* суспензия | ||||
| Флунизолид | ДАИ + спейсер | Ингакорт | 500-1000 | 1000-2000 | >2000 |
| Флутиказона пропионат (ФП) | ДАИ + спейсер | Фликсотид | 100-250 | 250-500 | >500 |
| ПИ Мультидиск | Фликсотид Мультидиск | ||||
| Триамцилон ацетонид | Мультидиск | Азмакорт | 400-1000 | 1000-2000 | >2000 |
Примечание: Обозначения: ДАИ — дозированный аэрозольный ингалятор, ПИ — порошковый ингалятор. * При применении пульмикорта суспензии через небулайзер возможно введение от 250 мкг до 4000 мкг будесонида.
Беклометазона дипропионат (БДП) — синтетический стероидный гормон, не обладающий минералокортикоидным действием; уровень всасывания гормона при использовании терапевтических доз незначителен, с чем связано отсутствие системных побочных эффектов (при дозах до 800-1000 мкг).
Назначают, как правило, по 100 мкг на ингаляцию (2 вдоха по 50 мкг) 4 раза в сутки (400 мкг в сутки), менее надежно введение суточной дозы за 2-3 сеанса; при отсутствии эффекта через неделю дозу увеличивают в 1,5-2,5 раза. При тяжелой форме заболевания рекомендуется сразу начинать с суточной дозы 800 мкг (допустимо увеличение дозы до 1500 мкг).
Выпускаются следующие лекарственные формы: микроаэрозоль во фторуглеродном распылителе по 50, 100, а также по 200 и 250 мкг на 1 вдох, капсулы по 50 мкг; суспензия (в 1 мл 50 мкг); дисковые формы (бекодиски по 100 и 200 мкг, ингалируемые с помощью дискового ингалятора «Дискхалер»). При использовании лекарственных форм по 200-250 мкг ингаляции обычно проводят 2 р/сутки.
Будесонид (пульмикорт) выпускается в капсулах для ингаляций по 200 мкг 2 раза в сутки. При необходимости доза может быть увеличена в 2, максимум в 4 раза. Средняя продолжительность курса лечения составляет 4-8 недель, как правило, с последующим переходом на поддерживающее лечение. Лечение может продолжаться длительное время.
Флунизолид (ингакорт) применяется в виде аэрозолей для ингаляций (1 вдох — 250 мкг). Средняя суточная доза — 1 мг (по 2 вдоха 2 раза в сутки, утром перед завтраком и вечером перед ужином); при недостаточном эффекте через неделю суточную дозу повышают до 1,5-2 мг (по 2 вдоха 3 или 4 раза в сутки). Продолжительность курса лечения — 6-8 недель с последующим переходом на поддерживающее лечение в дозе 0,25-0,5 мг 1 раз в день утром.
При наличии остаточного бронхоспазма для улучшения проникновения препарата до мелких бронхов за 10-15 мин до процедуры проводят ингаляцию в2-агониста.
Для практического врача большой интерес представляет сравнительная оценка механизма действия и лечебного эффекта беклометазон, будесонида и флунизолида. Оказалось, что по механизму действия ингаляционные ГКС не отличаются между собой, различия заключаются в их активности. Так, по мнению ряда авторов, будесонид в терапевтических сопоставимых дозах в 2-3 раза активнее беклометазона. Еще более активным является флунизолид. Это объясняется более выраженным местным действием препарата.
После ингаляции только 39 % флунизолида резорбируется в легких и попадает в общий кровоток, для беклометазона и будесонида эта величина составляет около 70 %. Кроме того, беклометазон представляет собой малоактивную форму лекарства и для достижения полной активности нуждается в гидролизе в области С21.
В легких эти реакции произойти не успевают в полной мере, но зато всосавшееся в легких лекарство при прохождении через печень превращается в активные соединения. Этим объясняется более выраженное системное действие беклометазона. В отличие от этого, флунизолид уже при введении находится в биологически активной форме и оказывает максимальное действие в органе-мишени и значительно менее выраженное — системное действие.
Это позволяет вводить флунизолид в больших дозах и более надежно контролировать тяжелую астму без применения системных стероидов. Указанными выше особенностями химического строения и фармакокинетики объясняются различия безопасных (в смысле системных проявлений) максимальных суточных дозировок ингаляционных ГКС при долговременном их применении.
Для беклометазона и будесонида они составляют 800-1000 мкг, но допустимо повышение дозы до 1500-1600 мкг, для флунизолида — 1-2 мг, но допустимо увеличение дозы до 3-4 мг. Только при увеличении суточной дозы флунизолида до 4 мг и более при длительном применении начинает проявляться угнетающее действие препарата на функцию коры надпочечников. Флунизолид, по-видимому, является наиболее эффективным из ингаляционных ГКС.
Ингаляционные ГКС длительное время использовали как препараты 2-го ряда при неэффективности интала или тайледа и бронхолитиков. В настоящее время в связи с развитием наших знаний о патогенезе бронхиальной астмы отношение к ингаляционным ГКС изменилось: при соответствующих показаниях их стали применять как препараты 1-го ряда. Ингаляционные ГКС предназначаются для длительного курсового применения.
Препараты не используются для купирования острых приступов астмы, поскольку лечебный эффект при любом способе введения ГКС (ингаляционно, внутрь, внутривенно) намечается только через 1-2 часа и достигает максимума через 6-7 часов. Это связано с тем, что ГКС сами по себе не вызывают расширения бронхов, а действуют только на воспалительный процесс и таким путем приводят к бронходилатации.
Терапевтический эффект от курсового лечения начинается через несколько дней (обычно не позже конца 1-й недели) после начала терапии. Эффективность лечения нарастает в течение нескольких недель, достигая максимума через 4-6 недель. После этого препарат принимают в той же дозе еще 1-1,5 месяца, затем переходят на поддерживающую терапию, которую можно проводить до 4-8 и более лет.
У гормонально-зависимых людей назначение ингаляционных ГКС способствует снижению дозировки принимаемых внутрь гормонов вплоть до полной их отмены. При этом ингаляционные ГКС подключают за 7-10 дней до начала снижения дозы ГКС, принимаемых внутрь. Снижение дозы начинают лишь на фоне стабильной фазы БА.
Клинические наблюдения показали, что снижение дозы принимаемого внутрь преднизолона до 15 мг может проводиться сравнительно быстро (на 5 мг каждые 3 дня). После этого доза преднизолона снижается по 2,5 мг в неделю (иногда в 2 недели). При суточной дозе 7,5 мг и ниже снижение дозы должно проводиться еще медленнее: по 2,5 мг каждые 3-4 недели.
Снижение дозы пероральных ГКС на фоне ингаляционного введения гормонов производят при тщательном клиническом контроле за состоянием больного: при ухудшении состояния снижение дозы прекращают или временно повышают дозу на одну ступень. В большинстве случаев на фоне ингаляционного введения ГКС не удается отменить преднизолон внутрь, но примерно у половины больных предоставляется возможность снизить его дозировку.
Часто, когда БА не контролируется назначенными дозами ИГКС, возникает вопрос: следует ли повысить дозу ИГКС либо добавить другое лекарственное средство. Крупные, хорошо спланированные рандомизированные исследования доказали, что добавление пролонгированных в2-агонистов к ИГКС у больных с персистирующей бронхиальной астмы любой степени тяжести является более эффективной схемой терапии по сравнению с увеличением дозы ИГКС, и такая комбинация становитсяновым «золотым стандартом» терапии БА, особенно её тяжёлых форм.
Высокая эффективность при БА комбинированной терапии в2-агонистов длительного действия с ИГКС послужила предпосылкой к созданию фиксированных комбинаций препаратов, таких как будесонид/формотерол (симбикорт) и сальметерол/флутиказон (серетид). Комбинация будесонид/формотерол имеет дополнительные преимущества, поскольку обеспечивает одновременно противовоспалительный эффект и быстрое купирование симптомов за счет входящего в состав быстродействующего формотерола, может приниматься однократно и позволяет назначать гибкие схемы лечения (от 1 до 4 ингаляций в сутки) в зависимости от течения заболевания с помощью одного ингалятора.
Комбинированные лекарственные средства (ЛС) для ингаляционного введения, содержащие в своем составе ГКС и в2-агонисты длительного действия, появились в медицинской практике несколько лет назад. Несмотря на такой короткий срок, они успели занять центральное место в фармакотерапии бронхиальной астмы и являются одними из самых перспективных лекарственных средств в оптимизации лечения больных ХОБЛ.
В частности, широкое применение этих препаратов поддержано в новом издании Глобальной стратегии профилактики и лечения БА.
Метаанализ ряда исследований показал, что у пациентов с недостаточным контролем за симптомами добавление сальметерола к терапии как низкими, так и высокими дозами ГКС способствует большему увеличению функции легких и уменьшению выраженности симптомов, чем увеличение дозы ГКС в два раза. Аналогичные данные получены и при использовании другого в2-агониста длительного действия — формотерола, применение которого позволяет снизить дозу ингаляционных ГКС более чем на 60 %.
Использование комбинированных ЛС обладает и другими преимуществами. При назначении ГКС и в2-агонистов в виде одной ингаляции препараты обладают большей эффективностью, чем при их применении по отдельности. При комбинированном использовании этих ЛС они попадают на одни и те же участки слизистой оболочки, благодаря чему лучше взаимодействуют друг с другом.
Кроме того, комбинированные ЛС обеспечивают лучшую приверженность больных к лечению, а их использование обходится дешевле, чем применение 2 препаратов по отдельности.
По сравнению с в2-агонистами длительного действия, ИГКС обладают значительно большей противовоспалительной активностью, но не влияют непосредственно на тонус бронхов. С другой стороны, ИГКС увеличивают количество активных в2-адренорецепторов в бронхах, благодаря чему усиливается бронхолитическое действие эндогенных катехоламинов и в2-агонистов. Применение ИГКС препятствует снижению чувствительности вплоть до развития блокады в2-рецепторов, которая может возникнуть при многократном применении в2-агонистов.
Противовоспалительные эффекты пролонгированных в2-агонистов, в сравнении с действием ИГКС, следует расценивать как незначительные. Однако применение этих лекарственных средств при бронхообструктивном синдроме приводит к существенно более быстрому улучшению бронхиальной проходимости за счет непосредственного воздействия на мышечный слой бронхов. Улучшение показателей спирометрии отмечается уже через несколько минут после назначения в2-агонистов (формотерола), в то время как положительное влияние ИГКС наблюдается только к концу первых суток лечения.
При БА комбинированная терапия способна значительно улучшить функцию легких, уменьшить число ночных симптомов, снизить потребность в в2-агонистах короткого действия и число обострений. Эти данные позволяют рекомендовать комбинированную терапию всем больным бронхиальной астмой, начиная с легкого персистирующего варианта течения.
Лекарственные средства, имеющие в своем составе сальметерол (серетид), должны использоваться только в качестве средств базисной терапии (1 или 2 приема в сутки). Это связано с тем, что бронхолитический эффект сальметерола начинается лишь через 20-30 минут после ингаляции, в связи с чем серетид не может использоваться для купирования приступа БА. Следует помнить, что, если в процессе лечения возникает необходимость увеличения дозы ГКС, больному следует назначить препарат, в составе которого имеется большая доза ГКС. Увеличивать дозу ГКС за счет более частого (более 2 раз в сутки) назначения серетида не следует из-за возможного риска передозировки сальметерола.
Препарат, имеющий в своем составе формотерол (симбикорт), может использоваться как для базисной терапии, так и (при необходимости) для купирования приступа БА. В отличие от лекарственных средств, содержащих сальметерол, симбикорт можно назначать чаще, 2 раз в день, при этом повышение дозы ГКС будет сопровождаться увеличением дозы формотерола, что обеспечивает усиление бронхолитического действия этого препарата. Комбинация будесонид/формотерол (симбикорт ) позволяет также более гибко дозировать препарат с помощью одного и того же ингалятора, увеличивая или уменьшая дозу от 1 до 4 вдохов в сутки, в зависимости от течения заболевания, вплоть до однократного приема при достижении стабильного состояния.
Таким образом, при использовании ингаляционных глюкокортикоидов необходимо руководствоваться следующими правилами:
1. Начинать лечение этими средствами нужно с максимальной дозы (в зависимости от тяжести течения астмы) с последующим ее постепенным снижением до минимально необходимой. Несмотря на быструю положительную динамику клинических симптомов, улучшение показателей бронхиальной проходимости и гиперреактивности бронхов происходит более медленно. Обычно для достижения стойкого эффекта терапии требуется не менее 3 месяцев, после чего доза препарата может быть уменьшена на 25 %.
2. Лечение ингаляционными стероидами должно быть длительным (не менее 3 месяцев) и регулярным.
3. Комбинация пролонгированных в2-адреномиметиков, антилейкотриеновых препаратов или препаратов теофиллина длительного действия с ингаляционными стероидами по эффективности превосходит увеличение дозы последних. Использование такой терапии позволяет снизить дозу топических глюкокортикоидов. В последние годы в клиническую практику введены фиксированные комбинации лекарственных препаратов: флутиказон/сальметерол (серетид), будесонид/формотерол (симбикорт), которые показаны при бронхиальной астме средней тяжести и тяжелого течения.
4. Применение ингаляционных стероидов позволяет уменьшить дозу таблетированных глюкокортикоидов. Установлено, что 400-600 мкг/сут бекламетазона дипропионата эквивалентны 5-10 мг преднизолона, принимаемых per os. Следует помнить, что клинический эффект отчетливо проявляется на 7-10-й день использования ингаляционных глюкокортикоидов. При их одновременном применении с таблетированными препаратами дозу последних можно начинать снижать не ранее этого срока.
5. При стабильном течении БА ингаляционные глюкокортикоиды применяют 2 раза в день. Будесонид у больных БА легкой и средней тяжести течения в фазе ремиссии может применяться однократно. При обострении кратность приема повышают до 2-4 раз в сутки. Подобный прием позволяет добиваться более высокого комплаенса.
6. Высокие дозы ИГКС могут быть использованы вместо системных стероидов для лечения и профилактики обострений астмы.
Побочные эффекты при ингаляционной терапии ГКС наблюдаются редко. Их можно разделить на местные и системные. Побочные эффекты зависят, главным образом, от дозы и длительности использования лекарственного средства, однако некоторые больные, по-видимому, более предрасположены к их развитию.
Местные побочные эффекты возникают вследствие оседания частиц ингаляционных глюкокортикоидов в ротоглотке и проявляются охриплостью голоса (дисфонией), кандидозом ротоглотки, раздражением глотки и кашлем.
Возможность развития кандидозного стоматита связана с тем, что только малая часть ингалируемых ГКС достигает легких. Большая их часть (около 90 %) оседает в полости рта и верхних дыхательных путях. Для предупреждения кандидозной инфекции рекомендуется полоскание рта и глотки после ингаляции, а также использование спейсера, препятствующего оседанию лекарства на слизистой оболочке полости рта, мягкого и твердого нёба. Эти простые мероприятия уменьшают также поступление лекарственного вещества в желудок за счет проглатывания, что способствует уменьшению системного действия.
Охриплость голоса связана с обратимой миопатией мышц гортани и исчезает после прекращения приема препарата. Причина развития этого осложнения неизвестна. Чаще развивается у людей, чья профессия связана с повышенной голосовой нагрузкой (певцы, лекторы, педагоги, дикторы и др.). Для лечения дисфонии используют снижение голосовой нагрузки; замену дозированных ингаляторов на порошковые; уменьшение дозы ингаляционных стероидов (в фазе ремиссии).
Кашель и раздражение глотки обусловлены воздействием примесей, которые содержатся в дозирующих ингаляторах; они реже возникают при использовании порошковых ингаляторов.
Системные побочные эффекты обусловлены всасыванием ингаляционных глюкокортикоидов из желудочно-кишечного тракта (после заглатывания) и дыхательных путей. Фракция кортикостероида, попадающая в желудочно-кишечный тракт, снижается при использовании спейсера и при полоскании ротовой полости после процедуры.
Выраженность системных побочных эффектов значительно меньше, чем при использовании системных глюкокортикостероидов, и они практически не отмечаются при использовании ингаляционных ГКС в дозе менее 400 мкг/сутки у детей и 800 мкг/сутки у взрослых. Тем не менее возможные побочные эффекты могут проявляться следующим образом: подавлением функции коры надпочечников, быстрым возникновением синяков, истончением кожи, остеопорозом, развитием катаракты, задержкой роста у детей (хотя до настоящего времени не получено убедительных данных о влиянии ингаляционных ГКС на задержку роста у детей и развитие остеопороза у взрослых).
Относительным противопоказанием для ингаляционных ГКС является туберкулез легких. К относительному противопоказанию пока относят и возраст до 6 лет, поскольку нет достаточного опыта по применению препарата в детском возрасте. С известной осторожностью проводят лечение беременных (до 3 месяцев) и кормящих матерей (передается с молоком матери).
Регулярный приём системных глюкокортикоидов показан больным с тяжелым течением бронхиальной астмы при неэффективности высоких доз ингаляционных ГКС в сочетании с регулярным приёмом броходилятаторов. Для длительной терапии системными ГКС рекомендуется использовать препараты преднизолоновой (преднизон, преднизолон, метилпреднизолон, метипред) и триамцинолоновой групп (триамцинолон, берликорт, кенокорт, полькортолон). Схемы ведения больных, находящихся на гормональной терапии, различаются в зависимости от её продолжительности.
При очень тяжелых формах заболевания используется внутривенное введение ГКС. Вначале назначаются высокие (адекватные тяжести состояния) дозы ГКС с последующим их снижением, которое проводится индивидуально в зависимости от степени чувствительности к препарату, тяжести заболевания, выраженности обострения, характера сопутствующих заболеваний.
Необходимая лечебная концентрация достигается при введении 1-2 мг/кг преднизолона (или адекватного количества других гормонов) с интервалами в 4-6 часов. В такой дозировке ГKC назначаются в течение 3-4 дней, а затем, по мере затухания обострения и уменьшения явлений обструкции, постепенно, в течение 5-6 дней дозы ГКС снижают вплоть до полной их отмены или перевода больного на поддерживающие дозы, вводимые перорально или ингаляционно в сочетании с другими противоастматическими препаратами.
В некоторых случаях при выраженном обострении БА более эффективен пероральный приём ГКС в первоначальной дозе 30-40 мг/сутки или эквивалентной дозе других гормональных препаратов в течение 7-10 дней до получения и закрепления клинического эффекта. Больной принимает препарат в два приёма: утром после завтрака 3 /4 суточной дозы и после обеда 1 /4 суточной дозы.
После достижения клинического эффекта дозу препарата можно снижать по 1 /2 таблетки в 3 дня; при уменьшении дозы до 10 мг (2 таблетки) преднизолона снижение дозировки лекарства следует проводить менее активно: по 1 /4 таблетки в 3 дня до полной отмены препарата или сохранения поддерживающей дозы (2,5-10 мг/сутки). При снижении дозы системных глюкокортикоидов больным БА рекомендуется добавлять ингаляционные глюкокортикоиды в средней терапевтической дозе (800-1000 мкг/сутки).
Если пациент раньше получал гормональную терапию (не менее 6 месяцев), снижение начальной дозы преднизолона (20-40 мг/сутки) проводится медленнее: по 1 /2 таблетки в 7-14 дней, а затем по 1 /4 таблетки в 7-14 дней вплоть до полной отмены или сохранения поддерживающей дозы препарата.
При наиболее тяжелом течении заболевания с самого начала назначают комбинированное лечение, включающее пероральное и ингаляционное применение ГКС (см. выше). Это позволяет при продолжении ингаляционной терапии чаще добиваться полной отмены ГКС внутрь или снижения поддерживающей дозы.
Побочные эффекты при длительном применении системных ГКС значительно более выражены, чем при лечении ингаляционными ГКС, и включают: остеопороз, кушингоидный синдром, артериальную гипертензию, сахарный диабет, подавление активности гипоталамо-гипофизарно-надпочечниковой системы, катаракту, глаукому, истончение кожи с образованием стрий и повышенной капиллярной проницаемостью (склонностью к образованию синячков), мышечную слабость.
Кроме того, могут развиваться эрозивный гастрит или язвы желудка («немые», безболевые язвы), клинически проявляющиеся кровотечениями, а у детей может отмечаться замедление роста. К редким осложнениям относятся психические нарушения: острые психозы, эйфория, депрессия, маниакальные состояния.
Для профилактики и лечения осложнений гормональной терапии необходимо снижение дозы препарата до минимальной. Показана диета, включающая молочные продукты с высоким содержанием кальция (творог, сыр), использование препаратов кальцитонина (миокальцик), препаратов кальция, анаболических стероидов (ретаболил и т.д.), а также других лекарств, рекомендуемых для лечения остеопороза. Кроме того, по показаниям используются препараты для противоязвенной терапии, улучшающие микроциркуляцию, антигипертензивные и т.д.
У некоторых больных, получающих длительную терапию системными ГКС, развивающиеся серьёзные побочные эффекты являются показанием для использования препаратов, позволяющих снизить потребность в глюкокортикоидах. Однако эти лекарственные средства зачастую сами несут высокий риск развития серьёзных побочных эффектов и поэтому назначаются только в случае тяжелых негативных влияний глюкокортикоидной терапии. К этим лекарственным средствам относятся метотрексат (в небольших дозах — 15 мг в неделю внутрь или в/м), препараты золота, циклоспорин А и препарат, содержащий антитела к иммуноглобулину Е — омализумаб.
Саперов В.Н., Андреева И.И., Мусалимова Г.Г.
источник