В 1859 английский врач Генри Солтер (Henry Salter) сообщил о любопытном наблюдении: приступы бронхиальной астмы быстро проходят в условиях внезапной опасности или очень сильного эмоционального возбуждения. Возможно, это первое описание лечебного воздействия эндогенного, т.е. вырабатываемого самим организмом, адреналина. В основе астматического приступа лежит сокращение гладкомышечных клеток бронхов, что приводит к их спазму (сужению). В результате возникает затрудненное свистящее дыхание. Адреналин воздействует на β2-адренорецепторы бронхиальных гладкомышечных клеток, что приводит к расслаблению мышечного слоя и расширению бронхов с облегчением дыхания. Сейчас это известно каждому студенту первого курса медицинского университета, однако всего 130 лет назад о существовании адреналина не подозревал никто, над открытием этого вещества работали лучшие умы своего времени.
Хотя уже врачи древнего Египта и Гиппократ (около 450 г. до н.э.) описывали бронхиальную астму (название «астма» произошло от греческого слова aazein — удушье), до конца XIX в. н.э. не было эффективных средств для купирования (прекращения) астматических приступов. В 1894 г. английский врач Георг Оливер (George Oliver) и физиолог Эдвард Шефер (Edward Schafer) поставили эксперимент с помощью собранного вручную оборудования, в котором показали, что экстракт мозгового слоя надпочечника (органа, расположенного непосредственно над почками, отсюда и название) приводит к выраженному увеличению частоты сердечных сокращений и повышению артериального давления у животных. Благодаря их открытию, вырабатываемое надпочечниками вещество заинтересовало научную общественность. Оливер и Шефер провели серию опытов для выяснения природы активного вещества в составе экстракта надпочечников. Их исследования явились прекрасным фундаментом для дальнейшей работы в этом направлении, за которую взялся американский биохимик и фармаколог Джон Джекоб Абель (John Jacob Abel) из балтиморского университета Джона Хопкинса. В 1899 г. Абель выделил активное вещество из экстракта надпочечников – эпинефрин (от греческих слов epi- — над, nephros – почка).

Джон Джекоб Абель (1857-1938)
Американский биохимик Джокичи Такамине (Jokichi Takamine) смог получить вещество в чистом стабильном кристаллическом виде и назвал его адреналином (от латинских слов ad – в дополнение, ren – почка). В 1901 г. Олдрич (Aldrich) определил химическую формулу адреналина C9H13NO3, очищенная субстанция была запатентована фирмой Parke-Davis & Company.

Джокичи Такамине (1854-1922)
К этому времени в результате множества экспериментов на животных стало очевидно, что адреналин оказывает мощное физиологическое действие, вызывая спазм мелких артерий, повышение артериального давления и увеличение частоты сердечных сокращений. В качестве лекарственного средства адреналин впервые применил профессор Соломон Солим-Кохен (Solomon Solis-Cohen) в 1900-х годах для лечения бронхиальной астмы. Он сообщил, что прием внутрь сушеных надпочечников прекращает астматический приступ, и объяснил это спазмом (сужением) бронхиальных сосудов под действием адреналина. Такая гипотеза отлично согласовывалась с популярной в то время теорией, согласно которой бронхиальная астма развивалась в связи с расширением сосудов, что приводило к отеку слизистой оболочки бронхов и уменьшению их просвета. Эту идею поддержали Джесс Буллова (Jesse Bullowa) и Дэвид Каплан (David Kaplan, Нью-Йорк), которые успешно купировали астматические приступы подкожными инъекциями чистого адреналина. В 1907 году появились данные о том, что адреналин расслабляет гладкомышечные клетки бронхов, благодаря чему возникла бронхоспастическая теория развития бронхиальной астмы. Таким образом, изучение эффектов адреналина способствовало пониманию патогенеза бронхиальной астмы, т.е. механизмов, лежащих в основе патологического процесса.
В 1905 году британские физиологи Вльям Бэйлис (William Bayliss) и Эрнест Старлинг (Ernest Starling) высказали идею о существовании веществ, которые образуются (синтезируются) в одном органе, выделяются в кровоток и воздействуют на другие органы. Таким образом, была заложена основа эндокринологии – учения о железах внутренней секреции и продуцируемых ими гормонах. Анализ действия адреналина, выделяемого надпочечниками и действующего, как минимум, на сердце, сосуды и бронхи, позволил отнести его к гормонам. Эту теорию развил американский физиолог Вальтер Кэннон, который утверждал, что эндокринная система играет важнейшую роль в поддержании гомеостаза, т.е. постоянства внутренней среды, и в регуляции работы всех органов. Британский физиолог Джон Ленгли (John Langley) и врач и физиолог Томас Эллиотт (Thomas Elliott) заложили основу учения о рецепторах – особых структурах в составе живых клеток, с которыми связываются биологически активные вещества и лекарства и через которые реализуется их эффект. Ленгли обратил внимание, что эффекты адреналина сопоставимы с результатами электрической стимуляции симпатических нервов, т.е. адреналин является симпатомиметиком. На самом деле нервными окончаниями симпатических нервов выделяется норадреналин – еще один симпатомиметик. Так была установлена тесная взаимосвязь между нервной и эндокринной регуляцией внутренних органов.
Адреналин активно использовался в медицинских целях еще до полной расшифровки механизмов его действия. В 1904 году немецкий химик Фридрих Штольц (Friedrich Stolz) впервые синтезировал искусственный адреналин – его кетоновую форму (адреналон), а в 1906 году – собственно адреналин. Активность искусственного адреналина оказалась выше очищенного экстракта надпочечников. Далее врачи стали искать оптимальный путь введения препарата. Parke-Davis & Companyв в 1909 году разработала ампульную форму выпуска адреналина для подкожного введения, фиксированная доза препарата в ампуле позволяла точно дозировать лекарство. В 1920 году в одном из старейших и самых авторитетных медицинских журналов The Lancet была опубликована статья Брайана Мелланда (Brian Melland), в которой он описал случай успешного применения адреналина у больной 30 лет. Она страдала бронхиальной астмой в течение 6 лет, болезнь проявлялась «ночными атаками спазма бронхов». Инъекции адреналина за неделю привели к полному купированию симптомов, а продолжение лечения в течение 5 недель значительно уменьшили частоту приступов. Мелланд также отметил, что адреналин был неэффективен при приеме внутрь.
В 1910 году Баргер (Barger) и (Дейл) применили адреналин в виде аэрозоля для ингаляций и уже в 1913 году Джймс Адам (James Adam), автор руководства по лечению бронхиальной астмы, отмечал, что такой путь введения адреналина за счет всасывания через слизистую оболочку носа, гортани и трахеи, может быть эффективной альтернативой подкожному введению препарата. В 1930-х годах появились первые электрические небулайзеры, эффективная ингаляционная терапия стала доступна, как в условиях стационара и врачебного кабинета, так и в домашних условиях.
Следует особенно заметить, что наблюдение доктора Солтера, описанное в начале статьи, представляет лишь академический интерес и ни в коем случае не может рассматриваться в качестве метода лечения приступов бронхиальной астмы, равно как адреналин в наши дни не является средством выбора для купирования астматических приступов. Сегодня известно, что в бронхах содержатся в основном β2-адренорецепторы, поэтому для лечения приступов бронхиальной астмы используются лекарства, воздействующие именно на этот тип рецепторов – β2-агонисты, например, сальбутамол. В отличие от адреналина, такие препараты в терапевтических дозах почти не влияют на β1- α-адренорецепторы, поэтому лишены многих побочных эффектов адреналина, в частности, учащенного сердцебиения и повышения артериального давления. Разработаны удобные ингаляторы, которые больные бронхиальной астмой могут носить в кармане и применять по необходимости, совершенствуется технология небулайзерной терапии. Адреналин остается одним из основных средств в арсенале реаниматологов, спасая жизнь больных при различных видах шока, используется врачами разных специальностей для купирования жизнеугрожающих состояний, таких как анафилаксия, для усиления действия местных анестетиков, например, в стоматологии.
Таким образом, на примере открытия и изучения адреналина можно проследить путь от случайного наблюдения до разработки мощных лекарственных средств, что, благодаря усилиям большой группы ученых – химиков, физиологов, врачей, положило начало новым направлениям в медицине – эндокринологии, учению о рецепторах, без которых немыслимы современная медицина и фармакология, а также способствовало пониманию патогенеза бронхиальной астмы, а значит разработке эффективных и безопасных препаратов для лечения этого заболевания.
(Очерк написан на основе статьи Arthur G. Epinephrine: a short history. Lancet Respir Med. 2015 May;3(5):350-1).
источник
Бронхиальная астма — хроническое воспалительное заболевание, которое приводит к разрушению эпителия дыхательных путей. В развитии заболевания существенную роль играют аутоиммунные и аллергические процессы. Характерным проявлением бронхиальной астмы являются приступы удушья (экспираторная одышка), вызываемые спазмом бронхов. Спазм бронхов вызывают в основном лей-котриены С4, D4, Е4 (цистеиниловые лейкотриены), и фактор активации тромбоцитов (ФАТ).
Для купирования приступов бронхиальной астмы ингаляционно применяют (β 2-адреномиметики короткого (около 6 ч) действия — сальбутамол, тербуталин, фенотерол. В качестве побочных эффектов эти препараты могут вызывать тахикардию, тремор, беспокойство.
При остром приступе бронхиальной астмы иногда применяют адреналин или эфедрин, которые вводят под кожу (при подкожном введении адреналин действует 30-60 мин, мало влияя на артериальное давление).
Бронхорасширяющее действие оказывают М-холиноблокаторы, из которых ингаляционно применяют ипратропий.
Эффективным средством для купирования приступов бронхиальной астмы является аминофиллин (эуфиллин), действующее начало которого — теофиллин оказывает миотропное спазмолитическое действие.
Теофиллин относится к диметилксантинам. Сходен по свойствам с кофеином (триметилксантин), оказывает более выраженное спазмолитическое действие.
Механизм бронхорасширяющего действия теофиллина:
I) ингибирование фосфодиэстеразы (повышение уровня цАМФ, активация протеинкиназы, фосфорилирование и снижение активности киназы легких цепей миозина и фосфоламбана, снижение уровня цитоплазматического Са 2+ );
2) блок аденозиновых A1-рецепторов (при возбуждении адено-зином этих рецепторов угнетается аденилатциклаза и снижается уровень цАМФ).
Кроме того, в связи с ингибированием фосфодиэстеразы и повышением уровня цАМФ теофиллин снижает секрецию медиаторов воспаления из тучных клеток.
Для купирования приступов бронхиальной астмы аминофиллин вводят внутримышечно или внутривенно.
Побочные эффекты аминофиллина: возбуждение, нарушения сна, сердцебиение, аритмии. При внутривенном введении возможны боли в области сердца, снижение артериального давления.
Для систематической профилактики приступов бронхиальной астмы рекомендуют (β 2-адреномиметики длительного действия — кленбутерол, салметерол, формотерол (действуют около 12 ч), а также аминофиллин в таблетках и М-холиноблокаторы.
Только профилактически применяют в виде ингаляций стабилизаторы мембран тучных клеток — недокромил и кромоглициевую кислоту (кромолин-натрий, интал), которые препятствуют деграну-ляции тучных клеток. Препараты не эффективны для купирования приступов бронхиальной астмы.
Для систематической профилактики приступов бронхиальной астмы внутрь назначают блокаторы лейкотриеновых рецепторов — зафирлукаст (аколат) и монтелукаст (сингуляр). Эти препараты препятствуют воспалительному и бронхоконстрикторному действию ци-стеиниловых лейкотриенов (С4, D4, E4).
При бронхиальной астме бронхорасширяющие препараты действуют как симптоматические средства и не замедляют развития заболевания. Так как бронхиальная астма — воспалительное заболевание, патогенетическое действие оказывают глюкокортикоиды (стероидные противовоспалительные средства). Чтобы уменьшить системные побочные эффекты глюкокортикоидов, ингаляционно назначают препараты, которые плохо всасываются через эпителий дыхательных путей — беклометазон, будезонид, флутиказон, флуни-золид.
Нестероидные противовоспалительные средства (ацетилсалициловая кислота, диклофенак, ибупрофен и др.) могут ухудшить состояние больных бронхиальной астмой, так как ингибируют циклооксигеназу, в связи с чем активируется липоксигеназный путь превращений ара-хидоновой кислоты (рис. 62) и увеличивается образование лейкотриенов.
Средства, влияющие на сердечно-сосудистую систему
источник
Исходя из патогенеза бронхиальной астмы, в борьбе с астматическими проявлениями применяют бронхорасширяющие средства и противовоспалительные препараты.
Адреномиметики при бронхиальной астме быстро снимают симптомы удушья. Следует помнить, что все бронхолитики обладают симптоматическим действием.
То, насколько часто они используются, будет индикатором эффективности основной, базисной терапии.
Итак, адреномиметики — обширная группа лекарственных средств, оказывающих стимулирующее воздействие на адренорецепторы. Адренорецепторы локализуются во всех тканях организма — они встроены в клеточные мембраны, представляют собой особые белковые молекулы.
Эффект адреномиметиков определяется воздействием на рецепторы, что приводит к определенным метаболическим изменениям. В итоге может возникать спазм или расширение сосудов и т. д.
Адреномиметики оказывают стимулирующее воздействие на адренорецепторы, подобное действию адреналина и норадреналина. Когда молекула агониста соединяется с рецептором на поверхности клетки, происходит взаимодействие с регуляторным белком.
Этот белок способствует активации особого фермента, стимулирующего синтез аденозинмонофосфата — вещества, участвующего в передаче сигналов в клетке. Вследствие этого в клетке происходят определенные химические процессы, в результате которых изменяется концентрация кальция.
На этот процесс реагирует гладкая мускулатура различных органов, расслабляясь или сокращаясь.
Эффект действия препаратов зависит от типа рецепторов, на которые осуществляется воздействие.
Хотя адренорецепторы бывают 5 типов, мы остановимся только на бета1- и бета2-адренорецепторах, раз речь идет об астме.
Итак, бета1-адренорецепторы локализованы в сердце, и их стимулирование приводит к увеличению ЧСС, повышению артериального давления. Также они находятся в почках.
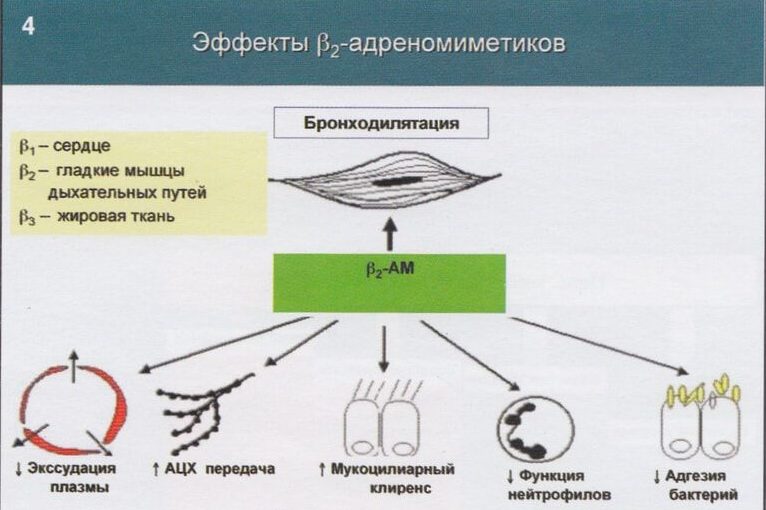
Бета-2-адренорецепторы локализуются в бронхах, скелетной мускулатуре, сосудах, сердце и других органах. Эффектом их стимуляции будет расслабление гладкой мускулатуры бронхов, снятие спазма, расширение просвета бронхиального дерева.
При астме адреномиметики оказывают симптоматический эффект и используются для купирования и предотвращения приступов.
Адреномиметики, применяемые при бронхиальной астме, разделяются на селективные и неселективные. Первые характеризуются тем, что воздействуют только на бета2-рецепторы, а вторые и на бета1, и на бета2.
При бронхиальной астме бета-агонисты должны воздействовать именно на бронхиальные бета2-рецепторы. Бета2-адреномиметики бывают длительного и короткого действия. Первые обладают пролонгированным эффектом и помогают предупредить ночные приступы, а вторые применяют в качестве средств против обострения астмы.
Следует обратить внимание на то, что адреномиметики, будь то селективные или неселективные, используют только по назначению врача. Если речь идет о адреномиметиках короткого действия, то это экстренные средства, которые ни в коем случае не следует применять бесконтрольно.
Они дают хороший терапевтический эффект, однако могут вызывать побочные явления – аритмию, гипертонический криз или гипотонию и многое другое. Пациентам с сахарным диабетом, артериальной гипертензией, атеросклерозом сосудов головного мозга, заболеваниями щитовидной железы применять такие средства рекомендуется с осторожностью, в той дозе и с той частотой, которую определил врач.
Бета-адреномиметики при бронхиальной астме используются как селективные, так и неселективные. Назначаются селективные адреномиметики короткого действия в форме аэрозоля, что позволяет быстро снять симптомы бронхиальной астмы.
Если ребенок не может в силу возраста использовать ингалятор, применяют специальные приборы для распыления лекарственного раствора — небулайзеры. Дозы препаратов для ингаляции при помощи небулайзера выше.
В больших дозах могут активировать бета1-адренорецепторы, альфа-адренорецепторы в сосудах. Неселективные возбуждают эти рецепторы в любых дозах. С этим связаны побочные эффекты — повышение артериального давления, увеличение ЧСС.
Некоторые селективные антагонисты бета-адренорецепторов:
Как было отмечено выше, бета-адренометики при бронхиальной астме применяют в комбинации с глюкокортикоидами и другими средствами. К средствам длительного действия относят, например, формотерол.
Длительный эффект связан с накоплением вещества в мембранах гладкомышечных клеток. При комбинации с глюкокортикоидами усиливают эффект гормонов, позволяют снизить их дозировку и, соответственно, уменьшить побочные эффекты при использовании для предотвращения ночных приступов, а также проявлений астмы физического напряжения.
Эти препараты не могут использоваться для монотерапии и в качестве экстренных средств для купирования удушья. Также следует избегать резкой отмены таких препаратов.
При применении оптимальных доз адреномиметиков короткого действия бета1-адренорецепторы миокарда практически не стимулируются.
В эту группу входят следующие препараты:
При приступе удушья адреномиметики короткого действия быстро купируют обострение — при ингаляционном введении эффект наблюдается уже спустя четыре минуты и длится на протяжении нескольких часов. Также они применяются для предупреждения проявлений астмы физического усилия.
Препараты этой группы не подходят для профилактического лечения — это средства экстренной помощи, которые действуют непродолжительное время. При частом использовании их эффективность может уменьшиться. Регулярное применение сальбутамола приводит к учащению приступов астмы физического усилия и увеличивает выраженность воспаления.
Для правильного введения лекарства при помощи ингалятора необходимы соответствующие навыки. В противном случае в бронхиальное дерево попадет меньше лекарства, чем требуется.
Неселективные адреномиметики при бронхиальной астме
Стимулируют бета1-, бета2-, альфа-адренергические рецепторы. При бронхиальной астме применяют следующие неселективные адреномиметики:
Как было отмечено выше, неселективные адреномиметики оказывают активное воздействие на сердечно-сосудистую систему даже в небольших дозах, провоцируют повышение артериального давления.
Важно, что для поддержания нормального качества жизни оптимален ступенчатый подход к использованию препаратов, который предполагает повышение доз и увеличение количества приемов по мере усугубления заболевания. Главная цель — контролировать астму, принимая минимальные дозы лекарств.
Если состояние пациента ухудшается, доза и частота приема увеличивается. Если астма хорошо поддается контролю, то доза и частота приема уменьшается. Чтобы перейти с одной ступени на другую, необходимо хорошо контролировать заболевание в течение определенного времени.
Цель лечения — поддерживать нормальное качество жизни, сохранять привычную физическую активность.
Прогноз бронхиальной астмы во многом зависит от того, выполняет ли пациент все предписания, которые касаются как схемы приема препаратов, так и общих правил, знания различий между препаратами базисной и неотложной терапии, профилактических мер.
Даже в период ремиссии в дыхательных путях сохраняется воспалительный процесс, но это не означает, что достичь хорошего самочувствия невозможно. Не стоит надеяться лишь на лекарственные средства: необходимо исключать контакты с аллергенами, соблюдать элиминационные диеты и в целом бережно относиться к своему здоровью.
источник
Механизм действия лекарственных средств, применяемых для купирования приступа бронхиальной астмы изложен в статье «Лечение бронхиальной астмы».
Неселективные адреномиметики оказывают стимулирующее воздействие на бета1- бета2- и альфа-адренергические рецепторы.
Адреналин — является препаратом выбора для купирования приступа бронхиальной астмы в связи с быстрым купирующим эффектом препарата.
У взрослых больных в момент приступа бронхиальной астмы подкожное введение адреналина в дозе 0.25 мг (т.е. 0.25 мл 0.1% раствора) характеризуется следующими особенностями: начало действия — через 15 мин; максимум действия — через 45 мин; длительность действия — около 2.5 ч; максимальная скорость потока воздуха на выдохе (МСПВ) увеличивается на 20%; изменений ЧСС не отмечается; незначительно снижается системное диастолическое артериальное давление.
Инъекция 0.5 мг адреналина приводит к тому же эффекту, но со следующими особенностями: длительность действия возрастает до 3 часов и более; МСПВ увеличивается на 40%; несколько повышается ЧСС.
С. А. Сан (1986) для купирования приступа бронхиальной астмы рекомендует вводить адреналин подкожно в следующих дозах в зависимости от массы тела больного:
- меньше 60 кг — 0.3 мл 0.1% раствора (0.3мг);
- 60-80 кг- 0.4 мл 0.1% раствора (0.4мг);
- больше 80 кг — 0.5 мл 0.1% раствора (0.5 мг).
При отсутствии эффекта введение адреналина в той же дозе повторяется через 20 мин, повторно можно ввести адреналин не более 3 раз.
Подкожное введение адреналина является средством выбора для начальной терапии больных в момент приступа бронхиальной астмы.
Введение адреналина не рекомендуется пожилым больным, страдающим ИБС, гипертонической болезнью, паркинсонизмом, токсическим зобом в связи с возможным повышением АД, тахикардией, усилением тремора, возбуждением, иногда усугублением ишемии миокарда.
Эфедрин — также может применяться для купирования приступа бронхиальной астмы, однако действие его менее выражено, начинается через 30-40 мин, но длится несколько дольше, до 3-4 ч. Для купирования бронхиальной астмы вводится подкожно или внутримышечно по 0.5-1.0 мл 5% раствора.
Эфедрин не следует применять у тех больных, которым противопоказан адреналин.
Селективные или частично селективные бета2-адреностимуляторы
Препараты этой подгруппы избирательно стимулируют бета2-адренорецепторы и вызывают расслабление бронхов, не стимулируют или почти не стимулируют бета1-адренореццепторы миокарда (при использовании в допустимых оптимальных дозах).
Алупент (астмопент, орципреналин) — применяется в виде дозированного аэрозоля (1-2 глубоких вдоха). Действие начинается через 1-2 мин, полное купирование приступа происходит через 15-20 мин, продолжительность действия около 3 часов. При возобновлении приступа ингалируется та же доза. В течение суток можно пользоваться алупентом 3-4 раза. Для купирования приступа бронхиальной астмы можно использовать также подкожное или внутримышечное введение 1 мл 0.05% раствора алупента, возможно и внутривенное капельное введение (1 мл 0.05% раствора в 300 мл 5% раствора глюкозы со скоростью 30 кап/мин).
Алупент является частично селективным бета2-адреностимулятором, поэтому при частых ингаляциях препарата возможны сердцебиение, экстрасистолия.
Сальбутамол (вентолин) — применяется для купирования приступа бронхиальной астмы, используется дозированный аэрозоль — 1-2 вдоха. В тяжелых случаях при отсутствии эффекта через 5 мин можно сделать еще 1-2 вдоха. Допустимая суточная доза — 6-10 разовых ингаляционных доз.
Бронходилатирующее действие препарата начинается через 1-5 мин. Максимум эффекта наступает через 30 мин, продолжительность действия — 2-3 ч.
Тербуталин (бриканил) — селективный бета2-адреностимулятор, применяется для купирования приступа бронхиальной астмы в виде дозированного аэрозоля (1-2 вдоха). Бронхорасширяющее действие отмечается через 1-5 мин, максимум через 45 мин (по некоторым данным через 60 мин), длительность действия — не менее 5 часов.
Значительного изменения ЧСС и систолического артериального давления после ингаляций тербуталина нет. Для купирования приступа бронхиальной астмы можно применять также внутримышечно — 0.5 мл 0.05% раствора до 4 раз в день.
Инолин — селективный бета2-адреностимулятор, применяется для купирования приступа бронхиальной астмы в виде дозированных аэрозолей (1-2 вдоха), а также подкожно — 1 мл (0.1 мг).
Ипрадол — селективный бета2-адреностимулятор, применяется для купирования приступа бронхиальной астмы в виде дозированного аэрозоля (1-2 вдоха) или внутривенно капельно 2 мл 1% раствора.
Беротек (фенотерол) — частично селективный бета2-адреностимулятор, применяется для купирования приступа бронхиальной астмы в виде дозированного аэрозоля (1-2 вдоха). Начало бронходилатирующего действия наблюдается через 1-5 мин, максимум действия — через 45 мин, продолжительность действия — 5-6 ч (даже до 7-8 часов).
Ю.Б.Белоусов (1993) рассматривает беротек как препарат выбора в связи с достаточной длительностью действия.
Беродуал — сочетание бета2-адреностимулятора фенотерола (беротека) и холинолитика ипрапропиума бромида, являющегося производным атропина. Выпускается в виде дозированного аэрозоля, применяется для купирования приступа бронхиальной астмы (1-2 вдоха), при необходимости препарат можно ингалировать до 3-4 раз в день. Препарат обладает выраженным бронходилатирующим эффектом.
Дитек — комбинированный дозированный аэрозоль, состоящий из фенотерола (беротека) и стабилизатора тучных клеток — интала. С помощью дитека можно купировать приступы бронхиальной астмы легкой и средней степени тяжести (1-2 вдоха аэрозоля), при отсутствии эффекта ингаляцию можно повторить через 5 мин в той же дозе.
Применение бета1, бета2-адреностимуляторов
Изодрин (изопротеренол, новодрин) — стимулирует бета1- и бета2-адренорецепторы и таким образом расширяет бронхи и повышает частоту сокращений сердца. Для купирования приступа бронхиальной астмы применяется в виде дозированных аэрозолей по 125 и 75 мкг в одной дозе (1-2 вдоха), максимальная суточная доза — 1-4 вдоха 4 раза в сутки. В некоторых случаях возможно увеличения числа приемов до 6-8 раз в сутки.
Следует помнить, что в случае передозировки препарата возможно развитие тяжелых аритмий. Нецелесообразно применение препарата при ИБС, а также при выраженной хронической недостаточности кровообращения.
Если спустя 15-30 мин после применения адреналина или других стимуляторов бета2-адренорецепторов приступ бронхиальной астмы не купируется, следует приступить к внутривенному введению эуфиллина.
Как указывает М.Э.Гершвин, эуфиллин играет центральную роль в терапии обратимого бронхоспазма.
Эуфиллин выпускается в ампулах по 10 мл 2.4% раствора, т.е. в 1 мл раствора содержится 24 мг эуфиллина.
Эуфиллин вводится внутривенно вначале в дозе 3 мг/кг, а затем производится внутривенное вливание поддерживающей дозы со скоростью 0.6 мг/кг/ч.
По данным СА.Сана (1986), эуфиллин надо вводить внутривенно капельно:
- в дозе 0.6 мл/кг в 1 ч больным, получавшим ранеетеофиллин;
- в дозе 3-5 мг/кг на протяжении 20 мин лицам, не получавшим теофиллин, а затем переходят на поддерживающую дозу (0.6 мг/кг в 1 ч).
Внутривенно капельно эуфиллин вводится до улучшения состояния, но под контролем концентрации теофиллина в крови. Величина терапевтической концентрации теофиллина в крови должна быть в пределах 10-20 мкг/мл.
К сожалению, на практике далеко не всегда возможно определить содержание теофиллина в крови. Поэтому следует помнить, что максимальная суточная доза эуфиллина составляет 1.5-2 г (т.е. 62-83 мл 2.4% раствора эуфиллина).
Для купирования приступа бронхиальной астмы далеко не всегда приходится вводить эту суточную дозу эуфиллина, такая необходимость возникает при развитии астматического статуса.
При отсутствии возможности определять концентрацию теофиллина в крови и отсутствии автоматизированных систем — насосов, регулирующих введение лекарства с заданной скоростью, можно поступить следующим образом.
Приступ бронхиальной астмы у больного массой 70 кг, не получавшего теофиллин.
Вначале водим внутривенно эуфиллин в дозе 3 мг/кг, т.е. 3×70= 210 мг (примерно 10 мл 2.4% раствора эуфиллина), в 10-20 мл изотонического раствора натрия хлорида очень медленно в течение 5-7 мин или внутривенно капельно в течение 20 мин.
После этого переходим на внутривенное вливание поддерживающей дозы 0,6 мг/кг/ч, т.е. 0,6 мг χ 70 = 42 мг/ч, или приблизительно 2 мл 2.4% раствора в час (4 мл 2.4% раствора в 240 мл изотонического раствора натрия хлорида со скоростью 40 капель в мин).
При отсутствии эффекта от эуфиллина в течение 1-2 ч от начала введения вышеуказанной поддерживающей дозы, начинают лечение глюкокортикоидами. Вводится внутривенно струйно 100 мг водорастворимого гидрокортизона (гемисукцината или фосфата) или 30-60 мг преднизолона, иногда через 2-3 ч приходится вводить их повторно.
При отсутствии эффекта после введения преднизолона можно снова вводить эуфиллин, применить бета2-адреностимуляторы в ингаляциях. Эффективность этих средств после применения глюкокортикоидов часто возрастает.
Ингаляции кислорода способствуют купированию приступа бронхиальной астмы. Увлажненный кислород ингалируется через носовые катетеры со скоростью 2-6 л/мин.
Вибрационной массаж грудной клетки и точечный массаж можно применить в комплексной терапии приступа бронхиальной астмы для получения более быстрого эффекта от других мероприятий.
С. А. Сан (1986) рекомендует следующие мероприятия:
- Ингаляции кислорода через носовой катетер по 2-6 л/мин (кислород можно давать и через маску).
- Назначение одного из бета-адренергических препаратов:
- адреналин подкожно;
- тербуталина сульфат подкожно;
- ингаляции орципреналина.
- Если через 15-30 мин не наступает улучшения, повторяют введение бета-адренергических веществ.
- Если спустя еще 15-30 мин не наступает улучшения, налаживают внутривенное капельное вливание эуфиллина.
- Отсутствие улучшения в течение 1-2 ч после начала введения эуфиллина требует дополнительного введения атропина или атровента в ингаляциях (больным с умеренным кашлем) или кортикостероидов внутривенно
- Продолжать ингаляции бета-адренергических веществ и внутривенное введение эуфиллина.
Лечение астматического статуса
Астматический статус (АС) — это синдром острой дыхательной недостаточности, развивающийся вследствие резко выраженной бронхиальной обструкции, резистентной к стандартной терапии.
Общепринятого определения астматического статуса не существует. Наиболее часто астматический статус развивается при бронхиальной астме, обструктивном бронхите. С учетом этиологии и проводимых до развития астматического статуса лечебных мероприятий можно привести и другие определения астматического статуса.
Согласно С. А. Сану (1986), астматическим статусом называют острый приступ астмы, при котором лечение бета-адренергическими средствами, вливанием жидкостей и эуфиллином неэффективно. Развитие астматического статуса требует также применения других методов лечения в связи с возникновением непосредственной и серьезной угрозы для жизни.
По Хитлари Дону (1984), астматический статус определяется как выраженное, потенциально опасное для жизни ухудшение состояния больного бронхиальной астмой, которое не поддается общепринятой терапии. Эта терапия должна включать три подкожных инъекции адреналина с 15-минутными интервалами.
В зависимости от патогенетических особенностей астматического статуса различают три его варианта:
- Медленно развивающийся астматический статус, обусловленный нарастающей воспалительной обструкцией бронхов, отеком, сгущением мокроты, глубокой блокадой бета2-адренорецепторов и выраженным дефицитом глюкокортикоидов, что усугубляет блокаду бета2-адренорецепторов.
- Немедленно развивающийся астматический статус (анафилактический), обусловленный развитием гиперергической анафилактической реакции немедленного типа с высвобождением медиаторов аллергии и воспаления, что приводит к тотальному бронхоспазму и асфиксии в момент контакта с аллергеном.
- Анафилактоидаьй астматический статус, обусловленный рефлекторным холинергическим бронхоспазмом в ответ на раздражение рецепторов дыхательных путей различными ирритантами; высвобождением гистамина из тучных клеток под влиянием неспецифических раздражителей (без участия иммунологических механизмов); первичной гиперреактивностью бронхов.
Все больные в состоянии астматического статуса должны быть немедленно госпитализированы в отделение интенсивной терапии и реанимации.
Лечение медленно развивающегося астматического статуса
I стадия — стадия сформировавшейся резистентности к симпатомиметикам, или стадия относительной компенсации
Применение глюкокортикоидов является обязательным в лечении астматического статуса, как только поставлен диагноз этого угрожающего жизни состояния.
Глюкокортикоиды в этом случае оказывают следующее действие:
- восстанавливают чувствительность бета2-адренорецепторов;
- усиливают бронходилатирующий эффект эндогенных катехоламинов;
- ликвидируют аллергический отек, уменьшают воспалительную обструкцию бронхов;
- снижают гиперреактивность тучных клеток, базофилов и, таким образом, тормозят выделение ими гистамина и других медиаторов аллергии и воспаления;
- устраняют угрозу острой надпочечниковой недостаточности вследствие гипоксии.
Глюкокортикоиды вводятся внутривенно калельно или струйно каждые 3-4 ч.
Н. В. Путова рекомендует применять преднизолон по 60 мг каждые 4 ч до выведения из астматического статуса (суточная доза может достигать 10 мкг/кг массы тела больного).
Согласно рекомендациям Т. А. Сорокиной (1987), начальная доза преднизолона — 60 мг; если в течение ближайших 2-3 ч состояние не улучшается, разовая доза увеличивается до 90 мг или к преднизолону добавляется гидрокортизона гемисукцинат или фосфат внутривенно по 125 мг каждые 6-8 ч.
Если состояние больного с началом лечения улучшается, продолжают вводить преднизолон по 30 мг каждые 3 ч, затем интервалы удлиняются.
В последние годы, наряду с парентеральным введением преднизолона его назначают внутрь по 30-40 мг в сутки.
После выведения из статуса суточную дозу преднизолона ежедневно уменьшают на 20-25%.
В 1987 г. опубликована методика лечения астматического статуса Ю. В. Аншелевича. Начальная доза преднизолона внутривенно — 250-300 мг, после этого продолжается введение препарата струйно каждые 2 ч по 250 мг или непрерывно капельно до достижения дозы 900-1000 мг в течение 6 ч. При сохраняющемся астматическом статусе следует продолжить введение преднизолона по 250 мг каждые 3-4 ч в общей дозе 2000-3500 мг на протяжении 1-2 суток до достижения купирующего эффекта. После купирования астматического статуса дозу преднизолона уменьшают каждые сутки на 25-50% по отношению к исходной дозе.
Эуфиллин является важнейшим лекарственным средством для выведения больного из астматического статуса. На фоне введения глкжокортикоидов бронходила-тирующий эффект эуфиллина возрастает. Эуфиллин, кроме бронходилатирующего эффекта, снижает давление в малом круге кровообращения, уменьшает парциальное давление углекислоты в крови и снижает агрегацию тромбоцитов.
Эуфиллин вводится внутривенно в начальной дозе 5-6 мг/кг (т.е. приблизительно 15 мл 2.4% раствора для человека с массой 70 кг), введение производится очень медленно в течение 10-15 мин, после этого препарат вводится внутривенно капельно со скоростью 0.9 мг/кг в час (т.е. приблизительно 2.5 мл 2.4% раствора в час) до улучшения состояния, а затем такая же доза в течение 6-8 ч (поддерживающая доза).
Внутривенное капельное вливание эуфиллина с вышеназванной скоростью наиболее удобно производить с помощью автоматического дозирующего устройства. При его отсутствии можно просто «подкалывать» в систему каждый час приблизительно 2.5 мл 2.4% раствора эуфиллина или наладить внутривенное капельное вливание эуфиллина 10 мл 2.4% эуфиллина в 480-500 мл изотонического раствора натрия хлорида со скоростью 40 капель в минуту, в этом случае скорость вливания эуфиллина будет приближаться к 0.9 мкг/кг в час.
При оказании помощи больному в состоянии астматического статуса допускается ввести 1.5-2 г эуфиллина в сутки (62-83 мл 2.4% раствора).
Вместо эуфиллина можно вводить аналогичные препараты — диафиллин и аминофиллин.
Проводится с целью гидратации, улучшения микроциркуляции. Эта терапия восполняет дефицит ОЦК и внеклеточной жидкости, устраняет гемоконцентрацию, способствует отхождению и разжижению мокроты.
Инфузионная терапия проводится внутривенным капельным вливанием 5% глюкозы, раствора Рингера, изотонического раствора натрия хлорида. При выраженной гиповолемии, низком Аартериальном давлениицелесообразно введение реополиглкжина. Общий объем инфузионной терапии составляет около 3-3.5 л в первые сутки, в последующие дни — около 1.6 л/м 2 поверхности тела, т.е. около 2.5-2.8 л в сутки. Растворы гепаринизируют (2,500 ЕД гепарина на 500 мл жидкости).
Внутривенные капельные вливания проводят под контролем ЦВД, диуреза. ЦВД не должно превышать 120 мм вод. ст., а темп диуреза должен быть не менее 80 мл/час без применения диуретиков.
При повышении ЦВД до 150 мм водного столба необходимо ввести внутривенно 40 мг фуросемида.
Необходимо также контролировать содержание в крови электролитов — натрия, калия, кальция, хлоридов и при нарушении их уровня производить коррекцию. В частности, во вводимую жидкость надо добавлять соли калия, так как при астматическом статусе часто возникает гипокалиемия, особенно при лечении глюкокортикоидами.
Уже в I стадии астматического статуса у больных имеется умеренная артериальная гипоксемия (РаО260-70 мм рт. ст.) и нормо- или гипокапния (РаСО2 в норме, т.е. 35-45 мм рт. ст. или менее 35 мм рт. ст.).
Купирование артериальной гипоксемии является важнейшей частью в комплексной терапии астматического статуса.
Ингалируется кислородно-воздушная смесь с содержанием кислорода 35-40%, производятся ингаляции увлажненного кислорода через носовые катетеры со скоростью 2-6 л/мин.
Ингаляции кислорода — это заместительная терапия острой дыхательной недостаточности. Она предупреждает неблагоприятные воздействия гипоксемии на процессы тканевого метаболизма.
Весьма эффективна ингаляция гелиокислородной смеси (75% гелия + 25% кислорода) длительностью 40-60 мин 2-3 раза в сутки. Смесь гелия и кислорода за счет более низкой плотности по сравнению с воздухом легче проникает в плохо вентилируемые участки легких, что значительно снижает гипоксемию.
Мероприятия по улучшению отхождения мокроты
Доминирующим патологическим процессом при астматическом статусе является обструкция бронхов вязкой мокротой. Для улучшения отхождения мокроты рекомендуются:
- инфузионная терапия, уменьшающая дегидратацию и способствующая разжижению мокроты;
- внутривенное введение 10% раствора натрия йодида — от 10 до 30 мл в сутки; Т. Сорокина рекомендует вводить его до 60 мл в сутки внутривенно и также принимать внутрь 3% раствор по 1 столовой ложке каждые 2 ч 5-6 раз в день; йодистый натрий является одним из наиболее эффективных муколитических отхаркивающих средств. Выделяясь из крови через слизистую оболочку бронхов, он вызывает их гиперемию, увеличение секреции и разжижение мокроты, нормализует тонус бронхиальных мышц;
- дополнительное увлажнение вдыхаемого воздуха, что способствует разжижению мокроты и ее откашливанию; увлажнение вдыхаемого воздуха производится путем распыления жидкости; можно вдыхать также воздух, увлажненный теплым паром;
- внутривенное или внутримышечное введение ваксам (ласольвана) — по 2-3 ампулы (15 мг в ампуле) 2-3 раза в день, и прием препарата внутрь 3 раза в день по 1 таблетке (30 мг). Препарат стимулирует продукцию сурфактанта, нормализует бронхолегочную секрецию, уменьшает вязкость мокроты, способствует ее отхождению;
- методы физиотерапии, включающие перкуссионный и вибрационный массаж грудной клетки.
В I стадии астматического статуса ацидоз неяркий, компенсированный, поэтому внутривенное введение соды показано не всегда. Однако, если рН крови менее 7.2, целесообразно вводить около 150-200 мл 4% раствора натрия гидрокарбоната внутривенно медленно.
Необходимо регулярно измерять рН крови с целью поддержания его на уровне 7.25.
Применение ингибиторов протеолитических ферментов
В ряде случаев в комплексную терапию астматического статуса целесообразно включать ингибиторы ферментов протеолиза. Эти препараты блокируют действие медиаторов аллергии и воспаления в бронхопульмональной системе, уменьшают отечность бронхиальной стенки. Внутривенно капельно вводится контрикал или трасилол из расчета 1,000 ЕД на 1 кг массы тела в сутки в 4 приема в 300 мл 5% глюкозы.
Гепарин уменьшает опасность развития тромбоэмболии (угроза тромбоэмболии существует в связи с дегидратацией и сгущением крови при астматическом статусе), обладает десенсибилизирующим и противовоспалительным действием, уменьшает агрегацию тромбоцитов, улучшает микроциркуляцию.
Рекомендуется вводить гепарин (при отсутствии противопоказаний) под кожу живота в суточной дозе 20,000 ЕД, распределив ее на 4 инъекции.
Внутривенное введение симпатомиметиков
Как указывалось выше, астматический статус характеризуется резистентностью к симпатомиметикам. Однако однозначного отношения к этим препаратам нет. Н. В. Путов (1984) указывает, что при медикаментозном лечении астматического состояния резко ограничивают или исключают использование адреномиметиков. Г. Б. Федосеев и Г. П. Хлопотова (1988) полагают, что в качестве бронхорасширяющих средств можно применять симпатомиметаки, если нет их передозировки.
С. А. Сан (1986) считает, что вводить бета-адренергические средства (например, изадрин) внутривенно следует только при наиболее тяжелых приступах астмы, не поддающихся обычным методам лечения, в том числе внутривенному введению эуфиллина, атропина и кортикостероидов.
X. Дон (1984) указывает, что прогрессирующий астматический статус, не поддающийся лечению при внутривенном введении аминофиллина (эуфиллина), ингаляциях симпатомиметиков, внутривенных вливаниях глюкокортикоидов, достаточно успешно может лечиться внутривенным введением Шадрина.
Следует отметить, что в ходе вышеизложенной терапии у больных повышается чувствительность к симпатомиметикам и при соблюдении правил их применения можно получить выраженный бронхорасширяющий эффект.
Лечение изадрином должно быть начато с внутривенного введения в дозе 0.1 мкг/кг в минуту. Если не наблюдается улучшения, доза должна постепенно увеличиваться на 0.1 мкг/кг/мин каждые 15 мин. Желательно не превышать ЧСС 130 в минуту. Отсутствие эффекта от внутривенного введения изадрина наблюдают примерно у 15% больных.
Лечение изадрином должно проводиться лишь у больных молодого возраста без сопутствующей сердечной патологии.
Основными осложнениями являются сердечные аритмии и токсико-некротические изменения миокарда.
В ходе лечения изадрином следует постоянно контролировать ЧСС, артериальное давление, ежедневно определять уровень в крови миокардиальных ферментов, особенно специфичных МВ-КФК-изоферментов.
Для лечения астматического статуса могут применяться селективные бета2-адреностимулояторы. Учитывая их способность избирательно стимулировать бета2-адренорецепторы и почти не оказывать влияния на бета1-адренорецепторы миокарда и, таким образом, не стимулировать избыточно миокард, применение этих препаратов предпочтительнее по сравнению с изадрином.
Г. Б. Федосеев рекомендует ввести внутривенно или внутримышечно 0.5 мл 0.5% раствора алупента (орципреналина) — препарата с частичной бета2-селективностью.
Можно применять высокоселективные бета2-адреностимуляторы — тербуталин (бриканил) — 0.5 мл 0.05% раствора внутримышечно 2-3 раза в день; ипрадол — 2 мл 1% раствора в 300-350 мл 5% раствора глюкозы внутривенно капельно и др.
Таким образом, стимуляторы бета2-адренорецепторов можно применять при лечении прогрессирующего астматического статуса, но только на фоне комплексной терапии, которая восстанавливает чувствительность бета2-адренорецепторов.
Длительная перидуралъная блокада
В комплексной терапии АС может применяться также высокая блокада перидурального пространства между DIII-DIV. По данным А. С. Бориско (1989), для длительной блокады в перидуральное пространство в области DIII-DIV вводится через иглу хлорвиниловый катетер диаметром 0.8 мм. С помощью катетера каждые 2-3 ч фракционно вводится 4-8 мл 2.5% раствора тримекаина. Первдуральная блокада может продолжаться от нескольких часов до 6 суток.
Длительная первдуральная блокада нормализует тонус гладкой мускулатуры бронхов, улучшает легочный кровоток, позволяет быстрее вывести больного из астматического состояния.
При бронхиальной астме, особенно при развитии астматического статуса, развивается дисфункция центральной и вегетативной нервной системы по типу образования застойных патологических интероцептивных рефлексов, вызывающих спазм сенсибилизированных мышц бронхов и повышенную секрецию вязкой мокроты с обтурацией бронхов. Длительная перидуральная блокада блокирует патологические интероцептивные рефлексы и тем самым вызывает бронходилатацию.
Ч. X. Скоггин указывает, что фгоротан обладает бронхолитическим действием. Поэтому больным при астматическом статусе может быть проведен общий наркоз. В результате этого бронхоспазм нередко прекращается и после окончания действия наркоза больше не возникает. Однако у некоторых больных после выхода из наркоза вновь развивается тяжелое астматическое состояние.
Дроперидол является альфа-адренорецептором и нейролептиком. Препарат уменьшает бронхоспазм, снимает токсические эффекты симпатомиметиков, возбуждение, уменьшает артериальную гипертензию. Учитывая эти эффекты дроперидола, в ряде случаев целесообразно включать его в комплексную терапию астматического статуса под контролем артериального давления (1 мл 0.25% раствора внутримышечно или внутривенно 2-3 раза в день).
II стадия — стадия декомпенсации (стадия «немого легкого», стадия прогрессирующих вентиляционных расстройств)
Во II стадии состояние больного чрезвычайно тяжелое, имеется резко выраженная степень дыхательной недостаточности, хотя сознание еще сохранено.
По сравнению с I стадией астматического статуса разовая доза преднизолона увеличивается в 1.5-3 раза и введение его осуществляется каждые 1-1.5 ч или непрерывно внутривенно капельно. Вводится 90 мг преднизолона внутривенно каждые 1.5 ч, а при отсутствии эффекта в ближайшие 2 ч разовую дозу увеличивают до 150 мг и одновременно вводят гидрокортизона гемисукцинат по 125-150 мг каждые 4-6 ч. Если с началом лечения состояние больного улучшается, начинают вводить 60 мг, а затем 30 мг преднизолона через каждые 3 ч.
Отсутствие эффекта в течение 1.5-3 ч и сохранение картины «немого легкого» указывает на необходимость бронхоскопии и посегментарного лаважа бронхов.
На фоне глюкоокортиковдной терапии продолжаются кислородная ингаляционная терапия, инфузионная терапия, внутривенное введение эуфиллина, мероприятия по улучшению дренажной функции бронхов.
Эндотрохеальная интубация и искусственная вентиляция легких с санацией бронхиального дерева
Если лечение большими дозами глюкокортикоидов и остальная вышеизложенная терапия в течение 1.5 ч не ликвидируют картину «немого легкого», необходимо производить эндотрахеальную интубацию и переводить больного на искусственную вентиляцию легких (ИВЛ).
С. А. Сан и М. Э. Гершвин формулируют показания к ИВЛ следующим образом:
- ухудшение психического статуса больного с развитием волнения, раздражительности, спутанности сознания, и, наконец, комы;
- нарастающее клиническое ухудшение, несмотря на проведение энергичной лекарственной терапии;
- выраженное напряжение вспомогательных мышц и втягивание межреберных промежутков, выраженное утомление и опасность полного истощения сил больного;
- сердечно-легочная недостаточностъ;.
- прогрессирующее нарастание уровня СО2 в артериальной крови, установленное путем определения газов крови;
- уменьшение и отсутствие дыхательных звуков на вдохе, так как уменьшается дыхательный объем, что сопровождается уменьшением или исчезновением экспираторных хрипов.
Для вводного наркоза используют предион (виадрил) из расчета 10-12 мг/кг в виде 5% раствора. Перед интубацией внутривенно вводят 100 мг миорелаксанта листенона. Базисный наркоз проводят с помощью закиси азота и фторотана. Закись азота применяют в смеси с кислородом в соотношении 1:2.
Одновременно с ИВЛ производится неотложная лечебная бронхоскопия с посегментарным лаважем бронхов. Бронхиальное дерево промывается подогретым до 30-35 ‘С 1.4% раствором натрия гидрокарбоната с последующим отсасыванием бронхиального содержимого.
При интенсивной терапии астматического статуса А. П. Зильбер рекомендует проводить ИВЛ в режиме положительного давления в конце выдоха (ПДКВ). Однако при правожелудочковой недостаточности режим ПДКВ может еще больше нарушить гемодинамику. Это особенно опасно, когда ИВЛ начинают на фоне перидуральной анестезии с неустраненной гиповолемией, что приводит к трудно корригируемому коллапсу.
На фоне искусственной вентиляции легких продолжается терапия, изложенная в разделе, посвященном лечению I стадии астматического статуса, а также коррекция ацидоза (200 мл 4% раствора натрия гидрокарбоната внутривенно) под контролем рН крови.
ИВЛ прекращается после купирования II стадии АС («немого легкого»), но продолжаются бронходилатирующая терапия, лечение глюкокортикоидами в снижающихся дозах, отхаркивающими средствами.
II стадия — гипоксемическая гиперкапническая кома
В III стадии выполняется следующий объем лечебных мероприятий.
Искусственная вентиляция легких
Больной немедленно переводится на искусственную вентиляцию легких. В период ее проведения каждые 4 ч определяется напряжение в крови кислорода, углекислоты, рН крови.
Бронхоскопическая санация также является обязательным лечебным мероприятием, проводится посегментарный лаваж бронхиального дерева.
Дозы преднизолона в III стадии увеличиваются до 120 мг внутривенно каждый час.
Коррекция ацидоза производится внутривенными вливаниями 200-400 мл 4% раствора натрия бикарбоната под контролем рН крови, дефицита буферных оснований.
Экстракорпоральная мембранная оксигенация крови
При острой дыхательной недостаточности ИВЛ не всегда дает положительный результат даже при высокой концентрации кислорода (до 100%). Поэтому иногда применяют экстракорпоральную мембранную оксигенацию крови. Она позволяет выиграть время и продлить жизнь больного, давая возможность острой дыхательной недостаточности пойти на спад под влиянием терапии.
Кроме вышеназванных мероприятий, продолжаются также лечение зуфиллином, регидратация, мероприятия по улучшению отхождения мокроты и другие, описанные в разделе «Лечение в I стадии астматического статуса».
Лечение анафилактического варианта астматического статуса
- Вводится внутривенно 0.3-0.5 мл 0.1% раствора адреналина в 10-20 мл изотонического раствора натрия хлорида. При отсутствии эффекта через 15 мин налаживается внутривенное капельное вливание 0.5 мл 0.1% раствора адреналина в 250 мл изотонического раствора натрия хлорида. При возникновении затруднений с внутривенным вливанием адреналина в кубитальную вену адреналин вводят в подъязычную область. Благодаря обильной васкуляризации этой зоны, адреналин быстро попадает в системный кровоток (вводится 0.3-0.5 мл 0.1% раствора адреналина) и одновременно в трахею путем протокола перстневидно-щитовидной мембраны.
Можно вводить внутривенно капельно Шадрин по 0.1-0.5 мкг/кг в минуту.
Адреналин или изадрин стимулируют бета2-адренорецепторы бронхов, уменьшают отек бронхов, купируют бронхоспазм, увеличивают сердечный выброс, стимулируя бета1-адренорецепторы.
- Проводится интенсивная глюкокортиковдная терапия. Немедленно внутривенно струйно вводят 200-400 мг гидрокортизона гемисукцината или фосфата или 120 мг преднизолона с последующим переходом на внутривенное капельное вливание той же дозы в 250 мл 5% раствора глюкозы со скоростью 40 капель в минуту. При отсутствии эффекта можно ввести внутривенно струйно снова 90-120 мг преднизолона.
- Вводится внутривенно 0.5-1 мл 0.1% раствора атропина сульфата на 10 мл изотонического раствора натрия хлорида. Препарат является периферическим М-холинолитиком, расслабляет бронхи, устраняет анафилактический бронхоспазм, уменьшает гиперсекрецию мокроты.
- Вводится внутривенно медленно (в течение 3-5 мин) 10 мл 2.4% раствора эуфиллина в 10-20 мл изотонического раствора натрия хлорида.
- Антигистаминные средства (супрастин, тавегил, димедрол) вводятся внутривенно по 2-3 мл на 10 мл изотонического раствора натрия хлорида.
Антигистаминные препараты блокируют Н1-гистаминовые рецепторы, способствуют расслаблению бронхиальной мускулатуры, уменьшают отек слизистой бронхов.
- При отсутствии эффекта от перечисленных мероприятий проводится фторотановый наркоз и при отсутствии эффекта от него — ИВЛ. Ингаляция 1.5-2% раствора фторотана по мере углубления наркоза устраняет явления бронхоспазма и облегчает состояние больного.
- Выполняется прямой массаж легких ручным способом (вдох осуществляется мешком наркозного аппарата, выдох — сдавливанием грудной клетки руками). Прямой массаж легких проводится при тотальном бронхоспазме с «остановкой легких» в положении максимального вдоха и невозможности выдоха.
- Ликвидация метаболического ацидоза проводится под контролем рН, дефицита буферных оснований внутривенным вливанием 200-300 мл 4% раствора натрия бикарбоната.
- Улучшение реологических свойств крови производится введением гепарина внутривенно или под кожу живота в суточной дозе 20,000-30,000 ЕД (распределив на 4 инъекции). Гепарин уменьшает агрегацию тромбоцитов и отек слизистой оболочки бронхов.
- Для борьбы с отеком мозга вводится внутривенно 80-160 мг лазикса, 20-40 мл гипертонического 40% раствора глюкозы.
- Применение альфа-адреноблокаторов (дроперидола) внутривенно в дозе 1-2 мл 0.25% раствора в 10 мл изотонического раствора натрия хлорида под контролем артериального давления снижает активность альфа-адренорецепторов и способствует купированию бронхоспазма.
Лечение анафилактоидного варианта астматического статуса
Основные принципы выведения больного из анафилактоидного статуса аналогичны таковым при оказании неотложной помощи при анафилактическом варианте астматического статуса.

источник
Полезные свойства гормона адреналина состоят в том, что он подготавливает человека к опасности. Фармакология выпускает препарат Эпинефрин (Адреналин), который содержит в качестве основного вещества адреналин. Каковы его функции, есть ли противопоказания и побочные факторы? Попробуем ответить на эти вопросы.
Адреналин выпускают в ампулах для инъекций в виде растворов — Эпинефрин гидрохлорид и Эпинефрин гидротартрат. Первое вещество это порошок, который имеет розоватый оттенок. Его растворяют в хлористоводородной кислоте. Ампулы с раствором входят в содержание упаковки.
Второе вещество представляет собой сероватое порошкообразное вещество. Гидротартрат растворяют в дистиллированной воде. Перед помещением в ампулу порошок стерилизуют при температуре 100 градусов. Стерилизацию проводят четверть часа.
Оба раствора плохо переносят воздействие света и кислорода. Поэтому, лекарство держат в темном месте. Перед введением больному раствора его полностью (из ампулы) набирают в шприц. Использовать открытые и размешанные с порошком растворы, когда они пробыли на воздухе нескольких часов, запрещается. Дозу инъекции назначает лечащий врач.
Различий между двумя видами препарата — гидрохлоридом и гидротартратом, нет. Но есть разница в молекулярных массах. Поскольку у второго масса молекул меньше, в ампулу помещается большая доза лекарства.
Препарат относят к фармакологической группе адрено- и симпатомиметиков. Он прописывается в следующих ситуациях:
- При возникновении быстрых аллергических реакций. Это может быть крапивница, отек Квинке, аллергический шок. При этом причина аллергии может быть разная — от укусов ос и других насекомых до аллергии на лекарственные препараты и на принятую пищу.
- При бронхиальной астме. Лечебное средство (ЛС) при астме снимает приступ удушья. Сюда же относятся затрудненное дыхание во время хирургической операции, остановка сердца в таких же условиях.
- Эпинефрин помогает остановить кровотечение из слизистых оболочек и сосудов кожи.
- Понижение артериального давления (гипотензия), в случаях, когда менее эффективные средства не оказывают нужного воздействия. Это может случиться при травме или шоке, циркуляции в крови бактерий (бактериемии), при недостаточной работе почек, при хронической недостаточности сердца, во время хирургических операций на сердце, при передозировке лекарственными препаратами.
- Для лечения понижения глюкозы в крови ниже нормы. Такое случается в ситуации передозировки инсулина.
- Для остановки кровотечений.
- В офтальмологической практике. Офтальмологи прописывают препарат при глаукоме, операциях на глазу, при конъюнктивите, отечности глаз, внутриглазном повышенном давлении. Также Эпинефрином добиваются остановки кровотечения из слизистой глаз.
- При несвязанной с половым возбуждением эрекции.
Кроме указанных показаний, препарат применяют во время операций для удлинения времени действия наркоза.
Адреналин не является безопасным средством. В некоторых ситуациях его применение запрещено или проводится с осторожностью под контролем специалиста. Противопоказания Адреналина достаточно серьезны. Болезни, при которых нельзя принимать Эпинефрин:
- атеросклероз (образование в сосудах холестериновых бляшек);
- повышенное артериальное давление;
- при наличии внутренних и внешних кровотечений;
- в период беременности;
- во время кормления малыша грудью;
- при слишком сильной реакции на введение препарата.
ЛС не применяют при наркозе с помощью определенных препаратов. Об этом известно анестезиологам.
Назначая лекарство, необходимо помнить о действии, которое он оказывает на человека:
- повышает АД;
- увеличивает количество глюкозы в крови;
- снимает спазмы бронхов;
- помогает избежать аллергии и вылечивает ее;
- суживает сосуды;
- тормозит образование гликогена в печени и мышцах скелета;
- повышает степень всасывания глюкозы тканями организма, активируя гликолитические ферменты;
- увеличивает активность мышц скелета;
- способствует сжиганию жира и препятствует его генерированию;
- помогает организму бодрствовать, увеличивая попутно психическую мобилизацию и активность мозга;
- направленно активирует деятельность гипоталамуса;
- способствует выработке адренокортикотропина;
- повышает свертываемость крови.
Адреналин нормализует обменные процессы и регенерацию миокарда и мышечной ткани. Он является противовоспалительным средством. Он способствует распаду белков с высвобождением энергии.
Поскольку ЛС повышает частоту дыхания и активизирует мозг, часто после инъекции больной чувствует головокружение. Он может неадекватно воспринимать окружающий мир.
Если не было оснований для повышения естественного гормона адреналина, при увеличении его содержания человек может почувствовать тревогу и необъяснимую раздражительность. Лекарство приводит к тем же последствиям.
В первобытные времена основной проблемой человека было добывание пищи. Эта проблема решалась путем охоты, преследования, быстрого бега. Адреналин при этом уменьшался. Сейчас задачи человека значительно расширились по составу. Но решение их находится без применения физической силы. Поэтому, объем адреналина не снижается. Чтобы его уменьшить, люди занимаются спортом.
Лечение препаратом назначается на определенный срок, который не стоит превышать. При долгом использовании лекарства угнетается функционирование сердца, что приводит к сердечной недостаточности.
Адреналин также плохо влияет на психически возбудимых людей. Их нервозность повышается, появляются проблемы со сном. В некоторых случаях у человека диагностируют хроническое стрессовое состояние.
Побочным эффектом от применения препарата является повышение артериального давления, вредное для гипертоников. Средство также нарушает ритм биения сердца. Но при лечении инъекциями Эпинефрина нельзя принимать такие лекарства для восстановления нормального сердцебиения, как Обзидан и Анаприлин.
Инструкция по применению Эпинефрина говорит о том, что уколы Адреналина ставят подкожно. Иногда врач назначает внутримышечные или внутривенные инъекции.
Дозировка рассчитывается специалистом индивидуально с учетом особенностей болезни и самочувствия больного. Следующая таблица дает представление о средней дозе лекарства:
| Возраст | Нижний предел (мл) | Верхний предел (мл) |
|---|---|---|
| Ребенок | 0,1 | 0,5 |
| Взрослый | 0,2 | 1,0 |
При остановке сердцебиения во время хирургической операции доза Адреналина доходит до 1 мл. Если лекарство призвано остановить астматический приступ, вводят до 0,7 мл. Как правило, для терапевтических целей врач порекомендует дозировку до 0,75 мл взрослому и до 0,5 мл ребенку.
При аллергическом шоке доза препарата Адреналина минимальна и составляет от 0,1 мл до 0,25 мл порошка, которые разводят в 10 мл раствора. В этом случае часто применяют капельный внутривенный способ введения раствора в пропорции 1:10000. Если опасности для жизни нет, применяют внутримышечный или подкожный способ введения.
Если специалист назначил лекарство для лечения пониженного АД, раствор вводят внутривенно с помощью капельницы. Доза составляет 0,001 мл в минуту.
При необходимости увеличить время функционировании анестетика, дозу рассчитывают из соображений, что на 1 мл анестетика приходится 0,005 мл Эпинефрина.
Симптомами передозировки служат:
- сильный рост цифр АД;
- расширение глазных зрачков;
- Увеличение частоты пульса, переходящее в слабый пульс;
- Наджелудочковая аритмия сердца, сопровождаемая электрической активностью предсердий частотой свыше 350 в минуту;
- Похолодание кожи и ее бледность;
- Беспокойство и страх без причины;
- Тошнота и рвота;
- Дрожание рук;
- Головная боль;
- Нарушение кислотно-основного баланса, сопровождающееся низким рН крови и дефицитом бикарбоната;
- Почечная недостаточность.
Передозировка может привести и к более серьезным последствиям. К ним относятся инфаркт миокарда, мозговое кровоизлияние, отек легких. Смертельной считается доза в 10 мл препарата.
Передозировку лечат приемом лекарств группы альфа- и бета-адреноблокаторов. Если передозировка вызвала сразу несколько симптомов, проводят комплексную терапию.
В медицине активно изучается вопрос сочетания лекарств. Так, известно, что недопустимо лечение Эпинефрином во время приема наркотических и снотворных средств и относящихся к ним лекарств, анальгетиков. ЛС уменьшит эффект от анальгина и других подобных лекарств. Препарат не назначают вместе с антидепрессантами. Он не сочетается с сердечными гликозидами, хинидином. Использование этих средств вместе с Адреналином увеличивают риск аритмии сердца. Некоторые препараты от Адреналина уменьшают воздействие на организм больного, другие приносят ощутимый вред.
Гормон назначают под строгим наблюдением врача в случаях:
- Низкого рН крови и низкой концентрации бикарбоната;
- При пониженном содержании кислорода в органах тела;
- При склонности к повышению АД;
- При головокружении, одышке, боли в груди, которые являются симптомами легочной гипертензии;
- При аритмии желудочков сердца;
- После инфаркта миокарда;
- При шоке, не связанном с аллергией;
- При атеросклерозе и нарушении проходимости сосудов;
- При блокировке кровотока в артерии.
Все случаи, при которых опасно принимать препарат, изложены в описании лекарства. Прежде, чем назначать лекарство, необходимо досконально изучить инструкцию. Колоть его в домашних условиях нельзя, если врач не даст такого разрешения. В стационаре всегда рядом специалисты, которые помогут при побочных эффектах от инъекции.
Срок годности Адреналина составляет 24 месяца. Хранить его надо в защищенном от солнечных лучей и искусственного освещения месте. Препарат любит прохладу, поэтому можно положить его на полочку на дверце холодильника.
источник