Бронхиальная астма является хроническим заболеванием органов дыхания. Отвечая на вопрос, чем лечить бронхиальную астму, специалисты утверждают, что лечение должно включать симптоматическую и базисную терапию. Это поможет лучше контролировать заболевание и уменьшить количество приступов удушья.
К медикаментам, которые используют при симптоматической терапии, можно отнести:
- бронхорасширяющие средства (β2-адреномиметики);
- продукты катаболизма пуринов (ксантины).
В период базисной терапии применяют:
- стероидные гормоны (кортикостероиды);
- профилактические противовоспалительные средства (кромоны);
- лекарства, что снижают активность ферментов и блокируют рецепторы к лейкотриенам;
- антитела.
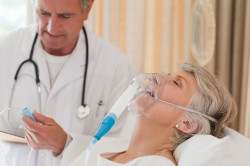
Кортикостероиды при бронхиальной астме вводят системно, методом многочисленных ингаляций. Ингаляционные глюкокортикостероиды можно разделить на хлорированные, фторированные и негалогенированные. Эти препараты для лечения бронхиальной астмы обладают противовоспалительным эффектом, который достигается за счет подавления воспалительных клеток, повышения чувствительности рецепторов, изменения синтеза простогландинов, уменьшения количества цитокинов.
При регулярных ингаляциях повышается синтез противовоспалительных белков и стабилизируется состояние клеточных мембран. Ингаляционные глюкокортикостероиды быстро выводятся из организма, обладают местным действием и снижают к минимуму все системные проявления. Благодаря своей липофильности препарат быстро накапливается в бронхах. Полнота эффекта от действия лекарства достигается за счет правильности применения и абсорбции в легких. Лечить бронхиальную астму глюкокортикостероидами нужно с применением ингаляторов, не содержащих фреон. Фреон ухудшает эффективность действия активных веществ.
Есть несколько концепций лечения данными препаратами:
- Ступенчатый подход. При данном методе доза препарата увеличивается в результате усугубления протекания заболевания. Основным недостатком ступенчатого подхода является то, что он не направлен на снижение частоты приступов и обострений, а лишь определяет дозу при увеличении или уменьшении симптоматики.
- Гибкое дозирование. Система гибкого дозирования более удобна, она позволяет значительно уменьшить число ингаляций и дозу лекарств. Средство для лечения бронхиальной астмы вводят средними дозами. Исходя из самочувствия больного и общего состояния бронхов, дозу увеличивают или уменьшают.
В качестве препаратов используют Симбикорт, Серетид, Мультидиск, Тевакомб, Метипред, Полькортолон.
Антилейкотриеновые препараты при бронхиальной астме нормализуют базальный тонус в бронхах, который повышается за счет активации ферментной системы. Данный тип лекарств используют для лечения аспириновой бронхиальной астмы. Самыми известными является Аколат, Пранлукаст и Сингуляр.

Медикаментозное лечение бронхиальной астмы моноклональными антителами подразумевает терапию такими препаратами, как Омализумаб и Ксолар. Данные медикаменты включают в себя антитела к IgE, которые быстро связывают свободные гликопротеины и притупляют аллергические реакции.
В сочетании с глюкокортикостероидными ингаляторами препараты моноклональных антител позволяют существенно снизить общий процент применения стероидных препаратов и значительно улучшить контроль над заболеванием. Прежде чем лечить бронхиальную астму этими препаратами, необходимо проконсультироваться со своим лечащим врачом. Бронхиальная астма непредсказуема. Самостоятельный подбор медикаментов в этом случае может стоить вам жизни.
Бронхорасширяющие средства бывают двух типов:
- Адреностимуляторы, применяемые для стимуляции β2-рецепторов. Они оказывают общее бронхорасширяющее действие. Эффект от применения можно наблюдать уже через 10-20 минут.
- Холинолитики, применяемые для блокировки M-холинорецепторов. Эти медикаменты предотвращают развитие спазма. Клинический эффект можно наблюдать через 30-60 минут. Холинолитики назначают в комплексе с адреномиметиками.
Медикаменты расслабляют бронхи, снимают спазм и приступы удушья. Неприемлемо самостоятельно выбирать препараты пролонгированного действия. Особое внимание стоит уделить применению дозированных ингаляторов. Продолжительность действия активных веществ в таких ингаляторах напрямую зависит от правильности применения устройства.
Рекомендуется применять бронхорасширяющие средства с целью профилактики, для постоянного поддержания проходимости бронх, предотвращения удушья. Подбор лекарственных препаратов проводит лечащий врач, учитывая результаты многочисленных обследований и фармакологических тестов.
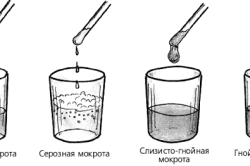
Слизь образуется из молекул гликопротеинов, водородных и кальциевых связей. За счет образования этих связей увеличивается адгезия слизи к бронхам. Слизь приобретает резиноподобный и стекловидный характер. Еще слизь может застаиваться в результате деформации бронхов, изменения их проходимости, а также при интенсивной продукции внутреннего подслизистого слоя.
Отхаркивающие средства способствуют очищению бронхов от слизи и мокроты. Это Бромгексин, Амброксол, Ацетилцистеин, Карбоксиметилцистеин и другие. Отхаркивающие средства нормализуют секрецию, снижают вязкость слизи, уменьшают ее эластичность и адгезию к стенкам дыхательных путей.
Соли йода обладают экстрабронхиальным эффектом. Попадая внутрь, они всасываются в кровеносную систему, проникают в бронхи и увлажняют слизь. Откашливание значительно улучшается. Бикарбонат натрия тоже оказывает регидратирующее действие.
Применяют бикарбонат в виде ингаляционных растворов. Растворы соды вызывают естественный гидролиз слизи. Облегчить бронхиальную астму можно за счет очищения респираторного тракта, уменьшения количества слизи и восстановления нормальной секреции легких.
Очевидно, что полностью излечить хроническую бронхиальную астму невозможно, а вот облегчить течение заболевания, исключить приступы удушья — это вполне реально.
источник
Бронхиальная астма — инфекционно-аллергическое заболевание, характеризующееся периодически возникающими приступами бронхоспазма и хроническим воспалительным процессом в стенке бронхов. Хроническое воспаление приводит к повреждению эпителия дыхательных путей и развитию гиперреактивности бронхов. В результате увеличивается чувствительность бронхов к стимулирующим факторам (вдыхание холодного воздуха, воздействие
аллергенов). К наиболее распространенным в окружающей среде аллергенам относят пыльцу растений, домашнюю пыль, химические вещества (сернистый газ), инфекционные агенты, пищевые аллергены и т.д. Их воздействие приводит к возникновению бронхоспазма, проявляющегося в виде характерных приступов удушья (экспираторная одышка).
В развитии бронхиальной астмы значительную роль играют аллергический и аутоиммунный процессы. Аллергический компонент заболевания развивается по механизму реакции гиперчувствительности немедленного типа.
Антигены, при попадании в организм, поглощаются макрофагами и это вызывает ряд последовательных реакций, которые приводят к активации пролиферации В-лимфоцитов и их дифференцировке в плазматические клетки, продуцирующие антитела, в том числе IgE (рис. 17-1). Антитела циркулируют в системном кровотоке и при повторном попадании в организм того же антигена, связывают его и выводят из организма. Пролиферация и дифференцировка В-лимфоцитов регулируется интерлейкинами (ИЛ), которые вырабатываются сенсибилизированными макрофагами и регуляторными Т-лимфоцитами, так называемыми Т-хелперами. Т-хелперы выделяют различные ИЛ, в том числе ИЛ-3, увеличивающий клон тучных клеток, ИЛ-5, увеличивающий клон эозинофилов и др. ИЛ-4 стимулирует пролиферацию и дифференцировку В-лимфоцитов (и, следовательно, продукцию IgE). Кроме того, ИЛ-4 вызывает сенсибилизацию тучных клеток и базофилов, т. е. экспрессию в их мембранах рецепторов к IgE (рис. 17-1). Эти рецепторы называют Fсε-рецепторами и делят на высокоаффинные FcεRI и низкоаффинные FcεRII. С высокоаффинными рецепторами FcεRI связываются IgE. При взаимодействии антигена с IgE, фиксированными на поверхности тучных клеток, происходит дегрануляция тучных клеток, из них выделяются биологически активные вещества, обладающие разными свойствами. Во-первых, вещества с бронхоконстрикторными свойствами (вызывающие брон- хоспазм), к которым относят цистеиниловые лейкотриены LtC4, LtD4, LtE4 (медленно реагирующая субстанция анафилаксии), фактор акти- вации тромбоцитов, гистамин и др. Во-вторых, вещества с хемотоксическими свойствами, вызывающие эозинофильную инфильтрацию бронхов (лейкотриен B4, фактор активации тромбоцитов). В-третьих, вещества, с проаллергическими и провоспалительными свойствами (простагландины Е2, I2 D2, гистамин, брадикинин, лейкотриены,
Рис. 17-1. Механизмы действия средств, применяемых при бронхиальной астме.
фактор активации тромбоцитов). Эти вещества расширяют кровеносные сосуды и повышают их проницаемость, вызывая отек слизистой оболочки, способствуют инфильтрации слизистой оболочки бронхов лейкоцитами (в том числе эозинофилами). Из активированных эозинофилов выделяются вещества, обладающие цитотоксическими свойствами (эозинофильные белки), повреждающие эпителиальные клетки. Таким образом эти вещества поддерживают воспалительный процесс в бронхах, на фоне которого развивается гиперреактивность бронхов к факторам, вызывающим бронхоспазм.
Выделяют несколько групп лекарственных средств, применяемых при бронхиальной астме.
— средства, стимулирующие β2-адренорецепторы;
— средства, блокирующие М-холинорецепторы;
— спазмолитики миотропного действия.
• Средства с противовоспалительным и противоаллергическим действием:
— стабилизаторы мембран тучных клеток;
— средства с антилейкотриеновым действием:
• блокаторы лейкотриеновых рецепторов;
• ингибиторы синтеза лейкотриенов (ингибиторы 5-липокси- геназы).
— препараты моноклональных антител к IgE.
Средства, стимулирующие β2-адренорецепторы
В качестве бронхолитиков можно использовать селективные агонисты β2-адренорецепторов — фенотерол, сальбутамол, тербуталин, гексопреналин, салметерол, формотерол и кленбутерол, а также неселективные агонисты — орципреналин и изопреналин (стимулируют β1— и β2-адренорецепторы).
Среди бронхолитических препаратов группа веществ селективного действия используется наиболее часто. Данная группа препаратов имеет ряд положительных качеств: β2-адреномиметики удобны в применении (вводят ингаляционно), имеют короткий латентный период (несколько минут), высокую эффективность, препятствуют
дегрануляции тучных клеток, а также способствуют отделению мокроты (увеличивают мукоцилиарный клиренс). Высокая эффективность β2-адреномиметиков при экспираторной одышке связана с тем, что они способны расширять мелкие бронхи. Это обусловлено неравномерностью распределения β2-адренореактивных структур в бронхах (плотность β2-адренорецепторов тем выше, чем дистальнее бронх, таким образом, максимальную плотность β2-адренорецепторов наблюдают в мелких бронхах и бронхиолах). Кроме бронхолитического действия, β2-адреномиметики препятствуют дегрануляции тучных клеток. Это связано со снижением концентрации ионов Са 2+ в тучных клетках (за счет повышения концентрации цАМФ в результате активации аденилатциклазы). Приступ бронхиальной астмы обычно заканчивается отхождением вязкой мокроты. β2-Адреномиметики облегчают отделение мокроты, что связано с устранением антигензависимого подавления мукоцилиарного транспорта и увеличением объема секреции вследствие расширения сосудов слизистой оболочки.
Сальбутамол (вентодиск*, вентолин*), фенотерол(беротек*), тербуталин (бриканил*), гексопреналин(ипрадол*) действуют от 4 до 6 ч. Бронхолитическое действие начинается быстро (латентный период 2-5 мин) и достигает максимума через 40-60 мин. Эти препараты можно использовать для купирования и профилактики бронхоспазма.
Кленбутерол (спиропент * ), ф о р м о т е р о л (форадил * ),салметерол (серевент * , сальметер * ) действуют продолжительно (около 12 ч), основное показание к их применению — профилактика бронхоспазма, Формотерол, кроме того, обладает коротким латентным периодом (1-2 мин). Однако использовать эти препараты для купирования бронхоспазма нерационально, поскольку в виду большой продолжительности действия существует риск передозировки.
Наряду с бронхолитическим действием все перечисленные препараты оказывают также токолитическое действие (см. главу «Средства, влияющие на миометрий»). Побочные эффекты: снижение артериального давления, тахикардия, мышечный тремор, отек слизистой оболочки бронхов, потливость, тошнота, рвота.
Орципреналин (алупент * , астмопент * ) отличается от вышеперечисленных бронхолитиков отсутствием селективности. Он стимулирует β1— и β2-адренорецепторы. В связи с β1-адреномиметическим действием, он обладает положительным дромотропным действием (поэтому может использоваться при атриовентрикулярном блоке и брадиаритмиях) и положительным
хронотропным действием, вызывая более выраженную тахикардию, чем селективные β2-адреномиметики.
В ряде ситуаций для купирования бронхоспазма в качестве средства скорой помощи применяют адреналин (стимулирует β1-, β2-, α1-, а2-адренорецепторы). Чтобы бронхолитический эффект адреналина не сопровождался выраженным прессорным действием, препарат следует вводить подкожно. Характерный набор свойств (прессорное действие в комбинации с бронхолитическим) делает адреналин средс- твом выбора при анафилактическом шоке (при этом для достижения выраженного прессорного эффекта препарат вводят внутривенно).
Бронхолитическое действие присуще симпатомиметику эфедрину. Однако из-за способности вызывать лекарственную зависимость его используют не самостоятельно, а в составе комбинированных препаратов с бронхолитическим действием.
Средства, блокирующие М-холинорецепторы
Как бронхолитики, М-холиноблокаторы уступают по эффективности β2-aдреномиметикaм. Это обусловлено несколькими причинами. Во-первых, распределение М-холинорецепторов в бронхиальном дереве таково, что чем дистальнее расположен бронх, тем меньше в нем М-холинорецепторов (таким образом, М-холиноблокаторы устраняют спазм не столько мелких, сколько крупных бронхов). Во-вторых, снижение тонуса бронхов представляет собой результат блокады М3-холинорецепторов гладкомышечных клеток бронхов, в то же время на пресинаптической мембране холинергических синапсов находятся М2-холинорецепторы (ауторецепторы), блокада которых (по принципу обратной отрицательной связи) приводит к усилению выделения ацетилхолина в синаптическую щель. При повышении концентрации ацетилхолина в синаптической щели он конкурентно вытесняет М-холиноблокаторы из связи с М3-холинорецепторами на мембране гладкомышечных клеток, препятствуя его бронхолитическому действию. Кроме того, М-холиноблокаторы уменьшают секрецию бронхиальных желез, что при бронхиальной астме нежелательно (снижение объема секреции делает мокроту более вязкой и трудноотделяемой). В связи с вышеизложенным блокаторы М-холиноре- цепторов рассматривают как вспомогательные средства.
Ипратропия бромид (атровент * , итроп * ) имеет в структуре четвертичный атом азота, и обладает низкой липофильностью, поэтому при ингаляционном применении практически не всасыва-
ется в системный кровоток. Бронхолитический эффект развивается через 30 мин после ингаляции, достигает максимума через 1,5-2 ч и продолжается 5-6 ч. Побочные эффекты: сухость во рту. Системных побочных (атропиноподобных) эффектов практически не вызывает.
Тиотропия бромид (спирива*) отличается от ипратропия тем, что блокирует постсинаптические М3-холинорецепторы в большей степени, чем пресинаптические М2-холинорецепторы, и поэтому более эффективно снижает тонус бронхов. Тиотропия бромид оказывает более быстрое (максимальный эффект развивается через 1,5-2 ч) и более продолжительное действие (около 12 ч), чем ипратропия бромид. Назначают ингаляционно 1 раз в сутки.
Бронхолитическим действием обладают все атропиноподобные средства, однако их применение в качестве бронхолитиков ограничено в связи с большим количеством побочных эффектов.
Спазмолитики миотропного действия
К бронхолитикам миотропного действия относят метилксантины: теофиллин и аминофиллин.
Теофиллин мало растворим в воде (1:180).
Аминофиллин (эуфиллин*) представляет собой смесь 80% теофиллина и 20% этилендиамина, что обусловливает более легкую растворимость этого вещества в воде.
Метилксантины как бронхолитические средства не уступают по эффективности β2-aдреномиметикaм, но в отличие от β2-aдреномиметиков их не вводят ингаляционно. Механизм бронхолитического действия метилксантинов связывают с блокадой аденозиновых А1-рецепторов гладкомышечных клеток, а также с неизбирательным ингибированием фосфодиэстеразы (типов III, IV). Угнетение фосфодиэстеразы в гладкомышечных клетках бронхов (фосфодиэсте-
раза IV) приводит к накоплению в клетках цАМФ и снижению внутриклеточной концентрации Са 2+ , в результате в клетках уменьшается активность киназы легких цепей миозина и нарушается взаимодействие актина и миозина. Это приводит к расслаблению гладких мышц брон- хов (спазмолитическое действие). Аналогичным образом теофиллин действует на гладкие мышцы кровеносных сосудов, вызывая расширение сосудов. Под действием теофиллина в тучных клетках также увеличивается концентрация цАМФ (за счет угнетения фосфодиэстеразы IV) и снижается концентрация Са 2+ . Это препятствует дегрануляции тучных клеток и высвобождению медиаторов воспаления и аллергии. Ингибирование фосфодиэстеразы в кардиомиоцитах (фосфодиэстераза III) приводит к накоплению в них цАМФ и повышению концентрации Са 2+ (повышение силы сердечных сокращений, тахикардия). При действии на систему органов дыхания, кроме бронхолитического действия, отмечается усиление мукоцилиарного клиренса, уменьшение легочного сосудистого сопротивления, стимуляция дыхательного центра и улучшение сокращений дыхательных мышц (межреберных и диафрагмы). Кроме того, теофиллин оказывает слабое антиагреган- тное и диуретическое действие. При приеме внутрь быстро и полно всасывается из кишечника (биодоступность выше 90%). Максимальная концентрация в крови достигается через 2 ч. Метаболизируется в печени с образованием неактивных метаболитов. Скорость метаболизма и продолжительность действия неодинаковы у разных пациентов (в среднем — около 6 ч). Побочные эффекты: беспокойство, нарушение сна, тремор, головная боль (связаны с блокадой аденозиновых рецепторов в ЦНС), тахикардия, аритмии (связаны с блокадой аденозиновых рецеп- торов сердца и ингибированием фосфодиэстеразы III), тошнота, рвота, понос. Разработаны таблетированные лекарственные формы теофиллина пролонгированного действия: эуфиллин ретард Н * , эуфилонг * , уни-дур * , вентакс * , спофиллин ретард * , теопэк * , теодур * и др. Ретардформа отличается более медленным высвобождением действующего начала в системный кровоток. При применении пролонгированных форм теофиллина максимальная концентрация достигается через 6 ч, а общая продолжительность действия увеличивается до 12 ч. К пролонгированным формам аминофиллина можно отнести ректальные суппозитории (применяют по 360 мг 2 раза в сутки).
В настоящее время на стадии клинических исследований находятся избирательные ингибиторы фосфодиэстеразы IV циломиласт (арифло*), рофлюмиласт. Эти препараты не только обладают бронхолитическим
действием. При их применении уменьшается количество и активность нейтрофилов, Т-лимфоцитов CD8+, уменьшается пролиферация Т-хелперов CD4+ и синтез ими цитокинов (ИЛ-2, ИЛ-4, ИЛ-5), подавляется продукция фактора некроза опухолей моноцитами, а также синтез лейкотриенов. В результате уменьшается воспалительный процесс в стенке бронхов. Избирательные ингибиторы фосфодиэстеразы IV могут применять как в фармакотерапии бронхиальной астмы, так и в фармакотерапии хронических обструктивных болезней легких. Общая проблема всех разрабатываемых препаратов — высокая частота тошноты и рвоты, что способно значительно ограничить их клиническое применение.
Фармацевтическая промышленность выпускает комбинированные препараты с бронхолитическим действием.
Для ингаляций применяют дитэк* (дозированный аэрозоль, содержащий в 1 дозе 50 мкг фенотерола и 1 мг кромоглициевой кислоты), инталплюс * (дозированный аэрозоль, содержащий в 1 дозе салбутамола 100 мкг и динатриевой соли кромоглициевой кислоты 1 мг), беродуал * (раствор для ингаляций и дозированный аэрозоль, содержащий в 1 дозе фенотерола гидробромида 50 мкг и ипратропия бромида 20 мкг), комбивент * (дозированный аэрозоль, содержащий в 1 дозе салбутамола сульфата 120 мкг и ипратропия бромида 20 мкг), серетидмультидиск * , содержащий салметерол с флутиказоном.
Для применения внутрь используют таблетки теофедрин Н* (одна таблетка содержит теофиллина 100 мг, эфедрина гидрохлорида 20 мг, экстракта красавки сухого 3 мг, парацетамола 200 мг, фенобарбитала 20 мг, цитизина 100 мкг); капсулы и сироп Трисолвин* (1 капсула содержит: теофиллина безводного 60 мг, гвайфенезина 100 мг, амброксола 30 мг; 5 мл сиропа содержат: теофиллина безводного 50 мг, гвайфенезина 30 мг, амброксола 15 мг), капли солутан* (1 мл соответствует 34 каплям и содержит: алкалоида корня красавки радобелина 100 мкг, эфедрина гидрохлорида 17,5 мг, прокаина гидрохлорида 4 мг, экстракта толуанского бальзама 25 мг, натрия йодида 100 мг, сапонина 1 мг, масла укропного 400 мкг, воды горькоминеральной 30 мг).
Течению бронхиальной астмы часто сопутствуют такие проявления гиперчувствительности немедленного типа, как крапивница, аллергический ринит, аллергический конъюнктивит и ангионевротический отек (отек Квинке). Их вызывает гистамин, выделяющийся из сенсибилизированных тучных клеток в ходе дегрануляции. Для устранения этих симптомов применяют антигистаминные препараты, блокирующие гистаминовые Н1-рецепторы (см. раздел «Противоаллергические средства»).
Средства с противовоспалительным и противоаллергическим действием
Глюкокортикоиды имеют сложный механизм антиастматического действия, в котором можно выделить несколько компонентов: противовоспалительное, противоаллергическое и иммуносупрессивное.
Противовоспалительное действие глюкокортикоидов имеет несколько механизмов. За счет экспрессии соответствующего гена они стимулируют продукцию липокортинов, естественных ингибиторов фосфолипазы А2, что приводит к уменьшению продукции в тучных клетках фактора активации тромбоцитов, лейкотриенов и простагландинов. Кроме того, глюкокортикоиды подавляют синтез ЦОГ-2 (за счет репрессии соответствующего гена), что также приводит к снижению синтеза простагландинов в очаге воспаления (см. рис. 17-1). Глюкокортикоиды угнетают синтез молекул межклеточной адгезии, что затрудняет проникновение моноцитов и лейкоцитов в очаг воспаления. Все это приводит к уменьшению воспалительной реакции, препятствует развитию гиперреактивности бронхов и возникновению бронхоспазма.
Глюкокортикоиды оказывают иммуносупрессивное действие, угнетая продукцию ИЛ (за счет репрессии соответствующих генов), в том числе ИЛ-1, ИЛ-2 и ИЛ-4 и др. В связи с этим они подавляют пролиферацию и дифференцировку В-лимфоцитов и препятствуют образованию антител, в том числе IgE.
Глюкокортикоиды уменьшают количество и сенсибилизацию тучных клеток (за счет уменьшения продукции ИЛ-3 и ИЛ-4), препятствуют биосинтезу в тучных клетках цистеиниловых лейкотриенов (за счет активации липокортина-1 и угнетения фосфолипазы А2), а также стабилизируют мембраны тучных клеток, препятствуя их дегрануляции (см. рис. 17-1). Это приводит к подавлению аллергической реакции немедленного типа. Глюкокортикоиды также сенсибилизируют β2-aдренорецепторы бронхов к циркулирующему в крови адреналину, в результате чего они усиливают бронхолитическое действие адреналина.
Глюкокортикоиды для резорбтивного действия (преднизолон, дексаметазон, бетаметазон и т.д.) высоко эффективны при бронхи- альной астме. Однако большое количество возникающих при этом
побочных эффектов делает целесообразным использование препаратов глюкокортикоидов для ингаляционного введения. К препаратам этой группы относят беклометазон, флутиказон, флунизолид и будесонид. Эти препараты практически не всасываются в системный кровоток, вследствие чего удается избежать побочных эффектов, связанных с их резорбтивным действием. Антиастматическое действие глюкокортикоидов нарастает постепенно при их регулярном применении. Используют их обычно для систематического лечения. В последние годы эти препараты стали выпускаться в порошковых (не содержащих фреона) дозированных аэрозолях, активируемых вдохом.
Беклометазон выпускают в ингаляторах различных модификаций: бекотид* (дозированный аэрозоль, 200 доз), беклазон* (дозированный аэрозоль, 200 доз во флаконе), беклазон — легкое дыхание * (дозированный аэрозоль, 200 доз во флаконе с оптимизатором дозы), бекломет-изихалер * (порошок для ингаляций, 200 доз в дозирующем устройстве изихалер), бекодиск * (порошок для ингаляций, 120 доз в комплекте с дискхалером). Беклометазон применяют главным образом для профилактики приступов бронхоспазма. Эффективен только при регулярном применении. Эффект развивается постепенно и достигает максимума на 5-7-е сутки от нача- ла использования. Обладает выраженным противоаллергическим, противовоспалительным и противоотечным действием. Уменьшает эозинофильную инфильтрацию легочной ткани, снижает гиперреактивность бронхов, улучшает показатели функции внешнего дыхания, восстанавливает чувствительность бронхов к бронхолитическим средствам. Применяют 2-4 раза в сутки. Поддерживающая доза 100-200 мкг. Побочное действие: дисфония (изменение или охриплость голоса), чувство жжения в зеве и гортани, крайне редко — парадоксальный бронхоспазм. При длительном применении может развиться кандидамикоз ротовой полости и глотки. Кроме того, препараты беклометазона (беконазе * ) могут применяться для лечения аллергического ринита.
Флунизолид (ингакорт * ) по фармакологическим свойствам и применению сходен с беклометазоном. Отличается от него более интенсивным всасыванием в системный кровоток, однако вследствие выраженного пресистемного метаболизма биодоступность флунизолида не превышает 40%, t1/2 составляет 1-8 ч. Так же, как и беклометазон, можно применять при аллергическом рините.
Будесонид (будесонид мите*, будесонид форте*, пульмикорт турбухалер * ) по фармакологическим свойствам и применению сходен с беклометазоном, но имеет ряд отличий. Будесонид имеет более продолжительное действие, в связи с этим его применяют 1-2 раза в сутки. Нарастание эффекта до максимума происходит более продолжительное время (в течение 1-2 нед). При ингаляционном введении около 28% препарата попадает в системный кровоток. Будесонид применяют не только при бронхиальной астме, но также и в дерматологии в составе мазей и кремов апулеин * . Местные побочные эффекты такие же, как у беклометазона. Кроме того, могут наблюдаться побочные эффекты со стороны ЦНС в виде депрессии, нервозности, возбудимости.
Флутиказон применяют при бронхиальной астме (дозированный аэрозоль фликсотид * ), при аллергическом рините (спрей для носа фликсоназе) * , при заболеваниях кожи (мазь и крем кутивейт * ). При бронхиальной астме препарат применяют 2 раза в сутки ингаляционно (20% от введенной дозы всасывается в системный кровоток). По свойствам и фармакокинетике сходен с будесонидом.
При ингаляционном применении глюкокортикоидов нельзя исключить их системную абсорбцию и риск угнетения инкреции эндогенных глюкокортикоидов (по механизму обратной отрицательной связи). Непрерывно ведется изыскание более совершенных препаратов глюкокортикоидов, одна из новых групп — «мягкие» глюкокортикоиды. К ним относят лотепрендола этабонат (применяющийся в офтальмологии) и циклесонид, рекомендующийся к применению при бронхиальной астме.
Циклесонид — эстерифицированный стероид, не содержащий галогенов, пролекарство. Действующее начало — дезизобути- рил-циклесонид образуется только после попадания циклесонида в дыхательные пути, где он преобразуется эстеразами. Применяют 1 раз в сутки, хорошо переносится, в меньшей степени, чем флутиказон, подавляет образование естественных глюкокортикоидов.
Стабилизаторы мембран тучных клеток
К препаратам этой группы относятся кромоглициевая кислота, недокромил, кетотифен.
Кромоглициевая кислота стабилизирует мембраны тучных клеток, препятствуя входу в них ионов кальция. В связи с этим
уменьшается дегрануляция сенсибилизированных тучных клеток (прекращается высвобождение лейкотриенов, фактора активации тромбоцитов, гистамина и других медиаторов воспаления и аллергии). Очевидно, что препараты кромоглициевой кислоты эффективны как средство профилактики, но не купирования бронхоспазма. При ингаляционном применении кромоглициевой кислоты в системный кровоток всасывается 5-15% от введенной дозы, t1/2 составляет 1-1,5 ч. Действие после однократного ингаляционного применения продолжается около 5 ч. При систематическом применении эффект нарастает постепенно, достигая максимума через 2-4 нед. При бронхиальной астме используют следующие препараты кромоглициевой кислоты: кромолин * , интал * , кропоз * , талеум * и др. Все указанные препараты применяют ингаляционно, обычно 4 раза в сутки. В связи с тем, что кромоглициевая кислота практически не всасывается в системный кровоток, препараты практически не оказывают системных побочных эффектов. Местные побочные эффекты проявляются в виде раздражения слизистой оболочки дыхательных путей: жжения и першения в горле, кашля, возможен кратковременный брон- хоспазм. Препараты кромоглициевой кислоты также применяют при аллергическом рините в виде капель в нос или интраназального спрея (вивидрин*, кромоглин*, кромосол*) и аллергическом конъюнктивите в виде глазных капель (вивидрин * , кромогексал * , хай-кром * , лекролин * ).
Недокромил (тайлед*, тайлед минт*) выпускают в виде кальциевой и динатриевой соли (недокромил натрий). По свойствам сходен с кромоглициевой кислотой, но имеет отличную химическую структуру. Применяют ингаляционно, в системный кровоток всасывается 8-17% вещества. Используют как средство профилактики, но не купирования бронхоспазма. Эффект нарастает постепенно, достигая максимума к концу 1-й недели регулярного применения. Назначают по 4 мг 4 раза в сутки.
Кетотифен (задитен*, зетифен*) имеет свойства стабилизатора мембран тучных клеток и блокатора Н1-рецепторов. Практически полностью всасывается из кишечника. Не очень высокая биодоступ- ность (около 50%) объясняется эффектом первого прохождения через печень; t1/2 3-5 ч. Применяют внутрь по 1 мг 2 раза в сутки (во время еды). Побочные эффекты: седативное действие, замедление психомоторных реакций, сонливость, сухость во рту, увеличение массы тела, тромбоцитопения.
Средства с антилейкотриеновым действием
Блокаторы лейкотриеновых рецепторов
Бронхоспазм, вызываемый цистеинилсодержащими лейкотриенами LTC4, LTD4 и LTE4 (ранее известными как медленно реагирующая субстанциия анафилаксии), — это результат стимуляции специфических лейкотриеновых рецепторов бронхиол (LTD4-рецепторы). Устраняют бронхоконстрикторное действие лейкотриенов конкурентные блокаторы лейкотриеновых рецепторов (см. рис. 17-1). К ним относят: зафирлукаст, монтелукаст, пранлукаст.
Зафирлукаст (аколат * ) не только устраняет бронхоспазм, вызываемый цистеиниловыми лейкотриенами (LTC4 LTD4LTE4), но и оказывает противовоспалительное действие, уменьшая проницаемость сосудов, экссудацию и отек слизистой оболочки бронхов. Из кишечника всасывается медленно и неполно. t1/2 около 10 ч. Применяют внутрь натощак (за 1 ч до еды) или через 2 ч после последнего приема пищи, 2 раза в сутки. Действие препарата развивается медленно, около суток, поэтому зафирлукаст применяют для профилактики приступов бронхиальной астмы, при длительном лечении бронхиальной астмы. Применяют его также при аллергическом рините. Побочные эффекты: диспепсия, фарингит, гастрит, головная боль. Зафирлукаст ингибирует микросомальные ферменты печени, поэтому удлиняет действие некоторых лекарственных средств.
Монтелукаст (сингулер*) избирательный антагонист LTD4-рецепторов. В отличие от зафирлукаста не ингибирует микросомальные ферменты печени (не изменяет продолжительность действия других лекарственных веществ).
Ингибиторы синтеза лейкотриенов
Зилеутон избирательно угнетает 5-липоксигеназу, препятствуя биосинтезу лейкотриенов (см. рис. 17-1). Применяют внутрь, зилеутон быстро всасывается из кишечника, t1/2 1-2,3 ч. Механизм действия препарата определяет основную сферу его применения: профилактика приступов бронхоспазма при бронхиальной астме и профилактика бронхоспазма, вызванного применением нестероидных противовоспалительных средств. Неизбирательные ингибиторы ЦОГ (особенно ацетилсалициловая кислота) могут спровоцировать бронхоспазм вследствие «субстратного шунтирования» арахидоновой кислоты (накапливающаяся при угнетении ЦОГ арахидоновая кислота расходуется на биосинтез лейкотриенов, которые и вызывают бронхоспазм).
Побочные эффекты: лихорадка, миалгия, диспепсия, головокружение.
Препараты моноклональных антител к IgE
Омализумаб (ксолаир * ) — препарат рекомбинантных человеческих моноклональных антител к IgE. Омализумаб связывается с циркулирующими в плазме крови IgE и уменьшает их количество, тем самым он препятствует связыванию IgE с высокоаффинными рецепторами FcεRI на мембранах тучных клеток. Кроме того, при регулярном применении омализумаба, количество FcεRI в мембранах тучных клеток уменьшается. Вероятно, это вторичная реакция на уменьшение количества IgE в плазме крови. Омализумаб не связывается с уже фиксированными к тучным клеткам антителами и не вызывает агглютинацию тучных клеток. При применении препарата урежаются приступы и восстанавливается чувствительность к ингаляционным глюкокортикоидам (что особенно ценно при развитии резистентности к глюкокортикоидам). Препарат вводят подкожно в дозе 150-375 мг один раз в 2-4 нед. В качестве побочных эффектов наблюдают инфекции верхних дыхательных путей (в том числе вирусные) и осложнения в местах инъекций (покраснение, боль и зуд). Возможны также головная боль и аллергические реакции.
источник
Моноклональные антитела против IgE (Ксолар) – новый препарат для достижения контроля бронхиальной астмы. Отбор пациентов и особенности лечения
- КЛЮЧЕВЫЕ СЛОВА: Ксолар, бронхиальная астма, омализумаб, bronchial asthma, monoclonal IgG1 antibodies, omalizumab, Xolair
Омализумаб (препарат Ксолар) относится к принципиально новому классу препаратов, используемых в лечении пациентов с неконтролируемой бронхиальной астмой (БА) аллергической природы. Препарат представляет собой рекомбинантные гуманизированные моноклональные антитела, относящиеся к группе иммуноглобулинов (Ig) G1, которые избирательно связываются с циркулирующим IgЕ – важнейшим медиатором аллергических реакций у пациентов с атопической (аллергической) формой БА. IgG1-каппа-антитело содержит человеческую структурную основу с определяющим комплементарность участком мышиного исходного антитела, который связывается с IgE. Омализумаб связывается с IgE и предупреждает его связывание с Fc-эпсилон-R1-рецептором, имеющим высокое сродство к IgE, снижая таким образом количество свободного IgE, способного запустить аллергический каскад.
В июне 2003 г. омализумаб был одобрен Управлением по контролю качества пищевых продуктов и лекарственных препаратов США (US Food and Drug Administration, FDA) для лечения пациентов с аллергической астмой (IgE-опосредованной) среднетяжелого и тяжелого течения при невозможности достижения контроля ингаляционными глюкокортикостероидами (ИГКС) и комбинированными препаратами, содержащими ИГКС и ингаляционные длительно действующие бета-2-агонисты (ДДБА). Омализумаб является первым, наиболее изученным и до настоящего времени единственным препаратом этого класса в лечении пациентов с БА. Его применение разрешено у взрослых и детей с 6 лет во многих странах мира, в том числе и в России. В 2011 г. в России был расширен способ дозирования препарата: верхняя граница исходного уровня IgE у пациента была изменена со значения 700 МЕ/мл до 1300–1500 МЕ/мл. Теперь диапазон использования препарата (уровень IgE) варьирует от > 30 МЕ/мл до 1300–1500 МЕ/мл [1].
Внедрение Ксолара (омализумаба) в практику российского здравоохранения позволило назначать препарат в условиях реальной клинической практики. Применение инновационного препарата довольно остро ставит вопрос о показаниях к его назначению, прежде всего, при неконтролируемой БА. В последние два десятилетия в лечении БА наблюдается значительный прогресс, тем не менее достижение контроля заболевания остается актуальной проблемой. Внедрение современной высокоэффективной базисной терапии привело к существенному улучшению качества медицинской помощи. Однако, по данным целого ряда наблюдательных исследований, у подавляющего большинства пациентов симптомы тяжелой БА не контролируются. Так, в исследовании INSPIRE (International Asthma Patient Insight Research – Международное исследование отношения пациентов к бронхиальной астме), включившем 3415 пациентов с БА в 11 странах мира, как минимум треть пациентов с тяжелым течением БА не достигали контроля заболевания при использовании наиболее эффективного стандартного лечения комбинированными препаратами [2]. Несмотря на проводимое лечение, 74% пациентов вынуждены ежедневно использовать препараты скорой помощи (бета-2-агонисты короткого действия). Важно понимать, что неконтролируемое течение БА сопряжено с высоким риском обострения БА и даже летального исхода.
Возможность достижения контроля тяжелой атопической БА очень часто осложняется не только течением самой БА, но и наличием ассоциированных с атопией сопутствующих заболеваний: аллергического ринита, синуситов, дерматита, каждое из которых приносит большие страдания пациентам.
Основными триггерами, не позволяющими достигать контроля заболевания, являются аллергены. Установлена прямая корреляционная связь между уровнем IgE и риском развития БА. В опубликованных данных клинических исследований ENFUMOSA (European Network For Understanding Mechanisms Of Severe Asthma – Европейская сеть по изучению механизмов тяжелой астмы) [3] и TENOR (Epidemiology and Natural History of Asthma: Outcomes and Treatment Regimens – Эпидемиология и течение бронхиальной астмы: исходы и схемы терапии) [4, 5] аллергия к различным аэроаллергенам была выявлена более чем у 50% и 90% пациентов с БА соответственно.
Было показано, что у пациентов, умерших от тяжелого астматического приступа, плотность рецепторов к IgE в подслизистом слое бронхов достоверно выше по сравнению с пациентами, умершими от других причин [6–9].
Омализумаб связывается с IgE и предотвращает его взаимодействие с высокоаффинным Fc-эпсилон-R1-рецептором, при этом происходит снижение количества свободного IgE, который является пусковым фактором для каскада аллергических реакций. Ксолар подавляет как раннюю, так и поздние фазы астматического ответа у пациентов. Общий уровень IgE (связанного и несвязанного) в сыворотке крови повышался после первой дозы препарата вследствие образования комплекса «омализумаб – IgE», характеризующегося более медленной скоростью выведения по сравнению со свободным IgE. На 16-й неделе после введения первой дозы омализумаба средний уровень общего IgE в сыворотке был в 5 раз выше по сравнению с таковым до лечения. После отмены Ксолара обусловленное его действием увеличение общего IgE и уменьшение свободного IgE были обратимыми. После полного выведения препарата из организма не наблюдалось увеличения концентрации IgE в сыворотке крови. При применении в рекомендуемых дозах среднее уменьшение свободного IgE в сыворотке составляло более 96%.
Кроме того, было обнаружено, что у пациентов с атопической астмой при лечении омализумабом снижается уровень циркулирующих эозинофилов и их количество в мокроте, полученной в результате стимуляции бронхов. Было также показано, что терапия Ксоларом снижает количество эозинофилов в мокроте и количество Fc-эпсилон-R1+-клеток в верхних дыхательных путях больных с аллергической астмой [10] и достоверно снижает число эозинофилов в подслизистом слое бронхов [11]. В исследовании O. Noga и соавт. наблюдалось более значительное увеличение апоптоза эозинофилов (относительно исходного показателя) к 12-й неделе терапии в группе, принимавшей омализумаб, по сравнению с группой плацебо [12]. В исследовании E.L. van Rensen и соавт. отмечено значительно более выраженное снижение количества эозинофилов (относительно исходного уровня) к 12-й неделе в группе, принимавшей омализумаб, по сравнению с группой плацебо [13].
Таким образом, Ксолар можно рассматривать как препарат, обладающим антиаллергическим и противовоспалительным действием.
- Исследование INNOVATE продемонстрировало, что у пациентов с неконтролируемой тяжелой персистирующей атопической БА добавление Ксолара к лечению (IV ступень терапии согласно рекомендациям GINA) приводит к следующим результатам:
- сокращению числа клинически значимых обострений БА на 26%;
- сокращению числа тяжелых обострений на 50%;
- значительному (на 44%) снижению числа экстренных обращений за медицинской помощью (число госпитализаций, включая госпитализацию в реанимационные отделения, незапланированных визитов к врачу) по сравнению с плацебо.
В подгруппе пациентов, ответивших на лечение омализумабом, частота клинически значимых обострений БА за 28-недельный период лечения снизилась на 60,5% по сравнению с группой плацебо (0,34 против 0,85, p 1/100 ÷ > 1/10) были боль, отек, эритема и зуд в месте введения препарата, а также головные боли. Они развивались чаще всего в течение первого часа от момента введения и сохранялись до нескольких дней, однако их выраженность значительно снижалась с каждым последующим введением.
источник
Новые биологические препараты на основе моноклональных антител обещают перевести лечение астмы в область персонализированной медицины.
По данным ВОЗ, во всем мире бронхиальной астмой страдают около 235 млн. людей. Эксперты считают, что 20% имеют тяжелую форму болезни, среди них у 20% астма неконтролируемая (симптомы, в том числе кашель, свистящие хрипы, приступы удушья, обычно наблюдаются и днем, и ночью, мешая нормальной работе и заставляя постоянно использовать ингалятор).
Чаще всего астматики лечатся ингаляционными глюкокортикостероидами, но для больных тяжелой формой астмы стандартная терапия обычно не работает, потому что у астмы много причин и форм. Так, решающую роль в некоторых формах астмы играют интерлейкины – информационные молекулы, секретируемые клетками иммунной системы. Интерлейкин-5 (ИЛ-5), например, стимулирует созревание эозинофилов и их миграцию из костного мозга. Эозинофилы защищают от инфекций, но могут вызывать в легких воспаление в ответ на действие аллергенов. Интерлейкин-13 (ИЛ-13) и интерлейкин-4 (ИЛ-4) помогают эозинофилам проникать в легочную ткань, провоцируют клетки эпителия на производство избыточной слизи и повышают жесткость дыхательных путей.
Под влиянием ИЛ-13 клетки эпителия легких вырабатывают еще одно вещество, которое участвует в развитии хронического воспаления при бронхиальной астме,– белок периостин, причем при неконтролируемом течении болезни его уровень повышается, коррелируя с повышением ИЛ-13.
Когда фармацевты и врачи это поняли, то приступили к созданию биологической таргетной терапии, направленной на блокирование этих интерлейкинов. Так была разработана серия новых препаратов на основе моноклональных антител (вырабатываются иммунными клетками, принадлежащими к одному клеточному клону).
Что предлагают фармкомпании
У некоторых биопрепаратов была непростая судьба. Так, первые испытания меполизумаба в конце 1990-х годов с треском провалились, и GlaxoSmithKline положила лекарство на полку. В результате похожей ситуации Schering Plough (сейчас входит в состав Merck) прекратила разработку реслизумаба и продала права на него другой компании.
Оба лекарства блокируют интерлейкин-5 (ИЛ-5). Ученые предположили, что так можно снизить количество эозинофилов и, соответственно, уменьшить симптомы астмы. Они думали, что помогут всем астматикам, но оказалось, что не у всех больных астму провоцирует интерлейкин-5.
Сегодня уже понятно: первые испытания были неудачными потому, что тестировали препарат не на тех пациентах. В 2009 году, когда испытания меполизумаба возобновились, было доказано, что месячный курс подкожных инъекций снижает частоту астматических приступов на 53% по сравнению с группой плацебо и позволяет уменьшить ежедневную дозу оральных кортикостероидов без потери контроля над астмой у людей с высоким уровнем эозинофилов, который не снижается кортикостероидами. В конце 2015 года меполизумаб был одобрен в Европе и США для поддерживающего лечения пациентов старше 12 лет с тяжелой астмой и эозинофилией.
Клинические испытания реслизумаба израильской компании Teva Pharmaceutical Industries завершились сентябре 2014 года, доказав, что 30-дневный курс инъекций препарата пациентам с неконтролируемой астмой и повышенным уровнем эозинофилов сокращает число приступов на 50–60% по сравнению с группой плацебо. В 2016 году препарат был зарегистрирован в Европе и США для лечения взрослых пациентов с тяжелыми формами эозинофильной бронхиальной астмы.
Бенрализумаб британской компании AstraZeneca имеет несколько иной принцип действия: он блокирует не собственно интерлейкин-5, а его рецептор, снижая уровень эозинофилов в мокроте и крови. III фаза клинических испытаний, которая закончилась в мае 2017-го, показала, что через 28 недель после начала терапии бенрализумаб сокращает потребление глюкокортикоидов на 75% (на 25% в группе плацебо), а частота приступов астмы в годовом исчислении снижается на 55–70%. Средство предназначено для подкожного введения раз в четыре или восемь недель. Заявка на регистрацию лекарства была подана в Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США в ноябре 2016 года.
Фармкомпании занимаются и другими интерлейкинами – ИЛ-13 и ИЛ-4. В 2016 году Roche представила результаты III фазы испытаний препарата лебрикизумаб для пациентов с повышенным уровнем сывороточного периостина или эозинофилов крови. Увы, эффект оказался менее выраженным, чем в исследованиях II фазы, где у больных с повышенным уровнем периостина отмечалось 60-процентное снижение числа астматических приступов.
Хорошие перспективы у дупилумаба, созданного совместно компаниями Regeneron и Sanofi. Действие препарата основано на ингибировании общего рецептора ИЛ-4 и ИЛ-13. Дупилумаб уже зарегистрирован в США как средство для лечения атопического дерматита и сейчас проходит III фазу клинических испытаний для применения при неконтролируемой персистирующей астме у взрослых и подростков 11–16 лет. Компании планируют к концу 2017-го подать заявку в Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США на лицензирование препарата. Сейчас продолжаются испытания дупилумаба для лечения носовых полипов и эозинофильного эзофагита.
За и против
Главный недостаток биологических препаратов – их дороговизна. В США годовой курс омализумаба стоит $10 000, меполизумаба – $32 500.
Есть и другие недостатки. Ведь даже среди астматиков с «правильным» биологическим профилем трудно определить, блокатор какого интерлейкина давать тому или иному пациенту, поскольку биомаркеры, привязанные к определенному лекарству, могут сочетаться. «Что давать больным: ингибитор ИЛ-5 или блокатор ИЛ-13? – вопрошает Лиам Хини, исследователь астмы в Университете Квинс в Белфасте (Великобритания) и руководитель Программы стратификации рефрактерной астмы (RASP).– Мы не можем точно сказать».
Некоторые врачи вообще скептически относятся к биопрепаратам. Так, пульмонолог Парамесваран Наир из Университета Макмастера в Гамильтоне, провинция Онтарио, Канада, уверен, что неконтролируемая астма – это чаще всего результат неправильного или нерегулярного использования имеющихся средств. Даже в группе плацебо на III фазе испытаний метолизумаба число приступов снизилось на 50%, подчеркивает он. Врач считает, что более точное назначение существующих лекарств и работа по приучению больных к регулярному и правильному их использованию позволит достичь тех же результатов, что и дорогостоящие моноклональные антитела.
Кроме того, биопрепараты – это не панацея. «Конечно, мы видим значительную разницу в количестве осложнений, но это еще не полное излечение. В идеале мы хотели бы создать препарат, который позволил бы полностью отменить любую другую терапию», – заявляет Энтони Монтанаро, глава отделения аллергии и клинического иммунологии Орегонского университета здоровья и науки в Портленде (США).
Но несмотря на все недостатки, биопрепараты – это настоящий прорыв, уверена Анна Мёрфи, фармацевт-консультант по респираторным заболеваниям университетских клиник Лестерского траста Национальной службы здравоохранения Великобритании: «Это новый шаг на пути к персонализированной медицине. Мне приятно думать, что когда-нибудь можно будет сказать: «Давайте выясним, что провоцирует астму у этого больного, и подберем ему правильное лечение».
Источник: The Pharmaceutical Journal
источник
Немногим более 20 лет тому назад в иммунологии произошло событие, которое было отмечено Нобелевской премией (Kuhler and Milstein, 1984), и которое положило начало новой эры в создании диагностических и лечебных препаратов. Это событие – разработка технологии получения моноклональных антител. Чем же моноклональные антитела отличаются от обычных, поликлональных, антител, которые продуцируются в организме млекопитающего (например, кролик, мышь, лошадь и др.) при введении антигена. Во-первых, известно, что в сыворотке крови иммунизированного животного будет содержаться, прежде всего, 2% антител, специфически реагирующих с антигеном, использованным для иммунизации. Остальные антитела будут направлены против других антигенов, с которыми организм животного встречался ранее; такие антитела представляют собой общий антительный иммунный репертуар (то, что мы называем «естественные антитела») (подробнее об антителах см. главу №6 «Иммуноглобулины»).
Во-вторых, известно, что подавляющее большинство естественно встречающихся антигенов являются сложными структурами и могут содержать в своем составе множество эпитопов (антигенных детерминант), которые иммунная система распознает и ответит выработкой конкретного специфического антитела (подробней о свойствах антигенов см. главу №4 «Антигены»). Таким образом, термин – поликлональные антитела – обозначает то обстоятельство, что в сыворотке иммунизированного животного содержатся антитела не против одной антигенной детерминанты (эпитопа), а против множества антигенных детерминант (эпитопов) конкретного антигена. Более того, эти антитела будут принадлежать не одному классу (или даже подклассу), а будут совокупностью антител разных классов.
Моноклональные антитела тем и отличаются от поликлональных, что они принадлежат к одному классу иммуноглобулинов (как правило, IgG) и что по специфичности своей они направлены против одной единственной детерминанты конкретного сложного антигена. Образно говоря, если организм представить стогом сена, а чужеродный микроб с характерной для него антигенной детерминантой – иголкой, то обнаружить эту иголку с помощью моноклонального антитела не составляет трудностей.
В чем коротко суть технологии получения моноклональных антител. Известно, что после иммунизации животного (как правило, это инбредные лабораторные мыши) в их селезенке содержатся В-лимфоциты, специфически отреагировавшие на все антигенные детерминанты, т.е. на каждую антигенную детерминанту – свой В-лимфоцит. Заслуга авторов Нобелевской премии, по сути дела, заключалась в идее создать из двух клеток – одну, но бессмертную. Они взяли из селезенки иммунизированной мыши В-лимфоцит и с помощью специальной технологии соединили его с миеломной клеткой. Получилась новая клетка, которая от В-лимфоцита взяла специфичность по отношению к конкретной антигенной детерминанте, а от миелоидной клетки – бессмертие и способность продуцировать иммуноглобулин одного класса. Такая клетка получила название – гибридома. Ее можно помещать в организм мыши, где она превратится в опухоль, продуцирующую моноклональные антитела, накапливающиеся в асцитной жидкости; или содержать в условиях культуры клеток in vitro, нарабатывая нужное количество моноклональных антител. В последующем такие моноклональные антитела подвергаются очистке различными методами и используются либо как диагностический инструмент, либо в виде фармпрепарата.
Говоря о фармпрепаратах на основе моноклональных антител, следует вспомнить еще несколько терминов. Полученное с помощью гибридомы моноклональное антитело является мышиным (как правило) иммуноглобулином и при введении в организм человека вызовет иммунный ответ против себя. Это приведет к тому, что при последующих введениях такого фармпрепарата, его эффективность буде нейтрализована антителами против него с развитием возможных побочных эффектов (вплоть до угрожающих жизни). Выход из положения был найден с помощью рекомби-нантных технологий. Вначале получили т.н. химерное моноклональное антитело. Известно, что специфичность иммуноглобулинов связана с F(ab)2 фрагментом. Взяв F(ab)2 фрагмент от мышиного моноклонального антитела и соединив его с Fс-фрагментом человеческого иммуноглобулина получили химерное моноклональное антитело, которое было уже ближе к человеческому организму, но все же продолжало вызывать иммунный ответ на себя. Следующий шаг в разработке фармпрепаратов на основе моноклональных антител был связан с созданием т.н. гуманизированных моноклональных антител, на 90% гомологичных человеческому иммуноглобулину. От первоначального гибридомного мышиного моноклонального антитела осталась лишь небольшая часть F(ab)2 фрагментов, отвечающих за специфическое связывание (гипервариабельные регионы). Фармпрепараты на осн ове гуманизированных моноклональных антител высокоспецифичны, фактически не иммуногены и обладают высоким профилем безопасности.
Нет сомнений, что в будущем диагностика и лечение огромного числа состояний и заболеваний будет связана с развитием гибридомной и рекомбинантной технологии. Например, к 2005 году в США разрешены к использованию в клинике 36 фармпрепаратов на основе моноклональ-ных антител. Еще большее их количество проходит клинические испытания.
ИНФЛИКСИМАБ (зарегистрирован в Украине по названием Ремикейд) – один из первых препаратов, созданных для антицитокиновой терапии.Представляет собой химерное моноклональное антитело, направленное против опухоль-некротизирующего фактора (ОНФ). При введении в организм связывается с ОНФ и блокирует его способно с т ь соед и н я ться со свои м р ецепт ором. Так и м обра з ом нейт ра ли зуется п ро-восп а л ите л ьны й потенциал ОНФ. Выпускается во флаконах, содержащих 100 мг препарата; вводится в/в, в течение 2-3 часов. Период полураспада введенной разовой дозы 5мг/кг – около 10 дней. Не наблюдали аккумулирования препарата при его введении три раза с 2-4 недельными интервалами. Клинический ответ на введение инфликсимаба обычно регистрируется через 2 недели.Показан для лечения болезни Крона, ревматоидного артрита и др. аутоиммунных заболеваний, резистентных к лечению традиционными препаратами.
Наиболее частый побочный эффект – тошнота. Кроме этого, во время введения препарата возможно появление боли в груди, лихорадки, покраснение лица, головная боль, крапивница, диспноэ, гипотония. Повторное введение инфликсимаба после длительного перерыва (2-4 года) в 25% случае сопровождалось развитием признаков сывороточной болезни через 3-12 дней после инфу-зии. При длительном применении инфликсимаба описаны случаи развития аутоиммунных заболеваний, серьезных инфекций или опухолей. Инфликсимаб не назначают при беременности.
Этанерцепт – представляет собой растворимый рецептор опухоль-некротического фактора человека, искусственно созданный с помощью рекомбинантных технологий. При введении в организм человека Этанерцепт связывается с ОНФ, находящимся в циркуляции и «отвлекая таким образом «на себя» ОНФα, нейтрализует его про-воспалительный потенциал». Введение под кожу разовой дозы Этанерцепта в 25 мг приводило к пику его концентрации в сыворотке через 3 дня, а период полужизни составил 5 дней.Основным показанием для Этанерцепта является ревматоидный артрит; ведутся клинические испытания по использованию Этанерцепта в лечении других аутоиммунных заболеваний, при которых доказано повышение концентрации ОНФα.
Рекомендуемая доза применения Этанерцепта у больных с активным ревматоидным артритом – 25 мг/м2, п/к, дважды в неделю.
Побочные эффекты в основном связаны с различными реакциями в месте введения. Описано появление антител против Этанерцепта; однако эти антитела не обладали нейтрализующими свойствами. В течение одного года наблюдения за больными, получавшими Этанерцепт, описаны появление у части из них ауто-антител, однако клинических признаков аутоиммунного заболевания не отметили.
РИТУКСИМАБ (зарегистрирован в Украине) – представляет собой «химерное» моноклональ-ное антитело субкласса IgG/κ, направленное против СД20-антигена. Ритуксимаб связывается с молекулой СД20, экспрессирующейся на поверхности большинства нормальных и малигнизи-рованных В-лимфоцитов, вызывая их последующий лизис. Под влиянием Ритуксимаба количество В-лимфоцитов в периферической крови, лимфатических узлах и костном мозге уменьшается. Есть также данные о том, что Ритуксимаб повышает чувствительность клеток лимфомы к цитотоксическому эффекту некоторых противоопухолевых препаратов.
Основным показанием для Ритуксимаба является low-grade (“indolent”) В-клеточная не-Ходжкинская лимфома.
Период полужизни Ритуксимаба прямо пропорционален его дозе и как правило удлиняется между первым и последующими введениями. В одном из исследований сообщалось, что период полужизни Ритуксимаба возрос между первой и четвертой инфузией в среднем с 33 до 77 часов. Сообщали об эффективности Ритуксимаба как монотерапии у больных с лимфомой при введении 375 мг/м2, медленно, в/в, еженедельно, на протяжении 4 недель. Более эффективным оказалось применение Ритуксимаба в комплексе с циклофосфамидом, доксорубицином, вин-кристином и преднизолоном.
Чаще всего побочные эффекты возникают при первой инфузии. К ним относятся: повышение температуры, озноб, тошнота, рвота, гипотензия, миалгии, боль в местах болезни, бронхоспазм, ангионевротический отек и зуд. Обычно эти побочные эффекты поддавались купированию при снижении темпа введения препарата или временному его прекращению, а также назначению симптоматического лечения, в том числе, антигистаминных препаратов.
ЭПРАТУЗУМАБ – еще один препарат, представляющий собой моноклональное антитело, направленное против В-лимфоцитов; в этом случае мишенью является молекула СД22, экспрес-сирующаяся на поверхности В-лимфоцитов. Введение Эпратузумаба, так же, как и в случае с Ритуксимабом, приводит к глубокому снижению количества В-лимфоцитов. Показана клиническая эффективность применения Эпратузумаба при аутоиммунной гемолитической анемии.
В последние годы ведутся интенсивные клинические исследования эффективности Эпрату-зумаба и Ритуксимаба при аутоиммунных заболеваниях, в механизме развития которых играют роль не только Т-, но и В-лимфоциты (системная красная волчанка, ревматоидный артрит и др.).
БАЗИЛИКСИМАБ (Симулект, «Новартис») – зарегистрирован в Украине – представляет собой «г уманизированное» моноклона льное а н т и те ло, на п ра в лен но е п ро т и в молек ул ы СД25, п ред-ста в л я ющей со бой α-субъединицу рецептора к интерлейкину-2. Связыва ясь с СД25, ба зиликси-маб блокирует рецептор и не позволяет интерлейкину-2 соединяться со своим рецептором и таким образом подавляется пролиферация клеток (подробнее см. о механизме действия Базиликсимаба в разделе 25.5.2.).
В Украине зарегистрирован еще один препарат, аналогичный Базиликсимабу – Даклизумаб (Хоффман Ля Рош).
Препараты h1F1 и h3D1 – (фирма Wyeth) – представляют собой «гуманизированные моно-клональные антитела, направленные против ко-стимуляционных молекул СД80 и СД86, соответственно, экспрессированных на поверхности антиген-презентирующих клеток.Мы уже писали, что для активации Т-лимфоцитов необходимо по крайней мере два сигнала. Один из них передается при контакте ТАГРР и молекулы ГКГ II класса на АПК. А второй связан с взаимодействием ко-стимуляционных молекул. Одной из таких пар ко-стимуляционных молекул есть молекулы СД80/86 на антиген-презентирующей клетке и молекула СД28 на Т-лимфоците. Их взаимодействие активирует Т-лимфоцит и индуцирует его пролиферацию. Введенные в организм препараты h1F1 и h3D1 связываются с молекулами СД80/86 на поверхности антиген-презентирующих клеток и таким образом блокируют передачу активацион-ного сигнала Т-лимфоцитам. Первые клинические испытания препаратов у больных с почечным аллотрансплантатом показали их эффективность и хорошую переносимость. Есть данные о применении этого метода лечения у больных с псориазом и ревматоидным артритом.
CTLA4Ig – препарат, созданный с помощью рекомбинантных технологий, представляет собой растворимый рецептор, состоящий из внеклеточной части молекулы CTLA-4, соединенной с Fc-фрагментом иммуноглобулина (Ig). Это еще один препарат, созданный для блокады передачи ко-стимуляционного активирующего сигнала.
Известно, что кроме молекулы СД28 (активирующей) на Т-лимфоците есть молекула CTLA-4 (СД152), взаимодействие которой с теми же молекулами СД80/86 на АПК ингибирует активность Т-лимфоцита. Однако появление молекулы CTLA-4 на поверхности Т-лимфоцита является транзиторным и наблюдается только после его активации. Поэтому ученые решили создать растворимую молекулу CTLA-4, которая бы при введении в организм блокировала молекулы СД80/86 на АПК и не позволяла бы им активировать Т-лимфоцит через молекулу СД28.
Первые клинические испытания CTLA4Ig показали его эффективность в лечении больных после пересадки почки, а также у больных с псориазом.
ЭФАЛИЗУМАБ (Efalizumab) – представляет собой «гуманизированное» антитело, направленное против адгезивной молекулы LFA-1 (СД11а).
Известно, что адгезивные молекулы играют важную роль в контакте клеток иммунной системы между собой при передаче активационных сигналов, при миграции клеток, выполняющих свою основную функцию иммунного надзора и т.д. Одной из таких пар адгезивных молекул являются молекула LFA-1 на Т-лимфоците и ее лиганд молекула ICAM-1 на антиген-презентирующей клетке.При введении в организм Эфализумаб связывается с молекулой LFA-1 и таким образом блокирует Т-клеточную активацию, миграцию и адгезию.Клинические испытания показали эффективность Эфализумаба у больных с псориазом и у больных с почечным аллотрансплантатом.В качестве побочных эффектов отмечают возможность развития лимфо-пролиферативных заболеваний при использовании больших доз Эфализумаба.
АЛЕФАЦЕПТ (Alefacept) – представляет собой растворимый белок, состоящий из молекулы LFA3 и молекулы IgG1, который создан с помощью рекомбинантных технологий. Молекула LFA3 (lymphocyte function antigen – 3) – экспрессируется на поверхности антиген-презентирующей клетки и является лигандом для молекулы СД2, которая экспрессируется на Т-лимфоците. Взаимодействие этой пары молекул несет дополнительный ко-стимуляционный сигнал, без которого активация Т-лимфоцита не наступит. При введении в организм Алефацепт связывается с молекулой СД2 и блокирует ее, не позволяя антиген-презентирующей клетке передать ко-стимуляционный сигнал своей собственной молекулой LFA3. Таким образом, предотвращается активация и пролиферация Т-лимфоцитов, а также усиливается селективный апоптоз Т-клеток.
Показана эффективность Алефацепта у больных с почечным аллотрансплантатом, а также при лечении больных с псориазом.
КЛЕНОЛИКСИМАБ (Clenoliximab) – моноклональное антитело, направленное против молекулы СД4. Известно, что молекула СД4, экспрессирующаяся на Т-лимфоцитах-хелперах, играет важную роль в развитии иммунного ответа на этапе распознавания Т-лимфоцитом информации об антигене, которая передается антиген-презентирующей клеткой. Первые попытки получив препарат на основе моноклональных антител против молекулы СД4 и с его помощью уменьшить в циркуляции количество СД4+ Т-лимфоцитов-хелперов делались давно и неоднократно. Однако такие лизирующие антитела, резко уменьшающие количество СД4+ Т-лимфоцитов успеха не принесли. Кленоликсимаб – одно из первых моноклональных антител (т.н. non-depleting) не снижающих количество СД4+ Т-лимфоцитов, но подавляющих их функциональную активность. Подобные non-depleting препараты на основе анти-СД4-моноклональных антител получены и другими фирмами; к ним относится OKT cdr4a.Получены первые данные о клинической эффективности Кленоликсимаба, в частности, при лечении ревматоидного артрита. hOKT3γ1 (Ala-Ala) – «гуманизированное» моноклональное антитело, направленное против СД3 структуры Т-клеточного антигенраспознающего рецептора. Следует отметить, что ОКТ-3 как фармпрепарат на основе анти-СД3 моноклональных антител был один из первых подобного рода препаратов, использованных в клинике при лечении больных после пересадки органов. В механизме действия препарата различают два момента: 1) цитотоксический эффект, приводящий к резкому снижению количества CD3+ Т-лимфоцитов; 2) блокирующий эффект, связанный с блокадой СD3-структуры антигенраспознающего рецептора Т-лимфоцитов и нарушением вследствие этого трансдукции сигнала при распознавании донорских антигенов. ОКТ-3 – один из наиболее распространенных биологических препаратов на основе моноклональных антител, нашедший широкое применение в клинической практике. После первой инъекции препарата в периферической крови резкое уменьшение количества Т-лимфоцитов отмечается буквально в течение первых 30–60 мин, связано не только с изменением числа Т-лимфоцитов, но и с другими эффектами, в частности перераспределением Т-клеток. Более того, уменьшение количества CD3+ клеток не является комплементзависимым, а вовлекаются и другие возможные механизмы, например усиление фагоцитоза после опсонизации Т-лимфоцитов с помощью моноклональных антител. Описано также усиление апоптоза Т-лимфоцитов после введения ОКТ-3 антител. Препарат широко используется не только при пересадке органов, но и в клинике аутоиммунных заболеваний. Однако препарат ОКТ-3 обладал выраженным цитотоксическим эффектом по отношению к Т-лимфоцитам, что сопровождалось выраженным синдромом гиперпродукции цитокинов. Эти побочные эффекты послужили толчком для создания новых препаратов. Одним из них является hOKT3γ1 (Ala-Ala), который сохранил в своем механизме блокирующий эффект, связанный с блокадой СД3-структуры антигенраспознающего рецептора Т-лимфоцитов и нарушением вследствие этого трансдукции сигнала при распознавании чужеродных антигенов. Вместе с тем, его действие на Т-лимфоциты более «мягкое» и не вызывает столь выраженную Т-лимфопению; отсутствуют также симптомы «цитокинового шторма» и активации системы комплемента.
Препарат используется в трансплантологии и клинике аутоиммунных заболеваний (сахарный диабет).
Проходит клинические испытания еще один анти-СД3 препарат, который получил название CAMPATH-3.
АЛЕМТУЗУМАБ (Campath 1H) – гуманизированное моноклональное антитело, направленное против молекулы СД52. Поскольку молекула СД52 экспрессируется на Т- и В-лимфоцитах, введение в организм Алемтузумаба приводит к выраженному снижению этих клеток в циркулирующей крови.
Алемтузумаб в комбинации с другими препаратами с успехом используется в трансплантологии.Показана также его эффективность при лечении В-клеточной хронической лимфоцитарной лейкемии.
Омализумаб – первый препарат на основе моноклональных антител, направленных против IgE. Известно, что аллергическое воспаление, опосредованное IgE, лежит в основе атопических заболеваний, к которым относятся бронхиальная астма, ринит, атопический дерматит и др. (подробнее об атопии см. раздел II «Аллергология»).
Клинические исследования показали, что введение Омализумаба быстро снижает концентрацию IgE в сыворотке крови, что сопровождается положительной динамикой в клинической картине бронхиальной астмы и ринита; улучшается также качество жизни больных.Препарат разрешен для лечения больных с атопической бронхиальной астмой и атопическим ринитом.
АНАКИНРА (Anakinra) (США) – представляет собой искусственно созданный с помощью ре-комбинантных технологий антагонист рецептора для интерлейкина – 1. Известно, что многие хронические воспалительные заболевания протекают на фоне повышенной продукции ИЛ-1. Интерлейкин-1, связываясь со своим рецептором, поддерживает воспалительный ответ.При введении в организм Анакинра связывается с ИЛ-1 и не позволяет ему соединяться со своим рецептором. Это приводит к снижению воспалительной реакции.Проведенные клинические испытания показали эффективность препарата и его хорошую переносимость у больных с ревматоидным артритом.Наиболее частым побочным эффектом была реакция на месте введения.Клинический эффект был сопоставим с таковым от инфликсимаба и этанерцепта.
БЕТАЛЕЙКИН (РОССИЯ) — препарат является лекарственной формой рекомбинантного ин-терлейкина -1β человека, получаемого по генно-инженерной технологии. ИЛ-1 действует на кроветворные клетки на разных этапах их созревания, включая стадию полипотетных стволовых клеток. Поэтому применение ИЛ-1 приводит к возрастанию не только количества гранулоцитов, но также тромбоцитов и лимфоцитов. Важной особенностью применения Беталейкина является возможность его использования одновременно с курсом химиотерапии. Препараты КСФ не могут быть использованы до окончания химиотерапии. Препараты КСФ не могут быть использованы до окончания химиотерапии и их применение ограничено только восстановлением подавленного лейкопоэза. Применение препарата ИЛ-1 на фоне продолжающейся химиотерапии позволяет не допустить падения числа лейкоцитов до критического уровня. Таким образом, Беталейкин может быть использован и как средство лечения и как средство профилактики токсической лейкопении, вызванной применением различных схем химиотерапии. Действие Беталейкина заключается не только в увеличении количества лейкцитов, но и приводит к усилению их функциональной активности. Активация хемотаксиса продукции кислородных радикалов и фагоцитоза нейтрофиль-ных гранулоцитов является составной частью иммуностимулирующегодействия ИЛ-1.
Беталейкин используется в широкой медицинской практике по следующим основным направлениям:
- В онкологии – для комбинированной терапии рака средство восстановления и защиты костномозгового кроветворения. Препарат может быть также использован для лечения отдельных видов опухолей (меланома, рак почки, рак мочевого пузыря).
- В клинике внутренних болезней – для лечения инфекционных заболеваний, в том числе туберкулеза. Хронических вирусных гепатитов В и С, вторичных иммунодефицитных состояний, вялотекущих воспалительных процессов.
- В хирургии – для лечения больных с травмами. Ожогами, трофическими язвами, абсцессами, флегмонами. Послеоперационными осложнениями инфекционной природы с явлениями анергии.
- В оторинатологии – для лечения хронических гнойных риносинуситов и отитов.
- В урологии и гинекологии – для лечения больных с хламидийной инфекцией и герпес-вирусной инфекцией.
РОНКОЛЕЙКИН («Биофарма», Украина) — рекомбинантный интерлейкин-2 человека (рИЛ-2), который по биологической и иммунологической активности не отличается от природного интерлейкина – 2 человека.
Выпускается в виде лиофилизированного порошка для приготовления раствора для инъекций по 1 000 000 МЕ, 500 000 МЕ, 250 000 МЕ в ампулах. Препарат относится к классу интер-лейкинов. Интерлейкин-2 продуцируется субпопуляцией Т-лимфоцитов (Т-хелперы 1) в ответ на антигенную стимуляцию. Синтезированный ИЛ-2 воздействует на Т- лимфоциты, усиливая их пролиферацию и последующий синтез ИЛ-2.Биологические эффекты ИЛ-2 опосредуются его связыванием со специфическими рецепторами, представленными на различных клеточных мишенях.
ИЛ-2 направленно влияет на рост, дифференцировку и активацию Т- и В-лимфоцитов, макрофагов, олигодендроглиальных клеток, эпидермальных клеток Лангерганса. От его присутствия зависит развитие цитолитической активности натуральных киллеров и цитотоксических Т- лимфоцитов. ИЛ-2 вызывает образование лимфокин-активированных киллеров и активирует опухоль-инфильтрирующие клетки.
Расширение спектра лизирующего действия эффекторных клеток обуславливает элиминацию различных патогенных микроорганизмов, инфицированных и малигнизированных клеток, что обеспечивает иммунную защиту, направленную против опухолевых клеток, а также вирусной, бактериальной и грибковой инфекций.
Показания. Иммунокоррекция при патологических состояниях, которые обусловлены или сопровождаются вторичной иммунной недостаточностью:
- Гнойно – воспалительные заболевания: сепсис различной этиологии (посттравматический, хирургический, акушерско-гинекологический, ожоговый, раневой и др.), перитониты, панкреатиты, пиелонефриты, эндометриты, остеомиелиты, абсцесы и флегмоны, стойкие пиодермии, рожистое воспаление, синуситы и др.
- Инфекционные заболевания: туберкулёз, хронический гепатит С, иерсиниоз, хламидиоз, герпес, цитомегаловирусная инфекция, хантавирусная инфекция, микозы, СПИД.
- Онкологические заболевания: почечноклеточный рак, меланома, колоректальный рак, поверхностный рак мочевого пузыря.
- Профилактика вторичного иммунодефицита, обусловленного проведением лучевой, медикаментозной терапии или хирургического лечения.
Применение .Внутривенное введенние
Гнойно – воспалительные заболевания: курс лечения 1 – 3 инъекции в дозах 0.25 – 0.5 – 1 млн. МЕ с интервалами между введениями 1, 2 или 3 дня.
Инфекционные заболевания: курс лечения от 2 до 24 инъекций в дозах 0.25 – 0.5 – 1 млн. МЕ с интервалами между введениями 1, 2 или 3 дня.
Онкологические заболевания: курсовые дозы препарата составляють от 8 до 30 млн. МЕ, повторные курсы проводятся через 1 – 2 месяца.
Профилактика вторичного иммунодефицита: дозы и длительность лечения Ронколейки-ном® зависят от начального состояния иммунной системы организма, основного лечения и динамики показателей иммунореактивности.
Возможны различные пути введения: в/в, эндолимфатическое, подкожное, инстилляция в околоносовые пазухи, в уретру, в мочевой пузырь, а также пероральный прием препарата.
Побочное действие. В некоторых случаях может наблюдаться кратковременный гриппопо-добный синдром, который является следствием процесса активации иммунной системы и не требует дополнительного лечения.
Противопоказания. Повышенная чувствительность к интерлейкину -2 или другому компоненту в анамнезе, аллергия на дрожжи, беременность, декомпенсированная сердечная, печеночная, почечная недостаточность; метастазы в головной мозг.
Особенности применения. Применение Ронколейкина® при аутоиммунных заболеваниях требует тщательного иммунологического контроля. Быстрое внутривенное введение препарата приводит к созданию высокой концентрации ИЛ-2 в системном кровообращении, что может сопровождаться явлениями сердечно-сосудистой недостаточности.
Заключая раздел подчеркнем наиболее важные побочные эффекты препаратов, возможность которых широко обсуждается:
- Сенсибилизация вследствие чужеродности моноклональных антител, которая может снижать эффект подобного рода препаратов.
- В некоторых случаях развитие неконтролируемой иммунной супрессии, которая может привести к развитию инфекционных осложнений. Особенно это возможно в случаях комбинирования биологических иммуносупрессивных препаратов с химическими.
- При введении ОКТ-3, т. е. препаратов против CD3 структуры антигенраспознающего рецептора, может наблюдаться активация Т-лимфоцитов.
Приведем дополнительно перечень кратко охарактеризованных препаратов на основе моно-клональных антител, созданных в последние годы.
Адалимумаб – полностью гуманизированные рекомбинантные моноклональные антитела против ОНФα. Предназначены для лечения ревматоидного и псориатического артрита.
Атасисепт – рекомбинатный химерный белок, содержащий внеклеточный лиганд — связывающий фрагмент рецептора TACI, трансмембранный активатор и Са-модулятор и модифицированный Fc-фрагмент человеческого IgG. Атасисепт является антагонистом двух цитокинов – BLys (стимулятора В-лимфоцитов) и APRIL (индуцирующего пролиферацию лиганда А), которые влияют на созревание, функционирование и выживание В-клеток. Показания — лечение системной красной волчанки, ревматоидного артрита, В-клеточных злокачественных новообразований и рассеянного склероза.
Афлиберцепт — рекомбинантный белок, состоящий из внеклеточных доменов человеческого рецептора фактора роста эндотелия сосудов, соединенных с компонентом Fc- фрагмента человеческого IgG1. Специфический антагонист циркулирующего VEGF.
Бевацизумаб – моноклональные антитела против фактора роста сосудистого эндотелия. Показания – лечение метастазов колоректальной карциномы (совместно с 5-фторурацил).
Голимумаб — человеческое моноклональное антитело к ФНО-а. Показания — лечение ревматоидного артрита.
Даклизумаб — моноклональное гуманизированное антитело (IgG1) против с а субединицы рецептора человеческого ИЛ-2 (СД25), который экспрессируется на активированных лимфоцитах после взаимодействия с чужеродным антигеном. Показания — лечение острого криза отторжения.
Денилейкин — дифтитокс — рекомбинатный составной белок, состоящий из фрагмента дифтерийного токсина, связанного с человеческим ИЛ-2. Показания — лечение рецидивирующей или рефрактерной кожной Т-клеточной лимфомы.
Деносумаб — моноклональные антитела подкласса IgG2 против рецептора-активатора ядерного фактора каппа В (RANKL) человека.
Ибритумомаб — Тиуксетан — Анти-СД20 моноклональные антитела. Показания — лечение рецидивирующей или рефрактерной фолликулярной не-ходжинской лимфомы после лечения ритуксимабом.
Ипилимумаб — человеческое анти CTLA-4 моноклональное антитело (IgG1). Подавляет взаимодействие CTLA-4 с В7.1 и В7.2, что способствует активации иммунного ответа. Показания — лечение меланомы.
Катумаксомаб (Ремоваб) — моноклональное трифункциональное антитело, имеющее 2 разных антиген-связывающих фрагмента и 3й функциональный связывающий фрагмент. Активно связывается с опухолевыми клетками через специфический связывающий фрагмент для СД3. Своим Fc-фрагментом активирует вспомогательные клетки, имеющие рецептор к Fcy (FcyR+ клетки). Показания — лечение эпителиальных опухолей.
Лебрикизумаб — гуманизированное моноклональное антитело (IgG4) против ИЛ-13. Показания — лечение бронхиальной астмы.
Муромонаб — анти-СД3 мышиные IgG2 моноклональные антитела. Показания — лечение острого криза отторжения почечного аллотрансплантата.
НАТАЛИЗУМАБ (Тизабри) — рекомбинантное гуманизированное антителопротив а4-интегринов-а4(31 и а4(37. Блокирует взаимодействие а4(37-интегрина с молекулой адгезии слизистой оболочки, аддресином-1 (MadCAM-1). Нарушение этих молекулярных связей препятствует миграции моно-нуклеарных лейкоцитов через эндотелий в воспалительную паренхиму. Дополнительный механизм действия натализумаба может быть обусловлен его способностью угнетать воспалительные реакции в тканях вследствие угнетения взаимодействия а4-экспрессирующих лейкоцитов с их лигандами во внеклеточном веществе и на клетках паренхимы. За счет подобного механизма действия натализумаб способен угнетать очаговые воспалительные реакции и ингибировать дальнейшее поступление иммунных клеток в воспалительные ткани. Показания — лечение рассеянного склероза.
Очаги поражения при рассеянном склерозе возникают при проникновении активированных Т-лимфоцитов через гематоэнцефалический барьер. После миграции через гематоэнцефали-ческий барьер лейкоциты вступают во взаимодействие с молекулами адгезии на поверхности воспалительных клеток и эндотелиальных клеток на стенках кровеносных сосудов. Взаимодействие между а4(31 и мишенями является важной составляющей патологического воспаления тканей мозга, нарушения этих взаимодействий снижает воспаление. У здорового человека адгезивные молекулы клеток сосудов-1 (VCAM-1) не экспрессируются в паренхиме мозга. Однако, в присутствии провоспалительных цитокинов молекулы VCAM-1 появляются на поверхности эндотелиальных клеток и, возможно, на поверхности глиоцитов вблизи очага воспаления. В условиях воспаления тканей центральной нервной системы (ЦНС) при рассеянном склерозе, взаимодействие а4(31 с молекулами VCAM-1, соединительным сегментом-1 (CS-1) и остеопоэти-на обуславливает крепкую адгезию и миграцию лейкоцитов в паренхиму мозга, запуская тем самым воспалительный каскад в тканях ЦНС. Блокирование молекулярных взаимодействий а4р1 с его мишенями при рассеянном склерозе снижает уровень воспалительных процессов в тканях мозга и ингибирует дальнейшее поступление иммунных клеток в очаг воспаления.
Нейгранин — полностью рекомбинантный гибридный белок, состоящий из сывороточного альбумина человека и человеческого гранулоцитарного колониестимулирующего фактора-1 (Г-КСФ1), полученного методом рекомбинантной ДНК-технологии. Сохраняет фармакологическую активность Г-КСФ in vivo, т.е. стимулирует мобилизацию нейтрофилов и гемопоэтических стволовых клеток из костного мозга.
Окрелизумаб – гуманизированное, гликозилированное моноклональное антитело против CD 20 (В-лимфоциты). Показания — лечение ревматоидного артрита.
Панитумумаб – рекомбинатное, гуманизированное IgG2 моноклональное антитело против человеческого рецептора эпидермального фактора роста (EGFr). EGFr способствует росту клеток в нормальной эпителиальной ткани, включая кожу и фолликулы волос, и экспрессируется на многих опухолевых клетках. Панитумумаб связывается с лигандным участком связывания EGFr и ингибирует аутофосфорилирование рецептора, вызванное всеми известными лигандами EGFr. Связывание панитумумаба с EGFr приводит к интернализации рецептора, ингибирования роста клеток, индукции апоптоза и снижению продуцирования интерлейкина 8 та сосудистого эндотелиального фактора роста. Добавление панитумумаба к радиационной терапии, химиотерапии и/или другим целевым терапевтическим средствам в исследованиях на животных приводило к повышению противоопухолевого эффекта по сравнению с использованием радиационной терапии, химиотерапии или целевых терапевтических средств без панитумумаба.
Саграмостим (Лейкин) — рекомбинантный человеческий гранулоцитарно-моноцитарный ко-лониестимулирующий фактор. Показания — лечение болезни Крона. В США 400.000 – 600.000 больных болезнью Крона. Поражения трансмуральные, обычно гарнуломатозные воспалительные, изъязвление мукозных, интестинальных структур, образование фистул. Вне ЖКТ – артриты, артралгии, ирититы, увеиты.
Танезумаб – гуманизированное IgG2 моноклональное антитело против фактора роста нервной ткани (ФРН). Показания – лечение средней тяжести или тяжелой хронической боли.
Тоцилизумаб – рекомбинантные гуманизированные моноклональные антитела против рецептора ИЛ-6. Показания – лечение ревматоидного артрита со средней или высокой степенью активности.
Трастузумаб – гуманизированные моноклональные антитела против HER2. Показания – лечение рака груди.
Цетуксимаб (Эрбитукс) – моноклональные химерные антитела (IgG1-класса) против рецептора эпидермального фактора роста. Показания – лечение колоректального рака; сквамозной карциномы головы и шеи.
Эрлотинив/Гефитиниб – ингибитор тирозин киназы рецептора эпидермического фактора роста. Показания – лечение рефрактерного или метастатического не-мелко-клеточного рака легких, метастатического рака груди, рака поджелудочной железы (Эрлотиниб), не-мелко-клеточного рака легких (Гефитиниб).
GSK 315234 А – гуманизированное моноклональное антитело против Онкостатина М.
Онкостатин М – элемент из семейства ИЛ-6, присутствует в воспаленном синовиальном слое и крови пациентов с ревматоидным артритом. Активизирует эндотелий, стимулирует высвобождение воспалительных медиаторов, пролиферацию синовиальных клеток, развития кровеносных сосудов, хрящевой распад, остеокластогенез, развитие костной эрозии.
LY 212 739 9 – гуманизированные моноклональные антитела (IgG4) против мембраносвязан-ного растворимого фактора, активирующего В-лимфоциты (BAFF).
ONY-P — вакцина для лечения рака предстательной железы без определенных метастазов у пациентов с первыми признаками резистентности к гормональной терапии. Препарат состоит из 2х компонентов, которые представляют собой аллогенные клетки, полученные из тканей предстательной железы человека; первый компонент — Р4Е6 – клеточная линия, полученная из тканей первичной опухоли предстательной железы; второй компонент — OnyCap23, субклон клеток здоровой предстательной железы, который по своему генному профилю схож с клетками костных метастазов.
МДХ – 010-06 — моноклональные человеческие антитела против молекул CTLA-4, угнетающих иммунную систему. Нейтрализация CTLA-4 усиливает ответ активированных Т-клеток.
МДХ-1100-06 — человеческие антихемокиновые CXCL моноклональные антитела. Показания — лечение активного язвенного колита.
источник

