Патогенез бронхиальной астмы – это механизм, согласно которому развивается недуг. Он состоит из двух стадий. Бронхиальная астма — хроническое воспаление органов системы дыхания. Больной сталкивается с дискомфортом в грудной клетке, приступами, которые сопровождаются характерным хрипом, одышкой, сильным кашлем утром и ночью. Симптоматику можно облегчить благодаря проведению специальной терапии.
Этиология и патогенез любой по виду бронхиальной астмы позволяют понять причину возникновения патологии и разработать грамотный план лечения. Для астматиков это гарантирует улучшение самочувствия в самые короткие сроки. Этиология бронхиальной астмы — это совокупность причин, из-за которых наблюдается увеличенная гиперактивность бронхов. Патогенез данной болезни выступает главным фактором её развития. Причём вид недуга и причины его появления здесь не имеют никакого значения.
Патогенез любого вида бронхиальной астмы базируется на двух реакциях: патофизиологическая и иммунологическая. Во втором случае в дыхательные пути проникает аллерген, который приводит к соответствующей реакции. При патофизиологической реакции наблюдается гиперреактивность бронхов в качестве ответа на воспаление в данном органе. У пациента сужается бронхиальный просвет, в результате чего ему становится сложно дышать. Могут произойти такие реакции:
- ранняя: спустя одну-две минуты происходит удушье. Кульминация наступает на пятнадцатой-двадцатой минуте. Обострение продолжается два часа;
- поздняя: через четыре-шесть часов возникает воспаление. Кульминация приходится на четвёртый-шестой час. Процесс длится двенадцать часов.
Обратите внимание! Многие больные сталкиваются с нарушениями ЦНС. Из-за патологического рефлекса появляется бронхоспазм, проходящий сквозь блуждающий нерв.
При любой симптоматике на лечение уходит немало времени и сил. Крайне важно, чтобы оно протекало комплексно. Происходит воздействие сразу на несколько систем органов.
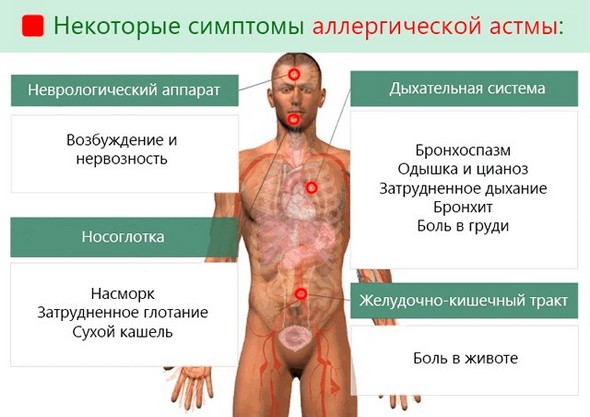
Этиопатогенез у маленьких больных включает затруднение носового дыхания, зуд кожи, чиханье, нарушение аппетита, беспокойство. Первые симптомы появляются настолько быстро, что нередко их не удаётся зафиксировать.
Обратите внимание! При бронхиальной астме у детей всегда возникает глюкокортикоидная недостаточность. Это довольно опасное состояние.
У маленьких пациентов приступ обычно возникает по ночам. Он сопровождается сильной головной болью, высоким артериальным давлением, тахикардией. Патогенез также включает сухие свистящие хрипы. Ребёнок становится бледным.
Патогенез бронхиальной астмы у всех детей определяется и выраженностью симптомов, и ответом на проводимое лечение. Изменения в организме могут происходить и в течение одного месяца, и на протяжении нескольких лет. Важно, чтобы процесс контролировал компетентный специалист.
Схема патогенеза напрямую зависит от вида заболевания. В случае аллергического происхождения аллергены вступают в связь с иммуноглобулинами группы E. Тучные клетки становятся активными. Происходит интенсивное воздействие медиаторов на слизистую. Это приводит к воспалению хронического характера. Пациент сталкивается с отёком и удушьем.
Если астма неаллергическая, то происходит развитие инфекции, активируются лизосомальные ферменты, влияющие на слизистую, выделяются клетки воспаления. Это приводит к образованию хронического воспаления. Сосуды становятся более уязвимыми, появляются отёк и асфиксия.
При бронхиальной астме хроническое воспаление могут спровоцировать такие факторы, как дым от сигарет, холодный воздух, чрезмерное физическое напряжение. Вследствие подобных воздействий возрастает сосудистая проницаемость, появляются гиперсекреция слизи, отёк. Всё это приводит к удушью.
Этиология любого вида бронхиальной астмы связана с такими факторами.
- Нервно-психические: плохое настроение, регулярные депрессии, стрессы сказываются на состоянии здоровья не лучшим образом.
- Инфекционные: грибки, бактериальные и вирусные агенты.
- Метеорологические: повышенная чувствительность организма к резким изменениям температуры, чрезмерно высокой или низкой влажности, скачкам давления.
- Атопические: насекомые, пищевые раздражители, животные, пылевые и растительные аллергены, медикаменты.
- Механические и химические: систематическое воздействие на систему дыхания химических веществ.
- Указанные выше факторы провоцируют развитие недуга. Они во многом определяют тяжесть течения болезни, регулярность приступов. Вместе с тем здесь нужно принимать во внимание состояние организма, предрасположенность. В группу риска входят люди с патологиями иммунной либо эндокринной системы. Немалое значение имеет и наследственность.
Этиология данной болезни у маленьких пациентов схожа с аналогичными у взрослых. Наиболее распространенными причинами возникновения недуга являются следующие:
- неподходящие пищевые компоненты;
- постоянный крик;
- стрессы;
- сильный плач;
- пыль в помещении, где находится ребёнок;
- попадание в дыхательные пути шерсти и перхоти животных;
- вдыхание пыльцы растений-аллергенов;
- реакция лекарства;
- сильный смех.
Пыль — главный источник проблем. В неубранной комнате формируются безупречные условия для образования плесени и клещей. Это повышает риск развития патологии у ребёнка. В мягкой мебели, матрасах и коврах обитают пылевые клещи. Повышенный уровень влажности в помещении способствует их размножению.
Заражение от пыли наиболее актуально в отношении новорожденных. Это связано с тем, что основную часть времени малыш проводит дома. Поэтому нужно как можно чаще бывать на свежем воздухе и регулярно проветривать помещение.
Обратите внимание! Лечению поддается бронхиальная астма у детей любого возраста. Главное – своевременно обратиться к компетентному доктору и не допускать воздействия аллергена.
Непременно поделитесь этой статьёй в социальных сетях, и тогда ещё больше людей узнает достоверную и полезную информацию об этиологии и патогенезе бронхиальной астмы.
источник
Патогенез бронхиальной астмы определяется клинико-патогенетическим вариантом.
Патогенез атопической бронхиальной астмы. В иммунологической фазе под влиянием неинфекционного аллергена (пыльца растений, растительные и животные белки, лекарственные средства) в условиях врожденного или приобретенного дефицита Т-супрессорной функции В-лимфоцитами продуцируются реагиновые IgE-антитела, которые фиксируются на тучных клетках. В патохимической стадии при повторном контакте с аллергеном происходит его связывание с иммуноглобулином Е на поверхности тучных клеток слизистой оболочки бронхов, агрегация мембранных IgE-рецепторов, дегрануляция тучных клеток — активный секреторный процесс (экзоцитоз) с выделением медиаторов, не сопровождающийся повреждением и гибелью клетки. Выделяются следующие медиаторы: обладающие бронхоспастическим и вазоактивным эффектом (гистамин; лейкотриены LTA4, LTB4, LTC4, LTD4; медленно действующая субстанция, основными компонентами которой являются LTC4 и LTD4; калликреин-подобное вещество, простагландины F2a, G2, D2, тромбоксан А2); обладающие хемотаксическим действием (эозинофильный и нейтрофильные хемотаксические факторы); протеолитические ферменты; лизосомальные ферменты; фактор активации тромбоцитов. В патофизиологической стадии под влиянием медиаторов развивается гиперреактивность бронхов, что проявляется бронхоспазмом, отеком слизистой оболочки бронхов, гиперкринией и дискринией — гиперсекрецией слизи и повышением ее вязкости. Развитию гиперреактивности бронхов способствует врожденный или приобретенный недостаток в бронхах фермента аденилциклазы. В дальнейшем формируется условно-рефлекторный механизм бронхиальной астмы.
Патогенез инфекционно-зависимой бронхиальной астмы. В патогенезе инфекционно-зависимого варианта БА участвуют следующие механизмы:
гиперчувствительность замедленного типа, основная роль в развитии которой принадлежит Т-лимфоцитам. При повторных контактах с инфекционным аллергеном они гиперсенсибилизируются и приводят к выделению медиаторов замедленного действия: факторов хемотаксиса нейтрофи-лов, эозинофилов, лимфотоксина, фактора агрегации тромбоцитов. Медиаторы замедленного действия вызывают в клетках-мишенях (тучные клетки, базофилы, макрофаги) освобождение простагландинов (PgD2, F2a), лейкотриенов (LNC4, LND4, LNE4) и др., вследствие чего развивается бронхоспазм. Кроме того, вокруг бронха формируется воспалительный инфильтрат, содержащий нейтрофилы, лимфоциты, эозинофилы. Этот инфильтрат является источником медиаторов немедленного типа (лейкотриены, гистамин), вызывающих спазм бронха и его воспаление. Из гранул эозинофилов выделяются также белки, повреждающие непосредственно мерцательный эпителий бронхов, что затрудняет эвакуацию мокроты;
аллергическая реакция немедленного типа с образованием реагина IgE (аналогично атопической астме). Развивается редко, на ранних стадиях инфекционно-зависимой БА, главным образом при грибковой и нейссериальной астме;
неиммунологические реакции — повреждение токсинами надпочечников и снижение глюкокортикоиднои функции, нарушение функции мерцательного эпителия и понижение активности р2-адренорецепторов.
Патогенез дисгормонального варианта бронхиальной астмы. В патогенезе четко участвуют гормональные факторы. Наиболее изучены нарушения глюкокортикоиднои функции и функции половых желез. Глюкокортикоидная недостаточность развивается преимущественно вследствие длительного лечения глюкокортикоидами, инфекционно-токсических влияний на надпочечники и способствует формированию гиперактивности тучных клеток, повышению уровня гистамина и PgF2a в крови и развитию бронхоспазма. Дизовариальные расстройства проявляются гиперэстрогенизмом и гипопрогестеронемией. Гиперэстрогенизм повышает активность транскортина, который связывает гидрокортизон крови и усугубляет надпочечниковую недостаточность, снижает активность р2-адренорецепторов. Гипопрогестеронемия понижает активность р2-адренорецепторов и способствует бронхоспазму.
Патогенез аутоиммунного варианта бронхиальной астмы.Этот вариант является этапом дальнейшего прогрессирования и усугубления течения атопической и инфекционно-зависимой БА. К патогенетическим механизмам этих форм присоединяются аутоиммунные реакции. При атопической БА выявляются аутоантитела (антиядерные, противолегочные, к гладким мышцам бронхов, к р-адренорецепторам мышц бронхов). Формирование иммунных комплексов (аутоантиген + аутоантитело) ведет к иммунокомплексному повреждению бронхов и р-адренергической блокаде.
Патогенез нервно-психического варианта бронхиальной астмы. Этот вариант, как и другие, может быть ведущим на определенных этапах болезни. Основные патогенетические механизмы следующие. Психоэмоциональные стрессы непосредственно влияют на тонус бронхов, так как при этом развивается повышенная чувствительность бронхов к гистамину и ацетилхолину. Кроме того, эмоциональное напряжение вызывает гипервентиляцию, стимуляцию ирритативных рецепторов бронхов внезапным глубоким вдохом, кашлем, смехом, плачем, что ведет к рефлекторному спазму бронхов.
Патогенез холинергичес кого варианта бронхиальной астмы. Основной патогенетический механизм — выраженная ваготония, что приводит к возбуждению ацетилхолиновых рецепторов и спазму преимущественно крупных и средних бронхов, а также к гиперсекреции слизистых и серозных желез трахеи и бронхов.
Патогенез формы «Первично-измененная реактивность бронхов» (в том числе «аспириновой астмы» и «астмы от физического усилия»). Это неиммунологическая бронхиальная астма, она связана не с первичными иммунологическими, эндокринными, нервно-психическими нарушениями, а с врожденной гиперреактивностью бронхов. В развитии гиперреактивности бронхов имеет значение увеличение межэпителиальных промежутков (это способствует прохождению через них различных химических раздражителей из воздуха, вызывающих дегрануляцию тучных клеток) и чрезвычайно выраженная реактивность бронхиальных ирритационных рецепторов, реагирующих сокращением бронха на воздействие холодного воздуха, табачного дыма и т. д.
«Астма от физического усилия» возникает вследствие повышенной чувствительности тучных клеток, альвеолярных макрофагов, слизеобразующих желез и гладких мышц бронхов к различным воздействиям. При интенсивном физическом усилии развивается гипервентиляция, в результате чего происходит испарение влаги бронхов, их охлаждение и дегрануляция тучных клеток, выделение медиаторов аллергии и воспаления, что ведет к спазму и отеку бронхов.
В основе «аспириновой астмы» лежит нарушение метаболизма арахидоновой кислоты под влиянием аспирина и других нестероидных противовоспалительных средств. После их приема из арахидоновой кислоты мембраны клеток вследствие активации 5-липооксигеназного пути образуются лейкотриены, вызывающие бронхоспазм. Одновременно угнетается циклооксигеназный путь метаболизма арахидоновой кислоты, что ведет к уменьшению образования PgE (расширяет бронхи) и увеличению — PgF2a (суживает бронхи). «Аспириновую астму» вызывают аспирин, нестероидные противовоспалительные средства (индометацин, бруфен, вольтарен и др.), баралгин, антастман, теофедрин, а также продукты, содержащие салициловую кислоту (огурцы, цитрусовые, томаты, различные ягоды) или желтые красители (тартразин).
Основным клиническим проявлением БА типичным для данного заболевания является приступ удушья, в котором различают 3 периода: период предвестников, период разгара и период обратного развития.Клинически он проявляется –экспираторной одышкой и приступами кашля с отхождением вязкой трудноотделяемой мокротой.
Типичная поза с приподнятым верхним плечевым поясом,грудная клетка цилиндрической формы.Больной делаетт короткий вдох и без паузы продолжительный мучительный выдох,сопровождающийся сухими дистанционными хрипами.В дыхании активно учавствует вспомогательная мускулатура грудной клеттки,плечевого пояса, брюшного пресса.Межреберныепромежутки расширены и расположены горизонтально.
При перкуссии-характерный коробочный звук.Нижние границы легких смещены вниз,снижена экскурсия легочных полей. Нередко экспираторная одышка провоцируется физической нагрузкой, резкими запахами, но затруднение дыхания при этом не достигает интенсивности приступа удушья, проходит самостоятельно.
Бронхообструктивный синдром у больных проявляется сильным, приступообразным кашлем, усиливающимся от разных запахов, при снижении температуры вдыхаемого воздуха, ночью и утром при вставании с постели, при заболевании гриппом, острым катаром верхних дыхательных путей, от физической нагрузки, нервного напряжения и других причин. Кашель утихает или становится менее интенсивным после приёма внутрь или ингаляции бронхолитиков.
При аускультации-ослабленное дыхание,сухие хрипы по всей легочной поверхности.После кашля количество хрипов увеличивается.При продуктивном кашле их количество уменьшается и дыхание из ослаблленного становится жестковатым.
. Внелёгочные проявления: вазомоторный ринит, крапивница, нейродермит, вазомоторный отёк Квинке, мигрень.
При длительно протекающих приступах удушья могут появляться признаки недостаточности правого желудочка. При рентгенологическом исследовании определяется повышенная прозрачность лёгочных полей, низкое стояние диафрагмы.
источник
Бронхиальная астма (БА) широко распространена в современном мире. Ею болеет каждый восьмой житель Европы. Для успешного лечения и профилактики заболевания необходимо знать его причины и особенности развития.
Именно поэтому изучению патогенеза бронхиальной астмы уделяется большое внимание. Подробнее об этом – далее в статье.
Бронхиальная астма – это хроническая болезнь, которая характеризуется поражением дыхательных путей. Основное ее проявление – рецидивирующие приступы обструкции, то есть закупорки, бронхов. Во время приступа больному тяжело сделать выдох из-за того, что бронхи спазмируются на высоте вдоха.
У астматиков с продолжительным и тяжелым течением бронхиальной астмы развиваются необратимые изменения в дыхательной системе. Разрастается соединительная ткань в легких, развивается пневмосклероз, истончаются альвеолы (эта патология получила название «эмфизема»). Это еще больше усугубляет течение заболевания и усиливает дыхательную недостаточность.
В основе патофизиологии бронхиальной астмы лежит повышенная чувствительность бронхов к различным провоцирующим факторам, причем эти факторы индивидуальны для каждого.
Важнейшую роль в этиологии бронхиальной астмы отводят аллергическому фактору. Провокаторы заболевания делятся на две большие группы: эндоаллергены (вырабатываются внутри организма) и экзоаллергены (поступают извне). Чаще причиной заболевания становится вторая группа провоцирующих факторов. К ним относятся:
- Инфекционные возбудители – вирусы, бактерии, грибки, простейшие.
- Раздражители растительного происхождения – пыльца растений, пух тополя.
- Аллергены животного происхождения – шерсть, перья, слюна, пух.
- Бытовые аллергены – пыль, бытовая химия.
- Пищевые продукты – чаще всего аллергическую реакцию вызывают орехи, мед, шоколад, помидоры.
- Медикаменты – ацетилсалициловая кислота, антибиотики.
У некоторых больных проявления астмы возникают при определенных погодных условиях. Особенно плохо переносят астматики дождь, высокую влажность, холод. В этом случае для БА характерно отсутствие приступов, если нет воздействия внешних раздражителей.
В ходе многочисленных исследований американские ученые установили, что стресс также может быть пусковым механизмом в развитии приступов. Он способен стать первопричиной болезни, а также усугубить уже имеющуюся бронхиальную астму.
В зависимости от природы и особенностей течения заболевания выделяют следующие формы БА:
- Атопическая – развивается вследствие воздействия аллергенов неинфекционной природы.
- Инфекционно-зависимая – приступ астмы возникает после перенесенных инфекций.
- Глюкокортикоидная – в ее основе лежит нарушение баланса кортикостероидных гормонов.
- Нервно-психическая – обструкция бронхов происходит вследствие длительного стресса.
- Аспириновая – прием лекарств, содержащих ацетилсалициловую кислоту, приводит к развитию приступа удушья.
- Астма физического напряжения – заболевание проявляется после физических нагрузок.
В основе патогенеза бронхиальной астмы лежит воспаление в стенке бронхов. Любое воспаление сопровождается повышенной проницаемостью стенок сосудов.
В результате этого плазма (жидкая часть крови) просачивается через них. Жидкость накапливается в слизистой бронха, развивается отек. Просвет органа сужается, затрудняется прохождение воздуха.
Но почему у одних людей при попадании аллергена развивается воспалительный процесс в дыхательной системе, а другие никак не реагируют на него? Ученые долго думали над этим вопросом и пришли к выводу, что все дело в наследственной предрасположенности.
У некоторых людей с рождения повышена активность особых клеток крови – Т-лимфоцитов-хелперов 2 типа. Из-за этого у них выделяется большое количество иммуноглобулина Е (IgE) – белка, провоцирующего аллергическую реакцию.
Активный синтез IgE приводит к дегрануляции (повреждению) тучных клеток, которые находятся на стенке бронхов. Они начинают высвобождать медиаторы воспаления. Именно из-за этих веществ повышается проницаемость стенок сосудов, и развивается воспалительный процесс.
Но воспаление – лишь один из механизмов развития бронхиальной астмы. Помимо него, в развитии приступа принимает участие спазм бронхов. Гладкая мускулатура этого трубчатого органа резко сокращается, что приводит к перекрытию его просвета.
Не менее важную роль в развитии приступа БА играет повышенная секреция слизи клетками эпителия бронхов, выстилающего внутреннюю поверхность его стенки. Таким образом, в патогенезе бронхиальной астмы и развитии удушья можно выделить три основных фактора:
- воспаление в стенке бронхов;
- повышенная реактивность бронхиального дерева, из-за чего спазмируются мышцы этого органа;
- увеличенная выработка слизи эпителиальными клетками.
В общем патогенез бронхиальной астмы можно разделить на три этапа:
- Иммунологический – возникает при первом контакте организма с аллергическим агентом. Характеризуется активацией клеток крови и выработкой IgE.
- Иммунохимический – развивается при последующих контактах с раздражителем. Уже выработанные иммуноглобулины запускают развитие реакции в бронхиальном дереве, которая сопровождается синтезом медиаторов воспаления.
- Патофизиологический – проявляется активными изменениями в стенке бронха, описанными ранее. У больного затрудняется дыхание, появляются свистящие хрипы.
У астматиков, как и у аллергиков, в крови повышается количество эозинофилов. Эти клетки относятся к группе лейкоцитов.
Они повреждают реснички на эпителии бронхов, ухудшая тем самым эвакуацию слизи, и провоцируют изменения в тканях. Их количество в общем анализе крови более 6% говорит в пользу диагноза бронхиальной астмы.
Этиология и патогенез бронхиальной астмы тесно взаимосвязаны. Фактор, который привел к приступу, определяет механизм его развития. Далее мы подробно разберем механизмы развития разных форм БА.
Это наиболее распространенная разновидность заболевания. Она развивается при повышенной чувствительности бронхов к аллергенам неинфекционной природы: бытовым, животным, растительным.
Особенность механизма развития бронхиальной астмы по атопическому типу заключается в его многоэтапности. Иммунологическая и иммунохимическая фазы проходят аналогично описанным в предыдущем разделе. А патофизиологический этап подразделяют еще на две стадии: раннюю и позднюю.
Ранняя реакция начинается в период от несколько минут до 2 часов после воздействия аллергенов. При этом слизистая стенки бронхов отекает, повышается выделение секрета, мускулатура спазмируется. Происходит закупорка просвета органа, прохождение воздуха затрудняется.
Поздняя стадия развивается примерно через 6 часов после действия раздражителя. Она характеризуется наличием стойкого воспаления в бронхах даже после спадания отека и прекращения спазма. Если не начать своевременное лечение, мышечная ткань органа заменяется соединительной. Данный процесс необратим.
Инфекционно-зависимая форма БА характерна для людей зрелого возраста. Она является осложнением перенесенных ранее острых респираторных вирусных инфекций, пневмонии, бронхита и других патологий органов дыхания.
Данная форма астмы характеризуется медленным развитием. Отек бронхов нарастает постепенно, состояние больного ухудшается на протяжении длительного времени. Пик заболевания наступает через две – три недели после перенесенной инфекции.
Течение инфекционно-зависимой формы более тяжелое. Отек, хоть и увеличивается медленно, не спадает на протяжении длительного времени. Эта форма БА тяжело поддается лечению при помощи традиционных медикаментов (бета-адреномиметиков, глюкокортикоидов).
Существует несколько механизмов развития бронхиальной астмы после воздействия инфекционных агентов:
- Аллергическая реакция медленного типа.
- Немедленная аллергическая реакция (аналогичная патогенезу атопической формы).
- Механизмы неиммунологического характера.
Реакция замедленного типа, соответственно названию, характеризуется длительным нарастанием отека. При этом для ее запуска требуется неоднократное воздействие аллергического агента. Клетки организма выделяют особые белки – медиаторы воспаления замедленного действия.
Эозинофилы также принимают участие в процессе. Они синтезируют белок, который повреждает реснитчатый эпителий бронхов. В результате его клетки не способны эвакуировать мокроту из просвета органа.
Неиммунологическая реакция развивается при непосредственном повреждении клеток бронхов инфекционными агентами.
Глюкокортикоиды – это гормоны, вырабатываемые корой надпочечников. Они обладают мощным противовоспалительным действием, угнетают аллергическую реакцию. Поэтому нехватка этих гормонов в организме может как спровоцировать первый приступ, так и стать причиной постоянных рецидивов.
Патогенез влияния недостатка глюкокортикоидов при бронхиальной астме таков:
- Снижается концентрация бета-адренорецепторов на эпителии бронхов, что приводит к снижению восприимчивости к адреналину, расслабляющему мускулатуру бронхов.
- Активность медиаторов воспаления не уменьшается не регулируется гормонами.
- Увеличивается секреция провоспалительных белков и одновременно снижается активность противовоспалительных.
Эта форма бронхиальной астмы чаще всего развивается при длительном лечении глюкокортикоидами. Бесконтрольный прием гормонов влияет на надпочечники, угнетая их функцию.
У девушек гормональная БА может возникать при нарушении баланса половых гормонов. Приступ провоцируется снижением количества прогестерона в крови и повышением уровня эстрогена, что характерно для второй половины менструального цикла.
Нервно-психическая форма бронхиальной астмы относится к группе психосоматических заболеваний. Это патологии, при которых длительные стрессы, депрессия, тревога проявляются в виде нарушения функции какого-либо органа и системы.
Для нервно-психической разновидности астмы характерно отсутствие органических изменений стенки бронхов на начальных этапах. Приступ развивается из-за спазма гладкой мускулатуры. Лишь при длительном течении заболевания возникают стойкие изменения в тканях органа.
В основе развития данной формы БА лежит гиперчувствительность эпителия бронхов к гистамину и ацетилхолину. Эти вещества являются нейромедиаторами, которые передают импульсы с периферии в центральную нервную систему.
Кроме того, приступ БА может провоцироваться любой нагрузкой, сопровождающейся глубоким вдохом.
В основе патогенеза бронхиальной астмы аспиринового типа лежит повышенная чувствительность к препаратам, содержащим ацетилсалициловую кислоту. Вещество приводит к нарушению обмена арахидоновой кислоты.
Это, в свою очередь, стимулирует синтез лейкотриенов, которые вызывают спазм бронхиального дерева. Подобный эффект оказывает не только Аспирин, но и другие нестероидные противовоспалительные препараты.
Еще одно негативное свойство салицилатов – снижение активности тромбоцитов. Эти клетки играют важную роль в свертывании крови при травме сосуда и в питании стенок сосудов. Поэтому угнетение функции тромбоцитов повышает ее проницаемость, что провоцирует развитие отека.
Эту форму астмы чаще всего наблюдают у женщин в возрасте 30 – 40 лет. Часто больные аспириновой астмой принимают противовоспалительные препараты из-за болей в спине, суставах и прочее.
Приступ БА физического напряжения развивается при повышенной физической нагрузке, спустя 5 – 20 минут после ее начала. Некоторые больные отмечают удушье спустя 5 – 10 минут после окончания нагрузок.
В большинстве случаев приступ астмы физического усилия не очень интенсивный. Однако порой приходится прибегать к помощи ингалятора.
Большую часть времени человек дышит носом. Увлажненный, очищенный и теплый воздух благоприятно влияет на дыхательные пути и не раздражает их. При активных физических нагрузках дыхание сбивается, воздух поступает через рот. Он сушит и раздражает слизистую бронхов.
Эпителиальные клетки начинают активно выделять медиаторы воспаления, развивается отек слизистой. Спазм гладких мышц стенки бронхов также принимает участие в развитии приступа.
Патогенез бронхиальной астмы у детей преимущество основан на аллергической реакции. Инфекционно-зависимая форма встречается гораздо реже. Ею обычно страдают дети старшего школьного возраста.
У детей просвет бронхов уже, чем у взрослого, и мускулатура развита хуже. Потому основную роль в развитии приступа у них играет отек и гиперсекреция слизи. В то же время у взрослых на первом месте стоит бронхоспазм. Узким просветом дыхательных путей можно объяснить более тяжелое течение БА в детском возрасте.
Значительное место в этиопатогенезе бронхиальной астмы у детей играет генетическая предрасположенность. Наличие в анамнезе аллергического диатеза, поллинозов, БА у родителей повышают риск развития болезни у ребенка.
У многих детей в качестве аллергенов выступают пищевые продукты. Первый приступ удушья часто развивается в 5 – 6 месяцев, когда малышу начинают давать прикорм. Иногда искусственное питание становится провоцирующим фактором.
При бронхиальной астме этиология и патогенез неразрывно связаны. Но вне зависимости от пускового фактора механизм развития приступа БА включат три процесса: отек слизистой, спазм гладких мышц, повышенная секреция слизи.
Заболевание часто предопределяется генетической предрасположенностью. Но нужно понимать, что человек не унаследует от родителей бронхиальную астму.
Ему передастся лишь повышенная чувствительность иммунной системы к определенным аллергенам. То есть наличие астмы у родителей еще не гарантирует ее развитие у ребенка.
Таким образом, патогенез БА сложен и многогранен. Надеемся, эта статья разъяснила особенности механизма развития этого заболевания.
источник
Бронхиальная астма (БА) – хроническое воспалительное заболевание дыхательных путей, в котором принимают участие многие клетки и клеточные элементы и которое обуславливает развитие бронхиальной гиперреактивности, приводящей к эпизодам обратимой спонтанно или под действием лечения обструкции бронхов, клинически проявляющейся повторяющимися эпизодами свистящих хрипов, одышки, чувства заложенности в груди и кашля, особенно по ночам или ранним утром.
Этиология бронхиальной астмы.
Факторы, влияющие на риск развития БА, можно разделить на факторы, обуславливающие развитие заболевания (в основном это внутренние факторы, в первую очередь наследственность), и факторы, провоцирующие появление симптомов (в основном это внешние факторы).
Основные факторы влияющие на развитие и проявление БА:
1. генетические (гены, предрасполагающие к атопии – повышенной выработке аллерген-специфических антител класса IgE и гены, предрасполагающие к бронхиальной гиперреактивности)
2. ожирение (повышенная выработка медиатора лептина увеличивает вероятность БА)
3. пол (до 14 лет распространенность БА у мальчиков в два раза выше, у взрослых БА распространена больше у женщин).
1. аллергены: помещений (клещи домашней пыли, шерсть домашних животных, аллергены тараканов, плесневые и дрожжевые грибы) и внешние (пыльца растений и т. д.)
2. инфекции (в основном респираторные вирусные, реже паразитарные)
3. профессиональные сенсибилизаторы
4. курение табака (как активное, так и пассивное)
5. загрязнение воздуха внутри и снаружи помещений
6. питание – у детей, находившихся на грудном вскармливании, частота БА меньше, чем у детей, находящихся на искусственном вскармливании
Основные факторы, провоцирующие обострение БА: 1) домашние и внешние аллергены; 2) поллютанты помещений и внешние поллютанты; 3) респираторные инфекции; 4) физическая нагрузка и гипервентиляция; 5) изменение погодных условий; 6) двуокись серы; 7) пища, пищевые добавки; 8) некоторые лекарства; 9) чрезмерные эмоциональные нагрузки; 10) курение (пассивное и активное); 11) ирританты (домашний аэрозоль, запах краски).
Патогенез аллергической (атопической) БА.
1. Иммунологическая стадия:
А) процессинг – поступивший в дыхательные пути аллерген захватывается макрофагом, расщепляется на фрагменты, связывается с гликопротеинами II класса главного комплекса гистосовместимости (HLA) и транспортируется к клеточной мембране макрофага
Б) презентация комплекса «антиген+HLA II» Т-лимфоцитам-хелперам
В) продукция Т-лимфоцитами-хелперами ряда цитокинов: ИЛ-4,5,6, которые стимулируют пролиферацию и дифференцировку В-лимфоцитов, ИЛ-5 и гранулоцитарного макрофагального стимулирующего фактора, которые активируют эозинофилы.
Г) синтез В-лимфоцитами специфических АТ (IgE, реагиновые АТ), фиксирующихся на поверхности тучных клеток, базофилах и эозинофилах
2. Иммунохимическая стадия: при повторном поступлении аллергена в организм больного происходит его взаимодействие с антителами-реагинами (IgE) на поверхности клеток-мишеней аллергии последующей дегрануляцией тучных клеток и базофилов, активацией эозиновилов и выделением большого количества медиаторов воспаления и аллергии.
3. Патофизиологическая стадия: развитие бронхоспазма, отека слизистой оболочки и инфильтрации стенки бронха клеточными элементами, воспаления, гиперсекреции слизи
а) Ранняя астматическая реакция – бронхоспазм под действием гистамина и других медиаторов (лейкотриенов C4, D4, E4 и др.) с выраженной экспираторной одышкой; начинается через 1-2 мин, достигает максимума через 15-20 мин и длится около 2 ч
б) Поздняя астматическая реакция – воспаление, отек слизистой бронхов, гиперсекреция слизи; развивается через 4-6 ч., достигает максимума через 6-8 ч. и длится 8-12 ч. Основные клетки-участницы: эозинофилы, альвеолярные и бронхиолярные макрофаги, нейтрофилы, Т-лимфоциты и др.
Другие патогенетические механизмы возникновения БА.
А) инфекционно-зависимый – бронхоспазм обусловлен продуктами метаболизма бактерий, грибов и вирусов, обладающих способностью вызывать анафилактические реакции (особенно характерно для нейсерий, увеличивающих содержание IgE в крови и бронхиальном секрете)
Б) дисгормональный – причины обструкции бронхов: ГКС недостаточность (гипперреактивность тучных клеток, повышение уровня гистамина, тонуса ГМК бронхов, усиление воспаления слизистой бронхов), гипопрогестеронемия, гиперэстрогенемия (повышение уровня гистамина и активности альфа-адренорецепторов).
В) нервно-псИхический – изменение бронхиального сопротивления формируется безусловными и условными рефлексами и др. (аутоиммуный, адренергический дисбаланс, первично измененная реактивность бронхов).
1. Бронхиальная астма (J45 по МКБ-10):
А) аллергическая (атопическая, экзогенная);
Б) неаллергическая (эндогенная);
В) смешанная (аллергическая + неаллергическая);
2. Астматический статус (J46, острая тяжелая БА).
источник
Бронхиальная астма (сокращенно БА) – болезнь органов дыхательной системы аллергического характера, имеет хроническое течение и связана с обратимостью обструкции бронхов и повышением их реактивности. Симптоматически проявляется рецидивирующими эпизодами удушья, одышкой, стеснением в грудной клетке и мучительным кашлем. Заболеваемость астмой с одинаковой частотой встречается в различных возрастных группах. Распространены случаи возникновения бронхиальной астмы у детей, половина из которых приходится на возраст до двух лет.
Этиология и патогенез у бронхиальной астмы полностью не изучены. Однако имеется достаточное количество данных об аллергенах, вызывающих БА, чтобы сформировалось общее понимание причин возникновения болезни. Среди них различают аллергены инфекционного и неинфекционного генеза.
- Пыльца растений (пыльцевые).
- Пыль и пух из перьевых подушек (бытовые).
- Шерсть различных животных и частички кожных покровов (эпидермальные).
- Аллергенные продукты питания.
- Химические компоненты (консерванты, бытовая химия).
- Лекарственные препараты: антибиотики, АСК и др.
Среди инфекционных аллергенов различают:
- Бактериальные – в основном их провоцируют стрептококки, стафилококки, кишечная палочка.
- Вирусные – вирус гриппа, адено- и риновирус.
- Грибковые.
Исходя из приведенного перечня, выделяют атопическую и инфекционно-зависимую формы бронхиальной астмы. При сочетании нескольких аллергенов из разных групп можно говорить о смешанном варианте БА.
Помимо возбудителей БА, существуют еще и обстоятельства, приводящие к ее возникновению:
- Наследственность.
- Генетические нарушения со стороны иммунной и эндокринной систем.
- Нарушение иммунного ответа на аллерген (атопия).
- Повышение восприимчивости бронхов к раздражителям.
При уже сформировавшемся хроническом течении болезни, имеются факторы, провоцирующие ее обострение:
- Курение.
- Вдыхание паров вредных выбросов.
- Психоэмоциональные нагрузки, стресс.
- Чрезмерная физическая нагрузка.
- Повышенная влажность и низкая температура воздуха.
- Колебания цифр атмосферного давления.
Совокупность вышеизложенных факторов увеличивает риск возникновения заболевания, поэтому настоятельно рекомендуется максимально минимизировать их влияние.
Главную роль в патогенезе заболевания играет воспалительный процесс в стенке бронха, возникающий под воздействием аллергенов и инфекционных возбудителей. В результате повышается их чувствительность к раздражителям различного рода, к которым у здорового человека подобной реакции не наблюдается.
Воспалительный процесс имеет две фазы:
- Ранняя (немедленной реакции) – длительность от получаса до 2-3 часов. Развивается по типу бронхообструктивного синдрома.
- Поздняя (замедленной реакции) – длительность 24 часа, развивается спустя 4 часа после воздействия аллергена. Поражает стенки бронхов.
Астму считают фазовым заболеванием, поскольку ее протекание включает период благополучия и ухудшения. Несмотря на то, что заболевание является хроническим и не подлежит полному излечению, его течение можно контролировать.
Весь механизм формирования заболевания можно разделить на две стадии:
В некоторых медицинских источниках указана и иммунохимическая стадия. Она наблюдается при повторном попадании аллергена в дыхательные пути. Происходит контакт возбудителя с уже выработанными раннее (на иммунологической стадии), иммуноглобулинами Е, в результате чего развивается аллергическая реакция.
При астме встречаются аллергические проявления по I, III и IV типу.
- I тип (анафилактический) – немедленная аллергическая реакция. Проявляется повышенной продукцией иммуноглобулина Е при снижении защитной роли Т-лимфоцитов. Характерен для атопической формы астмы.
Астма не протекает однообразно. При этом I-й тип аллергической реакции является более распространенным, для него характерно более тяжелое, по сравнению с другими реакциями, течение (угроза анафилактического шока), он требует неотложной терапии.
Возникновение приступа связано с попаданием в организм инфекционного аллергена. Воспалительный процесс при этом развивается достаточно длительно. В большинстве случаев протеканию данной формы астмы способствуют перенесенные накануне инфекционные заболевания – чаще всего бронхит или гнойный синусит. При попадании инфекции, за счет выделения собственных продуктов метаболизма, обладающих токсическими свойствами, повреждается ткань бронхов и легких.
Механизм формирования бронхоспазма несколько иной, чем при атопической форме. Он протекает по типу аллергии замедленного типа, т. е. отсутствует первая стадия иммунной реакции. Заключается в выделении медиаторов воспаления (биологически активных веществ, служащих для передачи информации от одной клетки к другой), образовавшихся в результате взаимодействия защитных клеток с возбудителем.
Медиаторы, в свою очередь, влияют на тучные клетки и макрофаги (иммунные клетки) с высвобождением других биологически активных веществ – гистамина, простагландина и лейкотриенов, которые вызывают отек слизистой бронха и повышают секрецию желез.
Инфекционно-зависимый вариант астмы встречается гораздо реже атопического. Астматические приступы продолжительные, трудно поддающиеся лечению. Поэтому важно своевременно обратиться к лечащему врачу, чтобы избежать возможных осложнений.
За счет выработки иммуноглобулинов Е, G4 и их присоединения к наружной стенке клеток-мишеней, формируется повышенная чувствительность организма к повторному воздействию аллергена. При очередном взаимодействии аллергена с клетками-мишенями выделяются биологически активные вещества, которые формируют аллергическую реакцию немедленного типа. Если атопическая астма протекает длительно – может произойти склерозирование стенок бронхов.
Вышеперечисленные признаки и, как дополнение к ним, проведенные лабораторные исследования, позволяют различить формы болезни для постановки правильного диагноза и назначения верного лечения.
Возникновение бронхиальной астмы провоцируют и нарушения со стороны ЦНС, и гормональный дисбаланс. Со стороны нервной системы, контроль над тонусом мускулатуры бронхов осуществляет блуждающий нерв. При возбуждении парасимпатического отдела происходит сужение просвета бронха за счет повышения тонуса мышечного слоя, увеличение секреции желез, в то время как активация симпатической системы вызывает бронходилатацию (расширение). Именно нарушение баланса между симпатикой и парасимпатикой приводит к возникновению бронхоспазма.
Особое значение в формировании патогенеза заболевания играет деятельность адренорецепторов, находящихся в бронхах. В случае усиления стимуляции на альфа-рецепторы, происходит сужение просвета бронхов, а при стимуляции бета2-адренорецепторов – его расширение.
Гормональный дисбаланс также нередко провоцирует развитие бронхиальной астмы. При глюкокортикоидной недостаточности повышается уровень гистамина (одного из медиаторов воспаления), увеличивается тонические сокращения мышечного слоя бронхов и снижается чувствительность бета2-адренорецепторов. Все эти процессы также происходят при повышенных цифрах прогестерона, эстрогена и тиреоидных гормонов в крови.
Следует отдельно выделить основные моменты этиологии и патогенеза данного заболевания у детей школьного и дошкольного возрастов. У ребенка чаще диагностируют атопический вариант бронхиальной астмы. При этом он может маскироваться под симптоматику обструктивного бронхита. Инфекционно-зависимый тип встречается довольно редко, в основном у лиц старшего школьного возраста.
Протекает заболевание тяжелее, чем у взрослых. Особенно это выражено у детей в возрасте до 5 лет, что связано с анатомо-физиологическими особенностями детского организма, а именно с узким просветом бронхов и слаборазвитым мышечным аппаратом. При избыточном весе и ожирении у детей, астма развивается чаще за счет сниженной вентиляции легких, что обусловлено высоким стоянием диафрагмы. На фоне отягощенного анамнеза (наличие атопического дерматита, полинозов), существует опасность возникновения астматических приступов.
У детей бронхиальная астма чаще возникает на фоне генетической предрасположенности, при этом риск заболеваемости увеличивается, если астмой больны оба родителя.
Ниже представлена обобщенная схема механизма возникновения заболевания, единая для обоих вариантов астмы.
Аллергены в организме человека запускают следующие процессы:
- Возбуждение тучных клеток, макрофагов, эозинофилов и лимфоцитов.
- Выделение медиаторов воспаления.
- Активация защитных клеток: нейтрофилов, эозинофилов, макрофагов и лимфоцитов.
- Выделение медиаторов воспаления.
- Отечность слизистой оболочки, повышение продукции слизи.
- Увеличение реактивности бронхов.
- Развитие бронхиальной астмы.
Правильное понимание этиологии и патогенеза бронхиальной астмы позволяет правильно определить тактику ее лечения, что существенно улучшает качество жизни пациентов с данным заболеванием.
источник
Этиология бронхиальной астмы и патогенез любой из форм астмы выявляют фактор появления и помогает сформировать правильную базисную терапию. Этиология астмы – причины, приводящие к гиперактивности бронхов. Патогенез бронхиальной астмы у детей и взрослых – главная из причин ее развития. Вид заболевания и факторы проявления не имеют значения.
Кратко схема бронхиальной астмы разделяется по фазам, степени тяжести форме и осложнениям. Формы заболевания бывает:
- Экзогенной, или аллергической
- Неаллергической – эндогенной
- Смешанной, в которой сочетаются оба фактора
По степени тяжести астма бывает:
- Легкой интермиттирующей
- Легкой персистирующей
- Среднетяжелой персистирующей
- Тяжелой персистирующей
Фазы болезни разделяются на обострение и ремиссию.
Патогенез астмы основан на патофизиологической и иммунологической реакциях. При патофизиологической чувствительность бронхов возникает как ответ на воспалительный процесс. Сужение просвета затрудняет дыхание. Возникают реакции:
- Ранняя – удушающий приступ наступает через одну-две минуты, его пик приходит через пятнадцать-двадцать минут. Обострение длится в течение двух часов
- Поздняя – воспаление начинается через 4-6 часов, а через еще 4-6 часов достигает пика. Длительность обострения – 12 часов
Иммунологическая реакция вызвана проникновением в дыхательные пути раздражающего фактора (аллергена).
Многие из пациентов страдают нарушением работы центральной нервной системы. Патологический рефлекс провоцирует спазм бронхов, который проходит через блуждающий нерв. Симптоматика требует комплексного лечения и одновременного воздействия на несколько групп органов.
Этиология и патогенез бронхиальной астмы у детей сопровождается:
- Затрудненным дыханием через нос
- Кожным зудом
- Чиханием
- Беспокойным состоянием
- Нарушением аппетита
У детей чаще возникает ночной приступ с сильной головной болью, повышенным артериальным давлением, тахикардией, свистящими хрипами и бледностью кожи. Патогенез заболевания определяется степенью проявления симптомов и реакцией на базисную терапию. Изменения происходят от месяца до нескольких лет. Дети, заболевшие бронхиальной астмой, подвержены надпочечниковой недостаточности – заболеванию, возникающему как реакция на недостаточную секрецию коры надпочечников. На коже и слизистых оболочках проявляется бронзовая пигментация.
Заболевание вызывает расстройство водно-электролитного обмена и нарушает работу сердца.
Схема патогенеза бронхиальной астмы зависит от ее вида. При экзогенной форме раздражающие факторы взаимодействуют с иммуноглобулинами группы Е. Активизируются тучные клетки, медиаторы интенсивно действуют на слизистую оболочку. Процесс запускает развитие хронического воспаления, возникает отек и удушье.
При эндогенной форме астмы развивается инфекция, запускается активация лизосомальных ферментов. Они влияют на слизистую оболочку, выделяют воспалительные клетки. Появляется уязвимость сосудов, отек и удушье.
Этиологию бронхиальной астмы связывают с:
- Нервно-психическими факторами: депрессиями, плохим настроением, стрессами.
- Инфекционными факторами: грибками, бактериальными и вирусными агентами.
- Погодными: повышенной чувствительностью организма к температурным перепадам, высокой или низкой влажности и скачкам давления.
- Атопическими: насекомыми, пищевыми раздражителями, растительными, пыльевыми аллергенами, животными, лекарственными средствами.
- Механическими и химическими: систематическим воздействием на систему дыхательных путей химическими веществами.
Факторы, перечисленные в классификации, провоцируют развитие бронхиальной астмы, влияют на степень тяжести приступов их регулярность и протекание болезни. Внимание уделяется состоянию организма и наследственные факторы. В группе риска люди, страдающие нарушением иммунной или эндокринной систем.
В развитии приступов удушья выделяют три основных фактора:
- Воспалительный процесс стенок бронхов
- Повышенная степень реактивности бронхиального дерева, вызывающая спазм
- Повышенная выработка слизи клетками
Патогенез разделяется на три этапа:
- Иммунологический – возникает после первого контакта с аллергеном. Запускается активация клеток крови и выработка иммуноглобулина;
- Иммунохимический – развивается при других контактах с раздражающим фактором. Иммуноглобулины активируют реакцию в бронхиальном дереве, сопровождающуюся синтезом воспалительных медиаторов;
- Патофизиологический – характеризуется активными изменениями стенок бронхов. Проявляются свистящие хрипы и затрудненность в дыхании.
В крови астматиков повышаются эозофинилы, относящиеся к лейкоцитам. Эвакуация слизи ухудшается за счет повреждения ими ресничек на эпителиях. Это приводит к изменениям ткани, количество эозофинилов, превышающее 6% в анализе крови становится основанием для постановки диагноза бронхиальной астмы.
Этиология и патогенез бронхиальной астмы связаны между собой. Фактор, спровоцирующий приступ, определяет, его развитие. Перечислим развитие патогенеза, исходя из классификации бронхиальной астмы.
Развивается, в результате гиперактивности бронхов к факторам неинфекционного происхождения: бытовых животных и растительных. Развитие атопической астмы проходит многоэтапно: иммунологическая, иммунохимическая фазы остаются без изменений, патофизеологическая делится на две дополнительных стадии:
- Раннюю, при которой действие проходит от нескольких минут до двух часов с момента воздействия раздражающего фактора. Возникает отек бронхиальной стенки, повышается выделение секрета, происходит спазм мускулатуры, закупорка просвета, воздух движется затрудненно.
- Позднюю, развитие которой происходит через 6 часов после взаимодействия с аллергеном. Воспалительный процесс сохраняется после спада отека и купирования спазма. В запущенной форме происходит необратимая замена мышечной ткани на соединительную.
Проявляется у людей зрелого возраста на фоне перенесенных инфекционных заболеваний. Развивается медленно, с постепенным нарастанием отека. Пик приходится на вторую — третью неделю после перенесенной инфекции. Отек не спадает продолжительное время, что ухудшает самочувствие пациента, астму инфекционно-зависимого типа тяжело лечить медикаментами. Характеризуется несколькими типами реакций:
- Медленной – отек нарастает долго, активация реакции требует неоднократного контакта с аллергеном.
- Немедленная – эозофинилы запускают синтез белка, повреждая реснитчатыйэпителий. Клетки не могут эвакуировать мокроту из дыхательного просвета.
- Неиммунологической – запускается, в результате повреждения клеток бронхов инфекционными агентами.
Глюкокортикоиды – вид гормонов, вырабатываемых корой надпочечников, обладающие противовоспалительным действием, угнетающим аллергическую реакцию. Их нехватка провоцирует приступ и становится причиной рецидивов. Патогенез характеризуется:
- Снижением концентрации бета-адренорецепторов на эпителиях. Снижается восприимчивость к адреналину, расслабляющим бронхиальную мускулатуру
- Активность медиаторов воспаления не спадает, не регулируется с помощью гормонов
- Происходит повышение секреции прововоспалительных белков с одновременным снижением противовоспалительных
Развивается при долговременном лечении глюкокортикостероидами. Неконтролируемый прием гормонов угнетает функцию надпочечников. У девушек гормональный тип бронхиальной астмы возникает при дисбалансе половых гормонов. Приступ возникает в результате снижения выработки прогестерона в крови с повышением выработки эстрогена.
Психосоматическое заболевание — длительные стрессы нарушают нормальное функционирование органов. В начале отсутствуют признаки органических изменений стенки бронхов. Приступ вызван спазмом гладкой мускулатуры. Стойкие изменения возникают в запущенных формах. Данная форма бронхиальной астмы развивается в результате чувствительности эпителия бронхов к гистамину, ацетилходину. Они передают импульсы центральной нервной системе. Приступ провоцирует физическая нагрузка, сопровождаемая глубоким вдохом.
Вызвана повышенной чувствительностью к препаратам на основе ацетилсалициловой кислоты. Она нарушает обмен арахидоновой кислоты. Стимулируется синтез лейкотреинов, вызывающих спазм бронхиального дерева. Снижается активность тромбоцитов, провоцируется развитие отеков. Аспириновой астме подвержены большей частью женщины, в возрасте от 30-40 лет, принимающие обезболивающие препараты.
Приступ при астме физического усилия возникает через несколько минут после активной физической нагрузки и после нее. Интенсивность приступа небольшая, снимается ингалятором. Активные нагрузки делают дыхание сбивчивым, человек дышит ртом. Холодный сухой воздух раздражает слизистую оболочку и сушит ее. Эпителиальные клетки выделяют воспалительные медиаторы, развивая отек слизистой. Возникает спазм гладкой мускулатуры бронхов.
Этиология БА у детей схожа со взрослой. Среди распространенных раздражающих факторов:
- Реакция на прием медикаментов
- Крик и сильный плач
- Большое скопление пыли в детской
- Попадание шерсти животных в дыхательные органы
- Вдыхание пыльцы
- Стресс
- Непереносимость пищевых компонентов
- Сильный смех
Главным раздражающим фактором является пыль, она способствует развитию плесени и клещей. Пыльевые клещи живут в мягкой мебели и комнатах с повышенной влажностью. Через пыль обычно заражаются новорожденные дети, для профилактики нужно часто бывать на воздухе и проветривать комнату.
Этиология и патогенез бронхиальной астмы неразрывно связаны. Независимо от фактора, влияющего на развитие заболевания оно сопровождается: отеком бронхиальной слизистой оболочки спазмом гладкой мускулатуры, повышенным выделением слизи.
источник
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Согласно современным представлениям морфологической основой бронхиальной астмы является хроническое воспаление бронхиальной стенки с повышением количества активированных эозинофилов, тучных клеток, Т-лимфоцитов в слизистой оболочке бронхов, утолщением базальной мембраны и последующим развитием субэпителиального фиброза. Вследствие этих воспалительных изменений развивается гиперреактивность бронхов и бронхообструктивный синдром.
Развитие аллергической (атопической, иммунологической) бронхиальной астмы обусловлено аллергической реакцией I типа (немедленной аллергической реакцией) по Gell и Coombs, в которой принимают участие IgE и IgG,. Этому процессу способствует дефицит Т-супрессорной функции лимфоцитов.
В патогенезе аллергической бронхиальной астмы выделяют 4 фазы: иммунологическую, патохимическую, патофизиологическую и условнорефлекгорную.
В иммунологической фазе под влиянием аллергена В-лимфоциты секретируют специфические антитела, относящиеся преимущественно к классу IgE (реагиновые антитела). Происходит это следующим образом.
Поступивший в дыхательные пути аллерген захватывается макрофагом, перерабатывается (расщепляется на фрагменты), связывается с гликопротеинами II класса главного комплекса гистосовместимости (HLA) и транспортируется к клеточной поверхности макрофага. Описанные события получили название процессинга. Далее комплекс «антиген+молекулы HLA класса II» представляется (презентируется) Т-лимфоцитам-хелперам (аллергоспецифичным). После этого активируется субпопуляция Т-хелперов (Тh2), которая продуцирует ряд цитокинов, участвующих в осуществлении аллергической реакции I типа:
- интерлейкины 4, 5, 6 стимулируют пролиферацию и дифференцировку В-лимфоцитов, переключают синтез иммуноглобулинов в В-лимфоцитах на IgE и IgG4;
- интерлейкин-5 и ГМ-СФ (гранулоцитарный макрофагальный стимулирующий фактор) — активирует эозинофилы.
Активация субпопуляции Th2 и выделение указанных цитокинов приводит к активации и синтезу В-лимфоцитами IgE и IgG4, активации и дифференциации тучных клеток и эозинофилов.
Образовавшиеся IgE и IgG4 фиксируются на поверхности клеток-мишеней аллергии I (тучных клетках и базофилах) и II порядка (эозинофилах, нейтрофилах, макрофагах, тромбоцитах) с помощью клеточных Fc-рецепторов. Основное количество тучных клеток и базофилов находится в подслизистом слое. При стимуляции аллергеном количество их возрастает в 10 раз.
Наряду с активацией Тh2 тормозится функция субпопуляции Т-лимфоцитов-хелперов — Тh. Как известно, основная функция Тh — развитие замедленной гиперчувствительности (IV типа аллергической реакции по Gell и Coombs). Thl-лимфоциты секретируют гамма-интерферон, который тормозит синтез реагинов (IgE) В-лимфоцитами.
Иммунохимическая (патохимическая) стадия характеризуется тем, что при повторном поступлении аллергена в организм больного происходит его взаимодействие с антителами-реагинами (в первую очередь IgE) на поверхности клеток-мишеней аллергии. При этом происходит дегрануляция тучных клеток и базофилов, активация эозинофилов с вьщелением большого количества медиаторов аллергии и воспаления, которые вызывают развитие патофизиологической стадии патогенеза.
Патофизиологическая стадия бронхиальной астмы характеризуется развитием бронхоспазма, отека слизистой оболочки и инфильтрации стенки бронха клеточными элементами, воспаления, гиперсекрецией слизи. Все эти проявления патофизиологической стадии обусловлены воздействием медиаторов аллергии и воспаления, которые выделяются тучными клетками, базофилами, эозинофилами, тромбоцитами, нейтрофилами, лимфоцитами.
В течении патофизиологической стадии выделяют две фазы — раннюю и позднюю.
Ранняя фаза или ранняя астматическая реакция характеризуется развитием бронхоспазма, выраженной экспираторной одышкой. Начинается эта фаза через 1-2 минуты, достигает максимума через 15-20 минут и продолжается около 2 ч. Основными клетками, участвующими в развитии ранней астматической реакции, являются тучные клетки и базофилы. В процессе дегрануляции этих клеток выделяется большое количество биологически активных веществ — медиаторов аллергии и воспаления.
Из тучных клеток выделяются гистамин, лейкотриены (ЛТС4, ЛТД4, ЛТЕ4), простагландин Д различные протеолитические ферменты. Кроме этих медиаторов, из тучных клеток выделяются также интерлейкины 3, 4, 5, 6, 7, 8, нейтрофильный и эозинофильный хемотаксический факторы, тромбоцитоакгивирующий фактор, гранулоцитарно-макрофагальный колониестимулирующий фактор и фактор некроза опухолей.
Дегрануляция базофилов сопровождается вьщелением гистамина, лейкотриена ЛТД4 эозинофильного и нейтрофильного хемотаксического факторов, тромбоцитактивирующего фактора, лейкотриена В, (вызывает хемотаксис нейтрофилов), гепарина, калликреина (расщепляет кининоген с образованием брадикинина).
Ведущим механизмом ранней астматической реакции является бронхоспазм, который обусловлен влиянием медиаторов гистамина, медленно реагирующей субстанции анафилаксии, состоящей из лейкотриенов С4, Д4, E4 простагландина Д„ брадикинина, тромбоцитактивирующего фактора.
Поздняя астматическая реакция развивается приблизительно через 4-6 ч, максимум ее проявлений наступает через 6-8 ч, длительность реакции 8-12 ч. Основными патофизиологическими проявлениями поздней астматической реакции являются воспаление, отек слизистой оболочки бронхов, гиперсекреция слизи. В развитии поздней астматической реакции принимают участие тучные клетки, эозинофилы, нейтрофилы, макрофаги, тромбоциты, Т-лимфоциты, которые скапливаются в бронхиальном дереве под влиянием секретируемых тучными клетками медиаторов и цитокинов. Медиаторы, выделяемые этими клетками, способствуют развитию воспалительных изменений бронха, хронизации воспалительного процесса и формированию при последующих обострениях необратимых морфологических изменений.
Ключевой клеткой в развитии поздней астматической реакции является эозинофил. Он продуцирует большое количество биологически активных веществ:
- основной белок — активирует тучные клетки, повреждает эпителий бронхов;
- катионный белок — активирует тучные клетки, повреждает эпителий бронхов;
- эозинофильный белок X — обладает нейротоксичным эффектом, угнетает культуру лимфоцитов;
- фактор, активирующий тромбоциты — вызывает спазм бронхов и сосудов, отек слизистой оболочки бронхов, гиперсекрецию слизи, повышает агрегацию тромбоцитов и индуцирует выделение ими серотонина, активирует нейтрофилы и тучные клетки, способствует нарушению микроциркуляции;
- лейкотриен С4 — вызывает спазм бронхов и сосудов, повышает сосудистую проницаемость;
- простагландин Д2 и F2a — вызывают бронхоспазм, повышение сосудистой проницаемости и агрегации тромбоцитов;
- простагландин Е2 — обусловливает вазодилатацию, гиперсекрецию слизи, угнетает клетки воспаления;
- тромбоксан А2 — вызывает спазм бронхов и сосудов, повышает агрегацию тромбоцитов;
- хемотаксический фактор — вызывает хемотаксис эозинофилов;
- цитокины — гранулоцитарно-макрофагальный колониестимулирующий фактор (активирует воспалительные клетки, способствует дифференцировке гранулоцитов); интерлейкин-3 (активирует воспалительные клетки и дифференцировку гранулоцитов); интерлейкин-8 (активирует хемотаксис и дегрануляцию фанулоцитов);
- протеолитические ферменты (арилсульфатаза, бета-глюкуронидаза — вызывают гидролиз гликозаминогликанов и глюкуроновой кислоты, коллагеназа — вызывает гидролиз коллагена);
- пероксидаза — активирует тучные клетки.
Биологически активные вещества, выделяемые эозинофилами, способствуют развитию спазма бронхов, выраженного воспалительного процесса в них, повреждению бронхиального эпителия, нарушению микроциркуляции, гиперсекреции слизи, развитию гиперреактивности бронхов.
Большую роль в развитии ранней и поздней астматической реакции играют альвеолярные и бронхиальные макрофаги. В результате контакта аллергенов и Fc-рецепторов макрофагов они активируются, что приводит к продукции медиаторов — фактора, активирующего тромбоциты, лейкотриенов В4 (в небольших количествах С4 и Д4), 5-НЕТЕ (5-гидроксиэйкозотетраеновой кислоты — продукта липоксигеназного окисления арахидоновой кислоты), лизосомальных ферментов, нейтральных протеаз, бетаглюкуронидазы, PgD 2.
В последние годы установлено, что в механизме привлечения эозинофилов и других клеток воспаления в бронхи играет огромную роль адгезия клеток к эндотелию. Процесс адгезии связан с появлением на клетках эндотелия молекул адгезии (Е-селектина и внутриклеточного ICAM-1), а на эозинофилах и других клетках воспаления — соответствущих рецепторов для адгезивных молекул. Экспрессия молекул адгезии на эндотелии усиливается действием цитокинов — фактора некроза опухоли (TFN-альфа) и интерлейкина-4, которые продуцируются тучными клетками.
Сейчас известно, что и сам эпителий бронхов играет большую роль в развитии воспаления в бронхе и бронхоспазма. Бронхиальный эпителий выделяет прововоспалительные цитокины, которые способствуют поступлению в бронх клеток воспаления и активируют Т-лимфоциты и моноциты, участвующие в развитии иммунного воспаления. Кроме того, бронхиальный эпителий (как и эндотелий), продуцирует эндотелии, обладающий бронхо- и сосудосуживающим эффектом. Наряду с этим бронхиальный эпителий вырабатывает азота оксид (NO), который обладает бронхорасширяющим эффектом и функционально уравновешивает действие многочисленных бронхосуживающих факторов. Вероятно, поэтому количество NO значительно возрастает в воздухе, выдыхаемом больным бронхиальной астмой, что служит биологическим маркером этого заболевания.
В развитии аллергической бронхиальной астмы ведущую роль играет гиперпродукция класса антител IgE (IgE-зависимая бронхиальная астма). Однако по данным В. И. Пыцкого и А. А. Горячкиной (1987), у 35% больных бронхиальной астмой имеется повышение продукции не только IgE, но и IgG. (IgE-IgG4-зависимая бронхиальная астма). Она характеризуется началом заболевания в более позднем возрасте (старше 40 лет), пролонгированными приступами, меньшей эффективностью проводимых лечебных мероприятий.
Реже в патогенезе аллергической бронхиальной астмы играет ведущую роль аллергическая реакция Штипа (иммунокомплексный тип). При этом образуются антитела, принадлежащие преимущественно к иммуноглобулинам класса G и М. Далее формируется комплекс антиген-антитело, патофизиологическое влияние которого реализуется через активацию комплемента, освобождение лизосомальных прагеолитических ферментов и медиаторов из макрофагов, нейтрофилов, тромбоцитов, активацию кининовой и свертывающей систем. Следствием этих процессов является бронхоспазм и развитие отека и воспаления бронха.

Азота оксид (NO) является эндотелиалышм расслабляющим фактором и посредством активации гуанилатциклазы и синтеза цГМФ вызывает расслабление гладкой мускулатуры сосудов и, следовательно, их расширение. Азота оксид образуется из аминокислоты аргинина под влиянием фермента NO-синтетазы (NOS). Существует две изоформы NO-синтетазы — конститутивная (cNOS) и индуцибельная (iNOS). Конститутивная NOS (cNOS) находится в цитоплазме, является кальций- и кальмодулинзависимой и способствует выделению небольшого количества NO на короткий период.
Индуцибельная NOS (iNOS) является кальций- и кальмодулинзависимой, способствует синтезу большого количества NO на длительное время. Она образуется в воспалительных клетках в ответ на действие эндотоксинов и цитокинов.
Сейчас известно, что NO-синтетаза присутствует в нейронах, эндотелиоцитах, гепатоцитах, клетках Купфера, фибробластах, гладких миоцитах, нейтрофилах, макрофагах.
В легких NO синтезируется под влиянием cNOS в эндотелиальных клетках легочной артерии и вены, в нейронах неадренергической нехолинэргической нервной системы.
Под влиянием iNOS NO синтезируется макрофагами, нейтрофилами, тучными клетками, эндотелиальными и гладкомышечными клетками, эпителиальными клетками бронхов.
NO в бронхопульмональной системе играет следующую положительную роль:
- способствует вазодилатации в малом круге кровообращения, следовательно, повышение продукции NO противодействует развитию легочной гипертензии при хронической обструктивной болезни легких;
- увеличение продукции NO способствует бронходилатации и улучшению функции мерцательного эпителия бронхов; NO рассматривается как нейротрансмиггер бронходилататорных нервов, противодействующий влиянию бронхоконстрикторных нервов;
- участвует в уничтожении микроорганизмов и опухолевых клеток;
- снижает активность воспалительных клеток, тормозит агрегацию тромбоцитов, улучшает микроциркуляцию.
Наряду с этим NO может играть в бронхопульмональной системе отрицательную роль.
INOS экспрессируется в дыхательных путях в ответ на воспалительные цитокины, эндотоксины, оксиданты, легочные ирританты (озон, сигаретный дым и др.). Продуцируемый под влиянием iNOS азота оксид взаимодействует с накопившимся в очаге воспаления продуктом частичного восстановления кислорода — супероксидом. В результате такого взаимодействия образуется медиатор пероксинитрит, который вызывает повреждение клеток, белков, липидов клеточных мембран, повреждает сосудистый эпителий, повышает агрегацию тромбоцитов, стимулирует воспалительный процесс в бронхопульмональной системе.
При бронхиальной астме активность iNOS повышается, содержание NO в эпителии бронхов нарастает, и увеличивается концентрация NO в выдыхаемом воздухе. Интенсивный синтез NO под влиянием iNOS может играть роль в формировании бронхиальной обструкции у больных среднетяжелой и тяжелой формами бронхиальной астмы.
Повышенное содержание оксида азота в выдыхаемом воздухе является биологическим маркером бронхиальной астмы.
В докладе «Бронхиальная астма. Глобальная стратегия. Лечение и профилактика» (ВОЗ, Национальный институт сердца, легких и крови, США), в Российском Консенсусе по бронхиальной астме (1995), в Национальной Российской программе «Бронхиальная астма у детей» (1997) респираторные инфекции рассматриваются как факторы, способствующие возникновению или обострению течения бронхиальной астмы. Наряду с этим крупнейший специалист в области бронхиальной астмы проф. Г. Б. Федосеев предлагает выделять отдельный клинико-патогенетический вариант заболевания — инфекционно-зависимую бронхиальную астму. Это оправдано, прежде всего, с практической точки зрения, так как достаточно часто не только первые клинические проявления или обострения течения бронхиальной астмы связаны с влиянием инфекции, но и значительное улучшение состояния больных наступает после воздействия на инфекционный агент.
В патогенезе инфекционно-зависимого варианта бронхиальной астмы участвуют следующие механизмы:
- гиперчувствительность замедленного типа, основная роль в развитии которой принадлежит Т-лимфоцитам. При повторных контактах с инфекционным аллергеном они гаперсенсибилзируются и приводят к выделению медиаторов замедленного действия: факторов хемотаксиса нейтрофилов, эозинофилов, лимфотоксина, фактора агрегации тромбоцитов. Медиаторы замедленного действия вызывают в клетках-мишенях (тучные клетки, базофилы, макрофаги) освобождение простагландинов (PgD2, F2а, лейкотриенов (ЛТС4, ЛТД4, ЛТК4) и др., вследствие чего развивается бронхоспазм. Кроме того, вокруг бронха формируется воспалительный инфильтрат, содержащий нейгрофилы,лимфоциты, эозинофилы. Этот инфильтрат является источником медиаторов немедленного типа (лейкотриены, гастамин), вызывающих спазм бронха и его воспаление. Из гранул эозинофилов выделяются также белки, повреждающие непосредственно мерцательный эпителий бронхов, что затрудняет эвакуацию мокроты;
- аллергическая реакция немедленного типа с образованием реагина IgE (аналогично атонической астме). Развивается редко, на ранних стадиях инфекционно-зависимой бронхиальной астмы, главным образом при грибковой и нейссериальной астме, а также при респираторно-синцитиальной инфекции, при пневмококковой и гемофильной бактериальной инфекции;
- неиммунологические реакции — повреждение токсинами надпочечников и снижение глюкокортикоидной функции, нарушение функции мерцательного эпителия и понижение активности бета2-адренорецепторов;
- активация комплемента по альтернативному и классическому пути с освобождением С3 — и С5 -компонентов, обусловливающих выделение и других медиаторов тучными клетками (при пневмококковой инфекции);
- высвобождение гистамина и других медиаторов аллергии и воспаления из тучных клеток и базофилов под влиянием пептидогликанов и эндотоксинов многих бактерий, а также лектин-опосредованным механизмом;
- синтез гистамина гемофильной палочкой с помощью гистидин-декарбоксилазы;
- повреждение эпителия бронхов с утратой секреции бронхорелаксирующих факторов и продукцией провоспалительных медиаторов: интерлейкина-8, фактора некроза опухоли и др.
Глюкокортикоидная недостаточность может быть одной из причин развития или обострения бронхиальной астмы. Глюкокортикоидные гормоны оказывают следующее влияние на состояние бронхов:
- повышают количество и чувствительность бета-адренорецепторов к адреналину и, следовательно, увеличивают его бронходилатирующий эффект;
- тормозят дегрануляцию тучных клеток и базофилов и выделение гистамина, лейкотриенов и других медиаторов аллергии и воспаления;
- являются физиологическими антагонистами бронхоконстрикторных веществ, тормозят продукцию эндотелина-1, обладающего бронхоконстрикторным и провоспалительным эффектом, а также вызывающим развитие субэпителиального фиброза;
- снижают синтез рецепторов, через которые осуществляется бронхосуживающее действие субстанции Р;
- активизируют продукцию нейтральной эндопептидазы, разрушающей брадикинин и эндотелин-1;
- тормозят экспрессию адгезивных молекул (IСАМ-1, Е-селектина);
- уменьшают продукцию провоспалительных цитокинов (интерлейкинов lb, 2, 3, 4, 5, 6, 8, 12, 13, фактора некроза опухоли а) и активируют синтез цитокинов, обладающих противовоспалительным эффектом (интерлейкин 10);
- тормозят образование метаболитов арахидоновой кислоты — бронхоконстрикторных простагландинов;
- восстанавливают структуру поврежденного эпителия бронхов и подавляют секрецию бронхиальным эпителием воспалительного цитокина интерлейкина-8 и факторов роста (тромбоцитарных, инсулиноподобных, фибробластактивирующих и др.).
В связи с наличием вышеуказанных свойств глюкокортикоиды тормозят развитие воспаления в бронхах, снижают их гиперреактивность, оказывают противоаллергическое и антиастматическое действие. Напротив, глюкокортикоидная недостаточность может в ряде случаев лежать в основе развития бронхиальной астмы.
Известны следующие механизмы формирования глюкокортикоидной недостаточности при бронхиальной астме:
- нарушение синтеза кортизола в пучковой зоне коры надпочечников под влиянием длительной интоксикации, гипоксии;
- нарушение соотношения между основными глюкокортикоидными гормонами (уменьшение синтеза кортизола и увеличение кортикостерона, обладающего менее выраженными по сравнению с кортизолом противовоспалительными свойствами);
- повышенное связывание кортизола с транскортином плазмы и снижение, таким образом, свободной, биологически активной его фракции;
- уменьшение в бронхах количества или чувствительности мембранных рецепторов к кортизолу, что, естественно, уменьшает воздействие глюкокортикоидов на бронхи (состояние кортизолорезистентности);
- сенсибилизация к гормонам гипоталамо-гипофизарно-надпочечниковой системы с продукцией IgE-антител к АКТГ и кортизолу;
- повышение порога чувствительности клеток гипоталамуса и гипофиза к регулирующему воздействию (по принципу обратной связи) уровня кортизола в крови, что, по мнению В. И. Трофимова (1996), на начальных этапах заболевания приводит к стимуляции синтеза глюкокортикоидов корой надпочечников, а при прогрессировали бронхиальной астмы — истощению резервных возможностей глюкокортикоидной функции;
- подавление глюкокортикоидной функции надпочечников вследствие длительного лечения больных глюкокортикоидными препаратами.
Глюкокортикоидная недостаточность способствует развитию воспаления в бронхах, их гиперреактивности и бронхоспазма, приводит к формированию кортикозависимости (кортикозависимая бронхиальная астма). Различают кортикочувствительную и кортико-резистентную кортикозависимую бронхиальную астму.
При кортикочувствительной бронхиальной астме для достижения ремиссии и ее поддержания требуются малые дозы системных или ингаляционных глюкокортикоидов. При кортикорезистентной бронхиальной астме ремиссия достигается большими дозами системных глюкокортикоидов. О кортикорезистентности следует думать в том случае, когда после семидневного курса лечения преднизолоном в дозе 20 мг/сут ОФВ, увеличивается менее, чем на 15% по сравнению с исходным.
В настоящее время хорошо известно, что у многих женщин резко ухудшается течение бронхиальной астмы (возобновляются и ухудшаются приступы удушья) перед или во время менструации, иногда в последние дни менструации. Установлено влияние прогестерона и эстрогенов на тонус бронхов и состояние бронхиальной проходимости:
- прогестерон стимулирует бета2-адренорецепторы бронхов и синтез простагландина Е, что обусловливает бронходилатирующий эффект;
- эстрогены ингибируют активность ацетилхолинэстеразы, соответственно повышают уровень ацетилхолина, что стимулирует ацетилхолиновые рецепторы бронхов и вызывают бронхоспазм;
- эстрогены стимулируют активность бокаловидных клеток, слизистой оболочки бронхов и вызывают их гипертрофию, что приводит к гиперпродукции слизи и ухудшению бронхиальной проходимости;
- эстрогены усиливают высвобождение гистамина и других биологических веществ из эозинофилов и базофилов, что обусловливает появление бронхоспазма;
- эстрогены усиливают синтез PgF2a, оказывающего бронхоконстрикторный эффект;
- эстрогены увеличивают связь с транскортином плазмы кортизола и прогестерона, что приводит к уменьшению свободной фракции этих гормонов в крови и, следовательно, снижению их бронходилатирующего эффекта;
- эстрогены снижают активность бета-адренорецепторов бронхов.
Таким образом, эстрогены способствуют бронхоконстрикции, прогестерон — бронходилатации.
При дизовариальном патогенетическом варианте бронхиальной астмы наблюдается снижение в крови уровня прогестерона во II фазе менструального цикла и повышение — эстрогенов. Указанные гормональные сдвиги приводят к развитию гиперреактивности бронхов и бронхоспазму.
Адренергический дисбаланс — это нарушение соотношения между бета- и альфа-адренорецепторами бронхов с преобладанием активности альфа-адренорецепторов, что вызывает развитие бронхоспазма. В патогенезе адренергического дисбаланса имеет значение блокада альфа-адренорецепгоров и повышение чувсгвительности альфа-адренорецепторов. Развитие адренергического дисбаланса может быть вызвано врожденной неполноценностью бета2-адренорецепторов и системы аденилатциклаза-3′,5′-цАМФ, их нарушением под влиянием вирусной инфекции, аллергической сенсибилизации, гипоксемии, изменений кислотно-щелочного равновесия (ацидоза), избыточного применения симпатомимегиков.
О нервно-психическом патогенетическом варианте бронхиальной астмы можно говорить в том случае, если нервно-психические факторы являются причиной заболевания, а также достоверно способствуют его обострению и хронизации. Психоэмоциональные стрессы оказывают влияние на тонус бронхов через вегетативную нервную систему (о роли вегетативной нервной системы в регуляции бронхиального тонуса). Под влиянием психоэмоционального стресса повышается чувствительность бронхов к гистамину и ацетилхолину. Кроме того, эмоциональное напряжение вызывает гипервентиляцию, стимуляцию ирритативных рецепторов бронхов внезапным глубоким вдохом, кашлем, смехом, плачем, что ведет к рефлекторному спазму бронхов.
А. Ю. Лотоцкий (1996) выделяет 4 вида нервно-психического механизма патогенеза бронхиальной астмы: истероподобный, неврастеноподобный, психастеноподобный, шунтовой.
При истероподобном варианте развитие приступа бронхиальной астмы является определенным способом привлечь внимание окружающих и освободиться от ряда требований, условий, обстоятельств, которые больной считает неприятными для себя и обременительными.
При неврастеноподобном варианте формируется внутренний конфликт вследствие несоответствия возможностей пациента как личности и повышенных требований к себе (т.е. своего рода недостижимому идеалу). В этом случае приступ бронхиальной астмы становится как бы оправданием своей несостоятельности.
Психастенический вариант характеризуется тем, что приступ бронхиальной астмы появляется при необходимости принять серьезное, ответственное решение. Больные при этом тревожны, неспособны к самостоятельным решениям. Развитие приступа астмы в этой ситуации как бы избавляет больного от чрезвычайно сложной и ответственной для него ситуации.
Шунтовой вариант характерен для детей и позволяет им избегать конфронтации с конфликтами в семье. При ссоре родителей развитие приступа астмы у ребенка уводит родителей от выяснения отношений, так как переключает их внимание на болезнь ребенка, который при этом получает максимум внимания и заботы к себе.
Холинергический вариант бронхиальной астмы — это форма заболевания, возникающая вследствие повышенного тонуса блуждающего нерва на фоне нарушений обмена холинергического медиатора — ацетилхолина. Этот патогенетический вариант наблюдается приблизительно у 10% больных. При этом в крови больных наблюдается увеличение уровня ацетилхолина и снижение ацетилхолинэстеразы — фермента, инактивирующего ацетилхолин; это сопровождается дисбалансом вегетативной нервной системы с преобладанием тонуса блуждающего нерва. Следует заметить, что высокий уровень ацетилхолина в крови наблюдается у всех больных бронхиальной астмой в периоде обострения, однако у больных холинергическим вариантом заболевания ацетилхолинемия значительно более выражена, и вегетативный и биохимический статус (в том числе уровень ацетилхолина в крови) не нормализуется даже в фазе ремиссии.
При холинергическом варианте наблюдаются также следующие важные патогенетические факторы:
- повышение чувствительности эффекторных рецепторов блуждающего нерва и холинорецепторов к медиаторам воспаления и аллергии с развитием гиперреактивности бронхов;
- возбуждение М1-холинорецепторов, что улучшает распространение импульса по рефлекторной дуге блуждающего нерва;
- снижение скорости инактивации ацетилхолина, накопление его в крови и тканях и перевозбуждение парасимпатического отдела вегетативной нервной системы;
- снижение активности М2-холинорецепторов (в норме они ингибируют выделение ацетилхолина из ветвей блуждающего нерва), что способствует бронхоконстрикции;
- увеличение количествахолинергических нервов в бронхах;
- повышение активности холинергических рецепторов в тучных клетках, слизистых и серозных клетках бронхиальных желез, что сопровождается выраженной гиперкринией — гиперсекрецией бронхиальной слизи.
«Аспириновая» бронхиальная астма — это клинико-патогенетический вариант бронхиальной астмы, обусловленный непереносимостью ацетилсалициловой кислоты (аспирина) и других нестероидных противовоспалительных препаратов. Частота выявления аспириновой астмы среди больных бронхиальной астмой составляет от 9.7 до 30%.
В основе «аспириновой» астмы лежит нарушение метаболизма арахидоновой кислоты под влиянием аспирина и других нестероидных противовоспалительных средств. После их приема из арахидоновой кислоты мембраны клеток вследствие активации 5-липооксигеназного пути образуются лейкотриены, вызывающие бронхоспазм. Одновременно угнетается циклооксигеназный путь метаболизма арахидоновой кислоты, что ведет к уменьшению образования PgE (расширяет бронхи) и увеличению — PgF2 (суживает бронхи). «Аспириновую» астму вызывают аспирин, нестероидные противовоспалительные средства (индометацин, бруфен, вольтарен и др.), баралгин, другие лекарственные средства, в состав которых входит ацетилсалициловая кислота (теофедрин, цитрамон, асфен, аскофен), а также продукты, содержащие салициловую кислоту (огурцы, цитрусовые, томаты, различные ягоды) или желтые красители (тартразин).
Установлена также большая роль тромбоцитов в развитии «аспириновой астмы». У больных «аспириновой» астмой наблюдается повышенная активность тромбоцитов, что усугубляется в присутствии ацетилсалициловой кислоты.
Активация тромбоцитов сопровождается повышенной их агрегацией, увеличением выделения из них серотонина и тромбоксана. Оба эти вещества вызывают развитие спазма бронхов. Под влиянием избытка серотонина усиливается секреция бронхиальных желез и отек слизистой оболочки бронхов, что способствует развитию бронхиальной обструкции.
Первично-измененная реактивность бронхов — это клинико-патогенетический вариант бронхиальной астмы, не относящийся к вышеперечисленным вариантам и характеризующийся появлением приступов удушья при физической нагрузке, вдыхании холодного воздуха, перемене погоды, от резких запахов.
Как правило, приступ бронхиальной астмы, возникающий при вдыхании холодного воздуха, раздражающих и резко пахнущих веществ, обусловлен возбуждением чрезвычайно реактивных ирритативных рецепторов. В развитии гиперреактивности бронхов большое значение имеет увеличение межэпителиальных промежутков, что способствует прохождению через них различных химических раздражителей из воздуха, вызывающих дегрануляцию тучных клеток, выходу из них гистамина, лейкотриенов и других бронхоспастических веществ.
Астма физического усилия — клинико-патогенетический вариант бронхиальной астмы, характеризующийся появлением приступов удушья под влиянием субмаксимальной физической нагрузки; при этом отсутствуют признаки аллергии, инфекции, нарушений функции эндокринной и нервной систем. В. И. Пыцкий и соавт. (1999) указывают, что более правильно говорить не об астме физического усилия, а о «постнагрузочном бронхоспазме», потому что этот вариант брон-хообструкции редко встречается изолированно и наблюдается, как правило, не во время, а после окончания физической нагрузки.
Основными патогенетическими факторами астмы физического усилия являются:
- гипервентиляция в ходе физической нагрузки; вследствие гипервентиляции происходят респираторная потеря тепла и жидкости, охлаждение слизистой оболочки бронхов, развивается гиперосмолярность бронхиального секрета; имеет место также механическое раздражение бронхов;
- раздражение рецепторов блуждающего нерва и повышение его тонуса, развитие бронхоконстрикции;
- дегрануляция тучных клеток и базофилов с выделением медиа торов (гистамина, лейкотриенов, хемотаксических факторов и других), вызывающих спазм и воспаление бронхов.
Наряду с указанными бронхоконстрикгорными механизмами функционирует также и бронходилатирующий механизм — активация симпатической нервной системы и вьщеление адреналина. Согласно S.Godfrey (1984), физическая нагрузка оказывает два противоположных действия, направленных на гладкую мускулатуру бронхов: расширение бронхов в результате активации симпатической нервной системы и гиперкатехоламинемии и сужение бронхов в результате выброса медиаторов из тучных клеток и базофилов. В период физической нагрузки симпатические бронходилатирующие влияния преобладают. Однако бронходилатирующее действие непродолжительно — 1-5 мин, и вскоре после окончания нагрузки на первый план выступает действие медиаторов, и развивается бронхоспазм. Приблизительно через 15-20 мин происходит инактивация медиаторов.
При высвобождении медиаторов тучные клетки резко снижают свою способность к дальнейшему их выделению — наступает рефрактерность тучных клеток. Полупериод восстановления тучных клеток к синтезу половинного количества медиаторов в них составляет около 45 минут, а полное исчезновение рефрактерности наступает через 3-4 ч.
Аутоиммунная бронхиальная астма — это форма заболевания, развивающаяся вследствие сенсибилизации к антигенам бронхопульмональной системы. Как правило, этот вариант является этапом дальнейшего прогрессирования и усугубления течения аллергической и инфекционно-зависимой бронхиальной астмы. К патогенетическим механизмам этих форм присоединяются аутоиммунные реакции. При аутоиммунной бронхиальной астме выявляются антитела (антиядерные, противолегочные, к гладкой мускулатуре бронхов, к бета-адренорецепторам мышц бронхов). Формирование иммунных комплексов (аутоантиген+аутоанитело) с активацией комплемента приводят к иммунокомплексному повреждению бронхов (III тип аллергической реакции по Cell и Coombs) и бета-адренергической блокаде.
Возможно также развитие IV типа аллергических реакций — взаимодействие аллергена (аутоантигена) и сенсибилизированных Т-лимфоцитов, секретирующихлимфокины с развитием, в конечном итоге, воспаления и спазма бронхов.
Мускулатура бронхов представлена волокнами гладкой мускулатуры. В миофибриллах присутствуют белковые тела актин и миозин; при взаимодействии их друг с другом и образовании комплекса актин+миозин происходит сокращение бронхиальных миофибрилл — бронхоспазм. Образование комплекса актин+миозин возможно только в присутствии ионов кальция. В мышечных клетках присутствует так называемый «кальциевый насос», благодаря которому возможно перемещение ионов Са ++ из миофибрилл в саркоплазматический ретикулум, что ведет к расширению (расслаблению) бронха. Работа «кальциевого насоса» регулируется концентрацией двух внутриклеточных нуклеотидов, действующих антагонистически:
- циклического аденозинмонофосфата (цАМФ), который стимулирует обратное поступление ионов Са ++ из миофибрилл в саркоплазматический ретикулум и связь с ним, вследствие этого тормозится активность кальмодулина, не может образоваться комплекс актин+миозин, и происходит расслабление бронха;
- циклического гуанозинмонофосфата (цГМФ), которыйингибирует работу «кальциевого насоса» и возвращение ионов Са ++ из миофибрилл в саркоплазматический ретикулум, при этом увеличивается активность кальмодулина, поступление Са ++ к актину и миозину, формируется комплекс актин+миозин, происходит сокращение бронха.
Таким образом, тонус бронхиальной мускулатуры зависит от состояния цАМФ и цГМФ. Это соотношение регулируется нейротрансмитерами (нейромедиаторами) вегетативной нервной системы, активностью соответствующих рецепторов на мембране гладкомышечных клеток бронхов и ферментами аденилатциклазой и гуанилатциклазой, которые стимулируют соответственно образование цАМФ и цГМФ.
В регуляции тонуса бронхов и развитии бронхоспазма большую роль играют следующие отделы вегетативной нервной системы:
- холинергическая (парасимпатическая) нервная система;
- адренергическая (симпатическая) нервная система;
- неадренергическаянехолинергаческая нервная система (НАНХ).
Блуждающий нерв играет большую роль в развитии бронхоспазма. На окончаниях блуждающего нерва выделяется нейромедиатор ацетилхолин, который взаимодействует с соответствующими холинергическими (мускариновыми) рецепторами, при этом активируется гуанилатциклаза, и происходит сокращение гладкой мускулатуры, развивается бронхоспазм (механизм описан выше). Обусловленная блуждающим нервом бронхоконстрикция имеет наибольшее значение для крупных бронхов.
Известно, что у человека симпатические нервные волокна не определяются в гладкой мускулатуре бронхов, их волокна выявляются в сосудах и железах бронхов. Нейромедиатором адренергических (симпатических) нервов является норадреналин, образующийся в адренергических синапсах. Адренергические нервы непосредственно не контролируют гладкую мускулатуру бронхов. Принято считать, что существенную роль в регуляции бронхиального тонуса играют циркулирующие в крови катехоламины — адреномиметики (норадреналин и образующийся в надпочечниках адреналин).
Они проявляют свое влияние на бронхи через альфа- и бета-адренорецегггоры.
Активация альфа-адренорецепторов вызывает следующие эффекты:
- сокращение гладкой мускулатуры бронхов;
- уменьшение гиперемии и отека слизистой оболочки бронхов;
- сокращение кровеносных сосудов.
Активация бета2-адренорецепторов приводит к:
- расслаблению гладкой мускулатуры бронхов (через увеличение активности аденилатциклазы и повышение образования цАМФ, как указано выше);
- увеличению мукоцилиарного клиренса;
- расширению кровеносных сосудов.
Наряду с важной ролью адренергических медиаторов в дилатации бронхов огромное значение имеет свойство адренергической нервной системы угнетать пресинаптическое выделение ацетилхолина и тем самым предотвращать вагусное (холинергическое) сокращение бронха.
В бронхах наряду с холинергической (парасимпатической) и адренергической (симпатической) нервной системой существует неадренергическая нехолинергическая нервная система (НАНХ), которая является частью вегетативной нервной системы. Волокна НАНХ-нервов проходят в составе блуждающего нерва и высвобождают ряд нейромедиаторов, влияющих через активацию соответствующих рецепторов на тонус бронхиальной мускулатуры.
Из таблицы видно, что важнейшим бронходилатирующим медиатором НАНХ-системы является вазоакгивный интестинальный полипептид (VIP). Бронходилатирующий эффект VIP осущесгвляюется посредством повышения уровня цАМФ. Murray (1997) и Gross (1993) придают нарушению регуляции на уровне НАНХ-системы наиболее важное значение в развитии синдрома бронхиальной обструкции.
источник