Аспириновая астма (АА) — это заболевание, при котором основным причинным фактором является прием лекарства, обладающего обезболивающим, жаропонижающим и противовоспалительным эффектами, относящегося к нестероидным противовоспалительным препаратам (НПВС). Это особый вид, встречающийся в среднем у 10-40% пациентов, страдающих бронхиальной астмой.
Что это такое? Это патологическое состояние, когда дыхательная система человека излишне остро реагирует на проникновение в организм любым путем (через рот, внутривенно и т. д.) вещества по типу аспирина. Избирательное поражение бронхов и легких, проявляющееся затруднением дыхания, маскируется под признаками бронхиальной астмы и тяжело поддается стандартному лечению.
Аспириновая бронхиальная астма (БА) — это один из клинических вариантов бронхиальной астмы, обладающий особым патогенетическим механизмом, связанным с непереносимостью обезболивающих и жаропонижающих (нестероидных противовоспалительных) лекарственных средств.
Наиболее часто причиной развития аспириновой астмы выступают представители группы салицилатов (аспирин) и производные индолуксусной кислоты (индометацин).
Однако необходимо помнить, что аспириновую астму могут провоцировать комбинированные медикаменты, имеющие в своем составе действующее вещество ацетилсалициловой кислоты, а также пищевые продукты, содержащие салицилаты (цитрусовые, ягоды, томаты,) или пищевые добавки/красители, придающие желтоватый оттенок продуктам (тартразин).
Обращает внимание клиническая особенность данной формы бронхиальной астмы, характеризующаяся осложненным течением с частыми обострениями. При этом добиться полного восстановления проходимости дыхательных путей бывает сложно.
На сегодняшний день не существует единой общепринятой патогенетической теории, объясняющей аспириновую астму. Путем исследований выяснено, что после приема аспириносодержащих и других нестероидных противовоспалительных средств изменяется нормальный механизм превращения арахидоновой кислоты, необходимый для образования веществ-регуляторов функций важных органов, на патологический.
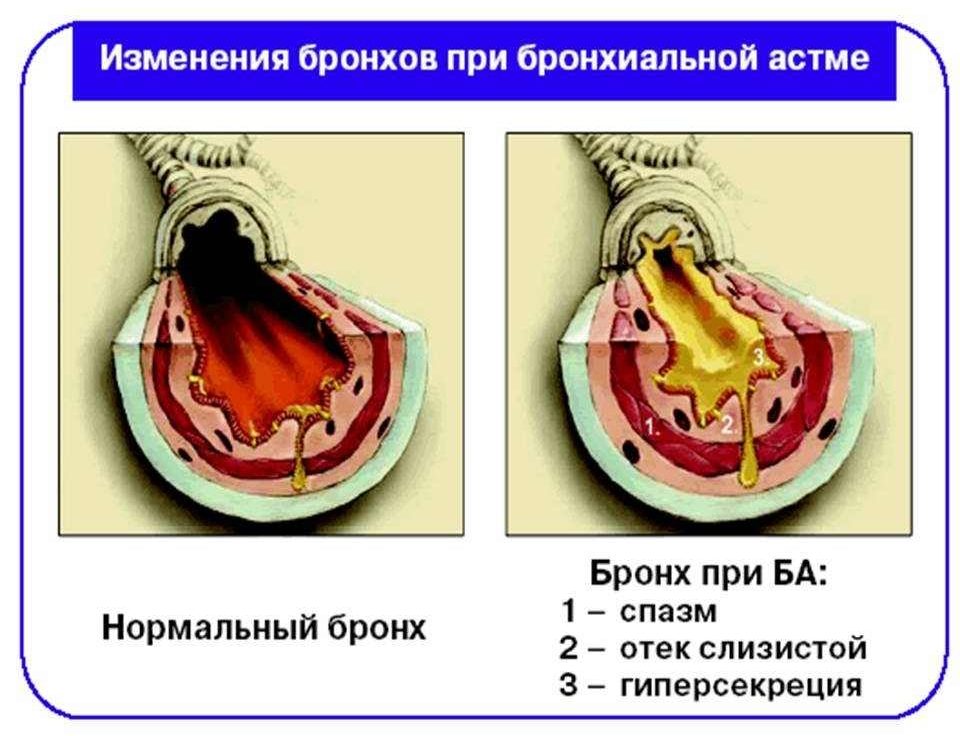
В результате измененного цикла арахидоновой кислоты наблюдается избыток (гиперпродукция) лейкотриенов. Эти вещества усиливают воспалительную реакцию, под их действием развивается отек и повышается сократимость бронхов, увеличивается секреция слизи, уменьшается кровоснабжение миокарда и сила сердечных сокращений.
При бронхиальной астме степень тяжести заболевания зависит не только от интенсивности воспалительного процесса в бронхах, но и от того, где локализуются эти процессы. Особенностью патогенеза аспириновой астмы является вовлечение не только крупных и средних бронхов, но и мелких дыхательный путей (диаметр которых составляет менее 2 мм), а также ткани легких.
Обширное воспалительное повреждение слизистой оболочки органов дыхания приводит к необратимым нарушениям функции газообмена (вдыхание кислорода и выдыхание углекислого газа). В результате формируются такие осложненные формы, как астма физического усилия, ночная астма, тяжелая бронхиальная астма с высоким риском повторных обострений, тяжело контролируемая астма.
Описано и изучено несколько клинических вариантов аспириновой астмы:
- «чистая» форма;
- астматическая триада;
- сочетание непереносимости НПВС с аллергической БА.
В первом варианте прослеживается четкая схема возникновения симптомов астмы в виде появления острой нехватки воздуха и кашля после приема производных салицилатов.
Вторую форму, согласно ее названию, можно представить формулой: анафилактоидные реакции на НПВС + астматическое удушье + патология слизистой носа в виде образования полипов.
Отличительными признаками триады являются заложенность носа, снижение или отсутствие обоняния, боль в проекции околоносовых пазух, головная боль. Когда эти симптомы начинают сочетаться с признаками спазмирования бронхов, что приводит к дыхательной недостаточности, следует оценить связь с приемом аспирина или других НПВС. При прогрессировании заболевания возрастает вероятность появления анафилактоидных проявлений по типу высыпаний, воспаления слизистой носа, конъюнктивита, расстройств пищеварительной системы.
Для третьей, более сложной формы существует риск развития тяжелой патологии дыханя, поскольку аспириновая астма устойчива к лечению глюкокортикоидными гормонами, а последние являются основной группой препаратов для оказания помощи при жизнеугрожающих приступах удушья.
В целом, рассматривая симптоматику аспириновой непереносимости, можно выделить большой спектр клинических проявлений:
- покраснение кожи лица или верхней части тела;
- приступы одышки и кашля;
- воспаление слизистой носа и слизистой оболочки глаз (конъюнктивит);
- высыпание по типу крапивницы;
- ангионевротического отека (типа Квинке);
- повышение температуры тела;
- понос;
- боль в верхней части живота, иногда сопровождающаяся тошнотой или рвотой.
- астматический статус как тяжелое обострение БА;
- остановка дыхания,
- потеря сознания
- шок.
При этом первые признаки начинающегося заболевания могут включать лишь чихание, насморк или заложенность носа и покраснение лица. А возникают данные симптомы через 1-3 часа после приема аспирина или другого НПВС.
Для подтверждения диагноза «аспириновая бронхиальная астма» следует учитывать характерные диагностические параметры:
- Приступ нехватки воздуха, вызванный приемом провоцирующего вещества (производных салицилатов или пищевой добавки тартразина), возникает в диапазоне 1-2 часов.
- Возможное развитие астматической триады: аспириновая астма + непереносимость салицилатов + риносинусит или патология слизистой носа по типу полипоза.
- Снижение показателей внешнего дыхания (например: жизненная емкость легких, пиковая (максимальная) скорость выдоха и др.).
- Положительный тест с аспирином или другие модификации провокационных тестов (например, с индометацином или тартразином).
Следует помнить, что диагностические пробы следует проводить при наличии реанимационного отделения и опытных врачей.
Острое нарушение дыхания (приступ) развивается при обострении аспириновой астмы и может возникать непредсказуемо при контакте с причинным фактором или нарушении эмоционального состояния пациента.
При возникновении дыхательной недостаточности нужно предложить больному занять удобное полусидячее положение и обеспечить поступление в помещение прохладного свежего воздуха. Необходимо измерить артериальное давление и контролировать изменения пульса и частоты дыхания.
Легкую форму приступа возможно устранить путем ингаляции препарата из группы селективных стимуляторов β2-адренорецепторов каждые 20 мин в течение 1-го часа.
Среднетяжелую форму приступа следует устранять инъекционными бронхоспазмолитиками.
Самая тяжелая форма приступа называется «астматический статус», который можно распознать по таким критериям:
- острый приступ затрудненного дыхания (частота дыхания — до 40 в 1 мин):
- преобладание затрудненного выдоха над вдохом в покое;
- синюшный оттенок кожи;
- повышенная потливость;
- учащается сердцебиение;
- подъем артериального давления до высоких показателей;
- вовлечение в дыхание вспомогательной мускулатуры (межреберные мышцы, мышцы плечевого пояса и др.);
- мучительный кашель;
- пациент вынужден принять положение сидя для облегчения дыхания.
Неотложная помощь при астматическом статусе включает:
- Ингаляция увлажненного кислорода.
- Применение системных гормонов.
- Внутривенная инфузия бронхолитиков.
- Инфузионная терапия, направленная на устранение патологии кровообращения и предотвращение[М28] сгущения крови.
- При необходимости — искусственная вентиляция легких.
- Симптоматическая терапия.
Оказание экстренной помощи должно сопровождаться постоянным мониторингом лабораторных показателей и проводиться под руководством врача.
Определение тактики лечения аспириновой астмы рекомендовано выполнять под руководством врача-аллерголога. Выбор направления, продолжительности и способа лечения зависит от тяжести заболевания, возраста пациента и наличия сопутствующих патологий.
Терапия обязательно включает такие компоненты:
- Соблюдение диеты.
- Исключение риска попадания в организм медикаментов, содержащих салицилаты или компоненты нестероидных противовоспалительных средств.
- Базовая фармакотерапия бронхиальной астмы, направленная на разрыв цепочки образования воспалительных веществ.
- Формирование толерантности (нечувствительности, невосприимчивости) к повторному действию производных салицилатов.
Что касается диеты, то надо помнить, что салицилаты есть природные, содержащиеся в продуктах (например, некоторые ягоды, фрукты, овощи, напитки с добавлением зелени или продукты, приготовленные из корнеплодов), а также синтетические, используемые для консервирования. Кроме этого, надо знать про неблагоприятный эффект от использования пищевого красителя тартразина. Поскольку зафиксировано, что у 30% больных с непереносимостью аспирина наблюдается перекрестная побочная реакция к тартразину (обозначение на упаковках — Е-102), рекомендуется отслеживать наличие такой добавки в продуктах или визуально определять ее присутствие в кондитерских изделиях, мороженом, содовой воде, явно имеющих желтый цвет или оттенок.
Вторым важным условием успешного лечения является исключение вероятности проникновения в организм медикаментов, в состав которых входят производные аспирина или синтезированные химические вещества, отнесенные к группе НПВС. Следует внимательно изучать состав действующих веществ лекарственного средства и возможные побочные реакции, связанные с его приемом.
Кроме этого, следует помнить что пищевую добавку тартразин также можно обнаружить в некоторых медикаментах или медицинских изделиях по типу поливитаминных комплексов, зубных паст и других.
Базовая терапия бронхиальной астмы должна соответствовать современным клиническим протоколам лечения и проводиться специалистами. Согласно международным рекомендациям, такое лечение должно включать следующие компоненты:
- мембраностабилизирующие препараты;
- блокаторы (антагонисты) лейкотриеновых рецепторов. Одни из них блокируют рецепторы лейкотриенов (действующее вещество — монтелукаст), другие ингибируют фермент липоксигеназу и снижают синтез лейкотриенов.
- лечение глюкокортикоидами, преимущественно при тяжелой форме заболевания.
Для формирования невосприимчивости (толерантности) организма к салицилатам клинически доказана эффективность метода десенситизации. В основе его лежит свойство иммунной системы пациента не отвечать на повторное введение провоцирующего вещества, поскольку наблюдается истощение рецепторов дыхательных путей. Для формирования такого эффекта схемой предусмотрено введение аспирина в первоначальной минимальной дозе (например, 5-10 мг) с последующим контролем функции дыхания. Если отсутствует негативная реакция организма, дозу повышают на 5-10 мг, и цикл мониторинга повторяется далее. По достижении порога чувствительности на провоцирующий фактор подбирается поддерживающая доза аспирина.
Обязательным условием для десенситизации является проведение опытным врачом в стационаре при наличии средств для оказания экстренной помощи.
Пациентам с аспириновой астмой рекомендовано воздерживаться от употребления пищи по типу копченых мясных изделий, поскольку они могут содержать производные салициловой кислоты. Еще один источник салицилатов – овощи, корнеплоды, цитрусовые. Природные салицилаты содержатся в черной смородине, малине, абрикосах, вишне. Употребление этих продуктов даже в маленьких количествах может спровоцировать спазм бронхов.
В некоторых продуктах питания присутствует химическое соединение, которое является аналогом аспирина по принципу действия на организм человека. Это тартразин (Е-102) – синтетическая добавка/краситель желтого цвета, используемая в кондитерском и консервном производстве.
Больным необходимо тщательно изучать состав таких продуктов или полностью отказаться от них, чтобы предотвратить обострение болезни, тем более что указанные на упаковке компоненты не всегда соответствуют тем, которые производитель на самом деле включил в состав продукта.
Комплекс мероприятий, при выполнении которых будет обеспечено предупреждение появления признаков аспириновой бронхиальной астмы и устранены факторы риска ее обострения, включает:
- соблюдение диеты и требований к качеству и составу продуктов питания;
- исключение вероятности приема лекарственных средств, обладающих обезболивающим, жаропонижающим и противовоспалительным эффектами, относящихся к нестероидным противовоспалительным препаратам (НПВП);
- применение лекарств группы блокаторов лейкотриеновых рецепторов, способных предупредить дневные и ночные симптомы бронхиальной астмы, уменьшить проявления сопутствующего сезонного и круглогодичного аллергического ринита.
В любом случае, своевременное обращение к врачу минимизирует вероятность развития осложнений и поможет в эффективном лечении.
источник
Для того, чтобы успешно контролировать течение болезни, важно не принимать препараты пиразолонового ряда (анальгин, амидопирин, реопирин, спазмалгин, темпалгин, баралгин, теофедрин и др.); ацетилсалициловую кислоту и препараты ее содержащие (плидол, томапирин, цитромон и др.); другие нестероидные противовоспалительные препараты и препараты, содержащие их в своем составе (диклофенак, индометацин, ибупрофен, сулиндак, пироксикам, напроксен и др.).
Исключается и прием тартразина – желтого красителя, подобного по своей химической структуре аспирину. Не следует принимать препараты (таблетки, драже) желтого цвета или покрытые оболочкой желтого цвета (но-шпа, тавегил, кеторол, другие препараты, окрашенные в желтый цвет).
При необходимости анальгезирующей или жаропонижающей терапии может быть рекомендован прием парацетамола (ацетоминофен, панадол, эффералган), солпадеина, фенацетина, трамадола(трамал).
Необходимо помнить, что некоторые пищевые продукты содержат красители и консерванты, употребляемые в пищевой промышленности для сохранения пищевых продуктов (сульфиты, бензоаты, тартразин и др.). Не рекомендован прием всех продуктов, куда входят промышленные или природные салицилаты. Они подобны по своей структуре аспирину. Салицилаты входят в консервы, в гастрономические изделия (колбасы, ветчину, буженину). Тартразин входит в тесто кексов, тортов, пирожных, крема желтого цвета, фруктовые и слабоалкогольные напитки, конфеты, мармелад и драже. Природные салицилаты обнаруживаются в малине, черной смородине, вишне, абрикосах, сливе, апельсинах, томатах и огурцах.
1. Авдеев С.Н. Бронхиальная астма в таблицах и схемах.- М.: Атмосфера, 2005.- 47с.
2. Авдеев С.Н. Роль комбинированного использования β2-агонистов и антихолинергических препаратов при бронхиальной астме.- Пульмонология.-2003.-№2.-с. 117-123.
3. Бельтюков Е.К. Локальная программа помощи больным бронхиальной астмой: организационные, эпидемиологические и фармакоэкономические аспекты: пособие для врачей и организаторов здравоохранения.- М., 2003.- 37с.
4. Бэрнс П., Годфри С. Бронхиальная астма. Бином.- Москва.- 2003.- 125с.
5. Глобальная стратегия лечения и профилактики бронхиальной астмы
(GINA). Перевод с английского. Пересмотр 2002г., Москва.-
6. Клинические рекомендации. Бронхиальная астма у взрослых. Атопический дерматит. Под редакцией акад. РАМН А.Г. Чучалина// Атмосфера.-М.-2002.-254с.
7. Федосеев Г.Б. Бронхиальная астма// Аллергология, Т 2. Частная аллергология. Под редакцией Г.Б.Федосеева, СПб: «Нордмед-Издат»,-2001.-с.64-138.
8. Чучалин А.Г. Белая книга. Пульмонология. Россия.- 2003.- Москва.- 2003.- 67с.
9. Чучалин А.Г. Бронхиальная астма и астмоподобные состояния.- Кремлевская медицина.-2002.-№1.-с. 21-24
10.Berges-Gimeno MP, Simon RA, Stevenson DD. The natural history and clinical characteristics of aspirin exacerbated respiratory disease. Ann Allergy Asthma Immunol 2002; 89:474-478
11.Jenkins C, Costello J, Hodge L. Systematic review of prevalence of aspirin induced asthma and its implications for clinical practice. Br Med J 2004; 328:43
12.Kasper L, Sladek K, Duplaga M, Bochek G, Liebhart J. Prevalence of asthma with aspirin hypersensitivity in the adult population of Poland. Allergy 2003; 58:1064-1066
13.Kowalski ML, Bienkiewicz B, Kordek P, Pawliczak R. Nasal polyposis in aspirin-hypersensitive patients with asthma (aspirin triad) and aspirin-tolerant patients. Allergy Clin Immunol Int- J World Allergy Org 2003; 6:246-250
14.Kupczyk M, Kuprys I, Gorski P, Kuna P. Aspirin intolerance and allergy to house dust mites: Important factors associated with development of severe asthma. Ann Allergy Asthma Immunol 2004; 92:453-458
15.Lee DK, Haggart K, Lipworth BJ. Reproducibility of response to nasal lysine-aspirin challenge in patients with aspirin-sensitive asthma. Ann Allergy Asthma Immunol 2004; 93:185-188
16.Mascia K, Haselkkorn T, Deniz YM, Miller DP, Bleecker ER, Borish L; TENOR Study Group. Aspirin sensitivity and severity of asthma: evidence for irreversible airway obstruction in patients with severe or difficult-to-nreat asthma. J Allergy Clin Immunol 2005; 116: 970-975
17. Picado C. The Role of Cyclooxygenase in Acetylsalicylic Acid Sensitivity. Allergy Clin Immunol Int – J World Allergy Org 2006; 18:154-158
18.Sanak M, Kielbasa B, Bochenek, Szczeklik A. Exhaled eicosanoids following oral aspirin challenge in asthmatic patients. Clin Exp Allergy 2004; 34:1899-1904
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Студент — человек, постоянно откладывающий неизбежность. 10127 — 

195.133.146.119 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Аспириновая бронхиальная астма — это патологическое состояние, относящееся к группе псевдоаллергий. В основе развития такого заболевания лежит повышенная чувствительность организма к ацетилсалициловой кислоте и другим медикаментам из группы нестероидных противовоспалительных средств. С клинической точки зрения, эта патология проявляется спазмом бронхиальной стенки, что ведет к сужению просвета бронхов и нарушению дыхательной функции. Помимо этого, зачастую присутствуют и другие специфические признаки, характерные для данного нарушения. Прогноз при этом патологическом процессе напрямую зависит от тяжести возникающих приступов и индивидуальных особенностей организма.
Впервые специфическая реакция по типу аллергии на прием аспирина была описана еще в тысяча девятьсот третьем году. На тот момент ацетилсалициловая кислота использовалась в медицинской практике уже четыре года. В тысяча девятьсот пятом году удалось зафиксировать два случая возникновения удушья после приема этого лекарственного препарата. Согласно статистике, среди всех форм бронхиальной астмы на долю аспириновой формы приходится около двадцати процентов. Чаще всего данное заболевание встречается в возрастном диапазоне от тридцати до пятидесяти лет. При этом женщины в несколько большей степени подвержены его развитию.
Как мы уже сказали, основным причинным фактором для возникновения такой болезни является аспирин и другие представители нестероидных противовоспалительных препаратов. Считается, что наибольшей активностью в этом плане обладают салицилаты и полициклические кислоты, например, индометацин. Стоит заметить, что более чем в пятидесяти процентах случаев при наличии гиперчувствительности к аспирину аналогичная реакция будет и на другие препараты. То, насколько интенсивно будет выражена патологическая реакция, напрямую зависит от пути введения лекарственного средства, а также от его дозировки. Тяжелее всего протекает приступ бронхиальной астмы при парентеральном поступлении медикамента в организм.
Помимо этого, нередко бронхиальная обструкция бывает вызвана не только лекарственными средствами, но природными салицилатами. К продуктам, содержащим в себе большое количество салицилатов, относятся вишня, мандарины, зеленый перец и оливки, миндаль, арахис и многое другое. В некоторых специях также содержится определенное количество этих веществ. Иногда данная болезнь развивается даже при употреблении в пищу консервов, в состав которых входят салициловая и бензойная кислоты.
Считается, что определенную роль в возникновении этого патологического процесса играет наследственная предрасположенность. Первый семейный случай, предположительно обусловленный аутосомно-доминантным типом наследования, был описан в тысяча девятьсот семьдесят четвертом году. Стоит заметить, что аспириновая бронхиальная астма формируется не из-за классической аллергической реакции. Ее возникновение связано с нарушением обмена омега-6-ненасыщенной жирной кислоты, называющейся арахидоновой. На этом фоне происходит активная выработка медиаторов воспаления, вызывающих повышение сосудистой проницаемости и чрезмерно интенсивную секрецию слизистого экссудата бронхов. Непосредственно сами бронхи спазмируются, а вырабатываемая слизь еще больше нарушает их проходимость.
Помимо вышеописанного, в развитии аспириновой бронхиальной астмы принимают участие еще несколько достаточно сложных механизмов, исходом которых является выраженное нарушение дыхательной функции.
Существует несколько вариантов течения этого патологического процесса. Наиболее часто в клинической картине отмечается наличие нескольких специфических симптомов. Примерно через полчаса или час после приема нестероидного противовоспалительного препарата больной человек начинает жаловаться на заложенность носа, обильное выделение из него слизистого экссудата, а также на слезотечение. При осмотре можно обнаружить, что лицо пациента гиперемировано. Возникают интенсивное чихание и головные боли. Спустя некоторое время развивается классический приступ удушья, характеризующийся затруднением выдоха.
В некоторых случаях параллельно нарастают такие симптомы, как болезненность в области живота, приступы тошноты и рвоты. У больного человека возникают головокружения и снижается артериальное давление.
Еще один вариант данного заболевания называется изолированным. Помимо удушья, никаких клинических проявлений больше не обнаруживается. Считается, что этот вариант имеет относительно благоприятный прогноз.
Нередко такое патологическое состояние сочетается с гиперчувствительностью и к другим веществам, например, к пыльце растений или продуктам питания. В этом случае зачастую присутствуют симптомы со стороны не только дыхательной системы, но и других органов. Очень часто при обследовании пациента обнаруживаются такие заболевания, как экзема, атопический дерматит и так далее.
В первую очередь для диагностики данной болезни необходимо тщательно собрать анамнез и проследить зависимость приступов от приема НПВС. В обязательном порядке следует оценить функцию внешнего дыхания. Подтверждение диагноза может проводиться с помощью провокационных тестов, осуществляемых только в специализированных медицинских учреждениях. Однако этот метод не рекомендован к широкому применению в связи с возможными рисками.
Бронхиальная астма является показанием к назначению ингаляционных глюкокортикостероидов, агонистов бета-адренорецепторов, а также антилейкотриеновых лекарственных препаратов. В ряде случаев для быстрого купирования приступа используются антихолинергические средства. При тяжелом течении заболевания применяются системные глюкокортикостероиды.
Говоря о профилактики этого заболевания, мы подразумеваем предупреждение обострений. С этой целью необходимо избегать приема НПВС, а также соблюдать все рекомендации лечащего врача.
источник
*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Бронхиальная астма — хроническое воспалительное заболевание дыхательных путей, в котором принимают участие многие клетки: тучные, эозинофилы, Т-лимфоциты. При наличии предрасположенности это воспаление приводит к повторяющимся эпизодам хрипов, одышки, тяжести в грудной клетке и кашлю, особенно ночью и/или ранним утром.
Аспирин внедрен в клиническую практику в 1899 г. как анальгезирующее и жаропонижающее средство. И уже в 1903 г. Dr. Franke (Германия) описал у себя аллергическую реакцию на прием аспирина в виде ларингоспазма и шока. В 1905 г.
Barnett описал и опубликовал два случая затрудненного дыхания на фоне приема аспирина. В 1919 г. Francis выявил зависимость между полипозным ринитом и гиперчувствительностью к аспирину. В 1922 г. W >и бронхиальной астмой.
В 1968 г. Samter и Beers снова описали этот симптомокомплекс, который назвали «аспириновой триадой». С этого времени стало известно много нового об эпидемиологии, клинических проявлениях и патофизиологии непереносимости аспирина и других НПВП у больных бронхиальной астмой. Ключевым является ворос о том, почему только у части больных бронхиальной астмой наблюдается непереносимость НПВП. Открытие цистенил-лейкотриенов и их участие в патогенезе бронхиальной астмы во многом объясняет патогенез аспириновой триады.
Термин «аспириновая астма» используется для обозначения клинической ситуации, когда одним из бронхоконстрикторных факторов у больного являются НПВП, в том числе и ацетилсалициловая кислота. АА, как правило, складывается из триады симптомов: полипозный риносинусит, приступы удушья и непереносимость НПВП. Нередко АА сочетается с атопической, однако может наблюдаться и как изолированная форма заболевания. АА характеризуется тяжелым упорным течением. Больные АА довольно часто попадают в реанимационные отделения — по данным ряда авторов, чаще, чем больные с другими клинико-патологическими вариантами бронхиальной астмы.
Течение риносинусита у данной категории больных бронхиальной астмой имеет свои особенности. Наиболее часто АА дебютирует длительным ринитом, который у 20-25% больных постепенно переходит в полипозную риносинусопатию.
Аспириновая риносинусопатия проявляется ринореей, заложенностью носа, отсутствием восприятия запахов, болью в проекции придаточных пазух носа, головной болью. Около половины больных полипозным риносинуситом со временем начинают реагировать удушьем на прием НСПВП. Нередко первые приступы удушья у данной категории больных возникают после хирургических вмешательств, например полипэктомий, радикальных операций на придаточных пазухах носа и др. В отдельных случаях полипозом поражаются и другие слизистые — желудка, мочеполовой системы. Иногда первому приступу удушья предшествуют годы непрерывно рецидивирующего хронического ринита, при котором не удается обнаружить экзоаллергены.
Назальные симптомы, как правило, резко выражены и плохо поддаются терапии. Обычно используются топические, а иногда и системные глюкокортикостероиды, но они часто недостаточно эффективны, и больным регулярно проводится хирургическое лечение.
Больные АА не переносят аспирин и другие НПВП, и эта непереносимость проявляется покраснением лица, потерей сознания, приступами удушья, кашля, ринита и конъюнктивита, уртикарными высыпаниями, отеком Квинке, подъемом температуры, диареей, болью в животе, сопровождающейся тошнотой и рвотой. Наиболее тяжелыми проявлениями реакции на аспирин являются астматический статус, остановка дыхания и шок.
Нет убедительных данных о наследственной предрасположенности к АА, однако исследования в этой области проводятся, так как имеются наблюдения нескольких семей, в которых бронхиальная астма сочетается с непереносимостью аспирина. Заболевание возникает в возрасте от 30 до 50 лет, чаще болеют женщины.
Больные АА составляет 9 — 22% всех больных бронхиальной астмой.
Клетки, участвующие в воспалении и находящиеся в дыхательных путях, вырабатывают различные медиаторы, которые оказывают непосредственное воздействие на гладкие мышцы бронхов, сосуды и секретирующие слизь клетки, а также посылают «сигналы» другим клеткам, тем самым привлекая и активируя их. Среди различных медиаторов, вызывающих сокращение гладких мышц бронхов, наиболее важное значение имеют цистеиновые лейкотриены. Эти вещества могут оказывать и другие существенные воздействия, например, вызывать отек, гиперреактивность бронхов и изменять секрецию слизи.
Так называемые медленно реагирующие субстанции (МРС-А) были открыты Felberg и Kellaway в 1938 г., когда эти исследователи ввели яд кобры в легкие морских свинок и показали, что при этом наблюдается не связанный с действием гистамина спазм бронхов, который возникал медленнее и продолжался более дллительно. Хотя еще в 1960-х годах Brockehurst и соавт. сделали вывод о том, что вещество МРС-А является исключительно важным медиатором аллергии, Smuelsson и его коллегам, установившим структуру МРС-А, пришлось дождаться проявления более качественных аналитических методов. После того как выяснилось, что на самом деле МРС-А является лейкотриеном, были предприняты значительные усилия, направленные на уточнение биологических свойств лейкотриенов и разработку лекарственных препаратов, являющихся их антагонистами и ингибиторами синтеза.
Лейкотриены синтезируются из арахидоновой кислоты, которая высвобождается при иммунологической или неиммунологической стимуляции различных клеток, участвующих в воспалении. Арахидоновая кислота может подвергаться дальнейшим метаболическим превращениям как с помощью циклооксигеназной системы (с образованием простагландинов и тромбоксанов), так и с помощью системы ферментов 5-липоксигеназы (с образованием лейкотриенов). Для функционирования 5-липоксигеназ требуется связанный с мембраной белок, называемый 5-липоксигеназактивирующим белком. Первоначально предполагалось, что этот фермент необходим для связывания с энзимами 5-липоксигеназы, однако теперь считается, что он, по-видимому, является контактным белком для арахидоновой кислоты.
Как только 5-липоксигеназа превратит арахидоновую кислоту в лейкотриены, она разрушается и инактивируется. Естественным промежуточным продуктом в ходе функционирования ферментной системы 5-липоксигеназы является лейкотриен А4 (ЛТА4) — нестабильный эпоксид, который затем, соединяясь с водой, может превращаться неэнтиматическим путем в дигидроксикислый лейкотриен В4 (ЛТВ4) или, соединяясь с глутатионом, — в цистеиновый лейкотриен С4 (ЛТС4). Далее ЛТС4 с помощью гамма-глютамилтранферазы превращается в ЛТД4 и затем с помощью дипептидаз — в ЛТЕ4. ЛТЕ4 подвергается дальнешим метаболическим превращениям. У человека, однако, небольшая, но постоянная часть ЛТЕ4 экскретируется в неизменном виде с мочой. Это наблюдение оказалось весьма полезным для осуществления контроля за процессом выработки лейкотриенов при бронхиальной астме и других заболеваниях.
Соотношение между ЛТВ4 и цистеиновыми лейкотриенами колеблется от клетки к клетке. Синтезировать ЛТС4 способны эозинофилы, базофилы, тучные клетки и альвеолярные макрофаги: нейтрофилы синтезируют преимущественно ЛТВ4.
Рецепторы для ЛТВ4 и для цистеиновых лейкотриенов различны. Основное действие ЛТВ4, по-видимому, состоит в привлечении и активации клеток, участвующих в воспалении, в первую очередь нейтрофилов и эозинофилов. ЛТВ4, как считается, играет важную роль в развитии гнойного воспаления, возможно, он также имеет существенное значение в развитии воспалительных заболеваний, в том числе ревматоидного артрита.
Однако его роль в патогенезе бронхиальной астмы вызывает сомнение и остается неясной. Показано, что антагонисты рецепторов к ЛТВ4 не оказывают влияния на нарушения функции дыхания, возникающие во время ранней отсроченной реакции больных бронхиальной астмой на «провокацию» антигеном.
В патогенезе АА в настоящее время ключевая роль отодится нарушению метаболизма арахидоновой кислоты. В нем принимают участие три группы ферментов циклоксигеназы (ЦО), липоксигеназы (ЛО) и моноксигеназы. Продуктами 5-липоксигеназного пути расщепления арахидоновой кислоты являются лейкотриены ЛТС4, ЛТД4 и ЛТЕ4, которые считаются наиболее мощными бронхоконстрикторами (в совокупности они составляют медленно реагирующую субстанцию анафилаксии). ЛТС4, ЛТД4 и ЛТЕ4 играют ключевую роль в воспалительной реакции при бронхиальной астме. Они не только являются бронхоконстрикторами, но и увеличивают сосудистую проницаемость, усиливая отек слизистой бронхов, вызывают повышенную секрецию слизи бронхиальными железами с нарушением клиренса бронхиального содержимого. Конкретный биохимический дефект у больных АА до настоящего времени не обнаружен, однако известно, что при приеме аспирина или других НПВП, являющихся ингибиторами ЦО, происходит «переключение» метаболизма арахидоновой кислоты преимущественно на липоксигеназный путь. Установлено также, что интенсивность приступа удушья, вызванного приемом НПВП, в значительной степени обусловлена выраженностью циклоксигеназного действия данного препарата.
Подчеркивая роль цистенил-лейкотриенов в патогенезе АА, следует отметить повышенное содержание ЛТЕ4 (приблизительно в 3-6 раз) в моче и ЛТС4 в назальном секрете в сравнении с другими вариантами бронхиальной астмы. Провокация аспирином резко повышает количество ЛТЕ4 и ЛТС4 в моче, назальном секрете и в бронхиальном лаваже.
Представляет также большой интерес тромбоцитарная теория развития АА. Было обнаружено, что тромбоциты больных АА в отличие от тромбоцитов здоровых активируются in vitro под действием НПВП, что проявляется увеличением хемилюминесценции и дегрануляции клеток с выбросом цитотоксических и провоспалительных медиаторов. Другие же клетки периферической крови не активировались под действием НПВП in vitro. Как известно, блокада ЦО, вызванная НПВП, приводит к угнетению продукции простагландина (ПГ) Н2. Авторы тромбоцитарной теории предполагают, что снижение уровня данного ПГ играет важную роль в активации тромбоцитов у больных АА.
В подавляющем большинстве работ не было выявлено участие реагинового механизма в развитии аспиринового удушья. Имеются лишь единичные сообщения об обнаружении специфических lgE-антител к дериватам аспирина.
Важное значение в постановке диагноза АА имеют данные анамнеза о реакции больного на прием обезболивающих или жаропонижающих препаратов. У части пациентов могут быть четкие указания на развитие приступа удушья после применения НПВП. Отсутствие у ряда больных АА указаний на непереносимость НПВП, как правило, обусловлено слуедующими причинами: относительно низкой степенью гиперчувствительности к препаратам с антициклоксигеназным действием, одновременным приемом медикаментов, нейтрализующих бронхоконстрикторное действие НСПВП, например антигистаминных, симпатомиметических средств, препаратов теофиллина, замедленной реакцией больного на НПВП, редким приемом НПВП.
Однако определенная часть больных АА не принимает НПВП, и приступы удушья у них могут быть связаны с употреблением в пищу природных салицилатов, а также консервированных с использованием ацетилсалициловой кислоты продуктов. Следует отметить, что значительная часть больных не осведомлена о том, что различные НПВП входят в состав таких часто используемых комбинированных препаратов, как цитрамон, пенталгин, седалгин, баралгин и др.
Важно задать больному бронхиальной астмой вопрос об эффективности применения теофедрина для купирования приступа удушья. Больные АА обычно указывают на неэффективность теофедрина, либо отмечаеют его двухстадийное действие: вначале наступает некоторое уменьшение бронхоспазма, а затем бронхоспазм вновь нарастает из-за присутствия в теофедрине амидопирина и фенацетина.
Интенсивность реакции на НПВП зависит от степени чувствительности больного к препарату, она также тесно коррелирует с антициклоксигеназной активностью данного препарата. По данным ряда авторов, наибольшую ингибиторную активность в отношении ЦО среди НПВП проявляет индометацин. Чем сильнее антициклоксигеназное действие НПВП, тем интенсивнее симптомы непереносимости данной группы препаратов. Интенсивность реакции также коррелирует с дозой принятого медикамента. Важную роль играет и способ применения НПВП. При ингаляционном, внутривенном или внутримышечном введении интенсивность реакции обычно максимальная.
Таким образом, в постановке диагноза АА большая роль отводится сбору анамнеза и анализу клинических проявлений болезни.
Для подтверждения диагноза АА в настоящее время могут применяться провокационные тесты in vivo или же in vitro.
При выполнении провокационного теста in vivo используют или прием аспирина внутрь, или ингалируют в нарастающих концентрациях водорастворимый аспирин — лизин-аспирин с последующим мониторированием показателей бронхиальной проходимости. В связи с возможностью развития приступа удушья данное исследование может проводиться только специалистом. Необходимы оснащение и наличие обученного персонала, готового оказать экстренную помощь при развитии бронхоспазма. Показанием для провокационного теста с аспирином является необходимость уточнения клинико-патогенетического варианта астмы. К провокационному тесту допускаются больные, у которых объем форсированного выдоха за 1 с (ОФВ1 ) составляет не менее 65-70 % от должных величин. Помимо низких показателей функции внешнего дыхания противопоказаниями к провокационным тестам являются также необходимость частого приема симпатомиметиков, деменция, беременность и выраженная кровоточивость. Антигистаминные препараты снижают чувствительность больного к аспирину, поэтому их отменяют не менее чем за 48 ч до начала теста. Симпатомиметики и препараты теофиллина отменяют в зависимости от их фармакокинетических свойств, например, сальметерол следует отменить не менее чем за 24 ч до начала теста.
В настоящее время разрабатывается методика лабораторной диагностики АА, основанная на определении ЛТЕ4 в моче и ЛТС4 в назальном лаваже.
Следует отметить, что при проведении провокационных тестов с лизин-аспирином у больных АА резко повышается содержание ЛТЕ4 в моче и ЛТС4 в назальном лаваже.
По-видимому, в ближайшее время будут рекомендованы определенные стандарты в диагностике данного варианта бронхиальной астмы.
В настоящее время в лечении бронхиальной астмы, в том числе и аспириновой, основная роль отводится длительному приему противоастматических противовоспалительных лекарств. Для подбора адекватной противовоспалительной терапии важно определить тяжесть течения бронхиальной астмы. Ни один тест не позволяет точно классифицировать степень тяжести бронхиальной астмы, однако комбинированная оценка симптомов и показателей функции внешнего дыхания дает представление о тяжести заболевания. Было показано, что оценка течения бронхиальной астмы, основанная на клинических проявлениях болезни, связана с показателями степени воспаления дыхательных путей.
В зависимости от уровня обструкции и степени ее обратимости астму по степени тяжести подразделяют на интермиттирующую, легкую персистирующую (хронического течения), средней тяжести (умеренную) и тяжелую. При лечении астмы в настоящее время применяют «ступенчатый» подход, при котором интенсивность терапии повышается по мере увеличения степени тяжести астмы. Наиболее часто используемыми препаратами вне обострения бронхиальной астмы являются ингаляционные кортикостероиды, доза которых зависит от степени тяжести астмы, недокромил-натрий и кромогликат натрия, теофиллины длительного действия и пролонгированные симпатомиметики.
Обычно больным АА необходимы высокие поддерживающие дозы ингаляционных кортикостероидов: назальные симптомы также требуют длительного лечения топическими стероидами. В данной группе больных часто приходится прибегать к назначению системных стероидов, поэтому разрабатываются различные патогенетические подходы к терапии АА.
Одним из патогенетических методов лечения АА является проведение десенситизации аспирином. Метод основан на феномене развития толерантности больного АА к повторному воздействию НПВП в период 24-72 ч после удушья, вызванного приемом НПВП. Stevenson показал, что десенситизация аспирином позволяет контролировать симптомы риносинусита и бронхиальной астмы. Десенситизацию аспирином проводят также больным при необходимости назначать НПВП по поводу других заболеваний (ИБС, ревматические болезни и др.). Десенситизация проводится по различным схемам, которые подбираются индивидуально, в стационаре и только врачом, владеющим данной методикой. Десенситизацию начинают с дозы 5-10 мг и доводят ее до650 мг и выше, поддерживающие дозы составляют 325-650 мг/сут.
Противопс сазанием к проведению десенситизаци i аспирином являются обострение бронх 1альной астмы, кровоточивость, язвенная болезнь желудка и двенадцатиперстной кишки, тяжелые заболевания печени и почек, беременность.
Исследования последних лет показали, что мехнизм десенситизации связан с нечувствительностью рецепторов воздухоносных путей к биологическим эффек- там лейкотриенов. Поэтому в настоящее время в терапии больных АА большое значение придается антагонистам лейкотриеновых рецепторов. Доказана клиническая эффективность препаратов сингуляр монтелукаст и зафирлукаст в терапии больных АА.
В проведенных исследованиях добавление антагонистов лейкотриенов к терапии бронхиальной астмы приводит к выраженному в сравнении с плацебо возрастанию ОФВ1 улучшению показателей пиковой скорости выдоха в утренние и вечерние часы, уменьшению ночных приступов удушья. Показан также хороший эффект антагонистов лейкотриенов при использовании в комбинации со стероидами и /или пероральными стероидами.
Таким образом, в настоящее время мы можем сказать, что появился класс препаратов, которые влияют на патогенетическое звено АА и дают выраженный клинический эффект.
1. Бронхиальная астма. Глобальная стратегия. Приложение к журналу «Пульмонология». — М., 1996:196.
2. Чучалин А.Г. Бронхиальная астма. М., 1997.
3. Bousquet J, et al. Eosinophilic inflammation in asthma. NEnglJMed 1990; 32’3:1033- 89.
4. British Thoracic Sosiety, et al. Guidelines on the management of asthma. Thorax 1993;48 (2 suppl):SI-S24.
5. Burney PGJ. Current questions in the epidemiology of asthma, in Holgate ST, et al (eds), Asthma: Physiology. Immunology, and Treatment. London Academic press, 1993; pp 3-25.
6. Holgate S., Dahlen S-E. SRS-A to Leukotrienes, 1997.
7. Stevenson DD. Desensitization of aspirin — sensitive astmatics: a theraputic alternative? J Asthma 1983;20 (Suppl l):31-8.
источник
Аспириновая бронхиальная астма – это заболевание, имеющее четко очерченную клиническую симптоматику, отличную от клинической картины всех других клинико-патогенетических вариантов бронхиальной астмы без непереносимости ацетилсалициловой кислоты (НБА).
Основным признаком заболевания является наличие непереносимости аспирина и других нестероидных противовоспалительных средств (НПВС), что проявляется приступами удушья, часто сочетается с рецидивирующей полипозной риносинусопатией и тогда обозначается как «астматическая триада».
Особенности клинического течения аспириновой бронхиальной астмы.
Аспириновая бронхиальная астма (АсБА) составляет 10-30% среди различных клинико-патогенетических вариантов бронхиальной астмы, причем женщины болеют в 2 раза чаще мужчин.
Клинические проявления АсБА начинаются задолго до появления первых признаков дискомфорта со стороны дыхательной системы. Наиболее ранним проявлением этого заболевания является нарушение функции эндокринной и иммунной системы. При этом у женщин наблюдаются различные нарушения менструального цикла, невынашивание беременности, раннее наступление менопаузы. У каждого шестого больного выявляется различная патология щитовидной железы. Больные отмечают снижение резистентности к вирусным инфекциям. Кроме того, имеются изменения со стороны центральной нервной системы: повышенная эмоциональная реакция на повторяющиеся стрессы в повседневной жизни, ощущения постоянной тревоги и внутренней напряженности, склонность к меланхолической депрессии. Со стороны сердечно-сосудистой системы отмечается вегетативно-сосудистая дистония по гипотоническому типу, часто наблюдается раннее начало варикозной болезни нижних конечностей. На этом фоне у большинства больных появляется патология верхних дыхательных путей: вазомоторный или неатопический ринит, а также полипозная риносинусопатия.
Первые клинические проявления заболевания со стороны дыхательной системы наблюдается, как правило, в период гормональных перестроек. приступы удушья появляются в третьем-четвертом десятилетиях жизни у женщин или в четвертом-пятом десятилетии у мужчин, а у детей как правило, в препубертатном периодах жизни. Незадолго до появления первых приступов удушья больные отмечают очень короткие предастмы, когда в клинической картине доминируют проявления хронического астматического бронхита и признаки измененной реактивности бронхов. Больные отмечают связь возникновения приступов кашля с вдыханием резких запахов, с физической нагрузкой, при снижении температуры вдыхаемого воздуха, ночью и утром при вставании с постели. Провоцирующим фактором первого приступа удушья лишь у 28% больных АсБА является прием ацетилсалициловой кислоты или других нестероидных противовоспалительных препаратов.
Приступ удушья, связанный с непереносимостью аспирина, имеет уникальную клиническую картину. В передах часа после его приема у больных развивается выраженное затруднение дыхания, сопровождаемое ринореей, слезотечением, покраснением верхней половины туловища, чаще всего головы и шеи. У некоторых больных приступу удушья могут сопутствовать гипотония, гиперсаливация, тошнота, рвота, а также боли в эпигастральной области. Все эти реакции очень опасны, так как развиваются почти молниеносно и могут привести к потере сознания, шоку и даже к летальному исходу.
Сразу после появления первых приступов удушья заболевание приобретает тяжелое прогрессирующее течение, несмотря на отсутствие приемов АСК и НПВС, и в течение 5 лет возникает зависимость от глюкокортикоидных гормонов. При этом клинические проявления астматического синдрома у больных АсБА также имеет отличительные особенности: быстро исчезает сезонность и четкая очерченность приступов удушья, возникает чувство постоянной заложенности в груди и снижается эффективность обычных бронхолитических средств. Тяжелое обострение заболевания наблюдается более 4 раз в год, при чем большинство больных аспириновой астмой реагируют на широкий спектр внешних воздействий:
Контакт с различными аллергенами
Вдыхание холодного воздуха или резких запахов
Изменение метеорологических условий
Прием лекарственных препаратов, не относящихся к группе НПВС
Употребление пищевых продуктов, содержащих естественные салицилаты
Различные психоэмоциональные переживания.
У 22% женщин отмечается связь обострений бронхиальной астмы со второй фазой менструального цикла.
На фоне ОРВИ, острых бактериальных инфекций или во время обострения хронических воспалительных заболеваний (хронический бронхит, хронический гайморит, хронический холецистит и пр.)
Таким образом, клинические проявления астматического синдрома у больных АсБА связаны с нарушением сосудистого тонуса и повышением проницаемости сосудов как в верхних (вазомоторный или неатопический ринит), так и в нижних дыхательных путях (выраженные обструктивные нарушения вентиляционной способности легких с частичной обратимостью обструкции на уровне дистальных отделов бронхиального дерева).
У больных аспириноврй астмой, как правило, выявляется и патология желудочно-кишечного тракта (хроническая гастрит, язвенная болезнь, болезнь Жильбера, хронический холецистит, желчнокаменная болезнь), нарушения углеводного обмена со склонностью к гипергликемии, изменения в системе кроветворения (снижение лимфопоэза, эритропоэза, гранулоцитопоэза с усилением эозинофилопоэза и мегакариоцитопоэза).
Таблица 1.особенности состояния различных функциональных
систем организма больных аспириновой и неаспириновой бронхиальной астмы.
и внутренняя напряжен-ность. Склонность
Патогенез аспириновой бронхиальной астмы
Проведенные на кафедре госпитальной терапии им. акад. М.В. Черноруцкого СПб ГМУ им. акад. И.П. Павлова фундаментальные иследования продукции мелатонина, оксида азота, функционального состояния тромбоцитарно-сосудистого звена гемостаза и функции внешнего дыхания в сопоставлении с результатами клинико-лабораторного обследования больных аспириновой бронхиальной астмой позволили обосновать гипотезу о ведущей роли гормона мелатонина (МТ) в патогенезе этого заболевания.
МТ образуется в шишковидной железе – эпифизе, расположенной между большим мозгом и мозжечком в борозде между передними буграми четверохолмия. Главными секреторными элементами железы являются пинеалоциты.
Источником синтеза МТ является триптофан, который поступает в пинеалоциты из сосудистого русла и превращается сначала в 5-гидрокситрептофан, а затем в серотонин (5-НТ), из которого образуется мелатонин.
Раннее считалось, что эпифиз является основным местом синтеза МТ в организме. Однако комплексные исследования (биохимические, иммуногистохимические, радиоиммунологические) позволили обнаружить многочисленные внеэпифизарные источники этого гормона в других органах, тканях и клетках, обладающих необходимым для этого ферментативным аппаратом. Так, показано, что мелатонин образуется в сетчатке, хрусталике, яичниках, костном мозге, энтерохромаффинных клетках кишечника, в эндотелии сосудов, а также в лимфоцитах, макрофагах и тромбоцитах. Установлено, что клетки, продуцирующие МТ, входят в состав диффузной нейроэндокринной системы организма, так называемой АПУД-системы, которая является важнейшей системой реагирования, контроля и защиты организма и играет важную роль в обеспечении гемостаза.
Мелатонин не только является центральным эндогенным синхронизатором биологических ритмов, но и участвует в регуляции различных звеньев системы гемостаза, а также окислительно-восстановительных процессов в организме, регулирует активность NO-синтазы и нейтрализует свободные радикалы, образующиеся в процессе синтеза и метаболизма оксида азота.
Тромбоциты у больных АсБА постоянно находятся в активированном состоянии. В этих условиях может увеличиваться концентрация кальция в цитоплазме и усиливаться метаболизм фосфолипидов мембраны, что приводит к агрегации кровяных пластинок, сопровождающейся реакцией освобождения и образования широкого спектра биологически активных веществ. Это влечет за собой целый каскад реакций и, в конечном итоге, развитие бронхоспазма, вазоспазма, отека слизистой дистальных бронхов, интерстициального отека легких и формирование бронхообтурационного синдрома и нарушений вентиляционно-перфузионных отношений.
Снижение продукции мелатонина у больных АсБА определяет характерное для них быстрое развитие зависимости от глюкокортикоидных гормонов. Нарушение рецепции к мелатонину не только в мелатонин-продуцирующих клетках, но и в апудоцитах эндокринных желез, в частности, гипоталамо-гипофизарно-надпочечниковой системы (ГГНС) и в пинеалоцитах самого эпифиза у больных АСБА ведет к нарушению эпифизарного контроля регуляции ГГНС.
Таким образом, снижение у больных АсБА базистной продукции мелатонина и нарушение рецепции клеток к МТ приводит к развитию патологических изменений на органном и системном уровнях. При этом у больных АсБА нарушение деятельности всех функциональных систем организма наступает задолго до развития астматического синдрома, что в значительной мере определяет особую его тяжесть , а также быстрое прогрессирование заболевания и формирование зависимости от глюкокортикоидных гормонов. Кроме того, следствием низкой продукции МТ у больных АсБА является усиление процессов пероксидации липидов и избыточное образование реактивных радикалов кислорода, отмена ингибирующего влияния МТ на активность 5-липоксигеназы, NO-синтазы и агрегацию тромбоцитов, в результате чего происходит активация этих клеток, увеличивается продукция лейкотриенов и оксида азота. следствием этих процессов является нарушение микроциркуляции в легких и развитие бронхообтурационного синдрома даже у тех больных, которые не принимают аспирин и другие НПВС. Снижение базисной продукции МТ ведет также к недостаточному образованию его метаболита – эндогенной ацетилсалициловой кислоты, что, в свою очередь, лежит в основе повышенной к ней чувствительности мелатонин-продуцирующих клеток, и, в частности, тромбоцитов. В результате минимальные дозы аспирина подавляют активность СОХ-1, что ведет к шунтированию уже нарушенного метаболизма арахидоновой кислоты в сторону большего образования лейкотриенов и развитию тяжелых астматических состояний у больных АсБА.
Диагностика аспириновой астмы
Диагностика аспириновой астмы представляет собой:
проведение лабораторных (анализ крови и мокроты) исследований;
инструментальных исследований (исследование функции внешнего дыхания, рентгенография придаточных пазух носа).
Анализ полученных данных необходимо проводить с учетом дифференциально-диагностических критериев аспириновой и неаспириновой астмы.
Для исключения гиперчувствительности к производным пиразолона (анальгин, бутадион, бенетазон и др) используют определение IgE с помощью радиоаллергосорбентного и иммуноферментного анализов.
Для подтверждения диагноза аспириновой астмы возможно проведение провокационного перорального теста с ацетилсалициловой кислотой (ППТА). Его начинают после выявления отрицательной реакции на аспирин-плацебо, в качестве которого применяют 0,64г белой глины. Первая доза АСК составляет 10 мг, в последующие дни она увеличивается до 20,40,80,160,320,640 мг. ежедневно проводится провокационная проба только с одной дозой АСК, учитывая возможность эффекта кумуляции и отсроченных реакций после приема данного препарата. Через 30,60 и 120 мин после приема соответствующей дозы АСК проводится контроль субъективных и физикальных данных и показателей ФВД. ППТА считают положительным, а дозу АСК пороговой при снижении Sgaw на 25% или ОФВ1 на 15% и более от исходного уровня. Субъективные критерии положительной реакции: ощущение удушья, затруднение дыхания, ринорея и слезотечение.
В последние годы многие исследователи отдают предпочтение ингаляционным и назальным провокационным тестам с раствором аспирина. При бронхиальном ингаляционном тесте доза аспирина увеличивается каждые 30 мин, а вся проба длится в течение нескольких часов. Для назальных провокаций препарат вводится в нижнюю носовую раковину, водится в течение 30 мин под контролем передней риноманометрии.
Лечение аспириновой астмы
Лечение должно быть комплексным и соответствовать тем целям, которые изложены в Международном консенсусе по диагностике и лечению бронхиальной астмы (GSAM, 1993):
Добиться установления контроля над симптомами бронхиальной астмы
Предупреждать обострения бронхиальной астмы.
Поддерживать функциональное состояние органов дыхания на максимально близком к нормальным величинам уровне
Поддерживать нормальный уровень активности больных, включая возможность выполнения физических нагрузок.
Устранить отрицательное влияние лекарства на больных
Предотвратить развитие необратимой обструкции воздухоносных путей
Предотвратить смерть от бронхиальной астмы
Для достижения этих целей и успешного лечения больных АсБА необходимо учитывать следующие принципы терапии этого заболевания:
Элиминационная терапия с исключением лекарственных препаратов из группы НПВС и продуктов, содержащих АСК.
Заместительная или стимулирующая терапия, направленная на повышение уровня мелатонина в организме больного
Улучшение микроциркуляции в легких и других органах и тканях.
Противовоспалительная терапия, направленная на стабилизацию клеточных мембран и снижение продукции лейкотриенов.
Иммуномодулирующая терапия, направленная на повышение активности Т1-хелперного звена иммунитета.
Лечение больных АсБА в фазе затихающего обострения или ремиссии заболевания
Больные АА должны исключить приём медикаментозных препаратов, относящихся к группе НПВС и обладающих перекрёстной реакцией с ацетилсалициловой кислотой: 1) ингибиторы СОХ1 и СОХ2, вызывающие неблагоприятные реакции даже при использовании в малых дозах (пироксикам, индометацин, сулиндак, толметин, ибупрофен, напроксен содиум, фенопрофен, меклофенамат, мефенамовая кислота, флубипрофен, дифлунизал, кетопрофен, диклофенак, кеторалак, этодолак, набуметон, оксапрозин); 2) слабые ингибиторы СОХ1 и СОХ2 (ацетаминофен, салсалат);3) относительные ингибиторы СОХ2 и слабые ингибиторы СОХ1, которые только при приёме в высоких дозах могут вызывать неблагоприятные реакции у больных АА (нимесулид, мелоксикам).
В настоящее время разработаны селективные ингибиторы циклооксигеназы (СОХ2), которые теоретически не вызывают перекрестных реакций с ацетилсалициловой кислотой (целекоксиб, рофекоксиб).
Безопасными для больных аспириновой астмой являются содиум салицилат, салициламид, холин магнезиум трисалицилат, декстропропоксифен, бензидамин, хлороквин, азапропазон. Эти препараты не ингибируют активность циклооксигеназ или являются слабыми ингибиторами СОХ2.
Кроме того, больные должны помнить о необходимости ограничить приём пищевых продуктов, содержащих салицилаты (яблок, абрикосов, грейпфрутов, винограда, лимонов, персиков, слив, чернослива, чёрной смородины, вишни, ежевики, малины, земляники, клубники, клюквы, крыжовника, огурцов, томатов, картофеля, редиса, репы, миндальных орехов, изюма, зимней зелени, напитков из корнеплодов, мятных конфет и кондитерских изделий с добавками зелени). Что же касается желтого красителя тартразина, используемого для окрашивания пищевых продуктов и кондитерских изделий, то, по последним данным, он не ингибирует циклооксигеназу. Редкие реакции непереносимости тартразина больными АА опосредованы иммуноглобулинами Е и могут быть расценены как реакции гиперчувствительности немедленного типа.
До недавнего времени одним из методов патогенетической терапии аспириновой астмы являлась десенситизация (ДС) ацетилсалициловой ксилотой с целью снижения чувствительности к этому препарату.
Существует несколько схем десенситизации:
Согласно первой схеме больной принимает аспирин в возрастающих дозах 30, 60, 100, 320 и 650 мг в один день с 2 часовыми интервалами.
Двухдневная схема предусматривает 3 часовые интервалы между приёмами АСК. В первый день больной принимает 30,60, 100 мг аспирина, на второй 150, 320,650 мг, в последующие дни сохраняют приём поддерживающей дозы аспирина – 320 мг ежедневно.
Проведение десенситизации по этим двум схемам показано только больным с низкой чувствительностью к АСК (пороговая доза≥160 мг) или с изолированной вазомоторной риносинусопатией. Для больных с высокой чувствительностью к АСК (пороговая доза ≤40мг) нами разработана схема постепенной десенситизации малыми дозами аспирина в комбинации с ультрафиолетовым облучением аутокрови. Лечение всегда начинают с приёма дозы аспирина, которая в 2 раза меньше пороговой. Затем в течение суток с интервалами в 3 часа дозу несколько увеличивают под контролем показателей функции внешнего дыхания каждый час после приёма АСК. В последующие дни дозу аспирина постепенно увеличивают в зависимости от индивидуальной переносимости и показателей функции внешнего дыхания. Затем наступает период, когда больному назначают пороговую дозу АСК 3 раза в день. Начало эффекта десенситизации характеризуется снижением исходных значений бронхиального сопротивления и повышением удельной проводимости бронхов при отсутствии ухудшения этих показателей в ответ на каждый приём пороговой дозы АСК в течение дня. В этот период больной может быть выписан из стационара с последующим еженедельным наблюдением в амбулаторных условиях.
Стойкое сохранение указанных выше критериев в течение месяца следует рассматривать как окончательный эффект десенситизации. После этого больной переходит на поддерживающий приём одной пороговой дозы АСК в день. При длительном приёме аспирина (более 1/2 года) может наступить период, когда происходит привыкание к обычной дозе АСК. В этом случае наступает обострение заболевания. Поэтому в период хорошего самочувствия больного и при наличии вышеперечисленных критериев эффективности лечения мы рекомендуем увеличивать дозу аспирина на 510 мг под контролем показателей функции внешнего дыхания.
Больным с высокой чувствительностью к АСК рекомендуется перед десенситизацией проводить курс ультрафиолетового облучения аутокрови (АУФОК), после которого происходит повышение порога чувствительности к аспирину в 2-3 раза. Курс АУФОК состоит из 5 сеансов, при этом интервал между первыми тремя сеансами составляет 3-5 дней, между остальными – 7-8 дней. Лечение АУФОК проводят больным аспириновой астмой в фазу ремиссии или затихающего обострения заболевания.
Противопоказаниями к проведению десенситизации аспирином являются:
1)высокая чувствительность бронхиального дерева к НПВС (пороговая доза менее 20 мг);
2)обострение бронхиальной астмы;
3)тяжелое течение бронхиальной астмы с выраженными побочными явлениями от длительной гормональной терапии;
4) развитие анафилактоидных реакций на приём аспирина;
6)склонность к кровоточивости;
7)язвенная болезнь желудка и 12перстной кишки.
Таким образом, применение десенситизации аспирином ограничивается большим объёмом противопоказаний, необходимостью длительного индивидуального подбора дозы в условиях стационара с последующей периодической её коррекцией, а также возможностью развития различных осложнений со стороны желудочно-кишечного тракта и выраженного обострения бронхиальной астмы в процессе лечения.
В последние годы для лечения больных аспириновой астмой используются блокаторы 5-липоксигеназы (зилеутон) и антагонисты лейкотриеновых рецепторов (монтелукаст, зафирлукаст). Показано, что лечение больных АА препаратами, изменяющими продукцию лейкотриенов, у большинства, но не у всех больных, предотвращает развитие бронхиальной обструкции и риноконъюнктивита при приёме АСК.
Постоянное использование этих препаратов способствует уменьшению ночных симптомов астмы и улучшению качества жизни больных АА. Однако в случае их отмены приступы удушья рецидивируют, при этом увеличивается в крови содержание лейкотриенов, уровень которых превосходит исходный до лечения.
Базисная терапия аспириновой астмы осуществляется препаратами, обеспечивающими коррекцию содержания мелатонина в организме больного.
Известно, что этим свойством обладают препараты эпифиза – эпиталамин и эпифамин – пептидные биорегуляторы направленного (органотропного) действия, получившие широкое применение в эндокринологии, онкологии и геронтологии. Показано, что они не только увеличивают синтез и секрецию мелатонина в организме, но и обладают мощным антиоксидантным действием, способствуют восстановлению нарушенных циркадных ритмов организма, нормализуют функцию передней доли гипофиза и содержание гонадотропных гормонов, устраняют дисбаланс в системе иммунитета, усиливают экспрессию рецепторов на Т- и В-лимфоцитах, нормализуют жировой и углеводный обмен, а также моторную функцию желчевыводящих путей, улучшают реологические свойства крови и микроциркуляцию и устраняют нарушения водно-электролитного баланса.
Известно также, что пептидные биорегуляторы – цитомедины обладают способностью регулировать процессы синтеза белка и участвуют в поддержании структурного и функционального гомеостаза клеточных популяций. При этом цитомедины взаимодействуют с мембранными рецепторами, что ведёт к их транслокации в клетку и высвобождению интерцитомединов. Последние, связываясь с рецепторными образованиями клеточных ультраструктур, создают оптимальные условия для жизнедеятельности клетки.
Можно полагать, что клиническая эффективность пептидных биорегуляторов эпиталамина и эпифамина у больных АА обусловлена не только повышением продукции мелатонина и участием его в регуляции межклеточных и межсистемных взаимоотношений, но и влиянием самих эпифизарных пептидов непосредственно на клеточные мембраны, что ведёт к нормализации функции мембрано-рецепторного аппарата тромбоцитов и других мелатонин-продуцирующих клеток ДНИЭС у больных АА.
Эпиталамин представляет собой комплекс водорастворимых пептидов с молекулярной массой до 10 кДа, выделенных из эпифиза крупного рогатого скота.
Одним из ключевых механизмов действия эпиталамина является его стимулирующее влияние на синтез и секрецию эпифизом мелатонина, который, в свою очередь, регулирует функцию нейроэндокринной и иммунной систем. Установлено, что под влиянием эпиталамина усиливается экспрессия рецепторов на Т- и В-лимфоцитах, а также восстанавливается нормальное соотношение субпопуляций лимфоцитов у больных со вторичными иммунодефицитами,
что позволило использовать его для профилактики и лечения злокачественных новообразований. Препарат замедляет возрастные изменения в иммунной и репродуктивной системах, нормализует циркадные ритмы, процессы обучения и памяти. Эпиталамин обладает антиоксидантным действием, оказывает положительное влияние на показатели водно-электролитного баланса, периферическую гемодинамику и реологические свойства крови, способствуя снижению тромбообразования.
Эпифамин получен из эпифиза крупного рогатого скота и свиней, представляет собой комплекс белков и нуклеопротеидов и по механизму действия аналогичен эпиталамину. Эпифамин выпускается в виде таблеток и капсул по 10 мг, покрытых кишечнорастворимой оболочкой.
Лечение больных аспириновой астмой пептидными биорегуляторами рекомендуется начинать в фазу затихающего обострения заболевания на фоне приема базисных противоастматических препаратов, дозы которых до окончания терапии не следует изменять.
Эпиталамин вводят внутримышечно по 10 мг ежедневно в утренние часы в течение 10 дней (100 мг на курс лечения). Содержимое флакона растворяют непосредственно перед применением в 1-2 мл изотонического раствора хлорида натрия, воды для инъекций или в 0,5% растворе новокаина.
Эпифамин принимают за 10-15 минут до завтрака и до обеда (2 раза
в сутки только в первую половину дня!) по 2 таблетки (каждая по 10 мг) в течение 10 дней (400 мг на курс лечения).
После курса терапии пептидами эпифиза в зависимости от изменения состояния больные могут постепенно снижать дозы противоастматических препаратов. Появление первых признаков дыхательного дискомфорта, требующего увеличения дозы базисных противоастматических средств, является показанием к повторному назначению курса эпиталамина или эпифамина, однако не ранее, чем через 4 месяца после окончания лечения эпиталамином и через 5-6 месяцев лечения эпифамином.
Противопоказанием к проведению лечения препаратами эпифиза могут являться аутоиммунные заболевания и диэнцефальный синдром.
Самостоятельной проблемой у больных аспириновой астмой является лечение полипозных риносинуситов. До настоящего времени практическим врачам не рекомендовалось прибегать к операции полипэктомии у больных АА. Однако применение пептидов эпифиза за месяц до планируемого оперативного вмешательства обеспечивает его успешное проведение и профилактику обострения бронхиальной астмы.
Таким образом, патогенетический подход к терапии заболевания открывает новые возможности для достижения существенного улучшения деятельности всех функциональных систем организма и тем самым обеспечивает успешную медицинскую и социальную реабилитацию больных АА.
источник