На Западе заболеваемость астмой, удваиваясь каждые двадцать лет, превращается во все более серьезную проблему.
Например, в США на астму приходится треть всех детских неотложных случаев. Без всякого намерения принизить значение этой медицинской проблемы для России, можно, однако, обратить внимание на некоторые нетривиальные наблюдения из области сравнительной эпидемиологии.
Заболеваемость астмой в экологически чистом Мюнхене выше, чем в гораздо более загрязненном в период принадлежности к ГДР Лейпциге.
В истово блюдущей свою чистоту Швеции от астмы страдают чаще, чем в живущей несколько другими проблемами Польше. Таким образом, кроме генетической предрасположенности (ведь и Мюнхен, и Лейпциг населены по большей части немцами — не могла же идеология въесться в генотип!) и загрязненности среды, на заболеваемость астмой может серьезно влиять еще какое-то обстоятельство, связанное с чистотой, но уже с обратным знаком.
Одно из предположений относительно природы этого обстоятельства основано на известных фактах о влиянии микробов на баланс иммунных реакций. Микробные инфекции приводят к активации лимфоцитов-хелперов типа Th1, которые, секретируя интерлейкин-2 и интерфероны, стимулируют Т-иммунитет и ингибируют TH2-хелперы. Функции последних состоят в секреции интерлейкинов-4, 5, 6, 10 и 13, которые стимулируют продукцию иммуноглобулинов Е В-лимфоцитами.
БА характеризуется рецидивирующим генерализованным воспалением бронхов, возникающим при их повреждении патогенными медиаторами тучных клеток, эозинофилов и Т-лимфоцитов, гиперреактивных к факторам, нейтральным для здоровых лиц, и клинически проявляющееся пароксизмами «свистящего» дыхания, кашля и одышки (вплоть до астматического статуса).
Эти эпизоды обычно связаны с распространенной, но изменяющейся по своей выраженности бронхиальной обструкцией, которая часто яштяется обратимой либо спонтанно, либо под влиянием лечения.
Ключевые положения определения бронхиальной астмы
I. Бронхиальная астма — хроническое персистирующее воспалительное заболевание дыхательных путей вне зависимости от тяжести течения.
2. Воспалительный процесс приводит к гиперреактивности бронхов, обструкции и появлению респираторных симптомов.
3. Обструкция дыхательных путей бывает четырех форм:
— острая бронхоконстрикция вследствие спазма гладких мышц;
— подострая — вследствие отека слизистой дыхательных путей;
— обтурационная — вследствие образования слизистых пробок;
— склеротическая — склероз стенки бронхов при длительном и тяжелом течении заболевания.
4. Имеет место атопия — генетическая предрасположенность к продукции иммуноглобулинов класса E(IgE).
Эпидемиология. БА является распространенным заболеванием. От 4 до 10% населения планеты страдают БА различной степени выраженности.
У детей этот процент повышается до 10—15%. В отдельных регионах, где сконцентрированы лица с отягощенной по БА наследственностью, болеют до 35% людей. Рост заболеваемости и более тяжелое течение бронхиальной астмы за последние десятилетия обусловлены экологическими нарушениями.
В возрасте до 5 лет и старше 60 лет чаше заболевают мужчины, в промежутке — чаще женщины.
Очевидно, что такое распределение зависит от гормонального фона. На долю БА (включая хронический бронхит с астматическим компонентом, когда реально следует говорить о сочетании двух заболеваний — БА и ХБ) приходится почти половина всех случаев инвалидности от ХНЗЛ.
Летальность при БА невысокая, составляет около 50 случаев смерти на 100 000 больных в год, однако в последние годы она имеет тенденцию к росту. Чаше всего больные с астмой погибают во время астматического статуса.
Этиология. БА — генетически детерминированное заболевание. Важным представляется установленная генетическая гетерогенность наследования при БА Сама атопия была маркирована на хромосоме 11q, но передача атопии через ген, локализованный в позиции llq, возможна лишь только по материнской линии. В-субъединицы высокоаффинных рецепторов IgE являются генами-кандидатами на хромосоме llq. Экспрессия этих рецепторов установлена в тучных клетках, базофилах, что имеет важное значение в реализации механизмов IgE-зависимой дегрануляции тучных клеток. Была также выявлена область генома человека, включающая гены, которые играют важную роль в развитии воспаления при атопии в случае БА: интерлейкины — 3, 4, 5, 9 и 13, а также гранулоцит-макрофагстимулирующий фактор и фактор роста № 1 фибробластов. Установлены многочисленные виды мутаций гена b2-рецептора. Мутация в 1б-й позиции (Gly by Arg) ассоциирует с тяжелым течением бронхиальной астмы. При полиморфизме гена b2-рецептора чаще возникает бронхиальная астма с низким ответом на ингаляции cальбутамола.
Факторы риска БА. Факторами, вызывающими сенсибилизацию предрасположенных к астме лиц путем индукции избыточного синтеза IgE, являются домашняя пыль, эпидермальные, пыльцевые, пищевые, лекарственные и изредка — другие аллергены.
В домашней пыли содержатся сенсибилизирующие продукты жизнедеятельности человека и насекомых, заселяющих жилище хозяина, обычно — микроскопических клещей, из которых наиболее часто встречается Dermatofagoidus pteronissinus, реже — других насекомых, например, тараканов или клопов. Основной аллергенной активностью обладают испражнения насекомых.
Актуальны эпидермальные аллергены домашних и комнатных животных и птиц: перхоть и шерсть собак, кошек, лошадей, перо и пух кур, домашних певчих и других птиц. Пыльцевые аллергены относятся к сезонным, провоцируют обострение БА весной или летом. Сезонными являются и аллергены спор рааличных ВИдов грибов, в том числе плесень, вызывающие обострение заболевания в сырое время года — весной или осенью. Наиболее аллергенные пищевые продукты — мед (содержит пыльцу!), орехи, цитрусовые, бобовые (особенно какао).
Аллергические реакции могут возникать при употреблении крабов, рыбных продуктов, коровьего молока, куриных яиц, злаков. Ягоды, овощи и кондитерские изделия, содержащие природные салицилаты и сходные с ними вещества, могут вызывать обострение БА неиммунными механизмами.
К обострению БА может привести прием лекарственных средств: антибиотиков, витаминов, ферментных и белковых препаратов, а также ацетилсалициловой кислоты и анальгетиков. Среди больных так называемой аспириновой астмой самый высокий процент смертельных исходов, что связывают с неосторожным назначением врачами разных специальностей НПВП. Среди факторов риска следует иметь в виду инфекционные вирусные заболевания дыхательных путей, что ведет вследствие высокой поляризации ТЬ2-клеток к повышенной продукции интерлейкинов 4 и 5. Далее нужно назвать поллютанты с выраженным бронхоконстриктивным действием: диоксиды серы и азота, озон, черный дым.
В последние годы накопились данные об агрессивном воздействии табачного дыма на дыхательные пути человека. Отдельно необходимо упомянуть пусковые факторы (триггеры), которые вызывают обострение бронхиальной астмы путем стимуляции воспаления или провоцирования острого бронхоспазма или того и другого.
У каждого индивидуума в каждое конкретное время триггерами могут быть разные факторы. Они включают длительное воздействие причинных факторов (аллергены или профессиональные агенты), к которым Уже сенсибилизированы дыхательные пути пациента с бронхиальной астмой.
К триггерам относятся также воздействие физических нагрузок, холодного воздуха, раздражающих газов (иррирантов), аэрополлютантов, изменение погоды, чрезмерные эмоциональные нагрузки. Кроме того, обострение бронхиальной астмы могут вызвать болезни верхних дыхательных пугей (риниты, синуситы, полипоз носа), гастроэзофагеальный рефлюкс, menses и беременность.
Патогенез. В основе патогенеза бронхиальной астмы лежит хроническое воспаление. Для астмы характерна особая форма воспаления бронхов, приводящая к формированию их гиперреактивности (повышенной чувствительности к различным неспецифическим раздражителям по сравнению с нормой); ведущая роль в воспалении принадлежит эозинофилам, тучным клеткам и лимфоцитам.
Воспаленные гиперреактивные бронхи реагируют на воздействие триггеров спазмом гладких мышц дыхательных путей, гиперсекрецией слизи, отеком и воспалительной клеточной инфильтрацией слизистой оболочки дыхательных путей. Все вышеперечисленное приводит к развитию обструктивного синдрома, клинически проявляющегося в виде приступа одышки или удушья.
Ранняя астматическая реакция опосредуется гистамином, простагландинами, лейкотриенами и проявляется сокращением гладкой мускулатуры дыхательных путей, гиперсекрецией слизи, отеком слизистой оболочки.
Поздняя астматическая реакция развивается у каждого второго взрослого больного бронхиальной астмой.
Классификация.
МКБ-10: — J45.0
— Астма 45.0 Преимущественно аллергическая астма. Аллергический бронхит. Аллергический ринит с астмой. Атопическая астма. Экзогенная аллергическая астма. Сенная лихорадка с астмой.
45.1. Аллергическая астма. Идиосинкразическая астма. Эндогенная неаллергическая астма.
45.8. Смешанная астма.
45.9. Неуточненная астма. Астматический бронхит. Поздно возникшая астма.
46.0. Астматический статус. Острая тяжелая астма.
Клинико-патогенетические варианты бронхиальной астмы (по Г, Б. Федосееву, 2002)
1. Атонический.
2. Инфекционно-зависимый.
3. Аутоиммунный.
4. Дисгормональный (гормонозависимый).
5. Дизовариальный.
6. Выраженный адренергический дисбаланс.
7. Холинергический.
8. Нервно-психический.
9. Аспириновый.
10. Астма физического усилия.
В Глобальной стратегии лечения и профилактики бронхиальной астмы (GINA, 2005) предложена классификация бронхиальной астмы по тяжести течения болезни, основанная на анализе клинических симптомов до начала лечения, количества b2-агонистов, применяемых для лечения симптомов, показателей функции внешнего дыхания.
Ступень 1: интермиттирующая БА: симптомы реже 1 раза в нед; короткие обострения; ночные симптомы не чаше 2 раз в мес; ОФВ1 или ПСВ > 80% от должных значений; вариабельность показателей ПСВ или ОФВ1 80% от должных значений; вариабельность показателей ПСВ или ОФВ1 = 20-30%.
Ступень 3: персистирующая БА средней тяжести: ежедневные симптомы; обострения могут влиять на физическую активность и сон; ночные симптомы чаше 1 раза в нед; ежедневный прием ингаляционных b2-агонистов короткого действия; ОФВ1 или ПСВ от 60 до 80% от должных значений; вариабельность показателей ПСВ или ОФВ1 > 30%.
Ступень 4: тяжелая персистирующая БА: ежедневные симптомы; частые обострения; частые ночные симптомы; ограничение физической активности; ОФВ1 или ПСВ 30%.
Клиническая картина.
Легкое эпизодическое течение характеризуется перемежающимися кратковременными эпизодическими симптомами менее 1 раза в нед; ночные симптомы менее 1 раза в мес; отсутствие симптомов в период между обострениями; нормальные или близкие к нормальным величины пиковой объемной скорости выдоха (ПОС) и объема форсированного выдоха за 1-ю секунду (OФВ1) в период между обострениями; потребность в b2-агонистах (b2-адреномиметиках) короткого действия менее 3 раз в нед.
Легкое персистирующее течение: приступы 1—2 раза в нед; ночные симптомы 1—2 раза в мес; симптомы легкие, но персистирующие; ПОС и ОФВ1 более 80% от должных величин, суточный разброс показателей менее 20%.
Среднетяжелое течение: обострения более 1-2 раз в нед; обострения могут приводить к ограничению активности, нарушению сна; ночные симптомы более 2 раз в мес; ПОС и ОФВ1: 60-80% от должных величин, суточный разброс показателей — 20—30%.
Тяжелое течение: частые обострения; постоянное наличие симптомов; частые ночные симптомы; ограничение физической активности; ПОС и ОФВ1 менее 60% от должных величин, суточный разброс показателей более 30%.
В последние годы ввели специальный термин «тяжелая бронхиальная астма», при котором в англоязычной литературе подразумевают следующие состояния: acute severe asthma, status asthmatecs, brittle asthma, fatal asthma, chronic difficult asthma, sudden onset attacks, slow onset attacks.
Русские аналоги приведенных англоязычных терминов могли бы быть следующими: острая тяжелая астма, астматическое состояние, нестабильная астма, фатальная астма, тяжелая хроническая астма, внезапно возникшая тяжелая астматическая атака, медленно развивающаяся астматическая атака.
Следует раскрыть приведенные названия. Термин «-острая тяжелая астма» подразумевает острое начало болезни, которая протекает так тяжело, что угрожает жизни больного. Астматическое состояние характеризуется клинической картиной нарастающего обострения и резким снижением эффективности бронхорасширяюших препаратов. В клинической картине обострения БА появляется такой синдром, как «немое легкое»; в особо тяжелых случаях развивается гипоксическая кома.
Нестабильная БА — относительно новый термин для российской медицины. Этим термином описываются больные БА с якобы хорошо подобранным лечением, но с внезапно возникающими тяжелыми обострениями.
Ярким примером может служить аспириновая форма болезни, когда внезапное тяжелое обострение провоцируется приемом нестероидных противовоспалительных препаратов.
Термин «хроническая тяжело протекающая БА» применяют в тех случаях, когда болезнь плохо контролируется ингаляционными ГКС; возникает необходимость назначать системные стероидные препараты.
Термин «фатальная астма» используют для описания внезапной смерти у больного, страдающего БА.
В течении БА выделяют 4 фазы.
Фаза обострения — возобновление, учащение и усиление приступов, кашля, одышки, дистантных хрипов, снижение эффективности бронхолитических препаратов. Нарастание признаков дыхательного дискомфорта может сопровождаться клиническими (повышение температуры тела, ознобы, потливость) и лабораторными (лейкоцитоз, эозинофилия и др.) признаками воспаления.
Фаза нестабильной ремиссии — состояние, при котором признаки дыхательного дискомфорта стали менее выраженными, но еще не достигнута стабильная ремиссия.
Ремиссия бронхиальной астмы — диагностируется в тех случаях, когда купированы приступы дыхательного дискомфорта, возможно возникновение единичных приступов удушья или других признаков дыхательного дискомфорта в соответствии с тяжестью течения бронхиальной астмы,
Стойкая ремиссия может быть диагностирована у тех больных, у которых признаков обострения болезни не было более 2 лет.
Диагностика БА.
При физикальном обследовании наиболее частой находкой являются сухие свистящие хрипы при аускультации, но они выслушиваются не всегда. Тем не менее, у больных при обострении заболевания могут обнаруживаться другие признаки, свидетельствующие о тяжести обострения; цианоз, сонливость, затруднения при разговоре, тахикардия, вздутие грудной клетки, включение дополнительной мускулатуры в акт дыхания и втяжение межреберных промежутков. Оценка функции легких.
Существует широкий спектр различных методов для оценки степени бронхиальной обструкции, но обычно используются объем форсированного выдоха за первую секунду (ОФВ1) и связанная с ним форсированная жизненная емкость легких (ФЖЕЛ), а также пиковая скорость выдоха (ПСВ).
Эти показатели зависят от природы бронхиальной обструкции, напрямую связанной с величиной просвета дыхательных путей и эластическими свойствами альвеол.
Спирометрия. Измерение ОФВ1 и ФЖЕЛ проводится с использованием спирометра путем выполнения маневра форсированного выдоха. Снижение ОФВ1 менее 80% кдолжной величине — объективный критерий нарушения бронхиальной проводимости.
Важным показателем функции легких является также отношение ОФВ1 к ФЖЕЛ (тест Тиффно), которое составляет у взрослых более 80%, а у детей, возможно, более 90%.
Любые значения ниже приведенных могут предполагать бронхиальную обструкцию. Пикфлоуметрия.
Оценка пиковой скорости выдоха, измеряемой пикфлоуметром, также является важным средством в диагностике и контроле проводимого лечения БА.
Пикфлоуметры удобны для использования в амбулаторных, домашних условиях с целью ежедневного объективного мониторирования заболевания.
Ниже приведена последовательность действий при правильном использовании пикфлоуметра.
• Тест выполняют стоя, держа прибор в горизонтальном положении. • Делают максимальной вдох, затем максимально сильный выдох через пикфлоуметр (стараясь при этом не кашлять).
• Необходимо сделать, как минимум, 3 попытки.
Учитывается наилучший результат.
• Обычно тест выполняют два раза в сутки (утром, сразу после сна и вечером, до приема лекарственных средств).
Помимо наивысших показателей ПСВ большое значение имеет разница между утренними и вечерними показателями (вариабельность ПСВ), которая рассчитывается по формуле: ПСВв — ПСВу / (ПСВв+ПСВу)х0,5
Вечерний показатель ПСВ обычно выше утреннего, однако наибольшую ценность имеет разница между ними.
Вариабельность ПСВ >20% считается ненормальной.
Следует помнить, что пиковая скорость выдоха (ПСВ) позволяет судить, главным образом, о тяжести обструкции крупных дыхательных путей. Основной недостаток метода: при выраженной обструкции мелких бронхов ПСВ может быть в пределах нормы.
Исследование гиперреактивности бронхов. Гиперреактивность бронхов является важным компонентом бронхиальной астмы, лежащим в основе нестабильности состояния дыхательных путей, проявляющимся повышением бронхоконстрикторного ответа на широкий спектр экзогенных и эндогенных стимулов.
В лабораторных условиях гиперреактивность определяется с использованием провокационных тестов (фармакологических, пробы с физической нагрузкой, холодным воздухом и др.).
Наиболее чувствительными тестами на гиперреактивность бронхов считаются фармакологические — с использованием гистамина, метахолина, ацетилхолина.
Проба с физической нагрузкой применяется у детей и пациентов молодого возраста с целью уточнения диагноза. Тест более специфичен, но менее чувствителен, чем фармакологические пробы.
Провокационные пробы с аллергеном, гипо- и гиперосмолярными растворами, холодным воздухом проводятся, в основном, в научных целях.
Профессиональная провокационная проба с предполагаемыми химическими или профессиональными агентами должна проводиться в специализированных центрах.
Необходимо подчеркнуть, что дети младше 6-8 лет обычно не могут выполнить стандартные тесты, использующиеся для исследования функции легких.
Ведется поиск других методов изучения функции легких у детей младшего возраста (например, осциллометрия), но эти исследования носят противоречивый характер.
У детей младше 18 месяцев применяют плетизмографию. С целью получения кривой поток-объем используют компрессию грудной клетки.
Другие методы исследования. При рентгенологическом исследовании легких обычно выявляются либо нормальная картина, либо признаки гиперинфляции (перерастяжения) легких.
Компьютерная томография показана с целью выявления острого вздутия легких, эмфиземы или сопутствующих бронхоэктазов.
Большинству больных бронхиальной астмой показано аллергологическое тестирование, которое проводится вне фазы обострения болезни.
Кожный prick-test выполняется со стандартными аллергенами для подтверждения атопии и выявления причинно-значимых аллергенов.
Для контроля делают пробу с гистамином (положительный контроль) и физиологическим раствором (негативный контроль).
Определение содержания в крови специфических IgE (радиоаллергосорбентные тесты) показано при невозможности выполнения кожной пробы (например, при тяжелой экземе).
Исследование крови. Нередко у больных БА отмечается эозинофилия (количество эозинофилов > 300/дл), однако определяется она далеко не всегда. У многих больных бронхиальной астмой имеет место повышение общего Ig E, но этот тест часто не информативен.
Уровень общего Ig Е, также как количество эозинофилов, повышается при паразитарных заболеваниях ЖКТ.
Анализ мокроты.Обнаружение эозинофилии мокроты при ее цитологическом исследовании является важным критерием подтверждения диагноза астмы. Контроль динамики содержания эозинофилов в мокроте важен для оценки эффективности проводимой терапии.
Лечение. Для назначения адекватной терапии необходимо учитывать тяжесть течения БА, фазу течения, тяжесть обострения (если заболевание в стадии обострения), клинико-патогенетический вариант БА.
В связи с этим необходимо проводить лечение бронхиальной астмы не в целом, а дискретно, различая:
1) лечение приступа БА (или ранней астматической реакции), направленное на ликвидацию пароксизмального спазма гладкой мускулатуры бронхов и бронхиол;
2) лечение обострения БА и патогенетически близкой ему поздней астматической реакции, направленное на подавление воспалительных реакций, текущих в бронхиальном дереве;
3) лечение астматического статуса, включающее неотложные мероприятия по борьбе с аллергическим воспалением бронхов, бронхоспазмом, острой дыхательной недостаточностью, синдромом «рикошета», гиповолемией и гиперкоагуляцией крови.
В фазе стабильной ремиссии БА лечения не требуется.
Начнем с организационных мероприятий. Элиминационная терапия проводится с целью удаления из окружения больного аллергенов, вызывающих аллергические реакции.
Она является важным и обязательным видом лечения, способным уменьшить частоту обострений БА и выраженность клинических симптомов, снизить потребность больных в лекарственных препаратах. Это лечение должно быть использовано у всех больных и не имеет противопоказаний и побочных действий.
Бытовая сенсибилизация более всего связана: с аллергией к клещам.
Для декартелизации жилища проводятся следующие мероприятия: удаление из комнаты мягкой мебели и ковров; использование специальных чехлов, непроницаемых для клешей, для подушек, матрацев и одеял;чистка постельных принадлежностей пылесосом не реже 1 раза в неделю, а стирка постельного белья каждые 1-2 нед; замена пуховых и перовых перин и подушек на синтепоновые; использование пылесосов, снабженных фильтрами или резервациями для воды.
Необходимо ежедневно проводить влажную уборку помещений (имеются данные, что мытье полов 10—20% раствором поваренной соли уменьшает количество клещей); хранить книги в застекленных шкафах; поддерживать относительную влажность воздуха не выше 50%, что отрицательно сказывается на росте и размножении клешей.
Нужно регулярно проветривать помещения; рекомендуется использовать воздухоочиститель с фильтрами.
Элиминационные мероприятия при сенсибилизации к аллергенам животных: устранить из квартир домашних животных и тщательно убрать помещения после этого; нельзя заводить новых животных; если устранить животное невозможно, необходимо не допускать его в спальню.
Использовать одежду из синтетических тканей вместо изделий из шерсти и меха; больным с эпидермальной сенсибилизацией нельзя вводить гетерологичные сыворотки (противостолбнячную, противодифтерийную, противоботулиническую, антирабическую и др.) из-за перекрестной реакции между антигенами перхоти и сыворотки животных.
При пыльцевой аллергии рекомендуются следующие элиминационные мероприятия: отъезд больных в другую местность, где нет растений, пыльца которых вызывает развитие заболевания; запрет на выезд больных за город в период поллинации растений и прогулки в сухую ветреную погоду; закрывать окна и форточки тканью или пленкой, которые не пропускают пыльцу в жилище.
При возвращении домой с улицы нужно прополоскать зев, принять душ и поменять одежду; на улице носить очки; в те дни, когда концентрация пыльцы в воздухе особенно высока, больным следует не выходить на улицу; рекомендуется применять фильтры для очистки от пыльцы поступающего в жилые помещения воздуха; в случае перекрестной аллергии необходимо соблюдать элиминационную диету (запрещается употреблять яблоки при аллергии к пыльт березы и др.).
При инсектной аллергии принимаются меры по борьбе с тараканами. Использование фосфорорганических инсектицидов допустимо только при длительном отсутствии больного в данном помещении.
При аллергических реакциях на укусы насекомых рекомендуется: не ходить босиком по траве; носить закрытую одежду и головной убор; не пользоваться дезодорантами и духами, привлекающими насекомых; при появлении насекомых не делать резких движений, не размахивать руками; закрывать окна и двери сеткой для защиты от насекомых; иметь противошоковый набор (жгут, по 2 ампулы с адреналином, преднизолоном, тавегилом, спирт, вату).
При грибковой сенсибилизации необходимы следующие профилактические меры: в помещениях, где живет больной, не должно быть плесени; своевременно лечить грибковые заболевания ногтей и кожи; запретить употребление дрожжесодержащих продуктов (пиво, квас, сыр, сухие вина, дрожжевое тесто и др.); нельзя использовать антибиотики из группы пенициллина.
Элиминационная терапия при наличии пищевой аллергии включает следующее:
— при очевидной непереносимости каких- либо продуктов употребление их запрещено на всю жизнь;
— при отсутствии убедительных данных о непереносимости тех или иных продуктов больному назначается гапоаллергенная диета с исключением «облигатных» аллергенов: цитрусовых, рыбы, яиц, шоколада, орехов, клубники, земляники, красных сортов яблок, ананасов, копченостей, икры, консервов, покупных кулинарных изделий, алкогольных напитков, газированных напитков; ограничивается соль;
— больным разрешаются нежирные сорта мяса (отварное говяжье и куриное), масло (сливочное, подсолнечное, кукурузное, оливковое), молочно-кислые продукты (творог, кефир, простокваша), каши (гречневая, овсяная, рисовая), овощи и фрукты (отварной картофель, брюква, капуста, огурцы, зеленые сорта яблок, арбуз, дыня и др.), ягоды (смородина, крыжовник, вишня, слива и др.), компоты, чай, несдобный хлеб;
— если выявлены определенные аллергены, то из рациона больного исключаются все пищевые продукты, в которые они входят. Например, при непереносимости куриных яиц исключаются содержащие яйца кондитерские изделия (торты, пирожные, печенье, кексы, мороженое и др,), майонез, макароны, куриное мясо, а также вакцины против гриппа, паротита, кори, краснухи, 148 Часть 2. Заболевания органов дыхания сыпного тифа, которые изготовляются с использованием куриных эмбрионов;
— развитию пищевой аллергии способствуют различные заболевания органов пищеварения (хронический холецистит, панкреатит, дисбактериоз кишечника и др.).
При лекарственной аллергии сведения о том, какие препараты вызывают аллергическую реакцию, выносятся на лицевую сторону истории болезни или амбулаторной карты.
Элиминационные мероприятия при этом сводятся к следующему:
— запрещается использование как самого лекарственного средства, так и комбинированных препаратов, в состав которых он входит. Например, при аллергии к производным пиразолона запрещается использование теофедрина, баралгина, пенталгина, спазмалгона и др.;
— запрещается применение препаратов, имеющих общие антигенные детерминанты с непереносимыми средствами. Например, при аллергических реакциях на пенициллин нельзя применять цефалоспорины, при аллергии к сульфаниламидам — местные анестетики.
источник

Обследование, основанное на сборе анамнеза, внешнем осмотре, пальпации, прослушивании и простукивании называется физикальным. Именно с такого метода диагностики начинается определение типа болезни.

- В каком возрасте начались астматические приступы, возможно какие детские болезни привели к астме. Это может быть коклюш, корь и другие, которые могут негативно повлиять на дыхательную систему.
- Были ли среди родственников астматики, это позволяет проследить генетическую связь, возможно кто-то из близких имел сильные аллергии.
- С какими раздражителями связаны приступы. Такие раздражители называются триггерами, и среди них может быть физическая нагрузка, холодный влажный воздух, микроскопические частицы шерсти и кожи собак, кошек, пыльца цветов разных растений, запыленность в помещении пылью определенного типа, продукты питания.
- Нужно узнать, как именно проходят приступы. Ведь при астматическом кашле пациенты принимают положение, при котором вдох менее мучительный, например, опираются руками о стол, расслабляя при этом плечевой пояс.
- Есть ли звуки при кашле, ведь свист при дыхании — это признак астматического сужения бронхов. Чтобы услышать характерные звуки при дыхании и приступах, не нужно прослушивать грудь стетоскопом, их хорошо слышно и на небольшом расстоянии.
- Долго ли длится приступообразный кашель, пропадает ли он после приема бронхолитических лекарств.
- После приступа наблюдается выделения вязкой, но прозрачной, как стекло мокроты, которая освобождает бронхи, таким образом облегчается дыхание, такие особенности также нужно узнавать при опросе.
Внешний осмотр проходит следующим образом:
- Врач смотрит на грудную клетку, которая может иметь вид, похожий на бочку. Такую форму грудная клетка приобретает вследствие развития эмфиземы, расширения легких, и, как результат — увеличение размеров грудной клетки;
-
Прослушивание проходит через стетоскоп, стетофонендоскоп или фонендоскоп, причем последний наиболее подходит для изучения звуков, издаваемых грудной клеткой при астме. Если происходит обострение, свист и характерные хрипы слышны по всей легочной поверхности, но при ремиссии свистящий хрип слышен снизу от лопаток и то только при усиленном вдохе.
- Постукивание пальцами не может эффективно сообщить информацию на ранних этапах астмы. Но если болезнь длится долго, то пальпацией и постукиванием можно услышать пустоту (звук картонной коробки), которая образовалась из-за эмфиземного расширения легких.
Лабораторные исследования проводятся в следующих направлениях:
- анализ крови направлен на определение количества эозинофилов — этот вид лейкоцитов является показателем аллергических процессов в организме;
-
если в анализе крови отсутствуют признаки воспалительных процессов и токсинов, выделяемых бактериями, то при наличии астматических симптомов доктору легче отличить астму от обычного бронхита или пневмонии;
- в мокроте под микроскопом можно обнаружить эозинофилы;
- в анализе мокроты присутствуют кристаллические вкрапления — особенные кристаллы Шарко-Лейдена и спиралевидные кристаллы Куршмана;
- мокрота при астме специфическая, отличается от мокроты при бронхите, структура двухслойная, консистенция густая, по густоте вязкая;
- методом проделывания царапин на коже (скарификации) берут пробы на аллергены, по которым уточняют аллергический возбудитель (триггер) бронхоспазма, аллергены вызывают на коже покраснение и зудящие ощущения;
- кал берут для определения гельминтов, которые могут размножиться до инвазивного количества и вызвать аллергическую интоксикацию организма, что также может влиять на возникновение приступов.
С помощью специально разработанных аппаратов проводится инструментальная диагностика. На первом месте в аппаратной диагностики стоит пикфлуометрия. На пикфлоуметре, который являет собой трубочку с нанесенной шкалой, измеряется самая большая скорость потока воздуха при выдохе, сделанном с максимальным усилием (форсированный выдох). Такая пиковая скорость выдоха называется ПСВ. Этот тест доступен детям с четырех лет, также он применяется и для взрослых.
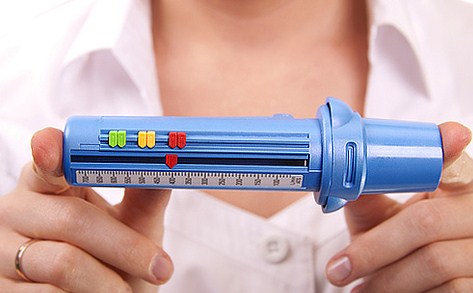
Измерительные процессы проводятся дважды в день, сутра и ближе к вечеру. Делаются три попытки, из которых выбирается та, которая сделана наиболее правильно. На трубку нанесена шкала с зеленой, желтой и красной зоной, которые обозначают степень проблемы. Но эта шкала не унифицирована, она подбираются путем индивидуальных двухнедельных исследований каждого больного. Если показатели в зеленой зоне, значит, что симптомы астмы под контролем, желтая зона — возможно обострение, при красной зоне нужно немедленно спешить человеку на помощь.
Больной должен зафиксировать лучшее значения ПСВ, и при дальнейшем использовании прибора при определении обструктивных изменений надобно соотносить с этим значениям другие показатели шкалы. Нужно правильно делать выдох форсированным способом, результаты записывать в дневник, чтобы с этими результатами ознакомить позже лечащего врача. Возможно, в вашем городе есть школа для больных астмой (где доктора рассказывают, как лечить это заболевание), поинтересуйтесь у доктора.

Спирограмма показывает форсированную жизненную емкость легких, сокращенно ФЖЕЛ, а также объем форсированного выдоха за одну секунду, сокращенно — ОФВ1, и так называемую пиковую скорость выдоха (ПСВ). Высчитывается индекс Тиффно, который составляет ОФВ1 поделить на ФЖЕЛ, у здоровых людей этот показатель выше 0,75.
Если при подозрениях на астму показатели спирографа в пределах нормы, делают медицинскую провокацию — дают больному метхолин или гистамин в виде ингаляций и сравнивают спирограмму с обычной обструкцией и под действием этих лекарств.
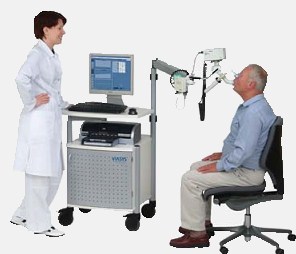
Но анализ дыхания может не дать четких результатов в случае, если заболевание являются профессиональным и приступ вызывает вещество, присутствующее только на работе. Чтобы диагностировать профессиональную астму, нужно кроме тестов дыхания изучить анализы и с помощью опроса выявить аллерген на рабочем месте пациента.
Если болезнь уже долго прогрессирует, развивается эмфизема, увеличение в объеме легких, которые на рентгенологической фотографии видимы как более прозрачные.
Томографию также назначают не во всех случаях, а только тогда, когда кашель и удушье не проходят длительное время, не смотря на лечение, и есть подозрения на наличие других болезней.
Диагностика астматических приступов у детей имеет особенности, поскольку они часто болеют респираторными и другими заболеваниями с похожими симптомами. Прежде всего у детей выясняют зависимость приступов от действий аллергенов, также возможную склонность к аллергии на генетическом уровне — есть ли близкие родственники с сильной аллергией на что-либо, это позволяет уточнить диагноз.

У детей исследуют внешнее дыхание с помощью приборов, предварительно дав бронходилататоры (препараты, расширяющие просвет в бронхах). Также сдают анализы, чтобы отследить наличие гельминтов и воспалительного процесса в организме, иногда проводят аллергологический тест. Но некоторые современные врачи отказываются от тестов на аллергены, резонно указывая на то, что в большинстве случаев аллергены вполне обычны и избежать их влияния довольно трудно.
У детей бронхиальная астма полностью излечима в большинстве случаев, однако для успешного лечения имеет большое значение своевременная диагностика бронхиальной астмы и правильное лечение, которое состоит не только в приеме медикаментов, но и в укреплении организма.
Люди пожилого возраста имеют множество заболеваний, которые могут хронически проходить долгие годы. Симптомы этих болезней могут накладываться на астматические, и клиническая картина становится нечеткой.

Кроме того, рекомендуется проводить функциональные методы выявления бронхиальной астмы, включающие ЭКГ, рентгенографию, пикфлоуметрию (это исследование нужно делать в течение 2 недель). Только после выполнения всех диагностических мероприятий назначается симптоматическое лечение бронхиальной астмы.
источник
Определение бронхиальной астмы, ее потенциальные факторы риска. Клиническая диагностика заболевания. Определение обратимости бронхиальной обструкции. Основные этапы терапии и характеристика препаратов для лечения бронхиальной астмы и ее обострений.
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
HTML-версии работы пока нет.
Cкачать архив работы можно перейдя по ссылке, которая находятся ниже.
Бронхиальная астма – хроническое воспалительное заболевание дыхательных путей, которое отличается наличием обратимой обструкции бронхов. Факторы риска бронхиальнай астмы. Факторы, провоцирующие обострение бронхиальной астмы. Формы бронхиальной обструкции.
реферат [23,0 K], добавлен 21.12.2008
Ведущие патогенетические механизмы бронхиальной астмы. Классификация и этиологические формы заболевания. Клиническая картина и осложнения. Постановка диагноза, дифференциальная диагностика и принципы лечения. Современный подход к лечению обострений.
контрольная работа [34,5 K], добавлен 27.02.2010
Понятие, причины, признаки бронхиальной астмы. Этиология, патогенез, клиническая картина данного заболевания. Обзор и характеристика методов немедикаментозного лечения бронхиальной астмы. Исследование влияния здорового образа жизни на состояние больного.
курсовая работа [44,9 K], добавлен 19.12.2015
История исследования заболевания бронхиальной астмой. Этиология бронхиальной астмы и ее аллергическая природа. Патоморфологические изменения у больных. Роль инфекции в патогенезе бронхиальной астмы. Клинические наблюдения психогенной бронхиальной астмы.
реферат [17,8 K], добавлен 15.04.2010
Причины возникновения и классификация бронхиальной астмы, ее клиническая картина и степени тяжести. Принципы и методы лечения астматического статуса. Характеристика препаратов, контролирующих течение заболевания и купирующих эпизоды бронхоспазма.
презентация [151,4 K], добавлен 21.10.2013
Определение, этиология, основные симптомы и особенности лечения бронхиальной астмы. Классификация средств, применяемых при бронхоспазмах. Описание современных лекарственных средств для лечения бронхиальной астмы. Сопоставимые дозы некоторых препаратов.
контрольная работа [36,1 K], добавлен 06.05.2015
Ступени терапии бронхиальной астмы. Интермиттирующее, легкое персистирующее течение заболевания, его тяжелая и средней тяжести форма. Клиническая картина заболевания до лечения. Назначение ежедневной лекарственной терапии для контроля над симптомами.
презентация [125,0 K], добавлен 28.11.2013
Определение бронхиальной астмы, ее распространенность и этиология. Триггеры и индукторы как факторы риска развития болезни. Симптомы бронхиальной астмы, лечение, шаговая терапия, диагностика, профилактика, экспертиза трудоспособности и физиотерапия.
история болезни [61,5 K], добавлен 26.04.2009
Возникновение бронхиальной астмы у детей. Наследственность в происхождении бронхиальной астмы. Клиническая картина и схемы оценки статуса больного с бронхиальной астмой. Анализ заболеваемости бронхиальной астмой у детей ММУ ГП№ 9 ДПО-3 (участок 23).
реферат [122,9 K], добавлен 15.07.2010
Проявления бронхиальной астмы — остро развившаяся обструкция дыхательных путей. Причины нарушения бронхиальной проходимости. Графики частоты обострений у мужчин и женщин без учета возраста. Отличия в возрастных ритмах обострений бронхиальной астмы.
статья [257,1 K], добавлен 22.07.2013
источник
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
Бронхиальная астма занимает одно из ведущих мест в статистике заболеваемости дыхательных путей. Сегодня, после множественных исследований в условиях стационаров созданы достаточно действенные схемы терапии и ведения астмы у пациентов разных возрастов. Одной из подобных схем является схема GINA, которая была дополнена в 2006 году. Данная схема лечения удовлетворяет требования самых лучших ученых, занимающихся изучением заболевания и разработкой методов терапии. В данном материале будут подробно изложены принципы современной терапии астмы, а также ведения болезни.
За несколько десятков лет тактика ведения заболевания и его терапии претерпели множество дополнений и доработок. Данные доработки стали возможны благодаря появлению инновационных способов диагностики, а также терапии астмы. Новые методы являются более совершенными и более безвредными для организма пациентов.
Сегодня одной из самых используемых методик терапии является Глобальная стратегия по лечению и профилактике бронхиальной астмы (GINA), которую дополнили совсем недавно.
Главными задачами данной схемы лечения установлено: разработка действенной и безвредной методики терапии астмы, профилактика обострений недуга, улучшение качества жизни пациентов, а также уменьшение числа смертельных исходов. Кроме этого схема GINA 2006 совершенно конкретно дает обозначение трем ступеням контроля заболевания, что является необходимым для разработки грамотной схемы терапии.
Бронхиальная астма является заболеванием, тормозить развитие которой вполне можно, если правильно проводить терапию. Одновременно схема терапии астмы и степень ее сдерживания варьирует на разных фазах течения заболевания, а также в зависимости от индивидуальных особенностей организма.
Принципы терапии астмы GINA подразумевают три стадии контроля заболевания:
Контролируемая форма – эта стадия контроля, подразумевающая использование методов лечения при отсутствии клинической картины астмы, при этом результаты специальных анализов почти нормальны. У пациентов с этой формой заболевания, по теории, изложенной GINA, можно уменьшить количество лекарств, применяемых для терапии.
Частично контролируемая форма протекает с присутствием определенных, не слишком явных признаков заболевания, проявляющихся при терапии. Схема терапии GINA дает возможность усиления терапевтических мер у подобной категории пациентов для снижения проявлений заболевания до стадии контролируемой астмы.
Неконтролируемая астма протекает с явными признаками заболевания, развивающимися независимо от хода терапии. Эта стадия требует обязательного и периодически изменяемого лечения.
Итак, очевидно, что стадии контроля заболевания в схеме терапии астмы GINA определяются в четкой зависимости от используемой методики терапии, а также направлены на вариабельность терапии в зависимости от состояния пациента.
Для получения рекомендаций по терапии бронхиальной астмы необходимо посетить консультацию терапевта, пройти необходимые обследования, а также проанализировать действенность предыдущих схем терапии.
Программа терапии астмы GINA предусматривает принципиально иные методы терапии заболевания, нежели использовались ранее. Одним из новейших введений является концепция SMART (Symbicort Maintenance and Reliever Therapy). Подобная схема терапии осуществляется с использованием препарата Симбикорт, являющегося комбинированным и включающего в себя два типа действующих компонентов: будесонид (глюкокортикоид) и формотерол (увеличивает просвет бронхов). Действенность подобной схемы терапии уже проверена и доказана в условиях стационаров.
Схема SMART основывается на применении лекарства Симбикорт в качестве главного лечебного средства, а также и для торможения приступов астмы. Подобное применение данного лекарства возможно потому, что оно состоит из двух действующих компонентов:
Формотерол – это лекарство, активизирующее бета-2-адренорецепторы. Действие формотерола проявляется в стремительном увеличении внутреннего диаметра бронхов, уменьшении аллергических проявлений в бронхах, усиления вывода слизи из бронхов, что предупреждает обострение заболевания при инфекционно-воспалительных недугах органов дыхания. Эффект от употребления данного вещества начинается спустя одну – две минуты с момента введения препарата (ингалятором). В связи с этим Симбикорт эффективен для остановки приступов удушья.
Будесонид – это вещество из группы гормонов глюкокортикоидов. Действие данного вещества заключаются в снижении воспаления и аллергического ответа в органах дыхания, снижении отека слизистой оболочки органов дыхания и тем самым увеличении внутреннего диаметра бронхов, усилении действия формотерола или иных веществ из группы бета-2-адреномиметиков. Вещество действует и на воспалительный процесс, но не быстро, зато достаточно долговременно.
Лекарство Симбикорт производится в форме ингалятора. В ходе терапии контролируемой астмы ингаляции нужно осуществлять два раза в сутки (по советам специалистов программы SMART). При появлении первых признаков обострения процесса кратность процедур следует наращивать в зависимости от состояния, но количество их не должно быть более восьми в день. Подобное применение лекарства дает возможность предупредить развитие обострения астмы.
Новые принципы терапии данного заболевания дают возможность более эффективно предупреждать ухудшение самочувствия, а также снизить количество употребляемых гормональных препаратов.
Автор: Пашков М.К. Координатор проекта по контенту.
источник
Этиология бронхиальной астмы
Бронхиальная астма – это хроническое воспалительное заболевание дыхательных путей, в котором принимают участие многие клетки и клеточные элементы. Хроническое воспаление обусловливает развитие бронхиальной гиперреактивности, которая приводит к повторяющимся эпизодам свистящих хрипов, одышки, чувства заложенности в груди и кашля, особенно по ночам или ранним утром. Эти эпизоды обычно связаны с распространенной, но изменяющейся по своей выраженности обструкцией дыхательных путей в легких, которая часто бывает обратимой либо спонтанно, либо под действием лечения [1].
Выделяют внутренние и внешние факторы, влияющие на развитие и проявления бронхиальной астмы. К внутренним факторам относятся: пол, ожирение, генетическая обусловленность (гены, предрасполагающие к атопии, и гены, предрасполагающие к бронхиальной гиперреактивности). К внешним факторам относятся: аллергены, инфекции (чаще вирусные), профессиональные вредности, курение, загрязнение воздуха, питание. Наиболее важными факторами, ответственными за развитие БА, являются аллергены, которые сенсибилизируют дыхательные пути, провоцируют начало заболевания и в дальнейшем поддерживают течение болезни. Выявление и элиминация аллергенов являются залогом успешного лечения БА.
Труднее всего бороться с бытовыми аллергенами, из которых наибольшее значение имеют клещи домашней пыли. Они содержатся в коврах, драпировочном материале, постельных принадлежностях, мягких игрушках, мягкой мебели. Клещевая БА характеризуется круглогодичным возникновением обострений, приступы развиваются преимущественно ночью. Рекомендуют исключение из обихода вышеперечисленных предметов, в качестве набивного материала для одеял и подушек желательно использовать синтепон, для уничтожения клещей применяют аттрактанты, обязательна ежедневная влажная уборка помещения, кипячение постельного белья, его вымораживание или проветривание на солнце.
Широко распространены аллергены животного происхождения: шерсть, пух, перо, перхоть, экскременты, слюна разных видов животных (кошек, собак, хомяков, морских свинок, птиц, кроликов, а также тараканов). Не следует держать в квартире аллергиков аквариумы, так как сухой корм для рыб обладает выраженной аллергенной активностью. Даже если животного уже нет в квартире, высокий уровень аллергенов сохраняется в течение нескольких лет.
Грибковые аллергены вызывают сенсибилизацию к плесневым и дрожжевым грибам. Грибы содержатся как внутри помещений, так и в окружающей среде. Наиболее часто грибковому заражению подвержены ванные комнаты, подвальные помещения. Грибы могут находиться в большом количестве весной в непросушенной даче, в прелой листве на приусадебном участке. Необходимо чаще проветривать помещения, бороться с влажностью и очагами плесени.
Пыльцевые аллергены, вызывающие БА, могут быть трех видов: деревья и кустарники (береза, ольха, лещина, орешник, ива, дуб, каштан, тополь, ясень и др.); злаковые травы (тимофеевка, овсяница, мятлик, пырей, гречиха, пшеница и т.д.); сорные травы (лебеда, амброзия, одуванчик, конопля, крапива, полынь и т.д.). В условиях средней полосы России отмечается 3 пика обострения болезни: весенний (апрель – май), обусловленный пыльцой деревьев; летний (июнь – август), связанный с пыльцой злаковых; осенний (август – октябрь), обусловленный пыльцой сорных трав. Уменьшение контакта с пыльцой осуществляется путем ограничения прогулок, кондиционирования воздуха жилых помещений, временного переезда на жительство в климатические зоны, где период цветения причинно-значимых растений завершился или еще не начался. Эффективна специфическая иммунотерапия.
Факторами, способствующими возникновению БА, являются респираторные инфекции, поллютанты промышленные (загрязнение атмосферного воздуха промышленными отходами), поллютанты помещений (газовые плиты), вещества, выделяемые при приготовлении пищи, химические вещества, выделяющиеся из отделочных материалов, моющие синтетические средства. Ведущее место среди лекарств, вызывающих приступы удушья, занимают антибиотики, особенно пенициллинового ряда, сульфаниламиды, витамины, ацетилсалициловая кислота и нестероидные противовоспалительные препараты. Отдельно выделяют аспириновую бронхиальную астму. Аллергенами могут быть продукты и вещества, содержащиеся в таких продуктах, как цитрусовые, шоколад, мед, орехи, а также искусственные красители, консерванты, гистамин и др. Нередко ингаляционные аллергены имеют общие антигенные свойства с определенными пищевыми веществами. Например, пыльца злаковых растений, пыльца полыни и подсолнечник могут спровоцировать перекрестную аллергию к ракообразным, пыльца березы – к моркови, яблокам, гречке [2].
Мощным фактором возникновения БА является табакокурение, в том числе и пассивное. Немаловажную роль в развитии бронхиальной астмы играют психологические аспекты. Спровоцировать приступы БА могут также стрессовые ситуации и физическая нагрузка. Еще Гиппократ отмечал роль эмоционального состояния больного в развитии и продолжительности проявления БА. Раздражение и страх часто могут провоцировать приступы болезни.
Терапия бронхиальной астмы
Лечение БА является комплексным. Оно включает соблюдение противоаллергического режима, медикаментозное и немедикаментозное лечение. Большое значение уделяется подбору базовой терапии, исходя из степени контроля над симптомами астмы. В настоящее время рекомендована классификация бронхиальной астмы по уровню контроля, которая отражает не только выраженность клинических проявлений, но и адекватность терапии (табл. 1). Все препараты для медикаментозного лечения подразделяются на два вида: для базисного лечения и для купирования обострения.
Национальная программа по стратегии лечения бронхиальной астмы рекомендует ступенчатый подход к терапии (табл. 2), при котором терапия становится интенсивнее по мере увеличения степени тяжести заболевания. Ступенчатый подход позволяет учитывать разнообразие тяжести течения заболевания у разных людей и у одного и того же пациента в разные временные периоды. Целью ступенчатого подхода является достижение контроля над астмой с применением наименьшего количества препаратов. Если течение астмы ухудшается, то количество и частота приема лекарств соответственно увеличиваются («ступень вверх»). Если же течение астмы хорошо контролируется в течение 3 мес., то количество и частота приема терапии уменьшаются («ступень вниз»).
Снижение дозы базовой терапии проводится в том случае, если состояние больного остается стабильным не менее 3 мес. (что контролируется ведением дневника, данными пикфлуометрии и обследованием врача). Уменьшение терапии проводится ступенчато, предыдущая доза препарата уменьшается на 25–50%, или отменяются дополнительные препараты. При комбинированной терапии ингаляционными глюкокортикостероидами (ИГКС) и системными глюкокортикоидами (ГК) сначала снижают и отменяют системные гормональные препараты, не изменяя доз ИГКС. При снижении дозы препаратов необходимо контролировать симптомы БА, клинические проявления и показатели функции внешнего дыхания. В настоящее время наиболее эффективными препаратами для контроля заболевания являются ИГКС. Их назначение рекомендовано при персистирующей БА любой степени тяжести. Длительная терапия ИГКС значимо снижает частоту и тяжесть обострений. Чем выше степень тяжести БА, тем бóльшие дозы ингаляционных стероидов надо применять (табл. 3).
Противовоспалительный эффект ИГКС связан с их ингибирующим действием на клетки воспаления и их медиаторы, включая продукцию цитокинов, вмешательство в метаболизм арахидоновой кислоты и синтез лейкотриенов и простагландинов, снижение проницаемости микрососудов, предотвращение прямой миграции и активации клеток воспаления, повышение чувствительности бета-рецепторов гладкой мускулатуры. ИГКС увеличивают апоптоз и снижают количество эозинофилов путем ингибирования интерлейкина-5. Таким образом, ИГКС приводят к стабилизации клеточных мембран, уменьшают проницаемость сосудов, улучшают функцию бета-2-адренорецепторов, стимулируют эпителиальные клетки. Учитывая, что лечение ИГКС является местным, оно обеспечивает выраженный противовоспалительный эффект непосредственно в бронхиальном дереве с минимальными системными проявлениями.
Наиболее важной характеристикой ИГКС является липофильность, благодаря чему препарат накапливается в дыхательных путях, замедляется их высвобождение из тканей и увеличивается его сродство к глюкокортикоидному рецептору. Эти препараты быстрее захватываются из просвета бронхов и длительно задерживаются в тканях дыхательных путей. Именно липофильность отличает ИГКС от системных препаратов, поэтому бесполезно назначать ингаляции системных ГКС (гидрокортизона, преднизолона, дексаметазона). Они независимо от способа применения обладают только системным действием. К ИГКС относятся: бекламетазона дипропионат, будесонид, флутиказона пропионат, флунизолид, триамцинолона ацетонид, мометазона фуроат (табл. 4). Форма выпуска – дозированные аэрозоли, дозированные порошки, растворы для использования в небулайзерах.
Легочная биодоступность зависит от наличия или отсутствия носителя. Ингаляторы, не содержащие фреон, имеют лучшие показатели эффективности. Так, бекламетазона дипропионат с фреоновым носителем используется в дозах вдвое больших, чем при использовании без фреонового носителя. Количество ИГКС, доставляемое в дыхательные пути, зависит также от дозы, типа ингалятора и техники ингаляции.
Можно привести следующие принципы применения ИГКС.
- ИГКС следует рекомендовать тем больным, у которых обычная потребность в применении бета-2-агонистов короткого действия составляет 2–3 раза в день и больше.
- ИГКС могут позволить сократить применение системных ГК у больных с ГКС-зависимой БА.
- Контроль БА быстрее достигается при назначении более высоких доз ИГКС.
- Все препараты группы ИГКС в эквивалентных дозах достаточно эффективны.
- Доказана эффективность ИГКС при назначении их 2 раза в день. При увеличении приема до 4 раз в сутки эффективность повышается незначительно при тех же дозах.
- Стандартные дозы ИГКС (800 мкг бекламетазона) при неэффективности могут быть увеличены до 2000 мкг в пересчете на бекламетазон.
- Снижение доз ИГКС следует осуществлять, постепенно уменьшая дозу на 25–50%, после того как состояние остается устойчивым в течение 3 мес.
Основные пути доставки лекарственных средств в дыхательные пути:
- дозированные аэрозольные ингаляторы: обычные, активируемые вдохом («легкое дыхание»), в комбинации со спейсером;
- дозированные порошковые ингаляторы: одноразовые, мультидозовые резервуарные, мультидозовые блистерные;
- небулайзеры: ультразвуковые, струйные.
Практически все аэрозольгенераторы имеют как свои преимущества, так и недостатки: достаточная или недостаточная портативность, необходимость или отсутствие необходимости координации вдоха и начала ингаляции, заправка лекарственных средств в процессе использования или возможность применения без дозаправки, стоимость и др. Следует учитывать, что у 80% пациентов возникают трудности при использовании дозированных аэрозолей. Врач должен обучить пациента правильной технике ингалирования, рекомендовать для использования небулайзеры и спейсеры. Основное преимущество последних заключается в том, что в бронхи попадает гораздо больше лекарства, меньшее количество оседает в ротовой полости, горле, языке, что снижает риск получить осиплость голоса, грибковые осложнения и кашель от удара струи аэрозоля. Пациентам рекомендуется полоскание рта водой после ингаляции для предупреждения развития грибковой инфекции.
При длительном лечении высокими дозами ИГКС могут проявляться системные побочные эффекты: геморрагии, угнетение коры надпочечников, остеопороз, катаракта, глаукома. ИГКС не противопоказаны при сопутствующем туберкулезе. Учитывая возможность развития побочных осложнений терапии ИГКС, целесообразно проводить комбинированную терапию, позволяющую достичь контроля над бронхиальной астмой меньшими дозами ИГКС.
Начиная с 3-й ступени при недостаточности контроля астмы к ИГКС необходимо добавлять бета-2-агонисты длительного действия, которые рассматриваются как альтернатива увеличению доз ингаляционных ГК у больных, плохо отвечающих на противовоспалительную терапию. С одной стороны, назначение бета-2-агонистов должно предшествовать очередному повышению доз ИГКС. С другой стороны, назначение этих лекарственных средств в качестве монотерапии не должно практиковаться, так как они не обладают выраженным противовоспалительным действием. Кроме того, появились данные, что у отдельных пациентов применение бета-2-агонистов увеличивает риск смерти. Регулярное применение бета-2-агонистов может приводить к развитию рефрактерности.
Комбинированная терапия способна значительно улучшить функцию дыхания, уменьшить число ночных приступов, снизить потребность в бета-2-агонистах короткого действия. Добавление бета-2-агонистов длительного действия более эффективно, чем увеличение ГКС в 2 раза. Наиболее частое применение находят 2 препарата – сальметерол и формотерол. Сальметерол характеризуется медленным началом действия. Бронхорасширяющий эффект наступает через 10–20 мин после ингаляции и сохраняется 12 ч. Липофильность сальметерола многократно превышает аналогичный показатель сальбутамола. Препарат уменьшает проницаемость легочных капилляров, стабилизирует мембраны тучных клеток, уменьшает местную и системную концентрацию гистамина. У большинства больных контроль над БА достигается назначением сальметерола по 50 мкг 2 раза в сутки. Следует отметить, что сальметерол обладает и рядом неожиданных свойств, в частности, вызывает снижение патогенности P. aeruginosa и оказывает протективный эффект в отношении Н. influenzaе. Формотерол по клиническим свойствам не уступает сальметеролу. Поддерживающая доза составляет 12–24 мкг. При сравнении эффективности этих 2 препаратов исследователи не смогли выявить значимых отличий. Формотерол, как полный агонист бета-2-адренорецепторов, обладает несколько большим эффектом и отличается большей дозозависимостью, что позволяет подбирать минимально эффективную дозировку.
Комбинированные препараты для ингаляционного введения, содержащие в своем составе ГКС и бета-2-агонисты длительного действия, появились несколько лет назад. Несмотря на это, они занимают центральное место в терапии БА и являются самыми перспективными средствами в оптимизации лечения БА. Эффективность ИГКС в комбинации с бета-2-агонистами значительно возрастает. Кроме того, попав при ингаляции на один и тот же участок дыхательных путей, препараты могут лучше взаимодействовать друг с другом. Комбинированные лекарственные средства обеспечивают лучшую приверженность больных лечению, а их использование обходится дешевле, чем использование двух препаратов по отдельности. При использовании комбинированной терапии повышается эффективность препаратов в более низких дозах ИГКС. Соединение препаратов в одном ингаляторе облегчает пациенту выполнение техники ингалирования.
К комбинированным препаратам относятся Серетид Мультидиск (салметерола ксинафоат + флютиказона пропионат) и Симбикорт Турбухалер (будесонид и формотерола фумарата дигидрат). Использование этих препаратов дает возможность гибкого дозирования (1–4 ингаляции в сутки) в зависимости от состояния больного. На фоне применения бета-2-агонистов длительного действия должен быть продолжен прием препаратов с коротким действием для купирования симптомов.
Наиболее эффективны для облегчения симптомов бета-2-агонисты с быстрым началом действия. Они являются наиболее эффективными бронходилататорами и препаратами выбора для купирования острых симптомов астмы. Препараты выпускаются в виде аэрозоля, таблеток, порошка. Из бронхолитиков пролонгированного действия нашли применение теофиллин и тербуталин. Эти препараты достаточно эффективны для купирования симптомов БА в ночные часы.
Системные стероиды при БА обычно применяют при обострении заболевания перорально или внутривенно (значительно реже) высокими дозами. Механизмы действия такие же, как у ИГКС. Однако системные ГК могут достигать других клеток-мишеней и формировать при длительном приеме системные осложнения. Стандартная доза – 40–50 мг преднизолона в сутки в течение 5–10 дней в период обострения. Назначение системных ГК для длительного контроля при персистирующей БА сразу определяет больного как тяжелого и требует назначения высоких доз ИГКС и ингаляционных бета-2-агонистов длительного действия. Ведение больного на монотерапии системными стероидами является грубой врачебной ошибкой, так как требует более высоких доз глюкокортикостероидов и приводит к развитию тяжелых осложнений: остеопороза, сахарного диабета, ожирения и др. [4].
План обследования больных, длительно получающих ГК, включает регулярный контроль физического развития; контроль артериального давления; обследование с помощью щелевой лампы для своевременного выявления катаракты; контроль электролитного обмена; систематическое исследование уровня сахара; анализ кала на скрытую кровь; оценку признаков возможного воспалительного процесса в легких или других органах; исследование базального уровня кортизола.
При БА применяются такие ГКС, как преднизолон, метилпреднизолон, которые обладают минимальным минералокортикоидным эффектом, относительно коротким периодом полувыведения и нерезко выраженным действием на поперечнополосатую мускулатуру. Если возможно, их следует назначать через день. Триамцинолон противопоказан беременным и детям, поражает желудочно-кишечный тракт, ведет к развитию мышечной дистрофии. Дексаметазон обладает выраженным подавлением функции коры надпочечников и низкой эффективностью при БА. Применение депонированных форм длительного действия категорически не рекомендуется. Любой пациент, которому назначены системные ГК для контроля БА, подлежит обследованию для установления причин, приведших к необходимости данного лечения.
Обозначим некоторые врачебные ошибки при терапии БА:
- неназначение ИГКС;
- недооценка степени тяжести на предшествующих этапах;
- попытка контроля воспаления в период обострения низкими дозами ГК, применение бета-блокаторов;
- неправильный подбор системы доставки для ИГКС;
- продолжающаяся экспозиция аллергена.
В ряде случаев имеет место неправильный диагноз БА, где респираторные симптомы являются следствием другой патологии. Перед врачом стоит задача контролировать БА меньшими дозами ГК, как системными, так и ингаляционными. Следует снижать системные ГК на фоне высоких доз ИГКС, уменьшая дозу не ранее чем каждые 3–4 недели во избежание развития осложнений. На фоне ее снижения нельзя уменьшать дозы ИГКС. После отмены системных ГК титрование ИГКС должно проводиться с учетом ступенчатого подхода. Одним из триггеров в развитии и обострении БА является инфекционный компонент. Как правило, это БА в сочетании с бронхитом или пневмонией. При назначении антибактериальной терапии следует повторно уточнить аллергологический анамнез. Чаще всего аллергические реакции развиваются на пенициллины и сульфаниламиды. При аллергии на пенициллины существует риск развития побочных реакций на использование любых бета-лактамных антибиотиков (цефалоспорины, карбапенемы), тогда могут быть показаны доксициклин, макролиды.
Недокромил или кромогликат натрия могут быть использованы в качестве дополнения к ИГКС или как их альтернатива у больных, которые не могут или не хотят применять стероиды. Хотя недокромил более эффективен, чем плацебо, степень его эффективности не позволяет рекомендовать его в качестве препарата первого ряда при лечении БА. Препараты этого ряда тормозят высвобождение медиаторов аллергии, предотвращают бронхоконстрикцию. Назначаются препараты длительно – не менее 2 мес. по 2 ингаляции 2 раза в день [5].
Из других препаратов медикаментозного лечения БА нашли применение антилейкотриеновые препараты в связи с доказанной ролью лейкотриенов в формировании наиболее важных патогенетических звеньев БА. Антилейкотриеновые препараты снижают симптомы бронхиальной астмы, уменьшают кашель, обладают противовоспалительным и слабым бронхорасширяющим эффектом. Это 2 группы препаратов: первая – ингибиторы синтеза; вторая – блокаторы рецепторов к лейкотриенам. Побочный эффект этой группы препаратов – гепатотоксичность.
Анти-IgE-терапия показана пациентам с повышенным уровнем IgE в сыворотке крови. Данные об эффективности омализумаба получены в 7 клинических исследованиях, проведенных у больных атопической БА, включая исследование с участием только больных с тяжелой персистирующей атопической БА, неконтролируемой, несмотря на медикаментозное лечение согласно 4-й ступени по руководству GINA, и 6 других исследованиях с преимущественным участием пациентов с тяжелой персистирующей БА. Прием омализумаба позволил снизить частоту клинически значимых и тяжелых обострений БА на 38 и 50% соответственно, а частоту обращений за неотложной медицинской помощью – на 47%. На протяжении года после назначения омализумаба в дополнение к стандартной базисной терапии 49% пациентов не нуждались в пероральном приеме стероидов, что на 47% больше по сравнению с группой базисной терапии. Лечение омализумабом позволило на 80% снизить потребность больных в препаратах неотложной помощи (бета-2-агонистах короткого действия). По сравнению с плацебо омализумаб улучшал качество жизни пациентов с БА на 49%. Кроме того, по данным проведенных клинических исследований, омализумаб имеет высокий профиль безопасности [6].
Немедикаментозное лечение БА включает в себя: респираторную терапию (тренировка дыхания, контроль дыхания, интервальная гипоксическая тренировка); массаж, вибромассаж; лечебную физкультуру; спелеотерапию и горноклиматическое лечение; физиотерапию; иглоукалывание; фитотерапию; психотерапию; санаторно-курортное лечение. Одно из центральных мест в лечении занимают самообразование больных и диспансерное наблюдение. Для оценки эффективности лечения каждый больной должен проводить мониторинг БА с помощью пикфлоуметрии, что дает возможность объективной оценки течения заболевания и соответствующей коррекции схемы лечения.
источник
 Прослушивание проходит через стетоскоп, стетофонендоскоп или фонендоскоп, причем последний наиболее подходит для изучения звуков, издаваемых грудной клеткой при астме. Если происходит обострение, свист и характерные хрипы слышны по всей легочной поверхности, но при ремиссии свистящий хрип слышен снизу от лопаток и то только при усиленном вдохе.
Прослушивание проходит через стетоскоп, стетофонендоскоп или фонендоскоп, причем последний наиболее подходит для изучения звуков, издаваемых грудной клеткой при астме. Если происходит обострение, свист и характерные хрипы слышны по всей легочной поверхности, но при ремиссии свистящий хрип слышен снизу от лопаток и то только при усиленном вдохе. если в анализе крови отсутствуют признаки воспалительных процессов и токсинов, выделяемых бактериями, то при наличии астматических симптомов доктору легче отличить астму от обычного бронхита или пневмонии;
если в анализе крови отсутствуют признаки воспалительных процессов и токсинов, выделяемых бактериями, то при наличии астматических симптомов доктору легче отличить астму от обычного бронхита или пневмонии;