Персистирующая бронхиальная астма — многие месяцы, даже годы имеется постоянная симптоматика (визинг, тяжесть в грудной клетке, затрудненное дыхание и кашель) и ограничения в образе жизни. Для нее характерны малые периоды, когда отсутствуют симптомы или вообще нет ремиссий, есть хроническая патология дыхательных путей с большими вариациями данных дневной пикфлуометрии. Симптомы появляются в ответ на действие определенного фактора или даже без него. Необходим регулярный прием бета-2-АГ, нередко и ГКС.
Эпизодическая, интермиттирующая бронхиальная астма, — эпизоды приступов (обструкции бронхов или кашля) сменяются бессимптомными периодами, когда не требуется лечение. Симптомы могут повторяться (обычно ночью, рано утром) ежедневно, еженедельно, ежемесячно или ежегодно. Приступ может быть тяжелый и потребовать лечения в течение нескольких дней и даже недель. Эта форма более характерна для молодых лиц с атопией (например, аллергическим ринитом). Имеется полная обратимость обструкции бронхов, в период ремиссии нет обструкции дыхательных путей и симптоматики.
Хроническая бронхиальная астма (обычно тяжело протекающая, с частыми обострениями) — клинически эти лица имеют комбинацию симптомов БА (ОФВ1 менее 70%; ее ежегодное снижение 25— 38 мл) и ХОБЛ (поражение мелких дыхательных путей) с развитием ХДН и ХЛС (астматическая форма ХОБЛ).
Клиническая картина бронхиальной астмы складывается из следующих синдромов.
• Бронхообструктивный — удушье и визинг — шумное дыхание с наличием звуковых, дистанционных хрипов, связанных с дыханием, снижение ОФВ].
• Бронхопульмональный — кашель, выделение мокроты, боль в груди, одышка, интоксикация, гипоксия.
• Кардиопульмональный — тахикардия, повышение АД, легочная гипертензия, снижение УОС, на ЭКГ — нарушения сердечного ритма или синдромная коронарная патология.
• Аллергический — появление приступа удушья при контакте с известным аллергеном, положительные кожные скарификационные пробы, крапивница, кожный зуд, эозинофилия крови.
• Нервно-психический — развивается при длительной гипоксемии и гиперкапнии, проявляется респираторной энцефалопатией — варьирующей неврологической симптоматикой: головной болью, сонливостью, раздражительностью и даже агрессивностью, тремором, эйфорией, неадекватностью поведения.
При любом варианте течения бронхиальной астмы основные клинические симптомы одинаковые (но вариабельные, преходящие, обычно ухудшаются ночью и провоцируются триггерами). Чаще наблюдаются приступ экспираторного удушья, затрудненное и свистящее дыхание (визинг), спастический кашель или сочетание этих симптомов на фоне резкого снижения ПСВ; реже — тяжесть в грудной клетке, усиливающаяся при ФН. В развитии приступа БА можно условно выделить три периода: предвестников (иногда их нет) —> разгара —> обратного развития.
Предвестники могут появляться за несколько минут или часов до начала приступа. Так, при атопической бронхиальной астмы это могут быть обильное отделение слизистой мокроты, першение в горле, «песок» в глазах, вазомоторные реакции со стороны слизистой носа или зуд кожи вокруг носа; при эндогенной бронхиальной астмы — появление сухого, повторного и мучительного кашля, часто возникающего во сне, что будит больного. Приступ бронхиальной астмы может возникнуть в любое время, в любом месте. Причем у ряда лиц неожиданно, с необъяснимо выраженной обструкцией дыхательных путей вследствие бронхоспазма (внезапная асфиксическая бронхиальная астма).
В период приступа субъективные жалобы могут варьировать (меняется адаптация к бронхиальной астме). Так, они могут быстро исчезнуть, если больной своевременно вдохнет бета-2-АГ.
Для периода разгара приступа характерно внезапное появление экспираторного удушья («нельзя свободно» дышать), тяжести в грудной клетки («трудно проходит воздух» по дыхательным путям) чаще под утро, при вставании с постели (утренней подвижности) или в определенное время ночью (приступ-«будильник»). Ночное удушье часто обусловлено суточными колебаниями кортизола, катехоламинов в крови (максимальным снижением их уровней ночью) и максимальным уровнем гистамина в это время; повышением вагального тонуса; увеличением уровня аллергенов пера подушек, постельных клещей; накоплением мокроты за ночь; вдыханием фосфорорганических инсектицидов (которыми обрабатываются постель, мебель); прямой аспирацией или гастроэзофагеальным рефлюксом (за счет кислой стимуляции рецепторов нижних отделов пищевода, вызывающей бронхоконстрикцию).
Приступ бронхиальной астмы может за несколько минут достигнуть очень большой силы. Его можно классифицировать по степени тяжести как нетяжелый, среднетяжелый и тяжелый.
источник
Ежегодно в первый вторник мая проводится День борьбы с бронхиальной астмой, который учредила ВОЗ в целях привлечения внимания к этому заболеванию, повышению осведомленности населения и улучшению терапии.
По оценкам ВОЗ, в настоящее время от бронхиальной астмы (БА) страдают 235 млн человек. Бронхиальная астма является самым распространенным хроническим заболеванием среди детей [1]
Бронхиальная астма — это гетерогенное заболевание, которое характеризуется хроническим воспалением дыхательных путей и диагностируется при наличии респираторных симптомов свистящего дыхания (визинга), одышки, стеснения в груди или кашля, различных по длительности и интенсивности, в сочетании с обратимой обструкцией дыхательных путей [1].
У людей с бронхиальной астмой симптомы могут наблюдаться несколько раз в день или в неделю, у некоторых — приступы возникают во время физической активности или ночью. Во время приступа эпителий бронхиол разбухает, что приводит к сужению дыхательных путей и сокращению воздушного потока, поступающего в легкие и выходящего из них. Повторяющиеся приступы часто приводят к бессоннице, дневной усталости, сниженному уровню активности, а также являются причиной пропусков школьных занятий и невыхода на работу. Коэффициент смертности при бронхиальной астме относительно низкий по сравнению с показателем при других хронических заболеваниях, однако она может привести к летальному исходу, если не принимать надлежащих лекарств или не соблюдать врачебных предписаний [1].
Основополагающие причины бронхиальной астмы полностью не выяснены. Самыми значительными факторами риска развития заболевания являются генетическая предрасположенность в сочетании с вдыхаемыми веществами и частичками, которые находятся в окружающей среде и могут провоцировать аллергические реакции или раздражать воздушные пути. Провоцировать бронхиальную астму могут следующие факторы:
– аллергены внутри помещений (например, клещи домашней пыли в постельных – принадлежностях, коврах и мягкой мебели, загрязнение воздуха и перхоть животных);
– аллергены вне помещений (такие как цветочная пыльца и плесень);
– химические раздражающие вещества на рабочих местах;
Другие провоцирующие факторы включают вдыхание холодного воздуха, крайнее эмоциональное возбуждение (гнев, страх), выполнение физических упражнений, применение лекарственных средств (НПВП, бета-блокаторы) [1].
Несмотря на то что бронхиальную астму нельзя полностью излечить, ее течение можно и нужно контролировать с помощью лекарственных средств. Надлежащее ведение пациентов позволяет держать болезнь под контролем и улучшить качество их жизни [1].
Целью лечения бронхиальной астмы независимо от возраста пациента является достижение контроля и управление заболеванием. Для этого необходимо полностью устранить или существенно уменьшить выраженность симптомов, достичь лучших показателей функции внешнего дыхания, уменьшить количество и снизить тяжесть обострений, оптимизировать терапию болезни и ее осложнений, а также сопутствующих заболеваний, рационально использовать лекарственные средства [2].
Лечение бронхиальной астмы можно проводить с применением ингаляционного, перорального или инъекционного 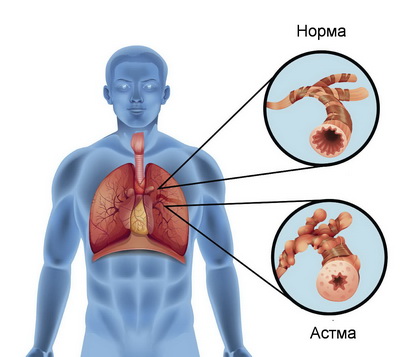
Для того, чтобы выработать единый подход к диагностике и лечению бронхиальной астмы, были созданы несколько важных международных рекомендаций. В частности, Глобальная инициатива по лечению и профилактике бронхиальной астмы (GINA) — это документ, определяющий направление диагностики, лечения и профилактики бронхиальной астмы, основанный на новейших достижениях в области медицины, фармакологии и молекулярной биологии [2]. Изначальный тезис GINA: чем тяжелее форма бронхиальной астмы, тем выше должна быть доза ингаляционного глюкокортикоида (ИГК), а для достижения наиболее оптимального контроля необходимо добавлять лекарства других классов (длительно действующие β2-агонисты (ДДБА), лейкотриеновые антагонисты, ингибиторы фосфодиэстеразы, анти-IgE-препараты, теофиллины длительного высвобождения, пероральные противоаллергические средства) [3].
Часто бронхиальная астма начинается в раннем возрасте. Характерные признаки заболевания у детей 5 лет и младше: кашель, визинг, затрудненное дыхание или одышка, снижение активности, положительный эффект от пробного лечения ИГК и β2-агонистами короткого действия (КДБА) в низких дозах [2].
В GINА-2014 было введено такое понятие, как «краткосрочная step-up-терапия» на 1–2 нед, например, при вирусной инфекции или экспозиции аллергенов. Данное изменение плана лечения позволяет усилить противовоспалительную терапию и снизить риск обострения заболевания при возникновении острой респираторной инфекции. В настоящее время в клинической практике широко используют введение ИГК в высоких дозах через небулайзер в сочетании с небулированными формами КДБА при возникновении обструкции на фоне респираторной вирусной инфекции.
Согласно схеме, приведенной в GINA-2015 для детей младше 5 лет, из терапии полностью исключены кромоны в связи с их недостаточной эффективностью, но имеющие хороший профиль безопасности. ДДБА в комбинации с ИГК также исключены в связи с отсутствием в настоящее время достаточной доказательной базы в отношении безопасности их применения в этой возрастной группе.
На первой ступени следует использовать по требованию КДБА, на второй — ежедневно ИГК в низких дозах или антагонисты лейкотриеновых рецепторов (АЛТР), на третьей — ИГК в двойной низкой дозе или сочетание ИГК в низких дозах с АЛТР, на четвертой — ИГК в повышенных дозах.
Международные согласительные документы утверждают, что у детей младшей возрастной группы, как и у старших детей, ИГК в индивидуально подобранных дозах безопасны и потенциальный риск побочного действия обоснован их клинической эффективностью. В то же время согласно рекомендациям Британского торакального общества (British Thoracic Society, BTS), АЛТР можно назначать как альтернативу ИГК или в качестве добавочной терапии тем детям, которые не полностью ответили на лечение ИГК [2].
Бронхиальная астма является самым распространенным заболеванием легочной системы у женщин в период беременности, частота которого в мире колеблется от 1 до 4% [4].
Беременность по-разному влияет на течение бронхиальной астмы. Изменения течения заболевания колеблются в довольно широких пределах: улучшение отмечают в 18–69% случаев, ухудшение — в 22–44%, отсутствие влияния беременности на течение бронхиальной астмы — в 27–43%. Это объясняется, с одной стороны, разнонаправленной динамикой у больных с различной степенью тяжести заболевания (при легкой и средней степени тяжести ухудшение течения БА наблюдают в 15–22%, улучшение — в 12–22% случаев), с другой — недостаточной диагностикой и не всегда правильной терапией. На практике бронхиальная астма достаточно часто диагностируют лишь на поздних стадиях заболевания. Кроме того, если ее начало совпадает с гестационным периодом, то заболевание может остаться нераспознанным, поскольку наблюдающиеся при этом нарушения дыхания часто относят к изменениям, обусловленным беременностью.
В то же время при адекватной терапии бронхиальной астмы риск неблагоприятного исхода беременности и родов не выше, чем у здоровых женщин, в связи с чем бронхиальную астму обычно не рассматривают как противопоказание к беременности, а контроль за ее течением рекомендуют обеспечивать с помощью современных методов лечения.
Принципиальные подходы к фармакотерапии бронхиальной астмы у беременных те же, что и у небеременных пациенток. Для базисной терапии бронхиальной астмы легкого течения можно использовать монтелукаст (представитель АЛТР), при среднетяжелом и тяжелом течении заболевания предпочтительно применять ИГК [4].
Чем старше пациент, тем труднее диагностировать астму, так как клинические проявления заболевания носят стертый характер в силу ряда особенностей, присущих людям пожилого и преклонного возраста (возрастные морфологические и функциональные изменения органов дыхания, множественность патологических синдромов, стертость и неспецифичность проявлений болезней, трудности при обследовании пациентов, истощение адаптационных механизмов организма).
В свою очередь, течение бронхиальной астмы (как, впрочем, и большинства болезней в пожилом возрасте) при отсутствии своевременно начатого лечения характеризуется быстрым ухудшением состояния, частым развитием осложнений, вызванных как болезнью, так (нередко) и проводимым лечением. Поэтому выбор препаратов требует особого подхода.
Большинству больных пожилого возраста с бронхиальной астмой показана комплексная индивидуально подобранная базисная медикаментозная терапия, включающая противовоспалительные и бронхоспазмолитические средства. В качестве препаратов для долговременного контроля астмы предпочтение следует отдавать ИГК. В период обострения астмы больных пожилого возраста целесообразнее переводить на применение бронхоспазмолитиков через небулайзер.
Для достижения контроля бронхиальной астмы у лиц пожилого возраста важно обеспечить не только больного, но и его родственников и близких (что особенно важно) необходимой информацией о болезни, способах ее контроля в домашних условиях, правилах пользования лекарственными средствами, в том числе ингаляторами [5].
В заключение следует отметить, что лекарства не являются единственным способом лечения бронхиальной астмы для пациентов всех групп — важно избегать контактов с веществами, провоцирующими заболевание. При медицинской поддержке каждый пациент с бронхиальной астмой должен знать, каких провоцирующих веществ должен избегать именно он [1].
Подготовила Александра Демецкая, канд. биол. наук
- Астма. Информационный бюллетень ВОЗ № 307. — Май 2011 г.
- Новик Г.А., Халева Е.Г. Современные подходы к базисной терапии бронхиальной астмы у детей раннего возраста. Роль и место антилейкотриеновых препаратов // Лечащий врач. — 2015; 12.
- Ходош Э.М. Бронхиальная астма: эволюция взглядов в аспекте GINA // Therapia. Український медичний вісник. — 2008; 7–8 (28).
- Игнатова Г.Л., Антонов В.Н. Бронхиальная астма у беременных // РМЖ. — 2015; 4:. 224.
- Палеев Н.Р., Черейская Н.К. Бронхиальная астма у пожилых: особенности течения, дифференциальный диагноз, лечение // Врач. — 2005; 10: 8–13.
источник
Персистирующее течение бронхиальной астмы относится к самой распространенной форме заболевания.
Астматические заболевания классифицируются по частоте развития симптоматики и тяжести течения. Для выяснения степени заболевания проводится анализ действия лекарственных препаратов кратковременного воздействия и объем форсированного выдоха.
Персистирующая форма астматического заболевания, в зависимости от тяжести проявлений разделяется на 4 степени, развитие которых определяется в зависимости от симптоматики. Такое распределение наиболее удобно и позволяет точно провести диагностику и нейтрализовать негативное воздействие.
- К первой степени относится легкая форма интермиттирующей астмы. Она сопровождается одышкой, хрипотой и кашлем. Такая симптоматика проявляется 1 раз в неделю. Ночью приступ возникает не чаще, чем 4 раза в квартал. Межприступный период характеризуется отсутствием симптомов. Показатели работы легочной системы в норме.
- Во второй степени бронхиальной астмы с персистирующим течением, симптоматика заболевания может появляться 2 раза в течение месяца. Ночью приступы почти не возникают. При этой стадии развития астмы нарушается естественная активность пациента. Отмечается постепенное нарастание легочной недостаточности.
- К третьей степени заболевания относится астма средней тяжести. Симптомы заболевания проявляются практически ежедневно, сопровождаясь сильными приступами. В этот период времени пациент вынужден ежедневно принимать бета г-адреномиметики краткого воздействия. Приступы нарушают привычный образ жизни больного, нарушая ночной сон и препятствуя выздоровлению.
- Четвертое место занимает наиболее осложненная форма бронхиальной астмы. При этой стадии отмечается постоянная боль, повторы приступов удушья и мучительный непродуктивный кашель. Пациент страдает от бессонницы, в связи с чем, нарушается биологический жизненный ритм. Эта форма заболевания требует обязательной госпитализации с дальнейшей терапией в стационарных условиях.
Следует отметить, что определить степень тяжести астматического заболевания, основываясь на симптомы, можно до начала первых лечебных процедур. В противном случае необходимо учитывать интенсивность проводимой терапии.
Персистирующая бронхиальная астма, как правило, носит эпизодическое течение и характеризуется кратковременными приступами, а также их отсутствием в промежутке между обострениями.
Астма характеризуется нарастающим обострением симптоматики и снижением активности используемых бронхорасширяющих средств. Тяжелое течение бронхиальной астмы иногда способно привести к гипоксии.
Нестабильное развитие заболевания отмечается у пациентов с характерными лечебными мероприятиями. Однако и среди таких больных возможно неадекватное течение бронхиальной астмы, сопровождающееся развитием острыми приступами с возможными осложнениями. Таким примером является аспириновая астма, которая развивается в ответ на прием НПВП.
Бронхиальная астма переходит в хроническое течение в случаях, когда болезни невозможно контролировать с помощью ингаляций и возникает острая необходимость в применении системных стероидных препаратов.
Присутствие бронхиальной симптоматики в легкой или средней степени заболевания может быть связано с рядом провоцирующих факторов, среди которых могут быть физические нагрузки и непосредственное контактирование с аллергеном.
Чаще всего бронхиальная астма сопровождается следующими проявлениями:
- клокотание в грудной области и хрипы;
- мучительный кашель с минимальным количеством мокроты;
- невозможность нормальной дыхательной функции;
- присутствие сдавливания в области груди.
При нарастании симптоматики течение заболевания осложняется и требует проведения экстренных медицинских мероприятий.
Риск появления персистирующей астмы обусловлен следующими причинами:
- генетическая предрасположенность;
- превышение иммуноглобулиновых тел в организме;
- курение любой формы;
- ОРВИ;
- деятельность, связанная с вредными производствами;
- избыточная масса тела.
Персистирующее развитие астмы способно развиться в результате многих факторов. Немаловажное значение имеет уровень гормонов в организме и наличие хронических инфекционных очагов. Поэтому необходимо своевременное лечение сопутствующих заболеваний во избежание обострений бронхиальной астмы.
Как правило, атопическая бронхиальная астма развивается у детей младше 10 лет. У детей младше 5 лет диагностика выполняется при помощи бронхографии.
Наиболее вероятными причинами заболевания у детей являются:
- генетическая наследственность, особенно со стороны матери;
- аллергическая реакция на лекарственные средства, продукты питания;
- наличие в анамнезе ребенка диатеза;
- легкое проявление обструктивного синдрома во время ОРВИ, так как у детей респираторно вирусные инфекции способны наиболее часто спровоцировать бронхиальную астму с непродуктивным приступообразным кашлем;
- у детей часто может встречаться астматический синдром при физической нагрузке (астма физического усилия), поэтому появление сильной одышки после физических упражнений должно насторожить родителей.
При любой тяжести заболевания у пациентов могут возникнуть осложнения: от легких до угрожающих жизни. На начальном этапе заболевания они могут протекать бессимптомно. Это развитие бронхиальной астмы у детей раннего возраста наиболее опасно.
Важно отметить, что у большинства детей к моменту полового созревания бронхиальная симптоматика может исчезнуть. Однако в 205 случаев у детей, страдающих от персистирующей астмы в раннем возрасте, возможны рецидивы в зрелом возрасте. У детей, страдающих «аспириновой астмой», шансов на выздоровление гораздо меньше.
При тяжести бронхиальной астмы выясняется подробный анамнез у пациента на наличие такой симптоматики, как свистящее и шумное дыхание, ночной кашель и т.д.
Визуальное диагностирование при кратковременных улучшениях не выявляет характерной для астмы симптоматики. Аускультация при развитии приступа определяет длительность выдоха и свистящее дыхание. При тяжелом приступе астмы наблюдается цианоз и вовлечение в дыхательную деятельность дополнительных грудных мышц. Астматическое заболевание необходимо различать с сердечной недостаточностью, для которой характерны сердечные шумы.
К главному диагностическому способу определения заболевания относится спирометрия, которая выявляет дыхательную функциональность. Кроме того, при отсутствии явных симптомов рекомендуется провести провокацию с гистамином, а также проверить реакцию при физической нагрузке.
- исследование анализа крови на выявление эозинофильного числа;
- выявление иммуноглобулина группы Е ;
- проведение кожных аллергологических проб.
Кроме того, для исключения пневмонии и возникновения хронических обструктивных бронхитов, назначается рентгенография грудной клетки.
Все виды астматических заболеваний, в том числе атопическая астма, предусматривают пятиступенчатую терапию:
- 1 — кратковременные приступы заболевания требуют применения лейкотриенового модификатора;
- 2 – в легкой персистирующей форме рекомендовано добавлять ингаляционную кортикостероидную терапию;
- 3 – среднетяжелая персистирующая стадия заболевания требует дополнительного приема агонистов длительного воздействия;
- 4 и 5 ступени тяжелой формы бронхиальной астмы предусматривают перорального употребления кортикостероидов.
В том случае, когда течение бронхиальной астмы поддается лечению, все мероприятия возвращаются на предыдущую степень.
При лечении астмы чаще всего назначаются кортикостероиды в ингаляциях. К ним относятся, Тафен Новолайзер, Фликсотид, Бекотид, Кленил и др. Ингалятор снимает симптоматику в зависимости от тяжести заболевания, улучшая работу легочной системы, устраняя бронхоспазмы. Кроме того, ингаляторы позволяют предотвратить развитие приступа при физических нагрузках, улучшая общее самочувствие пациента.
К вспомогательным средствам можно отнести антилейкотриены (Зафирлукаст, Монтелукаст). Эти средства позволяют снизить ингаляционные дозы глюкокортикостероидов, что позволяет избежать побочных проявлений. Кроме того, снизить частоту приемов и дозировку возможно с помощью Формотерола, Форадила, Аэролайзера и т.д.
При средней тяжести заболевания может назначаться Теофиллин, обладающий медленным высвобождением. Его используют через 4 часа после применения кортикостероидов, которые оказали желаемого результата при монотерапии.
Кромоны (кортикостероиды), в самостоятельном лечении используются достаточно редко. Они могут вызвать ряд побочных явлений. В особо тяжелых случаях иногда назначаются рекомбинантные антигены( Ксолар, Омализумар и т.д.). Фармакологическое влияние этих лекарств изучено недостаточно, однако многочисленные исследования указывают на снижение бронхиальной симптоматики при их употреблении.
Необходимо помнить, что любые лечебные мероприятия могут назначаться только высококвалифицированным специалистом в индивидуальном порядке. Особенно осторожно подбирается тактика лечения в отношении детей.
Астма, в том числе атопическая, способствует ухудшению дыхания, усиливает нагрузку на бронхиальную систему.
-
- Результатом продолжительного заболевания может быть эмфизема легких, хроническое развитие бронхита и нарастание соединительных тканей;
- помимо этого, образующиеся застойные процессы в легочной системе способны ухудшить работу сердечно-сосудистой системы, а инфекционный путь развития бронхиальной астмы повышает риски развития серьезных осложнений;
- длительный приступ способен проявиться пневмотораксами, а также попаданием воздуха в легочную область во время его разрыва, что требует немедленной госпитализации больного;
- неправильно выполненное лечение провоцирует тяжелое течение астмы и возникновение астматического статуса. Он протекает с максимальным сужением бронхиальной области и возникновением слизистых пробок, которые препятствуют нормальному воздухообмену.
Необходимо учитывать, что экстренная госпитализация требуется при развитии некоторых симптомов средней тяжести, которые выражаются следующими проявлениями:
увеличение сердечного сокращения (больше 100 ударов в минуту);
- аритмии;
- появление частоты дыхания от 25 ударов за минуту;
- возникновение экспираторной формы одышки;
- шумное дыхание и свистящие хрипы.
Кроме того, любое ухудшение состояния больного с нехарактерной симптоматикой также требует срочного медицинского вмешательства.
Профилактические мероприятия по предотвращению персистирующей бронхиальной астмы предусматривают следующие мероприятия:
- в первую очередь необходимо устранить контакт с аллергеном, который спровоцировал приступ;
- необходимо тщательно выбирать профессию — с ограничением негативного воздействия внешних факторов;
- важно проводить все необходимые вакцинации, в соответствии с прививочным календарем;
- необходимо соблюдать специальную диету, избегая жирной, соленой, сладкой и высококалорийной пищи.
Важно отметить, что регулярное и своевременно проведенное лечение, в зависимости от тяжести воспалительного процесса, способно предотвратить серьезные осложнения и привести к быстрейшему выздоровлению.
источник
Современные подходы к базисной терапии бронхиальной астмы у детей раннего возраста. Роль и место антилейкотриеновых препаратов
Противовоспалительные препараты — основа патогенетического лечения бронхиальной астмы. Цель этого обзора обобщить клинический опыт и знания об ингаляционных глюкокортикостероидах и антилейкотриеновых препаратах, рассмотреть их показания и эффективность на
Anti-inflammatory drugs are the basis for pathogenic treatment of bronchial asthma. Purpose of this review is to summarize the clinical experience and knowledge about inhaled corticosteroids and leukotriene receptor antagonists, discuss their indication to prescription and effectiveness of application in children.
Бронхиальная астма (БА) — это наиболее частое хроническое заболевание детского возраста и одна из основных причин детской смертности от хронических заболеваний. Обострение БА является частой причиной пропусков школы, поступления в отделение интенсивной терапии и госпитализации [1].
Для того чтобы выработать единый подход к диагностике и лечению БА, были созданы несколько важных международных рекомендаций: Национальная программа по обучению и профилактике бронхиальной астмы (NAEPP), Британское руководство по лечению астмы, Международный консенсус по астме у детей (ICON), Глобальная инициатива по лечению и профилактике бронхиальной астмы (GINA). GINA — это важный документ, определяющий дальнейшее направление диагностики, лечения и профилактики бронхиальной астмы, основанный на новейших достижениях в области медицины, фармакологии и молекулярной биологии. Многие национальные рекомендации, в том числе и рекомендации Союза педиатров России, практически полностью базируются на принципах Глобальной стратегии лечения и профилактики бронхиальной астмы.
Согласно новому определению, бронхиальная астма — это гетерогенное заболевание, которое характеризуется хроническим воспалением дыхательных путей и диагностируется по респираторным симптомам свистящего дыхания (визинга), одышки, стеснения в груди или кашля, вариабельных по длительности и интенсивности, в сочетании с обратимой обструкцией дыхательных путей. Диагностика БА должна основываться на анамнезе и характерной симптоматике, особенно это актуально для детей раннего возраста, а также на доказательстве обратимой обструкции дыхательных путей по тесту с бронходилататором или по другим тестам. Постановка тестов, подтверждающих диагноз БА, рекомендована до начала базисного лечения. Следует учесть, что на фоне базисной терапии, иногда достаточно длительной, не удается подтвердить обратимость и наличие скрытого бронхоспазма. Это не значит, что у больного нет БА. Если невозможно подтвердить диагноз БА с помощью теста с бронходилататором, то необходимо снова повторить этот тест позже или начать проводить пробное лечение для исключения или подтверждения диагноза БА. Назначение пробного базисного лечения может значительно облегчить диагностику и выбор дальнейшей тактики лечения.
Оценивая уровень контроля, БА подразделяют на хорошо контролируемую, частично контролируемую и плохо контролируемую. Критерии остались такие же, как в предыдущем издании GINA, — наличие дневных симптомов более чем 2 раза в неделю, ночные пробуждения из-за астмы, прием препаратов неотложной помощи более чем 2 раза в неделю и наличие любых нарушений деятельности вследствие БА. Однако оценка объема форсированного выдоха за первую секунду (ОФВ1) отнесена к факторам риска для неблагоприятного прогноза. Тяжесть БА оценивается ретроспективно по уровню терапии, необходимой для контроля симптомов и обострений.
У многих пациентов БА начинается в раннем возрасте. В GINA-2015 акцентируется внимание на наличии у детей младше 5 лет трех паттернов свистящего дыхания (рис. 1). Первая группа детей — это дети с такими характерными симптомами, как кашель, затрудненное дыхание и визинг, которые длятся менее 10 дней в течение инфекции верхних дыхательных путей (ВДП), повторяются 2–3 раза в год, и данные симптомы отсутствуют между эпизодами затрудненного дыхания и/или визинга. Следующая группа включает пациентов, у которых длительность симптомов увеличена (> 10 дней в течение инфекции ВДП), частота эпизодов > 3 в год или тяжелые эпизоды и/или ночные ухудшения, между эпизодами ребенок может иметь редкий кашель, визинг или затрудненное дыхание. И третий паттерн — то же самое, как и в предыдущем случае, плюс отягощенная наследственность по атопии, или у ребенка уже есть проявления той или иной аллергической патологии. Характерные признаки БА у детей 5 лет и младше: кашель, визинг, затрудненное дыхание или одышка, снижение активности, положительный эффект от пробного лечения низкими дозами ингаляционными глюкокортикостероидами (иГКС) и бета-2-агонистами короткого действия (КДБА) (табл. 1).
Круг дифференциальной диагностики бронхиальной астмы у детей младшего возраста широк и требует тщательного сбора анамнеза и проведения дополнительных тестов. При наличии у ребенка младшего возраста кашля и визинга необходимо исключить рецидивирующие инфекции нижних дыхательных путей (НДП), бронхолегочную дисплазию, аномалии развития трахеи и бронхов, врожденные пороки сердца, гастроэзофагеальный рефлюкс, инородное тело, туберкулез, врожденные и наследственные заболевания, муковисцидоз, гипотиреоз, узелковый периартериит, объемные процессы в грудной клетке и целый ряд более редко встречающихся заболеваний (табл. 2).
Главная цель терапии больных бронхиальной астмой — это достижение контроля и управление бронхиальной астмой. Согласно схеме, приведенной в GINA-2015 для детей младше 5 лет, из терапии полностью исключены кромоны в связи с недостаточной эффективностью, но имеющие хороший профиль безопасности. Длительно действующие бета-2-агонисты (ДДБА) в комбинации с иГКС также исключены в связи с отсутствием в настоящее время достаточной доказательной базы по безопасности их использования в этой возрастной группе. На первой ступени следует использовать по требованию КДБА. На второй ступени — ежедневные низкие дозы иГКС или антагонистов лейкотриеновых рецепторов (АЛТР). Двигаясь step-up, на третьей ступени — двойная низкая доза иГКС или сочетание низких доз иГКС с АЛТР. И на четвертой ступени — увеличение дозы иГКС (рис. 2). В GINА-2014 года было введено такое понятие, как краткосрочная step-up-терапия на 1–2 недели, например, при вирусной инфекции или экспозиции аллергенов. Данное изменение плана лечения позволяет усилить противовоспалительную терапию (добавив к получаемым иГКС антилейкотриеновые препараты или назначить препарат из этой группы «наивным» больным астмой) и уменьшить риск обострения заболевания при возникновении острой респираторной инфекции.
Создание и широкое использование в первую очередь иГКС существенно повлияло на возможности достижения контроля течения астмы. иГКС, обладая мощным противовоспалительным действием, воздействуют на основные механизмы формирования БА. Но, несмотря на использование иГКС, у части больных все же не удается достигнуть контроля над течением заболевания. И данное обстоятельство диктует необходимость использовать в лечении БА препараты, относящиеся к другим фармакологическим группам. За последние 50 лет разрешены к использованию в лечении БА у детей только две новые группы препаратов: антилейкотриеновые препараты и анти-IgE-антитела.
В настоящее время в клинической практике широко используют высокие дозы иГКС через небулайзер в сочетании с небулированными формами КДБА при появлении обструкции на фоне респираторной вирусной инфекции. Помимо купирования бронхообструкции при вирус-индуцированном визинге предполагается получение и протективного эффекта иГКС для предотвращения последующих рецидивов визинга. Так, при рецидивирующих эпизодах острого визинга лечение высокими дозами иГКС (1600–2000 мкг/день по беклометазону, разделенной на 4 приема/день, 5–10 дней с начала вирусной респираторной инфекции или ухудшении астмы) ассоциировалось с некоторым улучшением клиники у новорожденных и маленьких детей [2–4]. По результатам других исследований данная тактика не привела к изменению эволюции формирования БА у детей из группы риска по аллергическим заболеваниям. Было проведено трехлетнее наблюдение за 301 новорожденным, получавшим будесонид 400 мкг/день или плацебо после первого эпизода визинга в течение 2 недель начиная с третьего дня каждого эпизода визинга. В результате не было получено различий в количестве бессимптомных дней или в необходимости назначения оральных кортикостероидов (ОКС) как в группе получавших иГКС, так и в группе плацебо [5].
В исследовании MIST изучали назначение иГКС при инфекции респираторного тракта у дошкольников с рецидивирующим визингом, риском развития БА и эпизодами визинга [6]. Сравнивался ежедневный прием низких доз будесонида в ингаляциях и эпизодический прием высоких доз будесонида в ингаляциях на ночь в течение 7 дней. Был получен одинаковый эффект при регулярном и эпизодическом приеме иГКС. Выбор схемы назначения иГКС (регулярный, интермиттирующий и режим по потребности) у детей с визингом в клинической практике до сих пор является предметом дискуссий.
Большинство исследований, оценивающих системные эффекты иГКС, брали за основу результаты, полученные у детей старше 5 лет. Международные согласительные документы утверждают, что у детей младшей возрастной группы, как и у старших детей, индивидуально подобранные дозы иГКС безопасны и потенциальный риск побочного действия обоснован их клинической эффективностью [7–9]. В целом низкие дозы иГКС не ассоциировались с любыми серьезными побочными системными эффектами в клинических исследованиях, поэтому эта терапия рассматривается как безопасная [3, 8–17]. Хотя существуют данные, указывающие на то, что высокие дозы ассоциировались с заметными системными эффектами (темповая задержка роста и влияние на гипоталамо-гипофизарно-надпочечниковую систему) даже в первый год терапии [3, 7–17]. Эти эффекты такие же, как и в исследованиях, проведенных у старших детей. Влияние на рост было накопительное при продолжении длительного лечения [18–20]. Дети, которые находились на лечении флутиказоном пропионатом в течение двух лет в возрасте двух или трех лет [7], догнали в росте своих сверстников через два года после прекращения терапии иГКС. Ретроспективный анализ показал, что у детей младше двух лет и при весе
Г. А. Новик 1 , доктор медицинских наук, профессор
Е. Г. Халева
ГБОУ ВПО СПбГПМУ МЗ РФ, Санкт-Петербург
источник
Опубликовано в журнале:
«ПРАКТИКА ПЕДИАТРА»; март-аперль; 2015; стр. 42-49.
С.Э. Цыпленкова, к. м. н., врач-пульмонолог, Обособленное структурное подразделение Научно-исследовательский клинический институт педиатрии ГОУ ВПО РНИМУ им. Н.И. Пирогова Минздрава РФ, г. Москва
Бронхиальная астма (БА) остается серьезной общемировой проблемой. Повсеместно люди всех возрастов страдают этим хроническим заболеванием дыхательных путей, которое при недостаточно эффективном лечении значительно ограничивает повседневную жизнь пациентов и даже приводит к смерти. Распространенность БА, особенно среди детей, неуклонно возрастает, что связывают как с ухудшением экологической ситуации, так и с более совершенной диагностикой. БА наносит значительный ущерб, связанный не только с затратами на лечение, но также с потерей трудоспособности и ограничением социальной активности.
Ключевые слова: бронхиальная астма, Глобальная стратегия лечения и профилактики бронхиальной астмы, уровни контроля, принципы самоконтроля, синдром сочетания бронхиальной астмы и хронической обструктивной болезни легких (ХОБЛ).
Key words: bronchial asthma, Global Initiative for Asthma (GINA), control levels, the principles of self-control, syndrome the combination of bronchial asthma and chronic obstructive pulmonary disease (ACOS).
На протяжении последних десятилетий представления о БА радикально изменились, появились новые возможности для ее своевременной диагностики и эффективного лечения. Однако многообразие систем здравоохранения в разных странах и различия в доступности препаратов для лечения БА обусловили потребность в адаптации наиболее эффективных и экономически оправданных рекомендаций по лечению БА к локальным условиям во всем мире. В связи с этим в 1993 году Национальный институт сердца, легких и крови (NIHLB, США) совместно со Всемирной организацией здравоохранения (WHO, ВОЗ) создал рабочую группу, результатом деятельности которой явился доклад «Глобальная стратегия лечения и профилактики бронхиальной астмы» (Global Initiative for Asthma, GINA (англ.)), чтобы обеспечить внедрение результатов современных научных исследований в стандарты лечения БА. Однако, несмотря на все меры по распространению рекомендаций GINA, многократно обновленных с тех пор, и наличие эффективных препаратов, данные международных исследований свидетельствуют о низком уровне контроля над БА во многих странах. В связи с этим в 2014 году появилась новая редакция GINA. В нижеприведенном обзоре этого документа уделено внимание основным позициям, претерпевшим принципиальные изменения со времени предыдущей редакции GINA.
Следует отметить, что GINA-2014, в отличие от прежних вариантов, является справочником для реальной клинической практики, основанным на принципах доказательной медицины, стандартизированных результатах лечения и профилактики БА, предназначенным для стран с разным уровнем развития.
Что же на сегодняшний день известно о бронхиальной астме? Прежде всего, БА — это хроническое заболевание, которое можно контролировать, но нельзя вылечить. БА — это гетерогенное заболевание, характеризующееся хроническим воспалением дыхательных путей. Характерные симптомы БА — свистящие хрипы, или визинг (от англ. wheezing), одышка, затруднение дыхания, чувство заложенности в груди, кашель, различные по времени появления, частоте и интенсивности, — связаны с вариабельным ограничением экспираторного (выдыхаемого) потока воздуха. Симптомы бронхиальной обструкции, обусловленные при БА бронхоспазмом, утолщением стенки дыхательных путей и увеличением количества слизи в просвете, могут появляться или усиливаться в ответ на вирусные инфекции, аллергены, курение, физическую нагрузку и стресс.
При первичном выявлении типичных для БА симптомов, согласно рекомендациям экспертов, необходимо провести детальный сбор анамнеза, клиническое обследование, спирометрию (или пикфлоуметрию) с тестом на выявление бронхиальной обратимости; при подтверждении диагноза БА показано назначение соответствующего лечения. В ходе обследования может быть верифицирован альтернативный диагноз и назначено пробное лечение предполагаемого заболевания. При нетипичной картине БА проводится тщательное дообследование, при невозможности подтверждения диагноза БА и исключении альтернативных диагнозов предлагается проведение эмпирической терапии ингаляционными глюкокортикостероидами (ИГКС) и коротко действующими бета-2-агонистами (КДБА) по потребности с оценкой эффекта через 1-2 месяца.
В ходе лечения БА рекомендуют регулярно проводить динамическую оценку эффективности терапии БА, которая складывается из показателей контроля симптомов за последние 4 недели и выявления факторов риска неблагоприятного прогноза БА, к которым относят в числе прочих низкие показатели функции дыхания. Контроль лечения БА также включает в себя проверку техники ингаляции и приверженности к лечению, выявление побочного действия препаратов, составление письменного плана действий для пациента после выяснения предпочтений и целей пациента в лечении БА.
Наличие дневных симптомов БА более 2 раз в неделю, ночных симптомов (пробуждения из-за БА); потребность в препаратах, купирующих приступы удушья, более 2 раз в неделю и ограничение активности из-за БА в совокупности определяют уровень контроля БА: при отсутствии симптомов диагностируется контролируемая БА; частично контролируемая БА предполагает наличие 1-2 признаков, неконтролируемая БА — 3-4 признаков. Следует отметить, что в GINA-2014 показатели ФВД исключены из оценки уровня контроля БА, их рекомендуют использовать при оценке факторов риска неблагоприятного прогноза.
Необходимо учитывать, что такие сопутствующие заболевания, как хронический риносинусит, гастроэзофагеальная рефлюксная болезнь (ГЭРБ), ожирение, синдром обструктивного апноэ сна, депрессия, тревожные расстройства, всегда вносят вклад в симптоматику БА и ведут к снижению качества жизни, что требует соответствующих корректив в плане лечения таких пациентов.
Тяжесть БА в GINA-2014 рекомендуют оценивать ретроспективно (обычно после нескольких месяцев базисного лечения) исходя из объема терапии, необходимой для контроля над симптомами БА и ее обострениями. Особо подчеркивается, что степень тяжести БА непостоянна: она может изменяться с течением времени и в том числе под воздействием новых методов терапии.
Так, при легкой БА для пациентов с редкими симптомами (менее 2 раз в месяц) без сопутствующих факторов риска возникновения обострений на первой ступени терапии для купирования симптомов астмы рекомендуют коротко действующие бета-2-агонисты (КДБА), однако пока накоплено мало данных о безопасности монотерапии КДБА. Пациентам с легкой БА и высоким риском обострений показан регулярный прием низких доз ИГКС с КДБА по потребности (вторая ступень терапии), поскольку было показано, что низкие дозы ИГКС при легкой БА уменьшают симптомы и снижают риск обострений, госпитализаций и летальных исходов. В качестве альтернативы, особенно у пациентов с сопутствующим аллергическим ринитом или при отказе от лечения ИГКС, при легкой БА могут использоваться антагонисты лейкотриеновых рецепторов (АЛТР) или низкие дозы теофиллинов с КДБА по потребности. Однако в клинических исследованиях эффективность АЛТР и теофиллинов была достоверно ниже, чем при лечении низкими дозами ИГКС. При сезонных обострениях БА и отсутствии симптомов в межсезонье рекомендуют интермиттирующие курсы ИГКС и КДБА по потребности, причем предлагается начинать прием ИГКС сразу же при появлении первых симптомов и продолжать лечение еще 4 недели после окончания сезона цветения. Обращается внимание, что на каждом этапе перед принятием решения об увеличении объема терапии обязательна проверка техники ингаляции и приверженности лечению.
На третьей ступени терапии рекомендуется прием низких доз ИГКС в сочетании с ДДБА и КДБА по потребности (или низкие дозы будесонида/беклометазона + формотерол по потребности). Доказано, что такая терапия способствует уменьшению симптоматики и улучшению легочной функции, но при этом существенно не влияет на частоту обострений и довольно дорога. В то же время ДДБА уменьшают симптомы, снижают риск обострений, увеличивают ОФВ1 и позволяют уменьшить дозу ИГКС. Менее эффективной альтернативой является увеличение дозы ИГКС (до средних или высоких) или добавление АЛТР (или теофиллинов) к низким дозам ИГКС.
На четвертой ступени терапии используется комбинация средних или высоких доз ИГКС и ДДБА и КДБА по потребности (или по потребности низкие дозы ИГКС/формотерол); альтернативным является назначение высоких доз ИГКС в сочетании с АЛТР или низкими дозами теофиллинов (и КДБА или низкие дозы ИГКС/формотерол по потребности).
На пятой ступени терапии при недостаточной эффективности максимальных объемов ингаляционной противовоспалительной терапии рекомендовано добавление анти-IgE-препарата омализумаб (Ксолар) (и КДБА или низкие дозы ИГКС/формотерол по потребности). Альтернативой является назначение низких доз системных стероидов (менее 7,5 мг/с по преднизолону), что в целом способствует снижению риска обострений и в ряде случаев позволяет уменьшить дозу ИГКС, но при этом значительно увеличивает риск системных нежелательных явлений и требует тщательного мониторинга.
Важной проблемой остается недостаточный контроль над симптомами БА на фоне проводимой терапии. Для его улучшения предлагается регулярно оценивать технику ингаляций и приверженность пациентов к лечению. В сомнительных случаях необходимо тщательное повторное обследование для подтверждения диагноза БА; при нормальной легочной функции и наличии типичных жалоб рекомендуют на 2-3 недели сократить суточную дозу ИГКС вдвое с последующей оценкой симптомов и параметров внешнего дыхания. Очень важно устранить все факторы риска (курение, прием бета-блокаторов, нестероидных противовоспалительных препаратов, воздействие аллергенов), оценить и подобрать терапию сопутствующих заболеваний (ринит, ожирение, ГЭРБ, тревога, депрессия и т. д.). При сохранении симптомов нестабильной БА после тщательной оценки соотношения риска и пользы рекомендован перевод на следующую ступень терапии.
К долгосрочным целям лечения БА в GINA-2014 относят достижение хорошего уровня контроля симптомов и нормального уровня физической активности, минимизацию риска обострений, формирования фиксированной обструкции и нежелательных явлений лекарственной терапии. Достижение этих целей требует партнерства между пациентами и специалистами здравоохранения разного уровня. Выбор между препаратами для базисной терапии БА рекомендовано осуществлять согласно национальным руководствам и рекомендациям, основанным на данных об эффективности в клинических исследованиях и реальной практике, безопасности использования, доступности и стоимости. При выборе терапии для контроля симптомов БА и снижения риска неблагоприятного прогноза также необходимо учитывать индивидуальные особенности пациентов и их предпочтения. Следует принимать во внимание факторы риска или предикторы недостаточного ответа на терапию (курение, тяжелые обострения в анамнезе, сопутствующие заболевания и т. д.), практические навыки ингаляционной техники, приверженность лечению, доступность препаратов по стоимости.
Основным принципом стартовой терапии БА является раннее начало лечения сразу после установления диагноза. Низкие дозы ИГКС рекомендуют, если дневные симптомы БА возникают чаще 2 раз в месяц (ночные — чаще 1 раза в месяц) и сочетаются с факторами риска обострений. Старт с более высокой ступени терапии БА показан, если частота дневных симптомов выше (или ночные симптомы возникают чаще 1 раза в неделю), особенно при наличии факторов риска обострений. При дебюте БА с тяжелого обострения допустимо после короткого курса системных стероидов начать базисную терапию высокими дозами ИГКС (табл. 1) или ИГКС/ДДБА с последующим постепенным сокращением объема базисного лечения по мере стабилизации состояния.
Суточные дозы ингаляционных глюкокортикостероидов (с сопоставимой эффективностью) для пациентов с БА
| ИГКС | Суточная доза (мкг) (старше 12 лет) | Суточная доза (мкг) (6-11 лет) | ||||
| низкая | средняя | высокая | низкая | средняя | высокая | |
| Беклометазона дипропионат (CFC) | 200-500 | >500-1000 | >1000 | 100-200 | 200-4000 | >400 |
| Беклометазона дипропионат (HFA) | 100-200 | >200-400 | >400 | 50-100 | >100-200 | >200 |
| Будесонид (ДПИ) | 200-400 | >400-800 | >800 | 100-200 | >200-400 | >400 |
| Будесонид (суспензия для инг.) | 250-500 | >500 | >1000 | |||
| Циклезонид (HFA) | 80-160 | >160-320 | >320 | 80 | >80-160 | >160 |
| Флутиказона пропионат (ДПИ или HFA) | 100-250 | >250-500 | >500 | 100-200 | >200-500 | >500 |
| Мометазона фуроат | 110-220 | >220-440 | >440 | 110 | >220-440 | >440 |
| Триамцинолона ацетонид | 400-1000 | >1000-2000 | >2000 | 400-800 | >800-1200 | >1200 |
Установлено, что наибольшие клинические преимущества ИГКС отмечаются при использовании низких доз; эффективность применения высоких доз ИГКС при БА обсуждается, большинство случаев связано с увеличением риска системных нежелательных явлений.
Оценку эффективности проводимого лечения при БА рекомендуют проводить через 1-3 месяца после начала лечения (после перенесенного обострения БА — спустя неделю), в последующем — через 3-12 месяцев (у беременных пациенток с БА — каждые 4-6 недель). Через 2-3 месяца при недостаточном уровне контроля БА после оценки техники ингаляции и реальной приверженности лечению рекомендуют увеличение объема базисной терапии («шаг вверх»).
При присоединении вирусной инфекции или сезонном воздействии аллергенов при наличии письменного плана действий пациент с БА может самостоятельно увеличивать объем базисной терапии на 1-2 недели (особенно это касается пациентов, получающих низкие дозы ИГКС/формотерол в режиме базисной терапии и для купирования приступов). Уменьшение объема терапии («шаг вниз») рекомендуют после достижения хорошего контроля БА через 3 месяца до минимальной эффективной дозы ИГКС, которая полностью контролирует симптомы БА и предотвращает ее обострения.
GINA-2014 рекомендует тактику самоведения начинающихся обострений БА, что подразумевает постоянное наблюдение за симптомами и/или функцией легких (ПСВ, ОФВ1), наличие индивидуального плана действий, регулярный контакт пациента со специалистом для обсуждения вопросов лечения. При развитии обострения пациентам рекомендуют увеличить частоту использования «скоропомощного» ингалятора и объем базисной терапии с оценкой состояния через 48 часов: при сохранении ПСВ или ОФВ1 менее 60% от лучшего показателя и отсутствии улучшения рекомендуют продолжить применение «скоропомощного» ингалятора, базисной терапии в сочетании с введением преднизолона (40-50 мг/с) и обязательным контактом с врачом. Подчеркивается, что тяжелые обострения БА могут быть внезапными и без очевидных причин даже при легкой и хорошо контролируемой БА.
Хотя большинство пациентов могут достигнуть цели лечения и хорошо контролировать БА, некоторые пациенты не достигают контроля, несмотря на оптимально подобранную терапию. Термин «трудная в лечении» БА подразумевает под собой наличие различных сопутствующих заболеваний, продолжение контакта с аллергенами, низкую приверженность лечению, неадекватную ингаляционную технику. При резистентной (стойкой к лечению, рефрактерной) тяжелой БА симптомы или обострения плохо контролируются, несмотря на высший уровень рекомендуемого лечения. Это требует более тщательного выявления причин плохого контроля БА и тщательного мониторинга состояния таких пациентов.
В GINA-2014 впервые описан синдром сочетания астмы с хронической обструктивной болезнью легких (ХОБЛ) (ACOS — англ.), который характеризуется стойким ограничением воздушного потока с отдельными проявлениями, обычно связанными как с БА, так и с ХОБЛ. Актуальность этой проблемы связана с тем, что прогноз пациентов с признаками БА в сочетании с ХОБЛ хуже, чем при наличии только одного диагноза: для них характерны более частые и тяжелые обострения, более низкое качество жизни, быстрый регресс легочной функции, высокая стоимость лечения и летальность. Согласно литературным данным, распространенность синдрома сочетания БА и ХОБЛ среди пациентов с хроническими заболеваниями дыхательных путей варьирует от 15 до 55% и сильно зависит от возраста и пола. Считается, что если у пациента более трех признаков, характерных для БА и ХОБЛ или имеется равное количество признаков обоих заболеваний (табл. 2), то это очевидное доказательство синдрома сочетании астмы и ХОБЛ.
Характерные симптомы БА и ХОБЛ
| Признаки | БА | ХОБЛ | |
| Возраст, когда появились симптомы | До 20 лет | После 40 лет | |
| Характер симптомов | Варьируются по минутам, часам или дням. Ухудшение ночью или в ранние утренние часы. Появляются во время физической нагрузки, эмоций (включая смех), воздействия пыли или аллергенов. | Персистируют, несмотря на лечение. Дневные симптомы и одышка при физической нагрузке есть всегда. Хронический кашель и про дукция мокроты предшествуют одышке, обычно не связаны с триггерами. | |
| Функция легких | Вариабельные ограничения воздушного потока (спирометрия или пиковая скорость выдоха) | Персистирующие ограничения воздушного потока (ОФВ1/ФЖЕЛ 50 ppb), характерно для эозинофильного воспаления. | Обычно нормальный, низкий у активных курильщиков. |
| Эозинофилия крови | Поддерживает диагноз «астма». | Может быть выявлена во время обострений. | |
| Анализ воспалительных элементов в мокроте | Роль в дифференциальной диагностике не установлена на большой популяции пациентов. | ||
Стартовая терапия синдрома сочетания астмы и ХОБЛ (ACOS) основана на синдромной оценке и спирометрии: если у пациента доминируют проявления БА, то лечат как БА; если доминируют проявления ХОБЛ, то лечат как ХОБЛ. Если синдромная оценка подтверждает наличие ACOS или сохраняются сомнения в диагнозе ХОБЛ, то следует начать лечение БА на фоне проведения дополнительных исследований. Перед началом лечения необходимо тщательно взвесить эффективность и безопасность терапии: при любых проявлениях БА рекомендуют избегать назначения ДДБА без ИГКС, при любых проявлениях ХОБЛ показано симптоматическое лечение бронхолитиками или комбинированная терапия (ИГКС/ДДБА), избегая назначения монотерапии ИГКС. В случае подтвержденного диагноза ACOS показана терапия ИГКС в сочетании с ДДБА и/или длительно действующими холинолитиками (ДДХЛ). Важными стратегическими направлениями в лечении ACOS и ХОБЛ остаются мотивированный отказ о курения, различные методы легочной реабилитации, вакцинация против пневмококковой инфекции и гриппа и лечение сопутствующих заболеваний.
Диагностика БА у детей, согласно рекомендациям GINA-2014, в основном базируется на характерных симптомах (свистящие хрипы, кашель, затрудненное дыхание, ночные пробуждения и/или ограничение физической активности из-за этих симптомов) в сочетании с отягощенной семейной наследственностью и результатами клинического обследования.
Для БА у детей младше 5 лет характерен повторяющийся или постоянный кашель, усиливающийся в ночное время и сопровождающийся свистящими хрипами и затруднением дыхания. Характерно, что кашель при БА может провоцироваться физической активностью, плачем, криком, табачным дымом в отсутствие признаков респираторной инфекции. Для БА у детей также характерны повторные эпизоды свистящего дыхания (wheezing), в том числе во сне или при воздействии различных триггеров (вирусных инфекций, физической активности, смехе, плаче или под воздействием табачного дыма и различных поллютантов). Этими же факторами при БА у детей провоцируется появление затрудненного или тяжелого дыхания с удлиненным выдохом; оно, как правило, сопровождается снижением физической активности (одышка при беге, плаче, смехе, играх) и быстрой утомляемостью. Безусловно, вероятность установления диагноза БА у детей значительно увеличивается при выявлении семейной отягощенности по БА (особенно при наличии БА у родителей и сибсов), а также при наличии других аллергических заболеваний у ребенка (атопический дерматит, аллергический ринит и т. д.).
При назначении базисной терапии БА у детей младшего возраста предпочтительны низкие дозы ИГКС и бронхолитики короткого действия по потребности (КДБА). Диагноз БА у ребенка может быть подтвержден при достижении стойкого улучшения на фоне 2-3-месячного пробного лечения низкими дозами ИГКС и возобновлением симптомов БА после отмены терапии.
Важным вопросом остается прогнозирование риска обострений БА в ближайшее время. К таким признакам относятся сохранение неконтролируемых симптомов БА, более одного тяжелого обострения за предшествующий год, наступление сезона поллинации, сохранение экспозиции к табачному дыму и различным поллютантам, неустраненный контакт с аллергенами, особенно при присоединении вирусных инфекций, неблагоприятный социальный и психологический фон в семье, низкая приверженность лечению и плохая ингаляционная техника. К факторам формирования фиксированной бронхиальной обструкции при БА у детей относят тяжелое течение БА с госпитализациями в ОРИТ и перенесенный бронхиолит в анамнезе. Кроме того, следует учитывать возможные побочные эффекты проводимой терапии (системные — при повторных курсах системных стероидов или использовании высоких доз ИГКС; местные — вследствие неправильной ингаляционной техники, в том числе различные повреждения кожи лица и глаз при длительном использовании маски для небулайзера или спейсера).
В GINA-2014 для детей с БА до 5 лет также предложено использовать ступенчатый подход к терапии, который предполагает 4 ступени лечения. Первая ступень терапии используется у детей с редкими симптомами БА и низким риском обострений и предполагает в отсутствие базисной терапии использование КДБА по потребности. Вторая ступень лечения, предполагающая использование ИГКС в низких дозах (беклометазон дипропионат (HFA) — 100 мкг/с, будесонид pMDI + спейсер — 200 мкг/с, будесонид (суспензия для небулайзера) — 500 мкг/с, флютиказона пропионат (HFA) — 100 мкг/с, циклесонид — 160 мкг/с), предназначена детям с более частыми симтомами БА или при редких симптомах и наличии высокого риска обострений; в качестве альтернативы предлагается использовать антилейкотриены (АЛТР). На третьей ступени терапии при выраженных симптомах БА, не контролирующихся приемом низких доз ИГКС, рекомендовано использовать удвоенную суточную дозу ИГКС (как альтернатива — прежняя доза ИГКС + АЛТР). На четвертой ступени лечения при тяжелом течении БА у ребенка до 5 лет показано использование удвоенной суточной дозы ИГКС в сочетании с АЛТР.
Для детей в возрасте 0-3 лет предпочтительным способом доставки препаратов для базисного лечения БА считается ДАИ в сочетании со спейсером, снабженным лицевой маской; альтернативой является небулайзерная терапия с лицевой маской. Для пациентов с БА в возрасте 4-5 лет для базисной терапии предпочтительно использовать ДАИ в сочетании со спейсером с загубником, но возможно использование и спейсера с лицевой маской или небулайзера с загубником или лицевой маской.
Ранними симптомами начинающегося обострения БА у детей до 5 лет следует считать внезапное или постепенное появление/усиление свистящих хрипов и затрудненного дыхания, появление/усиление кашля, особенно вне сна, сонливость или вялость, слабость, снижение двигательной активности, изменение поведения, включая трудности при кормлении, недостаточный ответ на прием «облегчающих» препаратов; зачастую симптомы вирусных инфекций могут маскировать начинающееся обострение БА.
На любой ступени лечения, если активность ребенка с БА внезапно изменилась, а симптомы БА не купируются приемом ингаляционных бронходилататоров или период их действия прогрессивно укорачивается, то необходимо проводить повторные ингаляции КДБА каждые несколько часов и наблюдать за ответом; при отсутствии выраженного эффекта родителями должна быть начата терапия обострения БА на дому. Первоначальное лечение должно быть начато с назначения 2 доз (200 мкг сальбутамола или его эквивалента) через спейсер (с маской или без в зависимости от возраста), при отсутствии эффекта с интервалами в 20 минут допустимо проведение двух аналогичных ингаляций; после этого ребенок должен находиться под тщательным медицинским наблюдением (при необходимости — до нескольких дней). Если симптомы сохраняются на фоне приема 6 доз КДБА в течение 2 часов или отсутствует значимое улучшение в течение суток, то назначаются ИГКС в высоких дозах или системные стероиды (однако указывается, что оба вида лечения могут сопровождаться выраженными системными эффектами и требуют тщательного врачебного наблюдения).
Показаниями к неотложной госпитализации детей с БА до 5 лет, согласно рекомендациям GINA-2014, являются эпизоды нерегулярного дыхания и/или остановки дыхания, нарушения речи и глотания, разлитой цианоз, втяжение межреберных промежутков, падение сатурации при дыхании комнатным воздухом ниже 92%, резкое ослабление дыхания при аускультации, отсутствие ответа на начальную терапию КДБА, низкий ответ на последовательные ингаляции 6 доз сальбутамола (по 2 дозы троекратно с интервалами в 20 минут), сохраняющаяся одышка после использования КДБА (даже если отмечено некоторое улучшение состояния ребенка), невозможность организации лечения обострения на дому.
В GINA-2014 много внимания уделяется методам немедикаментозной профилактики и реабилитации больных с БА, что, безусловно, способствует повышению эффективности проводимых мероприятий и улучшению качества жизни этих пациентов.
В целом следует отметить, что GINA-2014 является рекомендательным документом, вобравшим в себя общемировой опыт борьбы с таким социально значимым заболеванием, как бронхиальная астма. Хочется надеяться, что в современных российских согласительных документах по лечению и профилактике БА найдут отражение основные положения GINA-2014 с учетом организационных и экономических возможностей нашей системы здравоохранения, что сделает жизнь пациентов с БА более качественной и безопасной.
источник


.jpg)
.gif)
.gif)
_575.gif)