Современные методы лечения бронхиальной астмы
Стандарты лечения бронхиальной астмы
Протоколы лечения бронхиальной астмы
Профиль: терапевтический.
Этап: поликлинический.
Цель этапа: купирование приступов удушья, обострения болезни.
Длительность лечения: 7-10 дней.
Коды МКБ:
J45- Астма
J45.0- Астма с преобладанием аллергического компонента
J45.1- Неаллергическая астма
J45.8 — Смешанная астма
J45.9 — Астма неуточненная
J46 — Астматический статус.
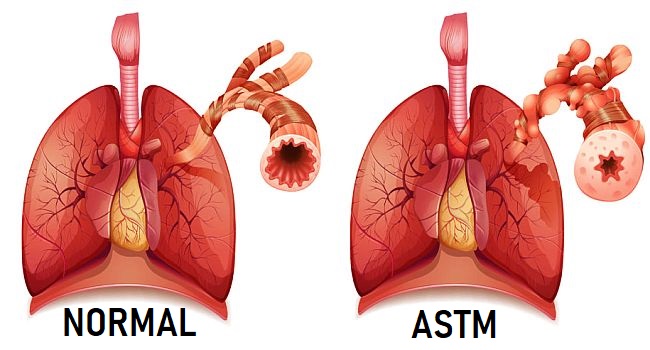
Определение: Бронхиальная астма (БА) — хроническое заболевание дыхательных путей, основным патогенетическим механизмом которого является гиперреактивность бронхов, обусловленная воспалением, а основным клиническим проявлением — приступы удушья (преимущественно экспираторного характера) вследствие бронхоспазма, гиперсекреции и отека слизистой оболочки бронхов. Приступы удушья, а также характерные для БА кашель, чувство «заложенности» в груди, эпизоды свистящих дистанционных хрипов возникают преимущественно в ночные или утренние часы и сопровождаются частично или полностью обратимой (спонтанно или вследствие лечения) бронхиальной обструкцией.
Классификация:
Классификация астмы основывается на совместной оценке симптомов клинической картины и показателей функции легких:
1. По этиологии: атопическая (экзогенная); неатопическая (эндогенная); смешанная.
2. По тяжести заболевания различают:
— ступень I (легкая интермиттирующая): количество симптомов днем
80% нормы, разброс показателей ПСВ менее 20%.
— ступень II (легкая персистирующая); количество симптомов днем > 1 раза в неделю, но 2 раз в месяц; ОФВ1 или ПСВ > 80% нормы, разброс показателей ПСВ 20%-30%.
— ступень III (персистирующая, средней тяжести); симптомы ежедневно, приступы нарушают активность; ночные симптомы > 1 раза в неделю; ОФВ1 или ПСВ — 60- 80% нормы, разброс показателей ПСВ > 30%.
— ступень IV (тяжелая персистирующая): симптомы постоянные, ограничена физическая
активность; ночные симптомы частые; ОФВ 1 или ПСВ 30%.
3. По фазе течения: обострение, нестабильная ремиссия, ремиссия, стабильная ремиссия (более 2 лет).
Факторы риска: аллергены клещей, домашней пыли (такие мелкие, что невидимы невооруженным глазом), курение табака (курит ли сам пациент или он вдыхает дым, когда курят другие), аллергены животных, покрытых шерстью, аллергены тараканов, пыльца и плесневые грибы вне помещений, плесневые грибы внутри помещений, физическая активность, лекарства.
Критерии диагностики: В анамнезе любое из следующих проявлений:
кашель, особенно ночью; повторяющиеся хрипы; повторяющееся затрудненное дыхание; повторяющееся чувство сдавления грудной клетки; симптомы возникают или ухудшаются ночью; симптомы становятся тяжелее при контакте с триггерами; важным клиническим маркером бронхиальной астмы является исчезновение симптомов спонтанно или после применения бронходилататоров и противовоспалительных препаратов. Наличие атопических заболеваний у больного или его родственников.
Обратимое или изменяющееся снижение проходимости дыхательных путей по показаниям спирометра (ОФВ 1 или ФЖЕЛ) или пикфлоуметра (пиковая скорость выдоха — ПСВ).
При использовании пикфлоуметра можно подумать об астме, если:
— ПСВ увеличивается более чем на 15% через 15-20 минут после вдыхания быстродействующих b2-агонистов, или
— ПСВ, измеренная вечером, отличается более чем на 20% от утренних значений у пациентов, принимающих бронходилятаторы и более чем на 10% у пациентов, не принимающих бронходилятаторы, или
— ПСВ снижается более чем на 15% после 6 минут непрерывного бега или физической нагрузки.
В ОАК может быть выявлена эозинофилия.
В ОАМ возможно выявление незначительной протеинурии или нет изменений.
Для дифференциальной диагностики: рентгенография грудной клетки (отсутствие изменения легочной ткани).
Термометрия. При стойком и длительном повышении температуры тела исследование гемокультуры на бактериемию на высоте лихорадки с определением чувствительности флоры к антибиотикам.
Перечень основных диагностических мероприятий:
1. Общий анализ крови
2. Общий анализ мочи
3. Микрореакция
4. Общий анализ мокроты
5. Флюорография
6. Исследование функций внешнего дыхания Перечень дополнительных диагностических мероприятий:
1. Рентгенография органов грудной клетки
2. Консультация пульмонолога
3. Консультация стоматолога
4. Консультация отоларинголога
5. Кожные пробы
6. Провокационные пробы
7. Цитология мокроты, исследование мокроты на БК
8. Анализ чувствительности микробов к антибиотикам
9. Проведение аллергопроб
10. Исследование внешнего дыхания с бронхолитиком и/или бронхопровокатором.
Тактика лечения: Исключить контакт с причинным аллергеном, влияния неспецифических раздражителей (курения, профессиональной вредности, поллютантов, резких запахов и др.).
Купирование приступов: ингаляционные b2-агонисты быстрого действия (сальбутамол, фенотерол); b2-агонисты длительного действия с быстрым началом действия (сальметерол, формотерол); ингаляционные холинолитики (ипратропия бромид); комбинированные ЛС, включающие холинолитики и b2-агонисты; метилксантины короткого действия (аминофиллин); системные ГКС (преднизолон).
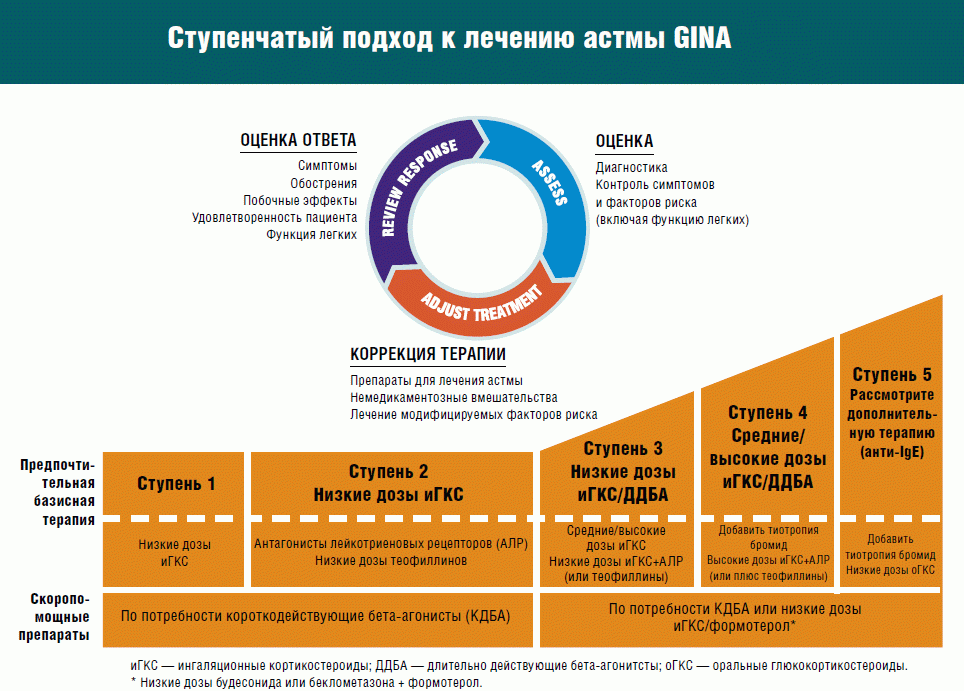
Для длительного ведения астмы рекомендуется ступенчатый подход в зависимости от степени тяжести.
Для всех уровней: дополнительно к регулярной ежедневной терапии, при необходимости должны применяться ингаляционные b2-агонисты быстрого действия, но не чаще 3-4 раз в день, фиксированная комбинация фенотерола и ипротропия бромида.
Ступень I — ежедневного приема для контроля заболевания не требуется. Рекомендуется назначать бронходилататоры короткого действия по потребности не более 1-2 раза в сутки.
Ступень II — Ингаляционный ГКС: беклометазон дипропионат 200-500 мкг в 1-2 приема, флутиказона пропионат 120 доз (100-200 мкг 2 раза в сутки), будесонид 100-250 мкг/сут.
Альтернативное лечение: назначение пролонгированных препаратов теофиллина (теотард, теопэк 200-400 мг/сутки), кромонов (ингаляции кромоглициевой кислоты 10 мг 4 раза в сутки или интал 5 мг/доза), блокаторов лейкотриеновых рецепторов (зафирлукаст 20 мг 2 раза в день). Бронходилататоры короткого действия (сальбутамол, фенотерол) по потребности не более 3-4 раз в сутки.
Ступень III — Ингаляционный ГКС: беклометазон дипропионат (800-1600 мкг в 3-4 приема) флутиказона пропионат 120 доз (400-1000 мкг 3-4 раза в сутки), Будесонид 800-1600 мкг/сут или. или ИГКС в стандартной дозе в сочетании с агонистами b2 -адренорецепторов длительного действия (сальметерол по 50 мкг 2 раза в день или формотерол по 12 мкг 2 раза в день), фиксированная комбинация фенотерола и ипротропия бромида либо с пролонгированным препаратом теофиллина. Бронходилататоры короткого действия (сальбутамол, фенотерол) по потребности, но не более 3-4 раз в сутки. Альтернативное лечение: назначение пролонгированных препаратов теофиллина (200-700 мг/сутки), кромонов (ингаляции кромоглициевой кислоты 20 мг 4-8 раз в сутки или интал 5 мг/доза), блокаторов лейкотриеновых рецепторов (зафирлукаст 20 мг 2 раза в день).
Ступень IV — Ингаляционный ГКС: беклометазон дипропионат 100 мкг — 10 доз (более 1000 мкг) в сутки флутиказона пропионат по 100-200 мкг 3-4 раза в сутки, будесонид более 800 мкг/сут, или эквивалент плюс ингаляционный b2-агонист длительного действия (сальметерол, формотерол), фиксированная комбинация фенотерола и ипротропия бромида; плюс один или более из следующих препаратов, если это необходимо: теофиллин замедленного высвобождения, антилейкотриеновый препарат, пероральный b2_агонист длительного действия, пероральный ГКС.
При наличии гнойной мокроты, высоком лейкоцитозе, ускоренном СОЭ назначают курс антибактериальной терапии учетом антибиотикограмм (спирамицин 3000 000 ЕД х 2 раза, 5-7 дней, амоксициллин+клавулановая кислота 625 мг х 2 раза, 7 дней, кларитромицин 250 мг х 2раза, 5-7 дней, цефтриаксон 1,0 х 1 раз, 5 дней).
Больным с вязкой мокротой назначают муколитики (амброксол, карбоцистеин, ацетилцистеин).
Перечень основных медикаментов:
1. Бекламетазон аэрозоль 200 доз
2. Ипратропия бромид аэрозоль 100 доз
3. Кромоглициевая кислота аэрозоль дозированный 5 мг; капсула 20 мг
4. Сальбутамол аэрозоль 100 мкг/доза; капсула 2 мг, 8 мг; раствор для небулайзера 20 мл
5. Теофиллин таблетка 100 мг, 200 мг, 300 мг; капсула 100 мг; 200 мг; 300 мг; капсула ретард 350 мг
6. Фенотерол аэрозоль 200 доз
7. Амброксол таблетка 30 мг; сироп 30 мг/5 мл
8. Преднизолон, таблетка 5 мг; раствор для инъекций 30мг/1 мл
9. Буденосид 100 мг, аэрозоль
10. Ипратропия бромид 21 мкг+фенотерола гидробромид 50 мкг.
Перечень дополнительных медикаментов:
1. Флютиказон аэрозоль 60 доз, 120 доз (или их комбинация: салметерол, флютиказона пропионат, 25/50 мкг; 25/250 мкг)
2. Кларитромицин 500 мг, табл.
3. Спирамицин 3 млн. ЕД, табл.
4. Аминофиллин раствор для инъекций 2,4% в ампуле 5 мл, 10 мл
5. Салметерол аэрозоль для ингаляции 25 мкг/доза
6. Амоксициллин+клавулановая кислота 625 мг
7. Азитромицин 500 мг.
Критерии перевода на следующий этап лечения: неэффективность бронхолитической терапии, некупируемые приступы удушья в течение 6-8 часов, нарастание дыхательной недостаточности, «немое легкое».
источник
Современная стратегия оказания медицинской помощи должна быть основана исключительно на доказательных данных. Это касается любого заболевания, в том числе и бронхиальной астмы. Создаются международные клинические рекомендации, которые в дальнейшем становятся основой для стандартов, закрепленных законодательно уже на региональном уровне.
Бронхиальная астма (БА) является распространенной патологией, которой страдают не только взрослые, но и дети. Это заболевание инфекционно-аллергической природы, в основе которого лежит гиперреактивность бронхов и связанные с нею спазм гладкой мускулатуры, отек и гиперсекреция. Диагностика болезни осуществляется путем анализа жалоб и анамнеза, выявления клинических симптомов и оценки функционального состояния бронхолегочной системы.
Иногда у детей можно встретить такой диагноз, как астматический бронхит. Но на самом деле в современной классификации его не существует. Причиной бронхиальной обструкции, подтвержденной клинически и на основании анамнеза, становится именно астма – как в раннем (с 2 лет), так и подростковом возрасте. А в качестве дополнительных методов, подтверждающих патологию, используются:
Для дифференциальной диагностики с другими заболеваниями используют рентгенографию грудной клетки, бронхографию, компьютерную томографию. Важное значение имеет положительный ответ на бронхолитическую терапию (свидетельство высокой обратимости обструкции).
Основанием для начала терапии станет установление точного диагноза с указанием степени тяжести и клинического течения бронхиальной астмы.
Стандарт по бронхиальной астме – это приказ министерства здравоохранения. И основное значение в нем уделяется, конечно же, алгоритмам предоставления специализированной помощи взрослым и детям в различных ситуациях.
Лечение стабильной бронхиальной астмы проводится согласно так называемой ступенчатой терапии: интенсивность мероприятий нарастает исходя из степени нарушений, до получения полного контроля над симптомами. Все препараты назначаются в индивидуальном порядке с учетом переносимости и эффективности.
Терапия бронхиальной астмы у детей, подростков и взрослых предполагает несколько вариантов на каждой ступени, которые могут стать альтернативой при выборе базисного (поддерживающего) лечения. Если терапевтической дозировки препаратов на одном этапе недостаточно, то переходят на следующий. Это выглядит следующим образом (таблица):
Основной целью такой терапии становится достижение контроля над бронхиальной астмой. При этом ведущую роль среди всех препаратов играют ИКС, которые признаны базисными средствами, устраняющими воспалительный процесс в бронхах. Начальные дозировки выбираются исходя из тяжести заболевания и ответа на терапию. Из средств доставки предпочтение отдается ингаляторам (аэрозольным, порошковым) или небулайзерам, и каждого пациента обучают, как ими пользоваться. А лекарственные формы с фиксированными комбинациями медикаментов (Беродуал, Серетид, Симбикорт) позволяет улучшить приверженность к терапии.
Если симптомы отсутствуют, то начинают постепенно снижать дозировку ИКС, добиваясь ее уменьшения на четверть или даже половину от исходной (на протяжении трех месяцев). В случаях, когда адекватного контроля достичь не удается, нужно направить пациентов, особенно детей, на дополнительное обследование в специализированные стационары.
Главным критерием эффективности лечения стабильной астмы является достижение контроля над симптоматикой болезни с использованием минимально достаточных для этого дозировок.
Ухудшение состояния пациента на фоне поддерживающей терапии говорит о развитии обострения. В этом случае стандарты лечения бронхиальной астмы предлагают в детском возрасте применять следующие препараты:
- Ингаляции сальбутамола (или в комбинации с ипратропия бромидом).
- При их неэффективности добавляется будесонид (через небулайзер).
- Принимается преднизолон внутрь.
- Вводится эуфиллин внутривенно (при отсутствии эффекта от предшествующих лекарств).
Все медикаменты используются в возрастных дозировках. Эуфиллин не применяется у детей до 2 лет, а будесонид – до 6 месяцев. При тяжелом приступе необходима немедленная госпитализация в стационар. А снижение оксигенации крови до уровня 94% и менее становится показанием для ингаляции кислорода.
У взрослых стратегия лечения обострений схожа. Стандарт медицинской помощи для астматиков предполагает сразу же (независимо от тяжести приступа) проводить оксигенотерапию, кислород можно использовать как средство доставки бета2-адреномиметиков. Сальбутамол принимают в увеличенных дозировках, в том числе и путем непрерывной ингаляции с помощью небулайзера. При слабой реакции, а также пациентам с умеренным и тяжелым обострением добавляют будесонид.
Глюкокортикоиды у взрослых назначаются во всех случаях. Отсутствие должного ответа на ингаляционные бронхолитики может стать основанием для внутривенного введения магния сульфата и эуфиллина. Если же у пациента есть признаки тяжелого и угрожающего жизни обострения (нарастающая дыхательная недостаточность, угнетение сознания, гиперкапния) и ему необходима искусственная вентиляция легких, то необходима госпитализация в реанимационное отделение.
Базисная медикаментозная терапия является эффективным методом предупреждения приступов у ребенка и взрослого. Но следует обращать внимание и на другие мероприятия. Важное значение имеет элиминация причинных аллергенов, отказ от курения, специфическая иммунотерапия. Пациентам с недостаточным контролем астмы также рекомендуют ограничить физические нагрузки в холодное время года.
Каждого пациента необходимо обучать использованию ингаляторов и небулайзеров, мониторингу собственного состояния (пикфлуометрия). Физическая реабилитация в виде аэробной гимнастики, плавания и дыхательных упражнений позволяет улучшить вентиляционные показатели, хотя это и не подкреплено достаточной доказательной базой.
В стандартах оказания медицинской помощи при астме четко прописано, как нужно лечить взрослых и детей в период ремиссии и при обострениях. Этим и руководствуются врачи при назначении терапии своим пациентам.
источник
Резюме. Опубликованы результаты научного обзора
Во всем мире распространенность неинфекционных заболеваний, особенно бронхиальной астмы, продолжает повышаться. Неинфекционные заболевания дыхательных органов наряду с патологиями сердечно-сосудистой системы, диабетом и онкологическими болезнями входят в четверку основных источников смертности населения. В данной ситуации разработка объективных методов диагностики и мониторинга является тем важным ресурсом, который необходимо задействовать на пути решения проблемы.
В июне 2017 г. в журнале «Clinical Medicine Insights: Pediatrics» группа ученых-педиатров из Нигерии опубликовала обзор тенденций и потребностей в использовании метода спирометрии при ведении больных бронхиальной астмой детей. Авторское исследование имеет особое значение для популяций, проживающих в странах с ограниченными ресурсами, поскольку распространение неинфекционных заболеваний оказывает на них непропорциональное влияние.
Бронхиальная астма является «лидером» в структуре респираторных неинфекционных заболеваний у детей, независимо от уровня благосостояния стран, в которых они проживают. Диагноз обычно основывается на анамнестических сведениях и симптоматическом подтверждении наличия бронхиальной обструкции. Этот субъективный метод далее может быть ориентирован на конкретные клинические рекомендации отдельных стран.
Однако нужно признать, что легочные функциональные тесты более чувствительны и объективны в вопросе диагностики, чем анализ клинических симптомов или исследование обструктивных явлений в бронхиальном дереве. Таким образом, для детей старшего возраста и взрослых спирометрия входит в большинство рекомендаций в качестве золотого стандарта диагностики и определения функции легких. Опубликованные значения эталонного диапазона спирометрии у детей 3–5 лет позволяют судить о приемлемости метода даже в этих возрастных группах.
Спирометры широко доступны в разумном ценовом диапазоне. Проведение спирометрии у детей не имеет абсолютных противопоказаний, а интерпретация получаемых результатов полностью стандартизирована. Тем не менее существует четкий разрыв между рекомендациями и практикой использования спирометрии (как это наблюдается в странах с ограниченными ресурсами), особенно у детей с бронхиальной астмой.
Собственно, спирометрия позволяет оценить внешнюю дыхательную функцию человека по объему вдыхаемого или выдыхаемого воздуха за единицу времени. Показания к ее проведению у детей включают семейный анамнез заболеваний, результаты анализа газов артериальной крови, рентгенографии органов грудной полости или физикального обследования, выявившего такие симптомы, как внутригрудные хрипы, кашель, рецидивирующие инфекции грудной полости и т.п. К другим показаниям относятся: определение тяжести ранее диагностированных заболеваний легких, мониторинг эффективности терапевтического вмешательства, предоперационная оценка для торакоабдоминальных хирургических вмешательств, любых вмешательств, предполагающих длительную анестезию.
Диагностика бронхиальной астмы с использованием спирометрии включает в себя интерпретацию значений объема принудительного выдоха в первую секунду, жизненного объема легких и отношения объема принудительного выдоха к жизненному объему легких. Уменьшение объема принудительного выдоха в первую секунду относительно жизненного объема легких является типичной для обструктивных нарушений вентиляции, таких как бронхиальная астма, хроническая обструктивная болезнь легких и эмфизема. Когда это отношение остается нормальным или высоким (обычно >80%) с уменьшением как объема принудительного выдоха, так и жизненного объема легких, предполагают наличие ограничивающего фактора, такого как интерстициальное заболевание легких, слабость дыхательных мышц или деформация грудной клетки (например кифосколиоз).
Выполнение бронходилатационной пробы для оценки обратимости обструкции подтверждает диагноз бронхиальной астмы, если между результатами спирометрии до и после применения бронхолитического теста отмечается разница более 12%.
Несмотря на важность метода спирометрии, исследования ученых из нескольких стран (развитых и развивающихся) свидетельствуют о недостаточности его использования как в высокоспециализированных медицинских учреждениях, так и на уровне первичной медико-санитарной помощи, обслуживающей и взрослые, и педиатрические популяции. Опрос врачей, проведенный в США, показывает, что менее четверти специалистов используют спирометрию при оценке и диагностике бронхиальной астмы у детей. В Бельгии в течение двух лет, предшествующих исследованию, лишь около 30% участников с обструктивными легочными заболеваниями были оценены с помощью спирометрии в учреждениях первичной медико-санитарной помощи. В Кот-д’Ивуаре 41% врачей не использовали спирометрию, поскольку они совершенно не осознавали полезность измерений объема принудительного выдоха при установлении диагноза бронхиальной астмы как у детей, так и у взрослых.
Еще одно исследование, проведенное в Юго-Восточной Нигерии, выявило, что 34% врачей в своей популяции изучали функции легких с целью установления диагноза бронхиальной астмы любыми методами, кроме спирометрии. Однако это исследование не оценивало, знали ли медики о важности спирометрии и доступности метода. Авторы отмечают, что даже в специализированных клиниках Нигерии, занимающихся вопросами лечения хронических респираторных заболеваний, где число детей, нуждающихся в проведении спирометрии, было наибольшим, эта возможность не была использована по отношению ко всем пациентам.
В условиях, когда проведение спирометрии не осуществляется на постоянной основе, возрастает вероятность того, что потребность в этом методе диагностики для конкретного пациента не будет распознана.
Исследуя причины ограниченного использования спирометрии, авторы нашли частичное объяснение в сложности понимания инструкций к ее выполнению со стороны детей. Для проведения таких процедур необходим достаточно осознанный уровень взаимодействия, поскольку большинство из них требуют повторного выполнения и визуальной обратной связи. Считается, что маленькие дети могут выполнять приемлемую спирометрию с задержкой дыхания в течение 6 с, достаточных для достижения плато, но совершить ровный максимальный выдох в течение стандартных 6 с без кашля представляется очень сложным. Эти обстоятельства вызывают задержку и неудобства в получении клинических результатов.
Обзор исследований в развитых странах выявляет схожие проблемы. Только 54% школьников способны выполнять спирометрию на уровне и в соответствии с Рекомендациями по спирометрии дошкольного учреждения Американского торакального общества/Европейского респираторного общества (Preschool spirometry recommendations of American Thoracic Society/European Respiratory Society). Уже старшая педиатрическая возрастная группа находит задачу принудительного выдоха менее сложной. Дети в возрасте 5 лет и старше легче справляются с силовым спирометрическим маневром и обеспечивают более надежный результат.
Все же авторы считают необходимым ввести курсовое и периодическое обучение врачей, обслуживающих детское население. Продольное исследование в Дании показало эффективность такого обучения по увеличению частоты использования спирометрии в амбулаторных условиях у пациентов с хроническими обструктивными заболеваниями легких.
Конкретные рекомендации по диагностике и лечению бронхиальной астмы в детском возрасте, включая Глобальную инициативу по бронхиальной астме (Global Initiative on Asthma), предлагают использование спирометрии каждые 1–2 года или чаще и в последующее время лечения бронхиальной астмы при исходной оценке, после начала лечения и стабилизации симптомов, а также в периоды прогрессирующего обострения или ремиссии.
Во многих развивающихся странах дети с бронхиальной астмой регулярно наблюдаются в учреждениях первичной медико-санитарной помощи, от которых, соответственно, зависит качество реализации руководящих принципов. Если учесть, что цель последней заключается в том, чтобы перевести рекомендации по управлению бронхиальной астмой к практическому применению для улучшения здоровья пациентов, возможность использования спирометрии в таких условиях не будет казаться слишком надуманной.
По мнению авторов, все педиатры должны владеть методом спирометрии и навыками интерпретации полученных результатов. Однако в условиях интенсивной клинической практики помощь в проведении исследования могут предоставлять специально обученные медсестры. Внимание этому вопросу следует уделить при обучении как в аспирантуре, так и в последипломной подготовке, если она должна быть оптимизирована для диагностики бронхиальной астмы.
источник
Бронхиальная астма – распространенное заболевание, встречающееся у 4-10% населения. В детском возрасте процент возрастает до 10-15.
Для бронхиальной астмы разработаны особые стандарты лечения. Однако часто на начальных стадиях ее неверно диагностируют и проводят неправильную терапию.
Поэтому в случае болезни, симптомом которой является свистящий хрип, стоит всегда помнить, что это может быть астма.
Бронхиальная астма представляет собой хроническую патологию воспалительного характера, поражающую дыхательные пути. Возникающие периодически приступы удушья являются основным клиническим проявлением заболевания.
Диагноз устанавливает врач после проведения комплексного обследования пациента. Для того чтобы не спутать бронхиальную астму с другими заболеваниями дыхательных путей, изучают снимки грудной клетки, полученные при компьютерной томографии или рентгенографии.
Стандарты лечения существуют для многих заболеваний, они представляют собой поэтапный комплекс мер, необходимый для постановки диагноза по всем необходимым критериям и эффективного лечения заболевания.
Стандарт лечения астмы включает современные методы лечения патологии, проверенные временем и улучшающие состояние больного.
Стандарты, по которым оказывается помощь больным, утверждаются Министерством здравоохранения.
В соответствии с ними проверяется медицинская документация, заполненная врачом, анализируется правильность назначенного комплекса обследований и терапии. Использование стандартов лечения астмы обусловлено несколькими причинами:
- Помощь, которая оказывается больному, в этом случае является эффективной и не приносит вреда здоровью.
- По стандартам работают все специалисты как в государственных, так и в частных лечебных учреждениях.
- В стандарты включены последние научные данные о патологии. Это позволяет более эффективно проводить лечение.
- Создается база статистических данных, единая для всех.
Степень тяжести бронхиальной астмы устанавливается при диагностике. От нее зависит выбор терапии заболевания. При диагностике учитывают интенсивность клинических симптомов астмы и результаты дополнительных исследований, а именно:
- При сборе анамнеза выясняется частота приступов и время их появления.
- Назначается анализ мочи, крови, обязательно исследование мокроты.
- Оценивается эффективность назначенной медикаментозной терапии.
- Оцениваются показатели внешнего дыхания, их отклонение от нормы.
По степени тяжести болезнь классифицируют следующим образом:
- 1-я степень — самая легкая форма болезни. Одышка, приступы и хрипы появляются не чаще одного раза в неделю. Приступы возникают после контакта с аллергенами, возможны во время простуды или при уборке дома, протирании пыли.
Также приступ может начаться от сигаретного дыма или резкого запаха. Речь пациента не нарушена, состояние в период между приступами в норме. При приступе возможна тахикардия, при выдохе слышен свистящий звук, а вдох удлиненный.
- 2-я степень: симптомы проявляются уже чаще, но приступ удушья возникает не более трех раз в неделю.
При приступе пациенту становится тяжело дышать. В легких прослушиваются сухие хрипы. При кашле иногда отделяется мокрота. Состояние пациента беспокойное. Кожа бледнеет, а в области носогубного треугольника она приобретает синеватый оттенок. Выдох бывает затрудненным, с громким свистом.
- 3-я степень: удушье может возникать у астматика ежедневно. Необходима постоянная поддерживающая терапия и медицинское наблюдение.
Наблюдается систематическое нарушение дыхания. У больного появляется холодный пот, его охватывает страх и паника. Свист во время дыхания отчетливо слышен даже с расстояния. Повышается артериальное давление.
- 4-я степень: обострения случаются несколько раз в день, часто симптомы удушья беспокоят ночью. Физическая активность пациента ограничена, так как нагрузка часто провоцирует приступ. Нарушается сон больного. Необходим ежедневный прием препаратов.
- 5-я степень: тяжелое течение астмы, слабо поддающееся коррекции. Назначаются большие дозировки сильнодействующих препаратов. Речь пациента прерывистая. Физическая активность сильно ограничена. Возможен летальный исход при приступе.
Диагностика состоит из нескольких этапов, каждый из которых связан с предыдущим.
- Сбор анамнеза и жалоб. Чаще всего пациент жалуется на одышку, затрудненный выдох, кашель, периодические приступы удушья. Важным критерием является изменение симптоматики при использовании бронхолитиков. Также выясняются факторы риска: наследственность, аллергические реакции и т. д.
- Объективный осмотр. Врач фиксирует одышку у пациента, симптомы возбуждения при приступе, хрипы при аускультации.
- Функциональные тесты. Наиболее простым методом является пикфлоуметрия. Тестирование позволяет врачу оценить тяжесть состояния. Пикфлоуметр должен иметь дома каждый астматик для ежедневного контроля.
- Выявление аллергенов с помощью различных методик. Применяют скарификационные пробы, возможно проведение провокационных тестов.
- Для дифференциальной диагностики назначаются дополнительные методы обследования: рентгенографию органов грудной клетки, ЭКГ, общий анализ крови, исследование мокроты.
Особенно тщательно нужно сопоставлять симптомы и результаты анализов у детей и пожилых людей, так как симптоматика часто отличается от стандартной.
Все средства, которые используются при лечении бронхиальной астмы, указаны в стандарте медицинской помощи.
Главным показателем эффективности лечения является достижение полного контроля над БА.
Принцип лечения заключается в следующем: терапия будет зависеть от степени нарушения функций бронхиального дерева. Количество препаратов и их дозировка с каждой ступенью увеличиваются.
Препараты подбираются с учетом сопутствующих патологий, индивидуальной непереносимости. Каждая ступень предполагает выбор между той или иной группой препаратов.
Если назначенные лекарства не приносят эффекта, осуществляется переход на новый уровень. Все этапы прописаны в стандарте лечения бронхиальной астмы.
- 1-я ступень. Перед тренировками, занятиями спортом, другой физической нагрузкой принимаются ингаляционные препараты, такие как бета2-агонисты, недокромил натрия. Иногда используют теофиллины короткого действия. Однако от их использования часто появляются побочные эффекты, поэтому их применение нежелательно.
- 2-я ступень. Лекарства те же, что и на 1-й ступени, но прием длительный и ежедневный. Используются теофиллины длительного действия. Иногда для лечения применяются ингаляционные гормональные препараты в дозировке до 800 мкг/день.
- 3-я ступень. Пациенту назначаются кортикостероиды в виде аэрозолей в дозировке 800-2000 мкг/день. Помимо них используют бронходилататоры длительного действия в качестве поддерживающей терапии, для уменьшения частоты ночных приступов удушья. В момент приступа применяются бета2-агонисты короткого действия.
- 4-я ступень Астма не поддается контролю, можно только улучшить состояние больного, уменьшить число приступов. Используют ингаляционные гормоны в больших дозах (800-2000 мкг), при тяжелых обострениях кортикостероиды принимают перорально. Бета2-агонисты быстрого действия применяют при приступе у взрослых, но не более 4 раз в сутки.
Обострения БА происходят из-за неправильно подобранной терапии или несоблюдения больным рекомендаций врача. Еще одна возможная причина – длительный контакт с аллергенами.
Часто подобные состояния требуют неотложной медицинской помощи. Нарастает одышка, свистящие хрипы слышны на расстоянии.
При приступе применяются следующие группы препаратов:
- ингаляционные бета2-агонисты: сальбутамол, фенотерол;
- глюкокортикоиды в виде ингаляций;
- ГКС в пероральной форме при тяжелых проявлениях астмы;
- антихолинергические средства – используются при состоянии удушья, угрожающем[М27] жизни больного;
- увлажненный кислород в тех случаях, когда у астматика есть признаки гипоксемии.
Для начала необходимо устранить воздействие аллергена на дыхательные пути ребенка. Терапия астмы у детей (как и у других категорий больных) состоит из базисной терапии и препаратов для купирования приступа.
У детей возникают сложности с применением ингалятора, предпочтительнее использовать спейсер, который является промежуточной емкостью для аэрозоля. Для ингаляций также используют небулайзер.
Для базисной терапии назначают антигистаминные средства и стабилизаторы клеточных мембран. В тяжелых случаях применяют гормональную терапию.
Немедикаментозная терапия бронхиальной астмы по стандартам лечения включает применение ЛФК, массажа, физиопроцедур и санаторно-курортное лечение.
Методы лечения подбираются индивидуально для каждого пациента. Одним из современных методов лечения астмы является аллерген-специфическая иммунотерапия, целью которой является снижение чувствительности организма к определенному аллергену.
Все меры профилактики делятся на те, что направлены на предупреждение развития заболевания и те, что могут замедлить прогрессирование болезни.
Меры первичной профилактики в обязательном порядке должны принимать курильщики, люди с наследственной предрасположенностью к астме и те, кто работает во вредных условиях. Они должны соблюдать все правила гигиены, своевременно лечить заболевания дыхательной системы, исключить контакт с аллергенами и вести здоровый образ жизни.
Профилактика приступов у астматиков включает одновременно лечение и мероприятия по предупреждению обострений.
Исключается действие аллергена, обязателен постоянный прием препаратов, назначенных врачом в соответствии со степенью тяжести астмы. Нельзя самостоятельно отменять препарат или увеличивать дозировку, так как это может привести к нарастанию симптомов.
Медицинская сестра в соответствии с назначением врача должна обучить пациента ежедневно контролировать параметры внешнего дыхания, используя пикфлоуметр в домашних условиях.
Если это возможно, то каждый день нужно выделять время для небольших физических нагрузок.
Астма – это патология, которую при правильном подходе к лечению в соответствии с современными стандартами можно полностью контролировать. Лечение бронхиальной астмы должен назначать специалист.
При этом учитывается степень тяжести заболевания, индивидуальные особенности пациента. В лечении важно наблюдать за реакцией организма на назначаемые препараты.
При обострениях очень важно вовремя принять меры, при необходимости госпитализировать пациента для предотвращения развития осложнений и астматического статуса.
источник
27–28 марта в Виннице состоялась IX научно-практическая конференция «Актуальные проблемы терапии», участниками которой стали представители лечебно-профилактических учреждений Украины. Работу конференции возглавил заведующий кафедрой пропедевтики внутренних заболеваний Винницкого государственного медицинского университета им. Н.И. Пирогова, доктор медицинских наук, профессор Юрий Мостовой, с докладами выступили ведущие ученые нашей страны в области терапии, кардиологии и пульмонологии. Среди них — главный пульмонолог и главный фтизиатр МЗ Украины, директор Института фтизиатрии и пульмонологии им. Ф.Г. Яновского АМН Украины, академик АМН Украины, доктор медицинских наук, профессор Юрий Фещенко, заведующий отделом симптоматических гипертензий Института кардиологии им. Н.Д. Стражеско АМН Украины, доктор медицинских наук, профессор Юрий Сиренко, заместитель директора по научной работе Института кардиологии им. Н.Д. Стражеско АМН Украины, доктор медицинских наук, профессор Михаил Лутай, член-корреспондент АМН Украины, доктор медицинских наук, профессор Екатерина Амосова и др. Генеральным спонсором форума выступила компания «GlaxoSmithKline».
Докладчики осветили вопросы диагностики и лечения артериальной гипертензии, ишемической болезни сердца, хронической сердечной недостаточности, пневмонии и т.д. Однако главным событием стала презентация недавно зарегистрированного в Украине нового комбинированного препарата, предназначенного для эффективного контроля бронхиальной астмы, — СЕРЕТИДА (салметерол + флутиказон). Этот препарат уже прочно вошел в мировую клиническую практику как «золотой стандарт» в лечении бронхиальной астмы. Клиническая эффективность и преимущество СЕРЕТИДА перед другими ингаляционными лекарственными средствами, применяемыми в фармакотерапии бронхиальной астмы, обоснованы с позиций доказательной медицины (Barnes P.J. Scientific rationale for inhaled combination therapy with long-acting
b 2-agonists and corticosteroids // Eur. Respir. J. — 2002. — Vol. 19. — P. 182 – 191).
ЧТО ТАКОЕ БРОНХИАЛЬНАЯ АСТМА?
В президиуме научно-практической конференции «Актуальные проблемы терапии» (слева – направо): заведующий кафедрой пропедевтики внутренних заболеваний Винницкого государственного медицинского университета им. Н.И. Пирогова, доктор медицинских наук, профессор Юрий Мостовой, главный пульмонолог и главный фтизиатр МЗ Украины, директор Института фтизиатрии и пульмонологии им. Ф.Г. Яновского АМН Украины, академик АМН Украины, доктор медицинских наук, профессор Юрий Фещенко, кандидат медицинских наук, доцент кафедры внутренних болезней № 1 Донецкого государственного медицинского университета Надежда Моногарова, продакт-менеджер представительства компании «GlaxoSmithKline» в Украине, кандидат медицинских наук Борис Венгеров.
Бронхиальная астма (БА) — распространенное заболевание, которое приводит к существенному ухудшению качества жизни. В настоящее время в Украине имеет место гиподиагностика данного заболевания, в связи с чем проблема дальнейшего совершенствования выявления БА становится особенно актуальной. 30 декабря 1999 г. Министерством здравоохранения Украины был издан приказ № 311 «Про затвердження інструкцій щодо надання фтизіопульмонологічної допомоги хворим», в основе которого лежит Соглашение (Консенсус) ведущих пульмонологов нашей страны о едином подходе к классификации, определению, диагностике и лечению БА, хронического обструктивного бронхита, пневмонии и туберкулеза. Консенсус был принят на II съезде фтизиатров и пульмонологов Украины, который состоялся в октябре 1998 г. в Киеве. В Приказе № 311 Министерства здравоохранения Украины дано определение, согласно которому БА — это хроническое воспалительное заболевание дыхательных путей, характеризующееся обратимой бронхообструкцией и гиперреактивностью бронхов, проявляющейся повышенной чувствительностью к воздействию различных раздражающих стимулов.
Ю. Фещенко отметил, что определение БА, утвержденное Минздравом Украины, принципиально не отличается от такового, содержащегося в международном Консенсусе по БА. Исходя из определения БА, можно сделать вывод: без купирования воспалительного процесса в бронхах невозможно добиться улучшения клинической картины заболевания, а именно уменьшения гиперреактивности бронхов и бронхообструкции. Поскольку в основе БА лежит специфическая воспалительная реакция с участием эозинофильных гранулоцитов и тучных клеток, фармакотерапевтическая тактика должна включать адекватное воздействие и на специфический воспалительный процесс, и на бронхообструкцию как во время приступов, так и в период между ними.
Необходимо отметить, что воспалительный процесс при БА существенно отличается от такового при хронических обструктивных заболеваниях легких (ХОЗЛ). Если при БА в воспалительный процесс вовлечены эозинофильные гранулоциты и тучные клетки, то при ХОЗЛ — главным образом нейтрофильные гранулоциты. Поэтому подход к лечению БА и ХОЗЛ существенно отличаются. Правда, приступы затрудненного дыхания при указанных заболеваниях сходны, в связи с чем нередко возникает необходимость дифференциальной диагностики этих заболеваний. В случае сочетания БА и ХОЗЛ диагностика еще более усложняется.
К сожалению, в Украине эпидемиологические исследования заболеваемости БА не проводятся. Данные, полученные в ходе исследования, проводившегося в 1982 г., являются последними достоверными сведениями о распространенности и заболеваемости неспецифическими заболеваниями легких, включая БА. Ю. Фещенко подчеркнул, что с 1982 г. за истекший период изменились представление о патогенезе, классификация, подходы к диагностике и лечению этого заболевания, и было неправильным экстраполировать полученные в 1982 г. данные на 2002 г. В настоящее время заболеваемость БА в Украине оценивается практически исключительно по количеству обращения пациентов в лечебно-профилактические учреждения. Однако такую методологию оценки заболеваемости БА вряд ли можно признать объективной, так как в этом случае важную роль играют субъективные факторы (не все пациенты обращаются к врачу по поводу данного заболевания, нередки случаи гиподиагностики БА, не все врачи правильно составляют отчет о вновь выявленном заболевании и т.д.). В нашей стране заболеваемость БА в общей структуре населения составляет 0,3–0,5%, что не соответствует действительности, тогда как в экономически развитых странах этот показатель на порядок выше — 3,7–12%. Хотя, безусловно, существуют определенные географические и популяционные отличия.
Ю. Фещенко сообщил о результатах исследований, которые были проведены по заданию ряда зарубежных фармацевтических компаний. Ученым удалось оценить реальную ситуацию с заболеваемостью БА в Украине. В ходе исследования (2000) было опрошено около 4,5 тыс. семей. У каждого 25-го опрошенного была диагностирована БА. Следовательно, заболеваемость БА составляет не 0,3–0,5% согласно официальным статистическим данным, а 4%. Эта цифра более соответствует действительности. Возможно, при более глубоком исследовании окажется, что заболеваемость БА в Украине составляет около 6,5–7%. Для сравнения: практически у каждого 8-го жителя Польши, нашего ближайшего соседа, выявлена БА; значительная распространенность БА отмечается в Словении, Венгрии и некоторых других странах.
Стоимость лечения БА является важным социальным фактором. Так, в Швеции на лечение одного больного ежегодно выделяют 1315 долл. США (всех больных — 348 млн долл. США); в США — 640 долл. США (6,4 млрд долл. США); в Великобритании — 520 долл. США (1,79 млрд долл. США); в Австралии — 326 долл. США (500 млн долл. США). В Украине расходы в связи с 1 госпитализацией одного больного БА (средняя продолжительность — 14 дней) составляют около 700 грн. Как отметил Ю. Фещенко, для Украины это довольно значительные средства, однако, используются они нерационально. В подавляющем большинстве случаев госпитализации в связи с обострением БА можно было бы избежать, если бы пациенту была назначена рациональная схема фармакотерапии в период между приступами заболевания. Более целесообразно было бы вложить указанные средства в приобретение современных препаратов для лечения БА в период между приступами заболевания. Это позволило бы существенно улучшить контроль клинического течения БА, сохранить трудоспособность и обеспечить надлежащее качество жизни больного, а также избежать госпитализации.
КАК СЕЙЧАС ЛЕЧАТ БРОНХИАЛЬНУЮ АСТМУ В НАШЕЙ СТРАНЕ?
Как сообщил Ю. Фещенко, 62% больных БА находятся под наблюдением врачей общей практики (участковых терапевтов и педиатров), около 16% — под наблюдением врачей-пульмонологов, 12% — врачей-аллергологов. Возникает вопрос: как осуществляется контроль БА у пациентов? Какое лечение в настоящее время получают пациенты с этим тяжелым недугом?
Прежде чем ответить на эти вопросы, необходимо принять во внимание следующее. В Украине отмечена высокая частота госпитализации по поводу обострения БА. Почти каждого 3-го больного в течение года госпитализируют в терапевтическое или пульмонологическое отделение стационара. В Европе это самый высокий показатель госпитализации по поводу обострения БА. Причиной этого является нерациональное лечение пациентов с данным заболеванием и, следовательно, недостаточный контроль БА. В странах Центральной Европы госпитализация больных по поводу обострения БА является казуистикой.
Ю. Фещенко особо подчеркнул, что БА в период обострения хорошо поддается рациональной фармакотерапии, проводимой в амбулаторных условиях. Показанием к госпитализации может быть лишь наличие серьезного сопутствующего заболевания — сахарного диабета, почечной недостаточности, пептической язвы желудка и двенадцатиперстной кишки и т.п. Таким образом, высокий процент госпитализации пациентов с БА в Украине свидетельствует о том, что им уделяется недостаточное внимание со стороны врачей, а также о том, что больным назначают неэффективные схемы лечения, включающие в подавляющем большинстве случаев симптоматические средства. Между тем рациональное использование эффективных патогенетических лекарственных средств (ингаляционных кортикостероидов) наряду с симптоматическими в 99% случаев позволяет избежать госпитализации.
Недостаточное понимание патогенеза БА и неосведомленность в результатах масштабных рандомизированных клинических исследований приводят к необоснованным заявлениям о том, что использование ингаляционных кортикостероидов при БА не оказывает желаемого эффекта. Однако истинная причина не в том, что ингаляционные кортикостероиды являются неэффективными, а в том, что нерациональное использование создает мнимое впечатление об их неэффективности. Между тем ведущие специалисты в области диагностики и лечения БА относят ингаляционные кортикостероиды к базисным препаратам для лечения этого заболевания.
КАК НЕОБХОДИМО ЛЕЧИТЬ БРОНХИАЛЬНУЮ АСТМУ
Согласно Консенсусу, принятому на II съезде фтизиатров и пульмонологов Украины, а также аналогичным официальным документам Европейского респираторного общества и Американской торакальной ассоциации, только при интермиттирующем течении БА в период обострения заболевание сопровождается воспалительной реакцией со стороны бронхов, которая в период между приступами может отсутствовать. Для персистирующей БА (с легким, средней тяжести и тяжелым течением) в период между обострениями заболевания характерно постоянное наличие воспалительной реакции со стороны бронхов. В общей структуре течения БА интермиттирующее течение отмечено в 28%, легкое персистирующее в 25%, средней тяжести в 31%, тяжелое в 16% случаев. Поэтому необходим индивидуальный подход к диагностике и лечению больных БА.
Как лечить пациентов с БА? В упомянутом выше Приказе Министерства здравоохранения № 311 от 30 декабря 1999 г. приводится современная схема лечения больных БА в зависимости от стадии и течения заболевания. При интермиттирующем течении заболевания рекомендуется применение в основном b 2-агонистов короткого действия. К этой группе препаратов относится хорошо зарекомендовавший себя в клинической практике Вентолин (сальбутамол). При второй стадии заболевания (персистирующая легкая) в целях проведения противовоспалительной терапии рекомендуется раннее назначение ингаляционных кортикостероидов. Как подчеркнул Ю. Фещенко, альтернативы проведению ингаляционной корикостероидной терапии на сегодняшний день не существует.
ИНГАЛЯЦИОННЫЕ КОРТИКОСТЕРОИДЫ
Мнение о том, что кортикостероидные препараты необходимо применять лишь на поздних стадиях заболевания и в невысоких дозах является несостоятельным. Ингаляционные кортикостероиды обладают выраженным противовоспалительным эффектом. Благодаря низкой биодоступности современных ингаляционных кортикостероидов они практически не оказывают системного действия. Начинать терапию ингаляционными кортикостероидами необходимо с максимально высоких индивидуально-подобранных доз, а затем в зависимости от клинического течения заболевания снижать дозу до поддерживающей.
В перерыве участники форума обсуждают пути внедрения СЕРЕТИДА в отечественную клиническую практику
В клинике острых состояний при БА используют системные кортикостероиды в форме таблеток и раствора для инъекций. В некоторых случаях наиболее рационально начинать фармакотерапию с назначения инъекционных форм кортикостероидов, а затем в течение короткого периода перейти на использование ингаляционных препаратов. Необходимо учесть, что при использовании ингаляционных кортикостероидов клинический эффект не проявляется мгновенно. Для достижения клинического эффекта необходимо 4–7, а иногда 10 дней. При этом препараты воздействуют на воспалительный очаг локально, не абсорбируясь в кровь. С помощью кортикостероидов в течение короткого времени можно устранить обострение, значительно ослабить выраженность хронического воспалительного процесса.
Ингаляционные кортикостероиды являются препаратами высокой степени безопасности. У лиц, принимавших ингаляционные кортикостероиды, практически не отмечено развития кушингоидного синдрома. В течение 18 лет лишь у нескольких женщин, принимавших ингаляционные кортикостероиды, зафиксировано развитие остеопороза. Между тем остается недоказанным, что именно ингаляционные кортикостероиды являются причиной развития остеопороза.
Назначение кортикостероидов больным БА еще 20 лет назад звучало как приговор. Сегодня же, основываясь на принципах доказательной медицины, подтверждена высокая эффективность ингаляционных кортикостероидов на всех стадиях персистирующей БА.
В Украине для лечения БА в 57% случаев используют симптоматические препараты и только в 4% случаев — противовоспалительные. Хотя справедливости ради нужно отметить, что в последнее время наметилась положительная тенденция к более широкому назначению ингаляционных кортикостероидов. К тому же фармацевтический рынок страны насыщен ингаляционными кортикостероидами.
Исходя из вышеизложенного, нет причин не назначить больным с персистирующей БА ингаляционные кортикостероиды. В этом отношении представляет интерес опыт Литвы, где распространенность БА, а также количество средств, выделяемых государством для лечения этого заболевания, приблизительно соответствуют таковым в Украине. Однако в Литве основными лекарственными средствами, применяемыми для лечения БА, являются ингаляционные кортикостероиды, в то время как в Украине — b 2-агонисты короткого действия.
Следует полагать, что высокий показатель смертности вследствие БА, который сегодня в Украине составляет 3 на 100 тыс. населения, в значительной степени обусловлен неоправданной фармакотерапевтической тактикой лечения этого заболевания.
b 2—АГОНИСТЫ ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ
В последние годы разработаны b 2-агонисты пролонгированного действия, одним из представителей которых является Серевент (салметерол). Как отметил Ю. Фещенко, в настоящее время этот препарат используют недостаточно. Некоторые сетуют на его высокую стоимость. Между тем общепризнанным является тот факт, что высокоэффективное, безопасное и качественное лекарственное средство, выпускаемое в удобной для применения лекарственной форме, хотя и стоит недешево, однако характеризуется высокой комплаентностью. Украина, вероятно, является одной из немногих европейских стран, которые для лечения БА все еще используют орципреналин (неселективный агонист b -адренорецепторов). Однако этот метод уже давно устарел. Необходимо помнить о том, что в результате передозировки орципреналина может наступить внезапная смерть вследствие остановки сердца. Этот факт стал причиной запрета на применение орципреналина в клинической практике в экономически развитых странах.
КОМБИНИРОВАННАЯ ТЕРАПИЯ БРОНХИАЛЬНОЙ АСТМЫ. ПОЧЕМУ СЕРЕТИД?
Как отметила главный аллерголог Донецкой области Ольга Федорченко, основными базисными препаратами для лечения БА являются кортикостероиды. Поскольку БА сопровождается сужением просвета бронхов вследствие их гиперреактивности и воспаления, рациональное лечение заболевания должно включать применение b 2-агонистов пролонгированного действия и ингаляционных кортикостероидов. Учитывая, что наилучшие клинические результаты были получены при совместном применении Фликсотида (флутиказон) и пролонгированного агониста блокаторов b 2-адренорецепторов — Серевента (салметерол), было высказано предложение соединить эти два действующих вещества в одном препарате. В результате был создан препарат СЕРЕТИД, который оказался более эффективным по сравнению с известными препаратами, предназначенными для ингаляционного применения при БА (Barnes P.J. Scientific rationale for inhaled combination therapy with long-acting b 2-agonists and corticosteroids // Eur. Respir. J. — 2002. — Vol. 19.— P. 182 – 191).
ДОКАЗАТЕЛЬСТВА СИНЕРГИЗМА ФЛУТИКАЗОНА И САЛМЕТЕРОЛА
В основе высокой клинической эффективности СЕРЕТИДА лежит взаимодействие кортикостероида и b 2-агониста на клеточном уровне за счет общих механизмов сигнальной трансдукции. b 2-Агонисты расслабляют гладкую мускулатуру дыхательных путей, препятствуют освобождению медиаторов воспаления из тучных клеток, экссудации плазмы крови и угнетают активацию сенсорных нервных окончаний, кортикостероиды подавляют провоспалительную активность Т-лимфоцитов, эозинофильных гранулоцитов, макрофагов и дендритных клеток, в результате чего уменьшаются выраженность воспалительного процесса и гиперреактивность бронхов. Для достижения оптимального контроля БА необходимо сочетать применение b 2-агонистов пролонгированного действия и ингаляционных кортикостероидов.
«Все, чего человечество стремилось достичь в лечении бронхиальной астмы, оно уже достигло. Поставленную перед учеными задачу создать лекарственные средства, эффективность которых можно было бы сравнить с таковой системных кортикостероидов, а риск побочных реакций которых был бы минимальным, в настоящее время можно считать выполненной. Появление ингаляционных кортикостероидов можно расценить как качественный скачок в медицине. Теперь перед учеными стоит новая задача: попытаться отделить на молекулярном уровне терапевтический эффект препарата от побочного. Решение этой задачи будет следующим принципиальным шагом вперед».
P.J. Barnes, профессор, руководитель отдела респираторной медицины Королевского колледжа (Великобритания), «The Financial Express» от 12 марта 2000 г.
Флутиказон, проникая через клеточную мембрану в неизмененном виде, соединяется со специальным глюкокортикоидным рецептором, который находится в цитоплазме клетки, превращая его из неактивной формы в активную. Комплекс флутиказон — рецептор проникает в ядро клетки и связывается с соответствующими участками ДНК (GRE, — Glucocortico >b 2-адренорецептора. Это обусловлено тем, что промотор данного гена содержит участки GRE, поэтому b 2-агонисты стимулируют транскрипцию информационной РНК b 2-адренорецептора. В итоге на поверхности мембраны клетки увеличивается количество упомянутых выше рецепторов и чувствительность клетки к воздействию салметерола повышается. Это имеет исключительно важное значение при подборе эффективной схемы терапии БА, так как в процессе длительного применения b 2-агонистов наступает десенситизация (снижение чувствительности) b 2-адренорецепторов с последующим снижением клинической эффективности вышеупомянутых лекарственных средств. Применение ингаляционных кортикостероидов способствует образованию новых b 2-адренорецепторов, в результате чего клиническая эффективность комбинированного приема салметерола и флутиказона с течением времени по крайней мере не уменьшается.
Кроме того, необходимо принять во внимание, что бронходилатирующий эффект b 2-агониста осуществляется через вторичный мессенджер — циклический аденозинмонофосфат (цАМФ), который образуется в результате взаимодействия комплекса b 2-агонист — b 2-адренорецептор с G-белком и АТФ. При воспалительном процессе происходит избыточное образование фермента G-протеин-рецепторной киназы (GRK-2), который вызывает отсоединение G-белка от лигандрецепторного комплекса. Образование цАМФ уменьшается, что проявляется снижением клинической эффективности b 2-агониста. Флутиказон, устраняя воспалительный процесс, обеспечивает снижение активности фермента GRK-2. Комплекс b 2-агонист — b 2-адренорецептор — G-белок оказывается более стойким, что обеспечивает надлежащий клинический эффект салметерола.
Салметерол наряду с бронхолитическим действием может усиливать действие кортикостероидов — повышать плотность кортикостероидных рецепторов в ядре, а также увеличивать сродство флутиказона к рецепторным участкам ДНК, что способствует усилению транскрипции генов, отвечающих за синтез противовоспалительных соединений.
Салметерол усиливает способность флутиказона подавлять индуцированное аллергеном образование интерлейкинов в периферических мононуклеарах, оказывающих провоспалительное действие. Кроме того, угнетается образование молекул межклеточной адгезии (ICAM-1) в фибробластах, которые играют важную роль в воспалительном процессе. Таким образом, одновременное применение флутиказона и салметерола оказывает синергическое противовоспалительное и бронхолитическое влияние при БА.
ДОКАЗАТЕЛЬНАЯ МЕДИЦИНА
Ольга Федорченко отметила, что почти половина больных БА, которые получают плацебо, выбывают из клинического исследования уже на 14-й день. Среди пациентов, которые принимали салметерол, число выбывших было меньше. В случае, когда флутиказон назначают в суточной дозе 250 мг, определенный процент больных БА все же выбывает из исследования вследствие резистентности к проводимому лечению. Только при использовании СЕРЕТИДA, практически все больные участвовали в клиническом исследовании вплоть до его завершения (продолжительность исследования — 84 дня).
Важным преимуществом СЕРЕТИДА является высокая комплаентность. Препарат принимают 1–2 раза в сутки. При этом терапевтический эффект развивается с 1-го дня и со временем не уменьшается. Применение СЕРЕТИДА позволяет назначать ингаляционные кортикостероиды в более низкой дозе. При необходимости концентрация флутиказона в одной дозе может варьировать от 100 до 500 мкг. Следует отметить, что СЕРЕТИД более эффективно, чем будезонид, устраняет симптомы воспаления в бронхах, а также способствует улучшению некоторых спирометрических показателей (например, FEV1). Кроме того, клиническая эффективность СЕРЕТИДА превышала таковую отдельно взятых флутиказона и салметерола.
Применяя СЕРЕТИД, в более чем 25% случаев удавалось добиться полного контроля симптомов БА уже в течение 5–12 нед. Используя Фликсотид, такого успеха можно добиться приблизительно в 10% случаев, а Серевент — еще у меньшего количества больных.
В настоящее время СЕРЕТИД признан «золотым стандартом» в терапии БА. Его применение обеспечивает снижение общей стоимости лечения, так как оптимальный контроль за течением БА устанавливается в более сжатые сроки по сравнению с другими препаратами. Кроме того, отпадает необходимость назначать ингаляционные кортикостероиды в высоких дозах, в результате чего также снижается общая стоимость курсовой терапии, что немаловажно при лечении детей с БА. При надлежащем использовании СЕРЕТИДА практически не возникает потребности в госпитализации. Высокая степень безопасности позволяет избежать отрицательного влияния на состояние здоровья пациента, а также дополнительных затрат, связанных с устранением побочных реакций.
В настоящее время активно развиваются новые технологии создания лекарственных средств с использованием передовых достижений фармакогеномики, фармакопротеомики и биотехнологии. Вместе с тем представляется маловероятным, что в недалеком будущем появятся более эффективные, чем b 2-агонисты и ингаляционные кортикостероиды, препараты. Для большинства инновационных молекул характерен более узкий спектр действия по сравнению с вышеупомянутыми классами лекарственных препаратов. Поэтому они воздействуют на меньшее количество звеньев патологического процесса при БА, а следовательно, менее эффективны. Антилейкотриеновые средства, например, блокируют только один из многих провоспалительных медиаторов, вследствие чего его применение при БА является неэффективным. Моноклональные антитела к провоспалительным интерлейкинам, которые входят в состав препарата меполизумаба, эффективно снижают содержание эозинофильных гранулоцитов в дыхательных путях, однако не влияют на другие звенья воспалительного процесса, что также не позволяет его применять для лечения данного заболевания. Этот ряд можно было бы продолжить. К тому же инновационные препараты, созданные с помощью биотехнологических методов, являются дорогостоящими. Конечно, это не исключает возможности разработки новых эффективных препаратов для лечения БА в более отдаленной перспективе. Тем не менее, как считает P.J. Вarnes (2002), поступление на фармацевтический рынок альтернативного ингаляционным кортикостероидам лекарственного средства в ближайшие 10–15 лет не предвидится.
Учитывая тот факт, что на разработку инновационного препарата и его запуск на фармацевтический рынок уходит в среднем, 15 лет, вряд ли следует ожидать в ближайшем будущем появления более нового эффективного средства для лечения БА. Радует то, что на украинском фармацевтическом рынке уже появился препарат СЕРЕТИД — «золотой стандарт» в лечении и осуществлении оптимального контроля течения данного заболевания. Научно-практическая конференция в Виннице показала, что врачи готовы использовать СЕРЕТИД в клинической практике, назначая их своим пациентам.
Виктор Маргитич
Фото Евгения Кривши
1. Chapman K.R. Seretide for obstructive lung disease // Expert. Opin. Pharmacother. — 2002. — Vol. 3 (3). — P. 341-350.
2. Abbott M.B., Levin R.H. What’s new: newly approved drugs for children // Pediatr. Rev. — 2001 — Vol. 22 (10). — P. 357-359.
3. Nelson H.S. Advair (Seretide): combination treatment with fluticasone propionate / salmeterol in the treatment of asthma // J. Allergy Clin. Immunol. — 2001. — Vol. 107 (2). — P. 398-416.
4. Palmqvist M., Arvidsson P., Beckman O., Peterson S., Lotvall J. Onset of bronchodilation of budesonide / formoterol vs. salmeterol / fluticasone in single inhalers // Pulm. Pharmacol. Ther. — 2001. — Vol. 14 (1). — P. 29-34.
источник