МУЖСКАЯ РЕПРОДУКТИВНАЯ ФУНКЦИЯ ПРИ ЭПИЛЕПСИИ
Практикующие врачи нередко воспринимают мужской фактор бесплодия как самостоятельное заболевание, чему способствует и то, что мужское бесплодие отдельно обозначено в Международной классификации болезней (МКБ-10). Тем не менее мужская инфертильность и субфертильность фактически
являются синдромами, которые развиваются вследствие воздействия какого-либо этиологического фактора или наличия определенного первичного заболевания. Одним из заболеваний, существенно влияющих на репродуктивную функцию мужчины, является эпилепсия. Согласно статистическим данным, эпилепсией
страдают до 3% населения, большую часть из которых составляют мужчины. Аномальное функционирование гипоталамо-гипофизарной системы при эпилептических разрядах головного мозга может вызывать эндокринные нарушения, сказывающиеся на фертильности, а выделение в семенную жидкость некоторых
антиконвульсантов и их метаболитов способно приводить к снижению подвижности сперматозоидов. Данные теоретические соображения вызывают интерес к изучению репродуктивной способности мужчин, страдающих эпилепсией.
Материал и методы. Обследовано 27 пациентов мужского пола, страдающих эпилепсией, средний возраст которых составил 31,8 лет (23–40 лет). Все отобранные для исследования пациенты состояли в браке. Пациенты были разделены на две группы. В группу I вошли 11 мужчин, у которых эпилепсия связана с инструментально подтвержденными врожденными аномалиями центральной нервной системы. В группу II вошли 16 мужчин с посттравматической эпилепсией; медиана срока, прошедшего с момента получения травмы, – 1,6 года. Также была сформирована сопоставимая по возрасту контрольная группа, в которую вошли 15 соматически и неврологически здоровых мужчин, состоящих в браке.
В ходе беседы с врачом выяснялся репродуктивный анамнез пациентов, наличие детей в семье, продолжительность периода активной половой жизни до наступления беременности. Под бесплодным браком понималась ситуация, когда в паре за один год при активной половой жизни без использования методов контрацепции не наступала беременность. Статистический анализ проводился с помощью критерия хи-квадрат.
Результаты и обсуждение. В группе I бесплодный брак в анамнезе отмечался у 7 (63,6%) пациентов, отмечена статистически значимая разница с контрольной группой (p 0,05). Нарушения фертильности являются нередкой находкой у молодых мужчин, страдающих эпилепсией. Субфертильность и инфертильность могут наблюдаться у пациентов, больных эпилепсией с детского или подросткового возраста, что может быть связано с длительной нейроэндокринной дисрегуляцией под влиянием эпилептогенного очага в головном мозге и продолжительной, нередко агрессивной, антиконвульсантной терапией. Напротив, показатели фертильности пациентов с посттравматической эпилепсией и небольшой продолжительностью заболевания, по-видимому, не отличаются от показателей основной популяции.
ЭРЕКТИЛЬНАЯ ДИСФУНКЦИЯ ПРИ ЭПИЛЕПСИИ
Эпилепсия является одним из самых распространенных заболеваний центральной нервной системы; согласно статистическим данным, ей страдают до 3% населения. Отмечено, что у пациентов с эпилепсией нередко наблюдается полиморфная сексуальная дисфункция. Достаточно хорошо изучена и описана репродуктивная патология у женщин, больных эпилепсией. При этом до сих пор остается малоизученным состояние сексуальной и репродуктивной функций у пациентов мужского пола, так как в этой группе подобные нарушения менее явны, чем у женщин. Одним из показателей, характеризующих мужскую половую функцию, является качество эрекции. При эпилепсии возможны различные сочетания разнородных патогенетических факторов, вызывающих в совокупности эректильную дисфункцию: это эндокринный компонент, связанный с дисрегуляцией гипоталамо-гипофизарной системы при эпилептических разрядах, нейрогенный компонент, связанный с поражением центрального звена дуги эректильного рефлекса, а также побочные эффекты постоянно принимаемых антиконвульсантов. Целью работы была оценка встречаемости и патофизиологической характеристики эректильной дисфункции у пациентов, страдающих эпилепсией.
Обследовано 32 пациента мужского пола, страдающих эпилепсией, средний возраст которых составил 31,4 года (21–40 лет). Пациенты были разделены на две группы. В группу I вошли 15 мужчин, у которых эпилепсия связана с врожденными аномалиями центральной нервной системы. В группу II вошли 16 мужчин с посттравматической эпилепсией; медиана срока, прошедшего с момента получения травмы, – 1,6 года. Также была сформирована сопоставимая по возрасту контрольная группа, в которую вошли 15 соматически и неврологически здоровых мужчин. Информация об эректильной функции пациентов была получена в ходе беседы с врачом-андрологом, при заполнении валидизированной анкеты «Международный индекс эректильной функции» (МИЭФ-5). Наличие заболеваний, ассоциированных с нарушениями гемодинамики малого таза, являлось критерием исключения. Статистический анализ проводился с помощью t-теста Стьюдента и критерия согласия Пирсона (хи-квадрат).
Результаты. В группе I средний балл по опроснику МИЭФ-5 составил 13,6, что соответствует умеренно выраженной эректильной дисфункции; при этом отмечена статистически значимая разница с контрольной группой (p 0,05). 11
(73,3%) пациентов из группы I отметили отсутствие выраженных утренних эрекций и слабые мастурбационные эрекции, что позволило исключить психогенную эректильную дисфункцию; все мужчины из контрольной группы и группы II отмечали сохранность утренних эрекций (p
источник

Неврологами давно принято, что гормоны различными путями участвуют в проявлениях эпилепсии и в ее лечении АЭП. Например, определение повышенной концентрации пролактина в сыворотке крови после события, напоминающего эпилептический приступ, используется при проведении дифференциальной диагностики эпилептического приступа и неэпилептического события. Кроме того, лечение инфантильных спазмов при помощи адренокортикотропного гормона является стандартным подходом. Эти относительно распространенные варианты обычно не воспринимаются как часть нейроэндокринологии, но они ясно подтверждают наличие связи между нейростероидными гормонами и эпилепсией.
Динамическая роль гормонов при эпилепсии разноплановая, с вовлечением множества факторов. В этой статье описаны результаты основных исследований по изучению нейростероидов в контексте эпилепсии, нарушению гипоталамической гормональной регуляции при эпилепсии, а также влиянию АЭП на гормоны репродуктивной системы. На рис. 1 представлены гипоталамо-гипофизарная ось у женщин и мужчин, в том числе гормоны, имеющие отношение к тематике этой статьи. Обсуждены относящиеся к вопросу клинические варианты, в том числе катамениальная эпилепсия (приступы, связанные с менструальным циклом), синдром поликистозных яичников (СПКЯ), проблемы фертильности, перименопаузального и менопаузального периодов. Варианты тактики ведения пациентов предложены с учетом результатов, представленных в следующих разделах.
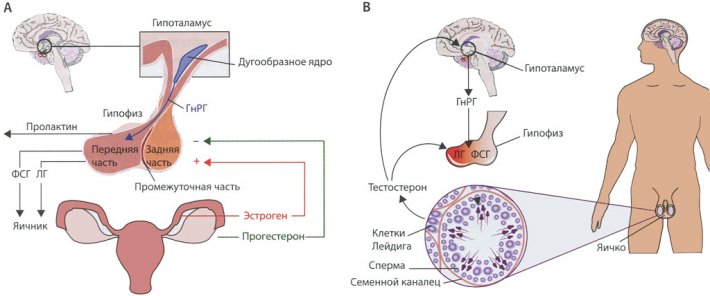
Рисунок 1. Гипоталамо-гипофизарная ось у женщин и мужчин.
Гормоны, имеющие отношение к тематике данной статьи, показаны у женщин (А) и мужчин (В).
ФСГ – фолликулостимулирующий гормон.
ЛГ – лютеинизирующий гормон.
ГнРГ – гонадотропин-рилизинг гормон.
Нейростероиды представляют собой молекулы стероидов, которые оказывают модулирующее воздействие на возбудимость головного мозга и, следовательно, могут влиять на развитие приступов. Эстроген и прогестерон, основные половые гормоны женщин, влияют на нейрональную возбудимость. Сложное воздействие эстрогена на нервную возбудимость осуществляется посредством двух механизмов. К первому относят негеномное воздействие с коротким латентным периодом, которое предположительно опосредуется через мембрану нейронов. Например, после воздействия 17β-эстрадиола на клетку гиппокампа при помощи метода локальной фиксации потенциала в конфигурации «whole cell» (Метод локальной фиксации потенциала (patch-clamp technique) – электрофизиологический метод локальной фиксации потенциала, используемый для изучения клеток, клеточных мембран, ионных каналов и, иногда, изолированных органелл; существуют различные модификации и конфигурации метода. Если по условиям эксперимента необходимо менять состав внеклеточной среды, используют конфигурацию «whole cell» («целая клетка»). В этом случае пипетку не отводят от клетки, а подают в нее отрицательное давление и таким образом разрушают изолированный фрагмент мембраны, при этом сохраняются клеточные структуры и регуляторные механизмы.) было выявлено усиление каинат-индуцированных токов. Такое воздействие имеет быстрое начало, является обратимым и дозозависимым, что соответствует мембранному эффекту. Ко второму, более тщательно изученному механизму, относят геномное воздействие с длительным (часы и дни) латентным периодом. Как и другие стероидные гормоны, эстроген пассивно проникает в клетку, где связывается с рецептором эстрогена и активирует его; рецептор представляет собой димерный ядерный белок, который связан с ДНК и контролирует генную экспрессию. После связывания эстрогена с рецептором этот комплекс образует фактор транскрипции, который связывается с гормон-чувствительными элементами генов и модифицирует клеточные ответные реакции. Примером этого воздействия служит эстрадиол-индуцированное повышение плотности сайтов связывания агонистов на NMDA-рецепторном комплексе (N-methyl-D-aspartate — N-метил-D-аспартат) в клетках гиппокампа, которое может быть зарегистрировано спустя 2 дня после начала лечения эстрадиолом. Давно было высказано предположение, что эстроген обладает проконвульсивными свойствами, но это влияние может быть более сложным, зависит от дозы, пути и кратности введения (однократного или длительного), природного гормонального фона и вида эстрогена. В целом в пределах физиологических концентраций эстроген, по-видимому, не является сильным проконвульсантом. Женщины с эпилепсией, однако, могут быть чувствительны к нейрофизиологическому проконвульсивному эффекту этого гормона в период стремительного эстрогенового пика, связанного с овуляцией.
При этом прогестерон, очевидно, способствует торможению нервной системы, в основном за счет воздействия его редуцированного метаболита аллопрегнанолона, который выступает положительным аллостерическим модулятором проводимости через ГАМК-ергические каналы. При исследовании на экспериментальных моделях установлено, что циклическое повышение и снижение концентрации прогестерона и аллопрегнанолона предсказуемо изменяло предрасположенность к развитию приступов, хотя неизвестно, объясняется ли полностью обострение катамениальных приступов этим циклическим гормональным влиянием.
Воздействие аллопрегнанолона на проводимость ГАМК-ергических каналов подчинено механизму обратной связи в пределах ГАМКА-рецептора. Компоненты субъединицы ГАМКA-рецептора подвергаются компенсаторным перестройкам в ответ на изменения эндогенных нейростероидов и при применении медикаментозных средств, оказывающих модулирующее влияние на ГАМКА-рецепторы, например, бензодиазепинов. Длительное воздействие аллопрегналона на крыс провоцирует усиление экспрессии α4-субъединицы ГАМКА-рецептора в гиппокампе, что приводит к снижению чувствительности ГАМКА— рецепторов к бензодиазепинам.
Другой основной половой гормон — тестостерон — также является нейростероидом. Тестостерон имеет два основных класса биологически активных метаболитов, оказывающих противоположное действие на нервную возбудимость: эстрогены, которые образуются под воздействием ароматазы, фермента системы цитохрома Р450, и 5α-редуцированные андрогены. Ароматаза и 5α-редуктаза экспрессируются в нескольких системах органов, в том числе и в головном мозге. 5α-Редуцированные андрогены оказывают преимущественно антиконвульсантный эффект, частично из-за их способности выступать в качестве субстратов для биосинтеза 5α-андростан- Зα-диола (5α-androstane-3α-diol — 3α-DIOL). Эта молекула структурно сходна с аллопрегнанолоном, образуется через сходный метаболический путь при помощи редукции и модулирует активность ГАМКА— рецептора таким же способом. Зα-DIOL синтезируется на периферии — в предстательной железе, печени и коже, а также глиальными клетками de novo в головном мозге. Установлено, что Зα-DIOL действует в зависимости от дозы как антиконвульсант при приступах у мышей, вызванных введением антагонистов ГАМКА-рецепторов — пентилентетразола, пикротоксина и сложного эфира (3-карболина. При изучении пентилентетразоловой модели приступов метаболит Зα-DIOL продемонстрировал мощный антиконвульсантный эффект. Потенциальная значимость Зα-DIOL для осуществления антиконвульсантного действия циркулирующих андрогенов была обнаружена на мышах с нокаутом гена 5α-редуктазы, у которых тестостерон не оказывал защитного влияния против приступов. Два других метаболита эндогенного тестостерона — андростерон и этиохоланолон, которые содержатся в довольно высоких концентрациях у мужчин, также обладают антиконвульсантными нейростеройдными свойствами. Оба метаболита продемонстрировали защитное действие против приступов у взрослых мышей мужского пола разной выраженности и в разных моделях, в том числе при воздействии 6 Гц электрической стимуляции, введении пентилентетразола, пилокарпина, 4-аминопиридина, по данным теста максимального электрошока, а также результатов исследования препаратов среза гиппокампа.
У женщин с эпилепсией отмечаются повышенные показатели развития СПКЯ и бесплодия, снижение либидо, а также раннее наступление менопаузы. Эпилепсия сама по себе действует как дезинтегратор работы эндокринной системы и приводит к развитию гипоталамической дисфункции, что в свою очередь, как правило, оказывает противоположное влияние на концентрацию андрогенов у мужчин и женщин — то есть у мужчин активность андрогенов снижается, а у женщин — повышается. Влияние эпилепсии на центральную репродуктивную деятельность сочетается с метаболическими нарушениями, вызванными воздействием АЭП на те половые гормоны, которые имеются и у мужчин и у женщин.
Области лимбической коры, в частности миндалевидное тело, имеют обширные реципрокные связи с гипоталамусом и могут оказывать модулирующее влияние на гипоталамо-гипофизарно-гонадную ось (рис. 1). У женщин и мужчин с эпилепсией наблюдается нарушение высвобождения гормонов гипофиза. Нарушение высвобождения фолликулостимулирующего гормона (ФСГ) и лютеинизирующего гормона (ЛГ) развивается вслед за дисфункцией клеток гипоталамуса, продуцирующих гонадотропин-рилизинг гормон (ГнРГ). ГнРГ, вырабатываемый небольшим количеством клеток, расположенных преимущественно в преоптической области гипоталамуса, контролирует активность гонад посредством секреции пульсирующего типа и стимуляции высвобождения гормонов гипофиза.
Популяция ГнРГ-продуцирующих клеток уязвима к повреждению во время приступов. У крыс женского пола с приступами, индуцированными введением каиновой кислоты в миндалевидное тело, была отмечена ипсилатеральная потеря ГнРГ-окрашенных волокон в гипоталамусе. Латерализация височной эпилепсии, по-видимому, связана с определенными типами дисфункции половой системы. В ходе обследования 30 женщин со сложными парциальными приступами, у которых эпилептиформные разряды регистрировались в височных долях унилатерально, и были доказательства эндокринных нарушений репродуктивной системы, левосторонние разряды сочетались с СПКЯ, а правосторонние — с гипогонадотропным гипогонадизмом. Согласно определению последнее представляет собой эндокринопатию репродуктивной системы центрального (гипоталамического или гипофизарного) происхождения.
Как правило, АЭП, которые индуцируют печеночные ферменты метаболизма, известны как фермент-индуцирующие АЭП, и оказывают непосредственное влияние на изменение уровня половых гормонов (рамка 1). Они также индуцируют выработку глобулина, связывающего половые гормоны (ГСПГ), которые снижают концентрацию биологически активных (свободных) половых гормонов в сыворотке крови. Сообщалось о существенном повышении уровня ГСПГ у мужчин с фокальной эпилепсией, получавших карбамазепин и фенитоин, по сравнению с получавшими ламотриджин и здоровыми лицами группы контроля. Снижение уровня свободного тестостерона было отмечено у мужчин, принимающих карбамазепин, фенитоин, окскарбазепин и вальпроаты, и у лиц с парциальной эпилепсией, которым не проводили лечение.
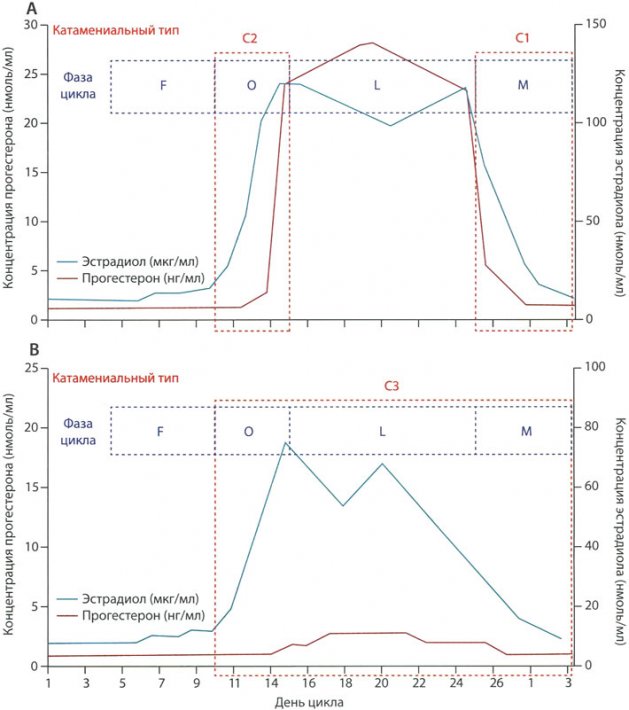 Паттерны катамениальной эпилепсии
Паттерны катамениальной эпилепсии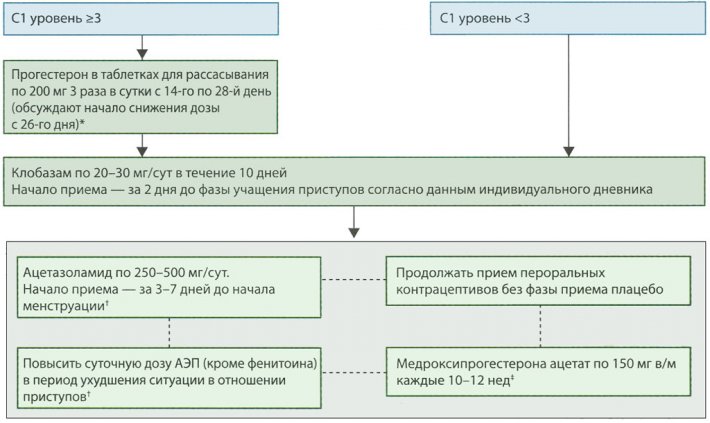 Алгоритм лечения катамениальных приступов при выявлении паттерна С1
Алгоритм лечения катамениальных приступов при выявлении паттерна С1