Исследование неслучайной инактивации Х-хромосомы – это метод генетической диагностики, при помощи которого исследуют состояние активной (функционирующей) Х-хромосомы клеток женского организма.
| Сроки выполнения | до 15 дней |
| Синонимы (rus) | Анализ неравновесной инактивации Х-хромосомы, определение неслучайной инактивацииглавной Х-хромосомы |
| Cинонимы (eng) | X-inactivation |
| Методы | Цитогенетическое тестирование при помощи спектрального кариотипирования |
| Единицы измерения | Результат представлен в виде специальной записи, отражающей структуру хромосомного набора. В заключении непосредственно указывается обнаружена, или не обнаружена инактивация Х-хромосомы. |
| Подготовка к исследованию | Забор биологического материала и подготовка к его сдаче производится по общим правилам. Лучше сдавать анализ в первой половине дня, исключить употребление пищи и курение не менее, чем за 2 часа. За неделю до забора крови должны быть исключены вредные воздействия на организм, в том числе медикаментозные. |
| Тип биоматериала и способы его взятия | Кровь из вены исследуемой женщины |

На протяжении жизни женщины, размножающиеся клетки передают активированную и инактивированную хромосому дочерним клеткам. Если активная хромосома сохраняет свою структуру, женский организм идеально функционирует. Но в тех случаях, когда эта Х-хромосома становится жертвой небольших мутаций (как правило, это делеции – отрыв фрагментов), включается специальный ген XIST. Он запускает неслучайную инактивацию измененной активной хромосомы. При этом она утрачивает часть своих функций. В первую очередь, страдает возможность полноценно кодировать информацию в отношении детородных функций женского организма.
Важно помнить! Анализ неравновесной инактивации Х-хромосомы – это не что иное, как определение состояния единственной функционирующей женской половой хромосомы. Обнаружение ее структурных изменений является свидетельством частичной утраты функций, что не может не сказаться на функциональных возможностях женского организма!
Исследуя структуру Х-хромосом женщины на предмет обнаружения неравновесной инактивации, можно сделать вывод о причинах женского бесплодия или нарушений менструально-овуляторной деятельности. Целесообразность приводить подобное исследование возникает при:
- Стойком бесплодии у женщин всех возрастных групп;
- Склерополикистозе яичников;
- Преждевременном истощении и увядании яичников;
- Некорригируемых перепадах гормональной активности яичников, сочетающихся любыми нарушениями их структуры.
Оценкой результатов анализа должен заниматься исключительно знающий специалист. В заключении указывается обнаружена или не обнаружена неслучайная Х-хромосомная инактивация. Если она имеет место, это говорит, что проблема бесплодия или другие нарушения женской половой сферы вызваны поломками на генном уровне.
Стоимость анализов Вопрос: Здравствуйте! Просьба, написать стоимость следующих анализов. Планирую сдавать в г.Сочи Старонасыпная ул., 22, микрорайон Адлер, БЦ Офис Плаза, эт. 2 Для женщины: 1.УЗИ органов малого таза на 5-8 день менструального цикла. 2.Определение группы крови( в том числе и резус фактора). 3.Клинический анализ крови, включая свертываемость крови 4.Биохимический анализ крови (в т.ч. глюкоза, общий белок, прямой и непрямой билирубин, мочевина) 5.Анализ крови на сифилис, ВИЧ, гепатиты В и С 6.Коагулограмма (по показаниям) 7.Общий анализ мочи 8.Исследование состояния матки и маточных труб (лапароскопия, гистеросальпингография или гистеросальпингоскопия) — по показаниям. 9.Инфекционное обследование: — бактериологическое исследование отделяемого влагалища, цервикального канала из уретры (мазок на флору) — микроскопическое исследование отделяемого цервикального канала на аэробные и факультативно-анаэробные микроорганизмы, трихомонады, грибы рода Candida (посев из цервикального канала) — ПЦР (хламидии, уреа- и микоплазмы, вирус простого герпеса I-II типов, цитомегаловирус) (цервикальный канал) — определение антител класса М, G на токсоплазму, краснуху (кровь) 10.ЭКГ 11.Флюорография легких (действительна 12 месяцев). 12.Консультация терапевта 13.Кольпоскопия и цитологическое исследование шейки матки . 14.Маммография (женщинам старше 35 лет), УЗИ молочных желез (женщинам до 35 лет). 15.Хромосомный анализ супружеским парам старше 35 лет, женщинам, имеющим в анамнезе случаи врожденных пороков развития и хромосомных болезней, в том числе и у близких родственников; женщинам, страдающим первичной аменореей. 16.Гистероскопия и биопсия эндометрия (по показаниям). 17.Гормональное обследование: кровь на 2-5 дни менструального цикла: ЛГ, ФСГ, пролактин, тестостерон (св., общ.), эстрадиол, прогестерон, кортизол (800-1700), Т3 св, Т4 св, ТТГ, СТГ, АМГ , 17-ОП, ДГА-S . кровь на 20-22 день цикла: прогестерон. 18. Консультация эндокринолога(по показаниям). 19. Заключение профильных специалистов при наличии экстрагенитальной патологии (по показаниям). 20.УЗИ щитовидной железы и паращитовидных желез, почек и надпочечников (по показаниям). Для мужчины: 1.Анализ крови на сифилис, ВИЧ, гепатиты В и С (анализы действительны 3 месяца). 2. Спермограмма и МАР-тест 3. Микроскопическое исследование эякулята на аэробные и факультативно-анаэробные микроорганизмы, трихомонады, грибы рода Candida (посев эякулята) (анализы действительны 6 месяцев). 4.ПЦР (хламидии, уреа- и микоплазмы, вирус простого герпеса I-II типов, цитомегаловирус) (эякулят). 5.Консультация андролога/уролога .
источник
kowara, пишет 18 ноября 2016, 20:42
Москва
Пол: Женский
Требуется: генетик
Здравствуйте. Подскажите, пожалуйста, у меня выявлена неслучайная инактивация X-хромосомы: генотип 24/25, (N 20-26). Анализ по крови, метод КФ-МЧ-ПЦР CAG-повтора 1 экзона гена AR. Ещё 1 анализ — метод исследования: прямое определение аллелей CGG-повтора в гене FMR1 методом метил-специфической ПЦР, заключение — определена аллель CGG-повтора 32 в гомозиготный состоянии. Мне 31 год, планируем ЭКО и необходимо понимать нужна ли прединплантационная диагностика или нет. Эта неслучайная инактивация — это серьезно? Что означает это и генотип? Спасибо большое.
Здравствуйте, обычно в клетках тела женщины гены считываются и работают только с одной из Х-хромосом. Вторая при этом находится в неактивном состоянии. Как правило, Х-хромосома инактивируется в конкретной клетке случайным образом, поэтому в целом, в организме примерно в 50% клеток работает одна Х- хромосома, в остальных 50% — другая. При неравновесной инактивации Х-хромосом это соотношение далеко от 50/50. Т.е. в большей части клеток по каким-то причинам преимущественно инактивирована одна и та же Х-хромосома. Это не несет для женщины каких-либо клинических последствий, если у женщины в оставшейся активной Х-хромосоме нет мутированных генов. Если они есть, то у такой женщины могут нарушаться определённые функции, связанные с работой этих генов. Есть мнение, что неравновесная (неслучайная) инактивация Х-хромосом ассоциирована с преждевременным истощением яичников у женщин. ПГД в этом случае Вам делать не нужно, Т.к. Нет конкретного Х-сцепленного заболевания, которое можно было бы анализировать у эмбрионов. Однако для более однозначного ответа все же стоит пройти очную консультацию генетика с тщательной оценкой семейного анамнеза. Количество CGG повторов в гене FMR1 у Вас нормальное. Риск рождения ребёнка с синдромом Мартина-Белл у Вас не увеличен. ПГД Вы можете сделать просто на все пары хромосом, исключив хромосомную патологию у эмбрионов до их подсадки в полость матки. Это не по медицинским показаниям, а просто по желанию, Т.к. В целом известно, что ПГД (методом CGH) увеличивает эффективность эко на 30%. При необходимости более подробной информации обращайтесь к нам за медико-генетической консультацией, также проводим ПГД.
Подскажите, пожалуйста, у меня нет » конкретного Х-сцепленного заболевания, которое можно было бы анализировать у эмбрионов»- это по результатам анализа или в моих анализах нет отношения к ПГД и мне необходимо сдать ещё анализы по результатам которых можно это определить?
Здравствуйте, из Ваших анализов можно сделать вывод только о двух генных заболеваниях с х-сцепленным типом наследования — это синдром Мартина-Белл (ген FMR1) и спино-бульбарная амиотрофия Кеннеди (ген AR). Вы не являетесь скрытой гетерозиготной носительницей наиболее частых мутаций в этих генах, а значит риск рождения у Вас детей с этими заболеваниями не повышен. А вообще, х-сцепленных болезней существует множество и проверять их все просто так, без особых показаний, дорого. Сходите к генетику на очный приём, в данной ситуации важно собрать подробный семейный анамнез.
С удовольствием посещу Вас.
Подскажите, какие анализы необходимо мне сдать, чтобы по результатам их получить полную консультацию по семейным анамнезам?
Приобрести эффективные лекарства для лечения этого заболевания
источник
Анеуплоидия по Х-хромосоме — одна из наиболее частых онтогенетических аномалий. Относительная устойчивость кариотипа человека к хромосомным аномалиям Х-хромосомы может объясняться инактивацией Х-хромосомы, процессом, эпигенетически подавляющим большинство генов в одной из двух Х-хромосом у женщин, не давая им производить какие-либо продукты. Здесь мы обсудим хромосомный и молекулярный механизмы инактивации Х-хромосомы.
Инактивация Х-хромосомы. Теория инактивации Х-хромосомы гласит, что в соматических клетках здоровых женщин (но не у мужчин) одна Х-хромосома инактивируется в начале эмбрионального развития, уравнивая таким образом экспрессию генов этой хромосомы у двух полов. В нормальных женских клетках выбор инактивируемой Х-хромосомы произволен, а затем поддерживается в каждом клоне клетки.
Таким образом, женщины мозаичны по экспрессии Х-сцепленных генов; некоторые клетки экспрессируют аллели, унаследованные от отца, другие клетки — от матери. Этот образец экспрессии генов отличает большинство Х-сцепленных генов от импринтируемых генов (также экспрессирующих только один аллель, но определяемых родительским началом не случайно), а также от большинства аутосомных генов, экспрессирующих оба аллеля.
Хотя неактивная Х-хромосома сначала была обнаружена цитологически по присутствию гетерохроматиновой массы (названной тельцем Барра) в интерфазных клетках, существует много эпигенетических характеристик, различающих активные и неактивные Х-хромосомы. Проливая свет на механизмы Х-инактивации, эти особенности могут быть диагностически значимыми для установления неактивной Х-хромосомы в клиническом материале.
Хромосомные характеристики Х-инактивации:
— Инактивация большинства генов, расположенных на неактивной Х-хромосоме
— Произвольный выбор одной из двух Х-хромосом в женских клетках
— Неактивная Х-хромосома:
а) гетерохроматиновая (тельце Барра)
б) поздно реплицируется в S фазе
в) экспрессирует XIST-PHK
г) связана с модификациями гистона macroH2A в хроматине
Область промотора многих генов в неактивной Х-хромосоме существенно модифицируется присоединением метильной группы к цитозину при действии фермента ДНК-метилтрансферазы. Как уже упоминалось в контексте геномного импринтинга в главе 5, такое метилирование ДНК связано с CpG динуклеотидами и приводит к неактивному состоянию хроматина. Дополнительные различия между активными и неактивными Х-хромосомами связаны с гистоновым кодом и оказались существенной частью механизма Х-инактивации.
Например, содержание варианта гистона macroH2A очень возрастает в неактивном хроматине Х-хромосом и позволяет различить две хромосомы в женских клетках.
У пациентов с дополнительными Х-хромосомами все Х-хромосомы, кроме одной, инактивируются. Таким образом, все диплоидные соматические клетки как у мужчин, так и у женщин, имеют единственную активную Х-хромосому, независимо от общего числа Х- или Y-хромосом.
Хотя инактивация Х-хромосомы, несомненно, является хромосомным феноменом, не все гены в Х-хромосоме подвергаются инактивации. Расширенный анализ экспрессии почти всех генов Х-хромосомы показал, что по крайней мере 15% генов избегают инактивации и экспрессируются как в активных, так и неактивных Х-хромосомах . Кроме того, еще для 10% генов показана переменная инактивация; т.е. они избегают инактивации у одних женщин, но инактивируются у других.
Примечательно, что эти гены не распределены произвольно по Х-хромосоме: большинство генов, избегающих инактивации, расположены на плече Хр (до 50%), по сравнению с Xq (несколько процентов). Данный факт имеет большое значение для генетического консультирования в случаях частичной хромосомной анеуплоидии X, так как дисбаланс генов на Хр может иметь большее клиническое значение, чем дисбаланс Xq.
которая покрывает неактивную хромосому.
При исследованиях структурно аномальных инактивированных Х-хромосом был картирован центр Х-инактивации в проксимальном отделе Xq, в полосе Xql3. Центр Х-инактивации содержит необычный ген XIST (англ. Xinactivate specific transcripts; специфическая транскрипция инактивированной Х-хромосомы), оказавшийся ключевым управляющим локусом Х-инактивации. Ген XIST имеет новую характеристику: он экспрессируется только в аллеле на неактивной Х-хромосоме; он отключен на активной Х-хромосоме как в мужских, так и в женских клетках.
Хотя точный способ действия гена XIST неизвестен, Х-инактивация не может происходить в его отсутствие. Продукт XIST — некодирующая белок РНК, остающаяся в ядре в тесной ассоциации с неактивной Х-хромосомой и тельцем Барра.
Х-инактивация в норме происходит в женских соматических клетках случайным образом и приводит к мозаицизму по двум популяциям клеток, экспрессирующих аллели одной или другой Х-хромосомы. Тем не менее существуют исключения из этого правила, когда в кариотипе имеются структурно аномальные Х-хромосомы. Например, почти у всех пациентов с несбалансированными структурными аномалиями Х-хромосомы (включая делеции, дупликации и изохромосомы) структурно аномальная хромосома всегда неактивна, что, вероятно, отражает вторичный отбор против генетически несбалансированных клеток, которые могли бы привести к значимым клиническим аномалиям.
Из-за преимущественной инактивации аномальной Х-хромосомы такие аномалии Х-хромосомы имеют меньшее влияние на фенотип, чем аналогичные аномалии аутосом, и, следовательно, более часто обнаруживаются.
Неслучайную инактивацию наблюдают также в большинстве случаев транслокаций X на аутосому. Если такая транслокация сбалансирована, избирательно инактивируется нормальная Х-хромосома, и две части транслоцированной хромосомы остаются активными, вероятно, снова отражая отбор против клеток с неактивированными аутосомными генами. В несбалансированном потомстве сбалансированного носителя, тем не менее, присутствует только продукт транслокации, несущий центр Х-инактивации, и такая хромосома неизменно инактивируется; нормальная Х-хромосома всегда активна.
Эти неслучайные образцы инактивации имеют общий эффект снижения, хотя и не всегда устранения, клинических последствий конкретного хромосомного дефекта. Поскольку образцы Х-инактивации хорошо согласуются с клиническим результатом, определение цитогенетическим или молекулярным анализом индивидуального образца Х-инактивации показано во всех случаях транслокации X и аутосом.
Одна закономерность, иногда наблюдающаяся у сбалансированных носителей транслокаций Х-хромосомы на аутосому, проявляется тем, что сам разрыв может вызывать мутации, нарушая ген в точке транслокации. Единственная нормальная копия конкретного гена инактивируется в большинстве или всех клетках из-за неслучайной инактивации нормальной Х-хромосомы, таким образом приводя к экспрессии у женщины сцепленного с полом признака, обычно наблюдающегося только у гемизиготных мужчин.
Выявлено несколько Х-сцепленных генов, когда типичный фенотип сцепленного с полом состояния обнаруживали у женщин с доказанной транслокацией Х-хромосомы на аутосому. Главный клинический вывод из этой информации — если женщина проявляет сцепленный с полом фенотип, обнаруживаемый обычно только у мужчин, показан хромосомный анализ с высоким разрешением. Обнаружение сбалансированной транслокации может объяснить фенотипическую экспрессию и выявить вероятную позицию гена на карте Х-хромосомы.
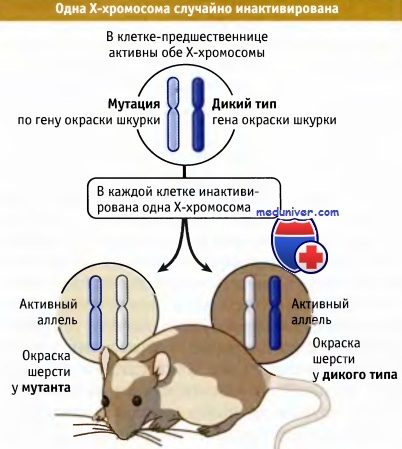
Клетки, у которых + аллель находится на активной хромосоме, обладают диким фенотипом, но клетки,
у которых на активной хромосоме находится аллель, приобретают мутантный фенотип.
источник
Исследование неслучайной инактивации Х-хромосомы – это метод генетической диагностики, при помощи которого исследуют состояние активной (функционирующей) Х-хромосомы клеток женского организма.
| Сроки выполнения | до 15 дней |
| Синонимы (rus) | Анализ неравновесной инактивации Х-хромосомы, определение неслучайной инактивацииглавной Х-хромосомы |
| Cинонимы (eng) | X-inactivation |
| Методы | Цитогенетическое тестирование при помощи спектрального кариотипирования |
| Единицы измерения | Результат представлен в виде специальной записи, отражающей структуру хромосомного набора. В заключении непосредственно указывается обнаружена, или не обнаружена инактивация Х-хромосомы. |
| Подготовка к исследованию | Забор биологического материала и подготовка к его сдаче производится по общим правилам. Лучше сдавать анализ в первой половине дня, исключить употребление пищи и курение не менее, чем за 2 часа. За неделю до забора крови должны быть исключены вредные воздействия на организм, в том числе медикаментозные. |
| Тип биоматериала и способы его взятия | Кровь из вены исследуемой женщины |

На протяжении жизни женщины, размножающиеся клетки передают активированную и инактивированную хромосому дочерним клеткам. Если активная хромосома сохраняет свою структуру, женский организм идеально функционирует. Но в тех случаях, когда эта Х-хромосома становится жертвой небольших мутаций (как правило, это делеции – отрыв фрагментов), включается специальный ген XIST. Он запускает неслучайную инактивацию измененной активной хромосомы. При этом она утрачивает часть своих функций. В первую очередь, страдает возможность полноценно кодировать информацию в отношении детородных функций женского организма.
Важно помнить! Анализ неравновесной инактивации Х-хромосомы – это не что иное, как определение состояния единственной функционирующей женской половой хромосомы. Обнаружение ее структурных изменений является свидетельством частичной утраты функций, что не может не сказаться на функциональных возможностях женского организма!
Исследуя структуру Х-хромосом женщины на предмет обнаружения неравновесной инактивации, можно сделать вывод о причинах женского бесплодия или нарушений менструально-овуляторной деятельности. Целесообразность приводить подобное исследование возникает при:
- Стойком бесплодии у женщин всех возрастных групп;
- Склерополикистозе яичников;
- Преждевременном истощении и увядании яичников;
- Некорригируемых перепадах гормональной активности яичников, сочетающихся любыми нарушениями их структуры.
Оценкой результатов анализа должен заниматься исключительно знающий специалист. В заключении указывается обнаружена или не обнаружена неслучайная Х-хромосомная инактивация. Если она имеет место, это говорит, что проблема бесплодия или другие нарушения женской половой сферы вызваны поломками на генном уровне.
Стоимость анализов Вопрос: Здравствуйте! Просьба, написать стоимость следующих анализов. Планирую сдавать в г.Сочи Старонасыпная ул., 22, микрорайон Адлер, БЦ Офис Плаза, эт. 2 Для женщины: 1.УЗИ органов малого таза на 5-8 день менструального цикла. 2.Определение группы крови( в том числе и резус фактора). 3.Клинический анализ крови, включая свертываемость крови 4.Биохимический анализ крови (в т.ч. глюкоза, общий белок, прямой и непрямой билирубин, мочевина) 5.Анализ крови на сифилис, ВИЧ, гепатиты В и С 6.Коагулограмма (по показаниям) 7.Общий анализ мочи 8.Исследование состояния матки и маточных труб (лапароскопия, гистеросальпингография или гистеросальпингоскопия) — по показаниям. 9.Инфекционное обследование: — бактериологическое исследование отделяемого влагалища, цервикального канала из уретры (мазок на флору) — микроскопическое исследование отделяемого цервикального канала на аэробные и факультативно-анаэробные микроорганизмы, трихомонады, грибы рода Candida (посев из цервикального канала) — ПЦР (хламидии, уреа- и микоплазмы, вирус простого герпеса I-II типов, цитомегаловирус) (цервикальный канал) — определение антител класса М, G на токсоплазму, краснуху (кровь) 10.ЭКГ 11.Флюорография легких (действительна 12 месяцев). 12.Консультация терапевта 13.Кольпоскопия и цитологическое исследование шейки матки . 14.Маммография (женщинам старше 35 лет), УЗИ молочных желез (женщинам до 35 лет). 15.Хромосомный анализ супружеским парам старше 35 лет, женщинам, имеющим в анамнезе случаи врожденных пороков развития и хромосомных болезней, в том числе и у близких родственников; женщинам, страдающим первичной аменореей. 16.Гистероскопия и биопсия эндометрия (по показаниям). 17.Гормональное обследование: кровь на 2-5 дни менструального цикла: ЛГ, ФСГ, пролактин, тестостерон (св., общ.), эстрадиол, прогестерон, кортизол (800-1700), Т3 св, Т4 св, ТТГ, СТГ, АМГ , 17-ОП, ДГА-S . кровь на 20-22 день цикла: прогестерон. 18. Консультация эндокринолога(по показаниям). 19. Заключение профильных специалистов при наличии экстрагенитальной патологии (по показаниям). 20.УЗИ щитовидной железы и паращитовидных желез, почек и надпочечников (по показаниям). Для мужчины: 1.Анализ крови на сифилис, ВИЧ, гепатиты В и С (анализы действительны 3 месяца). 2. Спермограмма и МАР-тест 3. Микроскопическое исследование эякулята на аэробные и факультативно-анаэробные микроорганизмы, трихомонады, грибы рода Candida (посев эякулята) (анализы действительны 6 месяцев). 4.ПЦР (хламидии, уреа- и микоплазмы, вирус простого герпеса I-II типов, цитомегаловирус) (эякулят). 5.Консультация андролога/уролога .
источник
Специалисты Клинического госпиталя на Яузе проводят полный спектр исследований для выявления причин бесплодия у мужчин и женщин и разрабатывают индивидуальные программы лечения для успешного зачатия.
Бесплодным считается брак, в котором женщина не может забеременеть на протяжении 12 месяцев при регулярной половой жизни без контрацепции. Бесплодие может быть обусловлено генетическими особенностями одного или обоих супругов.
Точное выявление причин бесплодия позволяет выбрать правильную тактику лечения и значительно ускорить достижение желанного результата — наступления беременности и рождения ребенка.
Не теряйте время на неэффективное лечение! Пройдите точную диагностику.
- кариотипирование;
- экспертная спермограмма;
- анализ мутаций в гене муковисцидоза (CFTR);
- определение делеций локуса AZF хромосомы Y (регионов а, b, c);
- определение индекса фрагментации хроматина (HALO- или TUNEL-тесты);
- FISH-исследование сперматозоидов — выявление численных хромосомных аномалий (анеуплоидий);
- электронно-микроскопическое исследование сперматозоидов (ЭМИС);
- определение числа (CAG)-повторов в гене андрогенового рецептора.
Выявив причины бесплодия и объективно оценив выраженность нарушений, репродуктолог сможет рекомендовать оптимальный для каждой пары метод преодоления бесплодия — заместительная гормональная терапия, искусственная инсеминация, ЭКО с ИКСИ, МЕЗА, ТЕЗА, ПЕЗА, ЭКО с донорской спермой и др. Современные репродуктивные технологии позволяют достичь успеха практически при любой сложности проблемы.
Пройдите обследование для исключения генетических причин бесплодия при:
- выраженной олигозооспермии или азооспермии (обструктивной, необструктивной);
- тератозооспермии;
- астенозооспермии:
- азооспермия — отсутствие сперматозоидов в эякуляте (обструктивная — связана с непроходимостью семявыносящих путей, необструктивная — при нарушении образования сперсматозоидов в яичках),
- олигозооспермия — сниженное количество сперматозоидов в эякуляте. О существенном угнетении сперматогенеза говорят при концентрации сперматозоидов менее 5 млн/мл эякулята,
- тератоззоспемия — нарушение морфологии сперматозоидов,
- астенозооспермия — нарушение подвижности сперматозоидов.
Записаться на консультацию
- хромосомные нарушения— носительство сбалансированной реципрокной или Робертсоновской транслокаций, инверсий и др. структурных изменений кариотипа в большинстве случаев сопровождаются нарушениями сперматогенеза. Аномалии кариотипа встречаются у мужчин с азооспермией и с олигозооспермией.
- аномалии числа половых хромосом — синдром Клайнфельтера (47,ХХУ); некоторые случаи дисомии хромосомы Y (47,XYY). Синдром Клайнфельтера является крайне распространённой патологией: на каждые 500 — 700 новорождённых мальчиков приходится 1 ребёнок с данной патологией. Синдром Клайнфельтера является одной из самых частых причин мужского гипогонадизма (гипергонадотропного гипогонадизма) и бесплодия.
- структурные аномалии половых хромосом.
- делеции локусаAZFхромосомыY. «Фактор азооспермии» — локус АZF включает гены, отвечающие за сперматогенез. Он делится на 3 региона: AZFa, AZFb. AZFc, делеции которых сопровождаются нарушениями сперматогенеза различной степени тяжести. Так, делеции в AZFa обычно сопровождаются синдромом «только клетки Сертоли». В случае делеции локусов AZFb, AZFс возможно обнаружение в тканях яичек сперматозоидов пригодных для процедуры ИКСИ. Делеции в локусе AZF в большинстве случаев возникают denovo в результате мутаций в клетках сперматогенного ряда или на ранних стадиях развития эмбриона. Делеции локуса AZF встречаются у 15% мужчин с выраженной идиопатической олигозооспермией и 20% мужчины с идиопатической необструктивной азооспермией.
- мутации в гене AR — андрогеннового рецептора. Влияние числа (CAG)-повторов на сперматогенез до конца не доказано, однако повреждения гена в области гормонсвязывающего участка (делеции и точковые мутации) достоверно приводят к развитию олигоастенотератозооспермии. Примерно случаев азооспермии или выраженной олигозооспермии связаны с точковыми мутациями в гене рецептора андрогенов.
- мутации в генах, приводящие к развитию гипогонадотропного гипогонадизма (синдром Каллмана и др. состояния).
- мутации в гене муковисцидоза CFTR. Муковисцидоз относится к числу наиболее распространенных моногенных заболеваний в европейской популяции и в среднем встречается с частотой 1 больной ребенок на каждые 2500 новорожденных. Примерно 1 из 25 человек является гетерозиготным носителем мутации в гене CFTR. Мутации в гене CFTR приводят к нарушениям сперматогенеза различной степени тяжести, часто без манифестации других признаков муковисцидоза.
- мутации в гене половой дифференцировки SRY.
Мутации в гене муковисцидоза CFTR приводят к врожденному отсутствию семявыносящих протоков (CBAVD, CUAVD) и непроходимости семявыносящих протоков.
Тератозооспермия и астенозооспермия могут быть обусловлены мутациями в отдельных генах или указывать на наличие хромосомных аномалий в кариотипе мужчины, а в сочетании с высокой степенью фрагментации хроматина в сперматозоидах свидетельствуют о нарушении оптимальных условий сперматогенеза и повышенной вероятности наличия численных хромосомных аномалий в сперматозоидах.
Мутации в генах, отвечающих за развитие гонад и их функционирование, в том числе генах, кодирующих гормоны ЛГ, ФСГ и их рецепторы, могут быть причиной бесплодия у мужчин. Однако данные нарушения встречаются настолько редко, что проводить генетические исследования для выявления возможной причины в рамках лечения в клиниках ВРТ не представляется целесообразным. Бесплодие может развиваться как следствие наличия у пациента генерализованного наследственного генетического заболевания (синдром Прадера-Вилли, синдром Нунан, гемохроматоз, анемия Фанкони, бета-талассемия и др.).
К бесплодию у мужчин могут приводить и различные экзогенные факторы облучение, перегрев яичек, курение и чрезмерное потребление алкоголя, перенесенные инфекционные заболевания, производственные яды, лекарства, болезни матери при беременности: сахарный диабет, фенилкетонурия и гипотиреоз, перенесенные инфекционные заболевания.
- Кариотпирование
- Преимплантационный генетический скрининг анеуплоидий
- Исследование уровня рецептивности эндометрия
- Исследование мутаций в генах системы гемостаза
- Исследование неравновесной инактивации хромосомы Х
Пройдите обследование для исключения генетических причин бесплодия при:
- бесплодии неясного генеза
- неудачных попытках искусственного оплодотворения, в том числе ЭКО
- нарушении имплантации эмбрионов
- невынашивании беременности
- спонтанных абортах и случаях неразвивающейся беременности в анамнезе
Хромосомные нарушения:
- нарушения механизмов расхождения хромосом в процессе оогенеза приводят к образованию яйцеклеток с численными хромосомными нарушениями. После 35 лет доля яйцеклеток с хромосомной патологией возрастает и может достигать 80% после 40 лет. Оплодотворение яйцеклетки с хромосомной патологией приводит к формированию анеуплоидного эмбриона. В большинстве случаев (за исключением трисомии хромосом 13, 18, 21 и численных аномалий половых хромосом) такие эмбрионы рано или поздно останавливаются в развитии, что приводит к самопроизвольному аборту или неразвивающейся беременности. Наличие хромосомной патологии у эмбриона также может быть причиной нарушения имплантации в стенку матки.
- хромосомные аберрации— носительство сбалансированной реципрокной или Робертсоновской транслокаций, инверсий и др. структурных изменений кариотипа в большинстве случаев приводят к образованию анеуплоидных яйцеклеток.
- аномалии числа половых хромосом: синдром Шерешевского-Тернера (45,Х); синдром трисомии хромосомы Х (47,ХХХ), синдром Свайера (46,XY).
- структурные аномалии половых хромосом могут быть причиной первичной недостаточности функции яичников.
Молекулярно-генетические нарушения:
- Мутации в генах, отвечающих за гомеостаз — повышенное содержание гомоцистеина, повышенная свертываемость крови и склонность к тромбообразованию — могут быть причиной бесплодия и невынашивания беременности.
- Нарушение рецептивности эндометрия и смещение времени имплантационного окна
- Синдром Мартина-Белл (синдром ломкой fragile X mental retardation syndrome,FRAXA) является наиболее частой причиной умственной отсталости у мальчиков. Развитие синдрома связано с экспансией тринуклеотидных повторов (CGG) в промоторной области гена FMR1 хромосомы Х. У здоровых индивидов число этих повторов колеблется от 6 до 54, а увеличение этого числа свыше 200 повторов приводит к феномену ломкой и клиническому проявлению заболевания. При количестве повторов от 55 до 200 (предмутационное состояние) заболевание в типичной форме не проявляется, но существует высокая вероятность проявления заболевания у потомков. У женщин-носителей предмутационного состояния в случаев развивается синдром раннего истощения яичников.
- Мутации в генах, обуславливающие развитие вторичной недостаточности функции яичников — гипогонадотропного гипогонадизма (нарушения в работе гипоталамо-гипофизарной регулирующей системы). Например, синдром Каллмана и др. состояния.
Также как и в случае мужчин, мутации в генах, отвечающих за функционирование репродуктивной системы, в том числе генах половых гормонов и их рецепторов, могут приводить к бесплодию. Бесплодие может быть следствием наличия генерализованного наследственного генетического заболевания (синдром Прадера-Вилли, адреногенитальный синдром, галактоземия, муковисцидоз, гемохроматоз, бета-талассемия и др.).
Воздействие неблагоприятных факторов окружающей среды, стрессы, перенесенные инфекции, в том числе во время внутриутробного развития, также могут приводить к развитию бесплодия.
Для установления причин бесплодия специалисты Клинического госпиталя на Яузе рекомендуют пройти консультации уролога, акушера-гинеколога, эндокринолога, клинического генетика. Консультация генетика рекомендуется всем парам, обращающимся к помощи ВРТ, и является обязательной при обнаружении той или иной формы генетической патологии у одного из партнеров.
источник
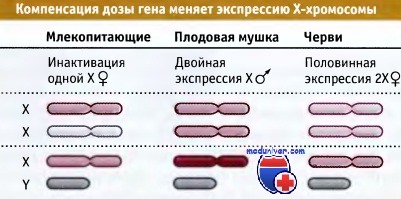
Основное генетическое различие между полами заключается в наличии разного числа Х-хромосом — одна Х-хромосома у самцов и две у самок. Для того, чтобы компенсировать лишнюю дозу гена, у самок происходит инактивация Х-хромосомы. В раннем эмбриогенезе в эпибласте полностью инактивируется одна из Х-хромосом. Она конденсируется, переходя в неактивное состояние, превращаясь в тельце Барра (рис.1). Процесс инактивации Х-хромосомы называется дозовой компенсацией.
Имеется два вида инактивации — специфическая, когда инактивируется определенная Х-хромосома, например только отцовская Х-хромосома у сумчатых (кенгуру), и случайная, когда выбор того, какая Х-хромосома будет инактивирована случаен (плацентарные млекопитающие). Хотя во внезародышевых органах плацентарных также происходит специфическая инактивация.
Центром инактивации является участок Х-хромосомы, называемый Xic (рис.2, 3), имеющий длину по разным данным 35, 80 тпн, или даже больше, что зависит от рассматривания прилежащих последовательностей, участвующих в регуляции инактивации. Xic содержит, как минимум, Xist — ген, кодирующий нетранслируемую RNA, Tsix — антисмысловой локус, содержащий различно метилируемый минисателлитный маркер DXPas34. Так же, очевидно, в формировании Xic участвует последовательность на 3′ конце Xist. Вероятно, что другие регулирующие последовательности лежат дальше 3′ конца гена Xist. Один из таких регуляторов содержит Xce локус, открытый как модификатор выбора Х-хромосомной инактивации.
Инактивация разделяется на стадии: определение дозы, выбор, инициация, устанавливание и поддержание. Эти процессы являются генетически различными и все они, кроме поддержания, контролируются Xic.
Во время счета дозы клетка определяет число Х-хромосом относительно числа аутосом. Помимо локусов на аутосомах в этом этапе принимает участие участок за 3′ конце Xist.
Во время выбора происходит определение того, какая из двух Х хромосом будет инактивирована. В этом процессе принимает участие последовательности в пределах Xist, Tsix и Xce.
Выбор того, какая Х-хромосома инактивируется, случаен, но это может регулироваться аллелями Xce (X-linced X controlling element). В различных мышиных линиях было обнаружено три таких аллеля — слабый Xcea, промежуточный Xceb и сильный Xcec. В гетерозиготах наиболее часто инактивируются те, которые несут более слабый аллель. Например, степень инактивации у гетерозигот Xcea/Xcec приблизительно 25:75. У гомозигот выбор происходит случайно. Xce локус расположен вблизи Xic. Предполагается, что Xce связывают транс-факторы, регулирующие работу генов в Xic, предопределяя выбор между Х-хромосомами. Инактивацию Х-хромосом можно увидеть, используя мышей с мутацией по гену окраски шерсти (например brindled) на одной Х-хромосоме и нормальный ген на другой. Клетки дикого типа дают черный цвет, а мутантные белый. (рис.4)
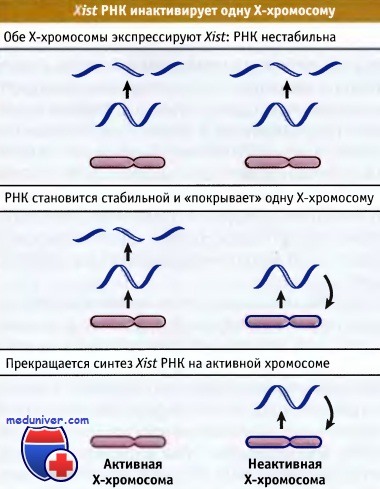
В недифференцированных клетках изначально гены Xist и Tsix экспрессируются одновременно на каждой Х-хромосоме. Но позже на одной из Х-хромосом репрессируется ген Tsix, что ведет к увеличению уровня экспрессии Xist. РНК Xist присоединяет различные белки, образуя комплексы, которые распределяются вдоль всей Х-хромосомы, запуская ее инактивацию. На другой хромосоме не происходит репрессии гена Tsix и его антисмысловая РНК связывает РНК Xist, блокируя ее накопление (рис.5). Такая хромосома останется в активном состоянии. РНК гена Xist не способна переходить с одной Х-хромосомы на другую.
На более поздних этапах происходит замена H2A гистона его аналогом macro H2A (см. обзор Гистоны) и метилирование H3K27, участие различных транс-факторов, CpG метилирование ДНК в промоторах. В конечном итоге происходит установление гетерохроматина по общей концепции (см. обзор Гетерохроматин). Поддержание инактивации.
Инициация инактивации контролируется эксперссией Xist и, однажды установившись, инактивированное состояние больше не зависит от Xic и Xist. На гибридах человеческих и мышиных клеток показвно, что при делеции гена Xist человеческая Х-хромосома поддерживает инактивированное состояние, что указывает на независимое от Xist поддержание инактивации Х-хромосомы. Хотя присутствие Xist после установления инактивации стабилизирует ее.
Сокращения:
Xic — Х inactivation centre -Центр инактивации Х-хромосомы.
Xi -X inactive — инактивируемая Х хромосома.
Xa — X-active — активируемая Х хромосома.
источник
Роль неслучайной инактивации Х-хромосомы в формировании преждевременной недостаточности функции яичников
ГУ Научный центр акушерства, гинекологии и перинатологии РАМН, Медико-генетический научный институт РАМН, НИИ Молекулярной медицины при ММА им. И.М.Сеченова, Москва
П реждевременная яичниковая недостаточность (ПНЯ) описывается как «многофакторный синдром», в развитии которого могут принимать участие генетические, иммунные, инфекционные, ятрогенные, психогенные и другие факторы [1]. Данная патология проявляется вторичной аменореей, низким уровнем эстрогенов, бесплодием на фоне повышенного уровня гонадотропинов (ФСГ, ЛГ). В структуре первичной аменореи ПНЯ составляет 10-28% [2]. У женщин с вторичной аменореей ПНЯ встречается с частотой 4-18% [3].
Согласно точке зрения большинства исследователей, ПНЯ формируется в результате делеций как в коротком, так и в длинном плечах Х-хромосомы (Xq) или наличия моногенных заболеваний. Делеции длинного плеча Хq представлены множеством вариантов. Область Xq13 является наиболее важным районом для поддержания функционирования яичников. Возможно, в этом участке находится центр инактивации Хq, что подтверждается клинической картиной, характерной для гипергонадотропного гипогонадизма. Наиболее протяженные делеции захватывают область Xq13 и ассоциированы с первичной аменореей, отсутствием молочных желез и полным истощением яичников [4-8]. Для Xq не найдено каких-либо определенных точек разрыва, хотя в свете современных молекулярно-генетических открытий терминальные делеции можно расположить по значимости их влияния на функционирование яичников в таком порядке: Xq13-21, Xq22-25 и Xq26-28. В 1995 г. Ogata и Matsuo выявили сильную корреляционную зависимость между функционированием яичников и представленной выше последовательностью делеций в длинном плече Хq [8].
Инактивация Хq (ИХХ) характерна для млекопитающих и заключается в том, что одна из двух родительских Хq (отцовская или материнская) случайным образом инактивируется для обеспечения одинакового количества функционирующих X-сцепленных генов у представителей обоих полов [9]. Однако в ряде случаев имеет место избирательная ИХХ одного из родителей. Существуют данные о том, что неслучайная ИХХ встречается в норме в экстраэмбриональных тканях [10], а также при некоторых патологических состояниях: у мозаиков 45Х/46ХХ [11], у женщин со структурными аберрациями Хq [12], у бессимптомных носителей синдрома Ретта (Х-сцепленное доминантное заболевание) [13] и при поликистозе и преждевременном истощении яичников [9, 14]. В целом частота неслучайной ИХХ в популяциях оценивается в 1,5-3,5% (Gale и соавт. 1997; Plenge и соавт. 1997; Lanasa и соавт. 1999) [15].
Выявление неслучайной ИХХ осуществляется с помощью методов, основанных на определении дифференциального метилирования активной и неактивной Хq. Непосредственно анализируются полиморфизмы Х-сцепленных генов — полиморфизм сайта узнавания рестриктазы BstXl в первом интроне гена фосфоглицерокиназы [10] или полиморфизм CAG-повтора в первом экзоне гена андрогенового рецептора (AR) [10, 16]. В том числе можно использовать метилчувствительную или метилспецифическую ПЦР с целью определения неслучайной инактивации Хq у пациентов с ПНЯ.
Материалы и методы
Обследованы 72 женщины с ПНЯ. Средний возраст пациенток составил 33,4±0,8 года, средняя продолжительность заболевания — 6,3±0,7 года, средний уровень ФСГ — 106,4±4,8 МЕ/л, ЛГ — 90,5±5,6 МЕ/л, Е2 — 76,7±9,7 МЕ/л, ТТГ — 2,7±0,38 мМЕ/л, ингибин В — 10,6±1,16 пг/л при двух определениях. У этих пациенток самостоятельная менструация отсутствовала 6 мес и более. Исследование проводили у женщин Европейской части России.
Больным осуществляли полное клиническое обследование, включающее семейный анамнез, данные о менархе и регулярности предшествующих менструаций, акушерский анамнез. Всем обследованным проводили гинекологический осмотр, ультразвуковое исследование органов малого таза, определение уровней гормонов (ФСГ, ЛГ, ТТГ, Е2, ингибин В) и кариологическое исследование.
Цитогенетический анализ
Хромосомные препараты готовили из культуры лимфоцитов периферической крови. Подсчитывали под микроскопом не менее 25 метафазных пластинок. Детальный анализ хромосом проводили на микрофотографиях с составлением кардиограммы. Дифференцированное окрашивание хромосом (G-метод) проводили по методу Seabright с предобработкой трипсином.
Выделение ДНК и определение неслучайной инактивации Xq
Геномную ДНК выделяли по модифицированному методу фенол-хлороформной экстракции [17]. Затем геномную ДНК обрабатывали рестриктазой Hhal, которая только в том случае гидролизует цепи ДНК, если цитозин CpG-динуклеотида в ее сайтах узнавания не метилирован. Состав реакционной смеси: геномная ДНК — 1-2 мкг, буфер SEBufferY(lOx) («СибЭнзим», Новосибирск) — 2 мкл, рестриктаза Hhal («СибЭнзим», Новосибирск) — 10 ед., деионизированная вода — до 20 мкл. Реакционную смесь инкубировали при температуре 65°С в течение суток. Далее проводили ПЦР по описанному выше протоколу, как матрицу использовали 2 мкл смеси продуктов рестрикции.
Длину CAG-повтора в гене AR определяли с помощью количественной флуоресцентной полимеразной цепной реакции (КФ-ПЦР). Последовательности праймеров и условия амплификации описаны ранее [18]. Аналогом праймера CAGF2-HEX являлся праймер CAGF2-FAM (конъюгированный на 5-м конце с флуоресцентным красителем FAM). Фрагментный анализ осуществляли разделением ПЦР-продуктов на генетическом анализаторе ABI3100 согласно протоколам ABI Prism 3100 Genetic Analyzer Kits «Applied Biosystems». Идентификацию аллелей проводили с помощью программного обеспечения GeneMapper v. 3.5 «Applied Biosystems».
Во всех информативных случаях определялась ИХХ. Считалось, что ИХХ имеет место при выполнении двух условий: отношение площади большего пика к сумме площадей двух пиков превышает 70% и при амплификации с рестриктов и нативной геномной ДНК это отношение отличается более чем на 3% [9, 14]. Кроме того, исследование проводилось в пороговых уровнях 80 и 90%.
Таблица 1. Цитогенетический анализ
Таблица 2. Частота неслучайной ИХХ
Частота неслучайной ИХХ больные с ПНЯ
Результаты
При изучении семейного анамнеза у 19 (26,4%) матерей наших пациенток отмечено несвоевременное выключение функции яичников: у 8 (11,1%) матерей преждевременная недостаточность яичников (до 40 лет), а у 11 (15,3%) — ранняя менопауза (до 45 лет). У матерей 8 (11,1%) пациенток были выявлены в анамнезе различные нарушения менструального ритма.
Изучение преморбидного фона показало, что 45 (62,5%) больных имели высокий инфекционный индекс. Регулярные менструации установились с менархе у 60 (83,3%) женщин, средний возраст менархе составляет 13,2±1,4 года, олигоменорея отмечена у 12 (16,7%) больных. У 25 (34,7%) из 72 пациенток с ПНЯ в анамнезе были роды. У 19 (26,4%) пациенток — 1, у 6 (8,3%) — 2 родов. У 23 (31,9%) пациенток этой группы были аборты, у 4 (5,6%) — самопроизвольные выкидыши. В группе нерожавших пациенток аборты были только у 6 (8,3%) женщин. Таким образом, до начала заболевания фертильность была сохранена у 31 (43%) женщин с ПНЯ, т.е. практически у каждой 2-й пациентки.
При клиническом обследовании 71 пациентки с ПНЯ выявлено: средний рост составил 161,5±3,8 см, средняя масса тела — 57,9±1,4 кг, индекс массы тела (ИМТ) — 24,7±3,6 кг/см 2 . Отмечено, что все женщины были правильного телосложения, с нормальным женским фенотипом, сохраненным интеллектом и у них отсутствовали какие-либо аномалии развития. Всем обследованным женщинам с ПНЯ было произведено исследование кариотипа. Среди 72 обследованных нами женщин аберрации Хq обнаружены у 3 (4,2%), из них 2 (2,8%) характеризовались низким уровнем мозаицизма и у 1 (1,4%) женщины — кариотип 45,Х. Данная пациентка фенотипически отличалась от описанных ранее больных низким ростом (150 см), диспластичными чертами — наличием деформированных ушных раковин, высоким арковидным небом, аномальным расположением зубов, короткой толстой шеей, низким ростом волос на затылке, широко расставленными сосками, наличием митрально-аортального порока сердца и аномальным развитием почек.
Из 69 пациенток с нормальным кариотипом только 60 (87%) были гетерозиготы (информативны) по полиморфизму CAG-повтора гена андрогенного рецептора.
Доля гомозигот по анализируемому локусу составила 9 (13%) женщин. Таким образом, количество информативных образцов ДНК составило 60 (87%).
Для оценки неслучайной ИХХ мы использовали три пороговых уровня, классифицируемых, как і 70, і 80, і 90%.
Среди этих 60 женщин гетерозигот у 25% (15/60) была выявлена неслучайная инактивация Хq і 70%, у 11,7% (7/60) і 80%, у 3,3% (2/60) і 90%. Результаты цитогенетического анализа представлены в табл. 1, а частота неслучайной ИХХ — в табл. 2.
Обсуждение
В этом исследовании мы попытались разобраться, действительно ли неслучайная ИХХ имеет отношение к формированию ПНЯ.
В задачу работы также входило изучение численных аномалий Хq у больных с ПНЯ. При исследовании кариотипа мы выявили 1 пациентку с наличием аномального клона 45,Х в кариотипе и 2 пациенток с низким уровнем мозаицизма по половым хромосомам 45,Х/46,ХХ (см. табл. 1). Подобные результаты описаны в литературе [19-21]. Подтверждением полученных нами данных являются ранее проведенные клинические наблюдения, согласно которым от 3 до 5% женщин с мозаичным 46,ХХ/45,Х кариотипом самостоятельно менструируют и в ряде случаев у них наступают самостоятельные беременности [22, 23]. Magee и соавт. описали пациентку с 45,Х-кариотипом, у которой было семь самостоятельно наступивших беременностей, однако скорее всего автор обследовал пациентку, имевшую ярко выраженный тканевый мозаицизм 46,ХХ/45,Х с преобладанием первого в яичниках, а второго в лимфоцитах периферической крови. Следует подчеркнуть, что у человеческого эмбриона 45,Х подобно всем млекопитающим с моносомией первично присутствуют герменогенные клетки, сохранение которых возможно в единичных экземплярах и является ключом к разгадке механизма фертильности при синдроме Тернера [24]. В ранее описанном случае больная с кариотипом 45,Х регулярно менструировала до 38 лет, однако подобно больным с дисгенезией гонад (синдром Тернера) она страдала митрально-аортальным пороком сердца и врожденной аномалией почек. Также обращало на себя внимание наличие у нее диспластичных черт, характерные для синдрома Тернера.
Powell и соавт. высказали гипотезу о том, что ПНЯ может быть результатом нарушений в работе ограниченного числа генов, задействованных в развитии яичников [25, 26]. Широкий спектр аномалий Хq может вызвать патологию мейоза и в результате приводить к частичной гибели половых клеток [27]. Поэтому истощение запаса ооцитов у женщин может быть непосредственно связано с неспособностью обеспечить функционирование яичников в течение репродуктивного возраста.
Однако мозаицизм 45,Х/46,ХХ в незначительном количестве клеток часто встречается в норме и увеличивается с возрастом [28-32]. Следовательно, наличие мозаицизма 45,Х/46,ХХ в незначительном проценте может и не является предрасполагающим фактором к ПНЯ.
Установлено, что около 5% из 2000 генов, локализованных на Хq, избегают инактивации [33]. Гены кандидаты, участвующие в поддержании функции яичников, вероятно, находятся в этих эухроматиновых районах, однако до настоящего времени не проведены исследования, однозначно подтверждающие эту гипотезу.
Исключив женщин с аберрациями Хq, мы определили Х-инактивационный статус. Для оценки неслучайной ИХХ мы использовали пороговый уровень і 70%, і 80%, і 90%. Частота случаев инактивации Хq у обследованных нами женщин с ПНЯ составил і 70-25%, і 80 — 11,7%, і 90 — 3,3%, в то время как в популяции, по данным Gale, Plenge, Lanasa, показатель ИХХ в пороговом уровне 70 и более составляет от 1,5-3,5%, что в 7,5 раз ниже полученных нами данных. При анализе результатов целесообразно отметить, что различные авторы предлагают отличающиеся друг от друга методы определения неслучайной инактивации Xq-хромосомы по CAG-повтору гена AR с детекцией меченых ПЦР-продуктов на генетических анализаторах. Например, в работе Sato и соавт. использовалась метилспецифическая ПЦР, а расчеты произведены для трех пороговых уровней: 70, 80 и 90% [9]; в работе Dijk и соавт. использовалась метилчувствительная ПЦР, рестриктаза Hpall, а пороговый уровень рассчитывался как изменение показателя ИХХ более чем на 30% при амплификации ДНК, обработанной Hpall, относительно нативной геномной ДНК [34]. В настоящей работе условия определения неслучайной инактивации по CAG-повтору AR также имели оригинальные модификации. Указанные различия в методах могут существенно влиять на частоту выявления неслучайной инактивации Хq. Это указывает на необходимость создания общепринятого протокола определения дифференциального метилирования Xq.
Основываясь на данных об увеличении частоты неслучайной ИХХ с возрастом, мы проанализировали возраст 15 пациенток с ИХХ, который варьировал от 21 года до 43 лет. Таким образом, средний возраст пациенток составил 35,1±1,9 года, в связи с чем мы предположили, что как минимум один компонент неслучайной ИХХ не ассоциирован с возрастом, а связан с формированием ПНЯ.
Как уже было сказано по поводу синдрома Тернера, некоторые гены, необходимые для функционирования яичников, могут быть необходимыми в 2 активных копиях и поэтому избегают ИХХ [35]. Предполагается, что незначительные структурные аберрации Хq могут приводить к ее неравновесной инактивации и далее к ПНЯ вследствие недостаточного функционирования генов, необходимые для развития яичников.
Таким образом, одно из возможных объяснений состоит в том, что неслучайная ИХХ и связанные с ней ПНЯ являются результатом генетических нарушений, которые избирательно инактивируют и приводят к недостаточному функционированию генов, задействованных в формировании и развитии достаточного фолликулярного пула яичников.
Поскольку случаи ярко выраженной неслучайной ИХХ были отмечены у женщин с ПНЯ, то мы предположили скрытые аномалии или мутации, которые не были идентифицированы при стандартном применении G-окраски, но эти нарушения могли привести к неслучайной ИХХ, клеточной селекции и затем к ПНЯ. Гены, вовлеченные в поддержание функционирования яичников, могут быть непосредственно повреждены при структурных аномалиях Хq и вызвать дисфункцию яичников. Генетические нарушения могут приводить к потере герменогенных клеток или снижению их количества относительно других клеточных субпопуляций, сопровождающихся неравновесной ИХХ и ПНЯ.
Таким образом, генетические факторы могут играть важную роль в развитии ПНЯ. Для установления природы этих факторов необходимы дальнейшие исследования групп сцепления в семьях, что подтверждается особенностями семейного анамнеза у наших пациенток.
источник
Воинова В. Ю., Юров И. Ю., Ворсанова С. Г., Юров Ю. Б.,
Исследование особенностей инактивации хромосомы Х в семьях с Х-сцепленной умственной отсталостью у детей
Нами был проведен анализ особенностей инактивации хромосомы Х у 247 индивидуумов женского пола из 150 семей с Х-сцепленными формами умственной отсталости, небольшой группы женщин (6 индивидуумов) из семей со структурными аномалиями хромосомы Х и 25 женщин из 22 семей с недифференцированными формами нарушений интеллекта. В контрольной группе исследовали 80 женщин без фенотипических проявлений врожденных и наследственных нарушений, а также не имеющих близких родственников с болезнями, связанными с аномалиями хромосомы Х. Применялся молекулярно-генетический метод, основанный на метил-чувствительной рестрикции участка Х-сцепленного гена андрогенового рецептора, включающего полиморфную последовательность тринуклеотидных повторов (ЦАГ)n, число которых в норме широко варьирует, что позволяет различить два аллеля гена андрогенового рецептора у лиц женского пола. Инактивация хромосомы Х определялась как соотношение инактивированных аллелей гена андрогенового рецептора разного родительского происхождения и оценивалась как неравная, если это соотношение превышало 20:80 (рис. 29, вверху). Чтобы избежать ошибок, связанных с неполной амплификацией и рестрикцией, учитывалась интенсивность аллелей в образцах ДНК, необработанных ферментом (HpaII-) (рис. 29, внизу). На рис. 30 представлены результаты количественного ПЦР-анализа инактивации хромосомы Х при случайной (равной, рис. 30, А) и неслучайной (неравной, рис. 30, Б) Х-инактивации.
Проводилось также исследование в парах «мать-пробанд», которое позволило установить направление сдвига инактивации хромосомы Х у женщин. На рис. 31 приведен пример анализа направления сдвига инактивации хромосомы Х: у женщины было определено два фрагмента ДНК разной длины, которые соответствуют двум аллелям гена AR, а у пробанда определен один фрагмент, который соответствует унаследованному от матери аллелю данного гена. Сопоставив их длины, можно установить, что в клетках женщины преимущественно инактивирована хромосома Х, унаследованная пробандом (т.е. несущая мутацию). У части женщин (N = 37) число CAG-повторов в обоих аллелях гена андрогенного рецептора было одинаково, как и в ранее проведенных исследованиях [Юров и др., 2005 б; Plenge et al., 2002]. В случаях, когда оба аллеля гена AR имели одинаковую длину, анализ Х-инактивации невозможно было провести. С учетом этих 37 случаев общая эффективность данного метода для всех образцов ДНК в настоящем исследовании составила 89,4 %, что соответствует данным литературы [Sharp et al., 2000].
Рис. 29. Результаты анализа инактивации хромосомы Х методом определения статуса метилирования экспансии (CAG)n повторов гена AR у женщины из семьи с Х-сцепленной умственной отсталостью. По оси абсцисс на электрофореграммах указана длина фрагментов ДНК (пн), по оси ординат – интенсивность флюоресцентного сигнала в относительных единицах флюоресценции – relevant fluorescent units (RFU). Электрофореграмма HpaII+ (вверху) соответствует амплифицированным участкам ДНК, обработанной метилчувствительной рестриктазой, а HpaII– (внизу) соответствует амплифицированным участкам необработанной ДНК. Стрелками выделены амплифицированные фрагменты гена AR. Пики одного и того же уровня показывают стандарт длины последовательностей ДНК
Рис. 30. Результаты анализа инактивации хромосомы Х: А – пример случайной (60:40), Б – неслучайной (91:9) Х-инактивации. HpaII+ соответствует ДНК, обработанной метилчувствительной рестриктазой, HpaII– соответствует необработанной ДНК. Стрелками выделены амплифицированные фрагменты гена AR
Рис. 31. Анализ направления сдвига инактивации хромосомы Х у матери пробанда с XLMR. У матери преимущественно инактивирована хромосома Х, которую унаследовал больной сын, т.е. хромосома Х с мутацией Х-сцепленного гена. Стрелками выделены амплифицированные фрагменты гена AR
Обследованные семьи с Х-сцепленными моногенными заболеваниями были разделены на 2 подгруппы. В первую входили Х-сцепленные формы умственной отсталости, проявляющиеся у мальчиков-гемизигот, при которых женщины-гетерозиготы имеют либо стертые признаки болезни, либо являются асимптоматическими носительницами (синдром умственной отсталости, сцепленной с ломкой хромосомой Х, синдромы Коффина-Лоури, Симпсона-Голаби-Бемеля, Барта, Лоу, гипогидротическая эктодермальная дисплазия и др.) В данной подгруппе Х-инактивация исследовалась у матерей, сестер и некоторых других родственниц. Во вторую подгруппу вошли семьи больных с Х-сцепленными синдромами, проявляющимися преимущественно у гетерозигот с внутриутробной летальностью для мальчиков-гемизигот. В данной подгруппе Х-инактивация исследовалась у пробандов женского пола и их матерей.
Результаты анализа инактивации хромосомы Х в исследованных группах семей показаны в табл. 19. В целом при Х-сцепленных синдромах, проявляющихся у девочек-гетерозигот, сдвиг Х-инактивации наблюдался у 45 % больных, а при Х-сцепленных заболеваниях, проявляющихся у гемизигот, сдвиг Х-инактивации определён у 46 % женщин из семей больных мальчиков (в 7 раз чаще, чем в контроле – 6,5 %).
Удельный вес сдвига инактивации хромосомы Х у женщин из семей с Х-сцепленными формами умственной отсталости
Удельный вес сдвига инактивации хромосомы Х среди индивидуумов женского пола
Достоверность различий с контролем
Абсолютное
количество индивидуумов женского пола
Женщины (матери и другие родственницы) из семей с Х-сцепленными формами умственной отсталости, проявляющимися преимущественно у гемизигот, в том числе:
источник

