Болезнь Альцгеймера обычно развивается у пожилых людей. Типичными признаками патологии являются ухудшение памяти и снижение интеллектуальных способностей.
Человек, страдающий от этого недуга, плохо ориентируется в пространстве. Больной нуждается в помощи близких. Причины, вызывающие развитие патологии, до конца не изучены.
Невропатологи предполагают, что патологические изменения вызваны накоплением веществ. Их отложение в головном мозге при болезни Альцгеймера происходит постепенно.
Эта теория объясняет, почему патология непрерывно прогрессирует, а симптоматика усиливается. На первых этапах болезнь сложно диагностировать. При умеренной деменции признаки выражаются ярче. На поздних стадиях больной уже не может самостоятельно передвигаться и обслуживаться себя. Развитие патологии связано с нарушением работы головного мозга. Первые изменения начинаются уже на этапе ранней деменции.
Основными среди них являются:
- наличие болезни у родственников;
- возраст старше 65 лет;
- черепно-мозговые травмы;
- патологии щитовидной железы;
- влияние электромагнитных полей.
Кроме этого, учёные доказали, что существует высокая вероятность развития болезни Альцгеймера у пациентов с диагностированным синдромом Дауна. При этом заболевании геном человека содержит лишнюю хромосому. Медики называют данную патологию трисомия 21. Именно эта лишняя хромосома является источником опасного вещества, формирующего отложения. Высока вероятность развития деменции в относительно молодом возрасте. Болезнь Альцгеймера начинает прогрессировать по достижению 40 лет.
Нарушение нормального функционирования головного мозга связано с изменением его структуры. При этом формируются фибриллы. Они представлены скоплением большого количества гликопротеида. Это вещество не растворяется в воде и биологических жидкостях. Его невозможно удалить из тканей головного мозга. Такие изменения носят необратимый характер. По этой причине болезнь Альцгеймера не поддаётся лечению.
Фибриллы представляют собой жёсткие структуры. Они не только деформируют ткани головного мозга, лишая человека привычных навыков и способностей. Эти конгломераты оказывают токсическое действие на нервные клетки.
Однозначной версии, объясняющей развитие деменции в пожилом возрасте, не существует. Невропатологи склоняются к амилоидной гипотезе. Версия была выдвинута в 1991 году. Согласно этой теории, в головном мозге пациентов накапливается особое вещество – амилоид.
Данная структура представляет собой белок. Он образуется при расщеплении гликопротеидов под действием ряда ферментов.
Исходное вещество в норме всегда присутствует в мембранах нервных клеток здорового человека.
Амилоид является нерастворимым соединением. Он постепенно накапливается в тканях головного мозга. Эти отложения инициируют процессы необратимых изменений. По сути, начинается разрушение центральной нервной системы.
Со временем в нервной ткани накапливается всё больше опасного белка. Это объясняет непрерывное развитие болезни Альцгеймера. Приостановить отложение амилоида невозможно. Пациент при этом будет отмечать ухудшение памяти и умственных способностей. Постепенно теряются и двигательные навыки.
Следует отметить, что учёные обнаружили полезную роль амилоида и его предшественника относительно недавно. Прежде предполагалось, что эти вещества не нужны человеческому организму. Сейчас известно, что гликопротеид, являющийся предшественником амилоида, обладает противомикробными свойствами. Это открытие позволило предположить, что наличие указанных гликопротеидов обеспечивает иммунный ответ организма. Таким способом частично формируется врождённая защита от бактерий.
При определённых условиях необходимый для поддержания иммунитета амилоид видоизменяется. Вещество становится опасным для организма. Меняется сама химическая структура белка. Нитевидные молекулы формируют крупные нерастворимые скопления – фибриллы. Запускается процесс разрушения тканей головного мозга.
Постепенно весь амилоид, имеющийся на мембранах нейронов, переходит в патологически изменённую форму. К этому моменту человек уже утрачивает часть функций. Симптомы болезни Альцгеймера проявляются чётко. Невропатологи безошибочно диагностируют деменцию.
Учёные до сих пор не выяснили, что именно инициирует перерождение гликопротеида на мембранах. Эти знания смогут поспособствовать новым открытиям. В частности, появится возможность управлять процессами синтеза амилоида. На данный момент известно, что процесс его образования протекает при участии двух ферментов из класса секретаз.
Болезнь Альцгеймера долгое время может маскироваться. Начальные симптомы болезни Альцгеймера — забывчивость, рассеянность внимания — часто остаются незамеченными, что откладывает начало лечения, тем самым отягощая прогноз.
Хотите знать, передается ли болезнь Альцгеймера по наследству? Читайте эту статью.
Следующая информация будет полезна для всех: http://neuro-logia.ru/zabolevaniya/bolezn-alcgejmera/test.html. В статье представлены простые тесты для диагностики болезни Альцгеймера.
Болезнь Альцгеймера проявляется снижением интеллектуальных способностей, а также ухудшением памяти и способности ориентироваться в пространстве и времени.
Дегенеративные изменения связаны с появлением особого вещества – амилоида. Этот белок перерождается и начинает оказывать отравляющее действие на клетки головного мозга.
Токсичный гликопротеид опасен сам по себе. Нейроны мозга не могут полноценно функционировать. При этом амилоид постоянно накапливается в тканях. Образуются сгустки крупного размера – фибриллы, состоящие из аминокислотных последовательностей.
Такие конгломераты окружены единичными нитевидными молекулами амилоида. Они способны объединяться в кластеры. Это небольшие олигомеры, свободно перемещающиеся в тканях мозга. Кластеры, в отличие от фибрилл, растворяются в воде. Именно такие олигомеры, образованные из амилоидных бляшек, обладают наибольшей токсичностью. Они непосредственно нарушают работу всей нервной системы.
Подобные кластеры являются липкими структурами. Они располагаются между нейронами головного мозга. Их основой являются амилоидные бляшки. Между собой кластеры соединяются с помощью микротрубочек. Это нарушает течение нормальных обменных процессов в организме пациента, страдающего болезнью Альцгеймера. Затрудняется транспортировка питательных веществ к структурам головного мозга.
Кластеры способны продуцировать новые молекулы амилоида. Специалисты называют этот процесс вторичной нуклеацией. Количество опасного гликопротеида непрерывно растёт. Вместе с тем начинается массовая гибель нейронов.
Болезнь Альцгеймера – это разновидность необратимой деменции. Утраченные двигательные функции или когнитивные способности не возвращаются. Причиной патологических изменений становятся отложения амилоида в мозге больного. Учёные не знают, каким способом можно влиять на процесс изменения гликопротеидов на мембранах. По этой причине специфического медикаментозного лечения болезни Альцгеймера не существует.
Так, ряд специалистов предполагает, что деменцию провоцируют геномные нарушения.
Согласно существующей тау-гипотезе, патология развивается из-за нарушения структуры самих клеток мозга.
Болезнь поражает разные участки головного мозга. Максимальная концентрация амилоида обнаруживается в височной, теменной и лобных долях. Сначала появляется лёгкая рассеянность, которая со временем перерастает в серьёзные умственные расстройства.
До 45% случаев сенильной деменции приходится на болезнь Альцгеймера. Профилактика болезни Альцгеймера у мужчин и женщин направлена на активизацию физической и умственной деятельности.
Чем характеризуется тяжелая деменция и каков прогноз для жизни таких больных, вы узнаете, прочитав эту информацию.
источник
Под деменцией понимают выраженное нарушение когнитивных функций на фоне полного сохранения сознания. Самая частая причина деменции — болезнь Альцгеймера (БА), которой страдают 5% людей в возрасте 70 лет и 20% в возрасте 80 лет. На пациентов с БА приходится 20% госпитализаций в психиатрические стационары.
При МРТ обычно обнаруживают выраженную атрофию коры больших полушарий с расширением борозд и увеличением желудочков. Как показано на рисунке ниже, поражение медиальной височной доли (гиппокампальный комплекс и энторинальная кора) происходит в большей степени, чем других отделов. Первичная чувствительная кора и двигательная кора, а также верхние участки префронтальной коры остаются относительно сохраненными.
При посмертном исследовании коры больших полушарий обнаруживают следующие изменения:
• Массивная гибель пирамидных нейронов.
• Амилоидные бляшки и нейрофибриллярные клубки, преимущественно в гиппокампе и миндалевидном теле. Бляшки начинают скапливаться в стенках мелких кровеносных сосудов. Их появление можно объяснить разрушением определенного фермента с последующей гиперпродукцией белка β-амилоида. Клубки состоят из скоплений микротрубочек, которые связаны с патологической формой белка, ассоциированного с микротрубочками (θ-белок). Клубки постепенно замещаются амилоидом.
• Гибель более 50% холинергических нейронов базального ядра Мейнерта и области перегородки мозга, а также их волокон, идущих через неокортекс и мезокортекс. Было также показано, что гибель АХ-нервных окончаний провоцирует образование нейрофибриллярных клубков в височной доле.
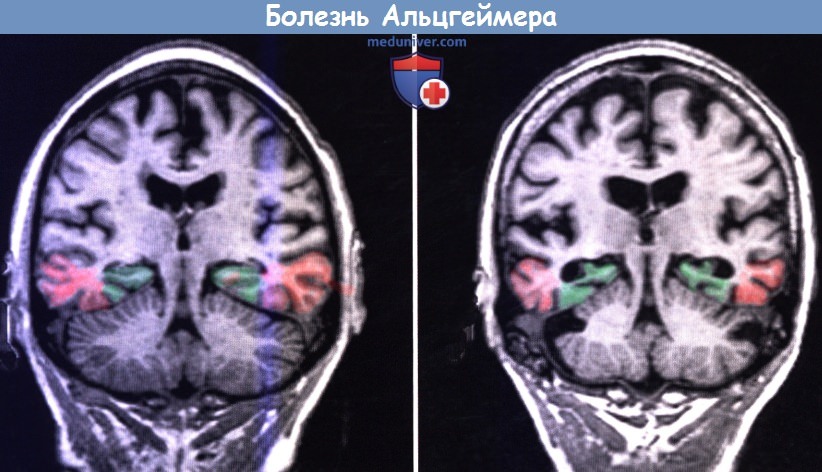
(А) В норме. (Б) Пациент с болезнью Альцгеймера.
Добавлены цвета: зеленый — гиппокамп; красный — энторинальная кора.
При помощи ПЭТ-исследования, направленного на определение скорости метаболизма глюкозы, определяют признаки гипометаболизма. Снижение метаболизма связано с гибелью пирамидных нейронов и (частично) с нарушением холинергической иннервации оставшихся пирамидных клеток. На мембранах здоровых пирамидных нейронов расположены возбуждающие АХ-рецепторы.
Несмотря на то, что процесс гибели нейронов в каждом случае протекает по-разному, чаще всего он начинается в медиальной височной доле, а затем распространяется наверх и вперед. Это может объяснить следующую последовательность развития симптомов.
• Снижение функции гиппокампа. Возникают антероградная амнезия и забывчивость, пациент не может вспомнить о произошедшем с ним событии даже спустя несколько минут (нарушение текущей эпизодической памяти). Пациент перестает ориентироваться на знакомых улицах, совершает опасные ошибки при управлении автомобилем (работа гиппокампа необходима для поддержки чувства пространства, за которое отвечает теменная доля). Нарушается внимание, пациенту становится сложно переключиться с одной задачи на другую.
• Снижение функции затылочно-височной коры. Повреждение поля 37 приводит к неспособности читать и писать. Повреждение височного полюса приводит к развитию крайне неприятного симптома—пациент перестает узнавать лица родственников и друзей. При вовлечении в процесс надкраевой и угловой извилин пациент не может писать.
• Снижение функции лобной коры. Примерно через три года после начала заболевания пациент просто «выпадает» из жизни, он может смотреть в стену и не понимать, что происходит вокруг. Подобное состояние «пустоты» обычно продолжается 5-6 лет до смерти.
Существует также редкий вариант болезни Альцгеймера с ранним началом, который наследуют по аутосомно-доминантному типу. Заболевание обычно возникает в возрасте 30-40 лет. Хромосомный анализ позволил установить, что за развитие болезни отвечает мутация на длинном плече хромосомы 21, которая нарушает действие гена, кодирующего синтез белка-предшественника амилоида. Эту мутация часто также обнаруживают у лиц с синдромом Дауна. У большинства лиц с синдромом Дауна, доживающих до зрелого возраста, развивается болезнь Альцгеймера.
Редактор: Искандер Милевски. Дата публикации: 25.11.2018
источник
Что такое болезнь Альцгеймера? Причины возникновения, диагностику и методы лечения разберем в статье доктора Полякова Т. А., невролога со стажем в 10 лет.
Болезнь Альцгеймера — это хроническое нейродегенеративное заболевание, с медленным началом и значительным ухудшением с течением времени. В 70% случаев болезнь Альцгеймера приводит к деменции.
Заболевание на данный момент изучено плохо. Предполагается, что в 70% случаев болезнь Альцгеймера объясняется генетическими причинами, среди других факторов риска — черепно-мозговые травмы, депрессия, эндокринные заболевания в анамнезе (гипотиреоз), эстрогенная недостаточность у женщин. Исследования последних лет показывают, что усиливают предрасположенность к болезни Альцгеймера гипертония, гиперлипидемия, гипергомоцистеинемия, сахарный диабет, метаболический синдром, инсулинорезистентность, заболевания сердца, а также наличие в истории болезни инсульта. [1] В развитых странах болезнь Альцгеймера является одним из наиболее дорогостоящих заболеваний. В России затраты на содержание больных деменцией составляют 74,8 млрд рублей в год. [2]
Начальные симптомы болезни Альцгеймера часто ошибочно принимаются за нормальные признаки старения.
Кратковременная потеря памяти — наиболее распространенный ранний симптом, который выражается в том, что больному трудно запоминать последние события. В трети случаев заболевание можно распознать по изменениям поведения.
По мере усугубления болезни возникают следующие симптомы:
- проблемы с речью;
- дезориентация;
- перепады настроения;
- потеря мотивации;
- снижение критики;
- проблемы с самообслуживанием и поведенческие расстройства.
- больные не в состоянии вспомнить нужное слово, и им приходится заменять его другим (парафазии), однако они хорошо повторяют сказанное.
- со временем возникают затруднения при назывании предметов (аномии).
- уже на ранней стадии возникают трудности с пониманием сложных грамматических структур (семантическая афазия), к которому затем присоединяется отчуждение смысла слова. [3]
Существуют отличительные патоморфологические признаки болезни Альцгеймера: амилоидные (сенильные) бляшки — это внеклеточные отложения в виде скопления фрагмента белка, называемые бета-амилоидом; нейрофибриллярные клубочки — скрученные микроскопические нити тау-белка внутриклеточной локализации. Происходит потеря связи между клетками мозга, ответственными за память, обучение и общение. Эти соединения, или синапсы, передают информацию из клетки в клетку. Важная роль в патогенезе принадлежит воспалительному процессу, связанному с активацией микроглии, которая инициируется накоплением амилоида. [1]
Макроскопически выявляется диффузная атрофия головного мозга с уменьшением объёма извилин и расширением боковых борозд, наиболее выраженная в височно-теменной области.
У значительной части больных цереброваскулярная патология может инициировать или усиливать дегенеративный процесс, связанный с отложением амилоида или другими характерными для заболевания изменениями.
Типичный фенотип болезни Альцгеймера — сочетание выраженных мнестических нарушений гиппокампального типа с акустико-мнестической афазией, зрительно-пространственными нарушениями и апраксией. [3]
Три атипичных фенотипа болезни Альцгеймера (неамнестических):
- с ведущим афатическим дефектом (логопенический вариант первичной прогрессирующей афазии);
- с доминирующими зрительно-пространственными нарушениями (задняя корковая афазия);
- преимущественно с дизрегуляторными нарушениями (лобный вариант болезни Альцгеймера).
Заболевание также подразделяется на формы с ранним началом, зачастую с положительным семейным анамнезом (до 65 лет) и поздним началом (старше 65 лет). Они отличаются патогенезом, генетическими факторами и разной скоростью прогрессирования.
Три стадии болезни Альцгеймера:
Первая: больные обслуживают себя сами, но им нужна помощь для решения финансовых вопросов, приготовления пищи и т. д.
Вторая: зависимость от посторонней помощи растет — больные не способны самостоятельно одеться, осуществить гигиенические процедуры, долго оставаться дома без присмотра.
Третья: больные не могут выполнить ни одно из привычных повседневных действий без помощи других людей.
Переход от одной стадии к другой коррелирует со снижением оценки по MMSE (Краткая шкала психического статуса), которая является надежным инструментом для отслеживания динамики заболевания.
Продолжительность жизни людей с болезнью Альцгеймера после установления диагноза обычно колеблется от трех до десяти лет. Более четырнадцати лет после установления диагноза живут менее 3% больных. Уменьшение выживаемости связано с тяжелыми когнитивными нарушениями, снижением уровня физической активности, частыми падениями и нарушениями в неврологическом статусе. Сопутствующие соматические заболевания также влияют на продолжительность и качество жизни при болезни Альцгеймера. Пневмония и обезвоживание — наиболее частые непосредственные причины смерти, вызванной болезнью Альцгеймера. Кроме того, чем старше возраст, тем выше общий возраст выживаемости. У мужчин прогноз менее благоприятен по сравнению с женщинами.
Трудности ранней диагностики болезни Альцгеймера во многом объясняются «маскированным» характером заболевания в этот период, когда отсутствуют явные внешние признаки деменции. Для постановки диагноза, определения тактики ведения пациента необходимо выявить характер и выраженность когнитивных нарушений. Основной метод оценки когнитивных функций — нейропсихологическое обследование, которое проводит врач, обученный данным методам исследования. В некоторых странах практикуется обследование больных их родственниками с помощью известных шкал для оценки когнитивных функций.
Молекулярная диагностика на ранней стадии заболевания также создаёт перспективы для раннего назначения лечения. Определение биомаркеров в плазме является менее инвазивной альтернативой для диагностики болезни Альцгеймера. Биомаркеры классифицируются на биомаркеры накопления амилоида и биомаркеры нейродегенерации. Основные биомаркеры отражают патологию амилоида (внеклеточное накопление Aβ1-40/1-42) или внутриклеточные включения нейрофибриллярных клубочков (гиперфосфорилированного тау). [4] [5]
Согласно рекомендациям 4-го Канадского консенсуса по диагностике и лечению деменции и рациональному использованию биомаркеров для диагностики болезни Альцгеймера и других деменций (CCCDTD4, 2011): [6]
1. Определение биомаркеров цереброспинальной жидкости не рекомендуются для диагностики болезни Альцгеймера с типичной клинической картиной (2А уровень);
2. Исследование биомаркеров не рекомендуется для скрининга здоровых людей с целью оценки риска развития болезни Альцгеймера в будущем (уровень 1В);
3.Биомаркеры цереброспинальной жидкости можно рассматривать в особых случаях, когда есть атипичные признаки или диагностические трудности при дифференциальной диагностике лобного варианта болезни Альцгеймера от лобно-височной деменции, а также случаи первично прогрессирующей афазии как следствие болезни Альцгеймера или лобно-височной дегенерации (уровень 2В).
Современные методы нейровизуализации позволяют расширить диагностические возможности прижизненной диагностики болезни Альцгеймера. В тоже время структурные изменения по данным магнитно-резонансной томографии являются более прогностически значимыми для дальнейших изменений в когнитивной сфере, чем биомаркеры цереброспинальной жидкости. По данным магнитно-резонансной томографии, признаки цереброваскулярного заболевания, такие как лейкоареоз и множественные подкорковые лакунарные инфаркты, чаще наблюдаются у пациентов с болезнью Альцгеймера, чем в контрольной группе. [7] Асимметричная атрофия медиальных отделов височной доли также не исключает сосудистую деменцию.
Описана смешанная модель патогенеза болезни Альцгеймера, которая предполагает взаимодействие церебральной амилоидной ангиопатии с сосудистыми факторами на ранних стадиях патологического процесса. Предполагается, что синергия между накоплением амилоида и цереброваскулярной патологией может инициировать дальнейшую дисфункцию нейронов и нейродегенерацию. [8] В этом отношении церебральные микрокровоизлияния, выявляемые в режиме Т2 градиентного эхо на магнитно-резонансной томографии, являются дополнительным и доступным диагностическим маркером, повышающим диагностическую значимость лейкоареоза и свидетельствующим в пользу церебральной амилоидной ангиопатии или гипертонической микроангиопатиии, особенно в случаях смешанной патологии и тяжелого когнитивного дефицита.
Локализация церебральных микрокровоизлияний является дифференциально-диагностическим признаком ведущего патологического процесса. В случае болезни Альцгеймера наблюдается корковая локализация микрокровоизлияний, в случае дисциркуляторной энцефалопатии или сосудистой деменции будут визуализироваться микрокровоизлияния в глубинных отделах мозга. [9] [10]
Одним из наиболее перспективных методов диагностики болезни Альцгеймера является позитронно-эмиссионная томография с лигандом, который связывается с амилоидом (PiB), однако накопление амилоида и захват соответствующего лиганда нарастают на стадии умеренных когнитивных нарушений, но после конверсии в деменцию дальнейшего накопления не происходит. [11]
Болезнь Альцгеймера пока не поддается лечению. Но благодаря группе новых препаратов и симптоматическому лечению можно сделать так, что снижение интеллекта больных будет более постепенным. В России зарегистрированы все современные антидементные препараты. Более того, они вошли в список жизненно важных лекарственных средств. Их всего четыре, и они прежде всего от болезни Альцгеймера, но нередко применяются и при деменциях другого происхождения.
К таким средствам относятся:
- ингибиторы холинэстеразы (донепезил, ривастигмин, галантамин)
- блокаторы NMDA-глутаматных рецепторов (акатинол-мемантин).
С целью лечения сопутствующих расстройств используются также антидепрессанты и нейролептики.
Существуют и нелекарственные методы воздействия — тренировки интеллектуальных функций. Нейропсихологическая реабилитация позволяет стимулировать к развитию новых нейронный сетей, обучая рабочие нервные клетки.
С увеличением осведомлённости общества о деменции будет расти и потребность в помощи по уходу, понадобятся значительные затраты для её организации. Пока же преобладает в основном неформальная помощь в семьях. Усилия по улучшению качества и доступности помощи потребуют вложений в меры первичной профилактики, и возможно, это позволит контролировать «эпидемии» деменций в разных регионах мира. В качестве основных мишеней первичной профилактики рассматриваются улучшение образования и устранение сосудистых факторов риска.
На сегодняшний день одной из основных целей профилактики является создание различных новых форм внебольничной помощи пациентам пожилого и старческого возраста с целью улучшения диагностики когнитивных нарушений разной степени тяжести, более раннее выявление заболеваний. С такой целью в развитых странах созданы клиники памяти, Альцгеймеровские центры. [2] В России также работают кабинеты памяти, научно-исследовательские центры по изучению расстройств памяти, запущены социальные интернет-проекты, например, memini.ru. Большое значение имеют «школы для родственников», так как родственники остаются один на один с этой болезнью и часто не знают, что надо делать.
Человек с деменцией обращен в прошлое. Больных надо аккуратно «тормошить» и в интеллектуальном плане, и в двигательном. Неподвижность плохо влияет на мозг. Лучший способ сохранить разум, это, как ни странно, даже не интеллектуальная деятельность, а двигательная активность. Именно в этом случае в мозге создаются условия, которые способствуют образованию новых связей между нейронами и укреплению мозгового резерва, что впоследствии противодействует развитию деменции.
источник
Несмотря на то, что научное общество до сих пор не может прийти к единому мнению относительно гипотезы возникновения болезни Альцгеймера, морфологические изменения, возникающие при данной патологии, изучены достаточно тщательно. Знание механизмов развития заболевания и отдельных его проявлений необходимо для своевременной диагностики сенильной деменции альцгеймеровского типа. Понимание патогенеза играет важную роль и в создании новых направлений терапии.
Что происходит с мозгом при болезни Альцгеймера на молекулярном уровне?
Все начинается с нарушения метаболизма. В нормальных условиях предшественник бета-амилоида расщепляется ферментом на одинаковые по размеру непатогенные пептиды. При дефекте ферментной системы или самого белка в результате указанной реакции получаются разные по длине фрагменты.
Нерастворимые длинные молекулы начинают откладываться в стенках сосудов и веществе головного мозга, затем объединяются между собой в бета-амилоидную структуру. Получившийся белок обладает токсичным воздействием на нейроны. Он способствует развитию оксидативного стресса, активирует медиаторы воспаления — вещества, поддерживающие воспалительную реакцию. Все эти процессы приводят к повреждению и смерти нервных клеток.
В свою очередь, из-за гибели нейронов базального ядра снижается концентрация ацетилтрансферазы, фермента, катализирующего образование ацетилхолина, одного из главных возбуждающих нейромедиаторов. Ацетилхолин отвечает за передачу нервного импульса: снижение его количества негативно отражается на когнитивных функциях и ведет к нарушению регуляции процессов памяти.
По мере накопления бета-амилоида происходит гиперактивация механизмов, направленных на защиту тканей. Они «отключают» синтез протеинов, необходимых для нормальной работы головного мозга и тем самым запускают процессы дегенерации, которые приводят к деменции.
Какие изменения характеризуют головной мозг при болезни Альцгеймера на клеточном уровне? Самыми главными являются появление сенильных бляшек и нейрофибриллярных сплетений, а также массовая гибель клеток вещества головного мозга.
Под этим термином подразумевают локальные внеклеточные скопления бета-амилоида различного размера в мозговом веществе. В первую очередь гибнут нейроны, окружающие именно «гнездные» отложения токсичного белка, поэтому на периферии бляшек всегда находятся поврежденные клетки.
Зрелой бляшке предшествует преамилоидное отложение. Стандартная «созревшая» бляшка состоит из четырех компонентов:
- центральное ядро — очаговое скопление бета-амилоида;
- клеточное окружение из микроглии, в этой же зоне изредка встречаются астроциты;
- аксоны и дендриты, находящиеся в стадии дегенерации;
- отростки нейронов, которые уже наполнены плотными тельцами.
Мозг больного Альцгеймером содержит сенильные бляшки в гиппокампе, миндалевидном теле, во всех отделах коры головного мозга, кроме чувствительных и двигательных зон.
Это внутриклеточные включения, основной составляющей которых считается гиперфосфорилированнный белок под названием тау-протеин. Они выглядят как узелки, либо клубочки, и представлены спиралевидными скрученными попарно филаментами.
Тау-протеин предназначен для стабилизации микротрубочек, органелл, отвечающих за создание цитоскелета и транспортировку веществ внутри клетки. Гиперфосфорилирование белка тау приводит к нарушению его связей с микротрубочками, что в итоге вызывает гибель нейрона.
Пораженные клетки уменьшаются в объеме, их цитоплазма вакуолизируется. В ней часто обнаруживают агрофильные гранулы.
| Свойства/Патоморфологический элемент | Сенильные бляшки | Нейрофибриллярные сплетения |
|---|---|---|
| внешний вид | скопления разных размеров овальной формы | узелки или клубочки из филаментов |
| локализация по отношению к клетке | внеклеточное пространство | внутри клетки, на внутренней стороне мембраны нейрона |
| локализация в головном мозге | гиппокамп, амигдала, кора | гиппокамп, амигдала, кора, базальное ядро Мейнерта |
Нейрофибриллярные сплетения локализуются там же, где сенильные бляшки, а также в базальном крупноклеточном ядре переднего мозга. К патоморфологическим элементам, схожим с ними по происхождению, относятся скопления актиновыхфиламентов или тельца Хирано, которые располагаются в нейронах гиппокампа и проксимальных дендритах.
Выраженность когнитивных нарушений при данной патологии не коррелирует с концентрацией двух предыдущих элементов (бляшек и нейрофибриллярных сплетений), зато напрямую зависит от того, насколько поврежден мозг при болезни Альцгеймера, и количества связей между нервными клетками. Чем меньше синапсов, тем тяжелее выражены нарушения.
Головной мозг при Альцгеймере страдает неоднородно. Массовую гибель нейронов отмечают на следующих участках:
- гиппокампе, отвечающем за консолидацию памяти;
- медиобазальных участках лобных долей;
- глубинных отделах височных долей;
- кореатрофичных долей головного мозга.
Нейробиологи из Университета штата Аризона во время испытаний обнаружили, что изменения в мозге при болезни Альцгеймера на клеточном уровне включают в себя также некроптоз. При изучении посмертных образцов в тканях мозга были обнаружены белки, являющиеся маркерами этого программируемого процесса. Поэтому некроптоз можно отнести к одному из механизмов развития нейродегенерации.
Гистологические исследования показывают, что вышеуказанные процессы приводят к постепенной атрофии ткани головного мозга, значительному уменьшению числа нейронов гиппокампа (особенно на уровне крючка), коры, подкорковых структур.
Отмечаются дегенеративные изменения дендритов, белого вещества, накопление бета-амилоида и нейрофибриллярных сплетений. Вместе с гибелью нейронов нарушаются синаптические связи. Сильнее всего эти изменения заметны в височной коре, базальных ядрах, гиппокампе, поясной извилине и в медиобазальных участках коры больших полушарий мозга.
Важно! У многих людей в пожилом возрасте в веществе мозга обнаруживаются сенильные бляшки и клубки из филаментов. Однако при Альцгеймере они распределяются неравномерно, преимущественно в определенных областях (например, в височных долях).
Скопления бета-амилоида выявляются не только во внеклеточном пространстве, но и в церебральных сосудах, а также в сосудистых сплетениях. Возможна дистрофия (иногда избыточная пролиферация) глии.
Мозг человека с болезнью Альцгеймера характеризуется следующими признаками:
- диффузной атрофией вещества, преимущественно височных, теменных и затылочных долей;
- сужением извилин;
- углублением борозд;
- асимметрией гиппокампов;
- расширением желудочков;
- расширением субарахноидальных пространств;
- уменьшением общей массы и объема;
Из-за атрофии коры и уменьшения общего объема мозга развивается компенсаторная гидроцефалия — ликвор постепенно заполняет образующиеся в белом веществе полости. Истончается дно III желудочка. Результатом этого является поражение области гипоталамуса и нарушение метаболизма вплоть до серьезных эндокринных сдвигов (яркий пример — прогрессирующая кахексия).
Немалый вклад в изучение патогенеза и проявлений данного заболевания внесли методы нейровизуализации: КТ, МРТ, ПЭТ, ОФЭКТ и т.д. Большое значение в диагностике Альцгеймера придается методу магнитно-резонансной томографии. Изменения на МРТ при болезни Альцгеймера позволяют учитывать возрастную инволюцию и упрощают дифференциальный диагноз с другими, схожими по клиническим проявлениям патологиями.
Магнитно-резонансную томографию проводят минимум два раза. Интервал между исследованиями должен составлять не меньше месяца — для оценки наличия и динамики дегенеративного процесса. При анализе учитывают возрастные изменения, церебральную атрофию и компенсаторную гидроцефалию.
Уже для ранних стадий заболевания характерно уменьшение объема медиальных участков височных долей. Наиболее точно дифференцировать возрастную норму от Альцгеймера удается благодаря измерению гиппокампа и энториальной коры: степень дегенерации гиппокампа у больных сенильной деменцией больше примерно в два раза. То же самое можно сказать о размерах височного рога.
Мозг больного Альцгеймером на МРТ на более поздних стадиях имеет следующие признаки:
- наличие включений (крупных очагов-бляшек и нейрофибриллярных сплетений);
- уменьшение массы и объема церебрального вещества;
- расширение желудочков;
- нарушение метаболизма в мозговом веществе.
У пациентов с БА на МРТ чаще выявляется поражение белого вещества в форме лейкоареоза. Особое значение имеют перивентрикулярные гиперинтенсивные очаги, в то время как глубокие поражения не имеют особой корреляции с сенильной деменцией.
В 60% случаев обнаруживаются изменения в подкорковых структурах в виде лакунарных кист, не прозвучавших клинически корковых инсультов, изолированных очагов.
Помимо обычного МРТ, в диагностику иногда включают перфузионную МРТ, диффузионно-взвешенную и спектроскопию.
Перфузионная МРТ — методика получения изображения после внутривенного введения специального вещества. Благодаря ей можно измерить гемодинамические параметры мозга. Ряд исследований выявил снижение объема гемоперфузии у пациентов с Альцгеймером почти на 20% по сравнению с нормой.
Спектроскопия — позволяет получить информацию о химическом составе тканей.
Важно! Большинство назначаемых методик исследования, даже МРТ, не всегда позволяет однозначно вынести вердикт о наличии болезни Альцгеймера на ступени ранней деменции. Поэтому при изучении изменений в церебральном веществе следует принимать во внимание все виды диагностики, не отдавая приоритет какому-либо из них.
Болезнь Альцгеймера на МРТ головного мозга с участием спектроскопии демонстрирует подъем уровня холина, что отражает разрушение миелиновых оболочек нервных волокон, подъем уровня мио-инозитола, что показывает аномалию цитоскелета. У пациентов с БА регулярно выявляются оба признака. Уровень других метаболитов, таких как креатин, N-ацетиласпартат, коррелируют с тяжестью деменции при Альцгеймере.
Если МРТ покажет болезнь Альцгеймера точно, то с компьютерной томографией все сложнее. Чувствительность компьютерного томографа по сравнению с ЯМР намного ниже, на КТ видны лишь значительные поражения вещества мозга.
| Изменения/метод исследования | КТ | МРТ |
|---|---|---|
| атрофия вещества мозга | при выраженных изменениях | на ранних стадиях |
| расширение желудочков | да | да |
| гидроцефалия | да | да |
| бляшки в сосудах | с контрастированием | да |
| очаги лейкоареоза | да | да |
| изменения размеров гиппокампа | при выраженных изменениях | да |
| изучение оболочек мозга | нет | да |
| изучение мягкого вещества | средняя точность | высокая точность |
| исследование структуры нервных волокон | нет | да |
На срезах КТ хорошо заметна атрофия коркового вещества, расширение субарахноидальных пространств и желудочков мозга, а также компенсаторная гидроцефалия, характерные для Альцгеймера. Видны будут и небольшие зоны лейкоареоза, а КТ с внутривенным введением контраста помогает обнаружить и амилоидные отложения в церебральных сосудах и сосудистых сплетениях.
Хотя все эти признаки и повторяют МР-симптоматику для сенильной деменции альцгеймеровского типа, но они становятся заметны только на поздних стадиях и нужны лишь для подтверждения уже поставленного диагноза. Если болезнь Альцгеймера МРТ покажет в стадии ранней деменции, то разрешающая способность компьютерного томографа попросту не позволит этого сделать.
источник
Всё чаще в стенах медицинских учреждений звучит вопрос пациентов: «Что такое болезнь Альцгеймера?» Это дегенеративное заболевание нервной системы за последние годы приобрело масштабы эпидемии. Самым пугающим является тот факт, что болезнь Альцгеймера симптомы и признаки на начальных этапах имеет такие же, как и другие деменции. Поэтому диагностика часто запаздывает, а лечение более эффективно, если его начинают как можно раньше.
Болезнь Альцгеймера – это постоянно прогрессирующее нейродегенеративное заболевание, которое поражает головной мозг и сопровождается деменцией коркового типа. Этот тип деменции характеризуется нарушением памяти, афазией, апраксией, акалькулией и другими очаговыми расстройствами высших психических функций.
Показатель заболеваемости при этой патологии тем выше, чем больше продолжительность жизни у людей в конкретной стране. Ведь на каждые последующие пять лет после 65-летнего возраста он увеличивается больше, чем в два раза. Так заболевание диагностируется у 6 — 11% пациентов старше 60 лет, а у людей достигших 80 — 85 лет – в 35 — 45% случаев.
Всемирная организация здравоохранения (ВОЗ) сообщает, что в 2016 г. деменцией страдало близко 0,44 — 0,46% (26,6 млн человек) населения земного шара. При этом прогнозируя, что к 2030 — 2035 г. этот показатель будет не ниже 0,55 — 0,6%, а абсолютное количество заболевших возрастёт в три-четыре раза.
Болезнь Альцгеймера причины имеет до настоящего времени так и не изученные. За последние десять лет было предложено около 15 теорий развития этой патологии, но ни одна из них не отвечает на все вопросы. Болезнь Альцгеймера пока остаётся загадкой для учёных.
Мнения исследователей сходятся в одном: существуют наследственная и спорадическая формы заболевания. Медико-генетические исследования доказали наличие мутации генов, расположенных в хромосомах 1, 14, 19 и 21.
Это подтверждается тем, что при болезни Дауна, когда возникает трисомия по 21-й хромосоме (то есть у человека присутствует лишняя хромосома), болезнь Альцгеймера встречается намного чаще и имеет более раннее начало.
Генетические мутации наблюдаются и не при аутосомно-доминантном наследовании. В таком случае риск заболеть повышается в 4 — 4,5 раза у ближайших родственников пациента, а если в роду имелось более 2 случаев болезни Альцгеймера, то риск увеличивается в 40 раз.
Существует три самых распространённых гипотезы патогенеза болезни Альцгеймера, которые скорее дополняют друг друга, чем противоречат:
- холинергическая теория;
- амилоидная теория;
- теория дезинтеграции тау-белка.
Согласно холинергической теории болезнь Альцгеймера спровоцирована недостаточностью нейромедиатора ацетилхолина. Это подтверждается эффективностью антихолинэстеразных препаратов на начальных этапах заболевания. Затем в патогенезе ведущая роль переходит скоплению амилоидных и нейрофибриллярных агрегатов.
Дефицит ацетилхолина связывают с атрофическими процессами в области базальных ядер головного мозга, в частности ядра Мейнерта, нейроны которого продуцируют этот медиатор.
В конце двадцатого века была выдвинута гипотеза, в которой первопричиной развития болезни Альцгеймера был назван бета-амилоид. Гены, кодирующие данный белок, находятся в 19-й и 21-й хромосомах. В результате мутации происходит избыточный синтез амилоида, что приводит к образованию специфических агрегатов (сенильных бляшек). Также следы этого белка обнаруживаются в нейрофибриллярных клубочках и стенках мозговых сосудов.
Однако не доказано, что увеличение образования сенильных бляшек ведёт к более быстрому прогрессированию болезни. Скорее скопление амилоида приводит к запуску таупатии и апоптозу нейронов.
Не менее популярной является гипотеза, в которой рассматривается роль тау-белка в возникновении болезни Альцгеймера. Этот белок в норме находится на микротрубочках, которые представляют собой транспортную систему клетки, доставляя питательные вещества от тела нейрона к отросткам. В результате гиперфосфорилирования тау-белка происходит нарушение структуры микротрубочек и их агрегация. Это приводит к образованию нейрофибриллярных клубков, которые становятся причиной преждевременной гибели клеток.
Нейрофибриллярные агрегаты обнаруживаются не только при болезни Альцгеймера, но и при других патологиях нервной системы, сопровождающихся интеллектуально-мнестическими нарушениями (деменция с тельцами Леви, болезнь Паркинсона и т.д.), а также в процессе нормального физиологического старения.
На данном этапе исследований неизвестно, как именно бета-амилоид и тау-белок нарушают функционирование клеток. Предполагают, что эти агрегаты изменяют гомеостаз ионов кальция в клетке, что провоцирует их апоптоз.
При патоморфологическом исследовании головного мозга определяется апоптоз нейронов в коре мозга, в гиппокампе, в базальном ядре Мейнерта. Отростки «выживших» нервных клеток также подвергаются дегенеративным процессам. Возникает нарушение в структуре пре- и постсинаптических мембран.
Обычно тяжесть болезни Альцгеймера коррелирует с морфологическими изменениями в мозге – количеством сенильных бляшек, нейрофибриллярных клубочков, числом разрушенных синапсов.
