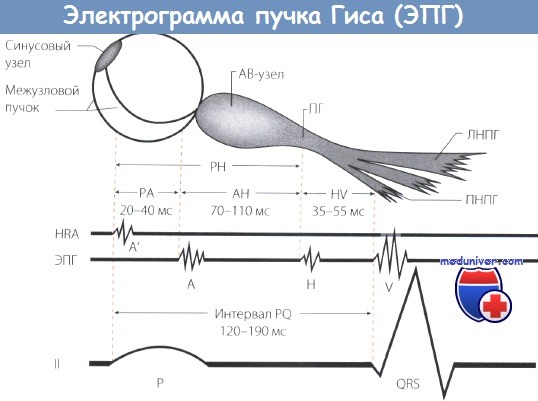
На рис. 6.9 представлена нормальная электрограмма пучка Гиса (НВЕ), которая состоит из трех групп осцилляции, каждая из ко торых соответствует активации определенного отдела проводящей системы.
Сопоставление электрограммы пучка Гиса с зубцом Р стандар тной ЭКГ позволяет количественно оценить ряд интервалов: 1) Интервал Р—А (от начала зубца Р ЭКГ до начала группы ос цилляции А на НВЕ) отражает время проведения электрического импульса по предсердиям; 2) Интервал А—Н (от начала осцилля ции А до начала осцилляции Н) соответствует времени проведе ния по АВ-соединению; 3) Интервал Я (продолжительность ос цилляции группы Н) отражает время проведения по общему стволу пучка Гиса; 4) Интервал Я— V (от начала осцилляции Н до пер вых отклонений желудочкового комплекса) соответствует прове дению импульса по пучку Гиса, его ветвям и волокнам Пуркинье. В табл. 6.1 представлены нормальные значения указанных интерва лов.
Использование метода электрографии пучка Гиса позволяет уточнить локализацию атриовентрикулярной блокады. В зависимос ти от уровня блокирования электрического импульса в атриовен- трикулярной системе М.С. Кушаковский и Н.Б. Журавлева выде ляют 5 типов АВ-блокад (табл. 6.2). Характерно, что каждый из этих типов может достигать различной степени блокирования элек трического импульса (от I до III степени) и, наоборот, каждой из трех степеней блокады может соответствовать разный уровень на рушения проводимости. Так, при атриовентрикулярной блокаде I степени в половине случаев наблюдается узловая форма блокады, проявляющаяся увеличением интервала А—Н электрограммы пучка Гиса больше 120 мс, тогда как интервалы Р—А и Н— V имеют нормальную продолжительность (рис. 6.10, а). Часто встречается также трехпучковая атриовентрикулярная блокада I степени, для которой характерно увеличение Я— К-интервала больше 55 мс (рис. 6.10, б). При стволовом типе атриовентрикулярной блокады I степени наблюдается увеличение продолжительности группы осцил ляции Н (Н РН 2) больше 20 мс, а при комбинированной блокаде — удлинение интервалов А—Н и H — V .
Такая же картина может наблюдаться при атриовентрикулярной блокаде И степени, проявляющейся периодическим выпадением желудочкового комплекса. Наиболее часто встречающийся узловой тип блокады характеризуется увеличением интервала А—Н электрограммы пучка Гиса (рис. 6.11, а), тогда как при редко встре чающейся стволовой атриовентрикулярной блокаде II степени наблюдается увеличение продолжительности группы осцилляции Н (НРН 2) (рис. 6.П, б). Полная атриовентрикулярная блокада III степени чаще носит характер трехпучковой блокады, хотя блоки рование электрического импульса может происходить и на уровне АВ-соединения (узловой тип), общего ствола пучка Гиса.
Таким образом, уточнение локализации атриовентрикулярной блокады I — III степени с помощью электрографии пучка Гиса по зволяет лучше понять конкретные механизмы, вызвавшие нару шение проводимости, и оценить прогноз заболевания. Однако сле дует помнить, что эта важная информация, получаемая с помо щью сложного инвазивного метода исследования, не должна яв ляться самоцелью. Проведение этого дополнительного исследова ния может быть оправдано только в том случае, если решается вопрос показаний к оперативному вмешательству, например, у больных с постинфарктным кардиосклерозом и хронической анев ризмой левого желудочка, осложненными прогрессирующей сер дечной недостаточностью и (или) тяжелыми нарушениями ритма и проводимости, требующими хирургической коррекции.
источник
Антиаритмическая терапия при нарушениях сердечного ритма (брадикардия, тахикардия).
Электрофизиологическое исследование – процедура, направленная на получение записи биологических потенциалов с внутренней поверхности сердца, используя при этом специальные электроды-катетеры и регистрационную аппаратуру.
Проведение специальных видов стимуляции для изучения электрофизиологических свойств проводящей системы, миокарда предсердий и желудочков. Выявление субстратов аритмии, их локализации и электрофизиологических характеристик. Контроль лекарственной и/или нефармакологической терапии.
Инвазивное электрофизиологическое исследование сердца (ЭФИ) используется в клинической практике с конца 60-х годов, когда впервые была описана методика регистрации потенциала пучка Гиса. С тех пор свое применение в клинической практике нашли различные методы и способы проведения ЭФИ, разнообразные виды стимуляции и большое количество видов многополюсных электродов.
В настоящее время использование ЭФИ для диагностики и лечения различного рода аритмий и нарушения проводимости сердца имеют огромное количество центров и клиник.
Появление возможности у врача проведения ЭФИ позволяет изучить основные механизмы аритмий и нарушения проводимости сердца.
Применение ЭФИ помогает решить три основные задачи:диагностика, лечение (как терапевтическое, так и хирургическое) и прогнозирование во многих клинических ситуациях.
Ранние электрофизиологические исследования заключались в регистрации внутриполюсной электрической активности при спонтанном ритме с помощью обычных электродов для стимуляции.
В современных методах используются электроды, устанавливающиеся в нескольких точках эндокарда для одновременной стимуляции и регистрациию.
Таким образом, различные электрофизиологические параметры определяются как при спонтанном ритме, так и во время стимуляции.
С помощью программируемой стимуляции можно вызвать множество различных нарушений сердечного ритма, электрофизиологическая приророда которых определяется методом картирования.
Электрофизиологическое исследование сердца (ЭФИ) — это метод исследования больных с нарушениями сердечного ритма и проводимости. Во время ЭФИ проводится электростимуляция различных отделов сердца и регистрация электрограмм.
Расположение электродов и их количество зависит от тяжести аритмии и целей, которые стоят перед электрофизиологом. Многополюсные эндокардиальные электроды проводятся в полость сердца и устанавливаются в следующих отделах:
1. В область правого предсердия
2. В область правого желудочка
3. Область Гиса
4. Коронарный синус (регистрация левых отделов сердца)
1. инвазивное
инвазивное в свою очередь подразделяется на три основных вида:
— эндокардиальное (исследование которое применяется для диагностических целей в условиях стационара, без наркоза и желательно без премедикации)
— эпикардиальное (проводится во время операции на открытом сердце)
— комбинированное (применение двух методов при наличии показаний)
Инвазивное ЭФИ позволяет проводить ЭС любого отдела всех четырех камер сердца. Поскольку эндокард не имеет болевых рецепторов, то ЭС совершенно безболезненна для пациента.
2. неинвазивное (чреспищеводное)
имеет широкий спектр применения от амбулаторно-поликлинических, до стационарных подразделений. Метод для клиницистов в их клинической деятельности наиболее доступен и менее обременителен для больного.
Диагностические возможности ЧпЭФИ ограничиваются стимуляцией левого предсердия. В ряде случаев, может быть достигнута стимуляция левого желудочка, но для этого необходимо подавать напряжение с амплитудой 30-60 В (мА), что практически невозможно без применения наркоза.
Направление больных к проведению эндокардиальному ЭФИ сердца осуществляется из терапевтических и аритмологических отделений районных больниц. Определяется категория больных с неясной этиологией потерь сознания, пароксизмальными формами наджелудочковых и желудочковых тахикардий, рефрактерность тахиаритмий к антиаритмическим препаратам.
- Оценка функции синусового узла у симптоматичных пациентов с подозрением на дисфункцию синусового узла.
- Повторные обмороки — если не найдены причины при неврологической или неинвазивной кардиологической оценке
- Атриовентрикулярные блокады (AV-блокады) — бессимптомная блокада неизвестного уровня
- Блокады ножек пучка Гиса — обмороки неустановленной этиологии
- Тахикардии с широкими QRS комплексами — разграничение ЖТ и наджелудочковых тахикардий с абберантными QRS
- Устойчивые ЖТ
- Наджелудочковые тахикардии — (AV — узловые, скрытые дополнительные пути проведения, WPW — синдром и фибрилляция предсердий)
Применение ЭФИ при диагностике аритмий и нарушений проведения зависит не только от природы нарушений ритма, но и от его клинических последствий. Целый ряд тахиаритмий подразумевает немедленное обращение к кардиохирургу, так как их терапевтическое лечение бесперспективно и даже опасно.
Прежде чем приступить к инвазивным диагностическим исследованиям, необходимо провести тщательный анализ результатов неинвазивных электрофизиологических тестов, начиная от ЭКГ в 12 отведениях и кончая динамическим исследованиями, такими как амбулаторное холтеровское мониторирование или тесты с физической нагрузкой.
Анамнез и физикальное обследование
Выявление и дифференциальная диагностика кардиологической и неврологической патологии
Выяснение факторов, провоцирующих эпизоды аритмии
Детализация синкопальных состояний
Исключение патологической активности ЦНС
Выявление патологических очагов
Выявление значимой цереброваскулярной недостаточности
ЭКГ в 12 стандартных отведениях
Рубцовые изменения миокарда
Нарушения внутрижелудочковой проводимости
Синдромы предвозбуждения желудочков
Суточное мониторирование ЭКГ
Соответствие возникновения симптоматики и изменениями на ЭКГ
Количественная оценка эктопической
активности
Суточная динамика аритмий
Ортостатический наклонный тест
Диагностика вазовагальных/
вазодепрессорных обмороков
Определение размеров камер сердца
Оценка сократительной способности
Обнаружение локальных гипо- и акинезий
Выявление внутрисердечной патологии
Выявление преходящей ишемии
Оценка аритмогенной функции катехоламинов
КТ – компьютерная томография; МРТ – магниторезонансная томография; ЦНС – центральная нервная система; ЭхоКГ – эхокардиография; ЭЭГ – электроэцефалография.
Наджелудочковые тахикардии у молодых и практически здоровых людей иногда вызывает незначительную симптоматику либо не вызывает никаких симптомов. Та же аритмия у больного человека с пораженем коронарных артерий может обусловить возникновение стенокардии, инфаркта или застойной сердечной недостаточности.
Нарушения ритма могут вызвать проявления различных неврологических, сердечных, легочных и общих симптомов. Сниженные резервные возможности сердца при сердечно-сосудистых и легочных заболеваниях могут усугубить имеющиеся клинические проявления.
Для оценки антиаритмических препаратов преимущественно используют метод чреспищеводной электрокардиостимуляцию (ЧпЭС).
Электрофизиологическое серийное тестирование медикаментов позволяет точно подобрать медикаментозные средства, которые могут эффективно предупреждать пароксизмы аритмий, а также прогнозировать и контролировать продолжительность терапевтического успеха.
ЭФИ с целью определения антиаритмической эффективности медикаментов проводится при наличии положительных ответов на два следующих вопроса:
идентична ли спровоцированная тахикардия возникающей спонтанно?
позволяют ли наблюдаемые во время ЭФИ с внутривенным введением медикаментов изменения электрофизиологических параметров прогнозировать эффективность лечения?
В клинической практике выделяются абсолютные и относительные показания к проведению электрофизиологического тестирования медикаментов:
1) В анамнезе приступы нарушений сердечного ритма, подтвержденные результатами ЭФИ.
2) Отсутствие или утрата антиаритмической эффективности медикаментозного лечения, особенно при наличии в анамнезе потерь сознания или других признаков нарушения гемодинамики.
1) Во время ЭФИ не находят показаний к имплантации электрокардиостимулятора, дефибриллятора, или радикальному хирургическому лечению.
2) На фоне электростимуляционного лечения возникают пароксизмы тахикардии — необходимость сочетания с медикаментозным лечением.
3) Рецидивирование тахикардии после хирургического лечения.
4) Целью медикаментозного тестирования во время проведения ЭФИ является нахождение антиаритмического препарата, прекращающего тахикардию, идентичную возникающей спонтанно, или предупреждающего ее провоцирование.
После определения возможности провоцирования и купирования тахикардии проводят острую фармакологическую пробу. С этой целью, на фоне индуцированного пароксизма, не менее чем через 5 минут после его начала, больному внутривенно медленно, под мониторным контролем, вводится антиаритмический препарат и определяется его действие на аритмию путем проведения сравнительной оценки электрофизиологических параметров сердца до и после введения препарата. Доза препарата не должна превышать расчетную (слайд 18), но если восстановление синусового ритма происходит раньше, инфузия может быть прекращена.
Первоначально оценивается купирующий эффект препарата. Если по истечении времени, достаточного для его проявления, синусовый ритм не восстановился, вновь осуществляют вагусные приемы. При их неэффективности пароксизм купируют с помощью ЭС, что не исключает в дальнейшем оценки протекторного действия препарата.
После восстановления синусового ритма повторяют исследование, предшествовавшее медикаментозной пробе, для оценки протекторного действия препарата. Следует отметить, что, в некоторых случаях, один и тот же препарат способен купировать пароксизм и не предупредить его возникновения, и наоборот.
Рекомендуется в течение одного дня исследовать эффективность лишь одного, реже двух препаратов. Исследование эффективности нескольких медикаментов в течение одного исследования приемлемо лишь при возможности определения концентрации препарата в крови пациента — с тем чтобы предыдущий препарат не влиял на действие последующего.
Отмечаются три возможных варианта действия препарата:
1) тахикардия прекращается;
2) использование препарата предупреждает (ранее возможное) провоцирование аритмии;
3) устойчивая тахикардия переходит в неустойчивую;
4) увеличивается длительность кардиоцикла (уменьшается ЧСС) во время пароксизма.
5) затруднение провокации пароксизма (сужение «окна» тахикардии более чем в два раза, необходимость более агрессивных методов стимуляции, появление чувствительности тахикардии к вагусным приемам).
II. Отсутствие какого бы то ни было влияния на тахикардию.
III. Отрицательное действие (аритмогенный эффект):
1) пароксизмы тахикардии становятся более тяжелыми;
2) снижается агрессивность методов индукции тахикардии;
3) проявляются побочные эффекты (они возможны и при первых двух вариантах воздействия на тахикардию).
Наличие протекторного действия позволяет назначать препарат для перорального приема в дозах, позволяющих достичь концентрации в крови, сходной с таковой при внутривенном введении. Через несколько дней (после достижения необходимой концентрации препарата в сыворотке крови) необходимо повторить исследование.
Достоверными критериями эффективности подобранной антиаритмической терапии являются отсутствие пароксизмов или существенное снижение их частоты и продолжительности, облегчение условий их купирования.
В заключение можно сделать следующие обобщения:
1) ЭФИ позволяет подобрать антиаритмические препараты для прекращения и/или предупреждения пароксизмов тахикардии;
2) медикаментозное тестирование при ЭФИ значительно сокращает время поиска эффективного препарата, в то время как другие методики тестирования (без применения стимуляции) являются довольно продолжительными;
3) если все антиаритмические препараты неэффективны, возникают показания к проведению немедикаментозного лечения (электростимуляционного или радикального хирургического).
1 класс: блокаторы натриевых каналов
3 класс: блокаторы калиевых каналов
4 класс: блокаторы кальциевых каналов
Перед исследованием необходимо отменить все антиаритмические препараты не менее чем за 5 периодов полувыведения. На практике ЭФИ проводится не ранее чем через 2 суток (в случае приема кордарона — 30 суток) после отмены всех кардиотропных препаратов. ЭФИ должно проводиться, по возможности, без премедикации или с минимальной седатацией пациента.
ЭФИ проводится в специально оборудованной рентгеноперационной. Оснащение операционной должно включать в себя необходимое оборудование для возможного экстренного оказания всех видов реанимационных мероприятий.
Подготовка пациента осуществляется по общим правилам для проведения катетеризационных вмешательств на крупных сосудах.
Проведение общего наркоза для проведения ЭФИ не показано. Если нет необходимости, не применяются и другие седатирующие препараты, в связи с их вагусными или симпатическими влияниями на сердце. Отменяются все препараты, имеющие антиаритмическое влияние на сердце.
В большинстве случаев катетеры вводят в правое сердце, что требует доступа через венозную систему (бедренная, передне-кубитальная, подключичная и яремная вены). Пункция проводится под местной анестезией раствором новокаина или другим анестетиком.
Проведение и установка электродов осуществляется под рентгеноскопическим контролем. Места установки электродов определяются задачей проведения ЭФИ. Наиболее общепринятой схемой установки является следующая: двух – четырехполюсный электрод в правом предсердии, четырех – шестиполюсный электрод в коронарный синус, четырех – шестиполюсный электрод в области пучка Гиса, двухполюсный электрод — в области верхушки правого желудочка.
Для установки электродов в правое предсердие могут использоваться разные доступы — вены как верхних, так и нижних конечностей. Если катетер в правом предсердии необходим для регистрации потенциала правого предсердия или его стимуляции, то, как правило, электрод устанавливается в синоатриальной области. При подозрении, что аритмогенным является правое предсердие, в нем могут устанавливаться многополюсные электроды.
Электрод в коронарный синус наиболее удобно вводить через левую подключичную вену. Наиболее часто в коронарный синус вводят четырех-шестиполюсный электрод для регистрации потенциалов левого предсердия и левого желудочка.
Прямое введение электрода в левое предсердие редко бывает необходимо, если это не связано с картированием непосредственно левого предсердия или анатомических структур, доступ к которым возможен только через него. При наличии незаращенного овального окна доступ к левому предсердию упрощается, при отсутствии, появляется необходимость в пункции межпредсердной перегородки, что требует наличия необходимого инструментария и опыта.
Используется практически при каждом ЭФИ. Запись электрограммы пучка Гиса необходима для оценки антероградного и ретроградного АВ-проведения. Активность пучка Гиса отражает двух- или трехфазный потенциал, находящийся на электрограмме между предсердным и желудочковым комплексами.
Электроды в правом желудочке устанавливаются при исследовании ретроградного ВА-проведения, желудочковой тахикардии, при необходимости экстренной стимуляции. Наиболее часто используемой позицией является верхушка правого желудочка.
Проведение электродов в него обычно не требуется. Но, при необходимости картирования непосредственно левого желудочка или ретроградно левого АВ кольца, а также его стимуляции для индуцирования левожелудочковой тахикардии электрод, как правило, проводится ретроградно. При этом используются бедренные артерии.
После установки электроды соединяются с регистрационной системой. После поступления биоэлектрического сигнала на вход регистрирующей системы сигнал фильтруется и дифференцируется, что позволяет более точно увидеть разницу между двумя рядом расположенными спайками. Количество регистрируемых на экране электрограмм у современных электрофизиологических систем различно, но для более адекватной оценки получаемых результатов необходимо не менее 12 каналов регистрации.
Проведение ЭФИ осуществляется по базовому, стандартному протоколу:
- Анализ полученных электрограмм. Измерение базовых интервалов на синусовом ритме (PA, AH, HV). Оценить правильность распространения возбуждения.
- Стимуляция желудочков для оценки ретроградного проведения от желудочков к предсердиям.
- Стимуляция предсердий для оценки функции автоматизма синусового узла, проведения и рефрактерности в атрио-вентрикулярном узле
- Применение агрессивных методик стимуляции
- Проведение фармакологических проб (введение атропина, астмопента, аденозина) и повторение всей программы стимуляции.
После окончания проведения диагностического протокола, если необходимо переходят к картированию уязвимого участка тахикардии, применяя критерии картирования, характерные для каждого вида аритмии.
Несмотря на все увеличивающийся опыт проведения ЭФИ сохраняется вероятность появления осложнений. Количество пункций и катетеров увеличивает частоту возможных кровотечений. Грубые манипуляции и длительное эффективное воздействие в одной точке может привести к перфорации миокарда. Несмотря на применяемые антикоагулянты сохраняется риск развития тромбоэмболий. Частая, труднокупируемая тахикардия может приводить к нестабильности гемодинамики.
Анатомия проводящей системы сердца (смотреть)
Хирургическое лечение нарушений сердечного ритма РЧА — при WPW синдроме, AV — узловой, реципрокной тахикардии, трепетании и мерцании предсердий
Имплантация и реимплантация ЭКС — показания, виды электрокардио-
стимуляторов, технические параметры
источник
ОАО «Медицина» Г.Е. Ройтенберг А.В. Струтынский «Внутренние болезни — сердечно-сосудистая система» On-line версия справочника
ВНУТРЕННИЕ БОЛЕЗНИ (сердечно-сосудистая система) » Глава 3. Нарушения сердечного ритма и проводимости » 3.3. Методы диагностики нарушений сердечного ритма » 3.3.4. Внутрисердечное электрофизиологическое исследование (ЭФИ)
Инвазивное внутрисердечное электрофизиологическое исследование (ЭФИ) относится к числу наиболее информативных методов изучения электрофизиологических свойств различных отделов сердца и его проводящей системы. Оно используется для уточнения локализации АВ-блокады, характера пароксизмальных тахиаритмий, источника и механизмов эктопических нарушений ритма, диагностики аномальных проводящих путей и т.п.
Чаще всего это исследование проводится с целью определения четких показаний к выработке индивидуальной тактики хирургического лечения рецидивирующих и прогностически неблагоприятных нарушений ритма и проводимости, а также для выбора типа имплантируемых искусственных водителей ритма — электрокардиостимуляторов (ЭКС). Кроме того, ЭФИ используют для купирования тяжелых аритмий, рефрактерных к обычным методам лечения.
Техника исследования. Исследование проводят в специально оборудованных ангиографических лабораториях, рентгенооперационных, оснащенных кардиореанимационным оборудованием, поскольку риск, связанный с катетеризацией полостей сердца, а также выполнением протокола ЭФИ, достаточно высок.
Для проведения внутрисердечного ЭФИ пунктируют основную вену плеча, подключичную или бедренную вену. Чаще используют последний доступ. В правые отделы сердца под рентгеновским контролем вводят один или несколько электродов-катетеров. Их количество зависит от конкретной программы ЭФИ. Обычно один трехполюсный электрод-катетер устанавливают на уровне медиальной створки трехстворчатого клапана, что позволяет зарегистрировать три основных элемента электрограммы пучка Гиса (рис. 3.18):
электрическую активность нижнего отдела ПП (LRA);
потенциал пучка Гиса (Н-потенциал);
возбуждение желудочков (V-потенциалы).
Рис. 3.18. Один из вариантов расположения электродов-катетеров при проведении внутрисердечного ЭФИ. Не показан катетер, находяшийся в коронарном синусе.
HRA — регистрация электрической активности верхних отделов ПП; LRA — нижних отделов ПП; H — пучка Гиса; RV — ПЖ
Второй четырехполюсный электрод-катетер устанавливают в высоком боковом отделе ПП, близко от расположения СА-узла. Этот электрод используют для программируемой стимуляции ПП, а также для регистрации электрограммы верхних отделов ПП (НRА).
Третий четырехполюсный электрод помещают в полость ПЖ. Он используется для программируемой стимуляции ПЖ, а также для регистрации электрограммы ПЖ.
Наконец, четвертый электрод-катетер проводят через правую подключичную вену в ПП, а затем — в устье коронарного синуса. Регистрируют электрограмму коронарного синуса, отражающую электрическую активность ЛП (не показана на рисунке).
Описанное расположение электродов-катетеров может быть использовано для записи эндокардиальных электрограмм (ЭГ), в частности, для записи ЭГ пучка Гиса, различных отделов предсердий и правого желудочка (рис. 3.19).
Эти данные используют для оценки скорости проведения электрического импульса в различных отделах сердца как в период спонтанного синусового ритма, так и во время искусственной стимуляции ПП.
Рис. 3.19. Эндокардиальные электрограммы (ЭГ), зарегистрированные при внутрисердечном ЭФИ.
HRA — ЭГ из верхних отделов ПП; LRA — ЭГ из нижних отделов ПП; ЭГкс — ЭГ коронарного синуса (ЛП); HBE — ЭГ пучка Гиса; H — общий ствол пучка Гиса; RV (V) — ЭГ ПЖ
Электрограмма пучка Гиса (ЭПГ или НВЕ), зарегистрированная синхронно с поверхностной ЭКГ, позволяет оценить скорость проведения возбуждения по правому предсердию, АВ-соединению, общему стволу пучка Гиса, а также ножкам и ветвям пучка Гиса. ЭПГ используется, например, для точной топической диагностики АВ-блокад.
На рис 3. 20. представлена нормальная электрограмма пучка Гиса (HBE), которая состоит из трех групп осцилляций, каждая из которых соответствует активации определенного отдела проводящей системы (рис. 3.21): 1) группа осцилляций А, отражающих деполяризацию нижней части предсердий; 2) группа осцилляций H, обусловленных активацией общего ствола пучка Гиса и 3) группа осцилляций V, вызванных деполяризацией миокарда желудочков.
Рис. 3.20. Нормальная электрограмма пучка Гиса (НВЕ). Объяснения и обозначения в тексте
Рис. 3.21. Соответствие осцилляций электрограммы пучка Гиса проведению возбуждения по предсердиям, АВ-соединению, пучку Гиса, его ветвям и волокнам Пуркинье
Сопоставление электрограммы пучка Гиса с зубцом Р стандартной ЭКГ позволяет количественно оценить ряд временных интервалов.
1. Интервал Р – А (от начала зубца Р ЭКГ до начала группы осцилляций А на НВЕ) отражает время проведения электрического импульса по предсердиям.
2. Интервал А – Н (от начала осцилляций А до начала осцилляций Н) соответствует времени проведения по АВ-соединению.
3. Интервал Н (продолжительность осцилляций группы Н) отражает время проведения по общему стволу пучка Гиса.
4. Интервал Н – V (от начала осцилляций Н до первых отклонений желудочкового комплекса) соответствует проведению импульса по пучку Гиса, его ветвям и волокнам Пуркинье.
В табл. 3.4. представлены нормальные значения указанных интервалов.
Нормальные значения интервалов электрограммы пучка Гиса
Возбуждение участка проводящей системы
Общий ствол и ветви пучка Гиса, волокна Пуркинье
Увеличение продолжительности того или иного интервала ЭПГ позволяет диагностировать преимущественные нарушения проведения по АВ-соединению, общему стволу или ножкам пучка Гиса.
Проведение в ножках и ветвях пучка Гиса может быть оценено по ЭПГ при использовании техники нарастающей по частоте стимуляции предсердий. Ухудшение проводимости по ножкам пучка Гиса сопровождается удлинением интервала Н–V.
Примеры патологических ЭПГ приведены в разделе 3.4.
Определение “точки Венкебаха”
Для оценки функции проводимости в АВ-соединении часто применяют технику нарастающей электрической стимуляции предсердий, которая у каждого человека (здорового или больного) закономерно приводит к возникновению узловой АВ-блокады II степени (типа I по Мобитцу). Критическая частота предсердной стимуляции, вызывающая АВ-блокаду, получила название “точки Венкебаха”. Она также характеризует функцию проводимости по АВ-соединению. В норме у большинства здоровых людей “точка Венкебаха” соответствует 140–150 стимулам в мин, а при ухудшении проводимости по АВ-соединению снижается до 130 стимулов в мин и менее.
Оценка функции проводимости в предсердиях
Скорость проведения в ПП оценивают по интервалу между осцилляциями, полученными в верхнем и нижнем отделах ПП (НRА–LRА), а также по времени между моментом нанесения искусственного экстрастимула (St) и началом предсердного ответа. При использовании электрода-катетера, расположенного в коронарном синусе, можно оценить время межпредсердного проведения (рис. 3.22).
Рис. 3.22. Схема оценки функции проводимости по предсердиям.
Обозначения те же, что и на рис. 3.19. 1 — время проведения по ПП; 2 — время межпредсердного проведения
Выявление ретроградного проведения по АВ-соединению
Возможность ретроградного проведения по АВ-соединению может быть оценена при регистрации ЭПГ. При электростимуляции ПЖ (через электрод-катетер, помещенный в ПЖ) на ЭПГ и ЭГ предсердия после появления желудочковых осцилляций (V), вызванных экстрастимулом, можно зарегистрировать осцилляции, отражающие возбуждение пучка Гиса (Н) и предсердий (А). Это свидетельствует о ретроградном (от желудочка к предсердиям) проведении электрического импульса в АВ-соединении.
Программированная электрическая стимуляция сердца
Программированная электрическая стимуляция сердца является важнейшим этапом проведения внутрисердечного ЭФИ, особенно у больных с рецидивирующими пароксизмальными тахиаритмиями или у пациентов с брадиаритмиями. В большинстве случаев она позволяет составить представление о характере и механизмах пароксизмов и локализации источника эктопических ритмов, решить вопрос о показаниях и способе хирургического лечения аритмии и, при необходимости, купировать возникшее нарушение ритма или проводимости.
Нанося по специальной программе серию экстрастимулов, приходящихся на различные участки сердечного цикла, а также меняя частоту навязанного ритма и место стимуляции, определяют продолжительность рефрактерных периодов отдельных участков проводящей системы сердца как в антероградном, так и в ретроградном направлении. У больных с пароксизмальными тахиаритмиями добиваются воспроизведения приступа аритмии, что позволяет по способу индукции и купирования аритмии составить наиболее полное суждение об основных механизмах ее возникновения и, соответственно, об оптимальных способах лечения аритмии, в том числе хирургических.
Эндокардиальное и эпикардиальное (интраоперационное) картирование также является одним из этапов внутрисердечного ЭФИ. Оно проводится с целью определения локализации областей, требующих хирургической деструкции, и чаще всего используется у больных с синдромом WPW для определения точного местоположения дополнительных (аномальных) путей АВ-проведения.
Эндокардиальное картирование проводят с помощью электродов-катетеров, устанавливаемых в нескольких точках по окружности правого и левого АВ-колец. При интраоперационном картировании чаще используется техника эпикардиального картирования. При нанесении экстрастимулов в области предсердий определяют место самой ранней желудочковой активации, которая соответствует локализации дополнительного (аномального) пути.

Внутрисердечное ЭФИ обладает следующими диагностическими возможностями. 1. Регистрация электрограммы пучка Гиса (ЭПГ) с целью точной топической диагностики нарушений АВ-проводимости (АВ-соединение, общий ствол или ножки пучка Гиса). 2. Определение скорости антероградного и ретроградного проведения в различных отделах сердца и его проводящей системы. 3. Определение продолжительности рефрактерных периодов СА-узла, предсердий, АВ-соединения и желудочков. 4. Оценка функции СА-узла. 5. Воспроизведение и купирование приступа тахиаритмии с целью определения ее характера, электрофизиологических механизмов и тактики лечения, в том числе хирургического. 6. Индивидуальное тестирование антиаритмических препаратов. 7. Эндокардиальное и эпикардиальное (интраоперационное) картирование с целью точного описания траектории движения (циркуляции) волны возбуждения по предсердиям, желудочкам или по дополнительным (аномальным) путям АВ-проведения. 8. Определение показаний к хирургическому лечению аритмий, а также временной или постоянной ЭКС.
Следует также иметь в виду, что техника ЭФИ может быть использована для купирования тяжелых тахиаритмий, не поддающихся консервативным методам лечения.
Таким образом, с помощью внутрисердечного ЭФИ можно получить наиболее полную информацию о характере и электрофизиологических механизмах разнообразных нарушений ритма и проводимости. В то же время инвазивный характер этой методики, выполнение которой требует применения дорогостоящей аппаратуры и небезопасно для больного, существенно ограничивает использование внутрисердечного ЭФИ в клинической практике. К этому методу обращаются, как правило, в тех случаях, когда речь идет о необходимости хирургического лечения аритмий.
источник
| ОАО «Медицина» Г.Е. Ройтенберг А.В. Струтынский «Внутренние болезни — сердечно-сосудистая система» On-line версия справочника | ||||||||||||||||||||||||||
| ВНУТРЕННИЕ БОЛЕЗНИ (сердечно-сосудистая система) » Глава 3. Нарушения сердечного ритма и проводимости » 3.3. Методы диагностики нарушений сердечного ритма » 3.3.4. Внутрисердечное электрофизиологическое исследование (ЭФИ) | ||||||||||||||||||||||||||
Инвазивное внутрисердечное электрофизиологическое исследование (ЭФИ) относится к числу наиболее информативных методов изучения электрофизиологических свойств различных отделов сердца и его проводящей системы. Оно используется для уточнения локализации АВ-блокады, характера пароксизмальных тахиаритмий, источника и механизмов эктопических нарушений ритма, диагностики аномальных проводящих путей и т.п. Чаще всего это исследование проводится с целью определения четких показаний к выработке индивидуальной тактики хирургического лечения рецидивирующих и прогностически неблагоприятных нарушений ритма и проводимости, а также для выбора типа имплантируемых искусственных водителей ритма — электрокардиостимуляторов (ЭКС). Кроме того, ЭФИ используют для купирования тяжелых аритмий, рефрактерных к обычным методам лечения. Техника исследования. Исследование проводят в специально оборудованных ангиографических лабораториях, рентгенооперационных, оснащенных кардиореанимационным оборудованием, поскольку риск, связанный с катетеризацией полостей сердца, а также выполнением протокола ЭФИ, достаточно высок. Для проведения внутрисердечного ЭФИ пунктируют основную вену плеча, подключичную или бедренную вену. Чаще используют последний доступ. В правые отделы сердца под рентгеновским контролем вводят один или несколько электродов-катетеров. Их количество зависит от конкретной программы ЭФИ. Обычно один трехполюсный электрод-катетер устанавливают на уровне медиальной створки трехстворчатого клапана, что позволяет зарегистрировать три основных элемента электрограммы пучка Гиса (рис. 3.18):
Второй четырехполюсный электрод-катетер устанавливают в высоком боковом отделе ПП, близко от расположения СА-узла. Этот электрод используют для программируемой стимуляции ПП, а также для регистрации электрограммы верхних отделов ПП (НRА). Третий четырехполюсный электрод помещают в полость ПЖ. Он используется для программируемой стимуляции ПЖ, а также для регистрации электрограммы ПЖ. Наконец, четвертый электрод-катетер проводят через правую подключичную вену в ПП, а затем — в устье коронарного синуса. Регистрируют электрограмму коронарного синуса, отражающую электрическую активность ЛП (не показана на рисунке). Описанное расположение электродов-катетеров может быть использовано для записи эндокардиальных электрограмм (ЭГ), в частности, для записи ЭГ пучка Гиса, различных отделов предсердий и правого желудочка (рис. 3.19). Эти данные используют для оценки скорости проведения электрического импульса в различных отделах сердца как в период спонтанного синусового ритма, так и во время искусственной стимуляции ПП.
Электрограмма пучка Гиса Электрограмма пучка Гиса (ЭПГ или НВЕ), зарегистрированная синхронно с поверхностной ЭКГ, позволяет оценить скорость проведения возбуждения по правому предсердию, АВ-соединению, общему стволу пучка Гиса, а также ножкам и ветвям пучка Гиса. ЭПГ используется, например, для точной топической диагностики АВ-блокад. На рис 3. 20. представлена нормальная электрограмма пучка Гиса (HBE), которая состоит из трех групп осцилляций, каждая из которых соответствует активации определенного отдела проводящей системы (рис. 3.21): 1) группа осцилляций А, отражающих деполяризацию нижней части предсердий; 2) группа осцилляций H, обусловленных активацией общего ствола пучка Гиса и 3) группа осцилляций V, вызванных деполяризацией миокарда желудочков.
Сопоставление электрограммы пучка Гиса с зубцом Р стандартной ЭКГ позволяет количественно оценить ряд временных интервалов. 1. Интервал Р – А (от начала зубца Р ЭКГ до начала группы осцилляций А на НВЕ) отражает время проведения электрического импульса по предсердиям. 2. Интервал А – Н (от начала осцилляций А до начала осцилляций Н) соответствует времени проведения по АВ-соединению. 3. Интервал Н (продолжительность осцилляций группы Н) отражает время проведения по общему стволу пучка Гиса. 4. Интервал Н – V (от начала осцилляций Н до первых отклонений желудочкового комплекса) соответствует проведению импульса по пучку Гиса, его ветвям и волокнам Пуркинье. В табл. 3.4. представлены нормальные значения указанных интервалов. Нормальные значения интервалов электрограммы пучка Гиса
Увеличение продолжительности того или иного интервала ЭПГ позволяет диагностировать преимущественные нарушения проведения по АВ-соединению, общему стволу или ножкам пучка Гиса. Проведение в ножках и ветвях пучка Гиса может быть оценено по ЭПГ при использовании техники нарастающей по частоте стимуляции предсердий. Ухудшение проводимости по ножкам пучка Гиса сопровождается удлинением интервала Н–V. Примеры патологических ЭПГ приведены в разделе 3.4. Определение “точки Венкебаха” Для оценки функции проводимости в АВ-соединении часто применяют технику нарастающей электрической стимуляции предсердий, которая у каждого человека (здорового или больного) закономерно приводит к возникновению узловой АВ-блокады II степени (типа I по Мобитцу). Критическая частота предсердной стимуляции, вызывающая АВ-блокаду, получила название “точки Венкебаха”. Она также характеризует функцию проводимости по АВ-соединению. В норме у большинства здоровых людей “точка Венкебаха” соответствует 140–150 стимулам в мин, а при ухудшении проводимости по АВ-соединению снижается до 130 стимулов в мин и менее. Оценка функции проводимости в предсердиях Скорость проведения в ПП оценивают по интервалу между осцилляциями, полученными в верхнем и нижнем отделах ПП (НRА–LRА), а также по времени между моментом нанесения искусственного экстрастимула (St) и началом предсердного ответа. При использовании электрода-катетера, расположенного в коронарном синусе, можно оценить время межпредсердного проведения (рис. 3.22).
Выявление ретроградного проведения по АВ-соединению Возможность ретроградного проведения по АВ-соединениюможет быть оценена при регистрации ЭПГ. При электростимуляции ПЖ (через электрод-катетер, помещенный в ПЖ) на ЭПГ и ЭГ предсердия после появления желудочковых осцилляций (V), вызванных экстрастимулом, можно зарегистрировать осцилляции, отражающие возбуждение пучка Гиса (Н) и предсердий (А). Это свидетельствует о ретроградном (от желудочка к предсердиям) проведении электрического импульса в АВ-соединении. Программированная электрическая стимуляция сердца Программированная электрическая стимуляция сердца является важнейшим этапом проведения внутрисердечного ЭФИ, особенно у больных с рецидивирующими пароксизмальными тахиаритмиями или у пациентов с брадиаритмиями. В большинстве случаев она позволяет составить представление о характере и механизмах пароксизмов и локализации источника эктопических ритмов, решить вопрос о показаниях и способе хирургического лечения аритмии и, при необходимости, купировать возникшее нарушение ритма или проводимости. Нанося по специальной программе серию экстрастимулов, приходящихся на различные участки сердечного цикла, а также меняя частоту навязанного ритма и место стимуляции, определяют продолжительность рефрактерных периодов отдельных участков проводящей системы сердца как в антероградном, так и в ретроградном направлении. У больных с пароксизмальными тахиаритмиями добиваются воспроизведения приступа аритмии, что позволяет по способу индукции и купирования аритмии составить наиболее полное суждение об основных механизмах ее возникновения и, соответственно, об оптимальных способах лечения аритмии, в том числе хирургических. Эндокардиальное и эпикардиальное картирование Эндокардиальное и эпикардиальное (интраоперационное) картирование также является одним из этапов внутрисердечного ЭФИ. Оно проводится с целью определения локализации областей, требующих хирургической деструкции, и чаще всего используется у больных с синдромом WPW для определения точного местоположения дополнительных (аномальных) путей АВ-проведения. Эндокардиальное картирование проводят с помощью электродов-катетеров, устанавливаемых в нескольких точках по окружности правого и левого АВ-колец. При интраоперационном картировании чаще используется техника эпикардиального картирования. При нанесении экстрастимулов в области предсердий определяют место самой ранней желудочковой активации, которая соответствует локализации дополнительного (аномального) пути.
Следует также иметь в виду, что техника ЭФИ может быть использована для купирования тяжелых тахиаритмий, не поддающихся консервативным методам лечения. Таким образом, с помощью внутрисердечного ЭФИ можно получить наиболее полную информацию о характере и электрофизиологических механизмах разнообразных нарушений ритма и проводимости. В то же время инвазивный характер этой методики, выполнение которой требует применения дорогостоящей аппаратуры и небезопасно для больного, существенно ограничивает использование внутрисердечного ЭФИ в клинической практике. К этому методу обращаются, как правило, в тех случаях, когда речь идет о необходимости хирургического лечения аритмий. Не нашли то, что искали? Воспользуйтесь поиском: источник Катетерная радиочастотная аблация (РЧА) является методом выбора в лечении суправентрикулярных аритмий и некоторых форм ЖТ. АВУРТ характеризуется очень коротким временем ретроградного (желудочково-предсердного) проведения. Аблация медленного проводящего пути АВ-узла осуществляется при помощи радиочастотного воздействия на область, непосредственно прилежащую ко входу в коронарный синус. Локализация дополнительных проводящих путей (ДПП), являющихся причиной синдрома WPW, определяется путем поиска места наиболее ранней активации желудочков во время синусового ритма или места наиболее ранней активации предсердий во время реципрокной тахикардии. Методики изоляции легочных вен эффективны в предотвращении пароксизмальной ФП. Для лечения ТП производится аблация перешейка (истмуса) цепи повторного входа в ПП. Перешеек располагается между трехстворчатым клапаном и нижней полой веной. При предсердных аритмиях, не поддающихся контролю, эффективна аблация АВ-узла, которая требует имплантации ЭКС. Фасцикулярную ЖТ и тахикардию из области выносяшего тракта ПЖ также можно излечить с помощью аблации. Катетерная РЧА изменила подходы к лечению многих видов нарушений ритма сердца, особенно суправентрикулярных. Для ряда часто встречающихся нарушений ритма сердца это не просто еще один способ лечения, а метод выбора, позволяющий добиться полного излечения и избавить пациента от необходимости приема лекарственных средств. Более чем 90% вероятность успеха достигается ценой очень низкого риска. Цель данной главы — кратко проиллюстрировать основные области применения катетерной аблации и обеспечить понимание того, как проводится поиск зон, подлежащих аблации. Обычно процедура выполняется под местной анестезией с внутривенной седацией. Последовательность активации сердца на фоне нормального и патологических ритмов изучается путем записи электрограмм из различных внутрисердечных зон с помощью многополюсных катетеров-электродов, вводимых путем чрескожной пункции бедренной вены и, при необходимости, бедренной артерии. Электроды позволяют также проводить электростимуляцию сердца для инициирования и купирования тахикардии. Картирование последовательности активации сердца на фоне нормального или навязанного ритмов, а также во время тахикардии позволяет локализовать цепь ре-энтри или фокус, являющиеся источником аритмии. Радиочастотная энергия, представляющая собой высокочастотный переменный ток, прикладывается с помощью специального катетера-электрода. Он имеет отклоняющееся окончание, позволяющее точно подвести кончик катетера к необходимой точке. Радиочастотное воздействие длится 30-120 с. При этом эндокард, контактирующий с кончиком катетера, и расположенный под ним миокард нагреваются до 50-70°С и, таким образом, подвергаются коагуляции. Окружающий миокард не повреждается. Если радиочастотную энергию подавать через катетер, орошаемый физиологическим раствором, зона повреждения может быть более обширной и глубокой. Это обусловлено предотвращением образования сгустков крови на кончике катетера и бывает полезным в сложных случаях, а также когда вмешательство производится по поводу ТП. В качестве альтернативного источника повреждающей энергии исследуется возможность применения криотермии. На рисунке ниже приведены типичные данные, полученные во время нормального синусового ритма. Записи делаются при скорости движения бумаги, составляющей как минимум 100 мм/с. На рисунке под шестью кривыми наружной ЭКГ можно видеть синхронную запись, полученную из трех внутрисердечных зон: из верхнего отдела ПП, вблизи трехстворчатого клапана и из коронарного синуса. Электрограмма из верхнего отдела правого предсердия. Электрод, расположенный в верхнем отделе ПП, находится вблизи синусового узла. В каждом сердечном цикле по этому каналу регистрируется самая ранняя электрическая активность предсердий. Она совпадает по времени с началом зубца Р на наружной ЭКГ. Электрограмма пучка Гиса регистрируется с помощью электрода, расположенного поперек трехстворчатого клапана. Можно видеть 3 волны: Обычно, как показано на рисунке выше, электрограммы регистрируются с помощью двух пар электродов многополюсного катетера, установленного поперек трехстворчатого клапана. При этом можно зафиксировать активность как проксимального, так и дистального отдела пучка Гиса. На рисунке ниже представлена электрограмма с резко удлиненным интервалом HV у пациента с бифасцикулярной блокадой. Коронарный синус залегает в борозде между ЛП и ЛЖ. Из этой позиции можно зарегистрировать электрограммы, отражающие активность как ЛП, так и ЛЖ. На рисунке выше на электрограмме коронарного синуса можно видеть высокоамплитудный сигнал ЛП, после которого следует волна меньшей амплитуды, возникающая вследствие активации ЛЖ. На рисунке выше представлен простой пример того, как может быть выполнено «картирование» пути распространения волны возбуждения. Во время нормального синусового ритма можно проследить, как импульс, зародившийся в верхнем отделе ПП (т.е. вблизи синусового узла), достигает нижней части ПП (вблизи АВ-узла), а затем — ЛП, что зарегистрировано с помощью электрода в коронарном синусе. После деполяризации предсердий активируется пучок Гиса, а затем миокард желудочков. — Вернуться в оглавление раздела «Кардиология.» источник ЭФИ и показания к его проведению Более 30 лет тому назад впервые с помощью электродного катетера зарегистрирована электрическая активность пучка Гиса. Это открытие стало новым шагом в развитии существующих представлений о механизмах нарушений ритма сердца и проводимости. Сначала эта методика получила название «исследование пучка Гиса», но уже в 1970 г. (Sheslag et al.) был внедрен термин «электрофизиологическое исследование» (ЭФИ). С того времени ЭФИ активно развивается и широко применяется в клинической практике. Применение ЭФИ дает возможность не только по-новому рассмотреть и понять механизмы нарушений ритма и проводимости сердца, но и подобрать оптимальную тактику лечения пациентов. Сформировались принципиально новые представления о механизмах действия антиаритмических средств. Благодаря активному внедрению ЭФИ в клинику получили интенсивное развитие кардиохирургические методы лечения аритмий, появился новый терапевтический метод — катетерная радиочастотная деструкция. Задача внутрисердечного ЭФИ 1. Определение функциональных характеристик проводящей системы сердца. 2. Изучение механизмов аритмии, факторов ее индукции и прекращения, выявление анатомических субстратов аритмии на основе анатомоэлектрофизиологических характеристик. 3. Точная топическая диагностика субстрата аритмии перед радикальным хирургическим вмешательством или катетерной абляцией. 4. Выявление аритмической патологии у больных с синкопальными состояниями, выявление больных с риском внезапной смерти. 5. Осуществление подбора медикаментозной терапии (медикаментозное тестирование). 6. Подбор режимов антитахикардитической электрокардиостимуляции, режимов кардиоверсии и дефибрилляции при имплантации кардиовертеров-дефибрилляторов. 7. Проведение катетерной деструкции субстратов аритмии. Требования к электрофизиологическим лабораториям Инвазивные ЭФИ должны выполняться в центрах, которые имеют кардиологическую, анестезиологическую и кардиохирургическую службы, при наличии оборудованного кабинета ЭФИ, персонала, подготовленного по клинической электрофизиологии сердца. Неинвазивное ЭФИ могут выполнять на базе кабинетов функциональной диагностики кардиологических отделений при обеспечении их эффективными быстродействующими препаратами, дефибрилляторами и возможностями быстрой транспортировки больного в реанимационное отделение. Требования к персоналу лаборатории ЭФИ В проведении ЭФИ принимают участие такие специалисты: 2 врача-электрофизиолога, анестезиолог, инженер-электронщик и медицинская сестра. Персонал лаборатории работает в условиях рентгеновского облучения. Кардиохирурги привлекаются для предоставления хирургической помощи при возникновении угрожающих для жизни осложнений. Оборудование лаборатории ЭФИ 1. Рентгенотелевизионная система передвижного или стационарного типа. 2. Универсальный электрокардиостимулятор. 3. Многоканальное регистрирующее устройство для синхронной регистрации ЭКГ и внутрисердеч-ных электрограмм. 4. Эндокардиальные электроды. 5. Оборудование для проведения реанимации. Под местной анестезией пунктируют и катетеризируют большую вену (обычно бедренную или подключичную) и под рентгенологическим контролем устанавливают эндокардиальные электроды в разных отделах сердца. Стандартными позициями электродов являются верхние отделы правого предсердия (HRA, high right atrium), венечный синус сердца (СS, coronary sinus), AV-со единение с пучком Гиса (НВ, His band), верхушечным отделом ПЖ (RV, right ventricular). Для размещения электрода в венечном синусе его вводят в левую подключичную или яремную вену. После проведения электродов в типичные позиции регистрируют полостные эндокардиальные электрограммы, обычно в биполярном режиме с синхронной записью стандартных и грудных отведений на разной скорости протяжения ленты (50 и 100 мм/с -1 ). После анализа базовых интервалов гисограммы на синусовом ритме приступают к выполнению стимуля-ции различных камер сердца. Обычно применяют биполярную стимуляцию с дистальным полюсом электрода как катода. В большинстве употребляемых в данное время протоколов стимуляций используется сила тока, которая в 2 раза превышает порог стимуляции (1–4 мА). Продолжительность стимулирующего импульса обычно 1–2 мс. На электрограмме определяют такие интервалы (рис. 5.1). Рис. 5.1. Проводящая система сердца РА — время проведения по правому предсердию — от начала Р до предсердного потенциала А на электрограмме пучка Гиса (в норме 20–50 мс);АН — время проведения по AV-узлу — интервал между началом активации предсердий (А) и началом активации пучка Гиса (Н) на электрограмме пучка Гиса (в норме — 50–140 мс);Н — время проведения по пучку Гиса — ширина потенциала пучка Гиса (Н) на электрограмме пучка Гиса (в норме не более 25 мс); НV — время проведения по системе Гиса — Пуркинье — интервал от начала потенциала Н на электрограмме пучка Гиса до начала комплекса QRS на поверхностной ЭКГ (в норме — 30–55 мс) При проведении ЭФИ рекомендуют такую последовательность выполнения протокола исследования: 1. Анализируют состояние проводящей системы сердца на начальном ритме по анализу базовых показателей электрограммы. 2. Оценивают функцию синусного узла. 3. Возрастающая по частоте стимуляция предсердия для оценки антероградного проведения и точки Венкебаха. 4. Программированная стимуляция правого предсердия одним и двойным экстрастимулом на спонтанном и заданном ритме (2–3 базовых цикла). 5. Стимуляция ПЖ вначале на верхушке, затем при необходимости на выходном тракте в 2–3 базовых циклах одним или двумя экстрастимулами. 6. Далее можно выполнять медикаментозные пробы, направленные на выявление преходящих нарушений функции синусного узла и AV-проведения или провокацию пароксизмальных тахиаритмий. Последовательность выполнения программы исследования может отличаться в зависимости от цели исследования, патологии и конкретной ситуации, возникающей в процессе проведения ЭФИ. Для получения максимально возможной информации следует придерживаться некоторых принципиальных моментов. ЭФИ в изучении функции синусного узла ЭКГ-проявления дисфункции синусного узла включают синусовую брадикардию в покое, неадекватный хронотропный ответ на нагрузку или стресс, синоатриальную блокаду выхода или остановку синусного узла. Общие проявления включают потерю сознания, предобморочное состояние, кратковременное головокружение или выраженную слабость. Аритмии обычно обусловлены одним или несколькими перечисленными факторами: поражение собственно синусного узла (например идиопатическая дегенераия, фиброз, ишемия или хирургическая травма), нарушение функции автономной нервной системы, а также действием препаратов. Клинически выявление возможной дисфункции синусного узла часто затруднено, поскольку симптомы аномалии могут быть кратко временными и доброкачественными, а у пациентов, не имеющих симптомов, возможно значительное изменение синусового ритма. Были предложены различные инвазивные тесты для оценки функции синусного узла. Время восстановления функции синусного узла (ВВФСУ) используется для оценки влияния сверхчастой стимуляции на автоматизм синусного узла. Часто вносится поправка на продолжительность синусового цикла (СЦ), что определяется как корректированное время восстановления функции синусного узла (КВВФСУ = ВВФСУ – СЦ). В норме ВВФСУ не превышает 1500–2000 мс, а КВВФСУ — 600 мс. Чувствительность обоих показателей до 60%, специфичность — 88%. Таким образом нормальные их значения не всегда дают возможность исключить наличие дисфункции синусного узла. Рекомендации по проведению ЭФИ для оценки функции синусного узла даны в табл. 5.1. Синоатриальное проведение может быть измерено непосредственно или с помощью нанесения предсердного экстрастимула на фоне синусового ритма или при стимуляции предсердия. Синопредсердная пароксизмальная тахикардия 1. Во время тахикардии потенциал верхней части правого предсердия предшествует потенциалу нижней его части и существенным образом не отличается от такового на фоне синусового ритма. 2. Тахикардия провоцируется электростимулом, нанесенным в период сердечного цикла, который предшествует блокаде его проведения в синусный узел. Интервал сцепления такого электростимула несколько короче интервала, при котором электростимул замещает синусовый импульс. 3. Единичный электростимул, нанесенный на предсердие с несколько меньшим интервалом сцепления, чем тот, при котором возник пароксизм, способен прекратить приступ тахикардии. 4. Частая стимуляция также провоцирует и угнетает эктопический ритм. 5. Дополнительными критериями диагностики является развитие блокады II степени антероградного проведения импульса в AV-узле во время тахикардии, которая не сопровождается прекращением приступа, а также ретроградная блокада проведения импульса при искусственной стимуляции желудочков. Предсердная пароксизмальная тахикардия 1. Потенциал предсердия предшествует потенциалу пучка Гиса. 2. Последовательность распространения возбуждения по предсердию в некоторых случаях нарушена. Если эктопический водитель ритма размещен в нижней части предсердия, потенциал его предшествует потенциалу верхней части правого предсердия; если водитель ритма находится в левом предсердии, то оно возбуждается прежде правого предсердия. 3. В некоторых случаях зарегистрированные предсердные потенциалы имеют разную конфигурацию (несколько очагов эктопического ритма). 4. Единичными электростимулами невозможно прекратить пароксизм. Частая стимуляция может лишь временно подавить эктопический ритм. В тех случаях, когда прогнозируют реципрокный механизм тахикардии, важнейшим диагностическим признаком считают ухудшение внутрипредсердной проводимости в момент провокации пароксизма. 5. Дополнительным признаком является антероградная или ретроградная блокада про-ведения импульса по AV-узлу, поскольку наличие этих нарушений исключает узловую пароксизмальную тахикардию. AV-узловая пароксизмальная тахикардия 1. Предсердные электростимулы с интервалом сцепления, который постоянно становится короче, вызывают пароксизм тахикардии, возникновению которого предшествует внезапное или постепенное удлинение интервала P—R. 2. Потенциал пучка Гиса предшествует во время тахикардии потенциалу желудочка. 3. Потенциал нижней части предсердия предшествует потенциалу его верхней части и по времени возникновения совпадает с потенциалом желудочка. 4. Стимуляция желудочка с возрастающей частотой или с помощью единичных импульсов с интервалом сцепления, который постоянно укорачивается, сопровождается постепенным замедлением ретроградного распространения возбуждения по предсердию. Это указывает на то, что импульс проводится AV-узлом, а не по дополнительному предсердно-желудочковому соединению. 5. Прекращение пароксизма происходит лишь в результате блокирования импульса в AV-узле. Фибрилляция, трепетание предсердий Диагноз пароксизмальной мерцательной аритмии обычно не вызывает затруднений, поэтому ЭФИ проводить не обязательно. Лишь при необходимости дифференциации между желудочковой экстрасистолией и аберрантными комплексами следует провести регистрацию электрограммы пучка Гиса. Регистрация потенциала пучка Гиса на гисограмме и нормальной продолжительности интервала Н–V дает возможность утверждать, что желудочковые комплексы являются аберрантными. И, наоборот, отсутствие потенциала Н или значительное укорочение интервала Н–V является характерным для желудочковых экстрасистол. При трепетании предсердий очень четко выделяются волны f, связанные или частично диссоциированные с желудочковыми комплексами. ЭФИ у пациентов с приобретенной AV-блокадой/хроническим нарушением AV-проведения Возможность регистрации потенциала пучка Гиса во время ЭФИ дает возможность описать 3 анатомических участка AV-блокады: а) Проксимальный (над пучком Гиса) — задержка проведения или блокада в AV-узле. б) Интрагисовый — задержка проведения или блокада в пределах пучка Гиса. в) Дистальный — размещен дистальнее пучка Гиса и располагается на уровне ножек пучка Гиса. Такая диагностика является крайне важной, поскольку прогноз больных с AV-блокадой зависит от уровня блокады: чем ниже уровень блокады, тем хуже прогноз. При прогрессирующем повышении частоты стимуляции правого предсердия отмечают по-степенное удлинение интервала А–Н до развития AV-блокады II степени на уровне AV-узла — «точка Венкебаха». В норме этот показатель превышает 110—130 импульсов в минуту. Есть определенные корреляции между картиной ЭКГ и уровнем блокады. При AV-блокаде II степени I типа с узкими комплексами QRS блокада обычно возникает на уровне AV-узла, реже может локализоваться в пучке Гиса. При AV-бло каде II степени тип I с широкими комплексами QRS (блокада ветви пучка Гиса) блокада проведения может возникать на уровне AV-узла, внутри или ниже пучка Гиса. AV-блокада II степени II типа обычно возникает на уровне пучка Гиса или ниже и чаще объеди-няется с блокадой ножки пучка Гиса. Изредка AV-блокада II типа возникает в AV-узле. При полной AV-блокаде с выскальзывающим ритмом и узкими комплексами QRS место блокады может локализоваться в AV-узле или пучке Гиса. При полной AV-блокаде с выскальзывающим ритмом с широкими комплексами QRS место блокады может располагаться в AV-узле, внутри или ниже пучка Гиса. Обычно она расположена ниже пучка Гиса. Прогноз пациентов с AV-блокадой зависит от уровня ее возникновения. Хроническая AV-блокада I степени, особенно блокада на уровне AV-узла, обычно имеет доброкачественное течение. Данная аномалия часто связана с приемом лекарственных препаратов и имеет обратимый характер. Клиническое течение узловой AV-блокады II степени обычно доброкачественное, прогноз зависит от наличия и состояния основного заболевания сердца. Прогноз пациентов с AV-блокадой II степени на уровне пучка Гиса неоднозначный. У таких пациентов часто возникают потери сознания и проявления СН. При отсутствии лечения AV-блокада II степени на уровне ниже пучка Гиса имеет плохой прогноз, блокада у таких пациентов часто прогрессирует до более высоких степеней, появляется симптоматика с потерей сознания. У пациентов с приобретенной полной AV-блокадой без лечения часто отмечают симптоматику независимо от уровня блокады (табл. 5.2). Согласно электрокардиографической классификации внутрижелудочковая проводящая система состоит из 3 пучков: переднего и заднего пучков левой ножки пучка Гиса и правой ножки пучка Гиса. Анатомическая основа деления проводящей системы у человека на 3 пучка не совсем понятна. Пациенты с двухпучковой блокадой имеют повышенный риск развития полной трехпучковой блокады. Внезапная смерть пациентов с двухпучковой блокадой может быть вызвана не только развитием полной трехпучковой блокады, но также и развитием желудочковых тахиаритмий. Последние могут играть важную роль у пациентов с прогресирующим заболеванием сердца и двухпучковой блокадой. По этой причине ЭФИ пациентов с дефектами внутрижелудочкового проведения и необъяснимыми симптомами должно также включать исследование AV-проводящей системы и оценку функции синусного узла, а также программированную предсердную и желудочковую стимуляцию с целью провокации тахиаритмии для выявления склонности к развитию как брадиаритмий, так и тахиаритмий (табл. 5.3). ЭФИ в диагностике пациентов с тахикардией и широкими комплексами QRS При широких комплексах QRS (>120 мс) важно дифференцировать наджелудочковую тахикардию от желудочковой тахикардии. Для отличия наджелудочковых тахикардий от желудочковых стойкие симптомы тахикардии непоказательны. Если диагноз наджелудочковой тахикардии невозможно подтвердить или установить, то тахиаритмию следует расценивать как желудочковую тахикардию и лечить соответственно. Тахикардия с широкими комплексами QRS может быть разделена на 3 группы: наджелудоч-ковая тахикардия с блокадой ножек пучка Гиса, наджелудочковая тахикардия с проведением по дополнительному предсердно-желудочковому соединению и желудочковая тахикардия. ЭФИ позволяет точно диагностировать практически все тахикардии с широкими комплексами, а также определить последовательность и соотношение между активацией предсердий и желудочков. При этом можно зарегистрировать электрограммы от структур, которые не отображаются на стандартной ЭКГ (таких как пучок Гиса или дополнительные пути проведения), а также могут быть проанализированы ответы на разные пробы со стимуляцией. Поскольку знание механизма аритмии обычно имеет критическое значение для выбора надлежащей терапии, ЭФИ часто занимают важное место в клинической диагностике у пациентов, имеющих тахикардии с широкими комплексами (табл. 5.4). ЭФИ в диагностике пациентов с тахикардией и узкими комплексами QRS (табл. 5.5) ЭФИ У пациентов с удлиненным интервалом Q‒T Удлинение интервала Q–T, связанное с потенциальной угрозой возникновения опасных для жизни аритмий, может регистрироваться постоянно или периодически как проявление врожденного синдрома удлиненного интервала Q–T или может возникать вследствие метаболических, токсических или патофизиологических факторов. ЭФИ имеет ограниченное значение для выявления, постановки диагноза или подбора терапии при врожденном или приобретенном удлинении интервала Q–T. ЭФИ у пациентов с врожденным синдромом удлиненного Q–T нередко приводит к запуску желудочковых аритмий, тогда как его диагностическое значение невысоко или отсутствует совсем (табл. 5.6). Наджелудочковые тахикардии при дополнительных путях проведения Дополнительные пути Кента и Джеймса 1. Навязывание ритма предсердия, постоянно возрастающего по частоте, или нанесение отдельных стимулов с постоянным укорочением интервала сцепления при наличии пучка Кента приводит к росту выраженности волны дельта, интервал Р—дельта—волна остается стабильным. При этом как для пучка Кента, так и для пучка Джеймса характерен на определенном этапе скачкообразный переход проведения импульсов лишь по дополнительному предсердно-желудочковому соединению. 2. Программированная стимуляция предсердия, вызывая пароксизм тахикардии, не выявляет отличительных особенностей, присущих AV-узловой тахикардии, то есть внезапного удлинения интервала А–Н или появления перио дики Венкебаха. 3. Программированная стимуляция желудочка не сопровождается увеличением времени ретроградного проведения возбуждения на предсердие, которое отражает его распространение по дополнительному предсердно-желудочковому соединению, а не по AV-узлу. 4. Выявляет нарушение последовательности ретроградного распространения волны возбуждения на предсердие. Это проявляется тем, что потенциал левого предсердия регистрируется раньше, чем правого. 5. Дополнительным признаком является регистрация нижнепредсердного потенциала на гисограмме после желудочкового комплекса в отличие от узловой тахикардии, при которой этот потенциал по времени возникновения совпадает с желудочковым. Дополнительный путь Махайма 1. Потенциал Н на гисограмме по времени возникновения совпадает с деформированным желудочковым комплексом в отведении электрограммы от желудочка и предшествует ему, тогда как регистрируемый комплекс QRS нормальной формы. 2. Частая стимуляция предсердия приводит к удлинению интервала P–Q и укорочению интервала H–V или даже к его слиянию с желудочковым комплексом, что сочетается с возникновением его аберрации по типу блокады одной из ножек пучка Гиса. 3. Аберрантный желудочковый комплекс нормализуется после введения атропина или на фоне стимуляции пучка Гиса. ЭФИ у пациентов с WPW-синдромом Рекомендации по проведению ЭФИ у пациентов с WPW-синдромом приведены в табл. 5.7. ЭФИ у пациентов с желудочковыми экстрасистолами, парными экстрасистолами и нестойкой желудочковой тахикардией Пароксизмальные желудочковые тахикардии 1. Наличие предсердно-желудочковой диссоциации, которая регистрируется на электрограмме пучка Гиса. Этот критерий является очень важным, но не абсолютным, так как выявляется, хотя и очень редко, при наджелудочковых тахикардиях с аберрантной желудочковой проводимостью. 2. Отсутствие потенциала Н перед желудочковыми комплексами или значительное укорочение интервала Н–V на гисограмме. 3. Частая и программированная стимуляция ПЖ в большинстве случаев приводит к возникновению желудочковой тахикардии. Конфигурация комплексов при этом аналогична тем, которые возникают во время спонтанно возникшего приступа. 4. Программированная стимуляция желудочков в большинстве случаев приводит к прекращению тахикардии. Желудочковая тахикардия с частотой ритма 175 уд./мин используют парные стимулы или частую стимуляцию желудочков. ЭФИ при подборе антиаритмической терапии у разных групп пациентов ЭФИ позволяет серийно оценивать вызванные лекарственными препаратами изменения проводимости и рефрактерности тканей сердца, а также особенности аритмий, включая индуцированность; при индуцированных аритмиях — оценить частоту, морфологию и гемодинамические последствия. После базового исследования (желательно без препаратов), в течение которого индуцируется аритмия, назначается препарат и повторяется электрическая стимуляция. Предполагается, что вызванное антиаритмическим препаратом снижение возможности повторно индуцировать аритмию свидетельствует об отсутствии рецидивов аритмии. Наоборот, если аритмия остается индуцированной, то достоверность повтора аритмии выше, чем в группе больных, где удалось достичь ее прекращения препаратами. Такой подход используется прежде всего у пациентов со стойкими желудочковыми тахикардиями и у пациентов, которые выжили после остановки сердца, хотя проведение ЭФИ возможно и у пациентов с наджелудочковыми аритмиями (табл. 5.12). О.С. Сычев, А.И. Фролов «Рекомендации по проведению электрофизиологического исследования» источник |
 Электрограмма пучка Гиса (ЭПГ). Схема.
Электрограмма пучка Гиса (ЭПГ). Схема. 
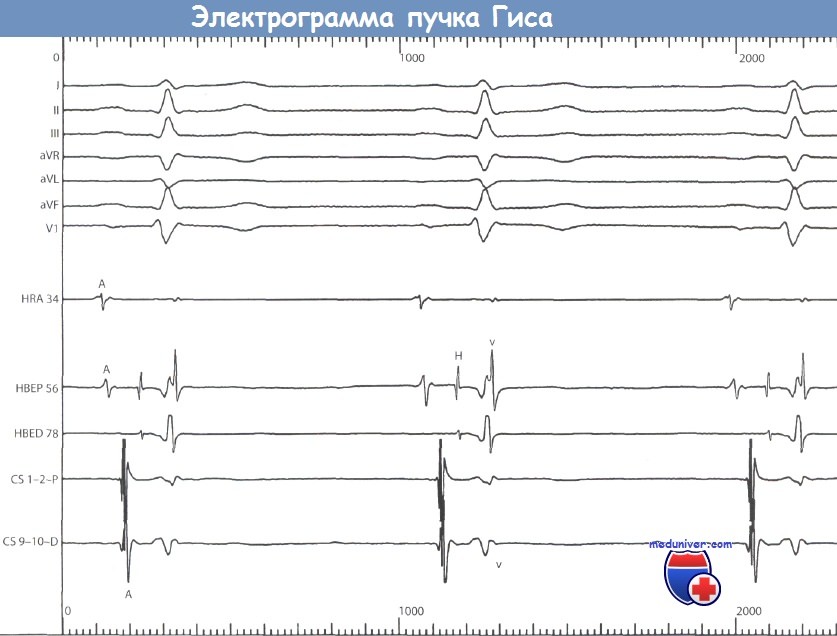 Синусовый ритм. 6 каналов записи наружной ЭКГ с синхронной записью электрограммы верхнего отдела ПП (HRA),
Синусовый ритм. 6 каналов записи наружной ЭКГ с синхронной записью электрограммы верхнего отдела ПП (HRA), 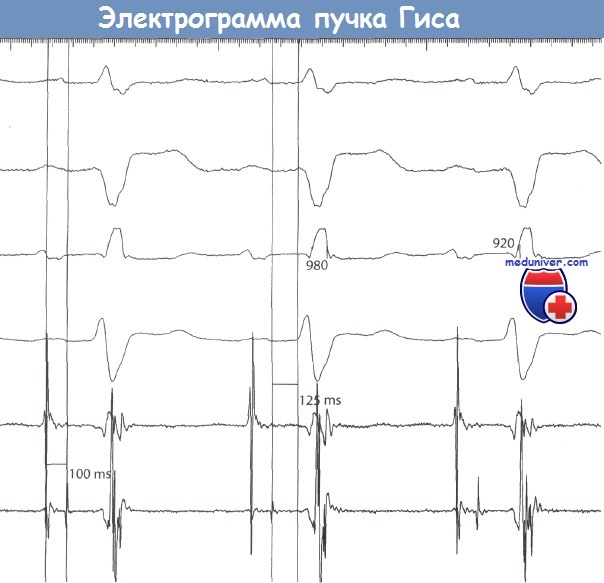 Синхронная запись отведений I, II, V1 и V6 наружной ЭКГ и электрограммы пучка Гиса (нижняя кривая) у пациента с бифасцикулярной блокадой и удлиненным интервалом PR.
Синхронная запись отведений I, II, V1 и V6 наружной ЭКГ и электрограммы пучка Гиса (нижняя кривая) у пациента с бифасцикулярной блокадой и удлиненным интервалом PR.