Вирусные заболевания возникли в глубокой древности, однако вирусология как наука начала развиваться в конце XIX века.
В 1892 г. русский ученый-ботаник Д. И. Ивановский, изучая мозаичную болезнь листьев табака, установил, что заболевание это вызывается мельчайшими микроорганизмами, которые проходят через мелкопористые бактериальные фильтры. Эти микроорганизмы получили название фильтрующихся вирусов (от лат. virus — яд). В дальнейшем было показано, что имеются и другие микроорганизмы, проходящие через бактериальные фильтры, поэтому фильтрующиеся вирусы стали называть просто вирусами.
Вопрос о происхождении вирусов является предметом многих исследований и дискуссий. Одни ученые предполагают, что вирусы являются потомками неклеточных форм живых паразитических микроорганизмов. Другие считают, что вирусы возникли в результате регрессивной эволюции одноклеточных микроорганизмов. Третьи думают, что вирусы произошли из клеточных элементов, ставших автономными системами.
Большой вклад в изучение вирусов внесли советские вирусологи: М. А. Морозов, Н. Ф. Гамалея, Л. А. Зильбер, М. П. Чумаков, А. А. Смородинцев, В. М. Жданов и др.
Вирусы — это неклеточная форма существования живой материи. Они очень малы. По образному выражению В. М. Жданова «величину их по отношению к величине средних бактерий можно сравнить с величиной мыши по отношению к слону». Увидеть вирусы стало возможным только после изобретения электронного микроскопа.
В настоящее время для изучения вирусов используют много методов: химические, физические, молекулярно-биологические, иммунобиологические и генетические.
Все вирусы подразделяются на поражающие человека, животных, насекомых, бактерии и растения.
У вирусов наблюдается большое разнообразие форм и биологических свойств, однако все они имеют общие черты строения. Зрелые частицы вирусов называют вирионами.
В отличие от других микроорганизмов, содержащих одновременно ДНК и РНК, вирион содержит только одну из нуклеиновых кислот — либо ДНК, либо РНК.
Нуклеиновая кислота вирусов может быть однонитчатой и двунитчатой. Почти все вирусы, содержащие РНК, имеют в своем геноме однонитчатую РНК, а содержащие ДНК — двунитчатую ДНК. В соответствии с двумя типами генетического вещества вирусы подразделяют на РНК- и ДНК-содержащие. К ДНК-содержащим относятся 5 семейств, РНК-содержащим — 10 семейств.
* ( Здесь приведены данные, касающиеся только некоторых из патогенных для человека вирусов.)
Классификация вирусов
Структура вириона. В центре вириона находится нуклеиновая кислота, которая окружена капсидом (от греч. kanca — ящик). Капсид состоит из белковых субъединиц, называемых капсомерами. Зрелый вирус по химической структуре является нуклеокапсидом. Количество капсомер и способ их укладки (рис. 52) строго постоянны для каждого вида вируса. Например, вирус полиомиелита содержит 32 капсомера, а аденовирус — 252 капсомера. Капсомеры могут быть уложены в виде многогранника с равномерными симметричными гранями — кубоидальная форма (например, аденовирус). Укладка в виде спиралей (сферическая) характерна для вирусов гриппа. Может быть тип симметрии, при котором нуклеиновая кислота имеет вид пружины, вокруг которой уложены капсомеры, в этом случае вирус имеет палочковидную форму — вирус, вызывающий болезнь листьев табака.
Рис. 52. Схематическое изображение расположения капсомеров в капсиде вирусов. а — вирус гриппа; б — аденовирус; в — вирус герпеса; г — вирус полиомиелита
Сложный тип симметрии имеет фаг: головка — кубоидальной, а отросток — палочковидной формы (сперматозоидная форма) (см. рис. 21, 22).
Таким образом, в зависимости от способа укладки вирусы подразделяют на кубоидальную, сферическую, палочковидную и сперматозоидную формы.
Некоторые вирусы, обладающие более сложной структурой, имеют оболочку, которая называется пеплос. Она образуется при выходе вируса из клетки хозяина. Вирусный капсид при этом обволакивается внутренней поверхностью цитоплазматической мембраны клетки хозяина и образуется один или несколько слоев оболочки суперкапсид. Такую оболочку имеют только некоторые вирусы, например вирусы бешенства, герпеса, энцефалита. Эта оболочка содержит фосфолипиды, разрушающиеся под воздействием эфира. Таким образом, воздействуя эфиром, можно отличить вирус, имеющий пеплос, от вируса с «голым капсидом».
У некоторых вирусов из внешнего липидного слоя оболочки выступают капсомеры в виде шипов (эти шипы тупые). Такие вирусы называются пепломерами (например, вирус гриппа, см. рис. 52).
Нуклеиновая кислота вируса является носителем наследственных свойств, а капсид и внешняя оболочка несут защитные функции, как бы оберегая нуклеиновую кислоту. Кроме того, они способствуют проникновению вируса в клетку.
Размеры вирусов. Измеряются вирусы в нанометрах. Величина их колеблется в широком диапазоне от 15-20 до 350-400 нм.
Методы измерения вирусов: 1) фильтрование через бактериальные фильтры с известной величиной пор; 2) ультрацентрифугирование — крупные вирусы осаждаются быстрее; 3) фотографирование вирусов в электронном микроскопе.
Химический состав вирусов. Количество и содержание ДНК и РНК вирусов неодинаковы. У ДНК молекулярная масса колеблется от 1·10 6 до 1,6·10 8 , а у РНК — от 2·10 6 до 9,0·10 6 .
Белки у вирионов обнаружены в незначительном числе, они состоят из 16-20 аминокислот. Кроме капсидных белков, имеются еще внутренние белки, связанные с нуклеиновой кислотой. Белки обусловливают антигенные свойства вирусов, а также в силу плотной укладки полипептидных цепей ограждают вирус от действия ферментов клетки хозяина.
Липиды и углеводы обнаружены во внешней оболочке сложных вирионов. Источником липидов и углеводов является оболочка клетки хозяина. Полисахариды, входящие в состав некоторых вирусов, обусловливают способность их вызывать агглютинацию эритроцитов.
Ферменты вирусов. Вирусы не имеют собственного метаболизма, поэтому они не нуждаются в ферментах обмена веществ. Однако у некоторых вирусов выявлено наличие ферментов, способствующих проникновению их в клетку хозяина. Например, у вируса гриппа А обнаружена нейраминидаза, отщепляющая нейраминовую кислоту, содержащуюся в оболочках животных клеток (эритроцитов и др.). У фагов — лизоцим, разрушающий клеточную оболочку, фосфатаза и др.
Выявление вирусных антигенов. Вирусные антигены в инфицированных клетках хозяина можно обнаружить с помощью метода иммунофлюоресценции. Препараты, содержащие клетки, инфицированные вирусами, обрабатывают специфическими иммунными люминесцирующими сыворотками. При просмотре в люминесцентном микроскопе в местах скопления вирусных частиц наблюдается характерное свечение. Вид вируса определяют по соответствию специфической люминесцирующей сыворотки, вызвавшей свечение.
Внедрение вируса в клетку, взаимодействие его с клеткой хозяина и репродукция (размножение) слагаются из ряда последовательных стадий.
Стадия 1. Начинается с процесса адсорбции за счет рецепторов вириона и клетки. У сложных вирионов рецепторы располагаются на поверхности оболочки в виде шиловидных выростов (вирус гриппа), у простых вирионов — на поверхности капсида.
Стадия 2. Проникновение вируса в клетку хозяина протекает по-разному у разных вирусов. Например, некоторые фаги протыкают оболочку своим отростком и впрыскивают нуклеиновую кислоту в клетку хозяина (см. главу 8). Другие вирусы попадают в клетку путем втягивания вирусной частицы с помощью вакуоли, т. е. на месте внедрения в оболочке клетки образуется углубление, затем края ее смыкаются и вирус оказывается в клетке. Такое втягивание называется виропексис.
Стадия 3. «Раздевание вируса» (дезинтеграция). Для своего воспроизведения вирусная нуклеиновая кислота освобождается от защищающих ее белковых покровов (оболочки и капсида). Процесс раздевания может начаться во время адсорбции, а может произойти тогда, когда вирус находится уже внутри клетки.
Стадия 4. На этой стадии происходит репликация (воспроизведение) нуклеиновых кислот и синтез вирусных белков. Эта стадия происходит при участии ДНК или РНК клетки хозяина.
Стадия 5. Сборка вириона. Этот процесс обеспечивается самосборкой белковых частиц вокруг вирусной нуклеиновой кислоты. Синтез белка может начаться непосредственно после синтеза вирусной нуклеиновой кислоты либо после интервала в несколько минут или несколько часов. У одних вирусов самосборка происходит в цитоплазме. У других в ядре клетки хозяина. Образование внешней оболочки (пеплоса) всегда происходит в цитоплазме.
Стадия 6. Выход вириона из клетки хозяина происходит путем просачивания вируса через оболочку клетки либо через отверстие, образовавшееся в клетке хозяина (в этом случае клетка хозяина погибает).
Типы взаимодействия вируса и клетки. Первый тип — продуктивная инфекция — характеризуется образованием новых вирионов в клетке хозяина.
Второй тип — абортивная инфекция заключается в том, что обрывается репликация нуклеиновой кислоты.
Третий тип — характеризуется встраиванием вирусной нуклеиновой кислоты в ДНК клетки хозяина; возникает форма сосуществования вируса и клетки хозяина (вирогения). В этом случае обеспечивается синхронность репликации вирусной и клеточной ДНК. У фагов это называется лизогения.
Микроскопическое исследование. При отдельных вирусных инфекциях в цитоплазме или ядрах клеток организма хозяина наблюдаются специфические внутриклеточные тельца — включения, имеющие диагностическое значение (тельца Бабеша — Негри при бешенстве, тельца Гварниери при оспе и др.). Размеры вирусных частиц и телец-включений удается искусственно увеличить специальными методами обработки препаратов с протравой и импрегнацией (например, метод серебрения по Морозову) и наблюдать при иммерсионной микроскопии. Более мелкие вирионы, лежащие за пределами видимости оптического микроскопа, обнаруживаются только при электронной микроскопии. Существуют разные точки зрения в отношении внутриклеточных включений. Одни авторы считают, что они представляют собой скопление вирусов. Другие считают, что они возникают в результате реакции клетки на внедрение вирусов.
Генетика вирусов. Модификация (ненаследуемые изменения) у вирусов обусловливается особенностями клетки хозяина, в которой происходит репродукция вируса. Модифицированные вирусы приобретают способность заражать клетки, аналогичные тем, в которых они модифицировались. У разных вирусов модификация по-разному проявляется. Например, у фагов изменяется форма «негативных пятен» (фаговых колоний).
Мутация — у вирусов возникает под влиянием тех же мутагенов, которые вызывают мутацию у бактерий (физические и химические факторы). Возникает мутация во время репликации нуклеиновых кислот. Мутации затрагивают различные свойства вирусов, например чувствительность к температуре и др.
Генетическая рекомбинация у вирусов может возникнуть в результате одновременного заражения клетки хозяина двумя вирусами, при этом может произойти обмен отдельными генами между двумя вирусами и образуются рекомбинанты, содержащие гены двух родителей.
Генетическая реактивация генов иногда происходит при скрещивании инактивированного вируса с полноценным, что приводит к спасению инактивированного вируса.
Спонтанная и направленная генетика вирусов имеет большое значение в развитии инфекционного процесса.
Устойчивость к факторам окружающей среды. Большинство вирусов инактивируется при действии высоких температур. Однако имеются исключения, например вирус гепатита термоустойчив.
К низким температурам вирусы не чувствительны, ультрафиолетовые солнечные лучи оказывают инактивирующее действие на вирусы. Рассеянный солнечный свет действует на них менее активно. Вирусы устойчивы к глицерину, что дает возможность длительно сохранять их в глицерине. Они устойчивы к антибиотикам (при культивировании вирусов исследуемый материал обрабатывают антибиотиками для подавления бактериальной флоры).
Кислоты, щелочи, дезинфицирующие вещества инактивируют вирусы. Однако некоторые вирусы, инактивированные формалином, сохраняют иммуногенные свойства, что позволяет использовать формалин для получения вакцин (вакцина против бешенства).
Восприимчивость животных. Круг восприимчивых животных для некоторых вирусов очень широк, например к вирусам бешенства чувствительны многие животные. Некоторые вирусы поражают только один вид животного, например вирус чумы собак поражает только собак. Имеются вирусы, к которым животные не чувствительны — например, вирус кори и т. д.
Органотропность вирусов. Вирусы обладают способностью поражать определенные органы, ткани и системы. Например, вирус бешенства поражает нервную систему. Вирус оспы обладает дермотропностью и т. д.
Выделение вирусов в окружающую среду. Из больного организма вирусы могут выделяться с калом, например вирус полиомиелита и другие энтеровирусы. Вирус бешенства выделяется со слюной, вирус гриппа — с отделяемым слизистой носоглотки и т. д.
Основные пути передачи вирусов. Воздушно-капельный (грипп, оспа), пищевой (полиомиелит, гепатит А), контактно-бытовой (бешенство), трансмиссивный (энцефалит).
Противовирусный иммунитет. Организм человека обладает врожденной устойчивостью к некоторым вирусам. Например, человек не чувствителен к вирусу чумы собак. Животные не чувствительны к вирусу кори. В этих случаях противовирусный иммунитет основан на отсутствии клеток, способных поддерживать репродукцию вирусов.
Противовирусный иммунитет обусловливается как клеточными, так и гуморальными факторами защиты, неспецифическими и специфическими. Неспецифические факторы. Мощным ингибитором репродукции вирусов является белковое вещество — интерферон. В здоровом организме он содержится в незначительном количестве, а вирусы способствуют продукции интерферона и количество его значительно увеличивается. Он неспецифичен, так как блокирует репродукцию разных вирусов. Однако он обладает тканевой специфичностью, т. е. клетки разных тканей образуют неодинаковый интерферон. Считают, что механизм действия его заключается в том, что он препятствует синтезу белка в клетке хозяина и этим прекращает репродукцию вируса.
К специфическим факторам противовирусного иммунитета относятся вируснейтрализующие антитела, гемагглютинирующие и преципитирующие.
Методы культивирования вирусов. Вирусы размножаются только в жизнеспособных клетках. Их культивируют: в куриных эмбрионах (рис. 53), культурах ткани человека и различных животных, в организме чувствительных животных, восприимчивых членистоногих.
Рис. 53, Куриный эмбрион. 1 — хорион-аллантоис: 2 — аллантоисная полость; 3 — амниотическая полость; 4 — желточный мешок; 5 — воздушный мешок; 6 — подскорлупная оболочка
В первый период развития вирусологии основным методом изучения вирусов являлось искусственное заражение животных, но этот метод сложный, и кроме этого животные ко многим вирусам оказались невосприимчивы.
Большое значение в развитии вирусологии имело введение методов культивирования вирусов в куриных эмбрионах и в культуре клеток тканей человека и животных.
Заражение куриных эмбрионов. Для репродукции вирусов используют куриные эмбрионы 7-12-дневного возраста, инкубированные в термостате при 37° С. Необходимым условием для правильного развития зародыша является соблюдение определенной влажности воздуха, которую можно создать, поместив в термостат сосуд с водой.
Пригодность куриного эмбриона для заражения определяется по наличию движений эмбриона и развитой сети кровеносных сосудов на хорион-аллантоисной оболочке при просвечивании с помощью овоскопа.
Культивирование вирусов в куриных эмбрионах проводится в разных местах эмбриона, который заражают (см. рис. 53):
1) на хорион-аллантоисную оболочку,
3) в амниотическую полость;
Заражение куриных эмбрионов проводят в боксе с использованием стерильных инструментов. Перед заражением куриные эмбрионы двукратно протирают ватным тампоном, смоченным спиртом.
Заражение на хорион-аллантоисную оболочку. После дезинфекции яйца осторожно срезают кусочек скорлупы с тупого конца, снимают подскорлупную оболочку — при этом обнаруживается хорион-аллантоисная оболочка. Инфекционный материал в количестве 0,1-0,2 мл при помощи шприца или пастеровской пипетки наносят на хорион-аллантоисную оболочку. После заражения отверстие закрывают колпачком и просвет между ним и куриным эмбрионом заливают парафином.
На другой стороне яйца простым карандашом пишут название инфекционного материала и дату заражения.
Заражение в амниотическую полость. Яйцо овоскопируют и на боковой стороне выбирают участок, где хорион-аллантоис лишен крупных кровеносных сосудов. Этот участок отмечают карандашом. Яйца укладывают на подставку в горизонтальном положении, дезинфицируют и специальным стерильным копьем прокалывают отверстие в скорлупе на глубину 213 мм, через которое вводят на это же расстояние иглу с инфекционным материалом непосредственно в амниотическую полость. Для того чтобы вводимая жидкость не вытекала обратно, предварительно делают прокол над воздушным мешком, после чего оба отверстия заливают парафином.
Заражение в аллантоисную полость. Заражение проводят в затемненном боксе. Отмечают воздушное пространство, скорлупу над воздушным пространством дезинфицируют и через отверстие в скорлупе вводят по направлению к эмбриону иглу шприца с материалом. Если игла попала в аллантоисную полость, то наблюдается смещение тени эмбриона. После заражения отверстие заливают парафином.
Заражение в желточный мешок. Скорлупу дезинфицируют. Яйцо помещают на подставку тупым концом вправо так, чтобы желточный мешок был обращен вверх. Над воздушной камерой в центре прокалывают отверстие. Через отверстие в скорлупе в горизонтальном направлении на глубину 2-3 мм вводят иглу шприца, которая попадает в желточный мешок. Материал вводят в объеме 0,2-0,3 мл. После введения материала отверстие парафинируют.
Температурный режим и длительность инкубации зависят от биологических свойств введенного вируса.
Инфицированные яйца ежедневно проверяют — овоскопируют для проверки жизнеспособности эмбриона. Если эмбрионы погибают в первые сутки, то причиной этого обычно бывает травма при заражении. Такие яйца выводят из опыта.
При необходимости раздельно исследовать каждую составную часть эмбриона материал собирают в определенном порядке: отсасывают аллантоисную жидкость, затем амниотическую жидкость, разрезают хорион-аллантоисную оболочку, отделяют амниотическую оболочку, эмбрион, желточный мешок и только после этого извлекают хорион-аллантоисную оболочку, отделив ее от внутренней поверхности скорлупы. Наличие вируса в зараженном эмбрионе определяют по характерным изменениям хорион-аллантоисной оболочки зараженного куриного эмбриона.
Вирусы, не обладающие гемагглютинирующей активностью, выявляют с помощью РСК.
Для выявления вируса в аллантоисной или амниотических жидкостях зараженных эмбрионов ставят РГА (гемагглютинация вызывается аллантоисной или амниотическими жидкостями или взвесью, приготовленной из хорион-аллантоисной оболочки).
Культивирование вирусов в культуре клеток. Для накопления вирусов в чувстсительных клеточных культурах используются ткани человека и различных животных. Наибольшее практическое применение получили однослойные культуры первично-трипсинизированных и перевиваемых линий клеток.
Однослойные культуры клеток выращивают в стеклянных плоских сосудах-матрацах. Клеточная суспензия в жидкой питательной среде при температуре 37° С позволяет получить «in vitro» слой клеток с определенной гистологической структурой. Присутствие вирусов в культурах тканей обнаруживают по изменению (дегенерации) клеток. Тип вирусов определяют путем нейтрализации действия вирусов при добавлении к вируссодержащему материалу соответствующих типоспецифических сывороток.
Эти методы позволяют быстрее учитывать результаты исследования и являются более экономичными. В тех случаях, когда вирусы не вызывают цитопатического действия (дегенерации) и не развиваются в куриных эмбрионах, пользуются методами заражения животных (см. главу 11).
Для культивирования вирусов используют перевиваемые клетки, которые чаще получают из клеток злокачественных опухолей.
Однослойные культуры получают из эмбрионов человека, курицы, животных.
Преимущество однослойных культур клеток — простота методики и легкость учета.
Способность клеток к размножению вне организма связана со степенью дифференциации ткани. Менее дифференцированные ткани обладают большей способностью к пролиферации (соединительная, эпителиальная ткань).
Сущность методов при приготовлении первичных культур ткани заключается в разрушении межклеточной ткани и разобщении клеток для последующего получения монослоя.
Разобщение клеток проводится путем воздействия на ткань протеолитических ферментов, чаще всего трипсина. Раствор трипсина способствует разъединению клеток при сохранении у них способности к размножению. Для выращивания культуры клеток необходима питательная среда. Состав среды сложный, он включает целый ряд ингредиентов: аминокислоты, глюкозу, витамины, минеральные соли, коферменты и т. д. Получение культуры ткани проводят в строго асептических условиях. В среду добавляются антибиотики (500 ЕД пенициллина и 250 ЕД стрептомицина в 1 мл) для подавления роста бактериальной флоры.
Подготовленную ткань заливают 0,25% раствором подогретого трипсина и инкубируют в термостате при 37° С. Во время инкубации ткань периодически помешивают путем вращения колбы. Трипсинизированные клетки центрифугируют при 800-1000 об/мин в течение 5 мин.
Трипсинизацию и центрифугирование проводят очень осторожно, чтобы не травмировать клетки. После центрифугирования надосадочную жидкость удаляют, а осадок клеток помещают в небольшой объем питательной среды. Для получения однородной массы взвесь клеток фильтруют через один слой марли в воронке (стерильной). Взвесь клеток проверяют на стерильность путем посева по 0,1 мл , в 2 пробирки с сахарным бульоном.
Успех культивирования клеток зависит от посевной Дозы, поэтому после трипсинизации производят подсчет клеток в камере Горяева. После подсчета взвесь клеток разводят питательной средой из такого расчета, чтобы в 1 мл содержалось 500000-1000000 клеток и разливают по пробиркам и матрацам. Пробирки с культурой ткани инкубируют в термостате в наклонном положении.
Посеянные культуры ежедневно просматривают под малым увеличением микроскопа для определения характера их роста. Нормальные пролиферирующие клетки светлые и растут однослойным пластом. Если клетки темные, зернистые и не пролиферируют, что может быть результатом загрязнения (плохая обработка посуды или загрязнение ингредиентов), то такие культуры изымают из опыта.
Смена питательной среды через 2-3 дня после посева улучшает интенсивность пролиферации.
Нормальные, хорошо пролиферирующие клетки заражают исследуемым материалом.
Перевиваемые культуры преимущественно получают из злокачественных опухолей. Штамм Hela — культура клеток рака шейки матки женщины по имени Helena (получен в 1950 г.); штамм Нер-2 выделен от больного раком гортани. Рост этих клеток поддерживается в лабораториях путем последовательных пассажей. Особенность их заключается в том, что они размножаются в течение длительного срока. В настоящее время эти клетки прошли уже тысячи генераций. В процессе пассажей они теряют некоторые морфологические и биохимические свойства — подвергаются мутации. Однако остаются вполне пригодными для культивирования в них вирусов. Культурой этих клеток пользуются лаборатории всего мира.
Размножение вируса в культуре клеток происходит в различные сроки в зависимости от свойств вируса и вида клеток.
О наличии вируса судят по цитопатическому действию. В микроскопе наблюдается дегенерация клеток. Время цитопатического действия и его характер зависят от дозы и свойств вируса.
У некоторых вирусов цитопатическое действие обнаруживается через несколько дней (вирус оспы), у других — через 1-2 нед (вирус гепатита и др.).
В настоящее время известны уже сотни вирусов, поражающих человека. Борьба с вирусными инфекциями осуществляется разными методами. Наиболее эффективна иммунизация. Таким способом ликвидирована оспа, сокращена заболеваемость полиомиелитом. Важное значение в борьбе с вирусными инфекциями имеют общественная профилактика — уничтожение бродячих собак (борьба с бешенством), личная профилактика и т. д.
Однако эти меры не могут обеспечить ликвидацию всех вирусных заболеваний. Ученые настойчиво ищут пути, при помощи которых можно было бы поразить вирус, не повредив клетку, в которой он находится.
Поэтому закономерно, что в программе КПСС вирусология названа одной из ведущих отраслей естественнонаучных знаний, которая должна получить преимущественное развитие в ближайшие годы.
Основные методы исследования вирусов. 1. Реакция гемагглютинации, реакция задержки гемагглютинации, реакция непрямой гемагглютинации. Реакция связывания комплемента.
2. Реакция нейтрализации вирусов в культуре тканей.
3. Метод иммунофлюоресценции.
4. Гистологический метод — выявление включений (телец Бабеша — Негри — при бешенстве; телец Пашена — при оспе и др.).
источник
В 1951—1953 годах их обнаружили у больных полиомиелито-подобными заболеваниями. Комитетом по номенклатуре вирусов было признано целесообразным сохранить название ЕСНО. В настоящее время известно более 30 серотипов этих вирусов, хотя не все они могут вызывать заболевания у людей. Вирусы непатогенны для лабораторных животных.
Структура.Вирионы имеют строение, характерное для представителей семейства Рicjrnaviridae: кубический тип симметрии (икосаэдр) капсид, содержащий 32 капсомера. Диаметр вириона 20—30 нм. Нуклеиновая кислота представлена РНК.
Резистентность.ЕСНО-вирусы, как и большинство энтеровирусов, эфиро- и спирторезистентны, антибиотикоустойчивы. В фекалиях и канализационных водах при 0°С сохраняют биологическую активность в течение нескольких недель. При 20°С в культуральной жидкости сохраняются годами. Инактивируются в течение нескольких минут при 100° С, через 30 минут — при 50°С. Инактивирующее действие на вирус оказывают хлорсодержащие дезинфектанты и формалин.
Культивирование.Большинство серотипов ЕСНО-вирусов размножаются в клетках Нер-2, Не1а, КВ, культурах клеток из человеческого амниона, обычно вызывая выраженное ЦПД. В куриных эмбрионах не репродуцируются.
Эпидемиология.Источником инфекции является больной человек или вирусоноситель. Циркуляция вируса среди населения довольно распространена. Восприимчивость к нему высокая и заболевания регистрируются среди различных групп населения, но самый высокий процент заболеваемости у детей до 10 лет.
У взрослых восприимчивость повышается при беременности или после лечения кортикостероидами. Механизмы заражения фекально-оральный, реже воздушно-капельный.
Патогенез и клиника.Патогенез подобен тому, который наблюдается при инфицировании вирусами Коксаки. Вирусы ЕСНО обнаруживаются через две недели после инфицирования в крови, слизи из зева и фекалиях. Являются возбудителями серозных менингитов (серотипы 1—7, 9, 11—23, 25, 27, 30, 31), полиомиелитоподобных заболеваний (серотипы 1—4, 6, 7, 9, 11, 13, 14, 16, 18, 30, 31), а также гастроэнтеритов, диареи, заболеваний верхних дыхательных путей, энцефалитов, перикардитов.
Лабораторная диагностика.Тип вируса определяется в РН и РТГА.
Иммунитет.Типоспецифический. Специфическая терапия не разработана. Можно использовать человеческий иммуноглобулин, серии которого имеют антитела практически ко всем типам вируса.
Профилактика.Профилактические мероприятия аналогичны тем, которые проводят в очагах Коксаки-инфекции.
Бешенство — особо опасное остро протекающее заболевание, передающееся через слюну от больных млекопитающих человеку; характеризуется поражением ЦНС с летальным исходом.
Инфекционную природу бешенства установили в начале XIX века, вирусную этиологию определил в 1903 году П. Ремленже. Возбудитель бешенства — вирус Nеuroryetesrabiesпринадлежит к родуLissavirus, семейству Rabdoviridae.
Морфология.Вирионы имеют пулевидную форму — один конец закругленный, другой — плоский, диаметр — 75—80 нм, длина — 180 нм. Геном представлен одноцепочечной РНК с молекулярной массой (4—5)×10 6 . Было показано, что депротеинизированная геномная РНК неинфекционна. Это отражает тот факт, что вирусная РНК имеет негативную полярность (то есть комплементарна м-РНК), поэтому для синтеза м-РНК вирус, заражающий клетку, должен содержать вирус-специфическую РНК-зависимую РНК-полимеразу. Геномная РНК инкапсидируется по всей длине единственным главным структурным белком. Процесс инкапсидирования завершается формированием спирального нуклеокапсида, который в свернутом состоянии определяет форму зрелого вириона.
Белки с активностью РНК-зависимой РНК-полимеразы (тран-скриптазы) присоединяются к нуклеокапсиду и образуют рибо-нуклеопротеид (РНП). При введении в клетку он проявляет ин-фекционность. У зрелых вирионов рибонуклеопротеид окружен оболочкой, состоящей из липидного бислоя с гликопротеиновыми выступами. Хотя оболочка не является необходимой для заражения, она повышает инфекционность вируса на три — пять порядков.
Антигеиная структура.Вирус бешенства содержит гликопро-теидный антиген вирусной оболочки и внутренний нуклеопротеидный антиген. Первый из них способен индуцировать образование вируснейтрализующих антител и защищать от заражения. Нуклеопротеидный антиген индуцирует образование комплемент — связывающих и преципитирующих антител, которые не имеют вируснейтрализующей активности. Вирус обладает гемадсорбирующими свойствами. Реакция гемадсорбции происходит в присутствии эритроцитов гусей, кур, хомяков, морских свинок.
Резистентность.Устойчивость вируса бешенства невелика. Инактивация в 1—5 %-ном растворе формалина наступает в течение 5 минут, в 0,1 %-ном растворе сулемы — за 2—3 часа, 1 %-ном растворе фенола — за две-три недели, 2 %-ном — за 24 часа, 5 %-ном — за 5—10 минут; 1 %-ный раствор перманганата калия убивает вирус за 20 минут, 3-5 %-ный соляной кислоты — за 5 минут, 10 %-ный йода — за 5 минут. Вирус чувствителен к щелочным растворам: под их воздействием происходит деструкция его липопротеиновой оболочки. Эта особенность имеет важное значение, так как промывание раны укушенного слабым раствором щелочи или мыльным раствором способствует инактивации вируса. В то же время низкие температуры консервируют вирус. Так, вируссодержащая суспензия в 0,1 %-ном сывороточном альбумине при нейтральном рН стабильна в течение нескольких лет при температуре минус 70°С или в лиофилизированном состоянии. Высушивание без вакуума инактивирует вирус через 10—14 дней. При температуре 23 °С вирус сохраняется в течение 28-53 дней, при 50°С инактивируется через час, 60 °С — за 5—10 минут, 70 °С — мгновенно.
Культивирование.Вирус бешенства можно культивировать на мышах, кроликах, морских свинках при интрацеребральном методе заражения. После предварительной адаптации к вирусу восприимчивы куриные эмбрионы. Размножается он в первичных культурах клеток почки сирийского хомячка, эмбриона овец, телят, куриных фибробластов, слюнных желез собак, а также в перевиваемых клеточных культурах ВНК-21, кроличьего эндотелия, почек эмбриона свиньи и некоторых других. Почти все типы культивируемых клеток — как первичные, так и перевиваемые, чувствительны к вирусу бешенства.
Первые удачные попытки по изменению биологических свойств вируса были проведены Л. Пастером с сотрудниками Ш. Шамберланом и Э. Ру (1882-1885). После 178-го интрацеребрального пассажа уличного вируса бешенства на кроликах вирус вызывал у них заболевание с гибелью на шестой день. Рабический вирус, вызывающий у кроликов бешенство после короткого инкубационного периода с постоянным фиксированным сроком, Л. Пастер назвал фиксированным вирусом (virusfixe), в отличие
от первоначального неизмененного, названного уличным (virusdesrues). Фиксированный вирус использовался для вакцинации крупного рогатого скота, кошек, собак.
Эпидемиология.Бешенство — это типичный зооантропоноз. Источником болезни и переносчиком вируса чаще всего являются домашние и дикие животные, в частности представители следующих семейств отряда хищников: собачьи — собака, волк, лисица, енотовидная собака, шакал, дикая собака; кошачьи — кошка домашная и дикая, рысь, пантера, леопард и др.; енотовые — енот-полоскун и др.; куньи — куница лесная и каменная, хорек, ласка, горностай и др.; виверровые — мангуст; гиеновые; медвежьи. Установлено, что летучие мыши-вампиры, являясь резервуаром и переносчиком вируса бешенства в природе, заражают животных и людей. В США отмечено пять случаев заболевания людей после укусов их насекомоядными летучими мышами.
Животное обычно заражается путем укуса больного животного и после длительного инкубационного периода заболевает. Болезнь может развиваться в форме паралича, но чаще проявляется в виде буйного бешенства, при котором затронута лимбическая система мозга, и животное в припадке ярости, гонимое лимбическим возбуждением, кусает всех без разбора. В слюне животного вирус присутствует в высокой концентрации и легко передается с укусами.
У людей обычно бывает паралитическая форма болезни, не связанная с агрессивностью, в связи с чем болезнь протекает как тупиковая инфекция.
Таким образом, бешенство передается через укус со слюной больного животного или во время ослюнения при наличии повреждений кожного покрова. Кроме того, имеются сообщения о передаче вируса с молоком, мочой, через конъюнктиву глаза, аэрогенным и энтерогенным путями.
Данные почти столетнего периода изучения бешенства свидетельствуют о том, что до 1955 года в большинстве стран основным источником заражения (80-90 % случаев) были собаки и в 0,2-4 % случаев — кошки. В 60—80-е годы нашего столетия в результате проведения массовой вакцинации собак против бешенства и возникновения в ряде стран Европы и Северной Америки эпизоотии бешенства среди диких плотоядных (лисиц, куниц и т. д.) роль отдельных источников возбудителя бешенства для человека изменилась.
В Украине в период с 1965 по 1980 год преобладающими источниками заражения (58,9 %) были лисы, енотовидные собаки, барсуки, куницы. Возрос удельный вес кошек (30 %), экологически связанных с лисицами. В то же время в большинстве стран Латинской Америки, Азии и Африки собака остается основным источником заражения человека.
Вопрос о роли грызунов как источников бешенства для человека окончательно не решен. Вирус бешенства выделен от мелких грызунов в США, Германии, Таиланде, однако в настоящее время не рекомендуют проводить антирабическое лечение лиц, укушенных грызунами.
Патогенез и клиника.Причины симптомов бешенства и гибели от него изучены недостаточно. По данным югославских ученых, вирус бешенства не размножается в организме до тех пор, пока не попадет в центральную нервную систему. Достигнув ее, он вызывает в ней необратимые изменения. Они наступают раньше, чем в организме успевает сформироваться активный иммунитет. Непосредственно после инфицирования возбудитель можно нейтрализовать специфическим иммуноглобулином.
Патогенез бешенства зависит от ряда факторов: вирулентности возбудителя, устойчивости организма животного, времени продвижения возбудителя до ЦНС. Случаи спонтанного выздоровления собак после искусственного заражения вирусом бешенства диких животных предполагают наличие у отдельных особей высокой степени защиты, то есть высоких титров гуморальных вируснейтрализующих антител.
Как было сказано выше, вирус бешенства попадает в организм человека через рану или микроповреждение кожи при укусе или ослюнении его бешеным животным. Реже входными воротами инфекции являются слизистые оболочки. Далее наблюдается центростремительное движение вируса по периневральным пространствам со скоростью 1 мм/ч. Дальнейшее размножение и накопление его происходит в основном в головном и спинном мозге с последующим центробежным распространением и поражением всей нервной системы, в том числе нервных узлов слюнных желез. Из слюнных желез вирусы выделяются в окружающую среду.
В течении болезни различают следующие стадии: продромальную, развившейся болезни с возбуждением, параличей, заканчивающуюся летальным исходом. Продолжительность инкубационного периода в известной степени зависит от локализации укуса (короткий — при укусах в лицо, голову, более длинный — при укусах в стопы), степени его тяжести, возраста укушенного. Инкубационный период чаще всего составляет от 10 до 30—40 дней, реже — до одного года и более.
Первые признаки болезни обнаруживаются почти всегда в месте укуса. Больные начинают ощущать зуд, тянущие и ноющие невралгические боли по ходу нервных путей, ближайших к месту укуса. Отмечается субфебрильное повышение температуры, общее недомогание, головная боль, симптомокомплекс тревоги. Продромальные явления усиливаются, наблюдается тошнота, усиливается потливость. Внезапно под влиянием какого-либо раздражения возникают пароксизмы гидро-, аэро-, фото-, акустико-
фобии. Приступ сопровождается болезненными спазмами мышц глотки. Вдох сильно затруднен, выдох поверхностный. Нарастает тахикардия, больные мечутся, возбуждены, умоляют о помощи, появляются галлюцинации. Когда возбуждение проходит, наступает стадия параличей или «зловещего успокоения». Часто развитие параличей начинается с нижних конечностей и идет по типу восходящего паралича Ландри. В этом периоде может исчезнуть аэро- и гидрофобия. Смерть наступает от паралича дыхательного или сосудодвигательного центра. По данным М. А. Селимова, примерно у 80 % больных заболевание длилось от трех до семи дней. Появившиеся сообщения I. Jillostonи соавторов об излечении больных от бешенства недостаточно убедительны.
Лабораторная диагностика.Для лабораторной диагностики бешенства во всех странах применяютиммунофлюоресцентныйанализ, гистопатологические исследования головного мозга и биопробу на кроликах или белых мышах.
Наиболее достоверными методами исследования мозга умершего является биопробапри интрацеребральном заражении лабораторных животных суспензией мозга и метод иммунофлюоресценции, заключающийся в обработке мазков-отпечатков мозга антирабическим флюоресцирующим гамма-глобулином для выявления вирусного антигена. Метод иммунофлюоресценции сравнительно экономичен и быстро воспроизводится: ответ получают в течение одного дня.
Гистопатологическиеисследования головного мозга основаны на выявлении телец Бабеша — Негри в цитоплазме больших нервных клеток аммонова рога, клеток коры головного мозга и мозжечка. Этот метод применяется довольно редко ввиду того, что в очагах природного типа циркулируют штаммы вируса, обладающие слабой негригенной активностью. Кроме того, новыми перспективными методами лабораторной диагностики являются методантирабических моноклональных антителииммунофлюоресцентный анализ кожных проб еще при жизни животного.
Лечение.Специфическое лечение не разработано. Применяются симптоматические средства с целью уменьшения страданий больного, снижения возбудимости нервной системы, улучшения сердечно-сосудистой деятельности. Для питания и восстановления потерь жидкости парентерально вводят солевые растворы, плазмозаменители, растворы глюкозы, витамины. Делают попытки лечения антирабическим иммуноглобулином в комплексе с реанимационными мероприятиями. Пока, однако, эти меры не привели к успеху.
Профилактика.Мероприятия по борьбе с бешенством и его профилактике основаны на классический триаде — обезвреживание или уничтожение источника инфекции, недопущение механизма передачи и создание невосприимчивости.
При бешенстве, как и при большинстве зоонозов, искоренение источника инфекции, особенно у диких животных, практически неосуществимо в силу экологических особенностей резервуара инфекции. Целью борьбы с эпизоотиями природного типа является поддержание численности животных, являющихся резервуаром бешенства, на определенном уровне. Специалисты считают, что плотность популяции, например, лисиц должна составлять 2-3 особи на 100 га.
В последнее время в США, Швейцарии, Канаде, Франции и Германии для профилактики бешенства диких животных используют оральную иммунизацию живой культуральной вакциной. Дозу вакцины в поливинилхлоридной упаковке помещают в куриные головки, которые раскладывают на местности. В течение 48 часов поедается до 63 % приманок. При оральной иммунизации не отмечают вирусоносительства и выделения вируса в окружающую среду.
Профилактика бешенства включает и комплекс мер по борьбе с эпизоотиями бешенства городского типа: предупреждение бродяжничества собак и кошек, обязательная их регистрация, профилактическая иммунизация домашних животных.
Предупреждение заболевания человека после укуса или ослюнения его бешеным или неизвестным животным осуществляется путем тщательной первичной обработки раны мыльным раствором или раствором перманганата калия и прижиганием концентрированной (10 %-ной) настойкой йода.
Прививки при бешенстве в большинстве случаев, за исключением вакцинации ветеринарных работников, лесников, персонала научно-исследовательских лабораторий, носят не профилактический, а лечебный характер и назначаются только при укусе бешеными или подозрительными на бешенство животными. При этом применяют три группы вакцин.
Мозговые, или нервно-тканевые, получаемые при внутримозговом заражении овец, кроликов, новорожденных белых крыс вакцинными штаммами вируса бешенства, инактивированные различными химическими веществами (фенол, эфир, формалин). У нас в стране применяется феноловая лиофилизированная антирабическая вакцина Ферми из мозга овец. Эти вакцины обладают значительной энцефалитогенностью, что приводит в отдельных случаях к развитию поствакцинальных осложнений.
В ряде стран применяются яичные живые антирабическиевакцины. В нашей стране такие вакцины не производятся и не применяются.
Культуральные вакцины.Это концентрированная инактиви-рованная культуральная антирабическая вакцина (КОКАВ) и куль-туральная антирабическая вакцина (КАВ). Она в 12-52 раза им-муногеннее мозговой референс-вакцины. В настоящее время
изучается специфическая активность КОКАВ при использовании сокращенных схем прививок (двух трехкратная иммунизация плюс две бустер инъекции).
Кроме антирабической вакцины, при укусах дикими животными назначается комбинированное лечение с применением антирабического гетерогенного (из сыворотки лошадей) иммуноглобулина в первый-второй день после укуса. Пассивное введение антител дает возможность удлинить инкубационный период болезни, в течение которого при помощи вакцины создается напряженный активный иммунитет. К недостатку антирабического иммуноглобулина относится довольно частое (15—20 % случаев) возникновение аллергических реакций разной степени тяжести. В настоящее время получен гомологический (из сыворотки человека) антирабический иммуноглобулин.
ВИРУС ИММУНОДЕФИЦИТА ЧЕЛОВЕКА
СПИД —синдром приобретенного иммунодефицита человека — одна из важнейших и трагических проблем, возникших перед человечеством в конце XX века. Суть этой проблемы заключается не только в том, что в настоящее время в мире многие миллионы людей инфицированы, что СПИД — это тяжелейшая экономическая проблема, поскольку содержание и лечение заболевших, разработка и производство диагностических и лечебных препаратов, проведение научных исследований уже сейчас стоят многие миллиарды, но и в том, что до сих пор нет радикального метода лечения и профилактики этой инфекции, вызывающей гибель больных в течение нескольких месяцев или лет.
Впервые СПИД как особое инфекционное заболевание, принявшее массовый характер, был зарегистрирован в 1981 году Центром по контролю за болезнями в Атланте (штат Джорджия, США). «Еженедельный вестник заболеваемости и смертности», выходящий в этой стране, сообщил о необычных формах пневмонии, вызванной условно-патогенными простейшими Рneumocystisсаrinii(пневмоцистной пневмонии), и злокачественной опухоли — саркомы Капоши у молодых людей, что не было ранее характерно для данного возраста. Кроме того, было установлено, что у таких больных развиваются другие инфекции (оппортунистические), вызванные условно-патогенными и патогенными бактериями, вирусами, грибами, простейшими и гельминтами. Данные свидетельствовали, что неизвестный возбудитель приводит к нарушению системы защиты организма, в частности клеточного и других звеньев иммунитета, и с 1982 года на страницах научных, а затем и публицистических изданий все чаще стали появляться статьи об «AIDS» (Аcquiredimmunodeficiencysyndrom) или в русском переводе — о СПИДе.
С самого начала было обращено внимание на то, что заболевшие СПИДом — люди с нетипичным сексуальным и социальным стилем жизни: гомосексуалисты, наркоманы. В дальнейшем группа риска, подверженная инфицированию, была расширена: в нее включили страдающих гемофилией, а также детей, рожденных от больных СПИДом матерей. За короткое время были зарегистрированы десятки случаев СПИДа, который передавался от человека к человеку, быстро прогрессировал, приводил к резкому ослаблению больных, присоединению сопутствующих инфекций и довольно быстрой гибели. Пути передачи заболевания указывали на его инфекционную природу, однако ни один из ранее изученных возбудителей не подходил с точки зрения распространения и характера поражений, вызываемых им в организме.
Поскольку иммунодефицитное состояние при СПИДе в основном затрагивает клеточно-зависимый иммунитет, было предположено, что новый инфекционный агент является патогенным для лимфоцитов, осуществляющих иммунные реакции, и проявляет к ним тропность (т. е. может в них размножаться). Такими свойствами обладали лишь некоторые представители особого семейства РНК-содержащих вирусов — ретровирусы, давно известные у животных. В поиск возбудителя СПИДа включились микробиологи, вирусологи, иммунологи, инфекционисты и в 1983—1984 годах были опубликованы данные о новом ретровирусе человека, вызывающем синдром приобретенного иммунодефицита.
Приоритет в открытии возбудителя принадлежит двум группам ученых, работавших независимо друг от друга: американским вирусологам из Национального ракового института США под руководством профессора Роберта Галло и французским специалистам из института Пастера в Париже, возглавляемым профессором Люком Монтанье. Ретровирус вначале было предложено назвать LAV (НТLV-Ш) от англ.Limphfdenopatyassociatedvirus(вирус, вызывающий лимфоаденопатию) иhumanТ-1уmphotropicvirus(вирус человека, обладающий тропизмом к Т-лимфоцитам), а в 1986 году по решению экспертов ВОЗ — НIV (от англ.Human immunodeficiency virus). В русской транскрипции — ВИЧ-1, или вирус иммунодефицита человека.
В настоящее время установлено существование нескольких разновидностей ВИЧ: НТLV-IY, LАV-2,SВL, АRVи др. Возбудители СПИДа — типичные ретровирусы, относящиеся к семействуRеtrоviridае. Название семейства связано с наличием у вирусов фермента ревертазы (обратной транскриптазы), с помощью которого с РНК-вируса в зараженных клетках синтезируется провирусная ДНК с последующим образованием провируса, интегрирующегося в клеточный геном.
Семейство разделяется на три подсемейства: Опсоvirinae(он-ковирусы), Sрumavirinае («пенящие» вирусы),Lentivirinае («медленные» вирусы). Большинство исследователей полагают, что ретровирусы ВИЧ принадлежат к подсемейству «медленных» вирусов, вызывающих заболевания с длительным инкубационным периодом, поражением мозга, суставов, крови, исхуданием и заканчивающихся смертью. Отличительной особенностью «медленных» вирусов является высокая степень генетической изменчивости, что особенно ярко выражено у ВИЧ.
Теории происхождения ВИЧ.Этот вопрос является весьма острым. Высказано немало предположений по данному поводу: от занесения вируса из космоса, до его «утечки» из лаборатории военного ведомства США, где он был искусственно создан. Некоторые авторы считают, что возбудитель СПИДа длительное время существовал в эндемичных регионах Центральной и Западной Африки, но глобальное распространение получил лишь в последние годы в связи с интенсивными транспортными связями и сопутствующими социальными явлениями (гомосексуализм, наркомания, свободные половые отношения).
Большинство же исследователей утверждают, что СПИД — это новое заболевание человека, а возбудитель его эволюционно сформировался лишь в последние десятилетия. В данном случае принципиальное значение приобретает открытие ретровируса обезьян. Близкие между собой разновидности этого вируса (SТLV-Шmас. иSТLV-IIIаgm.) вызывают у макак и африканских зеленых мартышек процессы, напоминающие СПИД у человека. Полагают, что вирусы обезьян, преодолев видовой барьер, явились генетическим началом для последующей эволюции ВИЧ. Лимфотропный вирус африканских зеленых мартышек широко распространен. Антитела к нему обнаружены у 70 % особей популяции обезьян в Уганде. Учитывая бессимптомное течение и широкое распространение у животных данной инфекции, следует предположить, что она исторически сформировалась давно. Поскольку африканские зеленые мартышки являются синантропным видом и живут вблизи поселений человека, существовала высокая вероятность неоднократного инфицирования последних данным возбудителем. С позиции межвидового перехода становится понятным, почему СПИД в настоящее время протекает тяжело и является летальным для людей.
Ш. Николь в 30-х годах сформулировал тезис о том, что стратегической позицией возбудителя является не гибель хозяина, а длительное сосуществование с ним, сохраняющее паразит как вид. В случае межвидового перехода пока еще не произошло взаимного приспособления и на первых этапах формирования его нередко наблюдается клинически тяжелое, порой губительное для хозяина течение болезни.
Выход возбудителя за границы эндемического очага или попадание в очаг чувствительных контингентов приводит к развитию острой, манифестной инфекции. В связи с этим считают, что историческое формирование ВИЧ произошло среди определенных изолятов аборигенов некоторых районов Центральной Африки, а при распространении возбудителя на новые континенты начался широкий эпидемический процесс. В целом проблема происхождения и эволюции возбудителя СПИДа еще далека от разрешения.
Морфология и антигенная структура.Возбудитель ВИЧ-ин-фекции — сложный по строению и химическому составу вирус (см. вкл. VIII). Вирион имеет округлую форму, электронноплотную сердцевину (покрытую белковым капсидом) и внешнюю оболочку, состоящую из двойной липидной мембраны, которую вирус приобретает в клетке из ее компонентов. Описаны две морфологические формы возбудителя: одна имеет диаметр частиц 120 нм и полиморфную сердцевину, вторая диаметром 90 нм и с цилиндрической сердцевиной. Сердцевина ВИЧ не полностью заполняет объем вириона, содержит две молекулы РНК, фермент ревертазу и пять видов белка. От внешней мембраны вируса отходят отростки диаметром 15 и высотой 9 нм, в состав которых входят гликопротеидыgр41 и gр120. В настоящее время расшифрована последовательность нуклеотидов вируса, изучена его генетическая структура.
Антигениыми свойствамиобладают, вероятно, все вирусные белки и их клеточные предшественники. Особенно важную роль в биологии вируса и патогенезе инфекции играют гликопротеиды внешней оболочки. Они имеют защитную функцию, определяют инфекционность вируса, являются протективными антигенами, с ними в основном связан высокий уровень изменчивости ВИЧ и его иммунодепрессивное и цитолитическое действие.
Возбудитель СПИДа характеризуется очень высокой генетической и, соответственно, антигенной вариабельностью. Скорость замены нуклеотидов в генах, кодирующих синтез гликопротеидов оболочки (gр41 и особенно gр120) и внутренних белков, входящих в состав сердцевины и капсулы, в сотни раз превышают соответствующий показатель других вирусов, даже наиболее изменчивого из них — вируса гриппа. Несмотря на такой уровень трансформации у вариантов ВИЧ остаются общие антигенные детерминанты, так как почти у всех больных СПИДом выявляются антитела к белкам одного прототипного вируса.
источник
Вирусы [от лат. virus, яд] — наименьшие по размерам агенты, имеющие геном, окружённый белковой оболочкой. Вирусы не воспроизводятся самостоятельно, они — облигатные внутриклеточные паразиты, репродуцирующиеся только в живых клетках. Все вирусы существуют в двух формах. В настоящее время известны вирусы бактерий (бактериофаги), грибов, растений и животных.
Внеклеточная форма — вирион — включает в себя все составные элементы (капсид, нуклеиновую кислоту, структурные белки, ферменты и др.). Внутриклеточная форма — вирус — может быть представлена лишь одной молекулой нуклеиновой кислоты, так как, попадая в клетку, вирион распадается на составные элементы.
Несмотря на внутриклеточный паразитизм, среди вирусов имеются крупные виды, соизмеримые по размерам с микоплазмами и хламидиями. Например, вирус натуральной оспы достигает 400 нм и вполне сравним с риккетсиями (300-500 нм) и хламидиями (300-400 нм). По морфологии выделяют вирусы палочковидные (например, возбудитель лихорадки Эбола), пуле-видные (вирус бешенства), сферические (герпесвирусы), овальные (вирус оспы), а также бактериофаги, имеющие сложную форму (рис. 2-1). При всём разнообразии конфигураций, размеров и функциональных характеристик вирусам присущи некоторые общие признаки. В общем виде зрелая вирусная частица (вирион) состоит из нуклеиновой кислоты, белков и липидов, либо в его состав входят только нуклеиновые кислоты и белки.
Вирусы содержат только один тип нуклеиновой кислоты, ДИК или РНК, но не оба типа одновременно. Например, вирусы оспы, простого герпеса, Эпстайна-Барр — ДНК-содержащие, а тогавирусы, пикорнавирусы — РНК-содержащие. Геном вирусной частицы гаплоидный. Наиболее простой вирусный геном кодирует 3-4 белка, наиболее сложный — более 50 полипептидов. Нуклеиновые кислоты представлены однонитевыми молекулами РНК (исключая реовиру-сы, у которых геном образован двумя нитями РНК) или двухнитевыми молекулами ДНК (исключая парвовирусы, у которых геном образован одной нитью ДНК). У вируса гепатита В нити двухнитевой молекулы ДНК неодинаковы по длине.
Вирусные ДНК образуют циркулярные, ковалентно-сцёпленные суперспирализованные (например, у паповавирусов) или линейные двухнитевые структуры (например, у герпес- и аденовирусов). Их молекулярная масса в 10-100 раз меньше массы бактериальных ДНК. Транскрипция вирусной ДНК (синтез мРНК) осуществляется в ядре заражённой вирусом клетки. В вирусной ДНК на концах молекулы имеются прямые или инвертированные (развёрнутые на 180″) повторяющиеся нуклеотидные последовательности. Их наличие обеспечивает способность молекулы ДНК замыкаться в кольцо. Эти последовательности, присутствующие в одно- и двух-нитевых молекулах ДНК, — своеобразные маркёры вирусной ДНК.
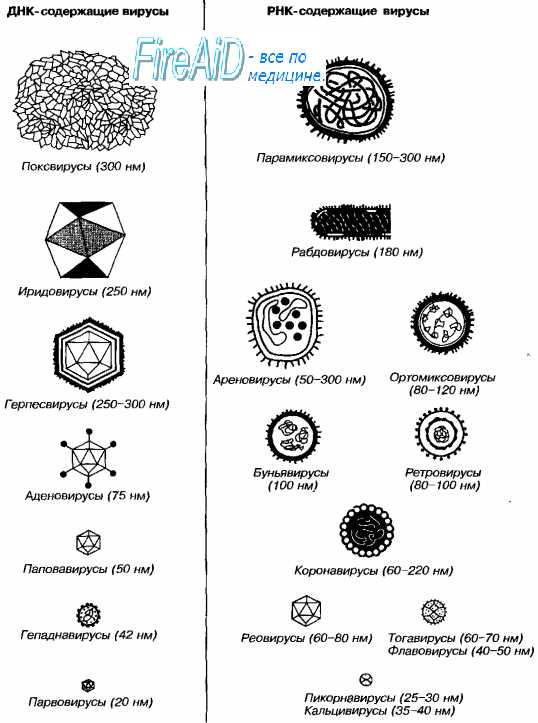
Вирусные РНК представлены одно- или двухнитевыми молекулами. Однонитевые молекулы могут быть сегментированными — от 2 сегментов у ареновирусов до 11 — у ротавирусов. Наличие сегментов ведёт к увеличению кодирующей ёмкости генома. Вирусные РНК подразделяют на следующие группы: плюс-нити РНК (+РНК), минус-нити РНК (-РНК). У различных вирусов геном могут образовывать нити +РНК либо -РНК, а также двойные нити, одна из которых -РНК, другая (комплементарная ей) — +РНК.
Плюс-нити РНК представлены одиночными цепочками, имеющими характерные окончания («шапочки») для распознавания рибосом. К этой группе относят РНК, способные непосредственно транслировать генетическую информацию на рибосомах заражённой вирусом клетки, то есть выполнять функции мРНК. Плюс-нити выполняют следующие функции: служат мРНК для синтеза структурных белков, матрицей для репликации РНК, упаковываются в капсид с образованием дочерней популяции. Минус-нити РНК не способны транслировать генетическую информацию непосредственно на рибосомах, то есть они не могут функционировать как мРНК. Однако такие РНК служат матрицей для синтеза мРНК.
Многие вирусные нуклеиновые кислоты инфекционны сами по себе, так как содержат всю генетическую информацию, необходимую для синтеза новых вирусных частиц. Эта информация реализуется после проникновения вириона в чувствительную клетку. Инфекционные свойства проявляют нуклеиновые кислоты большинства +РНК- и ДНК-содержащих вирусов. Двухнитевые РНК и большинство -РНК не проявляют инфекционных свойств.
источник
специфичные в отношении вируса бешенства нейтрализующие моноклональные антитела человека и нуклеиновые кислоты и связанные с ними способы
| Классы МПК: | C07K16/08 против материала из вирусов C12N15/13 иммуноглобулины C12N15/63 введение чужеродного генетического материала с использованием векторов; векторы; использование их хозяев; регулирование экспрессии A61K39/42 вирусные A61P31/12 противовирусные средства | ||||||||||||||||||||||||||||||||||||||||||||
| Автор(ы): | ХУПЕР Дуглас К. (US) , ДИТЦШОЛЬД Бернхард (US) | ||||||||||||||||||||||||||||||||||||||||||||
| Патентообладатель(и): | ТОМАС ДЖЕФФЕРСОН ЮНИВЕРСИТИ (US) | ||||||||||||||||||||||||||||||||||||||||||||
| Приоритеты: | |||||||||||||||||||||||||||||||||||||||||||||
| Таблица 1 Нейтрализация вируса бешенства под действием HRIG и моноклоналыюго антитела с SEQ ID NO:3/SEQ ID NO:4 | ||
| Изолят вируса бешенства (источник образца) | HRIG | Mab |
| (1) Енот (Procyon lotor), восточная область США | + | — |
| (2) Скунс (Mephitis mephitis), северная и центральная области США | + | — |
| (3) Скунс (М.mephitis), южная и центральная области США | + | — |
| (4) Скунс (М.mephitis),Калифорния, США | + | — |
| (5) Серая лисица (Urocyon cinereoargenteus), Техас, США. | + | — |
| (6) Серая летучая мышь (Lasiurus cinereus) | — | |
| (7) Летучая мышь кожан бурый (Eptesicus fuscus), Нью Йорк, США | + | — |
| (8) Летучая мышь кожан бурый (E.fuscus), Вашингтон, США | + | — |
| (9) Летучая мышь вечерник серебристый (Lasionycteris noctivagans), США | + | — |
| (10) Собака, граница США-Мексика | + | — |
| (11)Собака, Таиланд | + | — |
| (12) Собака, Филиппины | + | — |
| (13) Арктическая лисица (Alopex lagopus), Аляска, США | + | — |
Эксперимент in vivo, по оценке эффективности нейтрализации вируса моноклональным антителом, состоящим из тяжелой цепи с аминокислотной последовательностью SEQ ID NO: 3 и легкой цепи с аминокислотной последовательностью SEQ ID NO: 4, был проведен с использованием выделенного вируса бешенства техасского койота. В качестве чувствительной модели использовали сирийских хомячков. Группе из шести испытуемых животных и группе из десяти контрольных животных вводили в правую икроножную мышцу (gastrocnemius) 50 мкл гомогената слюнной железы койота, инфицированного (в естественных условиях) вирусом бешенства, в разведении 1:1000. Через 24 часа хомячкам вводили 50 мкл моноклонального антитела с концентрацией 0,68 мг/мл, что эквивалентно приблизительно 0,24 ME противорабической активности.
Результаты эксперимента показали, что имеется достоверное различие в длительности выживания для двух групп (р=0.0075). Различие определено по критерию Манна-Уитни.
Для наглядности результаты представлены графически. Прямоугольники отражают результаты выживания в диапазоне 25-75 персентилей. Медиана (50 персентилей) в группе, получившей антитело, выделена в виде линии внутри прямоугольника. Интервальные отметки показывают разброс данных как максимальный и минимальный результат внутри группы.
1. Антитело, которое нейтрализует вирус бешенства, включающее полипептид тяжелой цепи, имеющий по меньшей мере 80%-ную гомологию по отношению к аминокислотной последовательности SEQ ID NO:3, и полипептид легкой цепи, имеющий по меньшей мере 80%-ную гомологию по отношению к аминокислотной последовательности SEQ ID NO:4.
2. Антитело по п.1, включающее полипептид тяжелой цепи, имеющий по меньшей мере 90%-ную гомологию по отношению к аминокислотной последовательности SEQ ID NO:3, и полипептид легкой цепи, имеющий по меньшей мере 90%-ную гомологию по отношению к аминокислотной последовательности SEQ ID NO:4.
3. Антитело по п.1 или 2, которое представляет собой антитело человека.
4. Антитело по п.1 или 2, которое представляет собой антитело IgG1.
5. Антитело по п.2, включающее полипептид тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO:3, и полипептид легкой цепи, имеющий аминокислотную последовательность SEQ ID NO:4.
6. Фрагмент антитела, охарактеризованного в любом из пп.1-5, нейтрализующий вирус бешенства, где указанный фрагмент выбран из группы, состоящей из Fv фрагментов, Fab фрагментов и F(ab’) 2 фрагментов.
7. Выделенная нуклеиновая кислота, которая кодирует полипептид, содержащий аминокислотную последовательность SEQ ID NO:3, где полипептид содержит тяжелую цепь антитела, нейтрализующего вирус бешенства.
8. Нуклеиновая кислота по п.7, включающая нуклеотидную последовательность SEQ ID NO:1, кодирующую аминокислотную последовательность SEQ ID NO:3.
9. Выделенная нуклеиновая кислота, которая кодирует полипептид, содержащий аминокислотную последовательность SEQ ID NO:4, где полипептид содержит легкую цепь антитела, нейтрализующего вирус бешенства.
10. Нуклеиновая кислота по п.9, включающая нуклеотидную последовательность SEQ ID NO:2, кодирующую аминокислотную последовательность SEQ ID NO:4.
11. Экспрессирующий вектор, включающий по меньшей мере одну нуклеиновую кислоту по любому из пп.7-10.
12. Вектор по п.11, включенный в клетку-хозяин.
13. Способ лечения субъекта, подвергшегося воздействию вируса бешенства, включающий введение указанному субъекту терапевтически эффективного количества антитела по любому из пп.1-5 или фрагмента по п.6.
14. Способ по п.13, в котором антитело или фрагмент применяют в месте укуса субъекта или вводят системно.
источник