2018. Китайский профессор объявил о рождении генетически модифицированных детей
Китайский товарищ Хе Цзянькуя из Шэньчжэньского университета объявил что (впервые в мире) ему удалось отредактировать человеческую эмбриональную клетку, так что в результате родился ребенок, и даже два — близняшки Лулу и Нана. Говорит, что использовал технологию редактирования ДНК — CRISPR-Cas9 и затем, искусственное оплодотворение. Целью редактирования было наделить детей невосприимчивостью к ВИЧ — выключить ген CCR5, который связан с формированием белка, позволяющего вирусу попасть в клетку. Из 7 пар, участвовавших в эксперименте, беременности удалось добиться лишь в одном случае. Однако, доказательств — нет. Личности близняшек Хе не раскрывает из соображений конфиденциальности, а руководство Шэньчжэньского университета вообще говорит, что было не в курсе экспериментов ученого.
2018. Генетический тест позволит выбрать самого лучшего эмбриона
Пока родители еще не могут оптимизировать ДНК будущего ребенка (хотя прогресс и в этом направлении есть), но зато уже сегодня можно проверить эту ДНК перед оплодотворением (искусственным конечно). Компания Genomic Prediction разработала тесты генетического скрининга, которые могут предсказывать риск некоторых заболеваний или слабоумия у будущих детей. Например, так можно выявить эмбрионов с муковисцидозом или синдромом Дауна. Более того, Genomic Prediction говорит, что может примерно предсказать уровень IQ будущего ребенка. Т.е. появляется возможность выбрать не только более потенциально-здорового эмбриона, но и эмбриона с потенциально более высоким IQ. Компания уже начала переговоры с несколькими клиниками искусственного оплодотворения для использования такого скрининга по запросу клиентов.
2016. В Великобритании начались эксперименты по изменению генома человеческих эмбрионов
Хотя в конце прошлого года ведущие ученые мира специально встретились и договорились пока не редактировать ДНК человеческих эмбрионов, британские ученые — наплевали на это соглашение и получили от государственного регулятора разрешение на эксперименты по редактированию генома эмбрионов человека. Этим будет заниматься исследовательская группа биолога Кэти Ниакан из Института Фрэнсиса Крика. Первые генетически изменённые эмбрионы появятся, как ожидается, в начале лета этого года. Первичной целью исследования будет сокращение числа выкидышей и лечение бесплодия. Однако, в будущем эта технология может стать инструментом для улучшения здоровья детей еще до их рождения. Редактирование генома будет производиться с помощью молекулярной системы CRISPR. Учёным дозволено использовать модифицированные эмбрионы только для фундаментальных исследований — подсаживать их суррогатной матери строго запрещено.
2014. В Израиле научились лечить бесплодие стволовыми клетками
В Израиле успешно опробована новая методика лечения женского бесплодия. Автор методики — директор Центра лечения бесплодия доктор Элиягу Бар. Он предложил использовать в курсе терапии стволовые клетки самих женщин. Пациентка, не могущая забеременеть вследствие повреждения эндометрия, прошла курс лечения собственными стволовыми клетками. До этого женщина 15 раз безуспешно проходила процедуру ЭКО. В рамках новой методики лечение проходило в два этапа. На первом этапе из жировой ткани пациентки были извлечены стволовые клетки. Затем они были помещены в матку, в результате чего эндометрий стал восстанавливаться. Параллельно с этим женщина проходила курс подготовительной гормональной терапии; затем в матку пациентки был подсажен эмбрион. На этот раз беременность наступила.
2013. Первый ребенок, которого родили выбрав эмбрион с лучшим ДНК
Возможно, уже скоро нормальные семьи будут зачинать ребенка только через искусственное оплодотворение. Зачем? Чтобы выбрать пол ребенка и обеспечить ему хорошее здоровье. Ведь теперь появилась возможность относительно недорого провести расшифровку ДНК эмбриона и определить его предрасположенность к серьезным заболеваниям. Коннор Леви, рожденный 18 мая в США — это первый ребенок, который прошел такой искусственный отбор. Его родители решали свои проблемы с бесплодием, и в одной из клиник перед искусственным оплодотворением им предложили провести анализ ДНК. Всего у них получилось создать 13 эмбрионов (оплодотворенных яйцеклеток), и из них был выбран лучший — с оптимальным набором хромосом. Затем его поместили в матку матери, и результат вы можете видеть на фотографии выше.
2013. Хирургический робот Magellan начал оперировать фиброиды
Фиброиды — это доброкачественные опухоли матки — одна из наиболее частых причин женского бесплодия. До последнего времени одним из основных методов борьбы с фиброидами ***
источник
Это могут быть изменения в количестве и структуре хромосом, мутации отдельных фрагментов ДНК и т.д. Выявлением различных генетических нарушений занимается врач-генетик. К методам генетической диагностики причисляются цитогенетические исследования, которые могут проводиться на молекулярном уровне с целью изучения отдельных фрагментов ДНК и единичных генов.
Современная медицина пока не в силах вылечить генетические нарушения, однако своевременная постановка верного диагноза во многих случаях позволяет решить проблему бесплодия с помощью вспомогательных репродуктивных технологий и рождения здорового потомства. Эффективны они бывают тогда, когда точно установлена причина нарушения репродуктивной функции, поэтому генетические исследования часто входят в программу подготовки к ЭКО.
В обязанности врача-генетика входит:
- планирование и проведение комплексного генетического обследования;
- проведение анализа полученных результатов и постановка диагноза;
- расчет рисков для будущего потомства, связанных с обнаруженными генетическими отклонениями;
- выбор метода предимплантационной диагностики эмбрионов , который позволит обойти имеющиеся генетические проблемы.
Всем женщинам после 35 лет, которые планируют беременность, необходимо пройти консультацию генетика и сдать анализ на кариотип.
Семейным парам может потребоваться консультация генетика в следующих случаях:
- была обнаружена генная мутация или носительство аномального кариотипа;
- присутствует задержка полового развития или диагностировано первичное бесплодие;
- женщина имеет первичную или вторичную аменорею;
- мужчина страдает тяжелым нарушением сперматогенеза неясной этиологии;
- женщина имела два и более преждевременных прерываний беременности на раннем сроке;
- предыдущая беременность завершилась рождением мертвого ребенка;
- предыдущий ребенок был рожден с тяжелыми пороками развития;
- в ходе перинатальной диагностики у плода обнаружилась хромосомная аномалия;
- супружеская пара планирует проведениеЭКО, особенно если возраст женщины превышает 35 лет;
- ранее уже было проведено две и более неудачных попыток ЭКО.
Самой частой генетической причиной женского и мужского бесплодия становятся структурные и численные изменения кариотипа. В случаях первичного бесплодия аномальный кариотип выявляется примерно у 15% мужчин, в эякуляте которых отсутствуют сперматозоиды. Подобные изменения выявляются и у 30% женщин с первичной аменореей.
Преждевременная менопауза или синдром истощения яичников у женщин также может быть вызван генетическими причинами. До развития патологии женщина может иметь нормальный менструальный цикл и рожать детей. Причиной синдрома часто становится премутация гена FMR1. Полная его мутация приводит к синдрому Мартина-Белла – самой распространенной форме умственной отсталости после синдрома Дауна.
Среди наиболее часто встречающихся генетических причин мужского бесплодия можно выделить потерю определенных участков Y-хромосомы, что приводит к нарушениям сперматогенеза (азооспермия, олигоспермия и т.д.). В этом случае решить проблему бесплодия поможет метод ИКСИ. А для предотвращения передачи мутационного гена потомству супруги могут прибегнуть к процедуре преимплантационной диагностики эмбриона.
Генетическая диагностика эмбриона, проводимая на 3 сутки развития эмбриона, позволяет выявить возможные наследственные заболевания. Хотя не все патологии могут быть выявлены в ходе такого исследования, оно все же является весьма информативным и дает возможность обнаружить отклонения в количестве хромосом и их структуре.
Обычно предимплантационная генетическая диагностика рекомендуется в ситуациях, когда супружеская пара имеет повышенный риск родить ребенка с генетическими отклонениями. К тому же наличие хромосомных патологий может снизить вероятность имплантации эмбриона в матке, привести к невынашиванию беременности или рождению ребенка с умственными и физиологическими аномалиями.
Генетическая диагностика эмбриона осуществляется в цикле экстракорпорального оплодотворения еще до его переноса в матку. После проведения процедуры PGD пациентке переносятся только здоровые эмбрионы. Кроме всего прочего, предимплантационная генетическая диагностика позволяет заранее уточнить пол ребенка.
Показания к предимплантационной генетической диагностике:
- возраст супруги старше 35 лет;
- возраст супруга старше 39 лет;
- носительство хромосомных мутаций, трансолокаций и прочих хромосомных и генетических аномалий;
- имевшие место ранее выкидыши (два и более);
- две и более ранее проведенные неудачные попытки ЭКО.
Таким образом, при проведении ЭКО предимплантационная диагностика дает возможность выбрать для переноса исключительно здоровые эмбрионы. Это значительно снижает риски рождения ребенка с генетическими патологиями, а также увеличивает шансы на успешное вынашивание беременности.
Уже во время беременности проводится ряд диагностических исследований, позволяющих оценить развитие плода. Ряд патологий можно выявить при помощи такой методики, как биопсия ворсин хориона – клеток и тканей, окружающих плод. Определенные аномалии можно обнаружить и при исследовании амниотической жидкости и при проведении УЗИ.
В заключение стоит отметить, что при ЭКО, также как и при естественном зачатии, не может быть дана стопроцентная гарантия, что ребенок родится без невыявленных патологий физического или умственного развития. Однако риски развития генетических патологий у детей, рожденных после ЭКО, ничуть не выше, чем у детей, зачатых естественным образом.
Наиболее распространенные методы предимплантационной диагностики:
С целью исключения генетической патологии плода после 9 недель успешно применяется неинвазивный (по анализу крови матери) пренатальный тест.
Панорама-тест – он позволяет выявить такие генетические заболевания, как:
- Синдром Дауна, чувствительность > 99%
- Синдром Эдвардса, > 99%
- Синдром Патау, чувствительность > 99%
- Синдром Тернера, чувствительность 91,7%
- Обнаружение триплоидий Да
- Определение пола, мужской > 99,9%
- Определение пола, женский > 99,9%
- Половые хромосомы — отсутствие или дополнительная копия Да
- Некоторые делеционныедупликационные синдромы Да
Вы можете платно записаться на консультацию врача-генетика в нашей клинике «Новая Жизнь», г. Москва.
источник
Трансплантация органов и тканей — сложный, но весьма эффективный инструмент в борьбе со смертельно опасными заболеваниями. Многочисленные пересадки сердца, печени, почек, продлившие жизни тысяч безнадежных, казалось бы, пациентов, стали вполне штатными операциями. Сегодня хирурги и физиологи стремятся расширить сферу возможностей медицины и вывести трансплантологию на принципиально новый уровень. Так сказать, освоить те области, о которых раньше могли помыслить только писатели-фантасты.
Что же реально дала человечеству модификация живых организмов на генетическом уровне? По сути, биотехнология или генетическая инженерия (ГИ) — это совокупность методик, позволяющих вычленять отдельные гены из клеток, вводить их в генотип других организмов и получать рекомбинантные (т. е. расщепленные и собранные заново) ДНК и РНК. Более того, расшифровка последовательности аминокислот в белках позволяет искусственно синтезировать необходимые гены из базовых нуклеотидов.
Практическая сложность работы биотехнологов укладывается в обманчиво простой алгоритм. Если внедрить ранее выделенный или «собранный вручную» ген в ДНК живой клетки, она начнет воспроизводить требуемый белок. Это открывает поистине неограниченные возможности.
Хотим мы того или нет, генетическая модификация ненавязчиво, но прочно закрепилась в современной медицине. Ее достаточно широкое распространение объясняется бесценной возможностью перекраивания реалий под свои нужды.
Первый успех ГМО
Последствия такого тяжелого заболевания, как диабет, известны во всем мире. В первую очередь оно поражает сердечно-сосудистую и нервную системы, что влечет за собой угнетение всех функций организма. Ежегодно миллионы людей пополняют печальную статистику заболевших, и единственное, по сути, на что могут положиться диабетики, — это инсулин.
Вплоть до 80-х годов прошлого века препарат производился по технологии 1925 года — путем извлечения гормона из коровьей или свиной поджелудочной железы. Такой способ производства едва покрывал 10% потребностей. Учитывая же современные темпы распространения болезни, он не справился бы со столь массовым спросом на инсулин даже с применением полусинтетических методик. Широкодоступный сейчас препарат стал бы критически дефицитным, если бы не прорыв, совершенный совместными усилиями ученых из НИИ Бекмана и биотехнологической корпорации Genentech. В 1978 году Артур Риггс и Кэйити Итакура при участии Герберта Бойера успешно использовали технологию рекомбинантной ДНК для внедрения гена синтеза человеческого инсулина в геном бактерий — пекарских дрожжей и кишечной палочки. Клетки полученных в результате эксперимента генетически модифицированных бактерий успешно росли, делились и в результате своей незатейливой жизнедеятельности вырабатывали инсулин, идентичный человеческому.
Синтетический человеческий инсулин стал первым одобренным для использования лекарством, полученным путем генной инженерии. По сей день он считается одним из лучших препаратов, поддерживающих жизнь диабетиков по всему миру, а испытанная при его создании технология прочно вошла в обиход фармацевтических предприятий. Уже в 2000 году количество лекарств, полученных аналогичным путем, перевалило за сотню и продолжает расти.
В последние десятилетия правительства многих стран дали добро на разработку инновационных вакцин. Причины развязывания рук исследователей на государственном уровне вполне понятны: катастрофическое распространение устойчивых к антибиотикам микроорганизмов, рост числа заболевших теми инфекциями, с которыми раньше удавалось успешно справляться, банальное отсутствие эффективных вакцин против туберкулеза, СПИДа и малярии…
Для борьбы с этой напастью из невидимого невооруженным глазом мира создаются рекомбинантные вакцины. Таким способом уже удалось получить эффективные вакцины против гепатита В и вируса папилломы человека.
Для создания прививок методами генной инженерии из ДНК патогенного организма выделяется ген, кодирующий продукцию вызывающего иммунную реакцию белка, после чего ген встраивается в плазмиду, стабильную молекулу ДНК нейтрального микроорганизма, например дрожжевой бактерии. Готовый антиген вводят в культуру для последующего самокопирования путем клеточного деления, после чего молекулу вновь выделяют, очищают и используют в качестве вакцины. Проще говоря, все эти высокоточные манипуляции позволяют получить белки, безопасные для человека, но при этом вызывающие такой же иммунный ответ, как и болезнетворный гость. Попадая в организм, модифицированная молекула запускает в клетках самого тела синтез чужеродных протеинов, которые могут быть распознаны иммунной системой и нейтрализованы.
К сожалению, большинство подобных препаратов пока еще обладают недостаточной иммуногенностью, но работы по исправлению этого недостатка ведутся неустанно.
Следующей ступенью эволюции биотехнологий в медицине стала генотерапия, хоть ее методы пока находятся на стадии экспериментальных разработок. В ее основе лежит будоражащая воображение идея о коррекции наследственных и приобретенных генетических недостатков живого организма.
Важнейшая проблема, препятствующая внедрению генной терапии в медицинскую практику уже сейчас, — обеспечение эффективной трансфекции, доставки генов к клеткам-«мишеням». Наиболее перспективными считаются методики транспортировки встроенной в плазмиду модифицированной ДНК или молекулы в составе неонкогенных вирусных частиц.
Согласитесь, подобные замыслы привычнее видеть на страницах научно-фантастических романов. Тем не менее будущее планирует наступить раньше, чем может показаться.
30 августа 2017 года свершилось историческое событие, которое в ближайшие годы полностью изменит процесс лечения онкологии. Экспертный совет американского Управления по контролю продуктов питания и лекарств (FDA) единогласно одобрил генную терапию острого лимфобластного лейкоза детей и взрослых до 25 лет, разработанную группой ученых из Университета Пенсильвании и компании Novartis. С помощью модифицированного вируса иммунодефицита в собственные Т-лимфоциты пациента внедряется ген, помогающий распознавать и уничтожать злокачественные клетки. Звучит невероятно, но ВИЧ в буквальном смысле «учит» клетки организма бороться с раком!
Правда, успевший снискать славу революционного препарат, выпущенный на рынок под названием Kymriah, еще далеко не совершенен. Из-за ряда опасных побочных действий его можно применять только в клиниках под надзором прошедших специальную подготовку докторов. Хотя тот факт, что во время испытаний у 83% пациентов с острым лейкозом наступила ремиссия, позволяет решиться на этот рискованный шаг с оптимизмом.
В дальнейшем генная терапия сможет применяться для исправления дефектов центральной нервной системы, заболеваний сердца и сосудов, гемофилии, коррекции иммунного ответа (в т. ч. ВИЧ) и даже мутаций генома.
Некоторым гематологическим, кардиологическим, эндокринологическим и противовирусным лекарствам жизненно необходимо максимально соответствовать естественным аналогам в человеческом организме. В этом плане синтетические препараты имеют ряд неоспоримых преимуществ. Во-первых, в отличие от лекарств, получаемых из секреции животных, они аналогичны человеческим по структуре. Во-вторых, генная модификация в фармацевтике позволила отказаться от неподдающегося полной очистке специфического сырья, как, например, гипофизы трупов или моча женщин в менопаузе. И в-третьих, решающим фактором нередко оказывается дешевизна и рациональность производства. Для производства 200 граммов очищенного порошка инсулина необходима 1000 литров питательной среды, населенной генетически модифицированными бактериями, или 6000 коров, из чьих поджелудочных желез посмертно будет извлечен ценный гормон.
Когда вопрос встает таким «ребром», тысячи подопытных животных, принесенных в жертву прогрессу, кажутся меньшим из зол.
Несмотря на заметные, почти что футуристические успехи, медицинская генная инженерия остается областью, которую ученые только начинают осваивать.
По-прежнему остается масса чисто технологических трудностей, не говоря уже о несовершенстве способов преодоления иммунной реакции организма и риска заражения при использовании модифицированных вирусов. Тем не менее маячащие на горизонте светлого будущего перспективы заставляют упорных исследователей без сожаления поступаться принципами и страхами.
источник
Генетика – это наука, занимающаяся изучением наследственности человека. На ней основывается огромное количество медицинских исследований, но до сих пор остается много неизвестного. У некоторых людей генетические отклонения диагностируются при рождении, у других – намного позже. Генетическое бесплодие врач выявляет только в репродуктивном возрасте женщин и мужчин.
В генах человека заложена информация, которая требуется для оплодотворения яйцеклетки. По отдельности гены формируют белок, выстраивающий организм. Дети получают от родителей по 2 копии каждого гена.
Генетические факторы – основные проблемы генетического бесплодия. Они проявляются у женщин и мужчин из-за мутации хромосом. Когда специалист ставит диагноз генетического бесплодия, то предполагает нарушение количества хромосом или их структуры. В связи с этим при проблемах зачатия обследование проводится для обоих супругов.
Мутирующие хромосомы явно не выражаются в организме человека, но и бывают редкие исключения. Когда доктора ставят диагноз «генетическое бесплодие», он предполагает изменение числа хромосом или нарушение их структур. Поэтому пройти обследования должны оба супруга.
Этиология генетического бесплодия заключается в нарушении структуры и количества хромосом. Подобные отклонения бывают:
- регулярными – затрагивают все клетки тела;
- мозаичными – формируют клон клеток.
У здоровых женщин тоже выявляются аномалии хромосом – например, увеличение или уменьшение числа Х-хромосом. У представителей мужского пола генетическое бесплодие чаще всего возникает под влиянием наличия дополнительной Х-хромосомы или из-за аномального набора хромосом.
Генетические нарушения провоцируют следующие проблемы с вынашиванием ребенка:
- выкидыши на начальных сроках беременности – до 12 недель;
- остановка развития плода;
- проблемы со свертываемостью крови;
- преждевременное развитие менопаузы;
- отсутствие менструального цикла.
У мужчин генетический фактор бесплодия, как правило, выявляется в 30 – 60% случаев. Причинами становятся генетические патологии:
- Олигозооспермия – недостаточное число активных сперматозоидов для естественного оплодотворения.
- Патологии в строении хромосом, которые провоцируют самопроизвольные выкидыши у женщины, реже происходит мертворождение.
- Двусторонние патологии семявыводящих протоков.
- Недоразвитие семявыводящих протоков, когда в сперме отсутствуют сперматозоиды или они совсем неактивные.
- Азооспермия – недостаточная активность сперматозоидов.
К причинам генетического бесплодия также относятся: синдром Дауна, анемия некоторых форм, неправильное функционирование эндокринной системы, миотонические дистрофии.
У представительниц женского пола генетический фактор бесплодия зачастую диагностируется только на первых неделях беременности – происходит выкидыш. Если произошло 2 и больше выкидышей на ранних сроках, врач направляет пациентку на прохождение диагностики для выявления отклонений в строении хромосом. Причинами генетического бесплодия являются:
- Поликистоз яичников – излечимая болезнь.
- Эндометриоз – провоцирует самопроизвольные аборты.
- Адреногенитальный синдром – вызывает отклонения в строении хромосом у ребенка.
- Первичная аменорея – отсутствие менструации, что и становится причиной бесплодия.
- Генетические патологии, которые связаны со свертываемостью крови, провоцирующие выкидыши.
Если беременность не наступает в течение 2 лет, а в анамнезе женщины указано несколько самопроизвольных выкидышей на раннем сроке беременности, то гинеколог назначает прием у генетика. Этот врач обязательно проводит цитогенетическое и молекулярно-генетическое обследование пары.
У женщины должны быть в норме:
- менструальный цикл;
- концентрация гормонов в крови;
- проходимость маточных труб.
У мужчины должны быть в норме:
- качество спермы;
- отсутствие таких патологий, как гепатит В или С, ВИЧ, хламидий, кори и т.п.
Для точности диагноза дополнительно организуется рентгеноскопическое и эндоскопическое исследование. Они проводятся в амбулаторном порядке и достаточно быстро. Затем врач ставит диагноз и подбирает подходящее лечение.
При подтверждении генетического бесплодия проводится следующая терапия для получения возможности иметь детей:
- Искусственное оплодотворение – в матку искусственно вводится сперма партнера. Тем самым повышая возможность зачатия.
- ЭКО – оплодотворение яйцеклетки проводится в лабораторных условиях, а затем эмбрион подсаживается в матку женщины.
- ИКСИ – обычно реализуется для мужчин – метод заключается в отборе лучших сперматозоидов для последующего оплодотворения яйцеклетки.
Если не получается забеременеть какой-то отрезок времени не спешите самостоятельно ставить сами себе диагноз. Обратитесь к специалистам, которые помогут установить истинную причину. Генетическое бесплодие для супружеских пар звучит как приговор, но не стоит отчаиваться. Современные методы обследования и лечения делают чудеса.
источник
Генная инженерия человека нам, простым обывателям, все еще кажется чем-то из области научной фантастики. Тем неожиданней было сообщение издания «The Telegraph», в котором говорилось, что Совет по этике в Великобритании разрешил генную инженерию человеческих эмбрионов. Понятно, что от рекомендаций Совета по этике до закона о генетических вмешательствах «дистанция огромного размера», однако первый шаг, похоже, сделан.
« The Telegraph» обратился за комментарием к профессору Карен Юнг, председателю рабочей группы по редактированию генома и воспроизводству человека. Госпожа профессор заявила, что в будущем в числе репродуктивных технологий может оказаться и внесение наследуемых изменений генома для обеспечения определенных характеристик детей. Сперва, разумеется, таким способом будут бороться с наследственными заболеваниями, но потом «если технология будет успешно развиваться, у нее есть потенциал стать альтернативной репродуктивной стратегией, доступной родителям для достижения более широкого круга целей».
На вопрос, можно ли использовать генетическое редактирование, чтобы дети были высокими, со светлыми волосами и голубыми глазами (ну, если вдруг именно такая внешность будет в моде), профессор Йонг добавила что и этого она тоже не исключает…
Но у нас возник не этический, а, если так можно выразиться, технический вопрос: неужели ученые уже в состоянии переделать нам геном и заменить голубые глаза на карие?
Вся наша жизнь закодирована в молекулах ДНК – дезоксирибонуклеиновой кислоты. Удивительно, но все эти огромные молекулы состоят из комбинации всего лишь четырех основных элементов: азотистых оснований аденина, гуанина, тимина и цитозина (их обычно для краткости обозначают первыми буквами – A, G, T, C). Сложные последовательности этих элементов служат своеобразными матрицами, на которых синтезируются РНК – рибонуклеиновые кислоты. РНК — «рабочие лошадки» нашего организма, у каждой – своя специализация. Одни участвуют в синтезе белков, задавая верную последовательность элементов, другие поставляют аминокислоты к месту синтеза белков, третьи – «перекраивают» своих собратьев, катализируя реакции с участием РНК.
” Лично мне наш геном напоминает муравейник: с ДНК — муравьиной королевой, бесконечно откладывающей яйца, из которых появляются РНК–муравьи, среди которых есть солдаты, няньки, рабочие…
А в Википедии приводят такой пример: «ДНК нередко сравнивают с чертежами для изготовления белков. Развивая эту инженерно-производственную аналогию, можно сказать, что, если ДНК — это полный набор чертежей для изготовления белков, находящийся на хранении в сейфе директора завода, то матричная РНК — временная рабочая копия чертежа отдельной детали, выдаваемая в сборочный цех».
Выбирайте аналогию по своему вкусу!
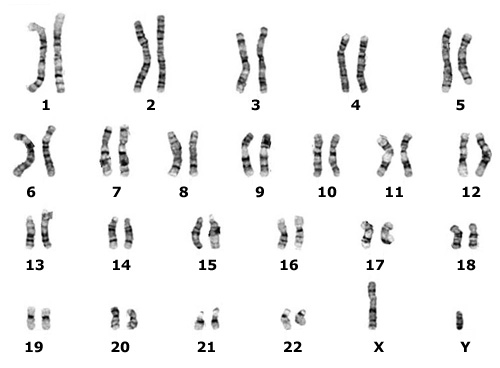
” В каждой паре хромосом одна досталась нам от отца, а другая от матери. 23-я пара отвечает за наш пол, поэтому хромосомы в ней могут отличаться: «ХХ» — у девочек, «ХУ» — у мальчиков.
Во всех аутосомах (не-половых хромосомах) и хромосома, доставшаяся от папы, и доставшаяся от мамы, содержат подобные гены на одних и тех же участках. Подобные – поскольку гены, у всех нас, вообще говоря, разные. К примеру, на участке, где располагается ген, ответственный за цвет волос, в одной хромосоме из пары окажется ген мамы-блондинки, а на другой – папы-брюнета. В таком случае один из генов будет доминировать, а второй, рецессивный, ждать своего часа. Если именно его передадут по наследству, и если в паре с ним окажется такой же рецессивный ген, то у него будет возможность проявить себя.
” Этот принцип наследования генетической информации чреват неприятными сюрпризами. И мы сейчас вовсе не о рождении голубоглазого блондина в семье кареглазых брюнетов, а о наследственных заболеваниях. Порой, скрытые в рецессивных генах, они дремлют во многих поколениях, никак не проявляя себя внешне. Но стоит такому гену встретиться со своим «собратом», и трагические последствия неизбежны.
Любые родители хотели бы вырезать зловредный ген из своей ДНК и заменить его на здоровый, обезопасив потомков. И тут мы снова возвращаемся к вопросу: неужели это реально?
В качестве эксперта мы привлекли кандидата биологических наук Светлану МИХАЙЛОВУ (pooha), научного сотрудника лаборатории молекулярной генетики человека Института цитологии и генетики СО РАН.
— Светлана Владимировна, генетический анализ во время проведения экстракорпорального оплодотворения, «зачатия в пробирке», вещь уже привычная?
— Да, оплодотворённой яйцеклетке дают несколько раз поделиться и анализируют, например, одну из 8 идентичных клеток. Этот метод используется в случаях, когда у пары высокая вероятность рождения ребёнка с генетическим нарушением, причина которого (конкретная генетическая перестройка или перестройки) известна. Если мутацию находят — клетки уничтожают, если нет – подсаживают по протоколу ЭКО женщине.
” — Доказано, что такое «отщипывание» клеток не приводит к нарушению развития зародыша. Этот метод технически гораздо сложнее и дороже, чем просто генетический анализ плода во время беременности, который проводится после забора амниотической жидкости или фрагмента плаценты, поэтому широкого распространения пока не получил.
— То есть, родителям остается только уповать, что однажды случайным образом «выпадет» комбинация здоровых генов. А нельзя ли как-то вырезать «плохие» гены?
— Ген удалять в большинстве случаев не надо, собственно, патогенные мутации как раз «удаляют» ген функционально. Надо заставить неправильно функционирующий ген работать нормально. Либо вырезать из него лишнее, либо вставить потерянное, либо заменить неправильное на правильное. Более простой подход — одним махом добавить в геном нормальную копию гена.

Своя собственная ДНК есть у митохондрий – органелл, отвечающих за «энергоснабжение» клетки. В отличие от остальных хромосом, находящихся в ядре, митохондриальные ДНК — это небольшие кольцевые молекулы, их количество в клетке варьирует от десятков до тысяч копий и зависит от возраста.
Яйцеклетка богата митохондриями, а сперматозоид содержит всего одну, обеспечивающую движение его «хвостика». После оплодотворения эта митохондрия уничтожается, поэтому все митохондриальные гены человека достаются ему только от матери.
Если причина заболевания находится в митохондриальной ДНК, то возможно использование митохондрий «третьего родителя». При этом ядро яйцеклетки матери, имеющей патогенные мутации, пересаживают в цитоплазму яйцеклетки женщины с нормальными митохондриями, а потом оплодотворяют её сперматозоидами отца и подсаживают по протоколу ЭКО. В частности, метод цитоплазматической замены успешно использовался в случае материнского бесплодия, связанного с нарушениями в митохондриальной ДНК. С 2015 г. этот метод генетической «модификации» человека легализован в Великобритании, но по-прежнему запрещён в США. Законодательство Австралии готовится к новшествам относительно генной инженерии. Чтобы обойти существующие запреты, такие манипуляции проводят на территории стран, где нет соответствующего законодательства, например в Мексике и на Украине.
О том, как на свет появился первый новорожденный с ДНК трех человек, читайте в в нашей публикации «Родился первый ребенок от трех родителей».
— Но как можно «оперировать» ген, неужели речь идет о реальных технологиях?
— Есть много способов разрезать молекулу ДНК. Инструменты для этого люди позаимствовали у бактерий. Борясь за место под солнцем (или, наоборот, в тени) бактерии синтезируют белки или комплексы белков и РНК, которые разрезают ДНК других видов бактерий и вирусов, но безвредны для ДНК хозяйки и её потомков. Эти молекулы прикрепляются к специфическим последовательностям ДНК (специфической фразе из «букв» А, С, T и G), которых заведомо нет в геноме хозяйки. Так что «отщипнуть» — не проблема, главное – правильно сшить обратно разрезанную молекулу. Если этого не сделать, то произойдёт разрыв хромосомы и нарушение функций того участка, где находится разрыв.
” — Сейчас наиболее перспективным орудием генного инженера считается бактериальная система CRISPR /Cas9 – часть иммунитета бактерий, модификации которой активно используют для редактирования геномов эукариот (живых организмов, клетки которых содержат ядра – прим. ред.). Бактерии «держат про запас» у себя в геноме фрагменты ДНК вирусов, с которыми они сталкивались раньше. Эти фрагменты позволяют бактерии быстро строить конструкции, состоящие из РНК и белков, которые специфически разрезают ДНК вирусов. При этом белок Cas9 функционирует как молекулярные ножницы, а так называемая gРНК, частично содержащая генетическую последовательность вируса, — это система GPS-навигации, которая направляет «ножницы» на специфический район ДНК. Бактерии борются с генами вирусов, но такой биотехнологический инструмент можно нацелить на произвольный участок ДНК любого организма.
— Чтобы клетка, ДНК которой разрезали таким способом, смогла восстановиться, в неё параллельно вводят ДНК с нужной последовательностью. Клетка запускает собственные механизмы починки ДНК и использует добавленную ДНК как матрицу для починки полученного повреждения. Таким образом, можно поменять одну генетическую последовательность на другую!
— Где же берут «правильные» гены?
— Практически любой ген человека можно вставить в геном бактерии, заставить эту бактерию активно делиться, а потом снова выделить нужный фрагмент в большом количестве. Так, сложные животные белки уже давно не выделяют из органов животных, а нарабатывают с помощью встроенных в бактерии генов (например, инсулин).
— То есть, генная инженерия возможна – пусть и в порядке лабораторного эксперимента?
— Чем сложнее организм, тем труднее это сделать. Для получения генномодифицированных лабораторных организмов такие подходы используются уже давно. Область применения этих методов – генная модификация сельхозкультур, сельскохозяйственных животных, но в особенности бактерий.
Однако перенести разработанные для экспериментальных организмов подходы на человека напрямую невозможно. Методы, которыми работают на животных и растениях, недостаточно специфичны. Часть полученных организмов нежизнеспособны, часть имеет «не те» признаки, их просто выбраковывают. Примером может служить «золотой рис». Его выводили методом генной модификации, добавив к геному риса два гена других организмов, что способствовало накоплению бета-каротина в его семенах. Действительно, был получен рис с заданными характеристиками, но его урожайность оказалась снижена. Предполагается, что причина этого – неудачные места встраивания новых генов.
С человеком цена ошибки слишком высока, поэтому эксперименты на людях очень ограничены. Любые генетические перестройки – риск перерождения клетки в раковую или её гибели. Естественно, можно обрабатывать культуру клеток или, например, колонию бактерий, но в итоге стараются выбирать только те клетки, которые имеют определённые характеристики, являющиеся признаком того, что модификация их генома действительно произошла.
” — Если обрабатывать многоклеточный организм, то в части клеток модификация может пройти, а в части нет. Предсказать, какая из клеток станет впоследствии предшественником конкретных тканей организма, невозможно, поэтому эффект такой модификации сейчас непредсказуем. Условно говоря, клетка, куда встроился ген кареглазости, попадёт в итоге в пятку.
— Можно ли поменять весь геном взрослого человека?
— Нет, работать со всеми клетками взрослого человека сейчас невозможно, да и не нужно. Организм, имеющий тяжёлое генетическое нарушение, влияющее на функции каждой клетки, просто погибает пренатально. Совместимые с жизнью генетические нарушения в основном проявляются в каком-то определённом органе или системе органов. Именно они и будут являться мишенями генных инженеров. Если ты хочешь карие глаза, то совершенно необязательно модифицировать ДНК пяток. Отработанных методик таких манипуляций со стабильным предсказуемым результатом на человеке пока нет, но генная инженерия развивается очень быстро, так что ждём!
— Первые опыты по использованию генной инженерии в лечении генетических заболеваний уже есть?
— В литературе описан успешный опыт генной терапии булёзного эпидермолиза (редкое хроническое наследственное заболевание, в результате которого непрерывно образуются раны на коже и слизистых оболочках – прим. ред.). Стволовые клетки кожи пациента обрабатывали вирусоподобными частицами, содержащими нормальную последовательность гена, выведенного из строя мутациями. Полученные клетки заселяли в повреждённые участки кожи ребёнка, и кожные покровы восстанавливались!
Были и попытки влиять на организм взрослого человека. Для этого в оболочку аденовирусной частицы упаковывали нужный генетический материал и с помощью аэрозоля обрабатывали дыхательные пути пациентов. Вирусные частицы прикреплялись к клеткам эпителия и впрыскивали в клетки ДНК «нужного» гена. Проводились и эксперименты по обработке вирусоподобными частицами с «правильными» генами клеток крови пациента.
” — В этих экспериментах результаты тоже были, но нестойкие. Это связано с тем, что изменённые клетки, хоть и производили нужные белки, но не размножались. Постепенно «правильные» клетки умирали, и симптомы заболевания возвращались. Ещё одна проблема такого метода – иммунный ответ организма на эти вирусоподобные частицы. Многие параметры при таком подходе контролировать невозможно, есть угроза повреждения нормального генетического материала клеток.
— Поэтому сейчас наиболее перспективное направление – модификация собственных стволовых клеток человека и запуск их обратно в организм. Уже есть методики забора фибробластов из кожи, перевод их обратно в состояние стволовых клеток и перепрограммирование в некоторые другие типы клеток. Это сейчас фактически остриё науки, на это брошено много сил и финансов (правда, не у нас в стране). Выращенные таким образом генетически «подправленные» клетки могут помочь человеку побороть СПИД и некоторые виды рака.
Пересадка собственных митохондрий недавно была использована у новорождённых с сердечно-сосудистыми патологиями в США. Вместо плохо работающего собственного сердца, с разрушенными от кислородного голодания митохондриями, не стали ставить донорское; в повреждённый участок сердечной мышцы вводили митохондрии, полученные из мышечной ткани детей. Клетки сердца захватили митохондрии и начинали работать нормально. В результате из 11 больных детей восьмерым не потребовалась трансплантация сердца! Хотя такую манипуляцию нельзя назвать генно-инженерной, но она создаёт задел для лечения пациентов, в том числе и «чужими» митохондриями.
Вообще в медицине много надежд возлагается именно на использование собственных немного доработанных клеток, и именно в связи с этим, я думаю, будет пересматриваться законодательство в области генной модификации по отношению к человеку.
источник
Каждый человек является носителем неповторимой комбинации отцовских и материнских генов. Именно от генов зависит, каким будет будущий человек. Однако гены подвергаются воздействию негативных факторов: неправильное питание (например, употребление генномодифицированных продуктов и др.), плохие экологические условия проживания, близкородственные браки, нездоровый образ жизни. В результате происходят генетические изменения. Одни могут появиться в организме человека с рождения, а другие произойти в течение его жизни. Генетические аномалии лежат в основе генетического бесплодия.
Генетическое бесплодие встречается гораздо чаще у мужчин, чем у женщин.
Согласно статистике 30-50% случаев мужского бесплодия вызвано генетическими заболеваниями. Генетические факторы бесплодия проявляются в нарушениях сперматогенеза. Процесс сперматогенеза проходит под контролем более 2000 генов, поэтому генетические мутации влияют на подвижность сперматозоидов, их морфологические и фертильные свойства.
К причинам генетического бесплодия у мужчин относят:
- Аномалии хромосомного развития. Например, синдром Кляйнфельтера, который характеризуется наличием лишней хромосомы.
- Мутация Y-хромосомы. Она является самой распространенной причиной генетического мужского бесплодия. Проявляется азооспермией (когда сперматозоиды полностью отсутствуют в эякуляте) либо олигозооспермией (в эякуляте содержится незначительное количество сперматозоидов).
- Мутация CFTR (в генемуковисцидоза). В результате его изменений происходит развитие кистозного фиброза, а также появляется отклонение в виде отсутствия семявыносящего протока.Такое генетическое изменение передается по наследству в 75% случаев.
| Известно, что женщины намного реже подвержены генетическому бесплодию в сравнении с мужчинами. С хромосомными нарушениями связывают невынашиваемость плода. Специалисты настоятельно рекомендуют пройти генетическое обследование женщинам, у которых происходило самопроизвольное прерывание беременности в двух случаях подряд. |
К генетическим факторам бесплодия у женщин относят:
- Синдром поликистозных яичников (встречается в 11% случаев бесплодия);
- Нарушения свертываемости крови , вызванные генетической предрасположенностью (влияют на вынашивание беременности);
- Хромосомная аномалия кариотип 45Х (вызывает прекращение менструаций);
- Мутация гена СYP21 (приводит к андрогенитальному синдрому);
- Трисомия по 16 хромосоме (связана с изменением количества хромосом в паре с двух на трех). Такое изменение часто приводит к самопроизвольному прерыванию беременности;
- Премутация гена FMR1 (вызывает преждевременное наступление менопаузы и характеризуется ломкой Х- хромосомы, отвечающей за умственное развитие).
Несмотря на развитие медицины генетические отклонения остаются неизлечимыми. При генетическом бесплодии наступление беременности возможно с помощью репродуктивных технологий.Искусственное оплодотворение является современной направлением медицины, которое постоянно развивается и совершенствуется. Применение разных методов искусственного оплодотворения позволяет женщине забеременеть и родить здорового ребенка в особо тяжелых формах мужского бесплодия. А в случаях генетического бесплодия у женщин возможно обратиться к услугам суррогатной матери. Суррогатное материнство применяется при угрозе невынашивания плода и если беременность представляет опасность для жизни самой женщины.
источник
Генетические изменения у одних людей находятся с рождения, у других — приобретенные. Ученые всего мира считают, что к этому приводит целый ряд факторов, таких как: брак с близким родственником, образ жизни, неправильное питание, загрязнение окружающей среды и многое другое.
В генах заложена вся наследственная информация, которая необходима для развития оплодотворения яйцеклетки. Гены по отдельности образуют белок, который выстраивают организм в целом. По две копии каждого гена дети получают от своих родителей.
Генетические факторы бесплодия являются одним из главных проблем генетического бесплодия. Причина этому – мутация хромосом, как у мужчин, так и женщин.
Мутирующие хромосомы явно не выражаются в организме человека, но и бывают редкие исключения. Когда доктора выставляют диагноз «генетическое бесплодие», он предполагает изменение числа хромосом или нарушение их структур. Поэтому пройти обследования должны оба супруга.
В современной медицине нет возможностей для исправления генетических изменений, но при правильной постановке диагноза, назначений и лечения можно прийти к беременности и рождению малыша.
Генетические причины бесплодия определяются в изменении структуры и числа хромосом. Такие нарушения являются как регулярными (выявляются во всех клетках тела), так и мозаичными (образуют клон клеток). У здоровых женщин также могут находиться хромосомные аномалии. Увеличение и уменьшение числа Х-хромосом. Хромосомные аномалии, которые включают изменения числа, и структуры не половых хромосом то есть инверсии.
Эти нарушения приводят к выкидышам на ранних сроках беременности до 12 недель, замиранию плода, не вынашиванию беременности до конца срока, нарушение свертываемости крови, преждевременная менопауза, отсутствие менструации и так далее. Поддержание репродуктивной функции и хорошее развитие у женщин и мужчин контролируется приблизительно двумя тысячами генов. Их мутации приводят к болезням, которые снижают фертильность и это может быть одним из основных признаков бесплодия.
Генетическое бесплодие у мужчин может быть обусловлено выявлением дополнительной Х-хромосомы или их аномальный набор. Полное отсутствие или недостаточное количество спермы. Частой причиной является врожденное двухстороннее недоразвитие семявыносящего протока, которое в 76% передается по наследству.
Мужское бесплодие связано с наследственной аномалией органов мочеполовой системы, нарушение эндокринной системы, синдром Дауна, болезнью почек, анемии, инфекции мочевыводящих путей, перегрев яичников (вызывает расширению вен семенного канала), опущение яичек в мошонку (крипторхизм), постоянные стрессовые ситуации, бесплодие не ясной этиологии и многие другие заболевания.
Если супружеская пара не может забеременеть в течении двух лет, или в анамнезе у женщины было несколько самопроизвольных абортов, врачи гинекологи рекомендуют посещение врача — генетика. Он в свою очередь планирует комплексное обследование, которое включает в себя цитогенетическое и молекулярно-генетическое исследование.
У женщин изучают менструальный цикл, гормональный уровень в крови, проходимость маточных труб. У мужчин тестируют сперму. Рекомендуют сдать анализы на различные инфекции: ВИЧ, гепатит В и С, хламидии, корь и так далее. Проводится ряд рентгеноскопических и эндоскопических обследований для уточнения диагноза. В высококвалифицированных клиниках эти обследования проводятся в амбулаторном порядке и не занимают много времени.
После тщательного анализа устанавливается диагноз. Затем разрабатывается схема лечения, позволяющая преодолеть генетическую патологию, если такая имеется.
Фото: Диагностика генетического бесплодия
Для созревания овуляции предлагают гормональную терапию. Чаще всего эта терапия назначается при синдроме поликистозных яичников. Под действием препаратов граафовые пузырьки созревают и лопаются для освобождения яйцеклетки.
Искусственное оплодотворение (инсеминация). Введение семенной жидкости мужчин в женскую матку увеличения шансов зачатия. При этом донором может быть любой, выбранный парой человек или анонимный донор.
Этот метод применяют при:
- перитониальном бесплодии;
- эндометриозе;
- гормональные нарушения;
- иммунологические патологии;
- необъяснимые причины бесплодия.
Метод ЭКО (экстракорпоральное оплодотворение) производится в лабораторных условиях вне тела матки. Эта процедура проводится несколькими этапами:
- стимулируется овуляция;
- контролируется созревание фолликул;
- проводится изъятие яйцеклетки из спермы;
- процедура оплодотворения проходит в условиях стационара;
- прослеживание за эмбриональным ростом;
- самые качественные эмбрионы переносятся в тело матки (1-3 штуки).
Перед провидением процедуры ЭКО врач должен рассказать пациенту про потенциальный риск для здоровья, будущего ребенка.
Отбор качественных сперматозоидов для оплодотворения:
- Микрохирургическая аспирация – процесс забора семенной жидкости из придатка яичка при помощи специальной иглы. Полученная сперма проходит обработку для выбора самых активных сперматозоидов, которые будут использованы для введения в яйцеклетку. Замороженные оплодотворенные яйцеклетки, которые хранятся в течении пяти лет, могут быть введены в матку.
Показания к процедуре:
- недоразвитие или полное отсутствие яичников;
- возраст женщины достиг 40 годам и старше;
- неэффективность других способов лечения;
- регулярное не вынашивание беременности;
- присутствие синдрома Тернера, высокий риск родить ребенка с генетическими отклонениями.
Если не получается забеременеть какой-то отрезок времени не спешите самостоятельно ставить сами себе диагноз. Обратитесь к специалистам, которые помогут установить истинную причину. Генетическое бесплодие для супружеских пар звучит как приговор, но не стоит отчаиваться. Современные методы обследования и лечения делают чудеса.
Если женщина и мужчина морально подготовлены перед ними открываются все двери к осуществлению мечты. Несмотря на то, что вышеперечисленные процедуры занимают, немало времени, конечный результат приятно порадует и молодая пара ощутит все прелести родительского счастья. Нет ничего лучше на свете, чем испытать материнский инстинкт.
источник
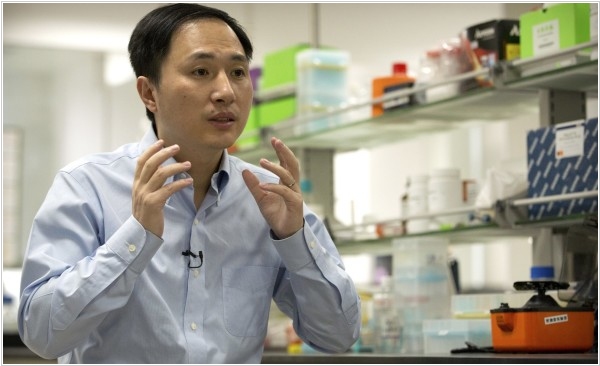
2018. Китайский профессор объявил о рождении генетически модифицированных детей
Китайский товарищ Хе Цзянькуя из Шэньчжэньского университета объявил что (впервые в мире) ему удалось отредактировать человеческую эмбриональную клетку, так что в результате родился ребенок, и даже два — близняшки Лулу и Нана. Говорит, что использовал технологию редактирования ДНК — CRISPR-Cas9 и затем, искусственное оплодотворение. Целью редактирования было наделить детей невосприимчивостью к ВИЧ — выключить ген CCR5, который связан с формированием белка, позволяющего вирусу попасть в клетку. Из 7 пар, участвовавших в эксперименте, беременности удалось добиться лишь в одном случае. Однако, доказательств — нет. Личности близняшек Хе не раскрывает из соображений конфиденциальности, а руководство Шэньчжэньского университета вообще говорит, что было не в курсе экспериментов ученого.
2018. Генетический тест позволит выбрать самого лучшего эмбриона
Пока родители еще не могут оптимизировать ДНК будущего ребенка (хотя прогресс и в этом направлении есть), но зато уже сегодня можно проверить эту ДНК перед оплодотворением (искусственным конечно). Компания Genomic Prediction разработала тесты генетического скрининга, которые могут предсказывать риск некоторых заболеваний или слабоумия у будущих детей. Например, так можно выявить эмбрионов с муковисцидозом или синдромом Дауна. Более того, Genomic Prediction говорит, что может примерно предсказать уровень IQ будущего ребенка. Т.е. появляется возможность выбрать не только более потенциально-здорового эмбриона, но и эмбриона с потенциально более высоким IQ. Компания уже начала переговоры с несколькими клиниками искусственного оплодотворения для использования такого скрининга по запросу клиентов.
2016. В Великобритании начались эксперименты по изменению генома человеческих эмбрионов
Хотя в конце прошлого года ведущие ученые мира специально встретились и договорились пока не редактировать ДНК человеческих эмбрионов, британские ученые — наплевали на это соглашение и получили от государственного регулятора разрешение на эксперименты по редактированию генома эмбрионов человека. Этим будет заниматься исследовательская группа биолога Кэти Ниакан из Института Фрэнсиса Крика. Первые генетически изменённые эмбрионы появятся, как ожидается, в начале лета этого года. Первичной целью исследования будет сокращение числа выкидышей и лечение бесплодия. Однако, в будущем эта технология может стать инструментом для улучшения здоровья детей еще до их рождения. Редактирование генома будет производиться с помощью молекулярной системы CRISPR. Учёным дозволено использовать модифицированные эмбрионы только для фундаментальных исследований — подсаживать их суррогатной матери строго запрещено.
2014. В Израиле научились лечить бесплодие стволовыми клетками
В Израиле успешно опробована новая методика лечения женского бесплодия. Автор методики — директор Центра лечения бесплодия доктор Элиягу Бар. Он предложил использовать в курсе терапии стволовые клетки самих женщин. Пациентка, не могущая забеременеть вследствие повреждения эндометрия, прошла курс лечения собственными стволовыми клетками. До этого женщина 15 раз безуспешно проходила процедуру ЭКО. В рамках новой методики лечение проходило в два этапа. На первом этапе из жировой ткани пациентки были извлечены стволовые клетки. Затем они были помещены в матку, в результате чего эндометрий стал восстанавливаться. Параллельно с этим женщина проходила курс подготовительной гормональной терапии; затем в матку пациентки был подсажен эмбрион. На этот раз беременность наступила.
2013. Первый ребенок, которого родили выбрав эмбрион с лучшим ДНК
Возможно, уже скоро нормальные семьи будут зачинать ребенка только через искусственное оплодотворение. Зачем? Чтобы выбрать пол ребенка и обеспечить ему хорошее здоровье. Ведь теперь появилась возможность относительно недорого провести расшифровку ДНК эмбриона и определить его предрасположенность к серьезным заболеваниям. Коннор Леви, рожденный 18 мая в США — это первый ребенок, который прошел такой искусственный отбор. Его родители решали свои проблемы с бесплодием, и в одной из клиник перед искусственным оплодотворением им предложили провести анализ ДНК. Всего у них получилось создать 13 эмбрионов (оплодотворенных яйцеклеток), и из них был выбран лучший — с оптимальным набором хромосом. Затем его поместили в матку матери, и результат вы можете видеть на фотографии выше.
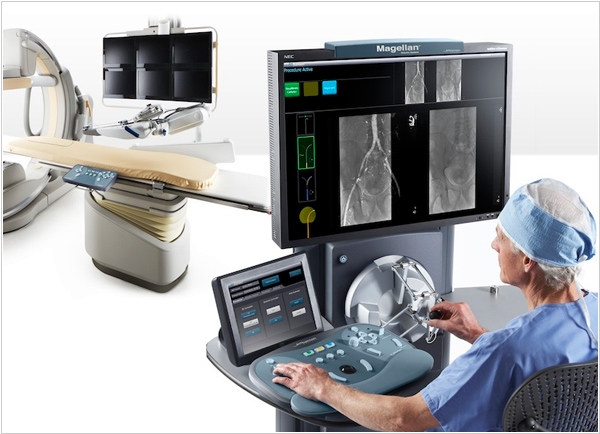
2013. Хирургический робот Magellan начал оперировать фиброиды
Фиброиды — это доброкачественные опухоли матки — одна из наиболее частых причин женского бесплодия. До последнего времени одним из основных методов борьбы с фиброидами ***
источник
Сегодня семейные пары, столкнувшиеся с женским, мужским, комбинированным бесплодием и даже бесплодием неясного генеза, когда врачи не могут установить первопричину этого заболевания, все равно могут стать счастливыми родителями.
Среди методов лечения бесплодия сегодня наибольшее распространение получили: оперативная эндоскопия, индукция овуляции и вспомогательные репродуктивные технологии.
Современный хирургический метод, суть которого заключается в операции или обследовании брюшной полости под контролем высокотехнологичной видеосистемы, благодаря чему врач может следить за ходом проводимых им манипуляций.
Оперативная эндоскопия, если говорить о ней как о способе лечения бесплодия, несет скорее диагностический характер и в меньшей степени лечебный. Так, лапароскопия стала одним из наиболее достоверных способов обследования, когда у семейной пары подозревается бесплодие неясного генеза. На момент опытных исследований она доказала свою результативность и вывела диагностику этого вида бесплодия на новый уровень.
Медикаментозное лечение, применяемое чаще всего при эндокринном бесплодии у женщин, результатом которого становится ановуляция, то есть отсутствии процесса овуляции. Цель этого способа лечения бесплодия в том, чтобы посредством приема лекарственных препаратов стимулировать овуляцию у пациентки.
Индукция овуляции, как правило, осуществляется по трем схемам лечения бесплодия, разница которых заключается в выборе лекарств, назначаемых специалистом индивидуально для каждой обратившейся семьи.
Так, в основе одной из схем лечения бесплодия находится лекарственный препарат под названием клостилбегит. Он является препаратом двойного действия, который при повышенном содержании в крови женского гормона эстрогена играет роль антиэстрогена, а при пониженном проявляет эстрогенный эффект. Его основное действие заключается в стимуляции главных репродуктивных гормонов, таких как фолликулостимулирующий гормон (ФСГ), отвечающий за формирование и рост фолликул, а также лютеинизирующий гормон (ЛГ), инициирующий процесс овуляции и готовящий эндометрий к прикреплению эмбриона. Согласно принятой схеме лечения бесплодия клостилбегитом в первом цикле его дозировка не должна превышать 50 мг в сутки. При этом максимальная дозировка не должна быть больше, чем 750 мг за цикл. Необходимо также знать, что прием этого лекарства более 5-6 раз в жизни может стимулировать истощение яичников, а значит привести к преждевременному климаксу.
Вторая группа препаратов, которая используется при данном методе лечения бесплодия: гонадотропины, которые, в свою очередь, делятся на два вида с разной силой действия. Так, человеческий менопаузальный гонадотропин имеет более щадящее действие, а рекомбинантный, разработанный с применением генной инженерии – является более мощным препаратом.
Третья схема лечения бесплодия заключается в комбинировании лекарственных средств.
Заключительным этапом индукции овуляции становится укол ХГЧ (хорионического гонадотропина человека), который необходим для дозревания яйцеклетки и наступления процесса овуляции.
Однако наиболее эффективными современными методами лечения бесплодия являются вспомогательные репродуктивные технологии, такие как искусственная инсеминация, ЭКО, ЭКО с ИКСИ, ЭКО с преимплантационным хромосомным скринингом и ЭКО с донорскими клетками.
Метод лечения бесплодия, который впервые был опробован более двухсот лет назад. И среди других современных методов лечения бесплодия он наиболее приближен к естественному зачатию. Бесспорно, его нынешняя версия сильно отличается от той, что практиковалась столетия назад, но суть осталась прежней – доставка спермы партнера искусственным путем в цервикальный канал или матку женщины, что значительно увеличивает шансы на зачатие. Объясняется это тем, что сперматозоидам не приходится самостоятельно «проходить» весь путь до яйцеклетки.
Искусственная инсеминация применяется при диагностированном мужском факторе, когда сперматозоиды имеют малую подвижность или численность, а также при бесплодии неясного генеза. В последнее время практикуют введение спермы мужа напрямую в полость матки.
Схема лечения бесплодия при использовании искусственной инсеминации такова:
- получение спермы до процедуры, которое не должно превышать нескольких часов либо ее разморозка, если она была заблаговременно криоконсервирована, что в данном случае увеличивает время на ее подготовку;
- обработка спермы; при естественном зачатии функцию «очистки» спермы выполняет цервикальный канал, где сперма естественным путем избавляется от семенной жидкости, клеточных элементов, а также неактивных сперматозоидов. Необработанный эякулят при искусственной инсеминации, введенный в полость матки грозит женщине инфекционно-воспалительными заболеваниями, а также анафилактическим шоком;
- само введение спермы является безболезненной и непродолжительной процедурой, которую, как правило, проводят либо один раз за цикл, непосредственно в дни овуляции, либо за несколько дней до нее, но в этом случае ее повторяют дважды за цикл с интервалом в два-три дня.
Также перед инсеминацией, в случае, когда бесплодие у супругов сочетанное, проводят стимуляцию овуляции. При этом искусственная инсеминация как способ лечения бесплодия не проводится при диагнозе «непроходимость маточных труб».
Вспомогательная репродуктивная технология, которая в своем «классическом варианте» состоит из следующих этапов:
- подготовительный этап, суть которого заключается в проведении необходимых обследованиях обоих партнеров;
- следующий шаг – процедура суперстимуляции овуляции у женщины, цель которого в получении сразу нескольких яйцеклеток, чего не может быть при обычной овуляции, это является обязательным условием при ЭКО, так как повышает шанс получить жизнеспособный эмбрион;
- сбор биологического материала (извлечение яйцеклеток, а также же получение спермы партнера/донора);
- непосредственно сама процедура экстракорпорального оплодотворения, то есть получение эмбрионов «в пробирке»;
- заключительная часть: перенос эмбриона в полость матки, который происходит, в среднем через 3-5 дней.
После чего врач-репродуктолог следит за наступлением и дальнейшим ходом беременности у пациентки.
Первый шаг к экстракорпоральному оплодотворению был совершен еще в 19 веке, когда группа английских ученых пыталась оплодотворить яйцеклетку кролика вне организма. После чего несколько десятилетий было отведено на разрозненные опыты, проводимые учеными разных стран, однако добиться доказательств того, что полученные данным методом эмбрионы могут привести к успешной беременности и появлению потомства, они не могли.
Уже к середине XX века стали проводиться эксперименты с женскими яйцеклетками. Однако до появления на свет первого ребенка, рожденного методом ЭКО, необходимо было пройти путь длинною в двадцать лет. Появление на свет Луизы Браун, первого «ребенка из пробирки» – поделило все, что было сделано в области репродуктологии на «до» и «после».
Сегодня это наиболее эффективный современный метод лечения бесплодия. Схема лечения бесплодия, с помощью процедуры ЭКО одна и та же для всех клиник мира, единственное отличие может быть в длине протокола, который варьируется в каждом конкретном случае и отличается используемыми препаратами, методиками проведения манипуляций и их сроками.
Интрацитоплазматическая инъекция сперматозоидов технология, при которой сперматозоид вводится непосредственно в цитоплазму яйцеклетки. Совместно с ЭКО является самым результативным способом лечения бесплодия при неясном генезе. Технология ИКСИ также применяется при пониженном качестве спермы и в случае, когда у пары обнаружено бесплодие на клеточном уровне.
В отличие от «классического варианта» ЭКО при ИКСИ сперматозоид вводят в яйцеклетку «вручную», для чего используются микроинструменты, а также микроманипуляторы, которые и преобразуют движения рук при помощи джойстиков в микродвижении инструментов.
На развитие ЭКО как современного метода лечения бесплодия повлияли такие науки как эмбриология, хирургия, фармакология и, кончено, генетика. Каждая из них внесла свой неоценимый вклад в то, что сегодня бесплодие для большинства семейных пар перестало быть неизлечимым диагнозом. Генетический подход, который сегодня становится приоритетным при таких вспомогательных репродуктивных технологиях как ЭКО, не только настоящее, но и перспективное будущее для всей репродуктологии.
Если говорить о показаниях к скринингу, то он рекомендован всем обратившимся за ЭКО семьям, так как даже идеальные эмбрионы, по оценке врача-эмбриолога, могут таить в себе хромосомные аномалии, приводящие к прерыванию беременности на ранних сроках или появлению малыша с ограниченными возможностями.
Этот способ широко распространен как за рубежом, так и в России. К нему прибегают женщины, которые по ряду причин не могут зачать ребенка со своей яйцеклеткой. Например, из-за генетических проблем или раннего истощения яичников, то есть преждевременной менопаузы, а также, когда женщина уже достигла позднего детородного возраста. Для них ЭКО с донорскими ооцитами является последним шансом на материнство. Сегодня ЭКО проводится с двумя группами ооцитов – свежими и витрифицированными. Используя последние достижения эмбриологии, которые добились сверхбыстрой заморозки яйцеклеток, ооциты могут храниться бессрочно и быть разморожены в любой необходимый момент.
Все современные методы лечения бесплодия с успехом осуществляются в клинике NGC.
Здесь разработано 12 программ ЭКО. Главным достоинством клиники по праву считается высококвалифицированная команда специалистов, которая поможет подобрать необходимую именно Вам программу лечения, пройти с Вами все этапы процедуры и подарить шанс стать родителями.
источник