Одной из ведущих причин женского бесплодия является полное отсутствие овуляции. При этом происходит нарушение фолликулогенеза (созревания яйцеклетки) в яичниках, что приводит к её невызреванию.
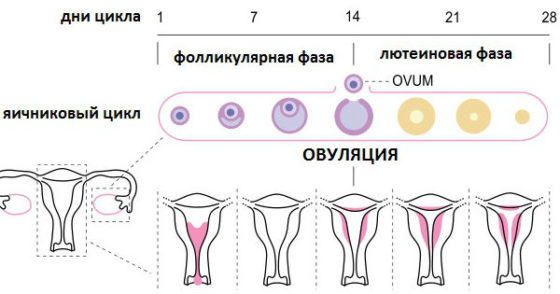
В здоровом женском организме период овуляции характеризуется выходом созревшей половой клетки в брюшную полость. Затем яйцеклетка осуществляет медленное продвижение по маточным трубам в направлении матки. В случае ановуляторного (эндокринного) фактора бесплодия, этого процесса не происходит, в результате чего половые клетки партнеров не могут встретиться.
По данным статистики около 20-30% всех случаев женской бездетности связаны именно с анвуляторными циклами. При этом чаще всего подобная патология поддается медикаментозной коррекции. Решающим фактором для преодоления эндокринного бесплодия считается определение причины отсутствия овуляции у женщины.
Репродуктивное здоровье женщины регулируется эндокринным взаимодействием между гипофизом, гипоталамусом и яичниками. Ключевыми гормональными факторами в этом отношении являются лютеинизующий (ЛГ) и фолликулостимулирующий (ФСГ) гормоны, а также эстрадиол. Ановуляторное бесплодие может быть вызванолюбым нарушением в этой цепочке:
- Недостаточность гонадотропных гормонов (I тип);
- Синдром поликистозных яичников (II тип);
- Преждевременное истощение овуляторного запаса (III тип).
К более редким факторам, провоцирующим ановуляцию, относят гипотиреоз и гиперпролактинемию. Диагностика и терапия для каждого типа заболевания имеет свои особенности.
Данная форма патологии характеризуется снижением секреции гонадотропных гормонов (гормонов стимулирующих рост фолликулов с яйцеклетками), это может быть вызвано осложненным течением хронических заболеваний, резким похудением, стрессами, а также наследственной предрасположенностью. При этом выделяют два вида нормогонадотропного ановуляторного бесплодия:
На основе гормонального исследования специалисты выделяют легкую, среднюю и тяжелую степень течения заболевания. Вывод делается на основании количественного содержания ЛГ, ФСГ и эстрадиола.
Симптомами гонадотропной недостаточности могут быть фенотипические особенности, такие как высокий рост, телосложение по мужскому типу, удлиненные руки и ноги, а также уменьшение количества волос на лобке и в подмышечных впадинах. Часто у женщин, страдающих данной формой эндокринного расстройства, наблюдается аменорея – первичное или вторичное отсутствие менструации. При помощи ультразвукового исследования специалисты могут наблюдать уменьшение размеров матки и яичников.
Определение нормогонадотропного ановуляторного бесплодия предполагает проведение следующих диагностических мероприятий:
- Анализ крови на гормоны;
- УЗИ органов малого таза;
- Липидограмма;
- Определение минеральной плотности костной ткани.
Лечение данной формы бездетности состоит из двух этапов. Целью первого этапа является подготовка организма к овуляции, путем назначения заместительной терапии. Таким образом, удается добиться увеличения размеров яичников и матки, появления признаков женского фенотипа, а также готовности эндометрия к имплантации оплодотворенной яйцеклетки.
Второй этап терапии предполагает медикаментозную стимуляцию овуляции при помощи назначения специальных препаратов – менотропинов. Если овуляция происходит, рекомендуется обеспечить поддержку второй, последующей фазы цикла, путем орального приема прогестерона.
Эффективность лечения будет в первую очередь зависеть от степени выраженности ановуляторного бесплодия, связанного с недостаточностью гонадотропинов. Определенное значение имеет также возраст пациентки. Статистика подтверждает наступление беременности у 80% женщин, прошедших лечение по данной схеме.
Если ультразвуковое исследование демонстрирует признаки поликистоза яичников, говорят об ановуляторном бесплодии II типа. Данная форма патологии часто сопряжена гипоандрогенией и инсулинорезистентностью. Синдром поликистозных яичников с трудом поддается медикаметнозной коррекции. Однако при правильно подобранной гормональной терапии и длительности лечения возможно ожидать положительно результата наступления беременности.
Лечение этой формы бездетности также предполагает проведение хирургической операции — лапароскопической термокаутеризации. В случае успешного исхода оперативного вмешательства вероятность наступления беременности существенно повышается.
Данное состояние характеризуется отсутствием ооцитов, в связи с ранним истощением овуляторного запаса. Такая форма ановуляторного бесплодия считается самой сложной в терапевтическом отношении, поскольку невозможно спровоцировать и предугадать спонтанную овуляцию.
Все формы эндокринного бесплодия могут быть успешно скорректированы до нормогормонального уровня, когда “настроены” все необходимые гормоны, и организм женщины может продуцировать нормальные яйцеклетки, а при их оплодотворении успешно их сохранить.
Для успешного исхода лечения любого вида гормонального бесплодия необходим длительный прием лекарств и, возможно, хирургическое лечение. Все эти мероприятия должен назначать только гинеколог-эндокринолог. На отделении гинекологии клиники НЕОМЕД есть все необходимое для диагностики и лечения женского бесплодия.
источник
Существует множество причин и типов инфертильности. Некоторые из них связаны с гормонами, именно таким и является ановуляторное бесплодие. Это не самый частый тип, однако, он хорошо известен врачам и с большей или меньшей степенью успешности поддается гормональной коррекции без хирургического вмешательства. О том, как проявляется данный тип патологии, и как ее лечить, рассказано в данном материале.
Корректное название данного состояния — нормогонадотропное ановуляторное бесплодие. Оно имеет гормональную причину и развивается вследствие гормонального дисбаланса, который возникает при нарушении в работе щитовидной железы и/или половых желез, вырабатывающих гормоны. При этом типе патологии отсутствует овуляция, яйцеклетка не созревает и не выходит из фолликула. Таким образом, хотя кажется, что менструальная функция нормальна, на самом деле непосредственно яйцеклетки, необходимые для зачатия, отсутствуют.
При этом протекание патологии может варьироваться. Овуляция может отсутствовать вовсе на протяжении длительного времени, отсутствовать периодически, быть неполноценной постоянно или периодически (то есть, созревает очень мало клеток). Все зависит от стабильности и степени нарушения гормонального баланса.
При этом, известны случаи, когда состояние компенсировалось и самостоятельно без лечения. То есть, оно проходило, как только гормональный уровень нормализовался в организме самостоятельно.
Этот тип инфертильности редко бывает абсолютным и неизлечимым. Обычно, он успешно поддается корректировке. Кроме того, такая инфертильность может быть как первичной, так и вторичной, так как непосредственно от процесса беременности и родов никак не зависит (хотя есть мнения, что роды могут спровоцировать гормональный сбой, приводящий к такому типу бесплодия).
Как ясно из написанного выше, причины данного заболевания всегда лежат в гормональном сбое, который может произойти по ряду причин, таких как:
- Прием медикаментозных гормональных препаратов;
- Аутоиммунные и эндокринные заболевания;
- Стресс, недостаток сна;
- Неправильное питание, вредные привычки;
- Резкие колебания веса в большую или меньшую сторону;
- Нарушения в работе гипоталамуса и гипофиза;
- Наследственная предрасположенность;
- Некоторые хронические заболевания, напрямую не связанные с эндокринной системой и гормонами;
- Врожденная гиперфункция коры надпочечников;
- Нарушения работы щитовидной железы;
- Заболевания печени;
- Ранний климакс, естественный или искусственный;
- Чрезмерные нагрузки, как физические, так и эмоциональные.
Какие же именно гормоны вовлечены в процесс? Основной причиной анновуляторного бесплодия является снижение выработки гонадотропных гормонов. Именно благодаря им происходит рост фолликула с последующим формированием в нем яйцеклетки.
Иногда причиной такого бесплодия является резкое повышение содержания в крови эстрогенов, зачастую сопровождающееся развитием новообразований в органах репродуктивной системы. Кроме того, иногда состояние обусловлено врожденными аномалиями в строении яйцеклетки. В этом случае шансы на наступление беременности практически равны нулю даже после курса лечения.
Симптоматика инфертильности заключается собственно в неспособности забеременеть. Врачи говорят о инфертильности тогда, когда зачатие не наступает в течение более чем полутора лет, на протяжении которых велась регулярная половая жизнь без применения средств контрацепции, в том числе и в период овуляции. Если на протяжении этого срока женщина не смогла забеременеть, то необходимо обратиться к врачу репродуктологу.
Однако этот тип патологии несколько специфичен и может иметь некоторую симптоматику. Это такие признаки ,как:
- Депрессия;
- Кровотечения ациклические или усиленные во время месячных;
- Сбои менструального цикла, регулярные или периодические;
- Потеря веса;
- В более редких случаях наблюдается истощение яичников, разрастание их тканей, поликистоз;
- На анализах может обнаруживаться существенный избыток эстрогенов.
Тщательное обследование в этих случаях помогает установить причину заболевания достаточно быстро. Если лечение начато своевременно, то по сравнению с другими формами бесплодия, данная имеет относительно неплохой прогноз.
Для диагностики состояния проводятся следующие исследования:
- УЗИ;
- Анализ крови на половые гормоны и гормоны надпочечников;
- Кольпоскопия;
- Анализ проходимости труб;
- Мазок на флору из влагалища;
- Посткоитальный тест.
Это поможет исключить иные причины бесплодия и подтвердить его гормональный характер.
Лечение состояния происходит полностью медикаментозно. Хирургическое вмешательство необходимо лишь тогда, когда оно сопровождается наличием больших, не поддающихся гормональному лечению, гормонозависимых новообразований.
В основном же лечение направлено на ликвидацию патологического состояния. В зависимости от того, какими причинами вызвано состояние, проводят то или иное лечение. Выбирается одна из следующих схем:
- Кломифенцитрамов в сочетании с хорионическим гонадотропином – первый препарат вводят с 9 по 12 дни цикла по 50 мг в сутки на протяжении трех месяцев, второй – на 10, 12 и 14 дни по 1500 ЕД в сутки внутримышечно;
- Только хорионический гонадотропин на 10, 12, 14, 16 дни цикла, по 1500 ЕД в сутки на протяжении трех месяцев, внутримышечно;
- Менопаузный гонадотропин с 5 по 14 дни цикла по 75 ЕД ежесуточно, на 15, 17 и 19 дни — хорионический гонадотропин по 1500 ЕД, проводится 2-3 курса;
- Прогестерон – по одной таблетке с 5 по 25 дни цикла на протяжении 3-4 месяцев, предпочтение отдается двухкомпонентным препаратам;
- Эстрогены (при снижении их содержания) – 5 мг эстрадиола внутримышечно однократно на 12, 1 или 14 дни цикла, на протяжении трех-четырех циклов.
Имеются и другие, менее распространенные схемы лечения. Наиболее подходящую назначает врач.
Ановуляторное бесплодие успешно лечится. У 80% женщин с таким диагнозом при поликистозе яичников наблюдается полное излечение без хирургического вмешательства. Если хирургическое вмешательство все же необходимо, то излечение после него наступает в 70% случаев. Менструальный цикл восстанавливается, овуляция становится нормальной, с достаточным количеством яйцеклеток.
Достаточно часто при таком типе бесплодия экстракорпоральное оплодотворение проводить нет необходимости. Так как физических препятствий для наступления зачатия нет, оно вполне возможно естественным способом. Исключение составляет один случай – когда ановуляция развилась в результате истощения яичников. В этом случае яйцеклетки не будут вырабатываться в любом случае, какое бы лечение не проводилось. Даже стимулирование супер-овуляции тут бессильно.
В этом случае может проводиться экстракорпоральное оплодотворение. Перед ним, с помощью гормональных препаратов, готовят эндометрий к прикреплению эмбриона. Если все же возможно получить собственные единичные яйцеклетки, то используют их. Если невозможно – то донорские. Они оплодотворяются в лабораторных условиях, а затем помещаются в полость матки.
источник
Отсутствие овуляции делает женщину бесплодной, поскольку именно от этого процесса зависит оплодотворение и зарождение нового организма. Ановуляторное бесплодие не является редкостью и у всех женщин хотя бы раз в жизни был менструальный цикл по той или иной причины не сопровождающийся овуляцией. Проблемой же является такое состояние, когда ановуляторные циклы становятся постоянными, что связано с нарушением в эндокринной системе человека. Важно вовремя понять, что послужило причиной отсутствия овуляции.
Говоря языком гинекологов, ановуляторное бесплодие является состоянием гормональной природы, при этом количество яйцеклеток остается нормальным, но процесса их созревания и/или выхода из яичника не возникает.
Нарушение выработки гормонов гипоталамуса, гипофиза, щитовидной железы, яичников приводят к тому, что овуляция не наступает (ановуляция), в результате чего не выполняются обязательные для зачатия условия. Сказать, что это бесплодие постоянное, нельзя, ведь нормализация количества гормонов приводит к восстановлению овуляции, следовательно, и фертильности.
Ановуляторное бесплодие может вызываться многими факторами. Важно понимать, что регуляция менструального цикла связана с несколькими уровнями гормонообразующих органов. Самое высокое место в этой иерархии занимают такие структуры, как:
- кора головного мозга;
- гиппокамп;
- лимбическая система.
Многие знают, что от сильного стресса могут прекратиться месячные, то есть развивается ановуляторное бесплодия.
Следующим звеном регуляции менструального цикла в целом и овуляции в частности является гипоталамус. На него воздействуют по типу обратной связи половые гормоны, нейротрансмиттеры, нейропептиды и другие вещества, в результате чего гипоталамус выделяет гонадотропин рилизинг-гормоны, которые относятся не только к половым железам, но и к другим органам. Мощнейшее действие на рилизинг-факторы гипоталамуса оказывают эстрадиол, эндогенные опиоидные пептиды – эндорфины, энкефалины, динорфины.
Третий уровень регуляции – гипофиз. Под воздействием гонадотропин рилизинг-гормонов продуцируются:
- ЛГ и ФСГ – лютеинизирующий и фолликулостимулирующий факторы;
- адренокортикотропный;
- пролактин;
- соматотропный;
- тиреотропный гормоны.
Без должного выделения веществ невозможно нормальное функционирование яичников и возникновения овуляции. Поэтому нарушение в количестве этих гормонов может стать причиной ановуляторного бесплодия.
Менструальный цикл имеет 2 фазы: фолликулиновая и лютеиновая, между которыми возникает овуляция. Первая фаза зависит в большей степени от фолликулостимулирующего гормона, вторая от лютеинизирующего гормона. Овуляцию как процесс стимулирует резкий подъем ЛГ.
Четвертый уровень регуляции – яичники, надпочечники, щитовидка. Ключевая роль принадлежит яичникам:
- в них созревают фолликулы;
- происходит овуляция;
- формирование желтого тела;
- продукция стероидных половых гормонов.
Большое влияние оказывают надпочечники на репродуктивную систему женщины. Ановуляторные менструальные циклы характерны для адреногенитального синдрома (АГС) различной выраженности.
Синдром поликистозных яичников является хроническим заболеванием, которое характеризуется ановуляцией и гиперандрогенией. Повышенный синтез ЛГ сопровождается снижением прогестерона, чем обусловлена ановуляторное бесплодие.
Развития ановуляторного бесплодия чаще всего вызвано следующими причинами:
- гормональные препараты, способствующие отсутствию овуляции (контрацептивы);
- гормонопродуцирующие опухоли молочной железы и надпочечников;
- нарушение работы гипоталамуса, гипофиза;
- дисфункция щитовидной железы (гипо- или гиперфункция);
- резкое снижение или набор веса;
- синдром поликистозных яичников;
- синдром истощения яичников;
- адреногенитальный синдром;
- заболевания печени (гепатит, цирроз);
- врожденные патологии, недоразвитие яичников, отсутствие рецепторов или их недостаток;
- отсутствие в рационе белковой, жирной пищи, витаминов, микроэлементов;
- физическое перенапряжение;
- хроническое недосыпание;
- регулярные стрессы.
Если без предохранения беременность у пары не наступает в течение года и половые сношения регулярны, то можно говорить о бесплодии.
Заподозрить ановуляторное бесплодие можно по таким симптомам:
- отсутствие ранее характерных для овуляции болевых ощущений внизу живота в середине цикла, недомогания;
- развитие кровотечений вне зависимости от менструального цикла;
- изменение характера менструальных выделений, продолжительности;
- потеря массы тела.
Но есть косвенные симптомы, которые помогут заподозрить нарушение гормональной регуляции:
- оволосение по мужскому типу;
- различные степени ожирения, жировая ткань в основном сконцентрирована в верхней половине туловища;
- недоразвитие наружных половых органов;
- наличие мужского тембра голоса;
- позднее начало менструации (15-16 лет);
- стрии на груди, животе, бедрах.
- Измерение базальной температуры. Утром до подъема с постели нужно произвести термометрию в прямой кишке, и эта манипуляция проводится весь менструальный цикл. Если отмечать на температурной кривой все значения, то на ней будет виден пик после овуляции на 0,4-0,8 град. За один день до месячных температура снизиться на 1 град. Нет подъема во второй фазе цикла – ановуляция.
- Чтобы узнать, произошел выход яйцеклетки из яичника или нет, можно воспользоваться простым тестом на овуляцию. Этот способ определит всплеск лютеинизирующего гормона, что указывает на свершившуюся овуляцию. Этим способом можно выявить подъем гормона в моче и слюне, но второй вариант будет значительно дороже. Но можно говорить о большей достоверности определения ановуляции.
- При осмотре шейки матки в зеркалах выявляется симптом «зрачка» накануне овуляции. Основан этот феномен на расширении наружного отверстия шейки и накоплении в нем прозрачной слизи.
- Феномен «папоротника» – кристаллизация шеечной слизи при высыхании на предметном стекле. Максимально выражено это явление во время овуляции.
- Растяжение шеечной слизи. Максимально растягивается шеечная слизь во время выхода яйцеклетки.
- Отсутствие овуляции можно обнаружить при помощи УЗИ. Специалист не выявит фолликулярной кисты на месте развития яйцеклетки.
- Мазок со стенки влагалища показывает клеточный состав отделяемого, который значительно меняется в зависимости от фазы менструального цикла, что регулируются гормонами.
- А что если овуляция произошла, но яйцеклетка не смогла добраться до пункта назначения? Это происходит, когда нарушена проходимость маточных труб. Выявить это нарушение можно с помощью рентгенкотрастирования, диагностической лапароскопии, хромогидротубации.
Итак, стало понятно, что овуляции все же нет, теперь важно выяснить, по какой причине она не происходит. В этом случае нужно сдавать анализы на количество гормонов в крови. Важны следующие показатели:
- ФСГ;
- ЛГ;
- прогестерон;
- пролактин;
- адренокортикотропный гормон;
- андрогены;
- инсулин и глюкоза при СПКЯ;
- эстрогены;
- кортизол;
- гормоны щитовидной железы.
Лечение ановуляторного бесплодия подразумевает воздействие на первопричину болезни: если это связано с препятствием на пути зрелой яйцеклетки, то оно устраняют посредством хирургических манипуляций. Если бесплодие связано с изменением гормонального фона, то в первую очередь назначают заместительную терапию или подавляют секрецию.
Назначение ингибитора эндогенных опиоидных пептидов – налоксона – приводит к повышению производства рилизинг-гормонов, таким образом давая возможность произойти нормальной овуляции.
При синдроме поликистозных яичников гонадотропин назначают в виде препаратов Хумегон и Пергонал. Средство Кломифен способствует нормализации гипоталамо-гипофизарной связи, что возвращает овуляцию в 30-40% случаев бесплодия при СПКЯ.
Самолечение в случае ановуляторного бесплодия может причинить только вред! Постоянно наблюдаться у врача и не принимать решения по поводу отмены или коррекции дозы препаратов самостоятельно!
Следует помнить, что замещение гормонами часто требует не одного, а многих циклов лечения. Нередко заместительная терапия продолжается всю жизнь.
Одним из способов забеременеть при отсутствии овуляции является искусственное оплодотворение. Для этого метода есть свои показания и противопоказания. Важно их определить и наметить четкий план действия, разработать подготовку к этому ответственному процессу и выбрать подходящий протокол ЭКО.
Ановуляторное бесплодие не является приговором и вполне лечится, если раньше обратить внимание на симптомы и начать разбираться с причинами патологии. При должном лечении, замещении утраченных гормональных функций можно забеременеть, выносить здорового ребенка и радоваться материнству.
источник
В современной медицине существует несколько видов женского бесплодия. Одним из них является нормогонадотропное ановуляторное бесплодие. Согласитесь, что даже выговорить его название тяжело. Но этот вид бесплодия все-таки существует и приносит немало страданий женщинам, которые мечтают о рождении ребенка. Попробуем внести ясность.
Проблема возникает вследствие заболевания щитовидной железы или половых желез. Известно, что эти железы отвечают за нормализацию менструального цикла. В связи с малейшими нарушениями работы желез возможны гормональные сбои в организме. Ановуляторное нормогонадотропное бесплодие характеризируется отсутствием овуляции у женщин детородного возраста. Иногда овуляция происходит, но очень редко или же бывает не совсем полноценной. Почему так происходит? Где кроется причина отсутствия овуляции?
Основной причиной заболевания считается снижение секреции гонадотропных гормонов, которые отвечают за стимуляцию роста фолликулов с яйцеклетками. Болезнь может быть вызвана осложнением после перенесения хронических заболеваний, частыми стрессовыми ситуациями, резким снижением веса, а также наследственной предрасположенностью.
В связи с этим возникает эндокринное (ановуляторное) бесплодие, причинами которого могут быть:
- Нарушения в работе гипофиза и гипоталамуса. У женщины наблюдается потеря веса, кровотечение, депрессия.
- Избыток эстрогенов при симптоме поликистозных яичников.
- Истощение яичников. Шансы забеременеть при этом диагнозе равны нулю.
- Аномальные явления в хромосомах яйцеклетки.
- Врожденная гиперфункция коры надпочечников.
- Дисфункция щитовидной железы.
- Болезни печени.
- Ранний климакс.
- Гипотиреоз и гиперпролактинемия, но в очень редких случаях.
В первую очередь нужно привести в норму работу желез внутренней секреции. Если ановуляция носит хронический характер, то нужно устранить дисфункцию не только эндокринных желез, но и привести в нормальное состояние эндометрий и маточные трубы. Эти нарушения происходят в процессе длительного дисбаланса гормональной сферы. Поэтому очень важно при появлении первых признаков нарушения овуляции сразу обратиться за медицинской помощью.
Если причиной эндокринных расстройств является избыточный вес или, наоборот, его нехватка, то необходима специальная диета с целью корректировки веса.
Неплохо лечится гормональное бесплодие, вызванное гиперпролактинемией. Это когда в крови пациентки наблюдается повышенное содержание гормона пролактина. Симптомами заболевания являются нарушения менструального цикла, выделения из молочных желез молозива или молока. В этих случаях врачи прибегают к помощи гормональных препаратов. Иногда лечение требует и хирургического вмешательства.
У 80 % женщин при синдроме поликистозных яичников успешно проходит лечение гормонального бесплодия, но иногда приходится прибегать к оперативному вмешательству. Оно заключается в клиновидной резекции яичников или каутеризации (электро- или термокоагуляции яичников). Эти методы приводят к снижению в организме уровня андрогенов. После этого примерно у 70% женщин восстанавливается менструальный цикл и происходит полноценная овуляция.
Этап стимулирования овуляции должен происходить под строгим контролем врача и является серьезной терапией, которая сопровождается частой УЗИ-иагностикой. Лечение проводится гормональными препаратами, которые подбираются врачом, учитывая индивидуальные особенности организма женщины, и имеют противопоказания и побочные эффекты.
Для стимуляции овуляции используют препарат кломифен цитрат (кломид), который способствует выработке в организме фолликулостимулирующего гормона. Иногда стимуляцию овуляции проводят не гормональными препаратами, а с помощью физических методов: электростимуляцией шейки матки и диэнцефальной области.
Если у женщины истощены яичники, то стимуляция овуляции тут не поможет. В таком случае следует прибегнуть к методу ЭКО (искусственное оплодотворение). Пересадка в полость матки уже оплодотворенной яйцеклетки под дальнейшим контролем врача позволяет женщине с эндокринными проблемами родить желанного малыша.
источник
Овуляторное бесплодие – это невозможность зачать детей в виду расстройства процесса созревания яйцеклеток в женском организме и выхода их из фолликулов. Более правильно будет называть это состояние ановуляторным бесплодием, поскольку в результате этих нарушений не происходит полноценная овуляция в организме женщины.
Не всегда нарушение процесса овуляции можно рассматривать как патологическое состояние. В некоторых случаях нерегулярный менструальный цикл вызваны природными изменениями в организме женщины:
- Менархе и последующее становление менструального цикла. Длится не более 6 месяцев. Возникает в подростковом возрасте. Эволюционный смысл – в активной гормональной перестройке и становлении функций репродуктивной системы.
- Период лактации. На протяжении около 6 месяцев у кормящих грудью женщин наблюдается лактационная аменорея. Эволюционный смысл её заключается в том, чтобы дать организму женщины окрепнуть после родов, а также в необходимости заботы о младенце.
- Период менопаузы. Угасание репродуктивной функции в организме женщины. Эволюционный смысл состоит в том, чтобы сократить число генетических отклонений и хромосомных мутаций в популяции, поскольку риск возникновения их при поздней беременности гораздо выше.
Но ановуляция в репродуктивном возрасте вне беременности и лактации – это патология. Есть несколько основных его причин. Самая частая – нарушение баланса гормонов.
В норме процессу овуляции предшествует ряд изменений уровней гормонов. Они выполняют различную функцию. В первой фазе (фолликулярной) преобладает выработка гипофизарного ФСГ – он обеспечивает созревание ооцита в фолликулах яичников. Эстрадиол тоже постепенно увеличивает свою концентрацию, принимая участие в активации пролиферации эндометрия.
Во время овуляции происходит резкое увеличение лютеинизирующего гормона гипофиза вместе с ФСГ – это приводит к выходу созревшего яйцеклетки из Граафова пузырька. После этого ооцит попадает в маточную трубу, где может произойти его оплодотворение.
Во второй фазе цикла происходит увеличение количества прогестерона – он отвечает за успешность имплантации оплодотворенной яйцеклетки, подавляет иммунитет для препятствия отторжения эмбриона. При отсутствии плодного яйца к концу цикла количество прогестерона и эстрадиола уменьшается. Эндометрий становится тоньше, и во время менструации отторгается из полости матки.
Гормональные нарушения могут быть вызваны выпадением одного из звеньев этого процесса:
- Нарушение цикла, вызванное расстройством нейрорегуляции – нарушается синтез рилизинг-факторов в гипоталамусе.
- Нарушение секреторной функции аденогипофиза – невозможность гипофиза выработать гормон в ответ на рилизинг-факторы гипоталамуса.
- Нарушение выработки половых гормонов, действующих на клетки-мишени: прогестерона, пролактина, эстрадиола.
- Гормональный дисбаланс, приводящий к расстройству овуляторное цикла (заболевания щитовидной железы и т.д.). Например, при гипотиреозе наблюдается увеличение количества пролактина, подавляющего действие ЛГ и наступление овуляции, а также повышающий риск развития синдрома поликистоза яичников.
- Синдром поликистоза яичников (синдром Штейна-Левенталя). Комплекс гормональных расстройств, при которых снижена выработка прогестерона с параллельным повышением продукции эстрогенов, андрогенов и инсулина. Определяется также расстройство гипоталамо-гипофизарной регуляции.
Органические поражения яичников, приводящие к невозможности высвобождения зрелых ооцитов и их формирования, тоже могут стать причиной овуляторного бесплодия. Основные патологические процессы, которые его вызывают:
- Наличие опухолей яичников.
- Кисты яичников, препятствующие нормальному течению овуляции.
- Недостаточность яичников и истощение фолликулярного запаса. В некоторых случаях бесплодие вызвано малым количеством клеток-предшественников ооцитов или изменениями эндокринной системы у женщины.
Недостаточность яичников подразделяется на:
Синдром резистентности яичников. Невосприимчивость тканей яичников к продуцируемым в достаточном количестве гормонам. При этом количество фолликулов в тканях яичников является достаточным. Это нормогонадотропное ановуляторное бесплодие. То есть состояние, при котором выработка гормонов, стимулирующих созревание фолликулов и выхода яйцеклеток, не нарушена.
Синдром истощения яичников. Вызван снижением фолликулярного запаса. Это может случиться по причине нарушения закладки ооцитов при внутриутробном развитии женщины, или же вследствие гормональных нарушений в зрелом возрасте. В этом случае запускается механизм инволюции яичников.
Недостаточность яичников подразделяется на первичную и вторичную:
Первичная недостаточность яичников может быть вызвана:
- Генетически запрограммированной ранней инволюцией яичников.
- Нарушениями онтогенеза женщины во время внутриутробного развития: инфекции у ее матери во время беременности, а также наличие у нее гормональных нарушений или патологии течения беременности.
Вторичная недостаточность яичников может развиться в результате:
- Нарушения нейроэндокринной регуляции репродуктивной системы: органические поражения гипоталамо-гипофизарной системы (в результате травм, гематом, неопластических процессов), недостаточное кровоснабжение от мозговых артерий.
- Алиментарных факторов: нехватки витаминов и нутриентов в рационе питания, пищевых расстройств (булимия, анорексия и прочее).
- Неврастении, частых стрессов, психоэмоционального перенапряжения.
- Хронических воспалительных процессов органов малого таза (специфические – туберкулезное, сифилитическое поражение органов половой системы, или неспецифическое воспаление).
Часто заподозрить наличие эндокринных нарушений врач может ещё во время первичного осмотра пациентки. Так, при гиперандрогенемии у женщины будет преобладать ожирение по мужскому типу (основная масса подкожной клетчатки локализуется на животе) и гирсутизм (наличие усиленного роста волос на лице и теле).
Смежная патология щитовидной железы, которая приводит к нарушению менструального цикла, проявляется в виде:
- Тиреотоксикоза – тахикардия, похудение, повышение температуры тела до 37 градусов, повышенная нервная возбудимость, мышечная слабость, депрессивное состояние, выпадение волос, повышение аппетита, нервозность.
- Гипотиреоза – набор массы тела, брадикардия, непереносимость холода, неспособность ясно мыслить, сухость кожи, выпадение волос, боли в суставах.
Железа может быть увеличена, иметь очаги уплотнения, узлы при любом варианте нарушений ее функции.
Диагностика патологий щитовидной железы заключается в:
- Внешнем осмотре, измерении пульса, давления, температуры тела пациентки, сборе анамнеза.
- Консультации эндокринолога, который производит осмотр железы, пальпаторное исследование, уточняет данные анамнеза.
- Сдаче анализа крови для определения уровня ТТГ и гормонов щитовидной железы: Т3, Т4.
- Сдаче анализа крови для выявления антител к тканям щитовидной железы (при подозрении на аутоиммунный тиреоидит).
- УЗИ щитовидной железы, на котором оценивается размер, консистенция, эхогенность ткани, симметричность долей, кровоснабжение щитовидки.
Если причина овуляторного бесплодия состоит не в нарушении работы щитовидной железы, то женщине необходимо сдать ряд анализов для определения уровня половых гормонов и гормонов гипоталамо-гипофизарной системы. Алгоритм выявления эндокринных нарушений половых гормонов таков:
- Проводится первичный осмотр пациентки, сбор данных анамнеза, уточнение характера менструального цикла (регулярность, продолжительность, и т.д.).
- Проводится гинекологический осмотр и взятие мазка из влагалища для исключения инфекционной природы патологических изменений.
- Назначается УЗИ, на котором могут быть выявлены органические поражения органов урогенитальной сферы: наличие воспалительных изменений эндометрия, полипов, миоматозных узлов, очагов эндометрита, наличие спаек и рубцов в матке и ее трубах, кистозные изменения яичников, наличие неопластических процессов, аномалий строения репродуктивных органов.
Назначаются анализы крови на уровень половых гормонов:
- определение уровня ФСГ и ЛГ;
- определение уровня прогестерона и эстрадиола в крови;
- определение уровня АКТГ (косвенно указывающего на гиперандрогенемию в связи с гиперфункцией надпочечников);
- определение уровня тестостерона в крови.
В случае подозрения на нарушение нейрорегуляции (травмы головы в анамнезе, инсульт в анамнезе, нарушения мозгового кровообращения, частые головокружения и т.д.) врач может назначить дополнительные исследования головного мозга и его сосудов на предмет органических поражений этих структур:
- Допплерография позвоночных артерий.
- КТ структур головного мозга в области турецкого седла (при подозрении на опухоль или травму гипофиза).
Все эти исследования проводятся в определенный день менструального цикла. Для того чтобы результат был максимально точным, следует соблюдать правила подготовки к сдаче анализа:
- За три дня до анализа желательно исключить жирную, жареную, копченую пищу.
- За день до сдачи анализа следует полностью исключить жирные блюда, острые продукты, пищу с избытком соли.
- Анализ следует сдавать натощак – последний прием пищи перед сдачей крови следует проводить не ранее, чем за 6 часов. Лучше всего сдавать анализ натощак с утра.
В день проведения исследования перед забором крови нельзя пить воду и любые напитки, в том числе чай без сахара.
В большинстве случаев проводится гормональная заместительная терапия: недостающие гормоны поступают в организм в виде лекарств. Оптимальным считается индивидуальный подбор дозы гормонов для заместительной терапии. Такое лечение является пожизненным или длится до наступления беременности.
Если причина в инфекции урогенитальной сферы – проводится антибактериальное лечение. Хроническое воспаление органов малого таза может вызвать рубцовые изменения и появление спаек, которые потребуют проведения операции для восстановления фертильности.
Доброкачественные новообразования яичников подлежат иссечению.
Наличие кист яичников малых размеров требует консервативного лечения. Если кисты имеют большой размер или лекарственная терапия оказалась неэффективна, производится хирургическая цистэктомия, в особо тяжелых случаях – с резекцией части яичника.
Наиболее тяжелым прогнозом в плане лечения является истощение фолликулярного запаса и ранняя инволюция репродуктивной функции в организме женщины. Такое состояние не поддаётся хирургическому лечению и гормонотерапии. Шансы забеременеть естественным путем в данном случае практически равны нулю. Но остается возможность достижения беременности с использованием ВРТ. Применяется ЭКО с донорскими ооцитами.
источник

Однако, каждая из форм ановуляторного бесплодия имеет ряд специфических признаков, симптомов и лабораторно-диагностических маркеров.
В структуре бесплодного брака ановуляторное женское бесплодие встречается в 30-40% случаев.
• Бесплодие вследствие гонадотропной недостаточности.
• Синдром поликистозных яичников.
• Яичниковая недостаточность.
• Гиперпролактинемия – повышенное содержание гормона пролактина в крови.
• Гипотиреоз – снижение уровня гормонов щитовидной железы.


• наблюдение девочек, рождённых от матерей с эндокринными нарушениями, у детского гинеколога. Это связано с тем, что часто бесплодие связано с генетической патологией, передающейся по наследству.
• борьба со стрессом. Частые стрессы являются основной причиной развития вторичного эндокринного бесплодия женщин. Ведь главным в связке регуляции менструального цикла гипоталамус-гипофиз-яичники, является гипоталамо-гипофизарная система, деятельность которой напрямую зависит от пихоэмоционального фона женщины.
• санация очагов инфекции в детском и подростковом возрасте. Такие инфекционно воспалителыне заболевания как: эндометрит, аднексит, оофорит, менингит, туберкулез являются основными причинами эндокринной недостаточности пораженных органов. Их своевременное лечение или предупреждение возникновения являются залогом гинекологического здоровья будущей мамы.
• нормализация веса. Женщины, как правило, ищут оправдание своей полноте в гормональных нарушениях – редко, но бывает, что это действительно так (гормоны являются причиной избыточного веса). Чаще дела обстоят наоборот – избыточный вес порождает гормональные нарушения. А избыточный вес является следствием нерационального образа жизни. Избыточная или сниженная масса тела напрямую влияет на органы внутренней секреции.

Необходимые лабораторно-инструментальные исследования 
• У3И — подтверждение отсутствия зрелого фолликула на 11-16 день цикла или отсутствие желтого тела на 19-23 день цикла.
• Гормональные — исследование уровня прогестерона на 18-23-й день цикла; выявление сниженного уровня ЛГ, предшествующего овуляции с помощью домашних мочевых тестов (тест «Клиаплан») на II-III день цикла.
• Измерение базальной температуры иногда применяют для выявления яичниковой дисфункции. Его преимущества в дешевизне и формировании ответственного отношения женщины к лечению.
При обнаружении признаков туберкулеза – консультация врача фтизиатра.
При гормональных нарушениях не гинекологиечких органов – гипопитуитаризм, нарушение работы щитовидной железы и надпочечников – необходима консультация врача эндокринолога.
При синдроме поликистозных яичников часто в лечении задействуется лапароскопическая хирургия – потому необходима консультация гинеколога – хирурга.

Лечение состоит из трёх этапов:
• Подготовка к индукции овуляции. На этом этапе проводят коррекцию эндокринных нарушений, подготовку эндометрия.
• Контролируемая индукция овуляции.
• Гормональная поддержка лютеиновой фазы индуцированного цикла.
Подробнее о диагностике и лечении каждого вида гормонального бесплодия в отдельности Вы сможете ознакомившись с соответствующей статьей.
Изобретение относится к медицине, а именно к эндокринной гинекологии, и может быть использовано для лечения первичного и вторичного бесплодия, причиной которого является ановуляция.
Известны способы лечения ановуляторного бесплодия: стимуляция овуляции гормонами (применение синтетических прогестинов с целью получения ребаунд-эффекта, использование клостилбегита или других аналогичных препаратов, введение гонадотропинов или аналогов гонадолиберинов), подавление избыточной секреции пролактина препаратами спорыньи, стимуляция овуляции хирургическими методами, в частности при лапароскопии (В.Н.Серов и соавт. 1995, В.П.Сметник, Л.Г.Тимилович, 1997, Т.Я.Пшеничникова с соавт., 1991).
Недостатки указанных способов — их недостаточная эффективность, «нефизиологичность», т.к. не происходит коррекции метаболических, вегетативных, эндокринных расстройств, сопутствующих ановуляции, нередкие осложнения (синдром гиперстимуляции яичников, гирсутизм, вегетативные расстройства, лекарственные поражения печени), риск повреждения органов брюшной полости и инфекции при эндоскопических вмешательствах, а также дороговизна и сложность выполнения.
Наиболее близким аналогом предлагаемого способа является использование битемпоральной индуктотермии в сочетании с вливаниями тиосульфата натрия и инъекциями церебролизина (авторское свидетельство №1296126 от 15 ноября 1986 года).
Недостатки: способ инвазивный и сложный, недостаточно эффективный.
Изобретение направлено на решение задачи — упрощение способа при высокой эффективности.
Технический результат: неинвазивное восстановление менструальной и репродуктивной функции.
Указанные задачи достигаются с помощью применения препарата «Танакан» 40 мг 3 раза в сутки во время еды в течение 3-х месяцев с одновременным приемом поливитаминного препарата Магне В6 по 2 таблетки 2 раза в сутки в течение 40 дней и проведения эндоназального электрофореза даларгина в течение 15-20 минут ежедневно, №10-12.
Известно, что расстройства овуляции при различных эндокринных заболеваниях, в том числе и при синдроме поликистозных яичников, обусловлены нарушениями гипоталамо-гипофизарной системы. Танакан представляет собой экстракт Гинкго билоба, действие которого обусловлено влиянием на процессы обмена веществ в клетках, реологические свойства крови и микроциркуляцию. Препарат улучшает мозговое кровообращение и снабжение мозга кислородом и глюкозой, нормализует метаболические процессы, оказывает антигипоксическое действие на ткани. Кроме того, танакан воздействует на высвобождение, обратный захват и катаболизм нейомедиаторов (норадреналина, допамина, ацетилхолина) и на их способность к связыванию с мембранными рецепторами и тем самым нормализует гипоталамо-гипофизарные расстройства. Для лечения ановулятоного бесплодия танакан не использовался. Применение витаминов обосновывается их активным участием в обменных процессах в качестве коферментов, присущим им адаптогенным и иммунокорегирующим эффектами.
состав препарата Магне-В6 входит магний, являющийся жизненно важным элементом, который находится во всех тканях организма и необходим для нормального функционирования клеток, участвует в большинстве реакций обмена веществ. В частности, он участвует в регуляции передачи нервных импульсов. Пиридоксин (витамин В6) участвует во многих метаболических процессах, в регуляции метаболизма нервной системы, улучшает всасывание магния из ЖКТ и его проникновение в клетки. Даларгин, являющийся синтетическим аналогом энкефалинов, характеризуется антистрессорным, иммуномодулирующим, цито- и ангиопротекторным, дезагрегационным действием и, по сути дела, является адаптогеном, т.к. повышает функциональные резервы механизмов адаптации. Препарат обладает высокой электрофоретической подвижностью. Учитывая анатомо-физиологические связи между слизистой оболочкой носа и гипоталамусом, при нарушениях менструальной и репродуктивной функции центрального генеза целесообразно его введение в виде эндоназального электрофореза, поскольку это позволяет преодолеть гематоэнцефалический барьер для даларгина.
Способ осуществляется следующим образом: больной назначают прием танакана по 40 мг 3 раза в день во время еды в течение трех месяцев с одновременным приемом Магне-В6 по 2 таблетки 2 раза в сутки 40 дней. Одновременно проводят 10-12 сеансов эндоназального электрофореза даларгина, ежедневно, в течение 15-20 минут сеанс.
Примеры конкретного выполнения.
Пример 1. Больная В., 24 года, обратилась с жалобами на редкие (через 31-109 дней) месячные, увеличение массы тела, отсутствие беременности в течение двух лет регулярной половой жизни без котрацепции, головные боли. Месячные нерегулярные с менархе (с 12 лет через 28-270 дней), масса тела увеличилась за последние 6 мес. на 5 кг. Половая жизнь с 18 лет, беременности не было. Из перенесенных заболеваний отмечает краснуху, ветряную оспу, эпидемический паротит, частые ангины, пиелонефрит с 16 лет. Наследственность: у отца гипертония. Объективный статус: рост 164 см, вес 93 кг, ИМТ — 34,5. Белые стрии на молочных железах, ягодицах и бедрах. Избыточное оволосение на ногах и передней брюшной стенке. Щитовидная железа не увеличена. Молочные железы мягкие, отделяемого из сосков нет. АД 130/90 мм рт.ст, отмечает повышение до 140/100. Генитальный статус: наружные половые органы сформированы правильно, шейка матки чистая, симптом «зрачка» отрицательный (26 день цикла); матка не увеличена, подвижна, безболезненна, придатки отчетливо не определяются. Консультирована терапевтом — DS: Симптоматическая артериальная гипертензия I ст., возможно дисгормональная. ЭКГ — синусовая аритмия, ЧСС 65-130 в минуту. Глазное дно — ДЗН бледно-розовые, артерии нормального калибра, умеренное венозное полнокровие. УЗИ малого таза: матка 46×42,1×44,5 мм с ровными четкими контурами, однородной эхоструктуры.
эхо — 4,6 мм. Правый яичник: 49,4×20,7×33 мм, форма округлая, высокой эхогенности; фолликулов более 10, в виде четок по периферии яичника, V=17,2 см 3 . Левый яичник: 46,4×24,4×31,3 мм, аналогичной структуры, V=18 см 3 . В обоих яичниках нет доминантного фолликула. Гормональное исследование: ФСГ — 9,0 мМЕ/мл, ЛГ — 14,2 мМЕ/мл, пролактин 146,4 мМЕ/мл, тестостерон — 0,63 нг/мл, С-пептид — 820,9 пм/л. Липидный спектр — IV тип дислипидемии. Глюкоза натощак — 4,1 ммоль/л, через два часа — 5,2 ммоль/л. В июле 2004 г. лапароскопия оперативная, клиновидная резекция правого яичника, электропунктура яичников, хромосальпингоскопия.
Диагноз: Нарушение менструальной функции по типу опсоменореи. Бесплодие I, ановуляторного генеза. Синдром поликистозных яичников. Метаболический синдром, ожирение II ст. Артериальная гипертензия I ст.
Проведено лечение: танакана по 40 мг 3 раза в день во время еды в течение трех месяцев с одновременным приемом Магне-В6 по 2 драже 2 раза в сутки 40 дней. Эндоназальный электрофорез даларгина, ежедневно по 15 минут №12. Оптимизировался ритм месячных (через 29-38-40 дней), наступила беременность. Беременность протекала с явлениями угрозы, роды произошли в срок. Родился мальчик 4314 г, 54 см, по Апгар 8-9 баллов.
Пример 2. Больная Т., 26 лет, обратилась с жалобами на нерегулярные месячные через 27-112 дней, периодические головные боли, периодические колющие боли в области сердца, слабость, утомляемость, раздражительность.
Месячные с 15 лет, нерегулярные, по 5-7 дней, умеренные, безболезненные. Половая жизнь с 16 лет, беременностей не было. Контрацепция: презервативы, Диане — 35 в течение шести месяцев. После отмены гормональной контрацепции отмечает усугубление нарушений менструальной функции — увеличение задержек менструации. Перенесенные заболевания: частые ОРВИ, ветряная оспа, эпидемический паротит, доброкачественная опухоль левой молочной железы при рождении, острый гайморит в 16 лет. Объективный статус: конституция нормостеническая, рост — 164 см, масса тела — 55 кг, ИМТ — 20,4, ОТ/ОБ — 0,73. Щитовидная железа не увеличена, молочные железы мягкие, отделяемого из сосков нет. АД 110/70 мм рт ст. Со стороны внутренних органов патологии не выявлено. Гинекологический статус: шейка матки чистая, симптом «зрачка» отрицательный (21 день цикла); матка не увеличена, подвижная, безболезненная, придатки отчетливо не определяются. УЗИ малого таза: матка размерами 50×33×38 мм нормальной эхоструктуры, М-эхо — 4 мм, яичника: правый 25×37×24 мм, V=14,8 см 3 , левый 52×38×30 мм, V=24,3 см 3 ; оба с эхонегативными включениями до 10, диаметром 2-10 мм, расположенными преимущественно по периферии яичника, сторома высокой эхогенности, соотношение строма/фолликулы 50/50. По тестам функциональной диагностики констатирована ановуляция. Глазное дно — полнокровие артерий и вен. При гормональном исследовании выявлена незначительная гиперпролактинемия (пролактин 776 мМЕ/мл), ФСГ, ЛГ, тестостерон в пределах нормы. Глюкоза натощак — 4,0 ммоль/л, через два часа — 3,8 ммоль/л. С-пептид в норме (463,4 пм). Показатели липидного спектра крови без особенностей. Диагноз: Нарушение менструальной функции по типу опсоменореи дисрегуляторного генеза. Ановуляция. Синдром поликистозных яичников. Вторичная гиперпролактинемия. Проведено лечение: танакана по 40 мг 3 раза в день во время еды в течение трех месяцев с одновременным приемом Магне-В6 по 2 драже 2 раза в сутки 40 дней, эдоназального электрофореза даларгина ежедневно по 20 минут №10. Больная осмотрена через 6 месяцев, отмечено прекращение головных болей, оптимизация менструального ритма (по 3-6 дней через 25-40 дней). От беременности предохраняется. При гормональном исследовании отмечена нормализация уровня пролактина (пролактин — 309,52 мМЕ/мл).
Положительный эффект предлагаемого способа в виде повышения эффективности лечения заключается в том, что у женщин с нейроэндокринными расстройствами и обусловленной ими ановуляцией оптимизируется функция гипоталамо-гипофизарной системы, уменьшается степень метаболических расстройств, включаются циклические процессы в яичниках благодаря улучшению трофики мозговых структур за счет танакана и эндоназального электрофореза даларгина, а также нейротропного действия пиридоксина, входящего в состав магне-В6. Ценность предлагаемого способа состоит в том, что он не вызывает осложнений и побочных реакций. Способ простой, доступный, легко воспроизводим, не требует больших экономических затрат, хорошо переносится больными.
Способ лечения ановуляторного бесплодия с помощью медикаментозных средств и физиотерапии, отличающийся тем, что в качестве медикаментозных средств назначают «Танакан» 40 мг 3 раза в сутки, курс 3 месяца с одновременным приемом Магне В6 по 2 таблетки 2 раза в сутки в течение 40 дней, а в качестве физиотерапевтичского метода используют эндоназальный электрофорез даларгина по 15-20 мин ежедневно, курс 10-12 процедур.
Корректное название данного состояния — нормогонадотропное ановуляторное бесплодие. Оно имеет гормональную причину и развивается вследствие гормонального дисбаланса, который возникает при нарушении в работе щитовидной железы и/или половых желез, вырабатывающих гормоны. При этом типе патологии отсутствует овуляция, яйцеклетка не созревает и не выходит из фолликула. Таким образом, хотя кажется, что менструальная функция нормальна, на самом деле непосредственно яйцеклетки, необходимые для зачатия, отсутствуют.
При этом протекание патологии может варьироваться. Овуляция может отсутствовать вовсе на протяжении длительного времени, отсутствовать периодически, быть неполноценной постоянно или периодически (то есть, созревает очень мало клеток). Все зависит от стабильности и степени нарушения гормонального баланса.
При этом, известны случаи, когда состояние компенсировалось и самостоятельно без лечения. То есть, оно проходило, как только гормональный уровень нормализовался в организме самостоятельно.
Этот тип инфертильности редко бывает абсолютным и неизлечимым. Обычно, он успешно поддается корректировке. Кроме того, такая инфертильность может быть как первичной, так и вторичной, так как непосредственно от процесса беременности и родов никак не зависит (хотя есть мнения, что роды могут спровоцировать гормональный сбой, приводящий к такому типу бесплодия).
Как ясно из написанного выше, причины данного заболевания всегда лежат в гормональном сбое, который может произойти по ряду причин, таких как:
- Прием медикаментозных гормональных препаратов;
- Аутоиммунные и эндокринные заболевания;
- Стресс, недостаток сна;
- Неправильное питание, вредные привычки;
- Резкие колебания веса в большую или меньшую сторону;
- Нарушения в работе гипоталамуса и гипофиза;
- Наследственная предрасположенность;
- Некоторые хронические заболевания, напрямую не связанные с эндокринной системой и гормонами;
- Врожденная гиперфункция коры надпочечников;
- Нарушения работы щитовидной железы;
- Заболевания печени;
- Ранний климакс, естественный или искусственный;
- Чрезмерные нагрузки, как физические, так и эмоциональные.
Какие же именно гормоны вовлечены в процесс? Основной причиной анновуляторного бесплодия является снижение выработки гонадотропных гормонов. Именно благодаря им происходит рост фолликула с последующим формированием в нем яйцеклетки.
Иногда причиной такого бесплодия является резкое повышение содержания в крови эстрогенов, зачастую сопровождающееся развитием новообразований в органах репродуктивной системы. Кроме того, иногда состояние обусловлено врожденными аномалиями в строении яйцеклетки. В этом случае шансы на наступление беременности практически равны нулю даже после курса лечения.
Симптоматика инфертильности заключается собственно в неспособности забеременеть. Врачи говорят о инфертильности тогда, когда зачатие не наступает в течение более чем полутора лет, на протяжении которых велась регулярная половая жизнь без применения средств контрацепции, в том числе и в период овуляции. Если на протяжении этого срока женщина не смогла забеременеть, то необходимо обратиться к врачу репродуктологу.
Однако этот тип патологии несколько специфичен и может иметь некоторую симптоматику. Это такие признаки ,как:
- Депрессия;
- Кровотечения ациклические или усиленные во время месячных;
- Сбои менструального цикла, регулярные или периодические;
- Потеря веса;
- В более редких случаях наблюдается истощение яичников, разрастание их тканей, поликистоз;
- На анализах может обнаруживаться существенный избыток эстрогенов.
Тщательное обследование в этих случаях помогает установить причину заболевания достаточно быстро. Если лечение начато своевременно, то по сравнению с другими формами бесплодия, данная имеет относительно неплохой прогноз.
Для диагностики состояния проводятся следующие исследования:
- УЗИ;
- Анализ крови на половые гормоны и гормоны надпочечников;
- Кольпоскопия;
- Анализ проходимости труб;
- Мазок на флору из влагалища;
- Посткоитальный тест.
Это поможет исключить иные причины бесплодия и подтвердить его гормональный характер.
Лечение состояния происходит полностью медикаментозно. Хирургическое вмешательство необходимо лишь тогда, когда оно сопровождается наличием больших, не поддающихся гормональному лечению, гормонозависимых новообразований.
В основном же лечение направлено на ликвидацию патологического состояния. В зависимости от того, какими причинами вызвано состояние, проводят то или иное лечение. Выбирается одна из следующих схем:
- Кломифенцитрамов в сочетании с хорионическим гонадотропином – первый препарат вводят с 9 по 12 дни цикла по 50 мг в сутки на протяжении трех месяцев, второй – на 10, 12 и 14 дни по 1500 ЕД в сутки внутримышечно;
- Только хорионический гонадотропин на 10, 12, 14, 16 дни цикла, по 1500 ЕД в сутки на протяжении трех месяцев, внутримышечно;
- Менопаузный гонадотропин с 5 по 14 дни цикла по 75 ЕД ежесуточно, на 15, 17 и 19 дни — хорионический гонадотропин по 1500 ЕД, проводится 2-3 курса;
- Прогестерон – по одной таблетке с 5 по 25 дни цикла на протяжении 3-4 месяцев, предпочтение отдается двухкомпонентным препаратам;
- Эстрогены (при снижении их содержания) – 5 мг эстрадиола внутримышечно однократно на 12, 1 или 14 дни цикла, на протяжении трех-четырех циклов.
Имеются и другие, менее распространенные схемы лечения. Наиболее подходящую назначает врач.
Ановуляторное бесплодие успешно лечится. У 80% женщин с таким диагнозом при поликистозе яичников наблюдается полное излечение без хирургического вмешательства. Если хирургическое вмешательство все же необходимо, то излечение после него наступает в 70% случаев. Менструальный цикл восстанавливается, овуляция становится нормальной, с достаточным количеством яйцеклеток.
Достаточно часто при таком типе бесплодия экстракорпоральное оплодотворение проводить нет необходимости. Так как физических препятствий для наступления зачатия нет, оно вполне возможно естественным способом. Исключение составляет один случай – когда ановуляция развилась в результате истощения яичников. В этом случае яйцеклетки не будут вырабатываться в любом случае, какое бы лечение не проводилось. Даже стимулирование супер-овуляции тут бессильно.
В этом случае может проводиться экстракорпоральное оплодотворение. Перед ним, с помощью гормональных препаратов, готовят эндометрий к прикреплению эмбриона. Если все же возможно получить собственные единичные яйцеклетки, то используют их. Если невозможно – то донорские. Они оплодотворяются в лабораторных условиях, а затем помещаются в полость матки.
© А. з. Морчиладзе РОЛь ИНгМБИТОРА АРОМАТАЗЫ —
НИИ акушерства и гинекологии АНОВУЛЯТОРНОГО БЕСПЛОДИЯ
Санкт-Петербург УДК: 618.177:618.11-008.64-085
■ Целью исследования явилось сравнение эффективности индукции овуляции ингибитором ароматазы летрозолом (у 58 женщин) с применением кломифена (у 44 женщин) у больных с нормогонадотропной недостаточностью яичников. Оценивалось количество фолликулов, показатель толщины эндометрия, частота овуляции и наступления беременности, уровень половых стероидных гормонов и гонадотропинов в крови. Среднее количество предовулятор-ных фолликулов на фоне приема кломифе-на было статистически значимо ф 0,7). Применение кломифена привело к развитию синдрома гиперстимуляции яичников (СГЯ) у трех женщин, тогда как в циклах с летрозолом не отмечено СГЯ ни в одном случае. Таким образом, преимущественно монофолликулярный рост и отсутствие развития СГЯ при использовании летрозола по сравнению с кломифеном позволяет считать индукцию овуляции летрозолом предпочтительным у женщин с высоким риском развития СГЯ.
■ Ключевые слова: гормональная недостаточность яичников; индукция овуляции; ингибитор ароматазы; летрозол; селективный модулятор эстрогеновых рецепторов; кломифен.
Наиболее распространенной причиной нарушения менструального цикла и бесплодия является нормогонадотропная недостаточность яичников, характеризующаяся неизмененным содержанием гонадотропинов в крови. Эта форма овариальной недостаточности может быть обусловлена как регуляторными так и первичноовариальными факторами — наружный гени-тальный эндометриоз (НГЭ), аутоиммунный оофорит, хронический аднексит, синдром поликистозных яичников (СПЯ), гиперандрогенемия надпочечникового происхождения, сахарный диабет (СД), ожирение и т. д. [5, 4, 2]. Принцип лечения ановуляторного бесплодия при нормогонадотропной недостаточности яичников заключается в восстановлении овуляции. Неоднородность данной группы больных по этиологии, патогенезу и клиническим проявлениям до настоящего времени вызывает серьезные диагностические трудности и является причиной противоречивых сведений об эффективности используемых методов восстановления репродуктивной функции.
Наиболее широко распространенными средствами индукции овуляции при нормогонадотропной ановуляции являются антиэстрогенные препараты, к которым относится селективный модулятор эстрогеновых рецепторов — кломифен. Наблюдается значительное расхождение между частотой овуляции и наступлением беременностей у женщин, применяющих кломифен. Несмотря на высокую частоту восстановления овуляции (60-80 %) [23, 19], беременность наступает лишь в 10-20 % случаев. В дополнение к этому 20-25 % женщин с синдромом поликистозных яичников (СПЯ) — резистентны к кломифену [26], и, как правило, это женщины с ожирением, инсулинорезистентностью и выраженной гиперандро-генемией [22]. Периферические антиэстрогенные эффекты кломифена, проявляющиеся отсутствием адекватной трансформации эндометрия и/ или цервикальной слизи, объясняют низкую частоту наступления беременности при достаточно высокой частоте овуляции [1, 17]. Другим недостатком применения кломифена является высокая частота многоплодия, которая колеблется в пределах 6-11 % [9, 28], а частота синдрома гиперстимуляции яичников (СГЯ) достигает 5 % [19]. Следующим этапом стимуляции овуляции является применение гонадотропных препаратов, существенно увеличивающих риск многоплодной беременности и СГЯ [13, 16, 18].
В арсенале средств, используемых в преодолении анову-ляторного бесплодия, в последнее десятилетие все более частое применение находят высокоселективные нестероидные ингибиторы ароматазы, которые блокируют превращение ан-дрогенов в эстрогены. В эффективных дозах эти препараты подавляют продукцию эстрогенов на 97-99 % [10]. R. Casper и M. Mitwally (2001) [20] предположили, что торможение синтеза эстрадиола ингибиторами ароматазы в совокупности с механизмом отрицательной обратной связи, приводит к повы-
шению продукции гонадотропинов. Авторы считают, что рост фолликула и созревание ооцита в процессе применения ингибиторов ароматазы связан с повышенным содержанием андрогенов в фолликулярной жидкости, усиливающих биологические действия фолликулостимулирующе-го гормона (ФСГ) и инсулиноподобного фактора роста I. Авторы допускают также центральный эффект ингибиторов ароматазы: торможение ароматазы в ЦНС может приводить к усилению продукции гонадотропин-рилизинг гормона гипоталамусом и гонадотропинов гипофизом.
Большинство публикаций [29, 12, 14] по вопросу индукции овуляции посвящены сравнению терапевтических эффектов ингибиторов арома-тазы и кломифена. Это сопоставление вполне закономерно, так как оба препарата обладают антиэстрогенным эффектом. Многие исследователи [24, 17] считают перспективным использование ингибиторов ароматазы у больных СПЯ, резистентных к кломифену, тогда как другие [3] не разделяют эту точку зрения. Ингибиторы аро-матазы в отличие от кломифена не блокируют эстрогеновые рецепторы и не оказывают периферического антиэстрогенного действия, в первую очередь, на эндометрий [11, 27]. Однако в работе, проведенной Badawy и соавт. [7], в группе женщин, применяющих кломифен, отмечена большая толщина эндометрия по сравнению с таковой на фоне использования летрозола (9,2 ± 0,7 мм против 8,1 ± 0,1 мм соответственно).
Известно негативное влияние андрогенов на фолликулогенез в яичниках. Применение ингибиторов ароматазы может приводить к гиперан-дрогенемии и этим тормозить рост и развитие фолликулов.
В настоящее время для индукции овуляции используются два препарата данной группы — анастрозол (AstraZeneca UK Limited, Великобритания) и летрозол (Novartis Pharmaceuticals Corporation, США) в дозах от 2,5 мг до 7,5 мг с 3-5 по 7-9 день цикла. Применяется также однократная доза летрозола — 20 мг на 3-й день цикла. По данным H. Holzer и соавт. [20], при индукции овуляции ингибиторами аромата-зы частота овуляции составила 70-80 %, частота наступления беременности 20-27 % на цикл лечения, причем с увеличением дозы препарата его эффективность повышается [6, 15]. Вместе с тем некоторые исследователи [8] отметили сопоставимую эффективность применения разных доз ингибиторов ароматазы. Проблема разработки эффективных режимов применения ингибиторов ароматазы ждет своего разрешения.
Таким образом, представляется весьма актуальным оценить потенциал ингибиторов арома-
тазы, как стимуляторов овуляции, с целью уточнения их места в общей стратегии преодоления ановуляторного бесплодия, а также как альтернативы другим индукторам овуляции, в частности кломифену. Изучение влияния различных доз ингибиторов ароматазы на содержание ан-дрогенов и эстрогенов в периферической крови, на соотношение тестостерона и эстрадиола и на гонадотропную функцию гипофиза, позволят внести ясность в механизм действия ингибиторов ароматазы и разработать оптимальные режимы их применения при нормогонадотропной ановуляции.
Оценка эффективности применения разных доз летрозола при стимуляции функции яичников у женщин с нормогонадотропной недостаточностью яичников, а также сопоставление результатов индукции овуляции ингибитором ароматазы — летрозолом с эффективностью селективного модулятора эстрогеновых рецепторов — кломифеном.
Для решения поставленных задач в период с 2009 по 2011 гг. проведено обследование 58 женщин (I группа) с нормогонадотропной недостаточностью яичников, применяющих летрозол с целью стимуляции овуляции и 10 здоровых женщин репродуктивного возраста. Проведена ретроспективная оценка эффективности кломи-фена у 44 женщин с нормогонадотропной недостаточностью яичников (II группа).
В первой группе обследованных женщин (58 больных — 129 циклов), принимающих летрозол, возраст колебался от 20 до 38 лет и в среднем составил 29,2 ± 0,4 года, средний индекс массы тела (ИМТ) равнялся 22,3 ± 0,6 кг/м2 Возраст менархе варьировал от 10 до 17 лет и в среднем составил 12,4 ± 0,5 года. Позднее менархе (в возрасте более 15 лет) имели 6 обследованных женщин. Причиной нормогонадотропной недостаточности яичников у 24 больных явился СПЯ, 14 — хронический аднексит, 20 — наружный генитальный эндометриоз (НГЭ) различной степени распространенности. У трех женщин было выявлено сочетание НГЭ с аденомиозом, подтвержденным гистероскопией. Нарушения менструального цикла (НМЦ) по типу олиго-опсоменореи были выявлены у всех больных СПЯ, из них у 17 нарушения цикла начались с менархе. Первичная аменорея в анамнезе отмечена у одной женщины, вторичная аменорея — у 4 больных с нор-могонадотропной недостаточностью яичников. Продолжительность вторичной аменореи варьи-
ровала от 6 до 32 месяцев и в среднем составила 14,3 ± 0,3 месяца. Первичным бесплодием страдали 36 больных, вторичным — 22, среди которых 5 женщин имели в анамнезе роды, 9 — невынашивание беременности, 6 — искусственные аборты, 2 — внематочную беременность. Четыре женщины в прошлом перенесли консервативную миомэктомию, у 9 были выполнены оперативные вмешательства на яичниках — в четырех случаях цистэктомия по поводу эндометриоидных кист, в 5 — диатермокаутеризация яичников. Комбинированное лечение по поводу эндометрио-за I-IV степени распространенности в прошлом получали 15 больных.
Во второй группе из 44 женщин с нормогона-дотропной недостаточностью яичников проведена индукция овуляции кломифеном. Средний возраст больных составил 30,3 ± 1,4 года (от 22 до 36 лет). У 16 из них овариальная недостаточность проявлялась недостаточностью лютеино-вой фазы, у 28 — ановуляцией. Недостаточность яичников развилась на фоне следующих заболеваний: СПЯ — у 17, НГЭ — у 15, хронический аднексит — у 12 больных. Регулярный менструальный цикл имели 18 женщин, НМЦ по типу олиго-опсоменореи — 27. Беременности в анамнезе имели 16 женщин, из них: у 6 — роды, у 8 — искусственные аборты, у двух — внематочная беременность. Критериями исключения явились: СД 1-го и 2-го типа, ожирение или дефицит массы тела, гипотиреоз, пролактинсекретирующая аденома гипофиза, гиперандрогенемия надпо-чечникового происхождения, системные заболевания, патоспермия партнера.
Обследовано 10 здоровых женщин репродуктивного возраста с регулярным менструальным циклом, не имеющих гинекологических заболеваний в анамнезе. Возраст обследованных женщин варьировал от 24 лет до 31 года и в среднем составил 27,9 ± 0,7 лет. ИМТ в среднем равнялся 21,1 ± 0,5 кг/м2 Средний возраст менархе у здоровых женщин составил 12,2 ± 0,3 года. Продолжительность менструального цикла колебалась от 26 до 32 дней, в среднем равнялась 28,1 ± 0,4 дня. Беременности в анамнезе имели 5 женщин, из них у четырех были роды, у одной — искусственный аборт.
Гормональное обследование включало определение в крови ЛГ, ФСГ, пролактина, дэгидро-эпиандростерона сульфата (ДГЭА-С), общего тестостерона (Алкор Био, Россия), а также андро-стендиона, эстрадиола, свободного тестостерона (DRG diagnostics, Германия) иммуноферментным методом на 2-3-и и 8-9-и день менструального цикла. Ультразвуковое исследование (УЗИ) органов малого таза проводили вагинальным датчиком (7,5 МГц, SonoасеX4, — Корея). Оценивали
толщину и эхогенность эндометрия, количество и размеры лидирующих фолликулов на 8-й, 12-й и 14-й день менструального цикла. Во второй фазе цикла определяли наличие желтого тела и структуру эндометрия.
Статистическую обработку проводили с использованием программ 0,7). The pregnancy rate per cycle was 17,1 %o in women receiving letrozole and 13,6 %o in patients taking clomiphene, without statistically difference between the groups (p > 0,7). Ovarian hyperstimulation syndrome (OHSS) occurred in 3 women receiving clomiphene and in no cases in letrozole group. Advantages of letrozole in comparison to clomiphene include absence of antiestrogenic adverse effects, predominantly monofollicular growth, and absence of OHSS, that might be well-promising for ovulation induction in women with height risk of OHSS.
■ Key words: normogonadotropic ovarian deficiency; ovulation induction; aromatase inhibitors; letrozole; selective modulator of estrogen receptors; clomiphene.
■ Адреса авторов для переписки-
Морчиладзе Ани Зурабовна — аспирант.
НИИ акушерства и гинекологии им. Д. О. Отта СЗО РАМН РАМН, отделение гинекологической эндокринологии. 199034, Россия, Санкт-Петербург, Менделеевская линия, д. 3. E-mail: ani.otta@mail.ru.
Morchiladze Ani Zurabovna — PhD student.
D. O. Ott Research Institute of Obstetrics and Gynecology.
Department of Gynecological Endocrinology.
199034 Russia, St. Petersburg, Mendeleyevskaya Line, 3.
источник