Я думаю, что далеко не все женщины даже слышали о таком состоянии, и не встречались с ним в жизни, но для тех, кто длительно лечится по поводу бесплодия, данное название может быть вполне знакомо, так как на проявления данного синдрома проводят обследование при невыясненных причинах бесплодия. И даже если данный диагноз вдруг появится в карточке ребенка – это не повод для отчаяния, а повод для того, чтобы пройти полноценное обследование и получить квалифицированную помощь и терапию, что даст возможность выносить и родить малыша без каких-либо проблем. Но сначала давайте разберемся в терминологии и происхождении загадочного синдрома.
Антифосфолипидный синдром обычно регистрируется у женщин, имеющих привычное невынашивание беременности, эпизоды внутриутробной смерти плода или резкие задержки в его развитии. При подобных состояниях в крови женщин обычно определяются особые антитела, возникающие на собственные компоненты мембран клеток – фосфолипиды, особые соединения, делающие оболочки живых клеток стабильными. Для жизни женщины они как таковые, не опасны, но во время беременности они могут стать причиной тромбообразования в области сосудов плаценты.
Из-за микротромбиков внутри сосудов плаценты происходит нарушение питания плода, что может приводить к разным осложнениям:
— резкой задержке внутриутробного развития и порокам развития,
— внутриутробной гибели плода и замершей беременности,
— отслойкам плаценты,
— формированию осложнений течения беременности.
Кроме того, при развитии антифосфолипидного синдрома у женщин выявляется наличие в организме особого волчаночного фактора – антикоагулянта. То есть это указания на то, что в организме существует вялотекущий иммунный процесс, поражающий собственные ткани и органы.
Чем же так опасен этот антифосфолипидный синдром? Он не дает нормально протекать беременности у женщины, часто давая упорные, привычные выкидыши, развитие преждевременных родов, формируя поздние токсикозы беременности (гестоз). Это дает повышение давления у женщины с еще большим нарушением кровообращения и ухудшением течения беременности. Формируется нарушение питания плацентой плода – так называемая фето-плацентарная недостаточность, и малышу в таких условиях резко может не хватать кислорода. В условиях имеющегося антифосфолипидного синдрома частота осложнений беременности и родов достигает 80-85%, антитела к фосфолипидам обнаруживают у примерно 2-3% клинически здоровых женщин, а если у женщины имеется невынашивание – как минимум в 15% и более, причем это антитела к фосфолипидам органов репродуктивной женкой системы. Если же у женщины выявляется два и более выкидыша или замерших беременности, антифосфолипидные антитела обнаруживают у таких пациенток практически в каждом втором-третьем случае.
Как себя может проявлять синдром?
Выделяют первичную форму антифосфолипидного синдрома, когда антитела к фосфолипидам возникают на фоне здоровья иммунной системы и без поражения каких-либо других ее органов. В таком случае обычно антитела к фосфолипидам обнаруживают в крови, и более никаких изменений в организме женщины не происходит, все органы и системы здоровы и вроде бы функционируют клинически нормально, есть только проблемы с зачатием, вынашиванием и рождением. А при всем этом женщина чувствует себя вполне нормально, может не иметь даже никаких хронических заболеваний.
Вторичный антифосфолипидный синдром, дающий осложнения во время беременности, обычно возникает как сопутствующее проявление аутоиммунной патологии, в частности заболеваний системной волчанкой, ревматизмом или аутоиммунным поражением щитовидной железы. То есть вторичный синдром возникает как осложнение имеющегося поражения иммунитета, когда антитела начинают распространяться за границу одного органа или системы, ткани. Обычно у таких пациенток есть изначально жалобы на здоровье, и к ним присоединяются проблемы с деторождением.
Проявления антифосфолипидного синдрома в первичном или вторичном варианте будут схожими. Обычно происходит формирование привычного выкидыша. Когда беременность если и возникает, то прерывается в ранние сроки. Также могут формироваться повторяющиеся замершие беременности в сроки первого-второго триместра, могут быть внутриутробная гибель плода и тяжелые проявления гестозов, преждевременные роды в разные сроки беременности. Во время беременности может развиваться тяжелая недостаточность системы мать-плацента-плод, снижение количества тромбоцитов, также могут развиваться тяжелые предвестники проблем с беременностью в виде нарушения свертывания крови, вплоть до ДВС. Без лечения проблемы плода у женщин с антителами к фосфолипидам возникают в практически 90-95% случаев. Среди женщин такой синдром регистрирует примерно у 3-4%.
При наличии каких-либо проблем в репродуктивном здоровье, беременность всегда нужно планировать и тщательно к ней готовиться. Особенно важно подробное обследование и подготовка к беременности тем женщинам, которые ранее имели замершую беременность, самопроизвольный выкидыш в сроки до 9-10 недель, ранний токсикоз или формирование гестоза, а также признаки отслойки хориона или плаценты. При таких состояниях проводится целый цикл исследований – определяют наличие половых инфекций, том числе и скрытых, методами иммуноферментного анализа или полимеразной цепной реакции, а также исследование систем свертывания крови. Также проводится анализ крови на исключение волчаночного антикоагулянта, а также антител к фосфолипидам. Проводится комплексная оценка системы иммунитета при помощи особых анализов.
При антифосфолипидном синдроме подготовка к беременности будет включать следующие этапы:
— проведение комплексной оценки состояния здоровья репродуктивных органов обоих супругов. Если выявляются разного рода эндокринные заболевания, их необходимо корректировать.
— проведение комплекса анализов на выявление различного рода инфекционных агентов в области репродуктивной системы и всего организма в целом. Проводят выявление ДНК возбудителя или антител к нему, по уровню антител проводят определение активности процесса. При выявлении факта инфекции проводится профилактика при помощи антибиотиков, иммуноглобулинов, других препаратов химиотерапевтического ряда. Также могут применяться особые препараты ферментного ряда.
— проводят исследование иммунной системы и если выявлены нарушения, показана иммунокоррекция медикаментозными препаратами. В иммунотерапии применяют вифероновые свечи, «Кипферон» или «Ридостин». Могут быть проведены курсы лимфоцитотерапии – вводят женщине лимфоциты мужа с целью формирования толерантности к ним.
— также проводят оценку степени изменений в системе гемостаза, при необходимости проводится коррекция препаратам антитромботического ряда, назначение «Курантила» или «Инфукола». При выявлении признаков аутоиммунного процесса и для активного воздействия на данную патологию применяют гормональные препараты глюкокортикоидного ряда, ферментные препараты или препараты индукторов интерферона. Также проводят коррекцию препаратами для пополнения питательных запасов в тканях и профилактики гипоксии тканей, это могут быть препараты янтарной кислоты, «Корилип» или «Лемонтар», препараты витаминов и метаболитные комплексы.
При наличии проблем с беременностью также выявляется и нарушение в психологическом состоянии пары, и крайне важно проведение еще и психокоррекционных мероприятий. Проводятся курсы успокоительных препаратов, терапия антидепрессантами, курсы «Магне В6», как активного участника обменных процессов, в том числе и головного мозга. Очень помогает проведение парной или индивидуальной психотерапии. Важно также разъяснить супругам необходимость проведения детального обследования состояния здоровья, а если есть проблемы с внутренними органами – полноценного лечения, так как состояние здоровья в целом может существенно влиять на течение антифосфолипидного синдрома в целом.
источник
Почему беременность в целом здоровых женщин снова и снова прерывается? Можно ли справиться с этой проблемой? Разгадку повторных выкидышей нашли российские врачи под руководством заведующего кафедрой акушерства и гинекологии, руководителя лаборатории патологии гемостаза ММА им. И.М.Сеченова, профессора Александра Давидовича МАКАЦАРИЯ.
Почему беременность в целом здоровых женщин снова и снова прерывается? Можно ли справиться с этой проблемой? Разгадку повторных выкидышей нашли российские врачи под руководством заведующего кафедрой акушерства и гинекологии, руководителя лаборатории патологии гемостаза ММА им. И.М.Сеченова, профессора Александра Давидовича МАКАЦАРИЯ.
— В чем суть ваших открытий?
— Одна из причин осложнений, возникающих на разных этапах беременности, — это нарушения в системе свертывания крови. По разным причинам кровь человека загустевает и начинает течь по сосудам с замедленной скоростью. Возникает большой риск образования тромбов. Они, в свою очередь, могут закупорить сосуды и привести к тяжелым последствиям.
Из-за нарушений свертывания крови у одних женщин в матке не приживается плодное яйцо. Других дам преследуют бесконечные выкидыши на ранних сроках. У третьих возникают нарушения в плаценте. И ребенок, недополучая кислород, рождается слабым, больным, а то и вовсе погибает.
— Отчего возникают такие нарушения?
— Один из виновников — это так называемый антифосфолипидный синдром. Иммунная система начинает работать как бы против себя. Борясь с самим собой, организм вырабатывает особые вещества, которые сгущают кровь, и она уже не может нормально двигаться по сосудам.
Эти нарушения имеют и генетические корни. У 10% современных европейцев существуют особые генетические нарушения, по которым можно определить, предрасположен ли человек к развитию тромбозов. У человека произошла мутация некоторых генов, отвечающих за свертывание крови. Такие нарушения передаются по наследству из поколения в поколение. Причем «поломка» гена дает о себе знать только в определенных обстоятельствах — во время беременности, операции, при травмах, приеме гормонов. Это те условия, при которых увеличивается свертываемость крови.
То есть беременность и лечение гормонами — это не причины неприятностей. Это почва, на которой лучше всего прорастает неблагоприятная наследственность. А когда генетические дефекты соединяются с антифосфолипидным синдромом, плюс наступает беременность, то риск появления тромбозов особенно высок. Соответственно, весьма высока вероятность того, что у женщины будут проблемы с вынашиванием.
— Почему происходят изменения в генах?
— Одна из причин — действие на человека современной цивилизации. Частые операции с неизбежными кровопотерями вынуждают организм на такой ответ. Возникает как бы «защитная реакция» в виде повышенного свертывания крови. Она становится более густой и вязкой. Для того чтобы в критической ситуации при операции или родах «расход» крови был бы минимальным.
— Как же быть? Дефектные гены ведь исправить невозможно?
— К сожалению, внести нужные коррективы в гены мы пока не в силах. Но это не значит, что женщинам с невынашиванием и другими проблемами свертывания крови помочь нельзя. Просто в такой ситуации мы идем иначе — не путем устранения причины заболевания, а путем прицельной профилактики.
Сегодня появилась возможность тщательной диагностики таких генетических нарушений. По результатам анализов мы можем отобрать женщин в группу риска. А затем будем делать все, чтобы свести к минимуму возможность осложнений со стороны свертывания крови, в том числе во время беременности. Женщине нужно будет скорректировать образ жизни, питание и начать принимать ряд препаратов. Их прием необходим в течение всей беременности.
— Кому прежде всего стоит пройти анализ свертывания крови?
— Прежде всего, тем дамам, у которых уже были случаи невынашивания беременности — выкидыши или преждевременные роды. Тем, у кого диагностировали нарушения кровотока в плаценте. Обязательно должны обследоваться женщины, у которых рождались мертвые дети или младенцы погибали в первые месяцы жизни.
Исследовать, как происходит процесс свертывания крови, нужно и тем, у кого в роду были нарушения со стороны сердечно-сосудистой системы. Например, у близких родственников были тромбозы, инсульты, инфаркты. Дамы, планирующие беременность, должны поинтересоваться у своих мам и бабушек, не было ли у них проблем с вынашиванием, все ли дети родились живыми. Диагностика необходима и людям, предрасположенным к полноте, имеющим устойчивость к инсулину, больным сахарным диабетом.
— Можно ли при диагностике обойтись традиционным анализом крови на протромбин?
— Нет, обычный анализ на протромбин в этом деле вам не поможет. На сегодняшний день он не дает нужной информации и даже может ввести человека в заблуждение. Ведь и при высоком протромбине у вас может развиться кровотечение, а при низком -тромбоз, и наоборот. Сегодня существуют другие анализы, которые показывают, что кровь в организме свертывается.
— После того как генетическая теория предрасположенности к тромбозам доказана, можно ли оправдать гормональную терапию, которую совсем недавно американцы подвергли нещадной критике?
— Шум вокруг заместительной гормональной терапии (ЗГТ) имел следующее основание. Американская организация ’Инициатива во имя женщины» исследовала десятки тысяч женщин, принимавших ЗГТ. И в результате сделала заключение о том, что прием женских гормонов хотя и снижает симптомы менопаузы, но в то же время увеличивает риск инфарктов и инсультов в
Такие ошеломляющие цифры остановили многих врачей, которые до того спокойно назначали гормоны своим пациенткам. Но наши собственные исследования показали, что риск сосудистых проблем повышается не оттого, что препарат плохой. А потому, что в группу обследованных попали дамы как раз с наследственной склонностью к тромбозам. Женщинам с этой генной мутацией действительно не стоит принимать оральные контрацептивы и препараты ЗГТ.
Но этих дам опять же можно отобрать в группу риска и лечить альтернативными способами, например, гомеопатией, фототерапией. Либо в крайних случаях им тоже можно давать гормональные препараты, но с параллельным приемом лекарств, разжижающих кровь.
Тем же дамам, у которых в системе гемостаза нет никаких пугающих изменений, отказываться от необходимых им гормонов не стоит. Так что эти средства никто не отменял. Более того, при некоторых серьезных заболеваниях гормонотерапия просто незаменима.
— Кроме традиционных аспирина и курантила, какие новые средства применяются при повышенной свертываемости крови?
— Появилась целая группа новых препаратов, среди которых доминирует низкомолекулярный гепарин. Первым таким лекарством стал Фраксипарин, затем — Фрагмин. Это препараты XXI века: они лишены плохих качеств своих предшественников. Они укрепляют сосудистую стенку и оказывают великолепный профилактический эффект. Совсем недавно выпущен новейший французский препарат Арикстра.
Гепарин очень хорош для профилактики тромбофилических осложнений во время беременности. Применяя это средство, мы добились вынашивания у 91% женщин, которым до того не удавалось родить ребенка.
Кроме того, для предотвращения тромбозов и анемии беременные женщины принимают фолиевую кислоту. Причем в группе риска этот препарат назначается в довольно высоких дозах.
Есть еще одна новая группа препаратов, необходимых при нарушениях системы свертывания крови. Речь идет о полиненасыщенных жирных кислотах. Эти вещества препятствуют слипанию клеток крови. Они содержатся в некоторых продуктах питания, а теперь стали выпускаться и в виде лекарственных препаратов. Например, в аптеках продается такое средство, как Омега-3.
— Скажите, а если у человека есть наследственная предрасположенность к тромбозам, какие факторы могут спровоцировать их выход из тени?
— Основные факторы — это беременность, операция. Кроме них, могут повысить свертываемость крови злоупотребление кофе и курение. Также не рекомендуется есть много острого, жирного и копченого. Масса тела тоже своеобразный фактор риска. У чересчур полных дам всегда страдает система свертывания крови и беременность и роды протекают тяжелее.
— Как быть, если антифосфолипидный синдром или дефектный ген найдены, а женщина собралась беременеть?
— Если у вас найдут какие-то нарушения, то за месяц до беременности вы начнете принимать противотромботические препараты. Лечение будет продолжаться в течение всего времени вынашивания малыша. В этом случае вероятность благополучного исхода беременности очень высока. Эффективность правильного и своевременного лечения сегодня приближается к 100%.
источник
В последние десятилетия все чаще в медицинской практике имеют место случаи «необъяснимого» бесплодия или привычного невынашивания беременности (неоднократно повторяющиеся замершие беременности, привычный выкидыш). Некоторые специалисты связывают такое положение дел со значительным ухудшением состояния окружающей нас среды, с изменением структуры питания, с широко распространённым в пищевой промышленности использованием различных заменителей и добавок, применением в медицине синтетических медикаментов и антибиотиков, малоподвижным образом жизни, постоянными стрессами и тому подобными факторами. Совершенно естественно, что на такие изменения не может не реагировать и иммунная система человека, в которой все чаще происходят наименее изученные медициной нарушения иммунитета, приводящие к повреждению собственных тканей и клеток организма самими же иммунными процессами (так называемые аутоиммунные заболевания).
Так, например, по данным разных источников от 10 до 15 процентов всех беременностей заканчиваются выкидышем. Часто бывает и так, что женщина даже и не подозревает еще, что беременна, а совсем крошечный эмбрион погибает до начала предполагаемой очередной менструации. Причин тому может быть несколько. Но чаще всего к этому приводят все те же аутоиммунные нарушения в организме матери.
Беременность – это настоящее природное таинство, совершенно уникальное и неповторимое. Ведь, по сути, беременность – это процесс, с помощью которого природа позволяет создать совершенно новый человеческий организм на основе синтеза клеток матери и отца ребенка. При этом в организме женщины на протяжении 9-ти месяцев живет и развивается генетически отличный от ее собственного организм ребенка, поскольку ребенок наследует не только гены матери, но и отца.
В норме функционирование иммунной системы предполагает, что клетки этой системы циркулируют в организме, выслеживая на поверхности всех без исключения клеток, что встречаются на их пути, так называемый белковый (генетический) код, который и является главным фактором тканевой совместимости. В организме человека иммунный ответ обусловлен, прежде всего, белками, входящими в так называемую HLA-систему (от английского Human Leukocyte Antigens – человеческие лейкоцитарные антигены). У каждого человеческого организма на поверхности клеток имеется генетически определенный набор таких белков. Этот набор называется тканевым типом. Если у двух людей тканевые типы похожи, то говорят о тканевой совместимости. При этом белки могут полностью совпадать (полная тканевая совместимость) или частично (частичная совместимость). Чем ниже степень совместимости, тем выше вероятность иммунного конфликта, потому что именно эти белки служат своеобразным маркером для иммунной системы, на основе которого она делит клетки на «свои» и «чужие». Для того, чтобы выявить вероятность подобного конфликта, проводят специальные исследования, например, HLA-типирование, т.е. исследование крови, которое позволяет выявить, в какой степени супруги сходны или различимы по антигенам (белкам) тканевой совместимости.
Каждый человек имеет неповторимое, свойственное только ему и отличное от любого другого человека сочетание HLA-генов, которое изначально строится на типированных генах отца и матери (по одному гену от каждого родителя). Если мужчина и женщины схожи по показателям тканевой совместимости, то это приводит к тому, что и ткани эмбриона похожи на ткани организма матери. В результате иммунная система матери может реагировать недостаточно, и необходимые для формирования эмбриона, его имплантации и успешного протекания беременности механизмы не запускаются, что приводит к невозможности имплантации эмбриона.
Исследование под названием HLA-типирование проводится по первому и второму классу. Это означает, что анализ проводится по двум классам HLA-антигенов. HLA-антигены первого класса встречаются на поверхности всех клеток человеческого организма, а HLA-антигены второго класса присутствуют только на поверхности клеток, принимающих участие в реакциях иммунной системы (активированные Т-лимфоциты, уничтожающие поврежденные чужеродные клетки, например, вследствие подавления инфекции, и стимулирующие другие клетки – В-лимфоциты и макрофаги, а также моноциты и дендритные клетки). Для того, чтобы провести такой анализ, требуется взять кровь из вены, как у женщины, так и у мужчины. В результатах анализа HLA-типирования лаборант указывает выявленные при данном исследовании совпадения для данной конкретной пары «мужчина-женщина». Если наблюдается совпадение по двум или даже более антигенам HLA, то очень часто это может быть причиной невынашивания беременности или ранних выкидышей, иногда даже на сроке 2-3 недели с момента зачатия, так что женщина даже не подозревает о самом факте зачатия. Иногда в таких ситуациях говорят, что природа обладает особой мудростью и предусмотрела специальный механизм, который не дает возможности зародиться и развиваться поражённому наследственной болезнью или нежизнеспособному организму. Причем и методы ЭКО в таких ситуациях также могут оказаться неэффективными. Связано это с тем, что организм каждого человека имеет гены, которые определяют предрасположенность к тем или иным болезням, что чаще всего не опасно для нашего потомства (например, если ген – рецессивный). Но в том случае, если этот ген присутствует в организме и отца, и матери, то вероятность рождения малыша, страдающего этим серьезным заболеванием, увеличивается многократно.
Иногда клетки иммунной системы сравнивают со стражами правопорядка. Если эти клетки обнаруживают «чужих» (это могут быть и чужеродные организму бактерии, различные вирусы, и также собственные измененные под влиянием каких-то внешних факторов клетки организма), то иммунная система немедленно выдает иммунный ответ. И если иммунная система вынуждена часто сражаться с разного рода «врагами», то со временем она становится чрезмерно активной. В этом случае и высока вероятность иммунологического бесплодия. Поскольку иммунная система человека – это очень сложный и комплексный механизм, то и сбои он может давать в различных участках этого комплекса (т.е. в зависимости от того, в каком месте человеческого организма развивается та или иная иммунная реакция). Так, например, в период овуляции у женщины под воздействием гормональных факторов в шейке матки вырабатывается специальная слизь, которая в норме помогает сперматозоидам проникнуть внутрь и, пройдя через матку и маточные трубы, достичь яйцеклетки. Однако, под воздействием чрезмерных аутоиммунных реакций организм женщины может вырабатывать такие антитела, которые приводят к «склеиванию» (агрегации) и гибели сперматозоидов в цервикальном канале. В этом случае говорят о такой разновидности иммунологического бесплодия. Аналогичным образом, возможно и «уничтожение» сперматозоидов при контакте их с яйцеклеткой или отторжение уже эмбриона в процессе непосредственной имплантации в полости матки. Самые последние исследования показывают, что если в организме женщины присутствуют антиспермальные тела, то они не только могут препятствовать зачатию, но также могут негативно влиять на течение беременности, приводить к задержке развития плода, токсикозу и даже вызвать самопроизвольный выкидыш.
И, в общем то, учитывая, что организм ребенка – чужероден для иммунной системы матери, то он погибал бы всякий раз, однако в норме матка – это своего рода иммунологически-привилегированное (для плода) место в организме женщине, поскольку именно в матке в процессе беременности природа предусмотрела специальную защиту, скрывающую клеточные структуры плода от иммунной системы материнского организма. Однако иногда случается так, что у некоторых женщин эта защитная система не включается, что приводит к отторжению плода, т.е. к раннему выкидышу. Современная медицина совсем недавно начала исследовать эту патологию и методы ее лечения находятся на этапе экспериментальной разработки. К их числу относятся введение лимфоцитов потенциального отца ребенка для того, чтобы повысить восприимчивость организма матери к отцовским генам еще до наступления беременности. Еще одним методом служит внутривенное введение иммуноглобулинов.
Одной разновидностью аутоиммунных нарушений является выработка антител к собственным тканям в организме женщины, последствием которой являются различные нарушения в системе гемостаза (т.е. в системе свертываемости крови). Такие антитела приводят к тому, что кровь становится более вязкой и это приводит к образованию сгустков крови разной величины (т.е. происходит формирование тромбозов и тромбоэмболических состояний). В процессе беременности их действие проявляется в том, что плод не может нормально развиваться, т.к. микротромбы в системе кровообращения матери препятствуют его достаточному кровоснабжению. Все это также может приводить как к задержке развития плода, так и к его гибели.
Выделяют три основных вида таких антител: волчаночный антикоагулянт, антитела к кардиолипину и антифосфолипидные антитела. Выявить их наличие можно с помощью специального анализа крови — гемостазиограммы. Лечение подобных аутоиммунных нарушений проводится с помощью специальных схем приема низкомолекулярных гепаринов или при помощи стероидов, которые подавляют подобную дисфункциональную реакцию иммунной системы.
Чаще всего антифосфолипидный синдром развивается под влиянием тяжелых инфекций либо вследствие генетических факторов, т.е. наследственно передающей предрасположенности к образованию тромбозов и тромбоэмболических состояний. Во втором случае (т.е. в случае «плохой» наследственности) в организме имеется дефектный ген (мутация), который и приводит к нарушениям в системе свертывания крови. Последствия такого гена мужчины ощущают, как правило, после сорока лет (инфаркты, инсульты), а женщины – во время беременности. В норме во время одноплодной беременности объем циркулирующей крови женского организма возрастает в среднем на 30-50%, при этом также повышаются показатели свертываемости и вязкости крови. Природа и здесь предусмотрела специальный механизм, который защищает женщину от патологической кровопотери во время родов. Однако у тех женщин, у которых имеется наследственная склонность к тромбофилии (вследствие мутаций в генах гемостаза) действие этого механизма может приводить к образованию тромбов в сосудах плаценты, а это в свою очередь может повлечь различные осложнения беременности (например, плацентарная недостаточность с задержкой развития плода в сочетании с гипоксией) вплоть до гибели плода на разных сроках беременности. Также мутации в генах гемостаза могут привести к сбоям и в функционировании организма самой матери (повышение артериального давления, отеки, дородовые кровотечения из-за отслойки плаценты и т.п.).
Следует также отметить, что по своим клиническим проявлениям наследственная и приобретенная склонность к образованию тромбозов очень похожи, но при этом также и встречаются случаи, когда одна дополняет другую, и в такой ситуации риск формирования тромбоэмболических состояний значительно возрастает, приводя к очень серьезным последствия для здоровья человека.
Как же распознать у себя наличие подобных неблагоприятных факторов течения беременности? Специалисты рекомендуют делать подробное исследование гемостаза (такое исследование называется обычно «расширенная гемостазиограмма») в том случае, если:
- в семье у близких родственников (матери, отца, бабушек, дедушек) были любые тромбозы, инфаркты или инсульты;
- если у самой женщины когда-то наблюдались систематическое повышение артериального давления, мигренеподобные головные боли, инфаркт, инсульт, варикозное расширение вен;
- имелись беременности, которые сопровождались такими серьезными осложнениями как привычное невынашивание, тяжелый гестоз, послеродовые кровотечения);
- неудачные попытки ЭКО.
Такой анализ делается один раз в жизни, и если он обнаруживает генетические изменения в гемостазе женщины, либо приобретенные изменения (антифосфолипидный синдром), то в этом случае требуется особый подход к ведению беременности со стороны наблюдающего женщину акушера-гинеколога, а также особого внимания со стороны женщины к своему здоровью как во время непосредственно беременности, так и в возрасте «после сорока».
Следует еще отметить, что иногда единственным признаком таких нарушений является наличие ложноположительных тестов на реакцию Вассермана. Женщину ничего не беспокоит, но в ее жизни были случаи, когда этот анализ давал положительный результат при отсутствии всех прочих симптомов сифилиса.
Антифосфолипидный синдром и мутации в генах гемостаза довольно распространенное явление: по данным европейских ученых наследственная тромбофилия встречается у 10-12% населения, а у женщин с привычным невынашиванием – у 48%, для антифосфолипидного синдрома эти цифры равны 5-6% и 52%, соответственно.
Очень важное значение при данной патологии имеет антитромботическая диета, которую необходимо соблюдать не только беременным с антифосфолипидным синдромом и мутациями в генах гемостаза, но и тем, кто только еще планирует беременность. Такая диета исключает жирное мясо, сало, бобовые, твёрдые сорта сыра, жирное цельное молоко, листовые овощи (шпинат, сельдерей, петрушка) и предписывает продукты, способствующие снижению свёртываемости крови. К числу последних относятся морепродукты, корнеплоды, ягоды (для нашей климатической зоны особенно важны сезонные сибирские ягоды), сухофрукты, морская капуста, имбирь.
источник
При диагнозе антифосфолипидный синдром — не отчаивайтесь: квалифицированные врачи помогут вам стать счастливой мамой.
При антифосфолипидном синдроме (АФС) у женщин с привычным невынашиванием беременности, внутриутробной гибелью плода или задержкой его развития в крови определяют антитела, вырабатываемые организмом беременной к собственным фосфолипидам — особым химическим структурам, из которых построены стенки и другие части клеток. Эти антитела (АФА) становятся причиной образования тромбов при формировании сосудов плаценты, что может приводить к задержке внутриутробного развития плода или его внутриутробной гибели, отслойке плаценты, развитию осложнений беременности. Также в крови женщин, страдающих АФС, выявляют волчаночный антикоагулянт (вещество, определяемое в крови при системной красной волчанке 1 ).
Осложнениями АФС являются выкидыш и преждевременные роды, гестозы (осложнения беременности, проявляющиеся повышением артериального давления, появлением белка в моче, отеков), плодово-плацентарная недостаточность (при этом состоянии плоду не хватает кислорода).
При АФС частота осложнений беременности и родов составляет 80%. Антифосолипидные антитела к различным элементам репродуктивной системы обнаруживаются у 3% клинически здоровых женщин, при невынашивании беременности — у 7— 14% женщин, при наличии двух и больше самопроизвольных абортов в анамнезе — у каждой третьей пациентки.
При первичном АФС выявляются только специфические изменения в крови.
При вторичном АФС осложнения беременности или бесплодие наблюдаются у больных с аутоиммунными заболеваниями,такими, как системная красная волчанка, аутоиммунный тиреоидит (воспаление щитовидной железы), ревматизм и др.
Первичный и вторичный АФС имеют сходные клинические проявления: привычное невынашивание беременности, неразвивающиеся беременности в I—II триместрах, внутриутробная гибель плода, преждевременные роды, тяжелые формы гестоза, плодово-плацентарная недостаточность, тяжелые осложнения послеродового периода, тромбоцитопения (снижение количества тромбоцитов). Во всех случаях предвестником гибели плодного яйца является развитие хронической формы ДВС-синдрома.
Наблюдения показывают, что без лечения гибель плода происходит у 90—95% женщин, имеющих АФА.
Среди пациенток с привычным невынашиванием беременности АФС выявляется у 27—42%. Частота этого состояния среди всего населения равна 5%.
Особенно важна подготовка к беременности женщин, имевших в анамнезе неразвивающиеся беременности, самопроизвольные аборты (на сроках 7—9 недель), ранние и поздние токсикозы, отслойку хориона (плаценты). В этих случаях проводится обследование на генитальные инфекции (методами иммуноферментного анализа — ИФА, полимеразной цепной реакции — ПЦР ), исследование гемостаза — показателей свертывающей системы крови (гемостазиограммы), исключают наличие волчаночного антикоагулянта (ВА), АФА, оценивают систему иммунитета с помощью специальных анализов.
Таким образом, подготовка к беременности включает в себя следующие этапы:
- Оценка состояния репродуктивной системы супругов. Коррекция эндокринных нарушений (гормональная терапия).
- Обследование пары с целью выявления инфекционного агента с применением ПЦР (выявление ДНК возбудителя) и серодиагностики (выявление антител к данному возбудителю), отражающей степень активности процесса. Лечение выявленных инфекций с помощью химиотерапевтических и ферментных препаратов (ВОБЕИЗИМ, ФЛОГЕНЗИМ), иммуноглобулинов (ИММУНОВЕНИН).
- Исследование состояния системы иммунитета, ее коррекция с помощью медикаментов (РИДОСТИН, ВИФЕРОН, КИПФЕРОН); лимфоцитотерапия (введение женщине лимфоцитов мужа); контроль и коррекция системы микроциркуляторного гемостаза
- Выявление аутоиммунных процессов и воздействие на них (для этого применяются глюкокортикоиды и альтернативные препараты: энзимы, индукторы интерферона).
- Коррекция энергетического обмена обоих супругов: метаболическая терапия с целью снижения дефицита кислорода в тканях — тканевой гипоксии (ИНОЗИЕ-Ф, ЛИМОНТАР, КОРИЛИП, метаболические комплексы).
- Психокоррекция — устранение тревожных состояний, страха, раздражительности; применяются антидепрессанты, МАГНЕ-В6 (этот препарат улучшает процессы обмена, в том числе и в головном мозге). Применение различных методов психотерапии.
- При наличии заболеваний различных органов у супругов, планирующих беременность, необходима консультация специалиста с последующей оценкой степени повреждения больного органа, адаптационных возможностей организма и прогноза развития плода с исключением генетических аномалий.
Чаще всего при наличии АФС выявляется хроническая вирусная или бактериальная инфекция. Поэтому первым этапом подготовки к беременности является проведение антибактериальной, противовирусной и иммунокорректирующей терапии. Параллельно назначаются и другие препараты.
Показатели системы гемостаза (свертывающей системы) у беременных с АФС существенно отличаются от показателей у женщин с физиологическим течением беременности. Уже в I триместре беременности развивается гиперфункция тромбоцитов, часто устойчивая к проводимой терапии. Во II триместре такая патология может усугубляться и привести к нарастанию гиперкоагуляции (повышению свертывания крови), к активации внутрисосудистого тромбообразования. В крови появляются признаки развивающегося ДВС-синдрома. Эти показатели выявляют с помощью анализа крови — коагулограммы. В III триместре беременности явления гиперкоагуляции нарастают, и удержать их в пределах, близких к нормальным, можно лишь при активном лечении под контролем показателей свертывающей системы крови. Подобные исследования проводят у данных пациенток также во время родов и послеродового периода.
Второй этап подготовки начинается с повторного обследования после проведенного лечения. Он включает контроль гемостаза, волчаночного антикоагулянта (ВА), АФА. При изменениях гемостаза применяются антиагреганты — препараты, предотвращающие образование тромбов (АСПИРИН, КУРАНТИЛ, ТРЕНТАЛ, РЕОПОЛИГЛЮКИН, ИНФУКОЛ), антикоагулянты (ГЕПАРИН, ФРАКСИПАРИН, ФРАГМИН).
При наступлении планируемой беременности (после обследования и лечения) проводят динамический контроль формирования плодово-плацентарного комплекса, профилактику фетоплацентарной недостаточности и коррекцию функции плаценты при ее изменении (АКТОВЕГИН, ИНСТЕНОН).
С I триместра, наиболее важного периода для развития плода в условиях аутоиммунной патологии, проводят контроль гемостаза каждые 2—3 недели. С ранних сроков, можно в цикле планируемого зачатия, назначают лечение гормонами — глюкокортикоидами, обладающими противоаллергическим, противовоспалительным, противошоковым действием. Сочетание глюкокортикоидов (МЕТИПРЕД, ДЕКСА-МЕТАЗОН, ПРЕДНИЗОЛОН и др.) с антиагрегантами и антикоагулянтами лишает активности и выводит из организма АФА. Благодаря этому снижается гиперкоагуляция, нормализуется свертываемость крови.
Все пациентки с АФС имеют хроническую вирусную инфекцию (вирус простого герпеса, папилломавирус, цитомегаловирус, вирус Коксаки и т.д.). В связи с особенностями течения беременности, применением глюкокортикоидов даже в минимальных дозах возможна активация этой инфекции. Поэтому во время беременности рекомендуется проведение 3 курсов профилактической терапии, которая состоит из внутривенного введения ИММУНОГЛОБУЛИНА в дозе 25 мл (1,25 г) или ОКТАГАМА 50 мл (2,5 г) через день, всего три дозы; одновременно назначаются свечи с ВИФЕРОНОМ. Малые дозы иммуноглобулина не подавляют выработку иммуноглобулинов, а стимулируют защитные силы организма.
Повторно введение иммуноглобулина проводится через 2—3 месяца и перед родами. Введение иммуноглобулина необходимо для предупреждения обострения вирусной инфекции, для подавления выработки аутоантител. При этом в организме беременной формируется защита (пассивный иммунитет) от хронической инфекции и циркулирующих в крови аутоантител, а опосредованно — и защита плода от них.
При введении иммуноглобулина могут быть осложнения в виде аллергических реакций, головной боли, иногда возникают явления простудного характера (насморк и др.). Для профилактики этих осложнений необходимо проверить иммунный, интерфероновый статус с определением в крови иммуноглобулинов класса IgG, IgM, и IgA (антитела IgM и IgA вырабатываются при первом попадании инфекционного агента в организм и при обострении инфекционного процесса, IgG остаются в организме после перенесенной инфекции). При низком уровне IgA вводить иммуноглобулин опасно из-за возможных аллергических реакций. С целью профилактики подобных осложнений женщине до введения иммуноглобулинов вводят антигистаминные средства, после чего назначают обильное питье, чай, соки, а при явлениях, подобных простудным, — жаропонижающие средства. Не следует вводить данные препараты на голодный желудок — незадолго перед процедурой пациентка должна принять пищу.
В последние годы появились исследования, в которых одним из перспективных направлений в лечении АФС признана инфузионная терапия растворами гидроксиэтилированных крахмалов (ГЭК), приводящих к улучшению микроциркуляции крови по сосудам. Клинические исследования растворов гидроксиэтилированного крахмала II-го поколения (ИНФУКОЛ-ГЭК) во многих клиниках РФ показали их эффективность, безопасность.
Известно, что тромбоз и ишемия сосудов плаценты (возникновение участков, где нет кровообращения) у беременных с наличием АФС начинается с ранних сроков беременности, поэтому лечение и профилактику плацентарной недостаточности проводят с I триместра беременности под контролем гемостаза. С 6—8 недель беременности используется поэтапное назначение антиагрегантов и антикоагулянтов на фоне глюкокортикоидной терапии (КУРАНТИЛ, ТЕОНИКОЛ, АСПИРИН, ГЕПАРИН, ФРАКСИПАРИН). При изменениях гемостаза (гиперфункция тромбоцитов и др.) и устойчивости к антиагрегантам в комплексе с данной терапией назначают курс ИНФУКОЛА через день внутривенно капельно.
Беременные с АФС относятся к группе риска по развитию фетоплацентарной недостаточности. Им требуется тщательный контроль за состоянием кровообращения в плаценте, плодово-плацентарного кровотока, возможный при проведении ультразвуковой допплерометрии. Это исследование проводится во 2-м и 3-м триместрах беременности, начиная с 16 недель, с интервалом в 4—6 недель. Это позволяет своевременно диагностировать особенности развития плаценты, ее состояния, нарушение кровотока в ней, а также оценивать эффективность проводимой терапии, что важно при выявлении гипотрофии плода, плацентарной недостаточности.
Для профилактики патологии плода женщинам с АФС с ранних сроков беременности назначают терапию, улучшающую обмен веществ. В этот комплекс (который нельзя заменить приемом обычных поливитаминов для беременных) входят препараты и витамины, нормализующие окислительно-восстановительные и обменные процессы на клеточном уровне организма. За время беременности рекомендуется 3—4 раза применять курс такой терапии продолжительностью 14 дней (2 схемы по 7 дней каждая). Во время приема этих препаратов поливитамины отменяют, а между курсами рекомендуют продолжать прием поливитаминов.
Для предупреждения фетоплацентарной недостаточности у женщин с АФС также рекомендуется во II триместре беременности, с 16—18 недель прием АКТОВЕГИНА внутрь в виде таблеток или внутривенно капельно. При появлении признаков плодово-плацентарной недостаточности назначают такие препараты, как ТРОКСЕВАЗИН, ЭССЕНЦИАЛЕ, ЛИМОНТАР, КОГИТУМ. При подозрении на отставание плода в развитии (гипотрофию) проводят курс специальной терапии (ИНФЕЗОЛ и другие препараты).
Тактика ведения беременных с АФС, изложенная в данной статье, апробирована на практике и показала высокую эффективность: у 90—95% женщин беременность завершается своевременно и благополучно при условии, что пациентки выполняют все необходимые исследования и назначения.
Новорожденных у женщин с АФС обследуют только при осложненном течении раннего неонатального периода (в роддоме). В этом случае проводят исследование иммунного статуса, а также гормональную оценку состояния ребенка.
источник
Несмотря на то что клинические рекомендации по диагностике, лечению антифосфолипидного синдрома разработаны ревматологами, к акушерству он имеет прямое отношение. Антифосфолипидный синдром при беременности приводит к привычному невынашиванию, что влечет за собой бездетность пары.
Антифосфолипидный синдром, или АФС – это патология, которая характеризуется повторяющимися тромбозами венозного, артериального, микроциркуляторного русла, патологией беременности с потерей плода и синтезом антифосфолипидных антител (афла): кардиолипиновых антител (аКЛ) и/или волчаночного антикоагулянта (ВА), и/или антител к бета2-гликопротеин Ⅰ. АФС – вариант часто приобретенной тромбофилии.
Код по МКБ 10 пересмотра – Д68.8.
Основой патогенеза антифосфолипидного синдрома является атака антителами мембран клеток. Чаще всего антифосфолипидный синдром развивается у женщин – в 5 раз чаще, чем у мужчин.
Манифестация синдрома происходит возникновением тромбозов, невынашиванием беременности. Часто до развития гестации женщины не подозревали о наличии этой патологии и присутствии антител в крови.
Существует несколько вариантов антифосфолипидного синдрома. Основная классификация их такова:
- Первичный – связан с наследственными дефектами гемостаза.
- Вторичный АФС возник на фоне аутоиммунных болезней (ревматоидный артрит, системная красная волчанка), васкулитов, органоспецифичных патологий (сахарный диабет, болезни Крона), онкологических процессов, лекарственного воздействия, инфекций (ВИЧ, сифилис, малярия), при конечной стадии почечной недостаточности.
- Другие варианты АФС:
- серонегативный
- катастрофический
- другие микроангиопатические синдромы (ДВС-синдром, HELLP).
Доказано влияние АФС в развитии таких осложнений беременности:
- бесплодие неясного генеза;
- ранние преэмбриональные потери;
- неудачные ЭКО;
- выкидыши на разных сроках;
- внутриутробная гибель плода;
- послеродовая гибель плода;
- синдром задержки развития плода;
- преэклампсия и эклампсия;
- тромбозы во время беременности и после родов;
- пороки развития плода.
В послеродовом периоде у ребенка также возникают последствия антифосфолипидного синдрома: тромбозы, нейроциркуляторные расстройства с формированием аутизма в будущем. 20% детей, рожденных от матерей с АФС, в крови присутствуют антифосфолипидные антитела без симптомов, что говорит о внутриутробной передаче аФЛ.
Патогенетической основой развития всех проявлений АФС при беременности является плацентарная децидуальная васкулопатия, что вызывается недостатком продукции простагландина, тромбозами плаценты и нарушением механизма имплантации. Все эти механизмы препятствуют беременности.
Выделяют критерии, по которым устанавливается диагноз «Антифосфолипидный синдром». Среди клинических критериев выделены следующие:
- Сосудистый тромбоз любой локализации: как венозный, так и артериальный, подтвержденный визуальными методами исследования. При использовании гистологического исследования в биоптатах должны отсутствовать признаки воспаления сосудистой стенки.
- Осложнения беременности:
- один или более эпизод гибели нормально развивающегося плода после 10 недель гестации или
- один или больше эпизодов преждевременных родов до 34 нед из-за значительной преэклампсии, эклампсии, плацентарной недостаточности или
- три или больше случаев подряд спонтанных абортов в сроке менее 10 недель, при отсутствии патологий анатомии матки, генетических мутаций, половых инфекций.
Лабораторные критерии таковы:
- В крови выявлены антитела к кардиолипину иммуноглобулины классов G и M в средних и высоких титрах, по крайней мере, 2 раза за 12 месяцев.
- Антитела к b2-гликопротеину I классов G и/или M в средних или высоких титрах, по крайней мере, 2 раза за год.
- Определен волчаночный антикоагулянт ВА в плазме в 2 более лабораторных исследованиях в промежутке хотя бы 12 месяцев. Заподозрить наличие ВА в крови можно при увеличении АЧТВ в коагулограмме в 2 и более раза.
Высокопозитивным считается анализ на антитела – 60 МЕ/мл, среднепозитивный ответ – 20-60 МЕ/мл, низкопозитивный – менее 20 МЕ/мл.
Для постановки диагноза «Антифосфолипидный синдром» необходимо присутствие одного клинического и одного лабораторного критерия.
Основным симптомом антифосфолипидного синдрома является тромбоз. У женщин эта патология проявляется невынашиванием беременности. Кроме таких очевидных признаков, у женщин могут проявляться дополнительные клинические критерии:
- сетчатое ливедо;
- наличие в анамнезе мигреней, хореи;
- трофические язвенные дефекты нижних конечностей;
- эндокардит и прочее.
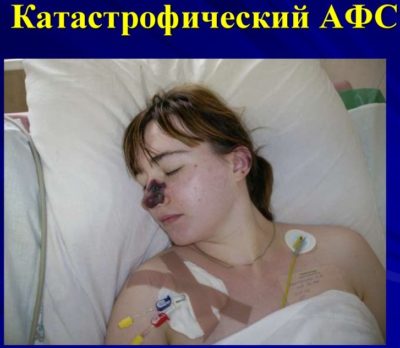
Очень тяжело протекает катастрофическая форма антифосфолипидного синдрома. Она сопровождается клиникой острой почечной недостаточности, респираторным дистресс-синдромом, печеночной недостаточностью, нарушением мозгового кровотока, тромбозом крупных сосудов, в том числе и легочной артерии. Без срочной помощь прожить с этой формой длительно невозможно.
Лечением АФС занимаются многие специалисты: ревматологи, гематологи, акушеры и гинекологи, кардиологи, кардиохирурги и прочие.
Пациенты, которые не имеют лабораторно выраженных признаков или клинических симптомов, не нуждаются в постоянном лабораторном контроле и непрерывной антикоагулянтной терапии. В этой группе пациентов проводят стандартную профилактику венозных тромбозов.
У пациентов с высоким титром волчаночного антикоагулянта и/или антифосфолипидных антител более 10 МЕ/мл без тромбоза требуется назначение специфической профилактики – Аспирин в дозировке 75-100 мг один раз в день.
У этих людей результаты анализов на антитела отрицательны, но имеется подтвержденные случаи тромбоза и высокий риск их образования. У этих больных проводится лечение антикоагулянтами низкомолекулярного гепарина в терапевтических дозах. Сразу после постановки диагноза используют:
- Дальтепарин 100 МЕ/кг 2 раза в сутки;
- Надропарин 86 МЕ/кг или 0,1 мл на 10 кг 2 раза в день подкожно;
- Эноксапарин 1 мг/кг 2 раза в день подкожно;
- Со второго дня назначают Варфарин с 5 мг в сутки.
У пациентов этой группы проводят гепаринотерапию не менее 3 месяцев. В начале терапии выполняют контроль МНО каждые 4-5 дня для поддержания целевого значения в 2,0-3,0.
В эту группу входят люди, у которых тромбозы происходят на фоне повышенных титров волчаночного антикоагулянта и антифосфолипидного антитела. У этой категории больных назначается Варфарин и низкие доза (75-100 мг) Ацетилсалициловой кислоты. Пациенты с высоким уровнем риска должны получать пожизненно антикоагулянтную терапию.
Подготовка к беременности при АФС проводится в 2 последовательных этапа. На первом проводят оценку коагулограммы, определяют антигенный компоненты крови, удаляют и санируют инфекционные очаги.
Второй этап – это непосредственная подготовка к беременности и ее ведение. Для этого необходима антикоагулянтная терапия. Она проводится индивидуально в течение 1-2 менструальных циклов. Для этого нужно отнести женщину в одну из следующих групп:
- Серонегативный вариант АФС с наличием в анамнезе акушерских проявления синдрома. В сыворотке могут быть обнаружены только антитела к бета2-гликопротеину I. В этой группе проводят подготовку с помощью таких препаратов:
- один из препаратов низкомолекулярного гепарина 1 раз/сутки подкожно (дальтепарин (Фрагмин)120 антиХа МЕ/кг или эноксапарин (Клексан) 100 антиХа МЕ/кг;
- рыбий жир по 1-2 капсулы 3 раза/сутки;
- фолиевая кислота 4 мг/сутки;
- Если отсутствует волчаночный антикоагулянт, но присутствует АФЛА без тромбозов и акушерских клинических проявлений:
- при умеренном титре АФЛА назначается Аспирин 75-100 мг/сутки, а при развитии беременности он отменяется с заменой на дипиридомол 50-75 мг/сутки;
- при высоком и умеренном титре антифосфолипидного антигена комбинируют Ацетилсалициловую кислоту 75 мг/сутки и низкомолекулярный гепарин один раз в сутки подкожно;
- рыбий жир по 1-2 капсуле 3 раза в день;
- фолиевая кислота 4 мг/сутки.
- Если нет в крови волчаночного антикоагулянта, но есть в высоком или умеренном количестве антифосфолипидный антиген и имеется клиника тромбозов и акушерские осложнения:
- один из НМГ (Клексан, Фрагмин, Фраксипарин) 1 раз в сутки подкожно;
- Аспирин 75 мг/сутки с отменой его при развитии беременности и назначением Дипиридамола 50-75 мг/сутки;
- рыбий жир 1-2 капсулы 3 раза в день;
- фолиевая кислота 4 мг/сутки.
- В плазме женщины обнаружены АФЛА и определяется волчаночный антикоагулянт ВА от 1,5 до 2 усл.ед. До нормализации ВА следует воздержаться от беременности. Для нормализации ВА менее 1,2 усл.ед применяют:
- Клексан 100 антиХа МЕ/кг или Фрагмин 120 антиХа МЕ/кг один раз в сутки подкожно;
- рекомендован иммуноглобулин человеческий внутривенно 25 мл через день 3 дозы, повторяют введение препарата в 7-12 недель беременности, в 24 недели и последнее введение перед родами;
- после установления ВА в пределах нормы назначают Ацетилсалициловую кислоту 75 мг/сутки до наступления беременности;
- Клексан или Фрагмин один раз в день подкожно в прежних дозировках;
- рыбий жир 1-2 кап. 3 раза в день;
- фолиевая кислота 4 мг/кг.
- Если ВА в крови более 2 усл.ед, то зачатие откладывается минимум на 6-12 месяцев. Риск развития тромбоза у таких женщин очень велик. Целевое значение ВА – 1,2 усл.ед. Терапия проводится не менее 6 месяцев.
Лабораторная диагностика и обследование при планировании беременности обязательно включает такие показатели свертывания крови:
- тромбоциты – 150-400*10 9 /л;
- фибриноген – 2-4 г/л;
- МНО – 0,7-1,1;
- продукты деградации фибриногена и фибрина – менее 5 мкг/мл;
- д-димеры – менее 0,5 мкг/мл;
- растворимые фибринмономерные комплексы должны отсутствовать;
- протеин С – 69,1-134,1%;
- антитромбин Ⅲ – 80-120%;
- агрегационная активность тромбоцитов с солью аденозиндифосфата – 50-80%, с гидрохлоридом адреналина – 50-80%;
- антикардиолипиновые антитела – все классы иммуноглобулинов менее 10 МЕ/мл;
- ВА – отрицательный или менее 0,8-1,2 усл.ед;
- гипергомоцистеинемия – отрицательная;
- мутация FV (Le >Ведение беременности при АФС
Чтобы во время беременности не возникало тромбозов и потери плода, необходима профилактика – немедикаментозная и медикаментозная.
- физическая активность стимулирует собственный тканевой плазминоген;
- эластичный медицинский трикотаж 1-2 класс компрессии;
- диета с большим количеством растительных масел, свеклы, чернослива, инжира, бананов, поскольку эти продукты обладают слабительным эффектом – это важно, чтобы при дефекации не создавать повышенное давление на стенки вен.
Существует несколько вариантов профилактики в зависимости от течения антифосфолипидного синдрома.
- Отсутствуют серологические маркеры ВА и антикардиолипиновый антиген, тромботические осложнения, могут определяться антитела к бета2-гликопротеину I.
- В первом триместре назначают Клексан или Фрагмин в дозировке для оптимального поддержания д-димеров и фолиевая кислота 4 мг/кг.
- Второй и третий триместры – Фригмин или Клексан до нормальных цифр д-димеров, рыбий жир, Аспирин 75-100 мг/кг при повышенной агрегации тромбоцитов, СЗП 10 мл/кг или концентрат антитромбина при снижени антитромбина 3 менее 80%.
- Перед родами Аспирин отменяют за 3-5 суток, вечернюю дозу НМГ меняют на СЗП 10мг/кг с гепарином 1-2 Ед на каждый мл СЗП.
- При родоразрешении – нормальный уровень д-димеров СЗП 10 мг/кг, при высоком уровне перед операцией – СЗП 5 мл/кг плюс гепарин 1 Ед на 1 мл СЗП или концентрат антитромбина 3, во время операции СЗП 5 мл/кг.
- При наличии в крови АФЛА и тромбозами или без них, отсутствует волчаночный антикоагулянт.
- 1 триместр – Клесан или Фрагмин для поддержания нормального уровня д-димеров+фолиевая кислота 4 мг/сутки.
- 2 и 3 триместры – Клексан или Фрагмин в индивидуальных дозировках+Аспирин 75 мг/сутки+рыбий жир 1-2 кап 3 раза в день, при снижении антитромбина 3 менее 80% активности – СЗП 10 мл/кг или концентрат антитромбина Ⅲ – 10-50 МЕ/кг, при повышении д-димеров более 0,5 мкг/мл – повышении дозировки НМГ.
- Перед родами – отмена Аспирина за 3-5 дней, НМГ заменяют на СЗП 10 мл/кг+НФГ 1-2 ЕД на каждый мл СЗП, при повышении антифосфолипидных антител назначается Преднизолон (Метилпред) 1-1,5 мг/кг внутривенно.
- При родоразрешении если нормальные D-димеры – СЗП 10 мл/кг; если повышены д-димеры, то до операции СЗП 5 мл/кг+НФГ 1 ед на каждый мл CPG или концентрат антитромбина 3, во время операции – СЗП 5 мл/кг, при значительном повышении антител – Преднизолон 1,5-2 мл/кг внутривенно.
- При повышении ВА от 1,5 до 2 усл.ед.
- 1 триместр – базовый прием Фрагмин или Клексана в дозе, как в прошлом варианте+фолиевая кислота+иммуноглобулин человеческий 25 мл через день 3 дозы в 7-12 нед. Если имеется повышение ВА более 1,5 усл.ед в первом триместре, то беременность стоить прервать.
- 2 и 3 триместр – Фрагмин и Клексан в дозировке для нормального поддержания д-димеров+Аспирин 75 мг+рыбий жир 1-2 кап 3 раза в день, при сниженном антитромбине – СЗП 10 мл/кг или концентрат антитромбина Ⅲ 10-50 МЕ/кг в/в, при повышении Д-димеров – повысить дозировку НМГ, иммуноглобулин 25 мл через 1 день 3 раза в 24 недели, если повышен ВА от 1,2 до 2 усл.ед – Преднизолон 30-60 мг/сут в/в, с 13 до 34 недели возможен перевод на Варфарин под контролем МНО.
- Перед родами если был Варфарин, то его отменяют за 2-3 нед, переводят на НМГ, Аспирин отменяется за 3-5 дней до родов, СЗП 10 мл/кг+НФГ 2 ед на каждый мл плазмы, Преднизолон – 1,5-2 мл/кг в/в, при сниженном антитромбине Ⅲ – концентрат антитромбина Ⅲ 10-30 МЕ/кг.
- При родах – до операции СЗП 500 мл+НФГ 1000 ЕД, во время операции – СЗП 10 мл/кг, Преднизолон 1,5-2 мг/кг в/в.
- При повышении ВА более 2 усл.ед беременность следует прерывать.
Если у женщины развился катастрофический антифосфолипидный или HELLP-синдром, то может быть назначен плазмоферез или плазмофильтрация.
После родоразрешения возобновить профилактику тромбоэмболии следует уже спустя 8-12 часов Фраксипарином (Надропарином) – 0,1 мл/10 кг, Клексан (Эноксапарин) 100 МЕ/кг, Фрагмин (Дальтепарин) 120 МЕ/кг, если нет кровотечения.
Если у женщины были отмечены тромбозы в анамнезе, то назначаются терапевтические дозы этих средств Фраксипарин – 0,1 мл/10 кг 2 раза в день, Клексан – 100 МЕ/кг 2 раза в день, Фрагмин – 120 МЕ/кг 2 раза в день.
Применение НМГ необходимо продолжать не меньше 10 дней. А если был эпизод доказанной тромбоэмболии, то антикоагулянты используются не менее 3-6 месяцев.
Повышение концентрации антигенов в крови требует консультации гематолога или ревматолога для решения вопроса о гормональной терапии.
Чтобы выявить АФС, можно пройти диагностику на платной основе. Многие частные лаборатории предлагают панель для определения антифосфолипидных антител. В лаборатории Инвитро в Москве цены на конец 2018 года таковы:
- обнаружение иммуноглобулинов G и M к кардиолипину стоит 1990 руб;
- диагностика вторичного АФС – цена 3170 руб;
- развернутое серологическое исследование на АФС – 4200 руб;
- лабораторные критерии АФС – 3950 руб.
В лаборатории Синэво в Москве цены на анализы этой панели несколько разняться:
- иммуноглобулинов G и M к кардиолипину – 960 руб;
- антитела к бета2-гликопротеиду I – 720 руб;
- антитела класса G к фосфолипидам – 720 руб;
- антитела класса M к фосфолипидам – 720 руб.
Примерно такие цены могут предложить и другие частные лаборатории в городах России.
источник
При антифосфолипидном синдроме (АФС) у женщин с привычным не-вынашиванием беременности, внутриутробной гибелью плода или заде-ржкой его развития в крови определяют антитела, вырабатываемые организмом беременной к собственным фосфолипидам — особым химическим структурам, из которых построены стенки и другие части клеток. Эти антитела (АФА) стано-вятся причиной образования тромбов при формировании сосудов плаценты, что мо-жет приводить к задержке внутриутроб-ного развития плода или его внутриутроб-ной гибели, отслойке плаценты, развитию осложнений беременности. Также в крови женщин, страдающих АФС, выявляют волчаночный антикоагулянт (вещество, определяемое в крови при системной красной волчанке 1).
Осложнениями АФС являются выки-дыш и преждевременные роды, гестозы (ос-ложнения беременности, проявляющиеся повышением артериального давления, по-явлением белка в моче, отеков), плодово-плацентарная недостаточность (при этом состоянии плоду не хватает кислорода).
При АФС частота осложнений беремен-ности и родов составляет 80%. Антифосолипидные антитела к различным элементам репродуктивной системы обнаруживаются у 3% клинически здоровых женщин, при невынашивании беременности — у 7— 14% женщин, при наличии двух и больше самопроизвольных абортов в анамнезе — у каждой третьей пациентки.
При первичном АФС выявляются толь-ко специфические изменения в крови.
При вторичном АФС осложнения бе-ременности или бесплодие наблюдаются у больных с аутоиммунными заболеваниями,такими, как системная красная волчанка, аутоиммунный тиреоидит (воспаление щи-товидной железы), ревматизм и др.
Первичный и вторичный АФС имеют сходные клинические проявления: привычное невынашивание беременности, нераз-вивающиеся беременности в I—II тримест-рах, внутриутробная гибель плода, преж-девременные роды, тяжелые формы гестоза, плодово-плацентарная недостаточность, тяжелые осложнения послеродового пери-ода, тромбоцитопения (снижение количест-ва тромбоцитов). Во всех случаях предвест-ником гибели плодного яйца является раз-витие хронической формы ДВС-синдрома.
Наблюдения показывают, что без лече-ния гибель плода происходит у 90—95% женщин, имеющих АФА.
Среди пациенток с привычным невына-шиванием беременности АФС выявляется у 27—42%. Частота этого состояния среди всего населения равна 5%.
Особенно важна подготовка к бере-менности женщин, имевших в анамнезе неразвивающиеся беременности, самоп-роизвольные аборты (на сроках 7—9 не-дель), ранние и поздние токсикозы, отс-лойку хориона (плаценты). В этих случа-ях проводится обследование на генитальные инфекции (методами иммуноферментного анализа — ИФА, полимеразной цепной реакции — ПЦР), исследование гемостаза — показателей свертывающей системы крови (гемостазиограммы), иск-лючают наличие волчаночного антикоа-гулянта (ВА), АФА, оценивают систему иммунитета с помощью специальных ана-лизов.
Таким образом, подготовка к беремен-ности включает в себя следующие этапы:
- Оценка состояния репродуктивной системы супругов. Коррекция эндокринных нарушений (гормональная терапия).
- Обследование пары с целью выявле-ния инфекционного агента с применением ПЦР (выявление ДНК возбудителя) и серо-диагностики (выявление антител к данному возбудителю), отражающей степень актив-ности процесса. Лечение выявленных ин-фекций с помощью химиотерапевтических и ферментных препаратов (ВОБЕИЗИМ, ФЛОГЕНЗИМ), иммуноглобулинов (ИММУНОВЕНИН).
- Исследование состояния системы им-мунитета, ее коррекция с помощью медика-ментов (РИДОСТИН, ВИФЕРОН, КИПФЕРОН); лимфоцитотерапия (введение женщи-не лимфоцитов мужа); контроль и коррекция системы микроциркуляторного гемостаза
- Выявление аутоиммунных процессов и воздействие на них (для этого применяют-ся глюкокортикоиды и альтернативные пре-параты: энзимы, индукторы интерферона).
- Коррекция энергетического обмена обоих супругов: метаболическая терапия с целью снижения дефицита кислорода в тка-нях — тканевой гипоксии (ИНОЗИЕ-Ф, ЛИМОНТАР, КОРИЛИП, метаболические комплексы).
- Психокоррекция — устранение тре-вожных состояний, страха, раздражитель-ности; применяются антидепрессанты, МАГНЕ-В6 (этот препарат улучшает про-цессы обмена, в том числе и в головном мозге). Применение различных методов психотерапии.
- При наличии заболеваний различных органов у супругов, планирующих беремен-ность, необходима консультация специалиста с последующей оценкой степени поврежде-ния больного органа, адаптационных возмож-ностей организма и прогноза развития плода с исключением генетических аномалий.
Чаще всего при наличии АФС выявляет-ся хроническая вирусная или бактериальная инфекция. Поэтому первым этапом подго-товки к беременности является проведение антибактериальной, противовирусной и иммунокорректирующей терапии. Параллель-но назначаются и другие препараты.
Показатели системы гемостаза (сверты-вающей системы) у беременных с АФС су-щественно отличаются от показателей у женщин с физиологическим течением беременности. Уже в I триместре беременности развивается гиперфункция тромбоцитов, часто устойчивая к проводимой терапии. Во II триместре такая патология может усугуб-ляться и привести к нарастанию гиперкоа-гуляции (повышению свертывания крови), к активации внутрисосудистого тромбообразования. В крови появляются признаки раз-вивающегося ДВС-синдрома. Эти показате-ли выявляют с помощью анализа крови — коагулограммы. В III триместре беремен-ности явления гиперкоагуляции нарастают, и удержать их в пределах, близких к нор-мальным, можно лишь при активном лече-нии под контролем показателей свертываю-щей системы крови. Подобные исследова-ния проводят у данных пациенток также во время родов и послеродового периода.
Второй этап подготовки начинается с повторного обследования после проведенного лечения. Он включает контроль гемос-таза, волчаночного антикоагулянта (ВА), АФА. При изменениях гемостаза применя-ются антиагреганты — препараты, предотв-ращающие образование тромбов (АСПИРИН, КУРАНТИЛ, ТРЕНТАЛ, РЕОПОЛИГЛЮКИН, ИНФУКОЛ), антикоагулянты (ГЕ-ПАРИН, ФРАКСИПАРИН, ФРАГМИН).
При наступлении планируемой беремен-ности (после обследования и лечения) про-водят динамический контроль формирова-ния плодово-плацентарного комплекса, про-филактику фетоплацентарной недостаточ-ности и коррекцию функции плаценты при ее изменении (АКТОВЕГИН, ИНСТЕНОН).
С I триместра, наиболее важного пери-ода для развития плода в условиях аутоим-мунной патологии, проводят контроль ге-мостаза каждые 2—3 недели. С ранних сроков, можно в цикле планируемого зача-тия, назначают лечение гормонами — глюкокортикоидами, обладающими противоал-лергическим, противовоспалительным, противошоковым действием. Сочетание глюкокортикоидов (МЕТИПРЕД, ДЕКСА- МЕТАЗОН, ПРЕДНИЗОЛОН и др.) с антиагрегантами и антикоагулянтами лишает ак-тивности и выводит из организма АФА. Бла-годаря этому снижается гиперкоагуляция, нормализуется свертываемость крови.
Все пациентки с АФС имеют хроничес-кую вирусную инфекцию (вирус простого герпеса, папилломавирус, цитомегаловирус, вирус Коксаки и т.д.). В связи с особен-ностями течения беременности, примене-нием глюкокортикоидов даже в минимальных дозах возможна активация этой инфек-ции. Поэтому во время беременности реко-мендуется проведение 3 курсов профилак-тической терапии, которая состоит из внут-ривенного введения ИММУНОГЛОБУЛИ-НА в дозе 25 мл (1,25 г) или ОКТАГАМА 50 мл (2,5 г) через день, всего три дозы; однов-ременно назначаются свечи с ВИФЕРОНОМ. Малые дозы иммуноглобулина не по-давляют выработку иммуноглобулинов, а стимулируют защитные силы организма.
Повторно введение иммуноглобулина про-водится через 2—3 месяца и перед родами. Введение иммуноглобулина необходимо для предупреждения обострения вирусной инфекции, для подавления выработки аутоантител. При этом в организме беременной формируется защита (пассивный иммуни-тет) от хронической инфекции и циркулиру-ющих в крови аутоантител, а опосредован-но — и защита плода от них.
При введении иммуноглобулина могут быть осложнения в виде аллергических ре-акций, головной боли, иногда возникают явления простудного характера (насморк и др.). Для профилактики этих осложнений необходимо проверить иммунный, интерфероновый статус с определением в крови иммуноглобулинов класса IgG, IgM, и IgA (антитела IgM и IgA вырабатываются при первом попадании инфекционного агента в организм и при обострении инфекционного процесса, IgG остаются в организме после перенесенной инфекции). При низком уровне IgA вводить иммуноглобулин опасно из-за возможных аллергических реакций. С целью профилактики подобных осложне-ний женщине до введения иммуноглобули-нов вводят антигистаминные средства, пос-ле чего назначают обильное питье, чай, со-ки, а при явлениях, подобных простудным, — жаропонижающие средства. Не следует вводить данные препараты на голодный же-лудок — незадолго перед процедурой паци-ентка должна принять пищу.
В последние годы появились исследова-ния, в которых одним из перспективных направлений в лечении АФС признана инфузионная терапия растворами гидроксиэтилированных крахмалов (ГЭК), приводя-щих к улучшению микроциркуляции крови по сосудам. Клинические исследования растворов гидроксиэтилированного крах-мала II-го поколения (ИНФУКОЛ-ГЭК) во многих клиниках РФ показали их эффек-тивность, безопасность.
Известно, что тромбоз и ишемия сосу-дов плаценты (возникновение участков, где нет кровообращения) у беременных с нали-чием АФС начинается с ранних сроков бе-ременности, поэтому лечение и профилак-тику плацентарной недостаточности прово-дят с I триместра беременности под контро-лем гемостаза. С 6—8 недель беременнос-ти используется поэтапное назначение антиагрегантов и антикоагулянтов на фоне глюкокортикоидной терапии (КУРАНТИЛ, ТЕОНИКОЛ, АСПИРИН, ГЕПАРИН, ФРАКСИПАРИН). При изменениях гемостаза (ги-перфункция тромбоцитов и др.) и устойчи-вости к антиагрегантам в комплексе с дан-ной терапией назначают курс ИНФУКОЛА через день внутривенно капельно.
Беременные с АФС относятся к группе риска по развитию фетоплацентарной не-достаточности. Им требуется тщательный контроль за состоянием кровообращения в плаценте, плодово-плацентарного кровото-ка, возможный при проведении ультразву-ковой допплерометрии. Это исследование проводится во 2-м и 3-м триместрах бере-менности, начиная с 16 недель, с интерва-лом в 4—6 недель. Это позволяет своевре-менно диагностировать особенности разви-тия плаценты, ее состояния, нарушение кровотока в ней, а также оценивать эффективность проводимой терапии, что важно при выявлении гипотрофии плода, плацен-тарной недостаточности.
Для профилактики патологии плода жен-щинам с АФС с ранних сроков беременности назначают терапию, улучшающую обмен ве-ществ. В этот комплекс (который нельзя за-менить приемом обычных поливитаминов для беременных) входят препараты и вита-мины, нормализующие окислительно-вос-становительные и обменные процессы на клеточном уровне организма. За время бере-менности рекомендуется 3—4 раза приме-нять курс такой терапии продолжитель-ностью 14 дней (2 схемы по 7 дней каждая). Во время приема этих препаратов поливита-мины отменяют, а между курсами рекомен-дуют продолжать прием поливитаминов.
Для предупреждения фетоплацентарной недостаточности у женщин с АФС также ре-комендуется во II триместре беременности, с 16—18 недель прием АКТОВЕГИНА внутрь в виде таблеток или внутривенно капельно. При появлении признаков плодово-плацентарной недостаточности назначают такие препараты, как ТРОКСЕВАЗИН, ЭССЕНЦИАЛЕ, ЛИМОНТАР, КОГИТУМ. При подозрении на отставание плода в развитии (гипотрофию) проводят курс специальной терапии (ИНФЕЗОЛ и другие препараты).
Тактика ведения беременных с АФС, из-ложенная в данной статье, апробирована на практике и показала высокую эффективность: у 90—95% женщин беременность завершается своевременно и благополучно при условии, что пациентки выполняют все необходимые исследования и назначения.
Новорожденных у женщин с АФС обс-ледуют только при осложненном течении раннего неонатального периода (в роддо-ме). В этом случае проводят исследование иммунного статуса, а также гормональную оценку состояния ребенка.
Комплексное исследование лабораторных маркеров антифосфолипидного синдрома (антинуклеарного фактора, антител к кардиолипину и бета-2-гликопротеину), используемое для диагностики и оценки прогноза этого состояния.
Серологические тесты при АФС, анализы крови при АФС.
Lab Panel, Antiphospholipid Syndrome (APS), Laboratory Criteria, APS.
Непрямая реакция иммунофлюоресценции.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Антифосфолипидный синдром (АФС) – это приобретенный аутоиммунный гиперкоагуляционный синдром, характеризующийся венозными и/или артериальными тромбозами и/или осложнениями беременности и наличием антифосфолипидных антител. Антифосфолипидные антитела (АФА) – это гетерогенная группа аутоантител, направленных против белков, связанных с мембранными фосфолипидами. В группу АФА входят антикардиолипиновые антитела (АКА); антитела к бета-2-гликопротеину; волчаночный антикоагулянт; антитела к аннексину V; антитела к фосфатидилсерин-протромбиновому комплексу и другие.
Хотя роль АФА в патогенезе АФС до конца не ясна, предполагается, что они являются причиной возникновения этого синдрома. Диагностика АФС сложна и носит комплексный характер. Лабораторные исследования являются неотъемлемой частью диагностического алгоритма. Во избежание ошибок необходимо понимать, какова роль лабораторных анализов в диагностике АФС и как правильно интерпретировать их результаты.
В настоящее время для диагностики АФС наиболее часто ориентируются на австралийские (сиднейские) критерии 2006 г. Эти критерии включают клинические и лабораторные признаки. К лабораторным критериям АФС относятся:
Для диагностики АФС необходимо наличие клинических и 1 или более указанных лабораторных критериев в двух или более анализах, выполненных с интервалом по крайней мере 12 недель.
Особенности интерпретации результата исследования
- Анализы на АФС характеризуются достаточно высоким процентом ложноположительных результатов (3-20 %). По этой причине их не используют в качестве скрининга у бессимптомных пациентов, в том числе у беременных женщин. Предложен следующий подход отбора пациентов, которым может быть показан анализ на АФС:
- Группа пациентов, которым целесообразно проводить исследование на АФС: пациенты молодого возраста (менее 50 лет) с необъяснимой и неспровоцированной венозной тромбоэмболией и/или артериальным тромбозом, тромбозом необычной локализации, случаи потери беременности на поздних сроках или любой тромбоз или осложнения беременности у пациентов с аутоиммунными заболеваниями (СКВ, ревматоидный артрит, аутоиммунная тромбоцитопения, аутоиммунная гемолитическая анемия);
- Группа пациентов, которым менее целесообразно проводить исследование на АФС: пациенты молодого возраста с привычным невынашиванием беременности ранних сроков, спровоцированной венозной тромбоэмболией и бессимптомные пациенты, у которых случайно было выявлено удлинение активированного частичного тромбопластинового времени (АЧТВ);
- Группа пациентов, которым наименее целесообразно проводить исследование на АФС: пациенты пожилого возраста с венозной и/или артериальной тромбоэмболией.
- Прием некоторых лекарственных средств и инфекционные заболевания могут приводить к появлению АКА, что, однако, носит транзиторный характер и не связано с повышенным риском тромбоза. По этой причине проводят не менее 2 анализов с интервалом по крайней мере 12 недель. У пациентов с сифилисом, болезнью Лайма, ВИЧ-инфекцией и некоторыми другими инфекционными заболеваниями может быть ошибочно диагностирован АФС на основании положительного результата АФА и сопутствующего инсульта или артериального тромбоза другой этиологии.
- Слабоположительный титр АКА и антител к бета-2-гликопротеину не имеет клинического значения.
- Хотя антитела к бета-2-гликопротеину обычно присутствуют вместе с АКА, некоторые пациенты с АФС могут иметь только антитела к бета-2-гликопротеину. Следует помнить, что чувствительность анализа на антитела к бета-2-гликопротеину невысокая (40-50 %). Поэтому во избежание ошибок диагностики рекомендуется исследовать оба типа антител (АКА и антитела к бета-2-гликопротеину) плюс волчаночный антикоагулянт.
- В практике встречаются случаи, напоминающие по клинической картине АФС, но негативные по «стандартным» лабораторным критериям (серонегативный АФС). Диагностика АФС у таких пациентов особенно сложна. Следует отметить, что действующие критерии АФС основаны преимущественно на мнении специалистов, а не на доказательствах исследований, поэтому к ним стоит относиться критически. Прояснить ситуацию с серонегативным АФС помогут анализы на дополнительные АФА, не входящие в принятые критерии:
- Антитела к фосфатидилсерин-протромбиновому комплексу;
- АФА класса IgA. В настоящее время учитываются только аутоантитела классов IgG и IgM. Антитела класса IgA не принимаются во внимание. С другой стороны, показано, что АФА класса IgA также увеличивают риск тромбоза.
Положительный результат этих дополнительных тестов может указывать на наличие АФС, несмотря на отсутствие «стандартных» критериев состояния.
Анализ на АФА используется не только для непосредственной диагностики АФС, но и для оценки риска тромбоза. По-видимому, разные виды АФА обладают разным тромбогенным потенциалом. Кроме того, риск тромбоза зависит также и от сочетания АФА. Так, наличие трех основных видов АФА (АКА, волчаночного антикоагулянта и антител к бета-2-гликопротеину), так называемая тройная серопозитивность ассоциирована с более высоким риском тромбоза, чем позитивность только по одному из АФА. Для более точной оценки риска тромбоза у пациентов с подтвержденным АФС целесообразно исключить другие известные факторы риска гиперкоагуляции:
- Наличие системной красной волчанки (СКВ). Пациенты с СКВ имеют повышенный риск тромбообразования. Этот риск еще более повышен при сочетании СКВ с АФС. Для скрининга СКВ у пациентов с АФС используют тест на антинуклеарный фактор. Антинуклеарный фактор (АНФ, антинуклеарные антитела, АНА) — это гетерогенная группа аутоантител, направленных против компонентов собственных ядер. АНА является очень чувствительным для СКВ тестом и поэтому используется в качестве скрининга. Существует несколько способов определения АНА в крови. Метод непрямой реакции флюоресценции (РНИФ) с использованием человеческих эпителиальных клеток HEp-2 позволяет определить титр и тип свечения. Для СКВ наиболее характерны гомогенный, периферический (краевой) и крапчатый (гранулярный) типы свечения.
- Врожденная тромбофилия;
- Беременность;
- Продолжительная иммобилизация;
- Хирургическое вмешательство.
В данное комплексное исследование вошли наиболее значимые аутоантитела при АФС (АКА, антитела к бета-2-гликопротеину и АНА). Следует еще раз подчеркнуть, что, хотя лабораторные тесты играют огромную роль в диагностике АФС, их стоит оценивать только в комплексе с клиническими данными. Повторные анализы рекомендуется выполнять с помощью одних и тех же тест-систем, то есть в одной лаборатории.
Для чего используется исследование?
- Для диагностики антифосфолипидного синдрома (АФС).
Когда назначается исследование?
- При наличии симптомов венозного или артериального тромбоза у молодого (до 50 лет) пациента или тромбоза необычной локализации;
- при обследовании пациентки с привычным невынашиванием беременности, то есть при наличии в анамнезе у женщины подряд трех и более самопроизвольных прерываний беременности в сроках до 22 недель;
- при наличии других косвенных признаков антифосфолипидного синдрома: симптомов повреждения клапанов сердца (вегетаций, утолщения, дисфункции), ретикулярного ливедо, нефропатии, тромбоцитопении, преэклампсии, хореи, эпилепсии;
- при наличии тромбоза или потери беременности у пациентов с аутоиммунными заболеваниями (например, СКВ);
- наряду с волчаночным антикоагулянтом при получении увеличенного частичного тромбопластинового времени (АЧТВ);
- при получении положительного результата RPR-теста при скрининге сифилиса.
Для каждого определяемого показателя:
Лабораторные критерии АФС (Sidney, 2006):
- наличие волчаночного коагулянта;
- наличие АКА класса IgG или IgM в среднем или высоком титре (более 40 фосфолипидных единиц ФЕ или в титре, превышающем 99 процентиль) при использовании метода иммуноферментного анализа, ИФА (ELISA); 1 ФЕ равна 1 мкг антитела;
- наличие антител к бета-2-гликопротеину классов IgG и/или IgM в титре, превышающем 99 процентиль, при использовании метода ИФА.
Что может влиять на результат?
- Прием некоторых лекарственных средств и инфекционные заболевания (герпес-зостер, ВИЧ) могут приводить к ложноположительному результату.
- Положительный результат не всегда означает наличие АФС: анализ рекомендуется повторить с интервалом по крайней мере 12 недель.
- Отрицательный результат не позволяет исключить АФС — следует помнить о наличии «серонегативного» АФС.
Кто назначает исследование?
Терапевт, врач общей практики, ревматолог.
- Rand JH, Wolgast LR. Dos and don»ts in diagnosing antiphospholipid syndrome. Hematology Am Soc Hematol Educ Program. 2012;2012:455-9.
- Lim W. Antiphospholipid syndrome. Hematology Am Soc Hematol Educ Program. 2013;2013:675-80. Review.
Если женщина имела подряд несколько неудачных беременностей, медики могут заподозрить у нее синдром Хьюза, или антифосфолипидный синдром. Это серьезное заболевание имеет крайне негативное влияние на процесс зачатия и вынашивания ребенка, но при своевременном выявлении и корректной терапии вероятность родить здоровое дитя достаточно высока.
Антифосфолипидный синдром, или синдром Хьюза, — это аутоиммунное заболевание. То есть оно возникает по причине сбоев в работе всей иммунной системы или ее частей. При синдроме Хьюза в организме вырабатываются антитела к фосфолипидам (вещество, из которого состоят структуры клеток) и белкам, которые их связывают. Антитела взаимодействуют с фосфолипидами и повреждают оболочки клеток. Возникают проблемы в системе свертывания крови. Это, в свою очередь, может иметь такие неприятные последствия, как тромбоз (закупорка) вен и артерий, невынашивание беременности и появление иных акушерских патологий, понижение уровня тромбоцитов в крови (тромбоцитопения). По статистике, около 5% жителей Земли страдают от этого недуга. Среди заболевших женщин больше, чем мужчин.
Сложно сказать точно, почему происходят такие сбои в работе иммунной системы, запускающие антифосфолипидный синдром. Медицинская наука называет возможные провоцирующие факторы. Среди них генетическая предрасположенность, перенесенные бактериальные или вирусные заболевания, а также онкологические недуги, длительный прием сильнодействующих лекарств (психотропных, гормональных). Синдром Хьюза часто является предвестником системной красной волчанки (тяжелого аутоиммунного заболевания) или может развиваться одновременно с ней.
Антифосфолипидный синдром (АФС) может протекать бессимптомно или проявляться характерными признаками. Наиболее частый признак АФС — это тромбоз вен. Часто страдают глубокие вены на ногах, это состояние может сопровождаться отеками конечностей и повышением температуры. Иногда на ногах появляются незаживающие язвы.
Нередко при АФС страдают поверхностные вены и сосуды печени и прочих органов. В таком случае может развиться серьезное осложнение — тромбоэмболия легочной артерии. Ее признаками являются отдышка, сильный кашель, отхаркивание крови, резкие боли в груди. Вследствие развития синдрома может пострадать сердце. Редко, но бывает, что АФС проявляется ухудшением зрения (по причине поражения сосудов сетчатки), развитием почечной недостаточности.
При синдроме Хьюза на коже разных частей тела часто можно увидеть «сосудистую сеточку», чаще всего — на нижней части ног, стопах, бедрах.
У женщин с данной патологией бывают сложности с зачатием, а осложнения беременности случаются в 80% случаев. Это могут быть самопроизвольные аборты, преждевременные роды, нарушения развития плода, гестозы (сопровождающиеся повышением артериального давления, белком в моче, отеками), кислородное голодание плода (гипоксия), отслойка плаценты и так далее. 30 процентов случаев невыношенных беременностей случаются по причине АФС. Поэтому так важно знать об этом диагнозе еще до зачатия, чтобы принять меры и подготовиться. Хотя часто бывает наоборот: именно привычное невынашивание (три и более выкидышей) наталкивает на мысль о наличии у женщины этой патологии.
При планировании беременности необходимо пройти полное обследование, сдать анализы, по данным которых врач определит наличие синдрома. После этого необходимо пройти курс лечения еще до зачатия.
Беременность усугубляет течение АФС. У женщины могут проявляться вышеописанные симптомы. Это покраснение нижней части ног, отеки, «сосудистая сетка» на ногах, появление язв; отдышка, боли в груди; головные боли и повышение артериального давления ; ухудшение зрения, памяти, нарушение координации; угроза прерывания беременности; гестоз; преждевременные роды (на сроках до 34 недель). Часто наличие синдрома Хьюза приводит к внутриутробной гибели плода и замершей беременности .
На этапе формирования сосудов плаценты у беременной могут образовываться тромбы. Вследствие этого развитие плода может происходить с задержками, или же он может погибнуть. АФС — одна из наиболее частых причин самопроизвольного прерывания беременности на сроке до 12 недель. Выкидыши могут повторяться, если женщина не проходит адекватную терапию. Такое явление называют привычным невынашиванием беременности. Поэтому так важна своевременная диагностика болезни.
Прежде всего, компетентный доктор расспросит женщину о ее симптомах и жалобах на состояние здоровья, а также о истории болезней в ее семье (были ли случаи инфарктов миокарда, ишемических инсультов, тромбозов). Кроме того, доктор изучит гинекологическую историю женщины: были ли беременности, как они протекали и чем завершились.
Беременная с подозрением на АФС должна будет также сдать анализы. А именно: общий анализ крови, коагулограмму (тестирование свертывания крови), иммуноферментный анализ для выявления антифосфолипидных антител в крови, анализ на выявление в крови волчаночного антикоагулянта. Если анализы показывают наличие АФС, то их повторно сдают через некоторое время для подтверждения диагноза. Возможно, понадобятся дополнительные консультации терапевта и врача-гематолога.
Кроме того, анализируют и состояние плода. Во время ультразвукового исследования специалист определяет, соответствуют ли размеры и показатели плода нормам. Проводят также кардиотокографию (оценку состояния плода по синхронным данным его двигательной активности, сердечных сокращений, а также сокращений матки).
После постановки диагноза проводят лечение, направленное на минимизацию осложнений со стороны системы свертывания крови. Назначают глюкокортикоиды (гормональные препараты с иммунорегулирующим действием), антиагреганты (средства, препятствующие «склеиванию» красных клеток крови). В небольших дозах может быть прописан иммуноглобулин. Обычно его вводят трижды в течении беременности: в первом триместре, в 24 недели и перед родами.
Иногда в небольших дозах назначают Гепарин (предупреждает свертывание крови) и Аспирин .
При необходимости применяются медикаменты, предупреждающие возникновение плацентарной недостаточности.
Кроме того, в течении всего срока вынашивания ребенка должен осуществляться тщательный контроль над состоянием здоровья женщины и ее ребенка. Регулярно нужно сдавать общий анализ крови, коагулограмму, следить за работой печени и почек женщины. Ежемесячно с помощью УЗИ контролируется состояние ребенка, соответствие нормам его показателей.
Ну и, конечно же, беременной женщине нужно полноценно питаться, много отдыхать и принимать витамины.
Обычно лечение антифосфолипидного синдрома осуществляется медикаментозными средствами. Различные рецепты народной медицины для предупреждения образования тромбов можно применять лишь как дополнение к лекарственной терапии и то — только после одобрения лечащего врача, поскольку не все травы и лекарственные растения можно использовать при беременности.
Народная медицина рекомендует для разжижения крови и предупреждения тромбозов использовать клюкву. Ее можно смешивать с медом и употреблять по несколько чайных ложек утром и вечером. Это также хорошее средство профилактики простудных заболеваний (клюква богата витамином С). Полезным для профилактики тромбобразования будет и настой из мяты : несколько чайных ложек мяты нужно залить кипятком, дать настояться и процедить. Его следует пить в течении нескольких месяцев утром по полстакана. Очень важно не переборщить с народными средствами. Лучше всего будет, если их подберет специалист народной медицины.
Специально для — Ксения Бойко
Одной из причин ненаступления беременности, повторных выкидышей (во всех триместрах беременности), замершей беременности, преждевременных родов – является антифосфолипидный синдром. К сожалению, большинство женщин узнают про антифосфолипидный синдром при беременности после нескольких неудачных попыток выносить ребенка.
Антифосфолипидный синдром (АФС) – это аутоиммунное нарушение, при котором в плазме крови находятся антифосфолипидные антитела и присутствуют определенные клинические проявления. Такими проявлениями могут быть: тромбозы, акушерская патология, тромбоцитопения, неврологические расстройства.
У 2–4 % женщин со здоровой беременностью обнаруживают в крови антифосфолипидные антитела;
Женщины с повторными выкидышами или несколькими замершими беременностями в 27–42 % случаев имеют антифосфолипидные антитела;
Причиной тромбоэмболии в 10–15 % случаев являются антифосфолипидные антитела;
1/3 инсультов в молодом возрасте – также следствие действия антифосфолипидных антител.
Для постановки диагноза антифосфолипидного синдрома необходимо клиническое проявление болезни и лабораторное подтверждение. Клиническое проявление антифосфолипидного синдрома при беременности – патология беременности, повторные выкидыши, замершие беременности в анамнезе, преэклампсия и эклампсия, сосудистые тромбозы.
Лабораторным признаком АФС при беременности является наличие в крови высокого титра антифосфолипидных антител.
Маркеры (типы) антифосфолипидных антител:
Волчаночный антикоагулянт (LA);
Антитела к кардиолипину (aCL);
Антитела к ß2-гликопротеину 1 класса (аß2-GP1).
Антифосфолипидные антитела бывают аутоиммунные и инфекционно-обусловленные.
О возможном антифосфолипидном синдроме при беременности могут заговорить врачи, если:
Произошло больше одной гибели ребенка в сроке больше 10-ти недель беременности;
Если были преждевременные роды на сроке меньше 34-х недель вследствие эклампсии, преэклампсии или плацентарной дисфункции;
3 и больше выкидыша (замершей беременности) на сроке меньше 10-ти недель.
Что касается анализа на АФС, то его назначают два раза для подтверждения диагноза. Промежуток между ними должен быть не менее 12-ти недель (раньше врачи рекомендовали 6 недель). Титр же антител должен быть высокий, больше 40-ка. Но в лабораториях предлагают значения гораздо меньшие, к примеру:
АТ IgM к кардиолипину 8-выше нормы Ед/мл АТ IgG к ß2-гликопротеину 8-выше нормы Ед/мл
Типы антифосфолипидного синдрома бывают: первичный, вторичный и катастрофичный.
В приведенной ниже схеме указаны проявления антифосфолипидного синдрома при беременности. Это самопроизвольные аборты, то есть естественное прерывание беременности (выкидыши); задержка в развитии плода; преждевременные роды и даже внутриутробная гибель плода.
Влияние антифосфолипидного синдрома на беременность:
АФС оказывает тромботическое влияние – тромбоз сосудов плаценты, задержка роста плода, привычное невынашивание, преэклампсия.
Нетромботическое влияние антифосфолипидного синдрома – снижение прогестерона, подавление синтеза ХГЧ, повреждение эмбриона. Беременность при АФС не наступает вследствие нарушения имплантации бластоциста (зачатие произошло, вот только крепко прикрепиться и развиваться малышу нет возможности).
Антифосфолипидный синдром при беременности необходимо лечить, чтоб выносить и родить здорового малыша. Есть ряд препаратов, которые назначает врач:
Глюкокортикоиды;
Аспирин в малых дозах;
Нефракционированный гепарин;
Аспирин в малых дозах + нефракционированный гепарин (эффективно);
Низкомолекулярный гепарин (эффективно);
Низкомолекулярный гепарин + аспирин в малых дозах (эффективно);
Варфарин;
Гидроксихлорохин;
Плазмаферез (при беременности не рекомендовано).
Антифосфолипидный синдром (АФС) относится к числу наиболее актуальныхмультидисциплинарных проблем современной медицины и рассматривается какуникальная модель аутоиммунной тромботической васкулопатии. Началоизучению АФС было положено около ста лет назад в работах A. Wassermann,
Антифосфолипидный синдром (АФС) относится к числу наиболее актуальныхмультидисциплинарных проблем современной медицины и рассматривается какуникальная модель аутоиммунной тромботической васкулопатии.
Начало изучению АФС было положено около ста лет назад в работах A.Wassermann, посвященных лабораторному методу диагностики сифилиса. Припроведении скрининговых исследований стало очевидным, что положительнуюреакцию Вассермана можно обнаружить у многих людей без клиническихпризнаков сифилитической инфекции. Этот феномен получил наименование«биологическая ложноположительная реакция Вассермана». Вскоре былоустановлено, что основным антигенным компонентом в реакции Вассерманаявляется отрицательно заряженный фосфолипид, названный кардиолипином.Внедрение радиоиммунологического, а затем и иммуноферментного метода(ИФМ) определения антител к кардиолипинам (аКЛ) способствовало болееглубокому пониманию их роли при заболеваниях человека. По современнымпредставлениям, антифосфолипидные антитела (аФЛ) — это гетерогеннаяпопуляция аутоантител, вступающих во взаимодействие с отрицательнозаряженными, реже нейтральными фосфолипидами и/илифосфолипидсвязывающими сывороточными белками. В зависимости от методаопределения, аФЛ условно подразделяются на три группы: выявляемые спомощью ИФМ с использованием кардиолипина, реже других фосфолипидов;антитела, обнаруживаемые с помощью функциональных тестов (волчаночныйантикоагулянт); антитела, которые не диагностируются с помощьюстандартных методов (антитела к белку С, S, тромбомодулину,гепарансульфату, эндотелию и др.).
Следствием пристального интереса к изучению роли аФЛ исовершенствования методов лабораторной диагностики явилось заключение,что аФЛ являются серологическим маркером своеобразногосимптомокомплекса, включающего венозные и/или артериальные тромбозы,различные формы акушерской патологии, тромбоцитопению, а также широкийспектр неврологических, кожных, сердечно-сосудистых нарушений. Начинаяс 1986 г. этот симптомокомплекс стал обозначаться как антифосфолипидныйсиндром (АФС), а в 1994 г. на международном симпозиуме по аФЛ былопредложено также использовать термин «синдром Hughes» — по именианглийского ревматолога, внесшего наибольший вклад в изучение этойпроблемы.
Истинная распространенность АФС в популяции до сих пор неизвестна.Поскольку синтез аФЛ возможен и в норме, низкий уровень антител нередковстречается в крови здоровых людей. По различным данным, частотавыявления аКЛ в популяции варьирует от 0 до 14%, в среднем же онасоставляет 2–4%, при этом высокие титры обнаруживаются достаточно редко- примерно у 0,2% доноров. Несколько чаще аФЛ выявляются у лиц пожилоговозраста. При этом клиническое значение аФЛ у «здоровых» лиц (т. е. неимеющих явных симптомов заболевания) не вполне ясно. Часто приповторных анализах уровень повышенных в предшествующих определенияхантител нормализуется.
Нарастание частоты встречаемости аФЛ отмечено при некоторыхвоспалительных, аутоиммунных и инфекционных заболеваниях,злокачественных новообразованиях, на фоне приема лекарственныхпрепаратов (оральные контрацептивы, психотропные средства и проч.).Имеются данные об иммуногенетической предрасположенности к повышенномусинтезу аФЛ и более частом их выявлении у родственников больных АФС.
Доказано, что аФЛ не только серологический маркер, но и важный«патогенетический» медиатор, вызывающий развитие основных клиническихпроявлений АФС. Антифосфолипидные антитела обладают способностьювоздействовать на большинство процессов, составляющих основу регуляциигемостаза, нарушение которых приводит к гиперкоагуляции. Клиническоезначение аФЛ зависит от того, связано ли их наличие в сыворотке крови сразвитием характерной симптоматики. Так, проявления АФС наблюдаютсятолько у 30% больных с положительным волчаночным антикоагулянтом и у30–50% больных, имеющих умеренный или высокий уровень аКЛ. Заболеваниеразвивается преимущественно в молодом возрасте, при этом АФС может бытьдиагносцирован у детей и даже у новорожденных. Как и другиеаутоиммунные ревматические заболевания, данный симптомокомплекс чащевстречается у женщин, чем у мужчин (соотношение 5:1).
Самыми частыми и характерными проявлениями АФС являются венозныеи/или артериальные тромбозы и акушерская патология. При АФС могутпоражаться сосуды любого калибра и локализации — от капилляров докрупных венозных и артериальных стволов. Поэтому спектр клиническихпроявлений чрезвычайно разнообразен и зависит от локализации тромбоза.По современным представлениям, основу АФС составляет своеобразнаяваскулопатия, обусловленная невоспалительным и/или тромботическимпоражением сосудов и заканчивающаяся их окклюзией. В рамках АФС описаныпатология ЦНС, сердечно-сосудистой системы, нарушение функции почек,печени, эндокринных органов, желудочно-кишечного тракта. С тромбозомсосудов плаценты склонны связывать развитие некоторых форм акушерскойпатологии ( ).
Венозный тромбоз, особенно тромбоз глубоких вен нижних конечностей, -наиболее типичное проявление АФС, в том числе в дебюте заболевания.Тромбы обычно локализуются в глубоких венах нижних конечностей, номогут нередко встречаться в печеночных, портальных, поверхностных идругих венах. Характерны повторные эмболии легочных артерий, что можетприводить к развитию легочной гипертензии. Описаны случаи развитиянадпочечниковой недостаточности вследствие тромбоза центральной венынадпочечников. Артериальные тромбозы в целом встречаются примерно в 2раза реже венозных. Они проявляются ишемией и инфарктами мозга,коронарных артерий, нарушениями периферического кровообращения. Тромбозвнутримозговых артерий — самая частая локализация артериальноготромбоза при АФС. К редким проявлениям относится тромбоз крупныхартерий, а также восходящего отдела аорты (с развитием синдрома дугиаорты) и брюшной аорты. Особенностью АФС является высокий рискрецидивирования тромбозов. При этом у больных с первым тромбозом вартериальном русле повторные эпизоды также развиваются в артериях. Еслиже первым тромбозом был венозный, то повторные тромбозы, как правило,отмечаются в венозном русле.
Поражение нервной системы относится к наиболее тяжелым (потенциальносмертельным) проявлениям АФС и включает транзиторные ишемические атаки,ишемический инсульт, острую ишемическую энцефалопатию, эписиндром,мигрень, хорею, поперечный миелит, нейросенсорную тугоухость и другиеневрологические и психиатрические симптомы. Ведущей причиной пораженияЦНС является ишемия мозга вследствие тромбоза мозговых артерий, однаковыделяют ряд неврологических и нейропсихических проявлений,обусловленных другими механизмами. Транзиторные ишемические атаки (ТИА)сопровождаются потерей зрения, парестезиями, двигательной слабостью,головокружением, транзиторной общей амнезией и нередко за много недельи даже месяцев предшествуют инсульту. Рецидивирование ТИА ведет кмультиинфарктной деменции, которая проявляется когнитивныминарушениями, снижением способности к концентрации внимания и памяти идругими неспецифичными для АФС симптомами. Поэтому ее нередко труднодифференцировать от сенильной деменции, метаболического (илитоксического) поражения мозга и болезни Альцгеймера. Иногда ишемиямозга связана с тромбоэмболией, источниками которой служат клапаны иполости сердца или внутренняя сонная артерия. В целом частотаишемического инсульта выше у больных с поражением клапанов сердца(особенно левых отделов).
Головные боли традиционно рассматриваются как одно из наиболеечастых клинических проявлений АФС. Характер головных болей варьирует отклассических интермиттирующих мигренозных до постоянных, невыносимыхболей. Имеется ряд других симптомов (синдром Гийена–Барре,идиопатическая внутричерепная гипертензия, поперечный миелит,паркинсонический гипертонус), развитие которых также ассоциируется ссинтезом аФЛ. У больных с АФС нередко наблюдаются вено-окклюзивныезаболевания глаз. Одной из форм такой патологии является преходящаяпотеря зрения (amaurosis fugax). Другое проявление — нейропатиязрительного нерва относится к числу самых частых причин слепоты приАФС.
Поражение сердца представлено широким спектром проявлений,включающих инфаркт миокарда, поражение клапанного аппарата сердца,хроническую ишемическую кардиомиопатию, внутрисердечный тромбоз,артериальную и легочную гипертензию. Как у взрослых, так и у детейтромбоз коронарных артерий является одним из основных локализацийартериальной окклюзии при гиперпродукции аФЛ. Инфаркт миокардаразвивается приблизительно у 5% аФЛ-положительных больных, при этом он,как правило, встречается у мужчин моложе 50 лет. Самым частымкардиологическим признаком АФС является поражение клапанов сердца. Оноварьирует от минимальных нарушений, выявляемых только приэхокардиографии (небольшая регургитация, утолщение створок клапанов),до порока сердца (стеноз или недостаточность митрального, режеаортального и трикуспидального клапанов). Несмотря на большоераспространение, клинически значимая патология, ведущая к сердечнойнедостаточности и требующая оперативного лечения, наблюдается редко (у5% больных). Однако в некоторых случаях может быстро развиваться оченьтяжелое поражение клапанов с вегетациями, обусловленнымитромботическими наслоениями, неотличимое от инфекционного эндокардита.Выявление вегетаций на клапанах, особенно если они сочетаются сгеморрагиями в подногтевое ложе и «барабанными пальцами», создаетсложные диагностические проблемы и необходимость проведениядифференциального диагноза с инфекционным эндокардитом. В рамках АФСописано развитие сердечных тромбов, имитирующих миксому.
Почечная патология весьма разнообразна. У большинства пациентовнаблюдается только бессимптомная умеренная протеинурия (менее 2 г всут), без нарушения функции почек, но может развиваться острая почечнаянедостаточность с выраженной протеинурией (вплоть до нефротическогосиндрома), активным мочевым осадком и артериальной гипертонией.Поражение почек связано главным образом с внутриклубочковыммикротромбозом и определяется как «почечная тромботическаямикроангиопатия».
Больные с АФС имеют яркое и специфичное поражение кожи, в первуюочередь сетчатое ливедо (встречающееся более чем у 20% больных),посттромбофлебитические язвы, гангрену пальцев рук и ног, множественныегеморрагии в ногтевое ложе и другие проявления, обусловленные тромбозомсосудов.
При АФС встречаются поражение печени (синдром Бадда–Киари, узловаярегенераторная гиперплазия, портальная гипертензия),желудочно-кишечного тракта (желудочно-кишечные кровотечения, инфарктселезенки, тромбоз мезентериальных сосудов), опорно-двигательногоаппарата (асептические некрозы костей).
К числу характерных проявлений АФС относится акушерская патология,частота которой может достигать 80%. Потеря плода может наступить влюбые сроки беременности, но несколько чаще отмечается во II и IIIтриместре. Кроме того, синтез аФЛ ассоциируется и с другимипроявлениями, в том числе с поздним гестозом, преэклампсией иэклампсией, задержкой внутриутробного развития плода, преждевременнымиродами. Описано развитие тромботических осложнений у новорожденных отматерей с АФС, что свидетельствует о возможности трансплацентарнойпередачи антител.
Для АФС типична тромбоцитопения. Обычно количество тромбоцитовколеблется от 70 до 100 х109/л и не требует специального лечения.Развитие геморрагических осложнений наблюдается редко и, как правило,связано с сопутствующим дефектом специфических факторов свертываниякрови, патологией почек или передозировкой антикоагулянтов. Нередконаблюдается Кумбс-положительная гемолитическая анемия (10%), режевстречается синдром Эванса (сочетание тромбоцитопении и гемолитическойанемии).
Полиорганность симптоматики и необходимость проведения специальныхподтверждающих лабораторных тестов обусловливают в ряде случаевтрудности в постановке диагноза АФС. В связи с этим в 1999 г. былипредложены предварительные классификационные критерии, в соответствии скоторыми диагноз АФС считается достоверным при сочетании, по крайнеймере, одного клинического и одного лабораторного признака.
- Сосудистый тромбоз: один и более эпизодов тромбоза(артериального, венозного, тромбоза мелких сосудов). Тромбоз долженбыть подтвержден при помощи инструментальных методов или морфологически(морфология — без значительного воспаления сосудистой стенки).
- Патология беременности может иметь один из трех вариантов:
– один и более случаев внутриутробной гибели морфологически нормального плода после 10 нед беременности;
– один и более эпизодов преждевременных родов морфологическинормального плода до 34 нед беременности из-за выраженной преэклампсии,или эклампсии, или выраженной плацентарной недостаточности;
– три и более последовательных случаев спонтанных абортовдо 10 нед беременности (при исключении анатомических дефектов матки,гормональных нарушений, материнских и отцовских хромосомных нарушений).
- положительные аКЛ класса IgG или IgM в сыворотке в средних ивысоких титрах, определенные, по крайней мере, дважды, с интервалом неменее 6 нед, с помощью стандартизованного иммуноферментного метода;
- положительныйволчаночный антикоагулянт, выявляемый в плазме, по крайней мере, синтервалом не менее 6 нед стандартизованным методом.
Дифференциальная диагностика АФС проводится с широким кругомзаболеваний, протекающих с сосудистыми нарушениями. Следует помнить,что при АФС наблюдается очень большое количество клиническихпроявлений, которые могут имитировать различные заболевания:инфекционный эндокардит, опухоли сердца, рассеянный склероз, гепатит,нефрит и др. АФС в ряде случаев сочетается с системными васкулитами.Полагают, что АФС должен быть заподозрен при развитии тромботическихнарушений (особенно множественных, рецидивирующих, с необычнойлокализацией), тромбоцитопении, акушерской патологии у лиц молодого исреднего возраста при отсутствии факторов риска возникновения этихпатологических состояний. Его следует исключать при необъяснимомтромбозе у новорожденных, в случаях некроза кожи на фоне лечениянепрямыми антикоагулянтами и у больных с удлиненным активированнымчастичным тромбопластиновым временем при скрининговом исследовании.
АФС вначале был описан как вариант системной красной волчанки (СКВ).Однако очень скоро было установлено, что АФС может развиваться и придругих аутоиммунных ревматических и неревматических заболеваниях(вторичный АФС). Более того, оказалось, что связь между гиперпродукциейаФЛ и тромботическими нарушениями имеет более универсальный характер иможет наблюдаться в отсутствие достоверных клинических и серологическихпризнаков других заболеваний. Это послужило основанием для введениятермина «первичный АФС» (ПАФС). Полагают, что примерно половина больныхАФС страдают первичной формой заболевания. Однако является ли ПАФСсамостоятельной нозологической формой до конца не ясно. Обращает насебя внимание высокая частота развития ПАФС среди мужчин (соотношениемужчин к женщинам составляет 2:1), что отличает ПАФС от другихаутоиммунных ревматических заболеваний. Отдельные клиническиепроявления или их сочетания встречаются у больных с ПАФС с неодинаковойчастотой, что, вероятно, связано с гетерогенностью самого синдрома. Внастоящий момент условно выделяют три группы больных ПАФС:
- больные с идиопатическим тромбозом глубоких вен голени,который часто осложняется тромбоэмболиями, прежде всего в системулегочной артерии, приводя к развитию легочной гипертензии;
- больныемолодого возраста (до 45 лет) с идиопатическими инсультами,транзиторными ишемическими атаками, реже окклюзией других артерий, втом числе коронарных; наиболее ярким примером этого варианта ПАФСявляется синдром Снеддона;
- женщины с акушерской патологией (повторные спонтанные аборты);
Течение АФС, тяжесть и распространенность тромботических осложнений принем непредсказуемы и в большинстве случаев не коррелируют с изменениемуровня аФЛ и активностью заболевания (при вторичном АФС). У некоторыхбольных АФС может проявляться острой, рецидивирующей коагулопатией,часто в сочетании с васкулопатией, затрагивающей многие жизненно важныеорганы и системы. Это послужило основанием для выделения такназываемого «катастрофического АФС» (КАФС). Для определения данногосостояния предлагались названия «острая диссеминированнаякоагулопатия–васкулопатия» или «разрушительная невоспалительнаяваскулопатия», что также подчеркивает острый, фульминантный характерэтого варианта АФС. Основным провоцирующим фактором КАФС являетсяинфекция. Реже его развитие связано с отменой антикоагулянтов илиприемом некоторых лекарственных препаратов. КАФС встречается примерно у1% больных АФС, но несмотря на проводимую терапию в 50% случаевзаканчивается летальным исходом.
Профилактика и лечение АФС представляют сложную проблему. Этообусловлено неоднородностью патогенетических механизмов, полиморфизмомклинических проявлений, а также отсутствием достоверных клинических илабораторных показателей, позволяющих прогнозировать рецидивированиетромботических нарушений. Не существует общепринятых международныхстандартов лечения, а предлагаемые рекомендации основаны главнымобразом на результатах открытых испытаний лекарственных препаратов илиретроспективного анализа исходов заболевания.
Лечение глюкокортикоидами и цитотоксическими препаратами при АФС,как правило, неэффективно, за исключением ситуаций, когдацелесообразность их назначения продиктована активностью основногозаболевания (например, СКВ).
Ведение больных с АФС (как и с другими тромбофилиями) основываетсяна назначении антикоагулянтов непрямого действия (варфарин,аценокумарол) и антиагрегантов (в первую очередь низких дозацетилсалициловой кислоты – АСК). Это связано прежде всего с тем, чтодля АФС характерен высокий риск повторных тромбозов, значительнопревосходящий таковой при идиопатических венозных тромбозах. Полагают,что большинство больных АФС с тромбозами нуждаются в профилактическойантиагрегантной и/или антикоагулянтной терапии в течение длительноговремени, а иногда и пожизненно. Кроме того, риск первичных и повторныхтромбозов при АФС необходимо снижать путем влияния на такиекорригируемые факторы риска, как гиперлипидемия (статины: симвастин -симвастол, симло; ловастатин — ровакор, кардиостатин; правастатин -липостат; аторвастатин — авас, липримар; фибраты: безафибрат -холестенорм; фенофибрат — нофибал, грофибрат; ципрофибрат — липанор),артериальная гипертензия (ингибиторы АПФ — капотен, синоприл, диротон,моэкс; b-блокаторы — атенолол, конкор, эгилок, беталок ЗОК, дилатренд;антагонисты кальция — амловас, норваск, нормодипин, лацидипин),гипергомоцистеинемия, малоподвижный образ жизни, курение, приеморальных контрацептивов и др.
У больных с высоким уровнем аФЛ в сыворотке, но без клиническихпризнаков АФС (в том числе у беременных женщин без акушерской патологиив анамнезе) следует ограничиться назначением небольших доз АСК (50–100мг/сут). Наиболее предпочтительны препараты аспирин кардио, тромбо АСС,обладающие рядом преимуществ (удобная дозировка и наличие оболочки,устойчивой к действию желудочного сока). Такая форма позволяетобеспечивать не только надежный антиагрегантный эффект, но и уменьшитьнеблагоприятное действие на желудок.
Больные с клиническими признаками АФС (в первую очередь стромбозами) нуждаются в более агрессивной антикоагулянтной терапии.Лечение антагонистами витамина К (варфарин, фенилин, аценокумарол)несомненно более эффективный, но менее безопасный (по сравнению с АСК)метод профилактики венозных и артериальных тромбозов. Применениеантагонистов витамина К требует тщательного клинического илабораторного контроля. Во-первых, это связано с увеличением рискакровоточивости, а риск развития данного осложнения из-за его тяжестипревосходит пользу от профилактики тромбоза. Во-вторых, у части больныхрецидивирование тромбоза отмечается после прекращения терапииантикоагулянтами (особенно в течение первых 6 мес после отмены).В-третьих, у больных АФС могут наблюдаться выраженные спонтанныеколебания международного нормализованного отношения (МНО), чтозначительно затрудняет использование этого показателя для мониторингалечения варфарином. Однако все вышеперечисленное не должно являтьсяпрепятствием для проведения активной антикоагулянтной терапии у техбольных, которым она жизненно необходима ( ).
Схема лечения варфарином заключается в назначении насыщающей дозы (5–10мг препарата в день) в течение первых двух дней, а затем в подбореоптимальной дозировки, обеспечивающей поддержание целевого МНО. Всюдозу целесообразно принимать в утренние часы, до определения МНО. У лицпожилого возраста для достижения того же уровня антикоагуляции следуетиспользовать более низкие дозы варфарина, чем у молодых. Необходимоиметь в виду, что варфарин взаимодействует с рядом лекарственныхпрепаратов, которые при сочетанном назначении как снижают (барбитураты,эстрогены, антациды, противогрибковые и противотуберкулезныепрепараты), так и усиливают его антикоагулянтное действие (нестероидныепротивовоспалительные средства, антибиотики, пропранолол, ранитидин идр.). Следует дать определенные рекомендации по поводу диеты, так какбогатая витамином К пища (печень, зеленый чай, листовые овощи -брокколи, шпинат, брюссельская и кочанная капуста, репа, салат-латук)способствует развитию резистентности к варфарину. Во время терапииварфарином исключается алкоголь.
При недостаточной эффективности монотерапии варфарином возможнопроведение комбинированной терапии непрямыми антикоагулянтами и низкимидозами АСК (и/или дипиридамолом). Такое лечение наиболее оправдано улиц молодого возраста без факторов риска кровотечений.
В случае избыточной антикоагуляции (МНО>4) при отсутствиикровотечения рекомендуется временно отменить варфарин до возвращенияМНО к целевому уровню. В случае гипокоагуляции, сопровождающейсякровотечениями, недостаточно назначения только витамина К (вследствиеотсроченного начала действия — через 12–24 ч после введения);рекомендуется свежезамороженная плазма или (что предпочтительнее)концентрат протромбинового комплекса.
Аминохинолиновые препараты (гидроксихлорохин — плаквенил, хлорохин -делагил) могут обеспечивать довольно эффективную профилактику тромбозов(по крайней мере, при вторичном АФС на фоне СКВ). Наряду спротивовоспалительным действием, гидроксихлорохин обладает определеннымантитромботическим (подавляет агрегацию и адгезию тромбоцитов,уменьшает размер тромба) и гиполипидемическим эффектами.
Центральное место в лечении острых тромботических осложнений при АФСзанимают прямые антикоагулянты — гепарин и особенно препаратынизкомолекулярного гепарина (фраксипарин, клексан). Тактика ихприменения не отличается от общепринятой.
При КАФС используется весь арсенал методов интенсивной ипротивовоспалительной терапии, применяемой при критических состояниях упациентов с ревматическими заболеваниями. Эффективность лечения вопределенной степени зависит от возможности устранить факторы,провоцирующие его развитие (инфекция, активность основногозаболевания). Назначение высоких доз глюкокортикоидов при КАФСнаправлено не на лечение тромботических нарушений, но определяетсянеобходимостью терапии синдрома системного воспалительного ответа(распространенный некроз, дистресс-синдром взрослых, надпочечниковаянедостаточность и др.). Обычно проводится пульс-терапия по стандартнойсхеме (1000 мг метилпреднизолона внутривенно в день в течение 3–5 дней)с последующим назначением глюкокортикоидов (преднизолон,метилпреднизолон) перорально (1–2 мг/кг/сут). Внутривенныйиммуноглобулин вводят в дозе 0,4 г/кг в течение 4–5 дней (особенноэффективен он при тромбоцитопении).
КАФС является единственным абсолютным показанием для проведениясеансов плазмафереза, которые следует сочетать с максимальнойинтенсивной антикоагулянтной терапией, использованием свежезамороженнойплазмы и проведением пульс-терапии глюкокортикоидами и цитостатиками.Циклофосфамид (цитоксан, эндоксан) (0,5–1 г/сут) показан при развитииКАФС на фоне обострения СКВ и для предотвращения «синдрома рикошета»после проведения сеансов плазмафереза. Оправдано использованиепростациклина (5 нг/кг/мин в течение 7 дней), однако ввиду возможностиразвития «рикошетных» тромбозов лечение должно проводиться состорожностью.
Назначение глюкокортикоидов женщинам с акушерской патологией внастоящее время не показано, в связи с отсутствием данных опреимуществах такого вида терапии и из-за большой частоты побочныхэффектов у матери (синдром Кушинга, диабет, артериальная гипертензия) иплода. Применение глюкокортикоидов оправдано только при вторичном АФСна фоне СКВ, поскольку направлено на лечение основного заболевания.Использование непрямых антикоагулянтов при беременности в принципепротивопоказано ввиду их тератогенного действия.
Стандартом профилактики рецидивирующих потерь плода являются малыедозы АСК, которые рекомендуется принимать до, в течение беременности ипосле рождения ребенка (по крайней мере, в течение 6 мес). Во времябеременности малые дозы АСК желательно комбинировать с препаратаминизкомолекулярного гепарина. При родоразрешении с помощью кесаревасечения введение низкомолекулярных гепаринов отменяется за 2–3 дня ивозобновляется в послеродовом периоде с последующим переходом на приемнепрямых антикоагулянтов. Длительная терапия гепарином у беременныхженщин может приводить к развитию остеопороза, поэтому для уменьшенияпотери костной массы необходимо рекомендовать прием карбоната кальция(1500 мг) в сочетании с витамином D. Следует иметь в виду, что лечениенизкомолекулярным гепарином реже вызывает остеопороз. Одним изограничений к применению низкомолекулярных гепаринов является опасностьразвития эпидуральной гематомы, поэтому, если существует вероятностьпреждевременного родоразрешения, лечение низкомолекулярными гепаринамипрекращается не позднее 36 нед беременности. Применение внутривенногоиммуноглобулина (0,4 г/кг в течение 5 дней каждый месяц) не имеетпреимуществ перед стандартным лечением АСК и гепарином, и показанотолько при неэффективности стандартной терапии.
Умеренная тромбоцитопения у больных АФС не требует специальноголечения. При вторичном АФС тромбоцитопения хорошо контролируетсяглюкокортикоидами, аминохинолиновыми препаратами и в некоторых случаях- низкими дозами АСК. Тактика лечения резистентной тромбоцитопении,создающей угрозу кровотечений, включает применение глюкокортикоидов ввысоких дозах и внутривенного иммуноглобулина. В случае неэффективностивысоких доз глюкокортикоидов методом выбора является спленэктомия.
В последние годы интенсивно разрабатываются новые антитромботическиеагенты, к которым относят гепариноиды (гепароид лечива, эмеран,сулодексид — вессел дуэ), ингибиторы тромбоцитарных рецепторов(тиклопидин, тагрен, тиклопидин-ратиофарм, клопидогрель, плавикс) идругие препараты. Предварительные клинические данные свидетельствуют онесомненной перспективности этих лекарственных средств.
Все больные АФС должны находиться под длительным диспансернымнаблюдением, первоочередной задачей которого является оценка рискарецидивирования тромбозов и их профилактика. Необходим контрольактивности основного заболевания (при вторичном АФС), своевременноевыявление и лечение сопутствующей патологии, в том числе инфекционныхосложнений, а также воздействие на корригируемые факторы рискатромбозов. Установлено, что прогностически неблагоприятными факторами вотношении летальности при АФС являются артериальные тромбозы, высокаячастота тромботических осложнений и тромбоцитопения, а из лабораторныхмаркеров — наличие волчаночного антикоагулянта. Течение АФС, тяжесть ираспространенность тромботических осложнений непредсказуемы;универсальные схемы терапии, к сожалению, отсутствуют. Вышеупомянутыефакты, а также полиорганность симптоматики требуют объединения врачейразличных специальностей для решения проблем, связанных с ведениемданной категории больных.
Н. Г. Клюквина , кандидат медицинских наук, доцент
ММА им. И. М. Сеченова, Москва
источник