Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
В предыдущей статье посвященной физиологии репродуктивной системы женщины мы вкратце рассказали о той роли, которую играют гормоны в развитии и функционировании женских половых органов. В регуляции менструального цикла и овуляции участвует множество эндокринных органов, и еще большее чисто продуцирующих ими гормонов. Потому по статистике эндокринное бесплодие занимает второе место как причина бесплодия. Но главное, что объединяет все формы эндокринного бесплодия – это отсутствие овуляции. Именно отсутствие овуляции делает процесс зачатия в данном случае невозможным – и это естественно, так как зачатие ребенка в условиях отсутствия яйцеклетки невозможно по определению.
Однако, каждая из форм ановуляторного бесплодия имеет ряд специфических признаков, симптомов и лабораторно-диагностических маркеров.
В структуре бесплодного брака ановуляторное женское бесплодие встречается в 30-40% случаев.
• Бесплодие вследствие гонадотропной недостаточности.
• Синдром поликистозных яичников.
• Яичниковая недостаточность.
• Гиперпролактинемия – повышенное содержание гормона пролактина в крови.
• Гипотиреоз – снижение уровня гормонов щитовидной железы.

• наблюдение девочек, рождённых от матерей с эндокринными нарушениями, у детского гинеколога. Это связано с тем, что часто бесплодие связано с генетической патологией, передающейся по наследству.
• борьба со стрессом. Частые стрессы являются основной причиной развития вторичного эндокринного бесплодия женщин. Ведь главным в связке регуляции менструального цикла гипоталамус-гипофиз-яичники, является гипоталамо-гипофизарная система, деятельность которой напрямую зависит от пихоэмоционального фона женщины.
• санация очагов инфекции в детском и подростковом возрасте. Такие инфекционно воспалителыне заболевания как: эндометрит, аднексит, оофорит, менингит, туберкулез являются основными причинами эндокринной недостаточности пораженных органов. Их своевременное лечение или предупреждение возникновения являются залогом гинекологического здоровья будущей мамы.
• нормализация веса. Женщины, как правило, ищут оправдание своей полноте в гормональных нарушениях – редко, но бывает, что это действительно так (гормоны являются причиной избыточного веса). Чаще дела обстоят наоборот – избыточный вес порождает гормональные нарушения. А избыточный вес является следствием нерационального образа жизни. Избыточная или сниженная масса тела напрямую влияет на органы внутренней секреции.
Необходимые лабораторно-инструментальные исследования 
• У3И — подтверждение отсутствия зрелого фолликула на 11-16 день цикла или отсутствие желтого тела на 19-23 день цикла.
• Гормональные — исследование уровня прогестерона на 18-23-й день цикла; выявление сниженного уровня ЛГ, предшествующего овуляции с помощью домашних мочевых тестов (тест «Клиаплан») на II-III день цикла.
• Измерение базальной температуры иногда применяют для выявления яичниковой дисфункции. Его преимущества в дешевизне и формировании ответственного отношения женщины к лечению.
При обнаружении признаков туберкулеза – консультация врача фтизиатра.
При гормональных нарушениях не гинекологиечких органов – гипопитуитаризм, нарушение работы щитовидной железы и надпочечников – необходима консультация врача эндокринолога.
При синдроме поликистозных яичников часто в лечении задействуется лапароскопическая хирургия – потому необходима консультация гинеколога – хирурга.
Лечение состоит из трёх этапов:
• Подготовка к индукции овуляции. На этом этапе проводят коррекцию эндокринных нарушений, подготовку эндометрия.
• Контролируемая индукция овуляции.
• Гормональная поддержка лютеиновой фазы индуцированного цикла.
Подробнее о диагностике и лечении каждого вида гормонального бесплодия в отдельности Вы сможете ознакомившись с соответствующей статьей.
Автор: Ткач И.С. врач, хирург офтальмолог
источник
В современной медицине существует несколько видов женского бесплодия. Одним из них является нормогонадотропное ановуляторное бесплодие. Согласитесь, что даже выговорить его название тяжело. Но этот вид бесплодия все-таки существует и приносит немало страданий женщинам, которые мечтают о рождении ребенка. Попробуем внести ясность.
Проблема возникает вследствие заболевания щитовидной железы или половых желез. Известно, что эти железы отвечают за нормализацию менструального цикла. В связи с малейшими нарушениями работы желез возможны гормональные сбои в организме. Ановуляторное нормогонадотропное бесплодие характеризируется отсутствием овуляции у женщин детородного возраста. Иногда овуляция происходит, но очень редко или же бывает не совсем полноценной. Почему так происходит? Где кроется причина отсутствия овуляции?
Основной причиной заболевания считается снижение секреции гонадотропных гормонов, которые отвечают за стимуляцию роста фолликулов с яйцеклетками. Болезнь может быть вызвана осложнением после перенесения хронических заболеваний, частыми стрессовыми ситуациями, резким снижением веса, а также наследственной предрасположенностью.
В связи с этим возникает эндокринное (ановуляторное) бесплодие, причинами которого могут быть:
- Нарушения в работе гипофиза и гипоталамуса. У женщины наблюдается потеря веса, кровотечение, депрессия.
- Избыток эстрогенов при симптоме поликистозных яичников.
- Истощение яичников. Шансы забеременеть при этом диагнозе равны нулю.
- Аномальные явления в хромосомах яйцеклетки.
- Врожденная гиперфункция коры надпочечников.
- Дисфункция щитовидной железы.
- Болезни печени.
- Ранний климакс.
- Гипотиреоз и гиперпролактинемия, но в очень редких случаях.
В первую очередь нужно привести в норму работу желез внутренней секреции. Если ановуляция носит хронический характер, то нужно устранить дисфункцию не только эндокринных желез, но и привести в нормальное состояние эндометрий и маточные трубы. Эти нарушения происходят в процессе длительного дисбаланса гормональной сферы. Поэтому очень важно при появлении первых признаков нарушения овуляции сразу обратиться за медицинской помощью.
Если причиной эндокринных расстройств является избыточный вес или, наоборот, его нехватка, то необходима специальная диета с целью корректировки веса.
Неплохо лечится гормональное бесплодие, вызванное гиперпролактинемией. Это когда в крови пациентки наблюдается повышенное содержание гормона пролактина. Симптомами заболевания являются нарушения менструального цикла, выделения из молочных желез молозива или молока. В этих случаях врачи прибегают к помощи гормональных препаратов. Иногда лечение требует и хирургического вмешательства.
У 80 % женщин при синдроме поликистозных яичников успешно проходит лечение гормонального бесплодия, но иногда приходится прибегать к оперативному вмешательству. Оно заключается в клиновидной резекции яичников или каутеризации (электро- или термокоагуляции яичников). Эти методы приводят к снижению в организме уровня андрогенов. После этого примерно у 70% женщин восстанавливается менструальный цикл и происходит полноценная овуляция.
Этап стимулирования овуляции должен происходить под строгим контролем врача и является серьезной терапией, которая сопровождается частой УЗИ-иагностикой. Лечение проводится гормональными препаратами, которые подбираются врачом, учитывая индивидуальные особенности организма женщины, и имеют противопоказания и побочные эффекты.
Для стимуляции овуляции используют препарат кломифен цитрат (кломид), который способствует выработке в организме фолликулостимулирующего гормона. Иногда стимуляцию овуляции проводят не гормональными препаратами, а с помощью физических методов: электростимуляцией шейки матки и диэнцефальной области.
Если у женщины истощены яичники, то стимуляция овуляции тут не поможет. В таком случае следует прибегнуть к методу ЭКО (искусственное оплодотворение). Пересадка в полость матки уже оплодотворенной яйцеклетки под дальнейшим контролем врача позволяет женщине с эндокринными проблемами родить желанного малыша.
источник
Существует множество причин и типов инфертильности. Некоторые из них связаны с гормонами, именно таким и является ановуляторное бесплодие. Это не самый частый тип, однако, он хорошо известен врачам и с большей или меньшей степенью успешности поддается гормональной коррекции без хирургического вмешательства. О том, как проявляется данный тип патологии, и как ее лечить, рассказано в данном материале.
Корректное название данного состояния — нормогонадотропное ановуляторное бесплодие. Оно имеет гормональную причину и развивается вследствие гормонального дисбаланса, который возникает при нарушении в работе щитовидной железы и/или половых желез, вырабатывающих гормоны. При этом типе патологии отсутствует овуляция, яйцеклетка не созревает и не выходит из фолликула. Таким образом, хотя кажется, что менструальная функция нормальна, на самом деле непосредственно яйцеклетки, необходимые для зачатия, отсутствуют.
При этом протекание патологии может варьироваться. Овуляция может отсутствовать вовсе на протяжении длительного времени, отсутствовать периодически, быть неполноценной постоянно или периодически (то есть, созревает очень мало клеток). Все зависит от стабильности и степени нарушения гормонального баланса.
При этом, известны случаи, когда состояние компенсировалось и самостоятельно без лечения. То есть, оно проходило, как только гормональный уровень нормализовался в организме самостоятельно.
Этот тип инфертильности редко бывает абсолютным и неизлечимым. Обычно, он успешно поддается корректировке. Кроме того, такая инфертильность может быть как первичной, так и вторичной, так как непосредственно от процесса беременности и родов никак не зависит (хотя есть мнения, что роды могут спровоцировать гормональный сбой, приводящий к такому типу бесплодия).
Как ясно из написанного выше, причины данного заболевания всегда лежат в гормональном сбое, который может произойти по ряду причин, таких как:
- Прием медикаментозных гормональных препаратов;
- Аутоиммунные и эндокринные заболевания;
- Стресс, недостаток сна;
- Неправильное питание, вредные привычки;
- Резкие колебания веса в большую или меньшую сторону;
- Нарушения в работе гипоталамуса и гипофиза;
- Наследственная предрасположенность;
- Некоторые хронические заболевания, напрямую не связанные с эндокринной системой и гормонами;
- Врожденная гиперфункция коры надпочечников;
- Нарушения работы щитовидной железы;
- Заболевания печени;
- Ранний климакс, естественный или искусственный;
- Чрезмерные нагрузки, как физические, так и эмоциональные.
Какие же именно гормоны вовлечены в процесс? Основной причиной анновуляторного бесплодия является снижение выработки гонадотропных гормонов. Именно благодаря им происходит рост фолликула с последующим формированием в нем яйцеклетки.
Иногда причиной такого бесплодия является резкое повышение содержания в крови эстрогенов, зачастую сопровождающееся развитием новообразований в органах репродуктивной системы. Кроме того, иногда состояние обусловлено врожденными аномалиями в строении яйцеклетки. В этом случае шансы на наступление беременности практически равны нулю даже после курса лечения.
Симптоматика инфертильности заключается собственно в неспособности забеременеть. Врачи говорят о инфертильности тогда, когда зачатие не наступает в течение более чем полутора лет, на протяжении которых велась регулярная половая жизнь без применения средств контрацепции, в том числе и в период овуляции. Если на протяжении этого срока женщина не смогла забеременеть, то необходимо обратиться к врачу репродуктологу.
Однако этот тип патологии несколько специфичен и может иметь некоторую симптоматику. Это такие признаки ,как:
- Депрессия;
- Кровотечения ациклические или усиленные во время месячных;
- Сбои менструального цикла, регулярные или периодические;
- Потеря веса;
- В более редких случаях наблюдается истощение яичников, разрастание их тканей, поликистоз;
- На анализах может обнаруживаться существенный избыток эстрогенов.
Тщательное обследование в этих случаях помогает установить причину заболевания достаточно быстро. Если лечение начато своевременно, то по сравнению с другими формами бесплодия, данная имеет относительно неплохой прогноз.
Для диагностики состояния проводятся следующие исследования:
- УЗИ;
- Анализ крови на половые гормоны и гормоны надпочечников;
- Кольпоскопия;
- Анализ проходимости труб;
- Мазок на флору из влагалища;
- Посткоитальный тест.
Это поможет исключить иные причины бесплодия и подтвердить его гормональный характер.
Лечение состояния происходит полностью медикаментозно. Хирургическое вмешательство необходимо лишь тогда, когда оно сопровождается наличием больших, не поддающихся гормональному лечению, гормонозависимых новообразований.
В основном же лечение направлено на ликвидацию патологического состояния. В зависимости от того, какими причинами вызвано состояние, проводят то или иное лечение. Выбирается одна из следующих схем:
- Кломифенцитрамов в сочетании с хорионическим гонадотропином – первый препарат вводят с 9 по 12 дни цикла по 50 мг в сутки на протяжении трех месяцев, второй – на 10, 12 и 14 дни по 1500 ЕД в сутки внутримышечно;
- Только хорионический гонадотропин на 10, 12, 14, 16 дни цикла, по 1500 ЕД в сутки на протяжении трех месяцев, внутримышечно;
- Менопаузный гонадотропин с 5 по 14 дни цикла по 75 ЕД ежесуточно, на 15, 17 и 19 дни — хорионический гонадотропин по 1500 ЕД, проводится 2-3 курса;
- Прогестерон – по одной таблетке с 5 по 25 дни цикла на протяжении 3-4 месяцев, предпочтение отдается двухкомпонентным препаратам;
- Эстрогены (при снижении их содержания) – 5 мг эстрадиола внутримышечно однократно на 12, 1 или 14 дни цикла, на протяжении трех-четырех циклов.
Имеются и другие, менее распространенные схемы лечения. Наиболее подходящую назначает врач.
Ановуляторное бесплодие успешно лечится. У 80% женщин с таким диагнозом при поликистозе яичников наблюдается полное излечение без хирургического вмешательства. Если хирургическое вмешательство все же необходимо, то излечение после него наступает в 70% случаев. Менструальный цикл восстанавливается, овуляция становится нормальной, с достаточным количеством яйцеклеток.
Достаточно часто при таком типе бесплодия экстракорпоральное оплодотворение проводить нет необходимости. Так как физических препятствий для наступления зачатия нет, оно вполне возможно естественным способом. Исключение составляет один случай – когда ановуляция развилась в результате истощения яичников. В этом случае яйцеклетки не будут вырабатываться в любом случае, какое бы лечение не проводилось. Даже стимулирование супер-овуляции тут бессильно.
В этом случае может проводиться экстракорпоральное оплодотворение. Перед ним, с помощью гормональных препаратов, готовят эндометрий к прикреплению эмбриона. Если все же возможно получить собственные единичные яйцеклетки, то используют их. Если невозможно – то донорские. Они оплодотворяются в лабораторных условиях, а затем помещаются в полость матки.
источник
Из книги «Тысячиии. вопросов и ответов по гинекологии» (2008)
Что такое индукция овуляции?
Индукция овуляции – это искусственная стимуляция процесса созревания яйцеклетки с помощью медицинских препаратов.
Какие существуют показания к проведению индукции овуляции?
Индукцию овуляции проводят по строгим показаниям, поскольку лекарственные средства, применяемые для этого, имеют много серьезных побочных эффектов, у женщин определенных категорий:
• Для лечения аменореи в некоторых случаях
• Для стимуляции овуляции у женщин с ановуляторными циклами
• Для урегулирования цикла у женщин с нерегулярными менструальными циклами
(олигоменорея)
• Для получения нескольких яйцеклеток в яичниках женщин, готовящихся к ЭКО (экстракорпоральное оплодотворение) или внутриматочной инсеминации (суперовуляция).
Здоровым женщинам с регулярными менструальными циклами проводить индукцию овуляции не рекомендуется.
Какими методами можно определить наличие овуляции?
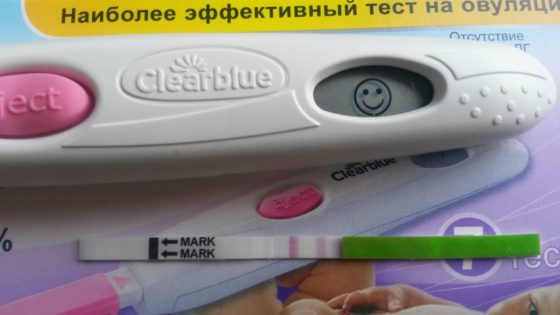
Существует несколько методов определения овуляции. Тесты на овуляцию становятся все популярнее благодаря простоте проведения. Они основаны на определении уровня ЛГ в моче женщины с помощью специальных полосок. Рост и пик уровня ЛГ наблюдается за 32‑36 часов до овуляции. Обычно этим тестом пользуются за 2‑3 дня до предполагаемой овуляции (у женщин с 28-дневным циклом – с 12 по 15 дни). У женщин с нерегулярными циклами тестом нужно пользоваться с 11 по 20 день цикла. Овуляцию у таких женщин можно подтвердить в течение 5 дней у 85 % случаев, и в течение 10 дней в течение 95 % случаев. Иногда овуляция может отсутствовать, что случается в норме, однако, если овуляция отсутствует в течение 2‑3 циклов, нужно обратиться к врачу.
Другой метод определения овуляции – это УЗИ. Овуляция обычно возникает при размерах фолликула в 1.8‑2.5 см. Этот метод более достоверен, если проводить несколько УЗИ в середине цикла через день. Этим же методом пользуются многие врачи для контроля овуляции в клиниках по бесплодию. Менее распространенный метод – это биопсия эндометрия с гистологическим исследованием, которая проводится за день до предполагаемых месячных. Этот метод позволяет также определить подготовленность эндометрия к возможной имплантации плодного яйца. Некоторые врачи предлагают измерять уровень ЛГ и эстрадиола в крови в течение нескольких дней цикла. Все реже женщины пользуются измерением базальной температуры тела, поскольку это не самый достоверный метод определения овуляции.
Можно ли применять индукцию овуляции у женщин, у которых удалены пограничные опухоли яичников?
Согласно данным новых исследований, считается безопасным проведение индукции овуляции у женщин после удаления пограничных опухолей яичника.
Какие существуют методы индукции овуляции?
Индукцию овуляции проводят одним или комбинацией нескольких медикаментозных препаратов, к которым относятся цитрат кломифена, ФСГ, ХГЧ, МГЧ (менопаузальный гонадотропин человека), бромкриптин, каберголин, гонадотропин-рилизинг гормон и его аналоги, ЛГ и ряд других.
Какие показания для индукции цитратом кломифена?
Показаний для индукции овуляции не так много, хотя в последнее время этим методом злоупотребляют многие врачи. Индукция показана женщинам с редкими менструациями или отсутствием менструации, тем, у которых причину бесплодия выяснить не удается, со средним эндометриозом, или по требованиям самих женщин. Стандартная доза – 50 мг, в течение 5 дней в начале цикла. Уровень возникновения овуляции, беременности и исход беременности одинаков, если индукция начата со 2, 3, 4 или 5 дня цикла. Врач должен следить за эффективностью индукции. Это можно проводить с помощью УЗИ, измерением базальной температуры тела, определением уровня эстрогена в крови.
Когда происходит овуляция после применения кломифена цитрата?
Овуляция возникает чаще всего через 5 дней после введения последней дозы цитрата кломифена, однако, у многих женщин овуляция может произойти от 10 до 23 дня цикла, поэтому в таких случаях важно следить за развитием фолликулов с помощью УЗИ.
Какие побочные эффекты использования цитрата кломифена, которыемогут препятствовать беременности?
Поскольку кломид является антиэстрогенным препаратом, он может вызвать неполноценность шеечной слизи, которая очень важна в процессе оплодотворения, и создать барьер для спермы. Даже при успешной овуляции такие женщины могут иметь затруднения с зачатием из-за искусственно созданного врачами шеечного фактора бесплодия. Поэтому для контроля качества слизи шейки матки специалисты рекомендуют проводить посткоитальный тест в первой половине цикла после каждой индукции цитратом кломифена. Другой негативный результат использования кломифена состоит в понижении качества эндометрия: он становится тонким и некачественным для успешной имплантации плодного яйца. Некоторые побочные эффекты связаны с возникновением горячих приливов (10 % случаев), нарушением зрения, сухости влагалища, синдромом гиперстимулированных яичников. В 10 % случаях возникает двуплодная беременность (двойняшки). У некоторых женщин может наблюдаться рост кист яичника, поэтому перед проведением курса индукции овуляции необходимо провести УЗИ яичников. Недостаточность лютеиновой фазы тоже не редкий побочный эффект при использовании кломида (наблюдается в 50 % случаев).
Когда индукция овуляции цитратом кломифена противопоказана?
Индукция овуляции этим препаратом противопоказана при наличии кисты яичника, беременности, заболеваний печени.
Как долго можно проводить индукцию овуляции цитратом кломифена?
Индукцию данным препаратом можно проводить в течение 4‑6 месяцев. У 40‑45% всех женщин и у 80 % правильно подобранных женщин беременность возникнет в течение 6 месяцев. После шести месяцев проводить индукцию овуляции нецелесообразно.
Какие препараты гонадотропинов используются для индукцииовуляции?
Гонадотропины – это гормоны, которые вырабатываются гипофизом, или же вещества, которые имеют похожее действие с гормонами гипофиза. Современная медицина использует следующие гонадотропины для индукции овуляции:
• менопаузальный гонадотропин человека (МХЧ)
• хорионический гонадотропин человека (ХГЧ)
• фолликулостимулирующий гормон (ФСГ)
• лютеотропный гормон (ЛГ, лютеинизурующий гормон).
Что собой представляет менопаузальный гонадотропин человека(МГЧ)?
Менопаузальный гонадотропин человека представляет собой комбинацию ФСГ и ЛГ, в основном, созданных с помощью генной инженерии из клеток яичника млекопитающих (например, хомячков). Такие комбинации имеют от 60 до 120 единиц гормонов (зависит от производителя). Впервые ФСГ и ЛГ были выделены из мочи женщин в менопаузе в 1954 году, и эту комбинацию гормонов называли питуитарные гонадотропины человека. У женщин в менопаузе количество ФСГ и ЛГ в моче повышено. Первая индукция овуляции была проведена в 1958 году, а первая беременность после индукции овуляции возникла в 1960 году.
Гонадотропины чаще всего показаны в тех случаях, когда индукция овуляции цитратом кломифена безуспешна, а также у женщин с гипоталамо-гипофизарным фактором бесплодия, когда не производится достаточное количество ФСГ и ЛГ.
Как проводится индукция овуляции МХЧ?
Препараты МХЧ чаще всего вводятся в виде инъекций, обычно со 2 или 3 дня цикла женщинам, готовящимся к ЭКО. У другой категории женщин (без ЭКО) индукция овуляции проводится с 7 по 12 день цикла со строгим УЗИ контролем роста фолликулов в яичнике. Определение уровня эстрогена в крови позволяет корректировать дозу препаратов.
Что собой представляет хорионический гонадотропин человека?
Хорионический гонадотропин человека вырабатывается плацентой, и его получают из мочи беременных женщин. Химическая структура, а поэтому и действие, почти одинаковое с ЛГ гипофиза. Поскольку резкий рост ЛГ перед овуляцией способствует созреванию яйцеклетки, введение ХГЧ перед предполагаемой овуляцией приводит к разрыву фолликула и выходу яйцеклетки.
Для получения положительного эффекта при таком виде индукции овуляции очень важно выбрать правильный день цикла для введения препарата, что многие врачи определяют с помощью УЗИ и измерением уровня эстрогенов крови. Овуляция наступает в течение 36‑48 часов после введения ХГЧ. Этот препарат часто используется для усиления воздействия цитрата кломифена, когда проследить за пиком ЛГ не удается. Поскольку ХГЧ выделяется с мочой, тест на беременность может быть ложноположительным в течение 10 дней после введения ХГЧ.
Какие существуют побочные эффекты применения гонадотропинов?
До 33 % всех беременностей, возникающих после индукции овуляции гонадотропинами, являются многоплодными (70 % – двойни, 30 % – тройни). Поэтому уровень преждевременных родов, а значит и уровень смертности новорожденных, повышен. Опасным побочным эффектом является синдром гиперстимуляции яичников (при использовании ХГЧ этот синдром встречается реже, чем при использовании других препаратов для индукции овуляции). Другими побочными эффектами являются нагрубание и болезненность молочных желез, вздутие живота, боли внизу живота, изменение настроения. В отличие от ЭКО, уровень пороков развития плодов после индукции овуляции не превышает уровень без индукции овуляции. Внематочные беременности возникают после индукции овуляции чаще (5‑8 % случаев по сравнению с 1‑2 % случаев в общей популяции женщин). Выкидыши наблюдаются в 15‑21 % женщин. Беременные женщины после индукции овуляции чаще страдают гипертонией беременных, а также частота отслойки плаценты у таких женщин увеличена.
Как проявляется синдром гиперстимуляции яичников?
Синдром гиперстимуляции яичников (СГСЯ) характеризуется увеличением яичников с развитием многочисленных кист (состояние поликистозных яичников), накоплением жидкости в тканях, брюшной полости и легких. В 2 % случаев такое состояние требует немедленной госпитализации. Возникновение синдрома гиперстимуляции яичников связано с резким подъемом уровня эстрогенов (эстрадиола) под влиянием гонадотропинов, что может привести к быстрому развитию кист яичников. Данное заболевание встречается в 10‑20 % случаев после индукции овуляции, в основном легкой и средней тяжести. При легкой степени СГСЯ яичники увеличены до 5 см в диаметре, наблюдается также незначительный асцит и прибавка в весе до 5 кг. При средней тяжести синдрома яичники увеличены от 5 до 12 см, имеется умеренный асцит, тошнота, рвота, дискомфорт внизу живота, и увеличение веса тела больше 5 кг. Тяжелые случаи гиперстимуляции яичников характеризуются увеличением яичников, выраженным асцитом, тошнотой, рвотой, поносом, одышкой, накоплением жидкости в легких, водянкой, сгущением крови, и могут привести к почечной недостаточности.
Тяжелые формы СГСЯ возникают у молодых женщин с нерегулярными редкими менструации, у которых после первой индукции возникло состояние поликистозных яичников (более 15 фолликулов). Синдром гиперстимулированных яичников имеет две фазы. Первая фаза проявляется со второго по седьмой день после овуляции, и количество признаков заболевания ограничено. Вторая фаза возникает после того, как женщина забеременела.
Как лечат синдром гиперстимулированных яичников?
Женщины с легким и средним СГСЯ могут находиться дома, желательно в постели, строго контролируя количество выпитой и выделенной жидкости. Если после индукции овуляции женщина резко поправилась на 1‑1.5 кг, такую женщину желательно госпитализировать. Тяжелые случаи необходимо лечить в больничных условиях с учетом состояния женщины.
В чем заключается профилактика возникновения СГСЯ?
При проведении индукции овуляции очень важно следить за реакцией яичников на введение лекарственных препаратов, что можно делать с помощью УЗИ. Если наблюдается развитие 1‑3 фолликулов размерами до 18‑20 мм, такую индукцию можно считать безопасной. Однако при появлении 5 фолликулов и больше, а также при резком увеличении эстрадиола крови, желательно прекратить индукцию овуляции.
Что собой представляют гонадотропин-рилизинг гормон?
Гонадотропин-рилизинг гормон вырабатывается гипоталамусом в незначительных количествах приблизительно каждые 60‑90 минут. Этот гормон приводит к стимуляции гипофиза и выработки им таких важных гормонов, как ЛГ и ФСГ. Для лечения некоторых видов аменорей и ановуляций используют медикаментозные препараты гонадотропин-рилизинг гормона в виде небольших объемов препарата, вводимых в пульсирующем режиме каждые 60‑90 минут под кожу живота с помощью специального приспособления. При правильном введении препарата риск возникновения синдрома гиперстимулированных яичников незначительный.
Какие существуют аналоги гонадотропин-рилизинг гормона и какова их роль в индукции овуляции?
Все аналоги гонадотропин-рилизинг гормона являются синтетическими гормонами, действие которых похоже на действие натурального ГнРГ, однако это действие можно модифицировать химически. Поэтому существуют две группы таких препаратов: агонисты и антагонисты. Агонисты стимулируют работу гипофиза и выработку им гонадотропинов. Однако если женщина принимает агонисты ГнРГ в постоянном режиме, в отличие от пульсирующей выработки этого гормона в организме, после всплеска уровня ФСГ и ЛГ, выработка гонадотропинов гипофизом значительно понижается. Это, в свою очередь, приведет к понижению уровня эстрогенов и подавлению овуляции. Антагонисты, наоборот, понижают выработку гормонов гипофизом, то есть понижают уровень ФСГ и ЛГ в крови женщины. Таблетированные препараты аналогов гонадотропина являются неэффективными для индукции овуляции. Однако многие специалисты по бесплодию применяют данные препараты для задержки овуляции и создания более зрелых яйцеклеток у готовящихся к ЭКО женщин. Эти препараты имеют много побочных эффектов, напоминающих состояние менопаузы (горячие приливы, нарушения настроения, сухость влагалища). Женщины могут страдать от головной боли, бессонницы, уменьшения размеров молочных желез, остеопороза.
С чем связаны неудачные попытки индукции овуляции?
Если после шести циклов индукции овуляции цитратом кломифена беременность не возникла, таких женщин называют кломифен-устойчивыми. В таких случаях необходимо исключить наличие скрытых эндокринных заболеваний (гиперпролактинемия, гиперплазия надпочечников, опухоли надпочечников, синдром Кушинга, заболевания щитовидной железы) и выраженного ожирения. У женщин с СПКЯ и гиперинсулинемией лечение противодиабетическими препаратами может подготовить условия для успешной индукции овуляции.
Другая серьезная проблема, связанная с индукцией овуляции, это возникновение синдрома недостаточности лютеиновой фазы (НЛФ), недостаточности прогестерона, и преждевременным назначением ХГЧ или прогестерона, что может подавить овуляцию. Для профилактики синдрома НЛФ назначают препараты ХГЧ при достижении фолликулов 23‑24 мм в диаметре. Прогестероновую недостаточность можно контролировать назначением прогестерона через 48 часов после овуляции, которая должна быть подтверждена с помощью УЗИ.
источник
Отсутствие овуляции делает женщину бесплодной, поскольку именно от этого процесса зависит оплодотворение и зарождение нового организма. Ановуляторное бесплодие не является редкостью и у всех женщин хотя бы раз в жизни был менструальный цикл по той или иной причины не сопровождающийся овуляцией. Проблемой же является такое состояние, когда ановуляторные циклы становятся постоянными, что связано с нарушением в эндокринной системе человека. Важно вовремя понять, что послужило причиной отсутствия овуляции.
Говоря языком гинекологов, ановуляторное бесплодие является состоянием гормональной природы, при этом количество яйцеклеток остается нормальным, но процесса их созревания и/или выхода из яичника не возникает.
Нарушение выработки гормонов гипоталамуса, гипофиза, щитовидной железы, яичников приводят к тому, что овуляция не наступает (ановуляция), в результате чего не выполняются обязательные для зачатия условия. Сказать, что это бесплодие постоянное, нельзя, ведь нормализация количества гормонов приводит к восстановлению овуляции, следовательно, и фертильности.
Ановуляторное бесплодие может вызываться многими факторами. Важно понимать, что регуляция менструального цикла связана с несколькими уровнями гормонообразующих органов. Самое высокое место в этой иерархии занимают такие структуры, как:
- кора головного мозга;
- гиппокамп;
- лимбическая система.
Многие знают, что от сильного стресса могут прекратиться месячные, то есть развивается ановуляторное бесплодия.
Следующим звеном регуляции менструального цикла в целом и овуляции в частности является гипоталамус. На него воздействуют по типу обратной связи половые гормоны, нейротрансмиттеры, нейропептиды и другие вещества, в результате чего гипоталамус выделяет гонадотропин рилизинг-гормоны, которые относятся не только к половым железам, но и к другим органам. Мощнейшее действие на рилизинг-факторы гипоталамуса оказывают эстрадиол, эндогенные опиоидные пептиды – эндорфины, энкефалины, динорфины.
Третий уровень регуляции – гипофиз. Под воздействием гонадотропин рилизинг-гормонов продуцируются:
- ЛГ и ФСГ – лютеинизирующий и фолликулостимулирующий факторы;
- адренокортикотропный;
- пролактин;
- соматотропный;
- тиреотропный гормоны.
Без должного выделения веществ невозможно нормальное функционирование яичников и возникновения овуляции. Поэтому нарушение в количестве этих гормонов может стать причиной ановуляторного бесплодия.
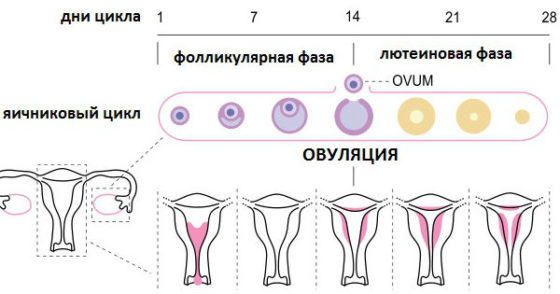
Менструальный цикл имеет 2 фазы: фолликулиновая и лютеиновая, между которыми возникает овуляция. Первая фаза зависит в большей степени от фолликулостимулирующего гормона, вторая от лютеинизирующего гормона. Овуляцию как процесс стимулирует резкий подъем ЛГ.
Четвертый уровень регуляции – яичники, надпочечники, щитовидка. Ключевая роль принадлежит яичникам:
- в них созревают фолликулы;
- происходит овуляция;
- формирование желтого тела;
- продукция стероидных половых гормонов.
Большое влияние оказывают надпочечники на репродуктивную систему женщины. Ановуляторные менструальные циклы характерны для адреногенитального синдрома (АГС) различной выраженности.
Синдром поликистозных яичников является хроническим заболеванием, которое характеризуется ановуляцией и гиперандрогенией. Повышенный синтез ЛГ сопровождается снижением прогестерона, чем обусловлена ановуляторное бесплодие.
Развития ановуляторного бесплодия чаще всего вызвано следующими причинами:
- гормональные препараты, способствующие отсутствию овуляции (контрацептивы);
- гормонопродуцирующие опухоли молочной железы и надпочечников;
- нарушение работы гипоталамуса, гипофиза;
- дисфункция щитовидной железы (гипо- или гиперфункция);
- резкое снижение или набор веса;
- синдром поликистозных яичников;
- синдром истощения яичников;
- адреногенитальный синдром;
- заболевания печени (гепатит, цирроз);
- врожденные патологии, недоразвитие яичников, отсутствие рецепторов или их недостаток;
- отсутствие в рационе белковой, жирной пищи, витаминов, микроэлементов;
- физическое перенапряжение;
- хроническое недосыпание;
- регулярные стрессы.
Если без предохранения беременность у пары не наступает в течение года и половые сношения регулярны, то можно говорить о бесплодии.
Заподозрить ановуляторное бесплодие можно по таким симптомам:
- отсутствие ранее характерных для овуляции болевых ощущений внизу живота в середине цикла, недомогания;
- развитие кровотечений вне зависимости от менструального цикла;
- изменение характера менструальных выделений, продолжительности;
- потеря массы тела.
Но есть косвенные симптомы, которые помогут заподозрить нарушение гормональной регуляции:
- оволосение по мужскому типу;
- различные степени ожирения, жировая ткань в основном сконцентрирована в верхней половине туловища;
- недоразвитие наружных половых органов;
- наличие мужского тембра голоса;
- позднее начало менструации (15-16 лет);
- стрии на груди, животе, бедрах.
- Измерение базальной температуры. Утром до подъема с постели нужно произвести термометрию в прямой кишке, и эта манипуляция проводится весь менструальный цикл. Если отмечать на температурной кривой все значения, то на ней будет виден пик после овуляции на 0,4-0,8 град. За один день до месячных температура снизиться на 1 град. Нет подъема во второй фазе цикла – ановуляция.
- Чтобы узнать, произошел выход яйцеклетки из яичника или нет, можно воспользоваться простым тестом на овуляцию. Этот способ определит всплеск лютеинизирующего гормона, что указывает на свершившуюся овуляцию. Этим способом можно выявить подъем гормона в моче и слюне, но второй вариант будет значительно дороже. Но можно говорить о большей достоверности определения ановуляции.
- При осмотре шейки матки в зеркалах выявляется симптом «зрачка» накануне овуляции. Основан этот феномен на расширении наружного отверстия шейки и накоплении в нем прозрачной слизи.
- Феномен «папоротника» – кристаллизация шеечной слизи при высыхании на предметном стекле. Максимально выражено это явление во время овуляции.
- Растяжение шеечной слизи. Максимально растягивается шеечная слизь во время выхода яйцеклетки.
- Отсутствие овуляции можно обнаружить при помощи УЗИ. Специалист не выявит фолликулярной кисты на месте развития яйцеклетки.
- Мазок со стенки влагалища показывает клеточный состав отделяемого, который значительно меняется в зависимости от фазы менструального цикла, что регулируются гормонами.
- А что если овуляция произошла, но яйцеклетка не смогла добраться до пункта назначения? Это происходит, когда нарушена проходимость маточных труб. Выявить это нарушение можно с помощью рентгенкотрастирования, диагностической лапароскопии, хромогидротубации.
Итак, стало понятно, что овуляции все же нет, теперь важно выяснить, по какой причине она не происходит. В этом случае нужно сдавать анализы на количество гормонов в крови. Важны следующие показатели:
- ФСГ;
- ЛГ;
- прогестерон;
- пролактин;
- адренокортикотропный гормон;
- андрогены;
- инсулин и глюкоза при СПКЯ;
- эстрогены;
- кортизол;
- гормоны щитовидной железы.
Лечение ановуляторного бесплодия подразумевает воздействие на первопричину болезни: если это связано с препятствием на пути зрелой яйцеклетки, то оно устраняют посредством хирургических манипуляций. Если бесплодие связано с изменением гормонального фона, то в первую очередь назначают заместительную терапию или подавляют секрецию.
Назначение ингибитора эндогенных опиоидных пептидов – налоксона – приводит к повышению производства рилизинг-гормонов, таким образом давая возможность произойти нормальной овуляции.
При синдроме поликистозных яичников гонадотропин назначают в виде препаратов Хумегон и Пергонал. Средство Кломифен способствует нормализации гипоталамо-гипофизарной связи, что возвращает овуляцию в 30-40% случаев бесплодия при СПКЯ.
Самолечение в случае ановуляторного бесплодия может причинить только вред! Постоянно наблюдаться у врача и не принимать решения по поводу отмены или коррекции дозы препаратов самостоятельно!
Следует помнить, что замещение гормонами часто требует не одного, а многих циклов лечения. Нередко заместительная терапия продолжается всю жизнь.
Одним из способов забеременеть при отсутствии овуляции является искусственное оплодотворение. Для этого метода есть свои показания и противопоказания. Важно их определить и наметить четкий план действия, разработать подготовку к этому ответственному процессу и выбрать подходящий протокол ЭКО.
Ановуляторное бесплодие не является приговором и вполне лечится, если раньше обратить внимание на симптомы и начать разбираться с причинами патологии. При должном лечении, замещении утраченных гормональных функций можно забеременеть, выносить здорового ребенка и радоваться материнству.
источник
Дата публикации: 20.04.2017 2017-04-20
Статья просмотрена: 933 раза
Адамова А. С., Ладыгина К. А. Современные подходы к индукции овуляции // Молодой ученый. 2017. №14.2. С. 1-4. URL https://moluch.ru/archive/148/41880/ (дата обращения: 17.07.2019).
Показаны возможные варианты и схемы проведения индукции овуляции с помощью лекарственных препаратов различных фармакологических групп, представлена оценка эффективности их применения в отдельных случаях.
Ключевые слова: ановуляторное бесплодие, восстановление фертильности, репродуктивное здоровье, индукция овуляции, СПКЯ.
Одной из основных биологических функций женского организма является репродуктивная [9,1]. Регулярный менструальный цикл — признак репродуктивного благополучия [10,12,11]. В результате циклических гормональных и анатомических изменений у женщин происходит овуляция. Этот процесс охватывает практически все системы органов. Регулируется овуляция благодаря взаимодействию нейро-эндокринных сигналов и половых желез, производящих яйцеклетки. Таким образом клетки гипоталамуса производят либерины, передней долей гипофиза секретируются фолликулостимулирующий (ФСГ) и лютеинизирующий (ЛГ) гормоны, а вместе они способствуют нормальному развитию яичников и созреванию в них овоцитов.
После того, как яйцеклетка становится достаточно зрелой, она покидает фолликул (специальное образование яичника, где развивался овоцит). Далее на месте её выхода образуется желтое тело — это бывший фолликул, который теперь будет синтезировать гормон прогестерон, пока яйцеклетка странствует в воронке и в самой маточной трубе, в которой при благоприятных обстоятельствах может быть оплодотворена попавшим сюда сперматозоидом. И если все проходит удачно, то спустя примерно 9 месяцев появляется на свет ребенок. [13]
Существует такое явление, как ановуляторный цикл — это менструальный цикл (период от одной менструации до следующей), при котором не произошло созревания яйцеклетки и ее выхода из яичника (т. е. овуляции). При этом в яичнике не образуется желтое тело, а менструальный цикл состоит только из одной фазы (фоликулярной) вместо двух — лютеиновая отсутствует.
Важно отметить, что ановуляторные циклы бывают и у здоровых женщин репродуктивного возраста. Как физиологическое явление они случаются в периоды грудного вскармливания, становления менструальной функции (первые 1–1,5 года после первой менструации), а также при угасании репродуктивной функции в пременопаузальный период. [4]
Существует несколько методов определения овуляции.
1. Определение уровня ЛГ в моче женщины с помощью специальных тест- полосок. За 32‑36 часов до овуляции происходит повышение концентрации ЛГ. Это проявляется в виде ярко-розовой метки на тесте. Когда овуляция произошла, то уровень ЛГ возвращается к нормальным показателям.
2. Следующий способ определить овуляцию — это УЗИ. Этот метод более достоверен, если проводить несколько УЗИ в середине цикла через день. Овуляция обычно возникает при размерах доминантного фолликула в 1, 8‑2,5 см. Непосредственно после овуляции на его месте УЗИ позволяет увидеть формирование желтого тела и образование жидкости в пространстве за маткой. Этим методом можно также определить подготовленность эндометрия к имплантации плодного яйца. [6]
4. При сохранном менструальном цикле возможно измерение прогестерона в сыворотке крови на 20–24 дни цикла и при снижении уровня прогестерона ниже 3–4 нг/мл цикл считается ановуляторным. [5]
5.Наиболее доступным, но не самым достоверным является метод измерения базальной температуры. У женщин без патологий во второй половине цикла базальная температура возрастает, как правило, на 0,5°. Но непосредственно перед этим повышением наблюдается небольшое ее снижение — на 0,4–0,6°, что является сигналом выхода созревшей яйцеклетки. Относительное увеличение температуры во второй фазе цикла сохраняется вплоть до наступления менструации. [2]
Таким образом, согласно последним клиническим рекомендациям, у женщин с регулярным циклом наличие эндокринного бесплодия устанавливают при выявлении ановуляции или недостаточности лютеиновой фазы (НЛФ). В настоящее время для подтверждения овуляции целесообразно использовать проводимый в домашних условиях самой пациенткой тест на овуляцию, позволяющий подтвердить преовуляторный выброс ЛГ, определяемого в моче. Применение теста позволяет отказаться от широко использовавшейся в прошлом оценки состояния функции яичников по графику базальной температуры и определению цервикального числа по Insler. Функцию жёлтого тела оценивают на 5–7й день после овуляции путём определения уровня прогестерона по данным теста.
Гормональные исследования назначают пациенткам с нарушениями менструальной функции (олиго, аменорея) и женщинам с регулярным ритмом менструаций, но имеющим признаки ановуляции или НЛФ. При этом определяют следующие гормоны: пролактин; гонадотропины: ФСГ, ЛГ; эстрадиол; андрогены: тестостерон, ДГЭАС; ТТГ, Т3, Т4. У женщин с регулярным ритмом менструаций указанные гормоны исследуют на 2–4й день цикла, при олигоменорее — на 2–4й день собственного или индуцированного гестагенами цикла, при аменорее — на любой день. [3]
О наличии хронической овуляторной дисфункции свидетельствует отсутствие овуляции в 2-х циклах из 3-х [5]. Если у женщины ановуляторные циклы носят систематический характер, то они в итоге приводят к бесплодию и рассматриваются как патологическое состояние, требующее соответствующего лечения.
Эндокринное бесплодие в основном зависит от следующих патологических состояний:
— гипоталамогипофизарная недостаточность (гипогонадотропный гипогонадизм при поражениях гипоталамуса, гипофиза или при гиперпролактинемии);
— гипоталамогипофизарная дисфункция (нормогонадотропная аменорея, олигоменорея или НЛФ, сопровождаемые или нет СПКЯ);
— яичниковая недостаточность, необусловленная первичным нарушением гипоталамогипофизарной регуляции (дисгенезия гонад, синдромы резистентных и истощённых яичников, ятрогенные повреждения яичников, первичная яичниковая гиперандрогения, сопровождающаяся или нет СПКЯ);
— ВГКН, сопровождающаяся или нет СПКЯ;
— гипотиреоз (сопровождающийся или нет гиперпролактинемией). [3]
С целью восстановления репродуктивной функции у женщин, помимо нормализации эндокринных нарушений, применяются различные методы индукции овуляции. Индукция овуляции — это сложная система воздействия (в первую очередь, лекарственных препаратов) на рецепторы половых желез для создания в женском организме условий, благоприятствующих выходу яйцеклетки из фолликула. Индукцию овуляции проводят одним или комбинацией нескольких медикаментозных препаратов, к которым относятся цитрат кломифена, ФСГ, ХГЧ (хорионический гонадотропин человека), МГЧ (менопаузальный гонадотропин человека), бромкриптин, каберголин, гонадотропин-рилизинг гормон и его аналоги, ЛГ и ряд других. Также используют хирургический метод — лапароскопический дриллинг. [2]
Существуют различные схемы индукции овуляции, реализуемые в соответствии с возрастом, основным заболеванием пациентки и другими факторами.
В связи с особенностями функционирования системы гипоталамус- гипофиз-яичники у пациенток с СПКЯ индукция овуляции у таких пациенток является основной проблемой и задачей для гинекологов и эндокринологов. Как правило, индукцию овуляции у таких пациенток начинают с применения кломифена цитрата. Механизм действия цитрата кломифена основан на его способности блокировать действие эстрогенов на гипоталамус и гипофиз. Как следствие действия кломифена цитрата и из-за отрицательной обратной связи гипоталамус повышает выработку гонадотропин-рилизинг гормона и, таким образом, способствует увеличению выработки гонадотропинов в передней доле гипофиза. В результате воздействия гонадотропинов на яичники восстанавливается нормальная функция яичников и происходит овуляция. [7] Синдром гиперстимуляции яичников (СГЯ) при применении КЦ развивается редко, частота многоплодной беременности не превышает 10 %. Но согласно последним исследованиям на данный момент примерно 30 % женщин с СПКЯ являются кломифенрезистентными. Были представлены критерии, прогнозирующие кломифенрезистентность у пациенток с СПКЯ и бесплодием:
— увеличение яичников (> 40Ѕ30 мм), по данным УЗИ;
— уровень Е2 ановуляторное бесплодие, восстановление фертильности, репродуктивное здоровье, индукция овуляции, СПКЯ
менструальный цикл, аденома гипофиза, турецкое седло, нарушение, контрастное вещество, желтое тело, доброкачественная опухоль, репродуктивная система женщины, репродуктивная функция, тройничный нерв.
витамин, женщина, лечение бесплодия, концентрация витамина, AMH, менструальный цикл, значительный дефицит, высокий шанс зачатия, высокая доза витамина, репродуктивная функция.
Эффективность применения этих методов, как правило, оценивается по частоте наступления беременности из расчета на число пациенток, вступивших в лечебный менструальный цикл, пункций фолликулов и переносов эмбрионов.
Для восстановления цикличности менструальной функции бывает достаточным снижения массы тела на 10–15 %. Диета назначается на основе диагностических данных и данных лабораторных исследований. Большинство пациенток хорошо переносят диету.
щитовидная железа, женщина, менструальный цикл, репродуктивная система, репродуктивный возраст, первичный гипотиреоз, пациентка, менструальная функция, данные, гипотиреоз.
Частота встречаемости нарушений менструальной функции при АИТ и возникшем гипотиреозе в 3–4 раза выше, чем в общей популяции женщин репродуктивного возраста.
Пятый этап — период ожидания наступления беременности: контролируемая индукция овуляции в течение не более 4 циклов. ЛС и схемы их введения определяются с учетом клинико-лабораторных характеристик пациенток.
У ряда пациенток на первый взгляд с нормальным менструальным циклом отмечается нарушение овуляции, пролонгированние фолликулярной фазы, недостаточность лютеиновой фазы.
Пациентки с ожирением хуже реагируют на индукцию овуляции и требуют более высоких доз гонадотропинов. У таких женщин низкие показатели оплодотворения, низкая частота беременности с повышенным риском раннего прерывания беременности.
источник
Бесплодие определяется как состояние пары, при котором по тем или иным причинам со стороны организма женщины или мужчины либо обоих партнеров детородного возраста беременность не наступает при регулярной половой жизни без применения каких-либо противозачаточных средств в течение 12 мес. Следует четко понимать, что бесплодие – это болезнь, и ее нужно лечить, а не ждать.Если причины ясны, лечение необходимо начинать как можно раньше. Срок ожидания у женщин старше 35 лет сокращается до 6 мес.
Для лечения ановуляторного бесплодия широко используется так называемая контролируемая овариальная стимуляция (КОС), или индукция овуляции. Различают медикаментозную и хирургическую КОС.
Для медикаментозной КОС используется несколько групп препаратов: антиэстрогены, метформин, гонадотропины и аналоги гонадотропин-рилизинг-гормона (ГнРГ) в виде агонистов и антагонистов.
1. Селективные модуляторы эстрогеновых рецепторов. Модуляторы эстрогеновых рецепторов оказывают частичное действие как агонисты и антагонисты в зависимости от содержания тканевых рецепторов эстрогенов и уровня доступности эстрогенов. Селективные модуляторы эстрогеновых рецепторов (СМЭР) действуют путем ингибирования отрицательного эффекта обратной связи циркулирующего эстрогена в гипофизарной области гипоталамуса [1]. СМЭР действуют на ткани и органы, содержащие эстрогеновые рецепторы, такие как гипоталамус, гипофиз, яичники, эндометрий, влагалище и шейка матки, конкурируя с эстрогенами и снижая содержание внутриклеточных рецепторов эстрогена. Тремя широко распространенными СМЭР, применяемыми у женщин, являются кломифена цитрат (КЦ), тамоксифен и ралоксифен.
КЦ при пероральном введении хорошо всасывается из желудочно-кишечного тракта. Обычно используемая суточная доза КЦ составляет 50-150 мг. Для пациенток с гиперответом на терапию, особенно с синдромом поликистозных яичников (СПКЯ), может потребоваться доза менее 50 мг. Дозы более 150 мг используются редко и характеризуются способностью усиливать антагонистическое воздействие КЦ на эндометрий и шейку матки, однако данный подход следует рассматривать как нецелесообразный. КЦ метаболизируется путем трансформации в печени и выводится с фекалиями, что увеличивает его биодоступность. Высокая способность связываться с белками плазмы крови, выводящий энтерогепатический цикл и накопление в жировых тканях увеличивает период полувыведения КЦ до 5 дней. Тамоксифен имеет еще более длительный период полувыведения, чем КЦ, – 7 дней. КЦ является слабым агонистом и умеренным антагонистом эстрогенов.
КЦ содержит две изомерные формы, каждая из которых имеет разную клиническую эффективность. Зукломифен – менее эффективная форма с длительным периодом полувыведения, которая сохраняется в организме даже в начале первого триместра беременности, достигнутой при использовании КЦ для индукции овуляции. Энкломифен является более мощной формой с коротким периодом полувыведения, которая в основном и оказывает клинический эффект после перорального введения КЦ.
В двух обсервационных исследованиях выявлено, что показатели овуляции и беременности у пациенток с СПКЯ, которые получали лечение тамоксифеном после неэффективности лечения КЦ, улучшались [2, 3]. Согласно данным обзора Кокрановской базы данных, проведенного Brown и соавт. [4], частота наступления беременности, овуляции, возникновения самопроизвольных абортов, коэффициент живорожденности и частота вынашивания беременности при индукци овуляции с помощью КЦ и тамоксифена были сходными.
2. Ингибиторы ароматазы. Анастрозол и летрозол являются нестероидными конкурентными ингибиторами ароматазы. Эти препараты были разработаны для лечения локального и метастатического рака молочной железы у женщин в период постменопаузы. В случае перорального приема период их полувыведения составляет 2 дня. Побочными эффектами ингибиторов ароматазы являются тошнота, головная боль, вагинальное кровотечение и боль в спине. Эффект подавления эстрогенов ингибиторами ароматазы зависит от дозы препарата. Гипоталамо-гипофизарно-яичниковая ось во время индукции овуляции остается неизменной, и это преимущество обеспечивает монофолликулярную овуляцию и снижение частоты многоплодной беременности. Отсутствие неблагоприятного антиэстрогенного воздействия КЦ на эндометрий и шейку матки является еще одним преимуществом ингибиторов ароматазы.
В проспективном рандомизированном исследовании, проведенном Diamond и соавт. [5], выявлено, что стимуляция яичников с использованием летрозола приводила к значительно более низкой частоте многоплодной беременности, сопровождающейся более низкой частотой живорожденности по сравнению с КОС гонадотропинами, но не по сравнению с таковой у пациенток с идиопатическим бесплодием, принимавших КЦ.
В другом проспективном рандомизированном исследовании Legro и соавт. [6] пришли к выводу, что при индукции овуляции с использованием летрозола у бесплодных женщин с СПКЯ были достигнуты более высокие по сравнению с КЦ показатели наступления овуляции и живорожденности.
Roque и соавт. [7] провели систематический обзор рандомизированных контролируемых исследований, сравнивающих результаты циклов КОС с использованием КЦ и летрозола у пациенток с СПКЯ. Статистически значимое увеличение рождаемости и частоты наступления беременности было зафиксировано в группе женщин, принимавших летрозол, по сравнению с таковой КЦ (относительный риск (ОР) 1,55 и 1,38 соответственно). Частота овуляции, самопроизвольных абортов и многоплодной беременности в двух группах были сходными. Авторы пришли к выводу, что в отношении живорожденности и беременности индукция овуляции у пациенток с СПКЯ с использованием летрозола обеспечивает лучшие результаты по сравнению с КЦ [7].
Положительные фармакодинамические эффекты летрозола способствуют более высокой частоте наступления беременности по сравнению с КЦ. Летрозол имеет более короткий период полувыведения (45 ч), чем КЦ. Накопление КЦ в организме приводит к длительному истощению эстрогеновых рецепторов, сопровождающемуся неблагоприятным воздействием на чувствительные к эстрогенам ткани половых органов.
Летрозол увеличивает биосинтез молекулярных маркеров рецептивности эндометрия, таких как интегрины. В 2005 г. выступление в Американском обществе репродуктивной медицины вызвало повышенную озабоченность по поводу врожденных пороков развития и риска тератогенности летрозола. Однако со временем эти утверждения былы подвергнуты критике из-за дизайна исследования и отсутствия публикации в рецензируемом журнале. Наоборот, в некоторых исследованиях [8, 9] выявлена более высокая частота развития сердечных и других врожденных аномалий при беременности, достигнутой с помощью индукции КЦ. В 2006 г. Tulandi и соавт. [10] провели многоцентровое исследование, в котором сравнили неонатальный исход 514 беременностей после индукции овуляции летрозолом и 297 беременностей после индукции овуляции КЦ. Они пришли к выводу, что частота развития врожденных аномалий и хромосомные показатели при применении летрозола и КЦ были сходными (2,4 против 4,8% соответственно). Кроме того, частота развития врожденных сердечных аномалий после приема КЦ была статистически значимо выше, чем летрозола (1,8 против 0,2% соответственно, р=0,02).
Метформин – это антидиабетический препарат для перорального применения группы биагуанидов, который повышает чувствительность рецепторов инсулина в периферических клетках. Целесообразность добавления метформина в протоколы лечения для увеличения частоты наступления беременности у пациенток с СПКЯ дискутируется. В систематическом обзоре, выполненном Palomba и соавт. [11], пришли к выводу, что у бесплодных пациенток с СПКЯ, КОС которым была проведена гонадотропинами для циклов интрацитоплазматической инъекции спермы (ИКСИ), показатели имплантации улучшились, но показатели наступления клинической беременности и рождаемости с использованием метформина не увеличились, несмотря на более низкие частоту развития синдрома гиперстимуляции яичников (СГЯ) и частоты возникновения самопроизвольных абортов [11, 12]. Так, обнаружено, что прием метформина более 3 недель снижает частоту возникновения самопроизвольных абортов (отношение шансов 0,41; 95% доверительный интервал 0,21-0,78, p=0,0086).
Специфические фенотипы и особенности пациенток с СПКЯ, у которых применение метформина целесообразно, должны быть определены до проведения индукции овуляции. Не рекомендуется назначать метформин всем пациентам с СПКЯ.
В обзоре Кокрановской базы данных, проведенном Tso и соавт. [13], были оценены клинические эффекты лечения метформином до и во время экстракорпорального оплодотворения (ЭКО) или ИКСИ у женщин с СПКЯ. Авторы пришли к выводу, что несмотря на значительные положительные эффекты, направленные на профилактику СГЯ, убедительные доказательства относительно улучшения рождаемости путем использования метформина до или во время процедур вспомогательных репродуктивных технологий (ВРТ) не найдены. Tso и соавт. подчеркнули, что использование этого инсулиносенситайзера повышает частоту живорожденности и увеличивает вероятность наступления беременности, не оказывая никакого влияния на частоту самопроизвольных абортов, количество ооцитов, общую дозу гонадотропина, продолжительность стимуляции, фертилизацию и частоту отмены цикла [13].
Фолликулостимулирующий гормон (ФСГ), лютеинизирующий гормон (ЛГ), хорионический гонадотропин человека (ХГЧ) и тиреотропный гормон являются гетеродимерными гликопротеиновыми гормонами, включающими α- и β-субъединицы. α-Субъединицы этих гормонов состоят из одних и тех же 92 аминокислот. β-Субъединица отвечает за биологическую специфичность гормона. Период полувыведения этих гормонов (за исключением ХГЧ) из сыворотки крови относительно короткий. Хотя β-субъединицы ЛГ и ХГЧ имеют сопоставимую биодоступность (80%), время полувыведения ХГЧ из плазмы крови в 10 раз превышает таковое ЛГ. C-концевые пептиды и остатки сиаловой кислоты, содержащие 31 аминокислоту, обусловливают эту разницу в фармакокинетике. Биодоступность рекомбинантного ФСГ (рФСГ) и рекомбинантного ЛГ (рЛГ) после подкожного введения составляет около 70 и 60% соответственно [14-16]. Фармакокинетические взаимодействия между рФСГ и рЛГ при их одновременном введении не наблюдаются. Период полувыведения рФСГ и рЛГ из сыворотки крови составляет около 24 и 10-12 ч соответственно. Уровни стабильного содержания рФСГ в плазме крови достигаются через 3-4 дня после повторных инъекций. У пациенток, у которых эндогенная гипоталамо-гипофизарная ось подавлена, рФСГ может самостоятельно эффективно обеспечивать активацию фолликуло- и стероидогенеза, несмотря на низкий уровень ЛГ в сыворотке. Различия клинического ответа на введение одних и те же доз препаратов ФСГ связаны с полиморфизмом рецепторов ФСГ, то есть с так называемой фармакогенетикой, а не с фармакокинетическим действием препарата [14-17].
Незначительные различия в составе при производстве, которые встречаются от партии к партии, наличие чужеродного белка и непредвиденная клиническая эффективность являются основными недостатками моноклональных гонадотропинов. В проспективном рандомизированном многоцентровом исследовании Frydman и соавт. [18] сравнивали эффективность применения рФСГ и мочевого ФСГ в соответствии с результатами циклов ВРТ. При использовании рФСГ зафиксировано получение большего количества ооцитов при более низких суммарных дозах и за более короткое время стимуляции по сравнению с мочевым ФСГ. Однако увеличение количества ооцитов не отразилось на повышении частоты наступления беременности.
Стимуляция фолликулогенеза при лечении бесплодия традиционно проводилась с использованием гонадотропинов, выделенных из мочи женщин в период постменопаузы. Продукты, полученные из мочи, состоят из комбинации гонадотропинов с непредвиденной клинической эффективностью и биологически активных медиаторов, таких как связывающие, прионные белки и факторы роста. Изменение точного количества гонадотропинов в препаратах человеческого менопаузального гонадотропина (чМГ) приводит к различному воздействию на гонады во время индукции овуляции. Содержание ХГЧ и продукты чМГ увеличиваются параллельно с увеличением чистоты препарата. ХГЧ секретируется эмбрионом и плацентой и физиологически поддерживает имплантацию и беременность. Аффинность связывания рецептора ХГЧ в 2 раза выше, чем ЛГ. ЛГ имеет более короткий период полувыведения из сыворотки крови, чем ХГЧ (23 против 32-33 ч соответственно). ХГЧ в большем количестве накапливается в организме и оказывает более выраженный угнетающий эффект на рецептор ЛГ, чем сам ЛГ. 6-8 МЕ ЛГ биологически эквивалентны 1 МЕ ХГЧ, что демонстрирует более высокую эффективность ХГЧ по сравнению с ЛГ. На сегодня дискуссии относительно того, следует ли использовать для ВРТ рЛГ или ХГЧ с целью улучшения результатов, продолжаются [19].
В проспективном обсервационном исследовании, проведенном Requena и соавт. [20], сравнивали эндокринный профиль доноров ооцитов, которым проводили стимуляцию ФСГ + рЛГ (соотношение 2:1) или чМГ. Хотя полученное количество ооцитов после КОС рекомбинантными гонадотропинами было больше, чем чМГ (16,5 против 11,8; p=0,049), количество ооцитов в метафазе II было больше при использовании чМГ (71,2 против 80,6%; р=0,003). При оценке уровней сывороточных стероидных гормонов (эстрадиол, прогестерон, тестостерон и андростендион) в день введения триггера овуляции и на 6-й день цикла было выявлено незначительное их повышение при использовании рекомбинантных гонадотропинов по сравнению с мочевыми. Сравнение внутрифолликулярных уровней стероидных гормонов в двух протоколах было статистически незначимым и текущие показатели беременности также были сопоставимы (46,1 против 46,1%) [20].
Devroey и соавт. [21] изучали безопасность и эффективность рФСГ и высокоочищенного чМГ при КОС в циклах с антагонистами ГнРГ и обязательным переносом единственной бластоцисты. Хотя большее количество ооцитов было получено благодаря применению рФСГ, однако и при использовании рФСГ, и при применении чМГ количество ооцитов фазы MII было сопоставимым. Авторы пришли к выводу, что несмотря на значительное расхождение в фармакодинамических эффектах, высокоочищенный чМГ оказывал действие, подобное таковому рФСГ в циклах с антагонистами ГнРГ и обязательным переносом единственной бластоцисты. Основанием этому служили клинические признаки беременности как при свежих переносах, так и при переносах размороженных пятидневных эмбрионов [21].
Недавно был разработан препарат гонадотропина, который содержит рФСГ и рЛГ в соотношении 2:1. Исследования доз, проведенные у пациентов с гипогонадотропным гипогонадизмом, подтвердили клиническую эффективность нового препарата и показали, что 75 МЕ ЛГ достаточно для оптимального фолликулогенеза [22].
В некоторых исследованиях продемонстрировано благоприятное воздействие на результаты лечения и показатели ответа яичников добавления ЛГ в схемы КОС у пациенток определенных групп. В частности к ним относятся женщины в возрасте старше 35 лет, лица с уменьшенным овариальным резервом и с полиморфизмом рецепторов ЛГ. Добавление ЛГ в протокол лечения повышает качество ооцитов за счет активации клеток теки яичников, что способствует продукции большего количества андрогенов, которые в конечном итоге превращаются в эстрогены в клетках гранулезы (увеличение эстрогенной среды в фолликуле яичника) [23].
Pacchiarotti и соавт. [24] провели проспективное рандомизированное исследование, в котором сравнили результаты ЭКО в протоколах стимуляции яичников с рФСГ + рЛГ (в соотношении 2:1) и чМГ. Выявлено, что применение рФСГ + рЛГ и чМГ обеспечивает сопоставимые результаты с точки зрения частоты имплантации, наступления беременности и качества эмбрионов, хотя существует статистическая разница в качестве ооцитов (лучшее качество ооцитов отмечено у пациенток, получавших чМГ). Эта разница нивелировалась за счет общего количества аспирированных ооцитов, которое было больше в группе рФСГ + рЛГ. Таким образом, общее количество ооцитов фазы MII было сопоставимым в обеих группах за счет более высокой частоты развития СГЯ в группе рФСГ + рЛГ. Уменьшение дозы ФСГ, используемого в группе чМГ, также привело к снижению стоимости цикла ЭКО [24].
Фармакологическим характеристикам и клиническому применению рФСГ + рЛГ в соотношении 2:1 посвящен обзор Bosch [25]. Хотя комбинация рФСГ и рЛГ 2:1 представляет собой оптимальную схему индукции овуляции в отношении безопасности и клинической эффективности у пациенток с гипогонадотропным гипогонадизмом, использование этой комбинации лекарств при стимуляции яичников для ЭКО остается дискуссионным, поскольку целевая популяция, у которой эта терапия эффективна, не определена. В качестве кандидатов для добавления рЛГ в схемы стимуляции по результатам предыдущих исследований были предложены пациентки, нуждающиеся в получении свыше 3000 МЕ рФСГ во время КОС, а также пациентки, демонстрирующие «плато» при фолликулярном росте, и пациентки с неадекватным ответом после 7 дней введения рФСГ [25].
Lehert и соавт. [26] выразили предположение, что у пациенток со слабым ответом на лечение добавление рЛГ к рФСГ по сравнению с одним только рФСГ может приводить к значительному увеличению количества ооцитов, случаев клинической беременности и вынашивания беременности. Humaidan и соавт. [27] в настоящее время проводят рандомизированное контролируемое многоцентровое исследование, целью которого является изучение возможных преимуществ комбинации фиксированных доз рФСГ + рЛГ по сравнению с монотерапией рФСГ у пациенток с плохим ответом яичников в соответствии с определением, предложенным болонскими критериями Европейского общества репродукции и эмбриологии человека (ESHRE).
Корифоллитропин-α представляет собой рекомбинантный ФСГ длительного действия, который поддерживает фолликулогенез в течение 7 дней после введения. Хотя фармакодинамические эффекты рФСГ длительного действия и обычного рФСГ сопоставимы, время полувыведения из сыворотки крови рФСГ длительного действия составляет 65 ч, что вдвое больше, чем обычного рФСГ. Исследования по определению дозы рФСГ длительного действия показали, что для клинической эффективности у пациенток с массой тела более 60 кг рекомендуются дозы 100 и 150 мкг [28]. В метаанализе Кокрановской базы данных, выполненном Pouwer и соавт. [29], указано, что хотя использование средней дозы (150-180 мкг) рФСГ длительного действия, по-видимому, является безопасным и одинаково эффективным вариантом КОС по сравнению с ежедневным введением рФСГ, у женщин с идиопатической субфертильностью, получивших низкую дозу (60-120 мкг) рФСГ длительного действия, было отмечено снижение уровня рождаемости в сравнении с группой, ежедневно получавшей рФСГ.
Сегодня ведутся исследования, посвященные безопасности и эффективности использования ФСГ длительного действия у пациенток с избыточной или слабой реакцией и у женщин со всеми причинами субфертильности. В систематическом обзоре и метаанализе Mahmoud Youssef и соавт. [30] пришли к выводу, что прием корифоллитропина-α в сочетании с ежедневным введением антагониста ГнРГ является хорошей альтернативой ежедневным инъекциям рФСГ с точки зрения эффективности и безопасности у пациенток с нормальным ответом на КОС в циклах лечения ЭКО/ИКСИ.
Что выбрать для окончательного созревания ооцитов: рекомбинантный хорионический гонадотропин человека или мочевой хорионический гонадотропин человека?
ХГЧ применяется для окончательного созревания ооцитов во время циклов ВРТ. Используются две его формы: рекомбинантный (рХГЧ) и мочевой (мХГЧ). мХГЧ имеет некоторые недостатки по сравнению с рХГЧ, такие как несоответствие между партиями при производстве, неконтролируемый источник и непредвиденная биологическая активность. В рандомизированном контролируемом проспективном исследовании Chang и соавт. [31] сравнили эффективность и безопасность применения рХГЧ в дозах 250 и 500 мкг и мХГЧ в дозе 10 000 МЕ при ВРТ. В качестве первичной конечной точки исследования выбрано общее количество полученных ооцитов, которое было сопоставимым в обеих группах. На основании результатов этого исследования рХГЧ был признан эффективным и переносимым с точки зрения индукции окончательного созревания фолликулов и лютеинизации для женщин, проходящих процедуры ВРТ. Youssef и соавт. [32, 33] выполнили два последовательных метаанализа Кокрановской базы данных, в которых сравнивали безопасность и эффективность подкожного введения рХГЧ и высокой дозы рЛГ с внутримышечным введением мХГЧ для индукции финального запуска созревания яйцеклеток в циклах ЭКО и ИКСИ. Авторы пришли к выводу, что частота наступления беременности и СГЯ при применении рХГЧ или рЛГ и мХГЧ для окончательного созревания фолликулов в программах ЭКО эквивалентна. В качестве лучшего выбора авторы рекомендуют использовать мХГЧ для окончательного запуска созревания ооцитов в циклах ЭКО и ИКСИ.
Одними из важнейших для КОС препаратов являются аналоги ГнРГ. Структура ГнРГ была расшифрована в 1971 г. в Сан-Франциско A. Schally и соавт. Эта работа в 1977 г. была отмечена Нобелевской премией в области медицины. После расшифровки молекулы ГнРГ были синтезированы аналоги этого гормона, которые близки по своей структуре к гонадолиберину, но отличаются более высоким сродством к рецепторам ГнРГ: агонисты ГнРГ (трипторелин, гозерелин, бусерелин, леупролида ацетат) и антагонисты ГнРГ (ганиреликс и цетрореликс).
Агонисты и антагонисты ГнРГ были получены одновременно – в 1972 г., однако внедрение антагонистов ГнРГ в клиническую практику началось значительно позже. Недостатками антагонистов ГнРГ первого поколения были недостаточно выраженный эффект, относительно короткий период полувыведения, аллергические реакции из-за стимуляции рецепторов тучных клеток и высвобождения гистамина, плохая растворимость. Только третье поколение антагонистов ГнРГ оказалось лишенным этих недостатков. Современные антагонисты ГнРГ имеют оптимальные показатели по степени подавления пиковой секреции ЛГ и низкий анафилактогенный потенциал.
При связывании с рецепторами ГнРГ в гипофизе агонисты ГнРГ активируют их таким образом, что повышается секреция ЛГ и ФСГ. Однако при их повторном назначении или применении депо-препаратов наступает фаза истощения гонадотрофов гипофиза (десенситизация), связанная с уменьшением количества рецепторов к ГнРГ. При использовании агонистов ГнРГ возникает дефицит эндогенного ФСГ, что требует применения более высоких доз гонадотропных препаратов для достижения адекватной КОС. Агонисты ГнРГ используются в циклах ВРТ по двум протоколам – короткому и длинному. По короткому протоколу гонадотропины назначаются одновременно с агонистами ГнРГ. По длинному протоколу стимуляция овуляции гонадотропинами начинается только после того, как наступит фаза десенситизации гипофиза и снизится выработка эндогенных ФСГ и ЛГ. Для надежной десенситизации гипофиза и для момента, когда может быть начата КОС, требуется длительное, не менее недели, применение агонистов ГнРГ.
В связи с этим возникла необходимость разработки протокола ВРТ, при котором можно было бы достигнуть супрессии гипофиза быстрее. Таким требованиям отвечает протокол с антагонистами ГнРГ, который позволяет ограничить прием этих препаратов только продолжительностью фолликулярной фазы, когда риск преждевременного спонтанного выброса ЛГ у пациенток максимален, и назначить соответственно одновременно со стимуляцией гонадотропинами. В противоположность агонистам ГнРГ антагонисты ГнРГ быстро и непосредственно подавляют выброс гонадотропинов путем конкурентного связывания их гипофизарных рецепторов (табл.).
Для антагонистов ГнРГ характерно быстрое угнетение рецепторов гипофиза, быстрое начало действия, «чистый» антагонистический эффект, быстрое восстановление функции гипофиза после их отмены. Отличительными признаками действия антагонистов ГнРГ являются следующие: не приводят к первоначальному подъему уровня ЛГ; не уменьшают количество рецепторов ГнРГ на клетках гипофиза; ингибирование ЛГ/ФСГ начинается сразу после введения препарата; при стимуляции используется внутренний резерв ФСГ, поэтому когорта растущих фолликулов разнородна; дозозависимость вследствие конкурентного связывания – степень супрессии зависит от уровня антагониста ГнРГ в крови.
После введения антагонистов ГнРГ уровень гонадотропинов в крови значительно снижается, причем уровень ЛГ снижается в большей степени, чем ФСГ. Так, после однократного введения 0,25 мг ганиреликса концентрация ЛГ снижается на 74%, а ФСГ – на 32%. После однократной инъекции угнетение сохраняется в течение 4-16 ч.
Внедрение в клиническую практику антагонистов ГнРГ позволяет проводить процесс стимуляции яичников на современном и безопасном уровне, в коротком и простом режиме, что отвечает интересам пациента. Такие отличительные свойства антагонистов ГнРГ, как угнетение секреции гонадотропинов без интернализации рецепторов на гонадотрофах, быстрый и обратимый характер действия, позволили существенно усовершенствовать протоколы КОС без снижения ее эффективности.
1. Длинный протокол КОС с агонистами ГнРГ. Длинный протокол КОС в циклах ВРТ с применением агонистов ГнРГ заключается в следующем. С 21-го дня менструального цикла ежедневно или в виде депо-форм вводятся агонисты ГнРГ, через 14-18 дней с учетом данных ультразвукового исследования (УЗИ) о толщине эндометрия и состоянии яичников (на предмет фолликулярных кист или кист желтого тела), а также уровня эстрадиола ( 10 МЕ/л) и с длительностью бесплодия Литература
- Brenner G.M., Stevens C. Pharmacokinetics. Рharmacology. Chapter. 2012; 925: 2.
- Gulekli B., Ozaksit G., Turhan N.O., Senoz S., Oral H., Gokmen O. Tamoxifen: an alternative approach in clomiphene resistant polycystic ovarian syndrome patients. J Pak Med Assoc. 1993; 43: 89-90.
- Dhaliwal L.K., Suri V., Gupta K.R., Sahdev S. Tamoxifen: An alternative to clomiphene in women with polycystic ovary syndrome. J Hum Reprod Sci. 2011; 4: 76-9.
- Brown J., Farquhar C., Beck J., Boothroyd C., Hughes E. Clomiphene and anti-oestrogens for ovulation induction in PCOS. Cochrane Database Syst Rev. 2009: CD002249.
- Diamond M.P., Legro R.S., Coutifaris C., Alvero R., Robinson R.D., Casson P. et al. Letrozole, Gonadotropin, or Clomiphene for Unexplained Infertility. N Engl J Med. 2015; 373: 1230-40.
- Legro R.S., Brzyski R.G., Diamond M.P., Coutifaris C., Schlaff W.D., Casson P. et al. Letrozole versus clomiphene for infertility in the polycystic ovary syndrome. N Engl J Med. 2014; 371: 119-29.
- Roque M., Tostes A.C., Valle M., Sampaio M., Geber S. Letrozole versus clomiphene citrate in polycystic ovary syndrome: systematic review and meta-analysis. Gynecol Endocrinol. 2015; 31: 917-21.
- Reefhuis J., Honein M.A., Schieve L.A., Rasmussen S.A. National Birth Defects Prevention Study. Use of clomiphene citrate and birth defects, National birth defects prevention study, 1997-2005. Hum Reprod. 2011; 26: 451-7.
- Davies M.J., Moore V.M., Willson K.J., Van Essen P., Priest K., Scott H. et al. Reproductive technologies and the risk of birth defects. N Engl J Med. 2012; 366: 1803-13.
- Tulandi T., Martin J., Al-Fadhli R., Kabli N., Forman R., Hitkari J. et al. Congenital malformations among 911 newborns conceived after infertility treatment with letrozole or clomiphene citrate. Fertil Steril. 2006; 85: 1761-5.
- Palomba S., Falbo A., La Sala G.B. Effects of metformin in women with polycystic ovary syndrome treated with gonadotrophins for in vitro fertilisation and intracytoplasmic sperm injection cycles: a systematic review and meta-analysis of randomised controlled trials. BJOG. 2013; 120: 267-76.
- Uysal S., Zeki Isik A., Eris S., Yigit S., Yalcin Y., Ozun Ozbay P. Correlation of endometrial glycodelin expression and pregnancy outcome in cases with polycystic ovary syndrome treated with clomiphene citrate plus metformin: a controlled study. Obstet Gynecol Int. 2015; 2015: 278591.
- Tso L.O., Costello M.F., Albuquerque L.E., Andriolo R.B., Macedo C.R. Metformin treatment before and during ЭКО or ICSI in women with polycystic ovary syndrome. Cochrane Database Syst Rev. 2014: CD006105.
- Porchet H.C., Le Cotonnec J.Y., Loumaye E. Clinical pharmacology of recombinant human follicle-stimulating hormone. III. Pharmacokinetic-pharmacodynamic modeling after repeated subcutaneous administration. Fertil Steril. 1994; 61: 687-95.
- le Cotonnec J.Y., Porchet H.C., Beltrami V., Munafo A. Clinical pharmacology of recombinant human luteinizing hormone: Part I. Pharmacokinetics after intravenous administration to healthy female volunteers and comparison with urinary human luteinizing hormone. Fertil Steril. 1998; 69: 189-94.
Полный список литературы, включающий 91 источник, находится в редакции
источник