Мужское бесплодие – нарушение мужской репродуктивной функции, выражающееся в невозможности иметь потомство. Чаще всего мужское бесплодие служит следствием качественного и количественного изменения сперматозоидов в эякуляте из-за перенесенных ранее воспалительных заболеваний половых органов, инфекционных и хронических болезней, воздействия на организм химических факторов. В 40- 50% случаев служит причиной бесплодного брака. Может обернуться распадом семьи и личной трагедией.
Мужское бесплодие – нарушение мужской репродуктивной функции, выражающееся в невозможности иметь потомство. Чаще всего мужское бесплодие служит следствием качественного и количественного изменения сперматозоидов в эякуляте из-за перенесенных ранее воспалительных заболеваний половых органов, инфекционных и хронических болезней, воздействия на организм химических факторов. В 40- 50% случаев служит причиной бесплодного брака. Может обернуться распадом семьи и личной трагедией.
Одна десятая часть всех пар не имеют возможности зачать ребенка без помощи медицины. При этом на долю женского бесплодия приходится 40%, а на долю мужского бесплодия 45%, на оставшиеся 15% приходятся случаи иммунологической несовместимости супругов и редкие формы бесплодия.
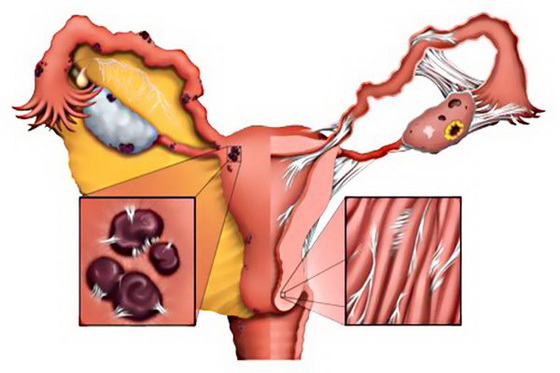
Мужской половой клеткой является сперматозоид, он содержит в себе генетическую информацию об отце. Генетическая информация сосредоточена в головке сперматозоида, а с помощью хвоста сперматозоид получает возможность передвигаться, чтобы достигнуть яйцеклетки. Сперматогенез происходит в яичках; сначала сперматозоид проходит по извитым канальцам, которые постепенно переходят в прямые и далее в придаток яичка. Общая длина канальцев около 500 метров, благодаря медленному движению по извитым канальцам сперматозоид созревает и становится способным оплодотворить яйцеклетку. В придатках яичек сперматозоиды проходят последнюю стадию роста, после чего через семявыводящий проток они поступают в семенные пузырьки, где скапливаются и смешиваются с эпителиальным секретом, который содержит питательные вещества для сперматозоидов. Из семенных пузырьков семенная жидкость эвакуируется в момент эякуляции, смешиваясь с секретом предстательной железы, получившаяся жидкость называется спермой.
Из вышеизложенного становится ясно, что основными причинами мужского бесплодия могут быть либо обтурация канала, при котором сперма из-за препятствий не может исторгнуться из мочеиспускательного канала, либо нарушения секреторной функции на любом из этапов.
При секреторной форме мужского бесплодия яички не производят нужное количество сперматозоидов, вследствие чего оплодотворение яйцеклетки невозможно. О такой форме бесплодия говорят и в случаях, когда у сперматозоидов нарушена подвижность или они имеют дефекты в строении.
Частой причиной секреторного мужского бесплодия является варикозное расширение вен яичек (варикоцеле). Отток венозной крови через расширенные вены затруднен, поэтому развиваются застойные явления, нарушается кровоснабжение и функция яичек угнетается. В основном варикоцеле поражается левое яичко, но со временем процесс переходит и на второе здоровое яичко. В результате функция обеих яичек значительно угнетается, продукция сперматозоидов снижается и развивается секреторная форма мужского бесплодия.
Водянка яичек, при которой в яичках скапливается жидкость, сдавливающая яичко, тоже может стать причиной секреторного мужского бесплодия, так как длительное сдавливание яичек жидкостью нарушает кровоснабжение сперматозоидопродуцирующей ткани. При паховой грыже наблюдается аналогичный процесс. Крипторхизм, то есть неопущение яичек в мошонку реже становится причиной мужского бесплодия. Лечение крипторхизма необходимо провести до семилетнего возраста, чтобы функция яичек была сохранена, иначе риск развития мужского бесплодия возрастает в несколько раз.
Эпидемический паротит, вирус которого поражает железистую ткань, в первую очередь поражает слюнные железы и половые железы. Поэтому эпидемический орхит при достаточно сильном воспалении и отсутствии лечения может значительно снизить репродуктивные функции мужчины, либо стать причиной мужского бесплодия.
Повреждения сперматогенного эпителия тоже могут вызвать мужское бесплодие, так действие проникающей радиации в зависимости от дозы проявляется либо тотальным поражением – лучевой болезнью, либо поражением отдельных тканей и органов, сперматогенный эпителий наиболее чувствителен к радиационному излучению. Электромагнитные колебания часто приводят к тому же исходу, при этом ношение любых средств связи на поясе до того, как ученые не вынесли окончательного вердикта, тоже является фактором риска.
Высокая температура угнетающе действует на весь процесс сперматогенеза и со временем может привести к необратимым последствиям и к мужскому бесплодию. В группу риска попадают как люди, работающие в горячих цехах, так и злоупотребляющие баней и сауной. Любые водные процедуры нужно заканчивать прохладным душем, чтобы температура в яичках пришла в норму. Сиденья с подогревом в автомобиле с одной стороны повышают комфортность, а с другой повышают температуру в яичках. Сдавливание промежности узким бельем и одеждой, частые удары ведут к дисфункции яичек и к полному мужскому бесплодию. Профессиональные занятия велоспортом часто сказываются на репродуктивной функции, мужское бесплодие у мужчин, длительно занимающихся велоспортом, диагностируется в несколько раз чаще.
Сифилис, туберкулез, брюшной тиф, прием противоопухолевых, противоэпилептических и антибактериальных препаратов и гормональные нарушения могут спровоцировать развитие мужского бесплодия. Временное мужское бесплодие развивается в результате длительного стресса, дефицита белка в организме, гиповитаминоза и злоупотребления алкоголем и курением. В регионах с неблагоприятными экологическими условиями процент пар с мужским бесплодием выше.
Диагностика секреторного мужского бесплодия основывается на спермограмме и на цитологическом исследовании тканей яичек, это помогает выяснить как степень патологического состояния, так и первопричину. После коррекции основного заболевания, приведшего к мужскому бесплодию, проводят курс улучшающий сперматогенез.
При этой форме мужского бесплодия движение сперматозоидам по одному или обоим семявыносящим каналам невозможно из-за закупорки. Основной причиной обтурации протоков являются воспалительные процессы в придатках яичек, в результате которых каналы склеиваются или закупориваются. Нелеченые травмы яичек и паховой области, повреждения во время операций на органах малого таза или сдавливание кистой семявыносящих протоков являются второй основной причиной обтурационного мужского бесплодия после орхитов. Реже причиной мужского бесплодия является отсутствие придатка яичка или семявыводящего протока, сифилис и туберкулез.
Во время диагностики обтурационного мужского бесплодия важно определить протяженность и локализацию обтурации. Лечение заключается в иссечении участка непроходимости или в формировании нового пути для сперматозоидов посредством наложения анастомозов.
У 10% бесплодных пар не обнаруживается каких-либо патологий, при этом у них могут быть дети от других браков. Более редкой причиной бесплодия является иммунологическая несовместимость или гиперчувствительность женщины к компонентам спермы. Если отверстие мочеиспускательного канала находится ниже вершины полового члена, то в момент эякуляции сперма не попадает на шейку матки, поэтому зачатия не наступает. Мужское бесплодие диагностируют и в случаях, когда за месяц мужчина совершает не более 1-го полноценного полового акта (из-за болезни или из-за предпочтения других видов секса).
После осмотра и опроса мужчины, с целью выявления заболеваний в анамнезе, которые могли привести к бесплодию, необходимо сделать спермограмму. Анализ следует повторить 2-3 раза, при этом перед обследованием требуется воздержание от половых контактов и от мастурбации на 2-3 дня. На прием к андрологу можно придти уже с готовыми анализами, что экономит время на диагностику. Если же обследование по поводу бесплодия проходят и мужчина, и женщина, то лучше, чтобы обследование проводилось в одной клинике, дабы врачи могли точнее установить причину бесплодия в паре и назначить правильное лечение.
В норме объем эякулята составляет 3-5 мл (около одной чайной ложки), если же количество эякулята меньше нормы, то это может говорить о гипофункции яичек. Если объем спермы менее 2-х мл, а все показатели спермограммы в пределах нормы, то зачатие маловероятно из-за небольшого объема спермы. В 1 мл спермы в норме должно быть не менее 20 млн. сперматозоидов, если их количество ниже этого крайнего значения, то говорят об олигозооспермии. Олигозооспермия может развиться из-за односторонней непроходимости семявыносящих путей или из-за гипофункции яичек, в результате чего и наступает мужское бесплодие. Если же у пациента наблюдается двусторонняя обтурация, то сперматозоиды в сперме полностью отсутствуют, тогда говорят об азооспермии. При этом, несмотря на то, что для оплодотворения яйцеклетки необходим всего один сперматозоид, снижение количества сперматозоидов до 1-го млн. делает зачатие невозможным. В момент эякуляции на шейку матки попадает около 200 млн. сперматозоидов, половина преодолевает слизистую пробку цервикального канала, но только малая часть достигает устья маточных труб. Поскольку яйцеклетка находится только в одной маточной трубе, то лишь половина сперматозоидов попадет в трубу с яйцеклеткой. То есть, чем меньше сперматозоидов находится в эякуляте, тем меньше вероятность наступления беременности, поэтому критическое снижение количества сперматозоидов в сперме является одним из признаков мужского бесплодия. Большая часть сперматозоидов должны иметь прямолинейный или хаотичный характер движения, если же количество подвижных сперматозоидов снижено, то это называется астенозооспермия, полное отсутствие подвижных сперматозоидов называется некрозооспермией.
Подвижность и количество сперматозоидов в эякуляте зависит от частоты половых контактов, именно поэтому мужчине, проходящему диагностику мужского бесплодия необходимо воздерживаться от половых контактов для получения достоверных результатов спермограммы. И, при совершаемых подряд половых актах, сперма утрачивает фертильность, поэтому необходимость в контрацепции отпадает.
Бесплодными могут быть пары, которые не воздерживаются перед зачатием, так как при частых контактах в сперме присутствуют незрелые формы сперматозоидов с низкой подвижностью и жизнеспособностью, а максимальное количество зрелых и жизнеспособных сперматозоидов содержится в сперме после 2-3 дней воздержания.
Морфологический анализ сперматозоидов позволяет оценить, какой процент сперматозоидов имеет нормальное строение, если более половины имеют полноценное строение, то это является нормой, снижение количества нормальных сперматозоидов называют тератозооспермией. У мужчин, которые проходят обследование на предмет мужского бесплодия, часто обнаруживают агглютинацию сперматозоидов, чего в норме не должно быть. В норме в сперме должны отсутствовать и участки скопления (агрегации) сперматозоидов, при этом визуально такая сперма выглядит неоднородной, а участки агрегации имеют большую плотность и более насыщенный оттенок. Агрегация сперматозоидов часто сопутствует снижению скорости движения. Такие изменения спермы, которые могут привести к мужскому бесплодию, наблюдаются при воспалительных заболеваниях органов малого таза и при гормональных нарушениях в организме мужчины.
Значительное количество лейкоцитов в сперме свидетельствует о воспалительном процессе урогенитального тракта. И мужчину, кроме обследования на предмет мужского бесплодия необходимо обследовать у уролога с целью выявления орхита, эпидидимита, везикулита или простатита.
Поскольку данные спермограммы лабильны, при необходимости обследование повторяют, дабы получить объективную оценку возможности оплодотворения.
Современная андрология располагает широкими возможностями лечения мужского бесплодия. В первую очередь необходимо нормализовать режим работы и отдыха, устранить профессиональные и бытовые вредности. Лечение заболеваний урогенитальной сферы, витаминотерапия, нормализация питания и назначение седативных препаратов в случае необходимости проводят у всех мужчин, которые проходят лечение мужского бесплодия.
При нарушенном сперматогенезе, проводят лечение мочеполовых инфекций, коррекцию эндокринных нарушений; показана заместительная терапия андрогенами. Схему лечения и выбор препаратов подбирают индивидуально в каждом случае.
Если у одного из супругов имеются воспалительные заболевания половых органов, то лечение мужского бесплодия начинают с лечения обоих супругов. При этом важно не только подавить микроорганизмы, но и выявить первоисточник с целью его устранения. После этиологического и патогенетического лечения рекомендован курс иммунокорректоров и общеукрепляющих препаратов. Некоторые инфекционные заболевания мочеполовой сферы требуют длительного лечения, критериями же выздоровления является отсутствие или наличие не более 2-х в поле зрения лейкоцитов в сперме, отсутствие стафилококковой микрофлоры и возбудителей венерических заболеваний и нормализация остальных показателей спермы.
Если в течение года после коррекции мужского бесплодия из-за инфекций мочеполовых путей беременность не наступает, то показана гормоностимулирующая терапия.
Искусственная инсеминация спермой мужа или донорской спермой показана при наличии коитальных нарушений, препятствующих попаданию эякулята во влагалище. При мужском бесплодии, обусловленном легким нарушением сперматогенеза или иммунологической агрессии слизи цервикального канала, искусственная инсеминация спермой мужа позволяет зачать ребенка многим парам. Искусственную инсеминацию спермой мужа называют гомологическим искусственным осеменением, а инсеминацию донорской спермой – гетерологическим.
Искусственная инсеминация показана при наличии у женщины старых разрывов промежности или анатомических препятствий со стороны влагалища и матки, при тяжелых формах вагинизма, анкилозных повреждений тазобедренных суставов и при неблагоприятном воздействии содержимого влагалища на сперматозоиды.
Если мужское бесплодие обусловлено недостаточной эрекцией или преждевременными эякуляциями, то этим парам также показана искусственная инсеминация спермой мужа. При гидроцеле больших размеров и пахово-мошоночной грыже, выраженной гипоспадии и олигозооспермии I-II степени тоже прибегают к искусственной инсеминации. Мужскую сперму можно криоконсервировать, особенно перед длительным приемом препаратов, которые могут вызвать мужское бесплодие или перед стерилизацией мужа.
К инсеминации спермой донора прибегают при мужском бесплодии, обусловленном аспермией, азооспермией, олигоспермией III степени и другими тяжелыми нарушениями сперматогенеза. Если супруг имеет заболевания, при которых рождение детей не рекомендуется, как например, при генетических заболеваниях, рождении детей с тяжелыми врожденными пороками развития или при мертворождении детей с признаками тяжелой гемолитической болезни из-за несовместимости супругов по Rh-фактору.
Для улучшения показателей спермы, эякулят разделяют на фракции, отделяя фильтрацией подвижные формы, используя несколько разных порций криоконсервированной спермы. Для улучшений показателей спермы мужчины, который прошел лечение мужского бесплодия в нее добавляют агринин, кофеин и простагландины.
Эффективность от введения нативной спермы в несколько раз выше, чем при инсеминацией криоконсервированной спермой, но при использовании криоконсервированной спермы снижаются ее антигенные свойства, что используется при лечении женского или мужского бесплодия в парах, в которых у женщин присутствуют антиспермальные антитела. При этом сперма вводится либо в цервикальный канал, либо внутриматочно через день от даты предполагаемой овуляции.
Гормональная терапия мужского бесплодия показана при различных нарушениях сперматогенеза в основном при нарушении подвижности сперматозоидов, в качестве стимуляции после коррекции основных заболеваний и реже в качестве основного лечения.
Заместительная гормонотерапия для лечения мужского бесплодия показана при гипогонадизме, идиопатических нарушениях подвижности сперматозоидов (патозооспермия) и при гипоандрогении. При блокирующем методе лечения мужского бесплодия мужчина несколько месяцев принимает препараты, подавляющие сперматогенез, после отмены качественные и количественные характеристики сперматозоидов улучшаются. Хотя этот антифертильный метод для лечения мужского бесплодия используется редко.
Стимулирующая гормонотерапия при мужском бесплодии основана на введении небольших доз гормонов, которые благотворно влияют на обменные и другие процессы, но при этом не воздействуют на гипоталамо-гипофизарную систему. Лечение мужского бесплодия с помощью гормонов длительное, не менее 9-ти месяцев с контролем результативности терапии не реже чем раз в 3 месяца. Дозировки и выбор препарата и схемы приема зависят от типа патологии и назначаются индивидуально. При концентрации сперматозоидов менее 5 млн./мл спермы, если подвижных форм сперматозоидов менее 20% гормонотерапия мужского бесплодия бесперспективна.
При мужском бесплодии, вызванном варикоцеле, хирургическим путем улучшают отток венозной крови от яичек. В результате исчезают застойные явления, нормализуется обмен веществ и восстанавливается сперматогенез. Яичковые вены либо перевязывают, либо склерозируют, либо лигируют. Прогноз операции при одностороннем варикоцеле благоприятный, если процесс имеет двусторонний характер, то иногда требуется дополнительная медикаментозная терапия мужского бесплодия.
При крипторхизме операцию по опущению яичек в мошонку проводят в раннем возрасте, однако необходимо исключить синдром Каллмана и другие врожденные патологии. Чем раньше проведена операция по орхипексии, тем меньше необратимых изменений в сперматогенном эпителии и тем меньше вероятность, что в зрелом возрасте потребуется лечение мужского бесплодия. Если низведение яичек проводили после достижения трехлетнего возраста, то лечение не дает высоких результатов и многим мужчинам в последствие приходится проходить лечение мужского бесплодия. Лечение крипторхизма гонадотропными гормонами малоэффективно.
При хирургическом лечении пахово-мошоночных грыж важно минимизировать риск травматизации семенного канатика, если операция произведена успешно, то обычно дальнейшей терапии мужского бесплодия не требуется, так как репродуктивная функция полностью восстанавливается. Если имеются врожденные аномалии мочеиспускательного канала, то пластической операции по восстановлению канала с формированием наружного отверстия на головке достаточно, чтобы в момент эякуляции сперма попадала на шейку матки. Если имеется участок сужения мочеиспускательного канала, то хирургическое лечение мужского бесплодия заключается в наложении анастомозов с помощью эндоскопической хирургии. Операции на семявыносящих путях применяют при обтурационной азооспермии, дополнительно устраняя причину обтурации (киста, участок воспалительной обструкции и др.).
Совместное посещение психотерапевта во время лечения женского или мужского бесплодия создадут благоприятную атмосферу для зачатия. Так как у многих пар после известия о временной невозможности иметь детей, наблюдается кризис, основанный на упреках, утрате нежности во время половых сношений и ощущении неполноценности. Беседы с психотерапевтами и психологами помогут сохранить нормальные взаимоотношения в семье и найти выход из создавшейся ситуации, например усыновление ребенка или использование донорского материала для зачатия. Важно понимать, что возможность быть отцом это возможность воспитывать ребенка, а отнюдь не быть его биологическим родителем. И, если мужчина по каким-либо причинам даже пройдя курс лечения мужского бесплодия, не может стать биологическим отцом, то это не говорит о его неполноценности. Психолог поможет преодолеть данный кризис без дополнительных сложностей (депрессия, алкоголизм, развод), потому как зачастую, смирившись с невозможностью зачать ребенка, и использовав альтернативные методы по созданию полноценной семьи, рождается здоровый и долгожданный ребенок.
источник
Бесплодие — отсутствие на протяжении 1 года и более беременности у женщины, регулярно живущей половой жизнью и не применяющей противозачаточных средств. Это не диагноз, этот термин применяют к паре, которая пытается зачать, когда причина неудач не известна. В 60% случаев причиной бесплодия являются нарушения в организме женщины, в 40%-в организме мужчины (неполноценность спермы, нарушения эякуляции, импотенция).
Что ждет мужчину при обращении к врачу по поводу бесплодия? Каковы методы диагностики бесплодия и возможные варианты лечения для мужчин? Об этом в нашей статье.
Под мужским бесплодием понимают отсутствие у мужчины способности к оплодотворению, даже несмотря на нормальное совершение полового акта.
В прежние годы ответственность за бесплодие брака чаще возлагалась на женщину. В последнее же время благодаря более частым обследованиям мужей и, в частности, лабораторным анализам семенной жидкости выяснилось, что примерно в половине бесплодных браков виновником бесплодия является не женщина, а мужчина.
К врожденным формам бесплодия относятся различные виды аномалий яичек: первичный гипогонадизм, то есть врожденное недоразвитие половых органов, врожденное отсутствие обоих яичек (крайне редкий порок развития), крипторхизм (неопущение яичек в мошонку) и некоторые другие, более редкие врожденные нарушения структуры яичек.
Приобретенное бесплодие может быть результатом воздействия различных неблагоприятных факторов на сперматогенный эпителий яичек: инфекционных заболеваний, нарушений питания, длительных охлаждений тела, рентгеновских лучей или радиоактивных излучений. По современным данным, примерно у одной четвертой части бесплодных мужчин причиной этого дефекта является перенесенный инфекционный паротит (свинка), осложненный двухсторонним орхитом. Более редкой причиной мужского бесплодия бывают другие инфекционные заболевания: тиф, грипп, малярия, сифилис, туберкулез. Как и при инфекционном паротите, причиной бесплодия после этих болезней может быть не только клинически выраженный орхит, то есть отчетливое воспаление яичка, но и токсическое воздействие инфекции на спрематогенный эпителий яичка без явных признаков орхита. Чем моложе пациент, тем больше угроза вредного воздействия инфекционного заболевания на яички, особенно в период полового созревания или до него.
Длительная лихорадка, то есть повышение температуры тела, сама по себе также может привести к нарушению сперматогенеза вследствие повышения местной температуры в яичке. На этот фактор следует обращать внимание у людей, длительно подвергающихся воздействию высокой температуры на производстве.
Среди различных видов хронической интоксикации наибольшее практическое значение имеет злоупотребление алкоголем и курением. Под влиянием злоупотребления алкоголем в яичках происходит жировое перерождение семенных канальцев и разрастание на их месте соединительной ткани, то есть рубцовое замещение паренхимы яичек. Клинические наблюдения указывают на значительную частоту бесплодия у хронических алкоголиков, а также на высокую вероятность рождения у них неполноценного потомства. Хроническое воздействие никотина также может быть причиной нарушения способности к оплодотворению, причем это нарушение исчезает после прекращения или значительного ограничения курения.
Большое значение для нормальной сперматогенной функции яичка имеет достаточное его кровоснабжение. Те заболевания, которые нарушают кровообращение в яичке, нередко приводят к изменениям его внешнесекторной функции, а при двустороннем характере заболевания — к бесплодию. К этим заболеваниям относятся варикозное расширение вен семенного канатика (варикоцеле), перекрут семенного канатика.
Принципиальное иное происхождение имеют те формы мужского бесплодия, при которых нарушено не образование семени в яичках, а его выведение по семявыносящим путям ( придаток, семявыносящий проток, семенной пузырек, мочеиспускательный канал). На каждом из этих участков может встретиться препятствие к прохождению семенной жидкости врожденного или приобретенного характера. Врожденные пороки развития мочеиспускательного канала – дефект его задней стенки (гипоспадия) – приводят к тому, что извергающаяся из неправильно расположенного наружного отверстия уретры спермы не попадает во влагалище, а изливается перед ним. Развившееся в результате хронического воспалительного процесса или повреждения мочеиспускательного канала сужение (стриктура) его также может, хотя и очень редко, послужить причиной бесплодия: при этом семенная жидкость задерживается в канале, забрасывается в мочевой пузырь или постепенно вытекает по окончании полового сношения.
Наиболее часто причиной экскреторной формы мужского бесплодия служат аномалии и заболевания придатков яичек. Двусторонние аномалии придатков яичка в виде гипоглазии (уменьшения размеров), аплазии (врожденного отсутствия) или облитерации (отсутствие просвета в этом органе) встречаются редко.
Гораздо чаще причиной бесплодия оказываются двусторонние воспалительные заболевания придатков яичка (эпидидимит). После специфического (гонорейного, туберкулезного) эпидидимита очень часто остаются рубцовые изменения, которые могут резко нарушить движение сперматозоидов по просвету придатка, вплоть до полной его непроходимости. Если такое поражение носит двухсторонний характер, наступает бесплодие.
Заболевания предстательной железы и семенных пузырьков также могут быть причиной бесплодия. При хронических воспалительных процессах в этих органах происходит нарушение состава их секрета, что ведет к понижению активности сперматозоидов в семенной жидкости.
Народные средства лечения бесплодия у мужчин, как правило, малоэффективны, но некоторые правила образа жизни и питания (диеты) для зачатия помогут немного улучшить качество спермы.
Комплексное клинико-лабораторное обследование мужчин, состоящих в бесплодном браке, позволяет выявить следующие основные причины бесплодия:
- Сексуальная и/или эякуляторная дисфункция;
- Инфекция придаточных половых желез;
- Варикоцеле;
- Идиопатическая олигозооспермия;
- Идиопатическая астенозооспермия;
- Идиопатическая тератозооспермия;
- Изолированная патология семенной жидкости;
- Иммунологический фактор;
- Ятрогенный фактор;
- Системные заболевания;
- Врожденные аномалии развития половых органов;
- Приобретенная патология половых органов;
- Эндокринные причины;
- Обструктивная азооспермия;
- Идиопатическая азооспермия;
- Генетический фактор;
Частота нарушений репродуктивной функции мужчин составляет 48%. Основными причинами мужского бесплодия являются: инфекции гениталий (11%), варикоцеле (7%) и идиопатическая олиго-, астено-, тератозооспермия (15%). Сочетание 2-х и более факторов бесплодия у пациентов выявлено в 32% случаев.
Любая терапия начинается с общих организационных и лечебных мероприятий, направленных на устранение бытовых и профессиональных вредностей, нормализацию режима труда, отдыха, питания больного, назначение седативной и антидепрессивной терапии, средств, повышающих антитоксическую функцию печени, витаминотерапию, с лечения сопутствующих заболеваний.
Медикаментозное лечение в основном применяется при нарушении сперматогенеза, обусловленном инфекцией гениталий, эндокринной патологией и сексуально-эякуляторных изменениях. С этой целью используется следующие группы препаратов:
- Андрогены: тестостерона андеканоат (андриол), тестостерона пропионат (тестовирон), тестэнат (сустанон-250).
- Антиэстрогены: клостилбегид, тамоксифен Гонадотропины: менотропин (хумегон, пергонал), хориогонадотропин (прегнил, профази).
- Рилизинг-гормоны: ЛГ-РГ (люлиберин), Гн-РГ (криптокур).
- Ингибиторы секреции пролактина: бромкриптин (парлодел).
- Химиотерапевтические средства.
- Иммуностимуляторы: тактивин, пирогенал, нормальный человеческий иммуноглобулин.
- Ангиопротекторы: пентоксифилин (трентал).
- Биогенные препараты: солкосерил, раверон, трианол
- Средства коррекции половой функции: каверджект, андриол, иохимбин, тентекс, химколин.
Терапия больных, страдающих воспалительными заболеваниями мужской репродуктивной системы, представляет собой трудную и сложную задачу. Поэтому только комплексное поэтапное лечение одновременно обоих супругов или половых партнеров, даже при выявлении инфекции у одного из них, позволяет достичь клинического выздоровления.
Комплексные методы включают следующие виды лечения: 1) этиологическое, 2) патогенетическое, 3) гормональное, 4) иммунологическое, 5) общеукрепляющее и психотерапию.
Этиологическое лечение направлено на устранение инфекции на основе проводимых цитологических, культуральных и других исследований. Лечение проводится в течение 20-30 дней с последовательным назначением 2-3 препаратов. Для этого используются средства группы тетрациклинов (доксициклин), фторхинолонов (абактал, таривид), цефалоспоринов (клафоран), макролиды (рулид), а также ацикловир, нистатин и трихопол. При неэффективности лечение повторяют под контролем идентификации инфекционного агента и выбора других лекарственных препаратов. Для профилактики кишечного дисбактериоза одновременно назначают бактисубтил в течение 10-15 дней. Средства, относящиеся к сульфаниламидам и производным нитрофурана из-за их гонадотоксического влияния в терапии должны быть исключены.
Патогенетическое лечение включает мероприятия по ликвидации первичного источника инфекции и реинфекции, устранению нейротрофических расстройств в месте воспаления и возможных осложнений. В связи с этим проводятся обследование и лечение полового партнера, выявление и санация очагов инфекции, местно применяются антимикробные препараты для введения в уретру и в мочевой пузырь, массаж простаты, физиотерапия.
Гормональные препараты назначаются в комплексной терапии при дефиците эндогенного тестостерона или для стимуляции обменных и регенераторных процессов. К ним относятся: провирон, андриол, сустанон-250.
Повышение иммунологической реактивности организма достигается применением тимолина, тактивина, нормального человеческого иммуноглобулина и биогенных препаратов (раверон, трианол).
Для закрепления и стабилизации результатов терапии на заключительном этапе проводится санаторно-курортное лечение, включающее установление нормального образа жизни.
Клиническими критериями выздоровления считают: 1) отсутствие или 6 /мл лейкоцитов в сперме; 2) отсутствие микрофлоры или при обсемененности Staphylococcus epidermidis 3 КОЕ/мл; 3) отсутствие других видов инфекции; 4) нормализация показателей спермы.
При отсутствии наступления беременности от 6 до 12 месяцев с момента окончания лечения обоим супругам назначают гормоностимулирующую терапию.
Первая успешная попытка искусственной инсеминации, целью которой было преодоление бесплодия, обусловленного мужским фактором, была осуществлена J . Hunter в 1790 г. В России первая искусственная инсеминация спермой мужа была произведена в 1925 г. А. А. Шороховой по поводу азооспермии.
В зависимости от источника получения спермы различают искусственную инсеминацию спермой мужа (гомологическое искусственное осеменение) и искусственную инсеминацию спермой донора (гетерологическое искусственное осеменение).
Показаниями для искусственной инсеминации спермой мужа являются, в основном, коитальные нарушения, препятствующие нормальному попаданию эякулята во влагалище; легкие формы нарушения сперматогенеза или иммунологическая агрессия цервикальной слизи.
Искусственная инсеминация спермой мужа выполняется в случае наличия у жены:
- старых разрывов промежности;
- анатомических препятствий со стороны влагалища и матки;
- тяжелых форм вагинизма;
- неблагоприятного воздействия на сперму содержимого влагалища или цервикальной слизи;
- анкилозных повреждений тазобедренных суставов.
Показаниями со стороны мужа к проведению искусственной инсеминации являются:
- отсутствие эрекции или недостаточная эрекция;
- большие размеры гидроцеле или пахово-мошоночной грыжи;
- преждевременная эякуляция ;
- выраженная гипоспадия;
- некоторые формы олигозооспермии I — II степени;
- патологический посткоитальный тест.
Искусственная инсеминация спермой мужа применяется перед стерилизацией мужа, в случае назначения ему лекарственных препаратов, которые вызывают бесплодие, или перед облучением. Перед этим сперму мужчин предварительно криоконсервируют.
В последнее время искусственную инсеминацию спермой мужа все чаще используют для преодоления иммунологической агрессии цервикальной слизи при бесплодии.
Инсеминацию спермой донорапроводят при бесплодии, обусловленном тяжелыми нарушениями сперматогенеза (аспермия, азооспермия, олигоспермия III степени). Инсеминацию спермой донора также применяют при тяжелых общих заболеваниях мужа, состоянии после болезни Hodgkin , при наличии муковисцидоза, болезни Werdhig — Hoffman ; в случае отрицательной генетической предрасположенности в семье (мертворождение, рождение детей с тяжелой формой гемолитической болезни вследствие сенсибилизации по Rh -фактору, рождение детей с пороками развития, обусловленными наличием наследственной патологии у мужа).
С целью улучшения показателей спермы предлагают фракционировать эякулят, отделять подвижные формы путем фильтрации, аккумулировать несколько эякулятов с помощью криоконсервации, добавлять калликреин, декстразу, аргинин, кофеин или простагландины.
При нормальном состоянии репродуктивной системы у женщин для искусственной инсеминации применяют цервикальный метод введения эякулята, при наличии антиспермальных антител — внутриматочный. Для повышения эффективности искусственного оплодотворения у женщин с двухфазным менструальным циклом целесообразно проводить эту процедуру на фоне индукции овуляции гормональными методами. Искусственное оплодотворение может производиться не только у абсолютно здоровых женщин, но и у пациенток со сниженной фертильностью (нарушение овуляции, односторонняя или затрудненная проходимость маточных труб, аномалии развития матки) после проведения соответствующей корригирующей терапии.
Искусственную инсеминацию необходимо проводить через день в период предполагаемой овуляции, в количестве 2 манипуляций в одном менструальном цикле.
Следует отдавать предпочтение введению нативной спермы, поскольку эффективность ее применения в 2-3 раза выше, чем при использовании криоконсервированного материала. Однако доказано, что замораживание снижает антигенные свойства спермы, что делает перспективным применение этого метода искусственного осеменения у женщин с антиспермальными антителами.
Эффективность применения инсеминации спермой мужа колеблется от 6 до 22%, а инсеминации спермой донора находится в пределах 30-60%.
Основное место в терапии патозооспермии занимают гормональные препараты в качестве самостоятельного или стимулирующего лечения после других методов коррекции (варикоцеле, инфекции гениталий).
Различают следующие виды гормонотерапии при мужском бесплодии:
- Заместительная терапия — введение гормонов осуществляется для замещения их эндогенного дефицита и является одним из самых успешных методов фармакотерапии. В андрологической практике примером заместительной терапии служит лечение гипогонадизма, идиопатической патозооспермии и сексуальных нарушений, обусловленных гипоандрогенией.
- Блокирующая (подавляющая) терапия — введение гормонов приводит к подавлению функции соответствующей железы. Так, назначение мужчинам больших доз тестостерона (500 мг/нед) в течение 3-4 месяцев вызывает торможение выработки гонадотропинов и угнетение сперматогенеза до азооспермии. После отмены препарата, на фоне увеличения продукции гормонов передней доли гипофиза, происходит восстановление сперматогенеза с характеристиками его параметров, превосходящих исходный уровень до лечения. Данный метод в литературе известен как ребаунд-эффект и называется антифертильным. В настоящее время метод широкого применения не имеет.
- Стимулирующая терапия — основан на введении небольших физиологических доз гормонов, обладающих благоприятным влиянием на обменные, воспалительные, иммунные и другие процессы в организме, без выраженных изменений в системе гипоталамус-гипофиз-яички. К таким препаратам относятся андриол и провирон, используемые в лечении идиопатической олигозооспермии.
Наиболее часто применяются следующие препараты: клостилбегит (25-150 мг/сут), хумегон (75-150 МЕ), прегнил (1500-5000 МЕ), андриол (80-160 мг/сут). Курс лечения, как минимум, соответствует продолжительности сперматогенеза, составляя 12-15 недель. Контроль за результатами лечения проводится каждые 3 месяца. При положительной динамике лечение может продолжаться до 9 месяцев. Появление в ходе лечения нежелательных симптомов или гинекомастии служит основанием для снижения дозы препарата или его отмены.
Терапию олигозооспермии с концентрацией сперматозоидов первичном (гипергонадотропным) гипогонадизме лечение проводится препаратами мужских половых гормонов, способных подавлять секрецию гонадотропных гормонов и восстанавливать сперматогенную функцию. Таким действием обладают 5% тестостерона пропионат, тестэнат (сустанон-250). При отсутствии выраженных изменений в системе гипофиз-яички назначаются препараты андриол, провирон, клостилбегид.
Лечение вторичного (гипогонадотропного) гипогонадизма заключается в применении гонадотропина. При дефиците ЛГ назначается хориогонический гонадотропин и его аналоги (прегнил, профази). При дефиците ФСГ применяется сывороточный гонадотропин или препараты хумегон, пергонал. В лечении возможно сочетание сывороточного и хориогонического гонадотропина. При недостаточности резервной функции клеток Лейдига эффективность терапии повышается за счет комбинации сывороточного гонадотропина с препаратами тестостерона (андриол).
Любая терапия начинается с общих организационных и лечебных мероприятий, направленных на устранение бытовых и профессиональных вредностей, нормализацию режима труда, отдыха, питания больного, назначение седативной и антидепрессивной терапии, средств, повышающих антитоксическую функцию печени, витаминотерапию, с лечения сопутствующих заболеваний.
Варикоцеле . Лечение включает прерывание ретроградного кровотока по яичковой вене для устранения гемодинамических нарушений в яичке. Методом выбора является операция по Иваниссевичу, суть которой — высокая забрюшинная перевязка яичковой вены. Аналогичный клинический эффект может быть достигнут рентгеноэндоваскулярной окклюзии яичковой вены путем введения в нее склерозирующих веществ, металлических спиралей, электроокклюзией вены током высокой частоты, эндоскопическим лигированием вены. При двустороннем варикоцеле выполняется прерывание кровотока по яичковой вене слева и справа. Реже перевязывают наружную семенную вену или вену с артерией (операция Паломо). В тех случаях, когда причиной левостороннего варикоцеле является венная почечная гипертензия, прерывание ретроградного кровотока осуществляется по центральной вене левого надпочечника.
Крипторхизм. Основной метод лечения — оперативный. Орхипексию необходимо выполнять в более раннем возрасте, до развития необратимых изменений в сперматогенном эпителии. Перспективным сроком оперативного лечения считается возраст до 2-3 лет. Низведение яичек в более позднем возрасте не гарантирует от бесплодия. Тактику консервативного лечения крипторхизма гонадотропными препаратами в надежде на самостоятельное низведение яичек следует считать малоэффективной и неоправданной.
Паховые и пахово-мошоночные грыжи . Особое внимание в хирургической коррекции уделяется минимальной травматизации элементов семенного канатика и выполнению без давления ушивания пахового канала. Выполнение этих вмешательств должно осуществляться хирургом-урологом с целью свести до минимума риск ятрогенного повреждения или иссечения семявыносящего протока.
Врожденные аномалии мочеиспускательного канала (эписпадия и гипоспадия). Пластические операции ставят целью воссоздать мочеиспускательный канал с наружным отвестием на головке, что позволит осуществить эякуляцию интравагинально.
Стриктуры и облитерации мочеиспускательного канала. Оперативное лечение — резекция суженного участка с последующим анастомозом концов уретры с нормальным просветом позволяет добиться адекватной коррекции. Стриктура уретры в последние время ликвидируется эндоскопическим методом.
Обтурационная азооспермия. В генезе этой формы бесплодия лежит непроходимость семявыносящих протоков. Причинами такого состояния могут быть:
- полная или частичная аплазия придатков яичек, семявыносящих протоков, семенных пузырьков;
- приобретенная непроходимость протоков в результате воспалительной обструкции;
- кисты и опухоли придатков яичек, сдавливающие проток придатка яичка;
- ятрогенная непроходимость протоков вследствие хирургических манипуляций в этой области.
Все способы оперативного лечения в зависимости от места наложения анастомоза делятся на 3 основные группы:
- вазо-вазоанастомоз;
- вазоэпидимоанастомоз;
- вазотестикулоанастомоз.
Самым результативным лечением является наложение анастомоза на протяжении протока по типу «конец в конец». При обструкции начальной части семявыносящего протока или протока придатка осуществляется микродиссекции до обнаружения нормального просвета и соединяют проток придатка с просветом семявыносящего протока, используя двухрядный шов. Обычно при этом резецируют зону обструкции (хвост, тело придатка, начальная часть семявыносящего протока). Анастомоз семявыносящего протока с яичком выполняется после резекции придатка в зоне rete testis. При обструкции тазовых отделов семявыносящих путей, крайне редко, из-за серьезного осложнения, обусловленного образованием мочевого свища, анастомозируют семявыносящий проток с мошоночным отделом мочеиспускательного канала.
Среди различных вариантов следует упомянуть анастомоз семявыносящего протока со сперматоцеле и перекрестный анастомоз между семявыносящими протоками или семявыносящим протоком придатком с другой стороны.
К редким видам оперативного лечения при врожденном отсутствии семявыносящего протока, протока и части придатка, непроходимости абдоминальной части семявыносящего протока, нарушении эякуляции, обусловленной параплегией, относится имплантация синтетических резервуаров спермы (искусственное сперматоцеле) в придаток или в подкожный карман выше паховой связки. Полученные сперматозоиды из семясборников с помощью аспирации используются для альтернативых методов лечения (ИСМ, ИКСИ).
Любая терапия начинается с общих организационных и лечебных мероприятий, направленных на устранение бытовых и профессиональных вредностей, нормализацию режима труда, отдыха, питания больного, назначение седативной и антидепрессивной терапии, средств, повышающих антитоксическую функцию печени, витаминотерапию, с лечения сопутствующих заболеваний.
При безуспешном консервативном и хирургическом лечении мужского бесплодия применяются альтернативные методы, к которым относятся:
- инсеминация спермой мужа (ИСМ),
- инсеминация спермой донора (ИСД),
- внутрицитоплазматическая инъекция сперматозоида (ИКСИ), входящая в программу экстракорпорального оплодотворения.
При олиго-, астено- и тератозооспермии используются различные методы капацитации, позволяющие улучшить показатели фертильности спермы и подготовить ее к инсеминации и консервации.
Выбор метода искусственной инсеминации основан на существующих медицинских показаниях.
Показанием для ИСМ является: 1) анатомические и функциональные нарушения репродуктивной системы у мужчин и женщин (эписпадия, преждевременная эякуляция, вагинизм); 2) субфертильные показатели спермы; 3) изолированные нарушения семенной жидкости с нормальными значениями количества и качества сперматозоидов; 4) ретроградная эякуляция при сохраненных нормальных сперматозоидах; 5) иммунологическое бесплодие, обусловленное цервикальным фактором.
Для проведения ИСД показания следующие: 1) инфертильное состояние мужчин, обусловленное аспермией, первичной азооспермией, некро- и тератозооспермией; 2) генетически закодированное носительство доминантно-наследственных заболеваний; 3) ретроградная эякуляция с отсутствием нормальных сперматозоидов.
При серьезных нарушениях репродуктивной функции мужчин, приводящих к критическому снижению концентрации сперматозоидов ( 3 /мл), подвижных и морфологически нормальных форм ( Маргарита 21.04.2014 11:56
источник
Одной из важных причин, вызывающих бесплодие, являются половые инфекции, или, иначе говоря, заболевания, передающиеся половым путем (обозначаются как ЗППП). Особенно это касается вторичного бесплодия, когда один ребенок уже есть, а при попытке планирования второй или последующих беременностей возникают неудачи. Пара обращается за медицинской помощью, а в процессе обследования в половине случаев выясняется, что проблемы с зачатием — следствие инфекционных заболеваний, обычно хронического течения. Не только инфекционные болезни приводят к бесплодию.
Что же это за инфекции, приводящие к бесплодию? Сюда можно отнести инфекционные агенты, являющиеся возбудителями как венерических болезней, так и воспалительных, вызывающих стойкие изменения в репродуктивной сфере мужчин и женщин. Список будет довольно внушительным. К основным из них относятся:
- гонорея;
- сифилис;
- трихомониаз;
- хламидиоз;
- микоплазмоз;
- уреаплазмоз;
- герпетическая инфекция;
- папилломавирус человека;
- паротит;
- гепатит;
- туберкулез и другие.
В отдельную группу ЗППП (ИППП), влияющих на возникновение бесплодия, можно выделить венерические болезни, возбудители которых передаются преимущественно через сексуальный контакт. В нашей стране из их числа особо распространены сифилис, гонорея, хламидиоз, уреаплазмоз, генитальный герпес, причем первые два заболевания считаются исконно венерическими, а остальные — условно венерическими. Они все могут повлиять на бесплодие.
После незащищенного полового контакта с больным человеком происходит заражение, причем для развития болезни должен пройти определенный период времени, который называют инкубационным периодом. Первые признаками, которые замечает заболевший человек, общие для всех половых инфекций. ИППП проявляются:
- повышением температуры тела;
- недомоганием;
- неприятными ощущениями в области гениталий, зудом, жжением;
- выделениями из половых путей;
- высыпаниями (чаще в интимной зоне).
Хламидиоз — наиболее распространенная на сегодня как в мире, так и в нашей стране, условно венерическая 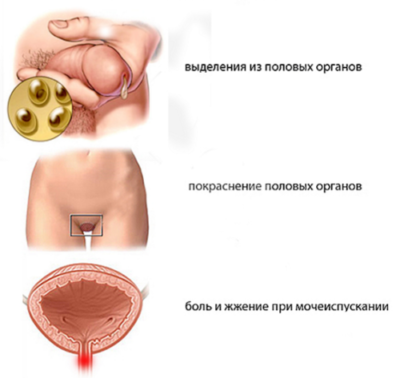
Заболевание в основном поражает урогенитальный тракт, отдаленным последствием чего зачастую является бесплодие. Хламидийная инфекция выявляется более чем у половины пациентов, обратившихся за медицинской помощью по причине бесплодия.
Проявляется болезнь во многих случаях у обоих полов с появления неприятных ощущений в области гениталий, тягучих выделений с заметным запахом. У женщин также отмечается появление хронических тазовых болей тянущего, ноющего характера. Возникают воспалительные изменения матки и придатков у женщин, яичек и предстательной железы у мужчин.
В дальнейшем возникают рубцовые поражения фаллопиевых труб у женщин, семявыводящих путей у мужчин, что приводит бесплодию. Если же беременность наступает на фоне имеющегося хламидиоза, то нередки выкидыши, а у доношенного ребенка значительно повышен риск врожденной хламидийной инфекции.
Уреаплазма и микоплазма — бактериальные инфекции, имеющие, как правило, хроническое течение без особых симптомов, что способствует заражению партнера. Заболевания могут обнаружиться лишь после врачебного осмотра, получения результатов лабораторных обследований, когда у пары беременность не наступает долгий период.
Хламидиоз, уреаплазмоз, микоплазмоз могут одновременно присутствовать в организме человека. Такая комбинация возбудителей достаточно часто встречается, называется микст-инфекцией и требует особого подхода в лечении.
Основные проблемы ЗППП, имеющих бессимптомное течение — это их способность вызывать стойкие изменения в половой сфере, приводящие к бесплодию, спустя месяцы или годы с момента заражения.
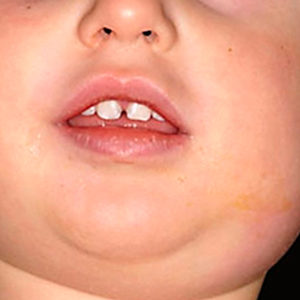
Инфекция вызывает поражение слюнных желез, но особую опасность для репродуктивного здоровья мужчины представляют осложнения, которые могут стать причиной бесплодия, если заражение произошло в период полового созревания. Паротит способен спровоцировать у мальчиков тяжелое воспаление тестикул, приводящие к полной атрофии органа и бесплодию в будущем.
Генитальный герпес — распространенная инфекция, вызывающая жгучие, очень болезненные пузырьковые высыпания в области паха, ануса, на слизистой гениталий. У женщин и мужчин встречается одинаково часто. Особенностью данной ИППП является рецидивирующее течение.
Болезнь нельзя вылечить полностью, время от времени случаются обострения, особенно на фоне слабого иммунитета. Вирус герпеса, однажды попав в организм, остается в нем навсегда.
Сама инфекция и ее проявления не приводит непосредственно к бесплодию, но способна вызывать серьезные патологии плода у беременной женщины. У мужчин возможно развитие простатита и нарушения сперматогенеза.
Репродуктивные способности пары во многом зависят от общего состояния здоровья. В здоровом теле поддерживается оптимальный баланс разных микробов. От качества этого равновесия во многом зависит состояние иммунитета, функциональность многих органов человека. В норме постоянно существующая в организме микрофлора, называемая условно-патогенной, не причиняет вреда здоровью.
К таким микроорганизмам можно отнести:
- стафилококки, стрептококки;
- энтеробактерии;
- дрожжевые грибки рода кандида;
- гарднереллы и другие.
При ослаблении иммунитета, наличии инфекционных, воспалительных заболеваний, при лечении антибиотиками и в некоторых других случаях, такие группы бактерий активизируются и представляют реальный риск гинекологическому здоровью женщины, угрожая бесплодием, вызывая гарднереллез, кандидоз и подобные заболевания.
Генитальный туберкулез встречается относительно редко, в отличие от туберкулезного поражения легких, кишечника, костей, других жизненно важных органов. Инфекция не относится к ЗППП, но вызывая стойкое воспаление матки и, даже чаще, маточных труб, приводит к бесплодию у женщин. Микобактерии туберкулеза попадают в мочеполовую сферу с током крови или лимфы. Именно таким путем инфекция разносится по организму из первичного очага. Сложно поддается лечению.
При обследовании пары, обратившейся к медикам с репродуктивными проблемами, обязательно присутствуют анализы на вирусный гепатит. Существует несколько типов гепатита. Серьезно влияние на способность к зачатию оказывают типы В и С. Инфекция относится к ЗППП, также может передаваться с трансфузией крови и от матери к ребенку. Сохраняется в организме на всю жизнь.
Гепатит поражает печеночную ткань. Токсины, вырабатываемые вирусным агентом, обнаруживаются во всех жидкостных средах человеческого организма, вызывают изменения в составе крови. Заболевание ухудшает транспорт и качество спермы, может снижать вероятность зачатия.
Успешно найти причины проблем с оплодотворением у партнеров и сделать все возможное для их 
Квалифицированные медики-диагносты определяют, есть ли нарушения менструального цикла, и какого характера, проверяют состояние органов малого таза на предмет наличия инфекций и воспаления, степень проходимости фаллопиевых труб у женщин; качество спермы, подвижность сперматозоидов — у мужчин.
О состоянии гормональной системы партнеров, наличии инфекционной составляющей в первичном и вторичном бесплодии пары информирует анализ крови — стандарт обследования.
В случае если подозрения на половые инфекции подтвердятся лабораторным путем, необходимо пройти полный курс лечения, неукоснительно соблюдая предписания врачей. Этого, как правило, достаточно, если воспалительный процесс не принял хронический характер и не нанес необратимых повреждений половым органам. Пока инфекция присутствует в организме, то применение современных вспомогательных репродуктивных технологий (ЭКО, ИКСИ и так далее) не целесообразно.
Если же вследствие инфекционных процессов образовались спайки в малом тазу, то понадобится оперативное вмешательство.
Комплекс консервативных и радикальных мер, современные методы репродуктологов с высокими шансами помогут победить мужское бесплодие. Лапароскопия (все малоинвазивные хирургические вмешательства) способна устранить большую часть женских гинекологических проблем, приводящих к потере фертильности.
Лечение бесплодия — процесс дорогостоящий, небыстрый, требует слаженной кропотливой работы команды врачей и самой пары, но наградой за пережитые испытания станет бесценная радость от рождения долгожданного ребенка.
источник
Осадчий А.В., Кульчавеня Е.В.
ФГБУ «Новосибирский НИИ туберкулѐза» Минздрава России, ГБОУ ВПО «Новосибирский государственный медицинский университет» Минздрава России Эл.почта: urotub@yandex.ru
Актуальность туберкулеза на современном этапе. Согласно данным ВОЗ, около трети населения земного шара инфицированы M. tuberculosis (МБТ). Инфицированный человек имеет риск развития туберкулеза не выше 10%, однако в случае сочетанных заболеваний, таких как сахарный диабет, ВИЧ-инфекция, состояние после трансплантации внутренних органов, а также при ряде вредных привычек (табакокурение) и хроническом недоедании, это риск существенно возрастает [1].
Среди внелегочных форм туберкулеза с начала 20 века 40-56% поражений приходилось на урогенитальный туберкулез (УГТ), однако с 2008 года на лидирующие позиции вышел туберкулез костей и суставов [2-5]. На Украине урогенитальный туберкулез занимает также второе место в структуре внелегочного (после костно-суставного) и составляет 29,5% случаев [6]. По данным некоторых ведущим симптомом генитального туберкулеза является бесплодие [7].
В Японии с 2000 по 2007 годы было диагностировано 355 случаев УГТ, из них нефротуберкулез – у 242 пациентов, туберкулез мужских половых органов – у 90 [8]. П.И. Степанов [9] обследовал 467 больных туберкулезом половых органов мужчин с 1984 по 2008 годы, при этом у 372 (79,7%) пациентов обнаружил туберкулез скротальных органов, туберкулез простаты диагностировал у 398 больных (85,2%); из них у 27 (5,8%) – изолированный [9].
Среди 58 больных туберкулезом предстательной железы жителей Западной Сибири было 38 сельчан и 20 горожан в среднем возрасте 49 лет (54,4 года у городских жителей и 46,7 лет – у сельских). 7 пациентов (12,1%) контактировали с больными туберкулезом людьми или животными; 3 (5,2%) ранее перенесли мочеполовой туберкулез, а 7 (12,1%) – туберкулез других органов и систем. У трех (5,2%) диагностировали изолированный туберкулез простаты (у одного из них диагноз верифицировали бактериологически, а у двух других – патоморфологически, после выполненной в урологических отделениях общей сети чреспузырной аденомэктомии в связи с доброкачественной гиперплазией предстательной железы) [10].
Туберкулез предстательной железы считается редким заболеванием [11], выявляемым как случайная находка при выполнении оперативного вмешательства на простате [12]. Однако в действительности правильнее будет назвать его редко диагностируемым заболеванием. Подтверждают это положение факты обнаружения туберкулеза предстательной железы у каждого третьего больного туберкулезом легких, подвергшегося биопсии простаты по тем или иным причинам, и у 77% мужчин, умерших от туберкулеза любых локализаций [13-16].
Туберкулезу предстательной железы посвящено не так много исследований. В конце прошлого века И.С. Камышан с соавторами [17-18] много внимания уделили совершенствованию диагностики и лечения больных туберкулезом простаты; авторы считали необходимым выполнять биопсию простаты для верификации диагноза. T. Donahue & J. Moul [19] также полагали необходимым в диагностически сложных случаях выполнять биопсию простаты, но подчеркивали, что до настоящего времени не существует консенсуса по методике, зонам забора материала, точках вкола.
Вскользь коснулся этой локализации туберкулеза в своем диссертационном исследовании С.И. Шкуратов [20]. В.М. Куксин [21] полагал обнаружение при проведении трансректального ультразвукового исследования (ТРУЗИ) кальцинатов предстательной железы веским основанием для проведения фтизиоурологического обследования. Он установил, что показатели васкуляризации линейной пиковой скорости ниже 5,8 см/с, линейной динамической скорости – 2,20 см/с, линейной средней скорости 4,00 см/с, пульсационного индекса выше 1,60 у.е., индекса резистентности выше 0,8 у.е., объемного кровотока – 0,009 л/мин, ПСС ниже 0,5 сосуд/см – являются критическими и свидетельствуют о возможном туберкулезном поражении органов половой системы [21].
Медицинская и социальная проблема бесплодия. Бесплодие является проблемой современного общества с растущей актуальностью. По некоторым оценкам 15% пар инфертильны [22-23]. Основные показатели спермограммы в значительной степени подвержены воздействию как экзогенных, так и эндогенных факторов [24]. Выделяют так называемое идиопатическое, первичное бесплодие – без явных внешних повреждающих факторов, и индуцированное, вторичное. Оксидативный стресс, испытываемый вследствие неблагоприятного влияния агрессивной среды, является одним из основных механизмов повреждения спермиев [22; 25-26]. Воспаление предстательной железы также приводит к нарушению качества спермы – в немалой степени за счет оксидативного стресса, продуцируемого продуктами воспаления [27]. Уровень инфертильности больных туберкулезом предстательной железы к настоящему времени не изучен.
Хронический простатит как предпосылка к нарушению репродуктивной функции. Во многих работах приведены доказательства негативного влияния хронического простатита и инфекций урогенитального тракта на качество эякулята [27-30]. Хроническое воспаление ведет к активации перекисного окисления липидов, снижению антиоксидантной функции (возрастает уровень диеновых конъюгат, малондиальдегида, снижается активность каталазы и супероксиддисмутазы), формированию в результате оксидативного стресса, что вызывает снижение фертильности [31]. Гипотезу повреждающего влияния оксидативного стресса на спермии экспериментально подтвердили J.M. Potts и F.F. Pasqualotto [32]. Влияние инфекционно-воспалительных заболеваний предстательной железы на фертильность отмечали и другие исследователи [33].
Вопреки устоявшемуся мнению некоторые исследователи полагают, что взаимосвязь между простатитом и бесплодием у мужчин остается неясной, однако соглашаются, что сопровождающая это заболевание лейкоспермия повышает уровень реактивных форм кислорода в семенной жидкости, вызывает иммунные отклонения, что должно рассматриваться как кофакторы в развитии бесплодия у больных простатитом [34-35].
M. Ludwig et al. [36] полагали, что воспаление и инфекция мужских половых органов являются важными факторами развития инфертильности. Не только простатит, но и эпидидимит, уретрит негативно влияют на оплодотворяющие способности эякулята [37]; особенно сильно выражено это влияние в случае генерализованного поражения органов половой системы мужчин, например, простато-везикуло-эпидидимита [38].
M. Siebels [39] также полагал, что инфекции урогенитального тракта подавляют фертильность мужчин, и отмечал, что в большинстве случаев может быть получен положительный эффект от антибактериальной терапии.
При изучении спермограмм у 71-го пациента с инфекцией репродуктивных органов (хронический бактериальный простатит, хронический эпидидимит, хронический уретрит) была выявлена следующая микрофлора: кишечная палочка (20 больных), клебсиелла (2 человека), протей у одного пациента, энтерококк у 20-и больных, гонококк у 8-и пациентов, хламидия у 16-и мужчин, стафилококк у одного, а у двух пациентов обнаружили микобактерию туберкулеза в дериватах половых желез. У всех этих больных было отмечено достоверное снижение уровня фруктозы и цинка в эякуляте по сравнению со здоровыми, а также меньший объем эякулята [40]. Таким образом, тщательное бактериологическое исследование в отношении всех потенциальных возбудителей позволило у 10% больных хроническими инфекционно-воспалительными заболеваниями половых органов установить туберкулез.
Необходимо считать установленным тот факт, что бактериальная и/или вирусная инфекция мужского репродуктивного тракта может быть причиной бесплодия. Однако обнаруженная микрофлора в эякуляте не всегда является этиологическим фактором воспаления: в семени практически здоровых мужчин находили уреаплазму (10-40%), энтеробактерию (90%) [41]. Бактериоспермия может нарушать морфологию и функцию спермиев и механически препятствовать продвижению их по семявыносящим путям, образуя бактериальнолейкоцитарные, гнойно-некротические сгустки [42].
Секрет простаты в норме обладает антисептическими свойствами за счет высокого содержания лизоцима, что является важным фактором в естественной устойчивости к урогенитальным инфекциям (УГИ). Факторы риска развития УГИ – доброкачественная гиперплазия простаты, различные вмешательства, биопсии [43].
Хронический простатит, особенно с рецидивирующим течением, оказывает неблагоприятное влияние на репродуктивную функцию, поскольку негативно влияет на вязкость эякулята, подвижность спермиев, их жизнеспособность, что было показано в исследовании [30]. Изучали факторы мужского бесплодия во время активного инфекционного воспаления предстательной железы – и пришли к выводу, что цитокины в семенной плазме не связаны с характеристиками эякулята [44]. Напротив, обнаружили, что нормализация концентрации прои антивоспалительных цитокинов улучшает параметры спермограммы [45].
Активность воспаления простаты отражается повышением числа лейкоцитов в ее секрете и в эякуляте. Лейкоспермия (пиоспермия) диагностируется при обнаружении в 1 мл эякулята ≥ 1 млн лейкоцитов при подсчете в камере Горяева при стандартной световой микроскопии [46]. Когда пиоспермия является проявлением активного инфекционно-воспалительного процесса в мужских половых органах, исследователи единодушны в негативной оценке влияния повышенного числа лейкоцитов в эякуляте на подвижность и морфологию спермиев [47-49]. Пиоспермию обнаруживали у 20-29% инфертильных мужчин. Среди лейкоцитов в семенной жидкости преобладали гранулоциты (50-60%), макрофаги составляли 20-30% [50-51].
Выявлена сильная корреляция между концентрацией лейкоцитов в семени и нарушением параметров эякулята [52]. Бактериоспермия была обнаружена у 15%, а пиоспермия – у 19% субфертильных мужчин, причем пиоспермия достоверно чаще ассоциировалась со сниженной концентрацией спермиев, их подвижностью и нарушением морфологии [53].
Хроническая генитальная инфекция может также способствовать выработке антиспермальных антител – еще один фактор бесплодия. Здоровая семенная плазма обладает выраженным антивоспалительным действием, в первую очередь обусловленным высоким содержанием лизоцима, поэтому при простатите и везикулите пиоспермия носит транзиторный характер, для ее выявления необходимы повторные исследования [54].
Присутствие ряда микроорганизмов в эякуляте (Escherichia coli, Ureaplasma urealyticum, Mycoplasma hominis and Chlamydia trachomatis) способствует агглютинации спермиев [55]; в другом исследовании было показано токсическое действие Escherichia coli на спермии [56].
Среди 179 бесплодных мужчин у 23% выявили пиоспермию; все параметры эякулята (число спермиев, доля подвижных форм, вязкость и т.д.) были у больных с пиоспермией ниже. Причем у мужчин с преобладанием в лейкоцитарной формуле моноцитов и макрофагов отмечали снижение объема эякулята; у пациентов с преобладанием Т-лимфоцитов снижалась вязкость спермы, а превалирование гранулоцитов коррелировало со снижением объема, уменьшением числа спермиев и их подвижных форм [57].
Лейкоциты нарушают поступательное движение спермия и препятствуют пенетрации овоцита in vitro [54]. Предполагается, что основной источник пиоспермии – придаток яичка. Подтверждением этой гипотезы служит факт редкого обнаружения пиоспермии у мужчин, перенесших вазэктомию. Лейкоциты могут попадать в эякулят и с секретом простаты при ее воспалении. По данным Н. Wolff [51], до 80% образцов эякулята с высоким числом лейкоцитов не дали роста микрофлоры. Автор делает заключение, что у этих пациентов был абактериальный простатит и в таком случае следует исключать туберкулез и ИППП, например, хламидиоз. Туберкулез предстательной железы всегда сопровождается пиоспермией [58-60].
Влияние туберкулеза на репродуктивную функцию мужчин. Наиболее сильное отрицательное влияние на оплодотворяющую способность эякулята оказывают инфекции, передаваемые половым путем, а также туберкулез. Туберкулез, в целом, является одной из ведущих причин бесплодия – как мужского, так и женского, и, быть может, именно поэтому редки случаи врожденного туберкулеза [47].
Туберкулез мужских половых органов (ТБМПО) включает в себя [61]:
- Туберкулѐзный эпидидимит (одноили двусторонний).
- Туберкулѐзный орхоэпидидимит (одноили двусторонний).
- Туберкулѐз предстательной железы (инфильтративная форма или кавернозная).
- Туберкулѐз семенных пузырьков.
- Туберкулѐз полового члена.
В качестве осложнений туберкулеза мужских половых органов выделяют: свищи мошонки и промежности, бесплодие, сексуальную дисфункцию [61].
Наиболее частой (58-78%) локализацией туберкулеза мужских половых органов является придаток яичка [62-64, 66]; двусторонний процесс закономерно завершается обструктивным бесплодием, которое далеко не всегда разрешается на фоне противотуберкулезной химиотерапии [64]. Туберкулезный орхит развивается реже, возможно, благодаря гемато-тестикулярному барьеру [65]. Вовлечение яичка означает генерализацию туберкулезного воспаления, и, как правило, требует хирургического вмешательства.
Туберкулезный эпидидимит может манифестировать остро, протекать торпидно или бессимптомно, когда поводом для обращения к врачу является бесплодие. Острое воспаление проявляется болью, отеком и уплотнением мошонки, и встречается у 40% больных туберкулезным орхоэпидидмитом [64]. Нередко развивается абсцедирование мошонки [62].
В случае подострого и хронического течения заболевание выявляют случайно путем обнаружения очагового уплотнения в мошонке; туберкулез верифицируют обычно патоморфологически после биопсии или эпидидимэктомии [67]. При ультразвуковом исследовании (УЗИ) у больных туберкулезным эпидидимитом обнаруживают эхогенную неоднородность ткани с очагами обызвествления [65, 68]. УЗИ мошонки выявляет диффузные гипои гиперэхогенные изменения структуры тканей придатка. На примере 18-и больных туберкулезным эпидидимитом установили, что активное воспаление визуализируется как бессосудистое уплотнение; гнойно-некротическое расплавление ткани, деструкция выражаются в появлении наряду с участками повышенной эхоплотности зон разряжения [65].
Туберкулѐз предстательной железы всегда считался заболеванием, необычайно трудным для ранней диагностики в силу отсутствия характерных клинических и лабораторных проявлений, а также не высокой частоты обнаружения микобактерии туберкулѐза в секрете простаты и/или эякуляте – а результаты лечения больных туберкулѐзом напрямую зависят от своевременности диагностики [59, 69]. Основной момент, на который следует обратить внимание урологу общей лечебной сети, это пиоспермия.
Туберкулез предстательной железы может передаваться половым путем. У больных туберкулезом легких M. tuberculosis в эякуляте обнаруживали редко (0,08% случаев), однако при сочетании туберкулеза с гепатитами В и С M. tuberculosis в эякуляте обнаруживали уже у 19% пациентов, а в секрете простаты – у 13% больных. При сочетанном течении туберкулеза, гепатита и сифилиса частота выявления МБТ в эякуляте возрастала до 49%, в секрете – до 44% [70].
П.И. Степанов [9] только у 3,1% больных ТБМПО обнаружил сохраненную фертильность, у всех пациентов была снижена копулятивная функция.
Доказано, что туберкулезный эпидидимит ведет к бесплодию [71-72], поскольку способствует рубцеванию семявыносящих путей, а при неблагоприятном течении болезни может завершиться потерей органа. Описан случай азооспермии после излечения урогенитального туберкулеза с исходом в кальцификацию семенных пузырьков [73]. В приведенном клиническом наблюдении для экстракорпорального оплодотворения спермий был получен путем пункции яичка.
На ранних стадиях туберкулез мужских половых органов может быть излечен химиотерапией; при запоздалой диагностике негативные последствия неизбежны [74].
Бесплодие редко проявляется у больных в острой стадии урогенитального туберкулеза, обычно это следствие его осложнений, избыточной фибротизации. Нередко генерализованный туберкулез манифестирует острым эпидидимитом – и прочие локализации, в том числе туберкулез легких, выявляют позже [75].
Бесплодие может быть самым первым симптомом, побуждающим пациента обратиться к врачу; в ходе обследования диагностируют туберкулез [76]. Подобный случай [75] описан у больного с бесплодием, была обнаружена пиоспермия, что послужило основанием к бактериологическому исследованию, выявившему МБТ.
B.S. Viswaroop et al. [64] нашли, что ТБМПО осложняется бесплодием в 10% случаев. Если туберкулез мочеполовой системы диагностирован на ранней стадии – химиотерапия может оказаться эффективной не только в отношении специфического воспаления, но и в отношении восстановления фертильности. Так, R.S. Shah [77] описывал 10 больных туберкулезным эпидидимитом с азооспермией на момент выявления; к окончанию терапии у всех мужчин появились спермии в эякуляте.
Четкообразное уплотнение vas deferens – один из характерных признаков туберкулеза мужских половых органов; предполагается, что деферентит развивается за счет ретроградного рефлюкса мочи [78].
Семенные пузырьки и выводные протоки простаты изолированно туберкулезом не поражаются. Воспаление и обструкция семявыбрасывающих протоков препятствуют попаданию в эякулят спермиев, а также приводят к снижению уровня фруктозы, необходимой для обеспечения подвижности спермиев [68]. Обструкция семявыносящих протоков вследствие туберкулеза вызывает расширение их проксимальных отделов. В дифференциально-диагностическом ряду на первом месте стоит ретроградная эякуляция, которая легко исключается при исследовании мочи, выпущенной после эякуляции [68].
Азооспермия при ТБМПО может быть и следствием обызвествления семенных пузырьков как исхода туберкулезного воспаления. Сообщали [79] о 33летнем больном, у которого в анамнезе была нефрэктомия по поводу туберкулеза, после чего в течение 10 лет отмечалось бесплодие. При ректальном исследовании определяли очаговое уплотнение простаты и увеличение семенных пузырьков; в пунктате семенных пузырьков секрет не был обнаружен [79].
В целом, для туберкулеза половых органов характерной считается атрофия, фибротизация семенных пузырьков с обструкцией семявыносящих протоков. J. Paick et al. [80] проанализировали данные 50-и мужчин, подвергнутых трансуретральной резекции (ТУР) семявыбрасывающих протоков в связи с бесплодием. У 17-и из них во время трансректального ультразвукового исследования (ТРУЗИ) выявляли атрофию семенных пузырьков, 15 из этих мужчин ранее болели туберкулезом легких. Подобные результаты были получены и другими авторами [81].
При ретроспективном анализе 69 историй болезни больных туберкулезом мужских половых органов было установлено, что эпидидимит диагностировали у 78,3% больных, из них у 68,1% односторонний. У 40,6% больных были обнаружены патологические изменения в эякуляте. 36,2% пациентов имели также туберкулез других локализаций [63].
F. Sole-Balcells [82] ожидаемо обнаружил снижение качества эякулята у всех больных половым туберкулезом, но и у 75% больных нефротуберкулезом также была выявлена олигоастенозооспермия. Данный вывод подчеркивает факт, что большой пласт больных ТБМПО остается недиагностированным; заболевание выявляют только на стадии развития осложнений.
Проблема влияния туберкулеза легких и противотуберкулезной химиотерапии на сексуальную функцию частично была раскрыта в работах М.Н. Щербаня [83-84]. Автор установил, что воспалительные изменения в эякуляте и секрете предстательной железы зарегистрированы значительно чаще у больных туберкулезом легких, чем у здоровых, особенно у больных фиброзно-кавернозным туберкулезом легких. На фоне проведенного противотуберкулезного лечения уровень лейкоцитоза в эксприматах половых желез у больных инфильтративным туберкулезом легких уменьшился, а у пациентов с фиброзно-кавернозным туберкулезом остался прежним. Было показано, что туберкулезный процесс в легких снижает уровень сперматозоидов у больных, причем более выраженное уменьшение отмечено у пациентов с фиброзно-кавернозным туберкулезом. На фоне проведенного противотуберкулезного лечения только у пациентов с инфильтративным туберкулезом легких отмечена положительная динамика. Включение в комплекс лечебных процедур простатотропной терапии (афала, простанорм, витапрост) позволило добиться статистически достоверного увеличения общего количества сперматозоидов как у больных с инфильтративным, так и с фиброзно-кавернозным туберкулезом легких [83-85].
Пути повышения эффективности этиотропной терапии больных туберкулезом половых органов мужчин.
Предстательная железа – сложный орган для проникновения и накопления антибиотиков, что сужает их выбор. Поэтому необходимо лечение больных хроническим простатитом проводить длительно, высокими дозами антибактериальных препаратов. При остром простатите хорошее накопление в паренхиме железы отмечено у цефалоспоринов, аминогликозида, карбопенемов. Среди фторхинолонов, создающих наиболее высокую концентрацию в ткани простаты, оптимальными являются офлоксацин, ципрофлоксацин и левофлоксацин. Левофлоксацин предпочтительнее прочих, так как лучше переносится, создает более высокую концентрацию в паренхиме железы, применяется всего один раз в сутки [86].
Изолированная антибактериальная терапия малоэффективна при хроническом бактериальном простатите, необходимо воздействие на разные звенья патогенеза – уменьшить отек ткани, улучшить кровообращение, устранить спазм гладкомышечных элементов простаты [58].
Для повышения насыщения паренхимы предстательной железы антибактериальными препаратами применялись фитотерапия, энзимотерапия, локальное низкоинтенсивное лазерное излучение, лимфотропное введение противотуберкулезных препаратов, однако не оценено их влияние на качество эякулята [8790].
Камышан с соавт. [91] с целью повышения эффективности лечения больных туберкулезом простаты предлагал проводить гальванизацию перинеальной области, рифампицин и изониазид назначал в суппозиториях с димексидом. Авторы полагали, что сочетанное применение электрофореза и ректального введения противотуберкулезных препаратов с димексидом может быть успешным у 80,7-96,6% пациентов.
Трудно сопоставлять результаты разных авторов, поскольку в исследование включены, как правило, небольшое количество разнородных пациентов. Так, наблюдали 18 больных туберкулезом простаты (средний возраст 66,7±10,2 лет); у каждого третьего был повышен уровень простатоспецифического антигена (ПСА) – от 4 до 31 нг/мл, хотя средняя цифра была в пределах нормы (2,7). Пациенты принимали рифампицин, этамбутол и изониазид в среднем в течение 7,5 мес. При контрольном обследовании, которое проводилось в сроки от 1 до 9 лет, пациентам выполняли биопсию простаты. На том основании, что в биоптатах не обнаружена МБТ (хотя присутствовали признаки воспаления), и снизился уровень ПСА, авторы делают вывод, что лечение было успешным [92].
W. Krafft & E. Carstensen [93] полагали, что пероральная терапия больных туберкулезом простаты эффективна лишь у каждого пятого. Авторы практиковали трансперинеальное введение в паренхиму железы 1,0 стрептомицина и 0,1 изониазида дважды в неделю в течение 4-5 недель. Таким образом были пролечены 90 пациентов. Авторы заключают, что метод обкалывания простаты хорошо переносится, но не приводят убедительных доказательств его более высокой эффективности. Тем не менее, они подчеркивают необходимость локальных инъекций, особенно больным кавернозным туберкулезом простаты [93].
Только 21,7% больных туберкулезом предстательной железы были излечены при помощи туберкулостатиков, а у 78,3% заболевание приобрело хроническое прогрессирующее течение. Вместе с тем проведение курса локальной низкоинтенсивной лазеротерапии на область простаты существенно улучшало результаты лечения. При пальпации железы в динамике отмечалось уменьшение ее размеров, улучшение тонуса, прекращение болезненности. Санация секрета простаты достигнута у 22 (62,8%) пациентов, прекращение бактериовыделения и симптомов интоксикации – в 100% случаев. Также на фоне лазеротерапии было отмечено повышение уровня лизоцима в секрете предстательной железы в среднем до 6,7 мкг/мл [89].
Инфекционно-воспалительный процесс в предстательной железе любой этиологии, а особенно – обусловленный M.tuberculosis, неизбежно ведет к избыточному фиброзированию и хронизации воспаления. Эпителий простаты препятствует проникновению в паренхиму значительного числа антибиотиков, а склеротические процессы и сопряженное с ними нарушение микроциркуляции еще больше затрудняет лечение больных ХП. Именно эти два момента обусловливают необходимость проведения патогенетической терапии больных ХП, особенно в случае развития осложнений, например, бесплодия.
Соответственно, в патогенетической терапии больных хроническим простатитом наибольшее применение нашли антиоксиданты и препараты, улучшающие микроциркуляцию, обеспечивающие противовоспалительный эффект.
В функционировании репродуктивной системы огромное значение имеет баланс микроэлементов, в первую очередь селена и цинка, а также достаточное насыщение организма витаминами А и Е [94]. Селен входит в состав многих ферментов и гормонов, поддерживает активность гуморального и клеточного иммунитета, влияет на репродуктивную функцию; накапливается в паренхиме гонад [95].
Цинк – кофактор большой группы ферментов, необходимых для протекания метаболических процессов [9]. Экзогенный дефицит цинка возникает при заболеваниях, сопровождающихся интенсивным размножением микроорганизмов, потребляющих цинк. МБТ персистирует преимущественно в фагосомах макрофагов, препятствуя их слиянию с лизосомами. Высказано предположение, что в немалой степени это обусловлено тем, что в процессе эволюции у МБТ сформировалась способность эффективно использовать питательные ресурсы эукариотических клеток, в том числе ионы металлов [96].
Цинк является антиоксидантом, его недостаток так же, как и недостаток селена может быть причиной идиопатического мужского бесплодия. Выявлена ассоциация табакокурения и инфертильности мужчин; авторы объясняют это тем, что курение понижает уровень цинка в эякуляте [97].
Содержание цинка резко снижается не только при простатите, но и при других заболеваниях предстательной железы [98]. При раке простаты уровень цинка в ее паренхиме снижался на 83%, при доброкачественной гиперплазии предстательной железы – на 61% [99]. Y.F. Zhang & C.Z. Liang [100] соглашаются, что ХП негативно влияет на качество спермы, в значительной степени из-за недостатка цинка.
А.В. Сивков с соавт. [101] обнаружили увеличение объема эякулята на 39%, и числа сперматозоидов – на 56% после месячного приема селцинка. Однако влияние Селцинк Плюс на репродуктивную функцию больных туберкулезом предстательной железы изучено не было.
Резюме. Несмотря на положительные эпидемические тенденции последних лет, туберкулез остаѐтся важной медицинской и социально-демографической проблемой. Большое число больных туберкулѐзом простаты среди больных туберкулѐзом органов дыхания остаѐтся недовыявленным: у каждого третьего при биопсии простаты получено патоморфологическое подтверждение специфического поражения предстательной железы, хотя клинически заболевание установлено не было. У 77% мужчин, умерших от туберкулеза всех локализаций, при аутопсии также обнаружили туберкулез простаты, как правило, прижизненно не диагностированный.
Хроническое воспаление предстательной железы – как неспецифической, так и туберкулезной этиологии, резко понижает качество эякулята, что в условиях исходно невысокого уровня фертильности в популяции может иметь драматические последствия.
Многочисленные исследования, посвященные бесплодию у больных туберкулезом мужчин, касаются преимущественно заболевания наружных половых органов, инфертильность объясняют обтурацией семявыносящих путей – инфекционно-воспалительной природы, или рубцово-деформирующими изменениями как результат заболевания. Бесплодие может быть самым первым симптомом, побуждающим пациента обратиться к врачу; в ходе обследования диагностируют туберкулез. Но влияние туберкулеза предстательной железы на функциональные показатели эякулята не изучено.
Показано позитивное влияние препаратов селена и цинка на качество эякулята у больных хроническим неспецифическим простатитом, при идиопатическом бесплодии, однако никем не изучена эффективность их комплексного применения при туберкулезе предстательной железы. Также не установлен оптимальный в отношении эффективности и безопасности способ введения противотуберкулезных препаратов при туберкулезе предстательной железы.
1. WHO. Fact sheet N°104, Reviewed March 2014, available on http://www.who.int/mediacentre/factsheets/fs104/en/
2. Жукова И.И. Туберкулез мочеполовой системы сегодня /И.И. Жукова, Е.В. Кульчавеня, Д.П. Холтобин, Е.В. Брижатюк, В.Т. Хомяков, А.В. Осадчий //Урология. – 2013. № 1. – С. 13-16
3. Кульчавеня Е.В. Современные тенденции эпидемической ситуации по внеторакальному туберкулезу. /Е.В. Кульчавеня, В.А. Краснов, С.Н. Скорняков, К. Мукамбаев, О.Н. Зубань, Д. П. Холтобин //Туберкулѐз и болезни лѐгких. – 2013.-№ 12.– С. 34-38.
4. Ревякина О.В. Основные показатели противотуберкулезной деятельности в Сибирском и Дальневосточном Федеральных округах. /О.В.Ревякина, Т.В. Алексеева, Г.С. Мурашкина, И.В. Павленок: Новосибирск; 2013. 89с.
5. Туберкулез в Российской Федерации, 2011 год. Аналитический обзор статистических показателей используемых в Российской Федерации и в мире. М.; 2013. 280с.
6. Степанов П.И. Актуальные вопросы патогенеза туберкулеза половых органов у мужчин. / П.И. Степанов //Урология, 2014. № 2. – С. 36-39.
7. García-López S.J., Pérez-Martínez A., Chávez-Martínez S., Sereno-Coló J.A. Genital tuberculosis and pregnancy to term. Case report. Ginecol Obstet Mex. 2014 Apr;82(4):261-7. ВЕС
8. Nakane K., Yasuda M., Deguchi T., Takahashi S., Tanaka K., Hayami H., Hamasuna R., Yamamoto S., Arakawa S., Matsumoto T. Nationwide survey of urogenital tuberculosis in Japan. Int J Urol. 2014 Jul 14. doi: 10.1111/iju.12549.
9. Степанов П.И. Структура поражения половых органов мужчин туберкулезом. / П.И. Степанов //Туберкулез и болезни легких, 2014. № 3. – С. 47-53.
10. Kulchavenya E. Male genital tuberculosis: epidemiology and diagnostic/ E. Kulchavenya, Chul-Sung Kim, O. Bulanova, I. Zhukova // World J Urol (2012) 30:15–21.
11. Sánchez Sánchez E., Fernández González I., Ruiz Rubio J.L., Herrero Payo A., Romero Cajigal I., Aramburu Gonzalez A., Antonio Moreno J., Berenguer Sánchez A. Transrectal echography in tuberculous prostatitis Arch Esp Urol. 1994 Dec;47(10):1016-8.
12. Ludwig M., Velcovsky H.G., Weidner W. Tuberculous epididymo-orchitis and prostatitis: a case report. Andrologia. 2008 Apr;40(2):81-3. doi: 10.1111/j.14390272.2007.00824.x.
13. Брижатюк Е.В. Биопсия простаты в диагностике туберкулеза предстательной железы /Е.В. Брижатюк, Е.В. Кульчавеня, А.А. Баранчукова, М.Н. Щербань //Современные вопросы урологии, андрологии, репродуктивной медицины: материалы. – Новосибирск, 2008. – с. 56.
14. Камышан И.С. Руководство по туберкулезу урогенитальных органов / И.С. Камышан– Киев, 2003. – 212 с.
15. Brizhatyuk E. Transrectal ultrasound guided biopsies in diagnostics of prostate tuberculosis / E. Brizhatyuk, A. Baranchukova, E. Kulchavenya // Europ. Resp. J.Vol. 32. Suppl. 52.Oct. 2008. – abs. 2446
16. Miletic B., Morovic M., Tomic Z., Ticac B. Tuberculous orchiepididymitis and CNS complication. Aktuelle Urol. 2006 Jan;37(1):67-8.
17. Камышан И.С. Туберкулез предстательной железы. / И.С.Камышан, С.Т. Бязров, В.И. Погребинский //Урология и нефрология, 1986 г.№ 2.с.65-71.
18. Камышан И.С. Роль биопсии предстательной железы у больных туберкулезом органов мочеполовой системы. / И.С.Камышан, С.Т. Бязров, В.И. Погребинский //Урология и нефрология, 1988 г.№ 2.с. 12-15
19. Donahue T., Moul J. Diagnostic accuracy of prostate needle biopsy. Curr Urol Rep. 2002 Jun;3(3):215-21.
20. Шкуратов С.И. Диагностика и лечение туберкулеза половых органов у мужчин: Автореф. дисс.к.м.н. – Москва, 1987 -18 c.
21. Куксин В.М. Дифференциальная диагностика туберкулеза предстательной железы: Автореф. дисс.к.м.н. – Новосибирск, 2002 -19 c.
22. Agarwal A., Virk G., Ong C., du Plessis S.S. Effect of oxidative stress on male reproduction. World J Mens Health. 2014 Apr;32(1):1-17. doi: 10.5534/wjmh.2014.32.1.1. Epub 2014 Apr 25.
23. Witkowska-Zimny M., Gunerka A., Wietrak E., Południewski G., LewStarowicz Z. Verification of the effectiveness of the dietary supplementation in infertility treatment. Pol Merkur Lekarski. 2013 Dec;35(210):347-51.
24. Нашивочникова Н.А. Эффективность спематона при мужском бесплодии. / Н.А. Нашивочникова, В.Н. Курпин, С.А. Селиванова //Урология, 2014. № 2. – С. 52-54.
25. Chen S.J, Allam J.P., Duan Y.G., Haidl G. Influence of reactive oxygen species on human sperm functions and fertilizing capacity including therapeutical approaches. Arch Gynecol Obstet. 2013 Jul;288(1):191-9. doi: 10.1007/s00404-0132801-4. Epub 2013 Mar 30.
26. Lombardo F., Fiducia M., Lunghi R., Marchetti L., Palumbo A., Rizzo F., Koverech A., Lenzi A., Gandini L. Effects of a dietary supplement on chronic pelvic pain syndrome (Category IIIA), leucocytospermia and semen parameters. Andrologia. 2012 May;44 Suppl 1:672-8. doi: 10.1111/j.1439-0272.2011.01248.x. Epub 2011 Nov 7.
27. Спивак Л.Г. α1 – Адреноблокаторы в в лечении хронического простатита и связанных с ним нарушений фертильности / Л.Г. Спивак //Consilium Medicum (урология/нефрология), 2014. – т.16. № 7. – с. 8-10.
28. Goodarzi D., Cyrus A., Baghinia M.R., Kazemifar A.M., Shirincar M. The efficacy of zinc for treatment of chronic prostatitis. Acta Med Indones. 2013 Oct;45(4):259-64.
29. Vicari E., Calogero A.E., Condorelli R.A., Vicari L.O., La Vignera S. Male accessory gland infection frequency in infertile patients with chronic microbial prostatitis and irritable bowel syndrome: transrectal ultrasound examination helps to understand the links. J Androl. 2012 May-Jun;33(3):404-11. doi: 10.2164/jandrol.111.014654. Epub 2011 Aug 25
30. Zhao H., Shen J.H., Chen Y.P., Yu Z.Y., Dong Q., Li H. Changes of seminal parameters, zinc concentration and antibacterial activity in patients with noninflammatory chronic prostatitis/chronic pelvic pain syndrome. Zhonghua Nan Ke Xue. 2008 Jun;14(6):530-2.
31. Tsiporenko S.Iu. Influence of Hepatomax on male fertility. Fiziol Zh. 2013;59(3):119-25.
32. Potts J.M., Pasqualotto F.F. Seminal oxidative stress in patients with chronic prostatitis. Andrologia. 2003 Oct;35(5):304-8.
33. Rusz A., Pilatz A., Wagenlehner F., Linn T., Diemer T., Schuppe H.C., Lohmeyer J., Hossain H., Weidner W. Influence of urogenital infections and inflammation on semen quality and male fertility. World J Urol. 2012 Feb;30(1):23-30. doi: 10.1007/s00345-011-0726-8. Epub 2011 Jul 12. Review.
34. Осадчук Л.В. Уровень фрагментации ДНК в сперматозоидах человека при варикоцеле и простатите. / Л.В. Осадчук, А.А. Еркович, Д.А. Татару и др. //Урология, 2014. № 3. – С. 37-43.
35. Atig F., Raffa M, Habib B.A., Kerkeni A., Saad A., Ajina M. Impact of seminal trace element and glutathione levels on semen quality of Tunisian infertile men. BMC Urol. 2012 Mar 19;12:6. doi: 10.1186/1471-2490-12-6.
36. Ludwig M., Dimitrakov J., Diemer T., Huwe P., Weidner W. Prostatitis syndrome. Changes in the ejaculate and effects on fertility. Urologe A. 2001 Jan;40(1):18-23.
37. Weidner W., Krause W., Ludwig M. Relevance of male accessory gland infection for subsequent fertility with special focus on prostatitis. Hum Reprod Update. 1999 Sep-Oct;5(5):421-32.
38. Vicari E., La Vignera S., Castiglione R., Calogero A.E. Sperm parameter abnormalities, low seminal fructose and reactive oxygen species overproduction do not discriminate patients with unilateral or bilateral post-infectious inflammatory prostato-vesiculo-epididymitis. J Endocrinol Invest. 2006 Jan;29(1):18-25.
39. Siebels M. Urogenital infections in the male and the desire to father a child. MMW Fortschr Med. 2003 May 29;145(22):37-9.
40. Marconi M., Pilatz A., Wagenlehner F., Diemer T., Weidner W. Impact of infection on the secretory capacity of the male accessory glands. Int Braz J Urol. 2009 May-Jun;35(3):299-308; discussion 308-9.
41. Keck C., Gerber-Schäfer C., Clad A., Wilhelm C., Breckwoldt M. Seminal tract infections: impact on male fertility and treatment options. Gynecol Obstet Fertil. 2012 Apr;40(4):226-34. doi: 10.1016/j.gyobfe.2012.01.003. Epub 2012 Mar 3.
42. Boitrelle F., Robin G., Lefebvre C., Bailly M., Selva J., Courcol R., Lornage J., Albert M. Bacteriospermia in Assisted Reproductive Techniques: effects of bacteria on spermatozoa and seminal plasma, diagnosis and treatment. Fertil Steril. 2012 May;97(5):1050-5. doi: 10.1016/j.fertnstert.2012.01.124. Epub 2012 Feb 16.
43. Wagenlehner F.M., Weidner W., Pilatz A., Naber K.G. Urinary tract infections and bacterial prostatitis in men. Curr Opin Infect Dis. 2014 Feb;27(1):97-101. doi: 10.1097/QCO.0000000000000024.
44. Pilatz A., Hudemann C., Wagenlehner F., Schuppe H.C., Diemer T., Weidner W., Renz H., Bschleipfer T. Seminal cytokines: is quantification useful in urogenital disorders? Urologe A. 2013 Mar;52(3):359-66. doi: 10.1007/s00120-013-3141-5.
45. Tsiporenko S.Iu, Loskutova I.V. Influence of phytotherapy on proand antioxidant status in spermatozoa, seminal plasma and immunologic status of sperm in men with chronic inflammation of the urogenital tract complicated by infertility. Lik Sprava. 2013 Jul-Aug;(5):102-10.
46. World Health Organization DoRHaR (2010) WHO laboratory manual for the examination and processing of human semen. In 5th (ed) Geneva, Switzerland
47. Flibotte J.J., Lee G.E., Buser G.L., Feja K.N., Kreiswirth B.N., McSherry G.D., Nolan S.M., Tolan R.W. Jr, Zhang H. Infertility, in vitro fertilization and congenital tuberculosis. J Perinatol. 2013 Jul;33(7):565-8. doi: 10.1038/jp.2012.146.
48. Perletti G., Marras E., Wagenlehner F.M., Magri V. Antimicrobial therapy for chronic bacterial prostatitis. Cochrane Database Syst Rev. 2013 Aug 12;8:CD009071. doi: 10.1002/14651858.CD009071.pub2.
49. Oluboyo A.O., Adijeh R.U., Onyenekwe C.C., Oluboyo B.O., Mbaeri T.C., Odiegwu C.N., Chukwuma G.O., Onwuasoanya U.F. Relationship between serum levels of testosterone, zinc and selenium in infertile males attending fertility clinic in Nnewi, south east Nigeria. Afr J Med Med Sci. 2012 Dec;41 Suppl:51-4.
50. Stanislavov R. Leukocytes in human seminal fluid. Akush Ginekol (Sofiia). 1999;38(3):20-1.
51. Wolff H. Methods for the detection of male genital tract inflammation. Andrologia. 1998;30 Suppl 1:35-9.
52. Yanushpolsky E.H., Politch J.A., Hill J.A., Anderson D.J. Is leukocytospermia clinically relevant? Fertil Steril. 1996 Nov;66(5):822-5.
53. Domes T, Lo K.C., Grober E.D., Mullen J.B., Mazzulli T., Jarvi K. The incidence and effect of bacteriospermia and elevated seminal leukocytes on semen parameters. Fertil Steril. 2012 May;97(5):1050-5. doi: 10.1016/j.fertnstert.2012.01.124. Epub 2012 Feb 16.
54. Wolff H. The biologic significance of white blood cells in semen. Fertil Steril. 1995 Jun;63(6):1143-57.
55. Diemer T., Huwe P., Ludwig M., Hauck E.W., Weidner W Urogenital infection and sperm motility. Andrologia 2003 35:283–287.
56. Diemer T., Huwe P., Michelmann H.W. Escherichia coli-induced alterations of human spermatozoa. An electron microscopy analysis. Int J Androl 2000 23:178– 186.
57. Wolff H., Politch J.A., Martinez A., Haimovici F., Hill J.A., Anderson D.J. Leukocytospermia is associated with poor semen quality. Fertil Steril. 1990 Mar;53(3):528-36.
58. Кульчавеня Е.В. Простатит. Диагностика и лечение: руководство / Е.В. Кульчавеня, А.И. Неймарк. – М.:ГЭОТАР-Медиа, 2010. – 256с.: ил. (Библиотека врача-специалиста).
59. Кульчавеня Е.В. Избранные вопросы фтизиоурологии / Е.В. Кульчавеня, В.А. Краснов. – Новосибирск: Наука, 2010. – 142 с., [0,25] л. вкл.
60. Kulchavenya E. Diagnosis and therapy for prostate tuberculosis / E. Kulchavenya, E. Brizhatyuk, V. Khomyakov // Therapeutic Advances in Urology, 2014; Vol 6 (4): 129-134.
61. Кульчавеня Е.В. Классификация, клиническая картина и диагностика туберкулеза мочевой системы / Е. В. Кульчавеня, А. А. Баранчукова // Медицина и образование в Сибири: эл. ресурс. – 2013 № 5. (http://www.ngmu.ru/cozo/mos/article/text_full.php? >
62. Orakwe J.C., Okafor P.I. Genitourinary tuberculosis in Nigeria: A review of thirty-one cases. Niger J Clin Pract. 2005;8:69–73.
63. Tzvetkov D., Tzvetkova P. Tuberculosis of male genital system—myth or reality in 21st century. Arch Androl. 2006;52:375–81.
64. Viswaroop B.S., Kekre N., Gopalakrishnan G. Isolated tuberculous epididymitis: A review of forty cases. J Postgrad Med. 2005;51:109–11.
65. Chung J.J., Kim M.J., Lee T., Yoo H.S., Lee J.T. Sonographic findings in tuberculous epididymitis and epididymo-orchitis. J Clin Ultrasound. 1997;25:390–4.
66. Lenk S., Schroeder J. Genitourinary tuberculosis. Curr Opin Urol. 2001;11:93–8.
67.Jayanti Mania-Pramanik, Shilpa Kerkar, Shobha Sonawane, Pratibha Mehta, and Vinita Salvi. Current Chlamydia trachomatis Infection, A Major Cause of Infertility. J Reprod Infertil. 2012 Oct-Dec; 13(4): 204–210.
68. Kumar R., Hemal A.K. Bilateral epididymal masses with infertility. ANZ J Surg. 2004;74:391. Kumar R, Thulkar S, Kumar V, Jagannathan NR, Gupta NP. Contribution of investigations to the diagnosis of congenital vas aplasia. ANZ J Surg. 2005;75:807–9.
69. Кульчавеня Е.В. Алгоритм диагностики туберкулеза предстательной железы / Е.В. Кульчавеня, Е.В. Брижатюк, А.А. Баранчукова, А.Г. Чередниченко, И.П. Климова //Туберкулез и болезни легких, 2014.№5. С. 10-15.
70. Афонин А.В. Туберкулезная инфекция, как инфекция, передаваемая половым путем / А.В. Афонин, Е.О. Перецманас, Е.Е. Топоркова, Е.П. Ходаковский //Вестник последипломного мед. образования. 2006. № 3-4. – С. 69-71.
71. Colino M., Escandon S., Gomez G. et al. Tuberculous epididymitis caused by Mycobacterium bovis Arch. Esp. Urol. 2003: Vol. 56. N 2; 175-178.
72. Fraietta R., Mori M.M., De Oliveira J.M., Cedenho A.P., Srougi M. Tuberculosis of seminal vesicles as a cause of aspermia. J Urol. 2003;169:1472.
73. Kondoh N., Fujimoto M., Takeyama M., Nakamura Y., Kitamura M., Matsumiya K., et al. Treatment of azoospermic patient with genitourinary tuberculosis: A case report. Hinyokika Kiyo. 1999;45:199–201.
74. Gueye SM, Ba M, Sylla C, Ndoye AK, Fall PA, Diaw JJ, et al. Epididymal manifestations of urogenital tuberculosis. Prog Urol. 1998;8:240–3.
75. Lubbe J., Ruef C., Spirig W., Dubs M., Sigg C. Infertility as the first symptom of male genitourinary tuberculosis. Urol Int. 1996;56:204–6.
76. Kumar R. Reproductive tract tuberculosis and male infertility. Indian J Urol. 2008 Jul;24(3):392-5. doi: 10.4103/0970-1591.42624.
77. Shah R.S. Obstructive azoospermia following genital tuberculosis may be reversible with medical therapy. AUA 2004 Abstract 1600. Available from: http://www.abstracts2view.com/aua_archive/view.php?nu=2004001503.
78. Indudhara R., Das K., Sharma M., Vaidyanathan S. Seminal vesiculitis due to Mycobacterium gastri leading to male infertility. Urol Int. 1991;46:99–100.
79. Fraietta R., Mori M.M., De Oliveira J.M., Cedenho A.P., Srougi M. Tuberculosis of seminal vesicles as a cause of aspermia. J Urol. 2003;169:1472.
80. Paick J., Kim S.H., Kim S.W. Ejaculatory duct obstruction in infertile men. Br J Urol. 2000;85:720–4.
81. Pryor J.P., Hendry W.F. Ejaculatory duct obstruction in subfertile males: Analysis of 87 patients. Fertil Steril. 1991;56:725–30.
82. Sole-Balcells F. Tuberculosis and infertility in men Eur. Urol. 1977: Vol. 3. N 3; 129-131.
83. Щербань М.Н. Нарушение сексуальной функции у больных туберкулѐзом лѐгких /М.Н. Щербань, Е.В. Кульчавеня, Е.В. Брижатюк, А.В. Осадчий // Уральский медицинский журнал. – 2012, № 3. – С. 97-101.
84. Щербань М.Н. Диагностика, предупреждение и лечение нарушений репродуктивной функции у мужчин, больных туберкулѐзом лѐгких /М.Н. Щербань, Е.В. Кульчавеня, Е.В. Брижатюк //Туберкулѐз и болезни лѐгких. – 2010.№ 10.– С. 31-36.
85. Кульчавеня Е.В. Нарушение сексуальной функции у мужчин, больных туберкулезом легких /Е.В. Кульчавеня, Е.В. Брижатюк, М.Н. Щербань // Врачебное сословие. 2008. № 2. – С. 22-30.
86. Локшин К.Л. Актуальные вопросы антибиотикотерапии простатитов. / К.Л. Локшин //Урология, 2014. № 4. – С. 55-61.
87. Гамазков Р.В. Лимфотропная терапия противотуберкулезными препаратами в лечении туберкулезного эпидидимита / Р.В. Гамазков, Р.К. Ягафарова, Л.А. Иванова //Проблемы туберкулеза, 2001. -№ 4. – С. 21-24.
88. Краснов В.А. Возможность использования иммобилизированного протеолитического фермента имозимазы при туберкулезе / В.А. Краснов, Н.Н. Кожевников, В.Е. Белявский и др. //Проблемы туберкулеза, 1995. № 3. – С. 22-25.
89. Хомяков В.Т. Низкоинтенсивное лазерное излучение в комплексном лечении полового туберкулеза у мужчин.//Автореф. дис. …к.м.н. – Новосибирск, 1995.
90. Ягафарова Р.К. Оценка эффективности комплексного лечения мочеполового туберкулеза / Р.К. Ягафарова, Р.В. Гамазков, О.А. Маничева //Проблемы туберкулеза, 1998. № 2. – С. 38-40.
91. Камышан И.С. Химиотерапия больных с туберкулезом предстательной железы. / И.С.Камышан, С.Т. Бязров, В.И. Погребинский //Урология и нефрология, 1991 г.№ 3.с. 21-25
92. Lee Y., Huang W., Huang J., Wang J., Yu C., Jiaan B., Huang J. Efficacy of chemotherapy for prostatic tuberculosis-a clinical and histologic follow-up study. Urology. 2001 May;57(5):872-7.
93. Krafft W., Carstensen E. Injection therapy of the prostate in prostatic tuberculosis. Urologe A. 1975 Jan;14(1):13-4.
94. Shalini S., Bansal M.P. Role of selenium in regulation of spermatogenesis: involvement of activator protein 1. Biofactors. 2005;23(3):151-62.
95. Mirone M., Giannetta E., Isidori A.M. Selenium and reproductive function. A systematic review. J Endocrinol Invest. 2013 Nov;36(10 Suppl):28-36.
96. Мохирева Л.В. Биологическая роль цинка в организме человека / Л.В. Мохирева, И.В.Богадельникова // Туберкулез и болезни легких, 2011. № 7. – С.3-10.
97. Colagar A.H., Marzony E.T., Chaichi M.J. Zinc levels in seminal plasma are associated with sperm quality in fertile and infertile men. Nutr Res. 2009 Feb;29(2):82-8. doi: 10.1016/j.nutres.2008.11.007.
98. Gómez Y., Arocha F., Espinoza F., Fernández D., Vásquez A., Granadillo V. Zinc levels in prostatic fluid of patients with prostate pathologies. Invest Clin. 2007 Sep;48(3):287-94.
99. Christudoss P., Selvakumar R., Fleming J.J., Gopalakrishnan G. Zinc status of patients with benign prostatic hyperplasia and prostate carcinoma. Indian J Urol. 2011 Jan;27(1):14-8. doi: 10.4103/0970-1591.78405.
100. Zhang Y.F., Liang C.Z. Progress in the studies of semen delayed liquefaction from chronic prostatitis. Zhonghua Nan Ke Xue. 2007 Jan;13(1):53-6.
101. Сивков А.В. Применение препарата Селцинк Плюс у больных хроническим неинфекционным простатитом и нарушениями фертильности. / А.В. Сивков, В.Н. Ощепков, В.В. Евдокимов и др. //Урология, 2011. № 5. – с. 27-33.
Статья опубликована в журнале «Вестник урологии». Номер №3/2015 стр. 79-103
источник