Нарушения функции гипофиза — болезни, которые в последние годы диагностируются несколько чаще, нежели ранее. Представлять себе такие проблемы в общих чертах нужно каждому человеку, чтобы при первых симптомах обратиться ко врачу за детальной диагностикой. Необходимо понимать, что болезни, связанные с нарушением деятельности гипофиза, опасны – это не только понижение качества жизни, но и высокая вероятность различных осложнений.
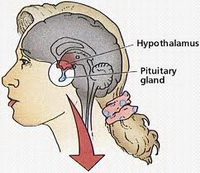
Гипофиз незаменим для эндокринной системы. Этим термином обозначают небольшого размера железу, расположенную в головном мозге, в его нижней половине. Железа находится вблизи седловидных черепных костей и продуцирует гормоны, обеспечивающие возможность нормальной жизнедеятельности, регулируя рост, обмен веществ и репродуктивную способность человека.
Если гормональный фон нарушается, то вполне вероятно, это состояние спровоцировали болезни гипофиза. Женщин и мужчин они поражают в равной мере, им подвержены люди разного возраста, социального положения, ведущие разный образ жизни.
Как правило, симптомом болезни гипофиза является ненормальное содержание гормонов, продуцируемых этой железой, в крови человека. Возможен как переизбыток, так и слишком маленькая концентрация. В любом из вариантов сильно страдает вся эндокринная система.
Обычно недостаточность продуцирования гормональных соединений провоцируется некорректным кровоснабжением или травмой головного мозга. В ряде случаев болезни, связанные с гипофизом, наблюдаются на фоне кровоизлияния, воспаления, проблем в сосудистой системе. Это может быть и последствием облучения.
Болезни гипофиза, при которых уровень активности железы завышен, зачастую связаны с доброкачественным новообразованием. Эту патологию в медицине называют аденомой. Заболевание распространено довольно широко, его развитие могут спровоцировать травмы или инфицирование головного мозга. В некоторых случаях аденома (болезнь гипофиза) развивается на фоне длительного приема контрацептивов перорально.
Болезни гипофиза проявляют себя рядом характерных только им симптомов. Кроме того, наблюдаются проявления, свойственные некоторым другим заболеваниям, из-за чего диагностирование может быть усложнено.
Так, если патология развилась еще до рождения, тогда заметить ее довольно легко – видно непропорциональное сложение, нездоровая внешность. Если гормональная активность недостаточна, рост замедляется, и на всю жизнь такой человек будет ниже среднестатистического. А вот излишняя активность железы приводит к гигантизму – рост не останавливается на протяжении всей жизни.
При болезни гипофиза некоторые пациенты вырастают поистине огромного роста, что сопровождается акромегалией – конечности увеличиваются, голос грубеет, осанка портится, внутренние системы и органы деформируются.
Если болезни гипофиза характерен некорректный, слишком слабый процесс выработки ростового гормона, это приводит к нарушениям в работе мочеполовой системы. При анализе крови на биохимию можно выявить недостаточность натрия, глюкозы, соматотропина. Также наблюдается неестественный ответ на инсулин.
Если нехватка гормонов развивается во вторичной форме, у пациентов диагностируют гипотиреоз. В некоторых случаях поражает гипофиз базедова болезнь. Довольно редко, но все же встречается гипофизарная карликовость – такая патология чаще поражает мужскую половину человечества, нежели женскую. Что хорошо, современная медицина знает довольно эффективные методики устранения патологии.
Если щитовидная железа не продуцирует необходимое для нормальной жизнедеятельности организма количество гормонов, это вызывает гипотиреоз. Обычно такое наблюдается при недостаточности функционирования этого органа либо при патологическом влиянии на процессы, контролирующие гормональный фон.
Первичный (тиреогенный) гипотиреоз обычно спровоцирован нехваткой йода в организме. В ряде случаев его вызывают механические травмы щитовидки, спровоцированные лучевой терапией, хирургическим вмешательством и т. п.
Вторичный гипотиреоз – заболевание, при котором в организме недостаточно гормонов, продуцируемых щитовидной железой. При этом нарушении гипоталамус не может генерировать тиреолиберин, что влияет на работу гипофиза – останавливаются процессы создания тиреотропного гормона.
Третичный гипотиреоз в современной медицине нередко также называют центральным. Эта форма узко распространена и отличается неспособностью щитовидной железы справляться с возложенными на нее функциями. В некоторых случаях это спровоцировано особенностями гипофиза, но иногда свою роль играет гипоталамус.
Заподозрить гипотиреоз в самом начале развития заболевания довольно сложно, так как его течение скрыто и яркой симптоматики не имеет. Чаще всего патологию выявляют при анализе крови для выявления особенностей гормонального фона. При врожденной форме у ребенка наблюдают вздутие живота, пупочную грыжу, непропорциональность языка, щитовидки. Со временем младенец теряет аппетит, нарушается нормальное развитие, вес выходит за рамки положенного, нарушается работа ЖКТ – появляются запоры.
Если начать лечить заболевание вовремя, можно восстановить функциональность всех систем организма в полной мере. Также в норму войдет и процесс роста ребенка.
При запущенной форме у взрослого патологию можно заподозрить по внешнему виду пациента – кожа на лице желтоватая, лицо отекает, так как жидкость не выводится из организма в нормальном режиме. Человек чувствует себя слабым, у него активно выпадают волосы и брови, кожу сушит, болят мышцы.
Обычно это довольно апатичный человек, который говорит хриплым голосом и довольно плохо слышит. Дальнейшее развитие болезни связано с нарушением работы нервной системы, что негативно влияет на память, способность концентрироваться, интеллект. Наблюдаются проблемы со сном, состояние у больного подавленное. В крови падает гемоглобин, растет холестерин.
Пролактин – гормон, в норме активно участвующий в образовании необходимого количества грудного молока кормящей матери. Гиперпролактинемия может развиться в одной из трех форм. Естественный вариант – это физиологическая форма, обусловленная родами и ростом. Патологическая обычно спровоцирована аденомой или иными внутренними нарушениям. При долговременном применении некоторых групп медикаментов может появиться фармакологическая форма заболевания.
Клиническая симптоматика может проявляться у пациентов разного возраста и половой принадлежности. При этом у женщин отмечается:
- выделение грудного молока;
- нарушение менструального цикла;
- невозможность забеременеть;
- понижение сексуального влечения;
- болезненные ощущения при половом акте.
У мужчин нередко развивается импотенция, возможно падение зрения. У больных в юном возрасте половая система развивается с задержкой. Гиперпролактинемия провоцирует проблемы метаболизма, акне. Больные ощущают постоянную слабость, нарушается сон. Нередко заболевание провоцирует сахарный диабет.
Есть две разновидности аденомы гипофиза – активная и неактивная гормонально. Обычно патология развивается довольно медленно, новообразование имеет доброкачественный характер. В зависимости от размера, говорят о микроскопической, макроаденоме.
На раннем этапе развития аденома практически не проявляет себя, что заметно усложняет диагностирование. Со временем опухоль провоцирует эндокринно-обменный синдром. При этом растет в размерах щитовидная железа, появляется лишний вес, бородавки. Большинство пациентов отмечают, что кожа становится жирной. У многих диагностируют диабет. Нередко аденома имеет и симптоматику гипотиреоза, гиперпролактинемии.
Развитие аденомы связано с офтальмологическим, неврологическим синдромом. При этом зрительное поле пациента претерпевает искажения, и он страдает от головных болей. Как правило, сильно падает зрение, наблюдаются нарушения движений глаз. Доктора объясняют это тем, то новообразование сдавливает турецкое седло, черепные нервы.
Нередко при аденоме гипофиза больные впадают в депрессию и страдают от нервных расстройств. Продолжительный рост новообразования провоцирует психические расстройства.
Если наблюдаются характерные для аденомы симптомы, есть хотя бы малейшее подозрение на это заболевание, необходимо записаться на прием к участковому терапевту, который перенаправит к эндокринологу. При пользовании услугами частной клиники можно сразу идти к эндокринологу для детального диагностирования состояния организма.
Врач выберет наиболее применимые инструментальные методики анализа, проконтролирует содержание гормонов в моче, крови, сделает анализ на биохимию. Если возникает предположение, что причина в узловатом гипотиреозе, дополнительно проводят ультразвуковую диагностику.
Для определения разновидности опухоли необходимо пройти компьютерную томографию или МРТ. Это также позволяет точно выявить размеры новообразования, понять, насколько пострадало турецкое седло и каков характер повреждений. При офтальмологическом исследовании также оценивают состояние черепных нервов.
Лечение заболеваний гипофиза определяется особенностями конкретного диагноза. Для начала необходимо подобрать препараты, позволяющие вернуть в норму гормональный фон. Больному назначают также медикаменты, стимулирующие продуцирование нужных гормонов внутренними системами организма. Дополнительно проводят общеукрепляющие мероприятия и выбирают диету, оптимальную для патологии.
Если установлена аденома, хороший результат может дать лучевая терапия, избавляющая от новообразования. При макроаденоме возможно хирургическое удаление опухоли.
Нехватку гормонов в крови необходимо восполнять внешними источниками, сопровождая это минеральными компонентами и витаминной терапией. При лечении малолетних пациентов гормоны вводят минимальными дозами. При удачно подобранной программе вскоре приходит в норму самочувствие, у детей нормализуется рост.
источник
Эндокринное бесплодие — состояние, при котором гормональные нарушения влияют на репродуктивную функцию. Появляются проблемы с зачатием: качество спермы снижается, наблюдаются сбои в менструальном цикле, которые провоцируют нерегулярность овуляций. Эндокринные нарушения, влияющие на фертильность, обычно возникают в щитовидной железе, надпочечниках, гипоталамусе и гипофизе, половых железах. Каждая третья пациентка с диагнозом бесплодие страдает именно от проблем с эндокринной системой.
Эндокринное бесплодие является групповой дисфункцией – совокупность гормональных нарушений, которые влияют на менструальный цикл у женщин и качество спермы у мужчин. Однако все эти нарушения приводят к одному – неправильной работе яичников и отсутствию овуляции (или ее нерегулярности).
Лечение эндокринного бесплодия состоит из трех этапов:
- устранение первопричины;
- коррекция гормонального фона;
- контроль над гормональным фоном.
Прогноз после эндокринных нарушений составляет 70-80% успешных беременностей. Остальные же пары могут обратиться к современным репродуктивным технологиям, которые позволяют иметь родных детей даже при серьезной дисфункции половой системы.
Биологические факторы риска:
- возраст от 25 лет;
- наличие кист и опухолей в половых органах;
- раннее наступление или задержка первой менструации;
- регулярные сбои в менструальном цикле;
- искусственное прерывание первой беременности;
- плохая наследственность;
- неправильный прием комбинированных оральных контрацептивов;
- сопутствующие эндокринные нарушения;
- урогенитальные болезни в анамнезе.
- вредная рабочая среда;
- наличие промышленных организаций в населенном пункте;
- вредные привычки;
- сочетание работы и учебы (параллельно с браком);
- бесконтрольные половые связи.
Главным симптомом эндокринного бесплодия будет отсутствие беременности при проблемах с менструальным циклом: задержки, сильные боли, сокращение или увеличение объема выделений, метроррагия. Более, чем у 30% женщин с таким диагнозом не наступает овуляция, хотя менструальный цикл проходит нормально. В таком случае можно говорить о кровотечениях, которые имитируют менструацию, но имеют другую природу.
Часто женщины жалуются на боли в животе и спине, различные выделения, цистит, боль во время секса. При повышении уровня пролактина появляется напряжение в молочных железах, выделяется молозиво. Симптомы ПМС усиливаются.
Если причиной эндокринного бесплодия является высокий уровень половых гормонов, симптомы будут следующими: акне, избыток волос, облысение, перепады артериального давления, ожирение, появление растяжек на коже.
- Неправильная работа гипоталамуса и гипофиза вследствие травмы головы и грудной клетки, опухолевых процессов в мозге, повышение уровня пролактина. Гормон пролактин угнетает секрецию фолликулостимулирующего и лютеинизирующего гормонов, а также яичники, что приводит к сокращению выделений в менструальный цикл, отсутствию овуляции.
- Преобладание мужских гормонов в женском организме (дисфункция яичников и надпочечников). Небольшое количество мужских гормонов необходимо организму женщины, однако их преобладание приводит к эндокринному бесплодию, поликистозу яичников, ожирению, кровотечениям, отсутствию менструации. Если уровень мужских гормонов растет под влиянием надпочечников, зачастую проблема в разрастании коры органа.
- При недостаточности лютеиновой фазы развивается нехватка прогестерона и эстрогенов. При сокращении уровня женских половых гормонов изменяется естественный процесс трансформации эндометрия, наблюдается дисфункция маточных труб.
- Дисфункция щитовидной железы. Нехватка гормонов этой железы и чрезмерная выработка гормонов диффузной тканью (диффузный токсический зоб) приводят к эндокринному бесплодии из-за отсутствия овуляции.
- Ожирение или худоба. Жировая ткань является частью эндокринной системы. Она принимает участие в обмене веществ в тканях, в частности, тканях репродуктивной системы. Избыток жировой ткани способен вызвать дисбаланс гормонов, что приводит к сбоям в менструальном цикле, а недостаток – проблемы с яичниками.
- Преждевременное наступление менопаузы. Прекращение менструации (ввиду истощения яичников) на определенный срок у женщин 36-38 лет может стать причиной климакса и эндокринного бесплодия.
- Синдром резистентных яичников (нарушение связи между гипофизом и яичниками). Синдром заключается в том, что рецепторы яичников перестают отвечать на гонадотропины, которые стимулируют выход яйцеклетки из фолликула. Синдром развивается после вирусных заболеваний, патологий беременности, стресса, недоедания, нехватки витаминов.
- Хромосомные мутации. Заболевания, которые появляются вследствие патологий на генетическом уровне, вызывают нехватку женских половых гормонов, отсутствие менструации, половой инфантилизм.
- Соматические патологии такие, как цирроз, туберкулез, злокачественные опухоли, гепатит, аутоиммунные заболеваний.
Общий и гинекологический осмотры, а также изучение анамнеза, помогают выяснить многие причины эндокринного бесплодия. Анализы и тесты зачастую нужны только для подтверждения диагноза. Среди анализов на эндокринное бесплодие выделяют измерение базальной температуры, тесты на овуляцию, УЗИ половых органов.
При постановке диагноза врач в первую очередь уточняет информацию по менструальному циклу (продолжительность, интенсивность ПМС, обилие выделений). Немаловажно проанализировать наследственные патологии. Также учитываются беременности в анамнезе, исход зачатия, осложнения после родов, состояние ребенка. Обязательно рассматриваются все хирургические вмешательства в половые органы и другие манипуляции, их характер и продолжительность. Врач отдельно рассматривает роль контрацептивов в половой жизни пациентки.
Общий осмотр направлен на оценку:
- роста женщины;
- массы тела;
- волосяного покрова;
- молочных желез;
- половых признаков.
Гинекологический осмотр заключается в:
- определение размеров влагалища, матки;
- оценке состояния шейки матки;
- оценке состояния придатков.
График базальной температуры позволяет диагностировать отсутствие овуляции (ановуляция). Эта температура показывает интенсивность выработки прогестерона яичниками. Прогестерон отвечает за трансформацию эндометрия в матке, которая нужна для лучшего прикрепления оплодотворенной яйцеклетки. Базальную температуру измеряют утром посредством введения термометра в анальное отверстие. Для того, чтобы график мог правильно отобразить состояние организма, измерять температуру в прямой кишке необходимо каждый день.
В день выхода яйцеклетки из фолликула показатели базальной температуры падают на 0,2-0,3°С. Во вторую фазу температура поднимается на 0,5-0,6°С. Если же овуляции не будет, тогда базальная температура держится ниже 37°С на протяжении всего цикла (в сочетании с сокращением второй фазы).
Подтвердить наличие овуляции можно путем определения уровня прогестерона в крови (менее 15 нмоль/л), а также прегнандиола в моче. В цикл без овуляции показатели во вторую, лютеиновую фазу, будут низкими. Домашние тесты на овуляцию позволяют определить концентрацию лютеинизирующего гормона в моче за сутки до выхода яйцеклетки.
Определить причины эндокринного бесплодия позволяют тесты на уровни:
- фолликулостимулирующего гормона;
- лютеинизирующего гормона;
- эстрадиола;
- пролактина;
- тиреотропного гормона;
- тиреоидных гормонов (Т3, Т4);
- дегидроэпиандростерон-сульфата.
Результаты можно считать корректными только при совершении тестов несколько циклов подряд. Определять уровни гормонов лучше на 5, 6 или 7 день цикла.
УЗИ помогает оценить процесс созревания яйцеклеток в фолликулах, определить доминантный фолликул и узнать время выхода яйцеклетки. Также проводят УЗИ надпочечников и щитовидной железы. Посткоитальный тест дает возможность определить характеристики цервикальной слизи. При ановуляции цервикальное число будет менее 10 баллов.
Состояние эндометрия напрямую зависит от работы яичников. При отсутствии овуляции биопсия эндометрия покажет гиперплазию (чрезмерный рост клеток) или недостаточность выделения соединений клетками ткани. Это при условии, что анализ проводится за 2-3 дня до предполагаемого начала менструации. Также на ановуляцию сопровождает отсутствие трансформации эндометрия.
Гормональные пробы помогают определить функциональность половых органов на разных стадиях менструального цикла. Суть метода заключается в определении естественного гормонального фона женщины после стимуляции различными препаратами.
Типы проб:
- Прогестероновая проба. Определение уровня эстрогенов при отсутствии менструации. Оценка реакции эндометрия матки на воздействие прогестероном. Определение отторжения эндометрия при снижении дозы гормона.
- Дексаметазоновая проба. Анализ генеза при чрезмерной выработке мужских гормонов (надпочечниками или яичниками).
- Кломифеновая проба. Актуальна при сбоях менструального цикла и отсутствии овуляции. Проба позволяет определить концентрацию стероидных гормонов в фолликуле, а также оценить способность гипофиза образовывать резервы.
- Проба с тиролиберином. Анализ работы щитовидной железы.
- Проба с церукалом. Наблюдение за реакциями между функциональным и органическим повышением уровня пролактина.
Другие методы диагностики причин эндокринного бесплодия:
- рентген черепа;
- лапароскопия (диагностическая).
Говорить о женском эндокринном бесплодии можно только после исключения факторов со стороны партнера и наоборот. Также следует изучить функциональность матки, фаллопиевых труб и иммунитета женщины в целом (иммунологическое бесплодие).
Диагностировать гиперпролактинемию можно путем двух проб крови. Чрезмерная выработка пролактина часто сопутствует патологиям органов малого таза (зачастую причиной является генитальный эндометриоз). Лечение эндометриоза способствует урегулированию пролактина и наступлению беременности.
Переизбыток пролактина на постоянной основе может сочетаться с недостаточностью щитовидной железы. Нехватка гормонов щитовидной железы, как причина гиперпролактинемии, выявляется путем исследования гормонов железы (уровни Т3, Т4). Нехватка гормонов щитовидной железы устраняется препаратами левотироксина натрия. Лечение приводит к урегулированию пролактина и спонтанному наступлению беременности.
Постоянная чрезмерная выработка пролактина может говорить об опухоли гипофиза (гормонально активная пролактинома). Диагностика состояния осуществляется путем КТ или МРТ. Пролактинома устраняется хирургическим, лучевым путем или медикаментозно. Даже после устранения опухоли и приведения уровня пролактина в норму, у пациенток может сохраняться инфертильность. Дальнейшее устранение бесплодия зависит от симптоматики.
Частой причиной бесплодия является гипергонадотропная аменорея – отсутствие менструации, повышение уровня ФСГ и нехватка эстрадиола. Данное явление может быть проявлением преждевременного истощения яичников или их изменений, недоразвития половых желез или нечувствительности яичников к гонадотропинам.
Гипергонадотропную аменорею диагностируют при помощи УЗИ яичников, изучения анамнеза, а также исследования кариотипа и консультации генетика (при подозрении на недоразвитость половых желез). Если железы развиты и возрастных патологий нет, применяют биоспию гонад. Процедура дает возможность исследовать фолликулярные резервы на предмет синдрома резистентных яичников (нечувствительность к гонадотропинам) или синдрома истощения яичников.
Понижение уровней эстрадиола, ФСГ и ЛГ говорит о гипоталамогипофизарной недостаточности – разрушение передней доли гипофиза, прекращение секрета тропных гормонов и дисфункция периферических желез (щитовидная, паращитовидная, надпочечниковая). Если состояние вызвано наследственными причинами или развилось в детстве, может присутствовать недоразвитость вторичных половых признаков, разрастание половых органов, отсутствие менструации. Данная недостаточность в репродуктивном возрасте прекращает менструацию или значительно ее сокращает.
При чрезмерной выработке мужских половых гормонов нужно оценить концентрацию андрогенов. При незначительном повышении тестостерона можно говорить о гиперандрогении, вызванной дисфункцией яичников. Часто болезнь развивается на фоне ожирения или склероза яичников.
Дегидроэпиандростерон (ДГЭАС) является андрогеном надпочечников. Его повышение говорит о том, что проблема кроется именно в этом органе. Незначительное повышение гормона указывает на врожденную гиперплазию коры надпочечников. Заболевание препятствует синтезу кортизола, что приводит к чрезмерному использованию стероидов в процессе образования андрогенов.
Высокие показатели ДГЭАС в сочетании с выраженными симптомами гиперандрогении указывают на опухоль в надпочечниках или яичниках. Чтобы определить локализацию опухоли и ее тип, прибегают к УЗИ и КТ, гормональным пробам (дексаметазон и тетракозактид), биопсии тканей.
Чтобы диагностировать эндокринное бесплодие на фоне гиперандреногении (без повышения уровней тестостерона и ДГЭАС), исследуют глобулины, связывающие половые гормоны, а также фракции свободного и связанного тестостерона. Анализ помогает определить влияние глобулинов на андрогены (дефицит первых усиливает влияние вторых). При сокращении глобулинов стоит проверить печень. Другие заболевания, которые могут сокращать уровень глобулинов, обычно выявляются на ранних стадиях диагностики причин гиперандрогении. Это может быть гипотиреоз, переизбыток кортизола при синдроме Иценко-Кушинга.
При выявлении причин эндокринного бесплодия у женщин с ожирением, необходимо прибегать к стандартным глюкозотолерантным тестам. Аномалии толерантности к глюкозе могут стать причиной бесплодия.
Лечение эндокринного бесплодия (с последующей беременностью) должно носить комплексный характер.
Устранение нарушений, которые оказывают влияние на функциональность желез. Это может быть борьба с ожирением, ослабление сахарного диабета, лечение надпочечников или щитовидной железы, хирургическое удаление опухолей и других образований.
Медикаментозное воздействие на преобладающий фолликул с целью вызвать овуляцию. Для стимуляции подходят препараты кломифен цитрата, которые заставляют гипофиз производить фолликулостимулирующий гормон. Стоит отметить, что лечение кломифен цитратом нередко вызывает многоплодие (в 10% случаев беременностей после стимуляции).
При отсутствии беременности (после лечения кломифен цитратом на протяжении шести циклов), назначают гонадотропины:
- человеческие менопаузальные гонадотропины (меногоном, менопур);
- рекомбинантные фолликулостимулирующие гормоны (гонал-Ф, пурегон);
- хорионический гонадотропин (прегнил, хорагон).
Гонадотропины также вызывают многоплодную беременность. Лечение этими препаратами может вызывать побочные эффекты.
Эндокринное бесплодие успешно лечится путем коррекции гормонального фона, но иногда требуется хирургическое вмешательство. При поликистозе яичников нужна клиновидная резекция, либо лапароскопическая термокаутеризация. Примечательно, что после термокаутеризации прогноз беременности составляет до 90%. Это обусловлено тем, что процедура исключает возможность спаечного процесса в малом тазу.
При эндокринном бесплодии в сочетании с другими патологиями рекомендовано экстракорпоральное оплодотворение. У партнеров берут образцы, оплодотворяют яйцеклетку «в пробирке» и пересаживают эмбрион в матку женщины. Метод позволяет обойти те процессы, которые происходят в трубах при естественном зачатии.
Современная медицина успешно лечит эндокринное бесплодие. Одними только медикаментами удается вылечить до 80% женщин с таким диагнозом. После лечения, если овуляция восстановилась (и не появились новые факторы бесплодия), у половины наступает беременность уже в первые шесть менструальных циклов стимуляции гормонами. Меньше шансов на беременность у женщин, чье эндокринное бесплодие вызвано проблемами с гипоталамусом или гипофизом.
Беременные, которые прошли курс стимуляции гормонами при эндокринном бесплодии, становятся на специальный учет у гинеколога и наблюдаются у эндокринолога. При симптомах выкидыша (дискоординация, слабая родовая деятельность) женщин срочно госпитализируют.
Предотвратить эндокринное бесплодие довольно просто – следить за здоровьем с самого детства. Нужно предотвращать любые патологии, которые могут оказать влияние на яичники и гипоталамо-гипофизарную область мозга. Родители должны уделять внимание инфекционным заболеваниям, которым подвержены дети, лечить ОРВИ и грипп. Причиной эндокринного бесплодия может стать хронический тонзиллит, токсоплазмоз, ревматизм.
Важно также держать под контролем психо-эмоциональное и физическое состояние. Нередко бесплодие развивается после хронической усталости, перенапряжения, травм (как психологических, так и сексуальных).
У взрослых женщин эндокринное бесплодие нередко является следствием абортов, патологий беременности, сложных родов, интоксикаций, хронических воспалений в мочеполовой системе. Отдельно стоит обратить внимание на лекарства, которые принимает женщина, и правильное ведение беременности.
источник
В последние годы увеличивается число женщин, страдающих различными нарушениями менструальной функции, а также возрастает количество бесплодных браков, причем среди причин бесплодия доминирующую роль играют эндокринные факторы.
Гипоталамические и гипофизарные формы бесплодия у женщин; этиология и патогенез, клинико-лабораторные данные
В последние годы увеличивается число женщин, страдающих различными нарушениями менструальной функции, а также возрастает количество бесплодных браков, причем среди причин бесплодия доминирующую роль играют эндокринные факторы.
Этиология:
1. Патология гипофиза.
• Синдром Шихена (о. гипопитуитаризм).
• Гипофизарный гипогонадизм.
• Гиперпролактинемия (пролактинома, гипотиреоз, нейролептики ).
• Гипофизарный нанизм.
• Болезнь Иценко-Кушинга.
2. Патология гипоталамуса.
• Синдром Каллмена.
• Нейрогенная анорексия.
• Перетренированность, тяжелый физический и умственный труд.
• Синдром Бабинского-Фрелиха.
Патогенез:
Данные виды бесплодия являются гипогонадотропными формами гипогонадизма. Таким образом, имеются нарушения выработки гонадотропинов (ФСГ и ЛГ), что приводит в свою очередь к нарушению деятельность регулируемых ими яичников, а также снижению в крови содержания эстрогенов, прогестерона и в моче 17-КС. Таков механизм возникновения бесплодия при синдроме Шихена, гипофизарном нанизме и гипогонадизме, синдроме Каллмена, Бабинского-Фрелиха.
При болезни Иценко-Кушинга наблюдается недостаточная стимуляция яичников гонадотропинами за счет блокады зон аденогипофиза при гиперпродукции кортикотропина.
Особое внимание следует уделить патогенезу бесплодия при гиперпролактинемии. Увеличение выработки пролактина наблюдается при пролактиноме, гипотиреозе, а также применении нейролептиков. Различают следующие группы факторов, ведущих к гиперпролактинемии:
• операции на молочной железе и грудной клетке.
• стрессы.
• избыточная пальпация молочной железы.
• избыточное употребление пива.
• избыток жирной пищи.
Увеличенное количество пролактина вызывает блок выработки ФСГ и ЛГ, приводит к снижению количества эстрогенов, аменорее и атрофии половых органов, а также снижению выработки прогестерона. Увеличенное количество пролактина в крови, высокий уровень ТТГ и бесплодие могут свидетельствовать о развитии гипотиреоза.
Клинико-лабораторные проявления:
Диагностический поиск начинается с анализа жалоб и сбора анамнеза. Наиболее характерны жалобы на нарушение менструальной функции по типу олиго- или аменореи ( первичной или вторичной ), бесплодие ( первичное или вторичное ), иногда на выделения из сосков (галакторея). Особую группу составляют больные с жалобами на избыточный рост волос на лице и теле по мужскому типу ( гирсутизм ), вульгарные угри, жирную себорею, выпадение волос на голове (алопецию ) и др. Данный симптомокомплекс является отражением гиперандрогении и будет рассмотрен отдельно.
Клиническое обследование должно включать:
— оценку роста и массы тела с вычислением индекса массы тела;
— оценку фенотипа ( женский, мужской );
— оценку состояния кожи ( цвет, влажность или сухость, наличие стрий, себореи, вульгарных угрей, характер полового оволосения, состояние волос на волосистой части головы);
— оценка степени развития молочных желез, наличие или отсутствие галактореи, тяжистых или узловатых уплотнений;
— гинекологическое бимануальное исследование и осмотр шейки матки в зеркалах;
— оценку общего состояния ( заторможенность, отечность, артериальное давление, пульс, изменение черт лица, увеличение размера обуви и т.д. );
— регистрацию осмотических генетических стигм ( высокое небо, короткая шея, бочкообразная грудь и др.).
Кроме общеклинического исследования, применяются функциональные тесты — измерение базальной, или ректальной температуры в течение не менее 3-х месяцев, оценка состояния цервикальной слизи ( симптом «зрачка», симптом натяжения слизи, симптом арборизации), кольпоцитология вагинального мазка с подсчетом индекса созревания и кариопикнотического индекса.
При бесплодном браке обязательным является обследование мужа: (сперматограмма, посткоитальный тест, консультация андролога).
Для уточнения уровня нарушения репродуктивной и других систем используют весь спектр современных методов обследования, включающий ЭЭГ,РЭГ, рентгенологические методы, КТ,МРТ, УЗИ, лапароскопию, гистероскопию с морфологическим исследованием. Кроме того, в ряде случаев необходимо определение уровня гипофизарных ( ЛГ, ФСГ, ПРЛ, ТТГ, СТГ и АКТГ ) и стероидных гормонов — Э-2 и других фракций эстрогенов, прогестерона, тестостерона, андростендиона, дегидроэпиандростерона ( ДЭА ) и его сульфата, 17-гидроксипрогестерона, кортизола и т.п. При необходимости проводят генетическое обследование.
При одновременном снижении уровней Э-2, ЛГ и ФСГ на фоне нормального содержания пролактина речь идет о вторичной гипофункции яичников, обусловленной выпадением их стимуляции со стороны гипоталамо -гипофизарной системы, т.е. о гипогонадотропной гипофункции яичников.
К гипогонадотропной гипофункции яичников условно относят так называемую нормогонадотропную гипофункцию, при которой базальный уровень гонадотропных гормонов не снижен. Однако, при определении частоты и амплитуды секреторных импульсов ЛГ и ФСГ обнаруживают нарушение циклического ритма их секреции.
источник
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
Гипогонадотропный гипогонадизм (ГГ) — заболевание, в основе которого лежит гипоталамо-гипофизарная недостаточность, сопровождающаяся задержкой полового развития центрального генеза, дефицитом эстрогенов.
Краткая информация о гипоталамусе, гипофизе и о механизмах работы данных органов изложена в статьях: «Бесплодный брак. Физиология женской репродуктивной системы» и «Бесплодный брак. Репродуктивная система женщины».
Данный вид бесплодия встречается в 15-20% случаев аменореи.
По времени развития различают врождённый и приобретённый ГГ.
По уровню повреждения различают гипоталамическую и гипофизарную формы.
По степени тяжести выделяют лёгкую, средней тяжести и тяжёлую формы.
Приобретённая недостаточность гонадотропинов — следствие воздействия внешних неблагоприятных факторов и может быть обратимой:
• аменорея (отсутствие менструации) при неврогенной анорексии (отказе от еды)
• при быстром снижении массы тела
• аменорея физической нагрузки – при чрезмерных физических нагрузках. Данное явления характерно для спортсменок.
• психогенная аменорея. Исчезновение месячных вследствие психического перенапряжения или стрессов
• послеродовый гипопитуитаризм (синдром Шиена). Как правило появляется вследствие обильной кровопотери в родах.
По причине недостаточности гипоталамо-гипофизарной системы отсутствует её циклическое стимулирующее влияние на яичники, развивается вторичная недостаточность яичников, обусловливающая отсутствие овуляции и дефицит эстрогенов. При этом анатомически и функционально яичники полноценны. Также изначально анатомически и функционально полноценны все половые органы женщины, но в условиях длительного состояния сниженного уровня эстрогенов органы репродукции претерпевают определенные дегенеративные изменения, несовместимые с наступлением беременности.
Бесплодие при ГГ относится к эндокринным формам. Основная причина бесплодия у женщин с ГГ — отсутствие роста фолликулов и овуляции. Это происходит из-за отсутствия стимулирующего влияния гонадотропинов (ФСГ, ЛГ) на фолликулярный аппарат яичников. Отсутствие гонадотропинов может быть обусловлено нарушением выработки гипофизом данных гормонов в условиях адекватной секреции Гн-РГ или отсутствием гипоталамической секреции Гн-РГ. Так же встречаются формы характеризующиеся дефектами гормонов Гн-РГ, ЛГ, ФСГ или дефектами их рецепторов на поверхности клеток мишеней.

Дефицит эстрогенов в организме женщины обусловливает характерные особенности внешности:
• Тип телосложения евнухоидный: высокий рост за счёт увеличения длины ног, увеличение длины рук, уменьшение поперечных размеров таза, увеличение ширины плеч.
• Вторичные половые признаки недоразвиты, реже отсутствуют, особенно это касается молочных желёз.
• Молочные железы у женщин с ГГ недоразвиты, иногда значительно, но могут быть нормально развиты, в зависимости от выраженности дефицита эстрогенов. При рентгенологическом или УЗИ исследовании часто выявляют полное замещение железистой ткани молочной железы жировой тканью с участками уплотненной соединительной ткани преимущественно в преареолярных (околососковых) областях. У части больных (18%) обнаруживают фиброзно-кистозную мастопатию.
• Оволосение в подмышечных впадинах и на лобке скудное или умеренное.
• Гинекологическое исследование выявляет гипоплазию наружных и внутренних половых органов. Слизистая оболочка влагалища тонкая, сухая, неэластичная. Шейка матки уменьшена, наружный зев точечный. Матка значительно уменьшенных размеров, иногда не удаётся прощупать матку отдельно от шейки. Яичники так же не прощупываются. Гипоплазия (недоразвитие) матки более выражена, чем недоразвитие яичников. Выраженное уменьшение размеров матки и яичников выявляют и при УЗИ органов малого таза.
Лабораторно инструментальные исследования
Основа диагностики ГГ, как и других форм эндокринного бесплодия, это гормональное исследование.
Характерные показатели при гипогонадизме:

1. Ввиду низкой эстрогенной насыщенности прогестероновая проба и проба с кломифеном у пациенток с ГГ отрицательная.
2. Циклическая гормональная проба — положительная.
Приведенные выше примеры лабораторной диагностики носят своей целью определение функционального состояния репродуктивной системы.
• ГГ с лёгкой степенью гипоталамо-гипофизарной недостаточности. При позднем наступлении менструации с нерегулярными скудными выделениями менструации исчезают вовсе. Телосложение пропорциональное. Молочные железы развиты с жировым замещением железистой ткани. Размеры матки и яичников соответствуют возрасту 12-13 лет. Уровни гонадотропинов в крови: ЛГ 5,8 МЕ/л (3,6-9,3 МЕ/л), ФСГ 2,6 МЕ/л (1,3-3,8 МЕ/л), эстрадиол — 50 пмоль/л (25,7-75,3 пмоль/л).
1. УЗИ органов малого таза для определения степени гипоплазии матки и яичников
2. липидограмма
3. исследование минеральной плотности костной ткани для выявления и профилактики возможных системных нарушений на фоне длительной гипоэстрогении
• ГГ с умеренной степенью гипоталамо-гипофизарной недостаточности. При наступлении менструации, но после 2-4 редких менструаций цикл исчезает. Телосложение диспропорциональное. Молочные железы недоразвиты, уменьшены в размере с жировым замещением железистой ткани. Размеры матки и яичников соответствуют возрасту 10-11 лет. Уровни гонадотропинов в крови: ЛГ 2,0 МЕ/л (1,7-2,5 МЕ/л), ФСГ 1,3 МЕ/л (1,1-1,6 МЕ/л), эстрадиол 30 пмоль/л (22,8-37,2 пмоль/л).
• ГГ с тяжёлой степенью гипоталамо-гипофизарной недостаточности. Полное отсутствие менструации, клинически больные характеризуются евнухоидными чертами телосложения. Молочные железы визуально отсутствуют или очень слабо развиты, с полным жировым замещением железистой ткани. Размеры матки и яичников женщины соответствуют таковым в возрасте 2-7 лет. Уровни гонадотропинов в крови: ЛГ 1,8 МЕ/л (1,3-2,4 МЕ/л), ФСГ ниже 1 МЕ/л, эстрадиол: ниже 30 пмоль/л.
Лечение бесплодия складывается из двух этапов: подготовительный этап и индукция овуляции.
1. На подготовительном этапе производят заместительную циклическую гормонотерапию последовательным назначением эстрогенов и гестагенов с целью коррекции гормонального статуса женщины. Так же производится стимулирование роста и развития женских половых органов: увеличения размеров матки, роста эндометрия, формирования рецепторного аппарата в органах-мишенях, что повышает эффективность последующей стимуляции овуляции. Длительность подготовительной терапии определяется в зависимости от выраженности гипогонадизма и составляет в среднем 3-12 месяцев.
2. Индукция овуляции производится гонадотропинами и преследует цель – осуществление овуляции. Адекватность назначенного лечения оценивается посредством УЗИ исследования фолликулов яичников. Адекватность дозы применяемых препаратов оценивают по динамике роста фоллликулов (в норме — 2 мм в сутки). При медленном росте фолликулов дозу увеличивают, при слишком быстром росте — снижают. Медикаментозное лечение продолжают до образования зрелых фолликулов диаметром 18-20 мм. Затем в/м однократно вводят определенную дозу хорионического гонадотропина (ХГЧ). Под контролем УЗИ наблюдают за овуляцией – отсутствие доминантного фолликула говорит о том, что произошла овуляция.
После констатации овуляции проводят поддержку лютеиновой фазы цикла препаратами из группы гестагенов.
Профилактика развития бесплодия при дефиците эстрогенов включает заместительную терапию. Исходя из механизме развития заболевания, общепризнанна необходимость проведения заместительной терапии женскими половыми гормонами — эстрогенами и гестагенами, цель которой — формирование женской внешности.
• В период полового созревания — для формирования женского типа телосложения, нормального развития половых органов, молочных желёз и вторичных половых признаков, а также для достижения нормальной массы костной ткани. Необходимы ранняя диагностика ГГ и своевременное назначение заместительной гормональной терапии (с 16-18 лет), продолжение её по возможности непрерывно до 20-23 лет.
• В репродуктивный период — перед индукцией овуляции в качестве подготовки к беременности желательна заместительная гормональная терапия в течение 3 месяцев. После беременности, родов и лактации необходима заместительная гормональная терапия виде длительных курсов минимум в течение 12 месяцев с целью профилактики остеопороза.
• В период после рождения ребенка — необходимы диагностика системных изменений, вызванных гормональными нарушениями и их коррекция с помощью заместительной гормональной терапии, фитотерапии и специфических препаратов для лечения остеопороза. Заместительную гормональную терапию при гипогонадотропном гипогонадизме у женщин можно продолжать до возраста естественной менопаузы (45-50 лет).
Автор: Ткач И.С. врач, хирург офтальмолог
источник
Дата публикации: 20.04.2017 2017-04-20
Статья просмотрена: 2694 раза
Романенко В. А., Теплякова М. А., Шабаева В. И. Гормональные нарушения при аденоме гипофиза как причина бесплодия // Молодой ученый. 2017. №14.2. С. 36-39. URL https://moluch.ru/archive/148/41929/ (дата обращения: 17.07.2019).
Представлена информация об аденоме гипофиза и расстройствах менструального цикла, встречающихся при данном заболевании и приводящих к бесплодию. Особое внимание уделено современной классификации аденом гипофиза, их распространенности, рассмотрены варианты этой доброкачественной опухоли и клинические проявления, диагностика. Отмечены возможности и варианты лечения при каждом из них. Подробно описаны нарушения фертильности женщин при данной патологии.
Ключевые слова: аденома гипофиза, доброкачественная опухоль, фертильность, менструальный цикл, пролактинома, МРТ, соматотропинома, аменорея
Проблемы бесплодия продолжают будоражить умы людей, на первом месте идет стерильность воспалительного генеза [7,9,10,8,6], на втором гормональное бесплодие [11].
Влияние аденомы гипофиза на нарушения менструального цикла и репродуктивной функции остаётся актуальной проблемой современной гинекологии [12]. Аденома гипофиза — это доброкачественное новообразование, происходящее из железистой ткани аденогипофиза, явлениями чего будут возникновения гипер- или гипосекреция гормонов. Между всеми интракраниальными опухолями занимает третье место по встречаемости после глиом и менингиом [1]. Процент встречаемости данного заболевания между всеми первичными опухолями ЦНС составляет от 7,3 до 18 % и выявляется в возрасте от 20 до 50 лет. Чаще встречается у женщин 20–30 и 50–60 лет [2]. Помимо серьезных неврологических расстройств, данная патология может привести к не менее серьезным нарушениям репродуктивной функции женщин.
Целью нашей работы явилось изучение особенностей вариаций аденом гипофиза и нарушений менструального цикла при данной патологии.
Репродуктивная система женщины представлена по типу функциональной системы [11], в которой все компоненты взаимодействуют в целях обеспечения различных полезных адаптивных результатов (Анохин П. К., 1974). Менструальный цикл (МЦ) является неотъемлемой частью этой структуры, и его регуляция осуществляется по принципу обратной связи, которая обеспечивается правильным синхронным взаимодействием всех уровней [3]. Гипофиз, а точнее, его передняя доля — аденогипофиз, которая синтезирует гонадотропные гормоны, представляет собой третий уровень из пяти. Поэтому, функциональные и органические поражения этого органа получают отклик со стороны репродуктивной системы женщины в виде расстройств МЦ и половой функции, сложностей с зачатием, бесплодия.
Различат следующие классификации аденом гипофиза:
- По гормональной активности аденомы гипофиза делятся на гормонально активные (ГА) и гормонально неактивные (НАГ). Гормонально активные аденомы могут клинически себя никак не проявлять, если количество вырабатываемого гормона незначительно выше или ниже нормы, но если выработка или недостаток гормона усиливается, то появляется соответствующий симптом.
- По гистологическому критерию подразделяются на:
– микроаденома (не более 10мм);
Рассмотрим наиболее распространенные из них.
Пролактиномы наиболее часто встречаются среди аденом гипофиза и составляют 40–50 % от них. Это гормонально активная опухоль, секретирующая повышенное количество пролактина. Наблюдается у женщин детородного возраста в 6–10 раз чаще, чем у мужчин. В норме пролактин вместе с фолликулостимулирущим (ФСГ) и лютеинизирующим гормонами (ЛГ) оказывает регулирующее действие на фертильную функцию женщины. К функциям пролактина можно отнести:
– синхронизирует созревание фолликула и овуляцию совместно с ЛГ;
– поддерживает существование желтого тела и образование прогестерона через участие в синтезе холестерина;
– подготавливает молочные железы к лактации;
– регулирует объем и состав амниотической жидкости;
– стимулирует молокообразование в альвеолах молочных желез во время лактации [3].
Таким образом, пролактин — один из основных гормонов, необходимых для репродукции, от него зависит овуляция, лактация. Верхней границей нормы пролактина у женщин является 25нг/мл(500 мЕД/л), это значение необходимо для диагностики гипер- или гипопролактинемии.
По локализации в пределах гипофизарной ямки и своим размерам пролактиномы делятся на:
- Интрасселярные микропролактиномы (пролактинсекретирующие аденомы диаметром до 1 см, находящиеся в пределах турецкого седла);
- Экстрасселярные макропролактиномы (пролактинсекретирущие аденомы диаметром более 1 см, выходящие за пределы турецкого седла).Размеры опухоли во многом определяют симптоматику и выбор терапии [5].
В основе патогенеза лежит патологическое повышение в крови концентрации пролактина, которое ведет к:
– нарушению рецепции к ЛГ, препятствует секреции тестостерона гранулезными клетками фолликула,в результате чего эстрогенов становится меньше;
– нарушению фолликулогенеза и развитию желтого тела — овуляции;
– формированию стойкой гипофункции яичников, недостаточности лютеиновой фазы, ановуляторные циклы, олигоменореи, аменореи [3].
Клинические проявления пролактиномы обусловлены повышенной секрецией пролактина и сдавлением опухолью близлежащие ткани.
Основными симптомами будут:
– нарушения МЦ (цикл нерегулярный, удлинение цикла до 40 дней, отсутствие овуляции, аменорея). Аменорея (отсутствие менструаций) носит гипогонадотропный характер, обусловлена первичной недостаточностью гипофиза и вторичной яичниковой недостаточностью) [3,4];
– галакторея (выделение грудного молока из молочных желез, не связанное с послеродовым периодом). Молоко может выделяться по каплям при надавливании на сосок либо независимо от контакта. Так же сочетание галактореи и аменореи носит название синдрома Форбса-Олбрайта [3];
– так как отсутствует овуляция — невозможно забеременеть;
– дефицит эстрогенов приводит к увеличению массы тела, задержки жидкости в организме, утрате либидо (половое влечение), диспареунии (болезненный коитус).
Что касается неврологической симптоматики, то она будет представлена:
– головными болями, обычно постоянного характера (за счет сдавления опухолью диафрагмы турецкого седла, иннервируемого тройничным нервом);
– зрительными нарушениями — от снижения цветоощущения до гемианопсии и потери зрения (при супраселлярном распространении опухоли с компромацией перекреста зрительных нервов);
– офтальмоплегией, диплопией, птозом
– болевыми ощущениями кожи области нижнего века, латерального угла глаза, верхней части щеки (нейропатия второй ветви тройничного нерва) [5].
Диагностику пролактиномы можно представить следующими действиями:
- Данные анамнеза и осмотра;
- УЗИ;
- Исследование уровня пролактина;
- Рентгенография турецкого седла;
- Микроаденому позволяет обнаружить МРТ с введением контрастного вещества.
В анамнезе пациентка обычно указывает на нарушения менструального цикла, бесплодие, головные боли, выделение молозива из молочных желез.
На УЗИ можно обнаружить уменьшение матки и яичников, поликистозные изменения в яичниках.
Необходимо определить концентрацию пролактина в сыворотке крови. Взятие крови осуществляется в 8–9 утра (т.к выработка пролактина носит циркадный характер ритма), в начале первой фазы цикла [5]. Существуют определенные значения для микроаденом (1500–400 МЕ/л)- и макроаденом (>8000 МЕ/л).
Рентгенография позволяет выявить опухоль, но если это не микроаденома. Для более качественной и точной визуализации применяют МРТ с введением контрастного вещества, 83–87 % микроаденом гипофиза диагностируются именно этим методом.
При пролактиномах проводят медикаментозное (основное), хирургическое и лучевое лечение. Основные цели при консервативном лечении пролактином:
- Контроль над уровнем пролактина;
- Наблюдение за размерами опухоли с целью восстановления дефектов полей зрения и функции черепно-мозговых нервов;
- Сохранение или восстановление функции гипофиза;
- Предупреждение вероятности рецидива и прогрессирования болезни.
Медикаментозная терапия будет представлена препаратами из группы агонистов дофамина (бромокрипин, абергин, каберголин) [3].
Транссфеноидальная хирургия — метод выбора при хирургическом лечении.
Лучевая терапия применяется если выше перечисленные методы неэффективны или как дополнение к ним, основной метод — радиохирургия.
Соматотропинома — это аденома гипофиза, гиперпродуцирущая соматотропный гормон (гормон роста-ГР). Составляет 20–25 % от общего числа аденом гипофиза. Заболевание чаще развивается в зрелом возрасте, 30–50 лет. Данное расстройство отличается низким качеством жизни, ранней инвалидизацией и невысокой выживаемостью.
Основной клинический синдром — это акромегалия, то есть увеличение отдельных частей тела и внутренних органов (чаще нос, конечности, язык). Нарушения менструального цикла могут быть такими же, как и при пролактиноме. Так же присутствуют жалобы на повышенную потливость, сонливость, быструю утомляемость, непереносимость жары, боли в конечностях и суставах. Нервно-офтальмологический синдром аналогичен пролактиноме.
Диагностика представляет собой комплекс процедур как при диагностике пролактиноме, только в крови исследуют концентрацию соматотропина и инсулиноподобного ростового фактора-1 (ИРФ-1), а так же при отсутствии подавления уровня ГР в крови на фоне пищевой нагрузки с 75 г глюкозы (величина минимального уровня ГР (ГР-надир) > 0,4 нг/мл). Содержание в крови ИРФ-1 отражает суточный соматотропиновый секреторный статус и является базовым показателем для диагностики акромегалии.
Лечение больных затруднено из-за несвоевременной диагностики заболевания и представляет собой:
– резекцию опухоли гипофиза;
– уменьшение содержания соматотропина и ИРФ-1;
– ослабление выраженности симптомов заболевания.
Хирургический метод — основной, он представляет собой селективную аденомэктомию трансназальным транссфеноидальным доступом.
Тиреотропинома — разновидность аденомы гипофиза, характеризующаяся гиперсекрецией тиреотропного гормона(ТРТГ). Наименее распространенное новообразование — от 0,5 до 2 % среди всех опухолей гипофиза. Встречаются в любом возрасте, наиболее часто у лиц в возрасте 30–60 лет, с равной половой частотой.
Клинически проявляются синдромом тиреотоксикоза, при опухоли больших размеров выпадают поля зрения. Помимо этого часто нарушается репродуктивная функция и функции половых желез. У женщин это нарушения менструального цикла вплоть до аменореи.
Диагностируется при помощи УЗИ щитовидной железы и анализ крови на концентрацию ТРТГ (в норме 0,4 до 4 мкМЕ/мл). Целями лечения будет восстановление эутиреоза и удаление опухоли. Метод выбора — хирургический, представлен эндоскопической трансназальной либо транскраниальной аденомэктомии [6].
Таким образом, аденома гипофиза — серьезная требующая внимания и безотлагательных действий патология, охватывающая многие органы и системы, которая приводит к нарушению регуляции репродуктивной функции женщин. У пациенток может привести к различным нарушениям менструального цикла (аменореи, нерегулярность, ановуляторные циклы), которые могут значительно снизить качество жизни и привести к такой сложной медико-социальной проблеме как бесплодие. Эта патология остается актуальной и требует более тщательного обследования больных.
- Сытый В. П., Гончар А. А., Сытый Ю. В.. Аденомы гипофиза: история, распространенность, клиника, диагностика, лечение/ Журнал проблемы здоровья и экологии -2010-№ 3-с.41–50.
- Ребекевша В. Г. Оценка маркеров пролиферации в аденомах гипофиза у женщин с нарушением репродуктивной функции /Журнал акушерства и женских болезней -2010-№ 4-c.111–117.
- Радзинский, В.Е., Фукс. А. М. Гинекология. — М.; «Гэотар» — Медиа, 2014.-1000с.
- Эрол. Р. Норвиц, Джон О.Шордж. Наглядное акушерство и гинекология. –М.;«ГЭОТАР»-Медиа,2010,-160 с.
- Насыбуллина Ф.А., Вагапова Г.Р.. Проблемные вопросы диагностики и лечения пролактином/ журнал лечащий врач-2013-№ 3-с.23.
- Петров Ю. А. Современные подходы к лечению хронического эндометрита у женщин с ранними репродуктивными потерями //Владикавказский медико-биологический вестник. -2011. –Т.ХШ. -№ 20–21. –С.42–46.
- Петров Ю. А. Результаты иммуно-микробиологической составляющей в генезе хронического эндометрита //Вестник Волгоградского государственного медицинского университета. -2011. -№ 3. –С.50–53.
- Петров Ю. А. Роль иммунных нарушений в генезе хронического эндометрита //Вестник Российского университета дружбы народов. Серия: Медицина. -2011. -№ 6. — С.282–289.
- Петров Ю. А. Современный взгляд на лечение хронического эндометрита в когортах с ранними репродуктивными потерями // Вестник Российского университета дружбы народов. Серия: Медицина. -2011. -№ 6. — С.274–282.
- Петров Ю. А. К вопросам патогенеза хронического эндометрита //Вестник Российского университета дружбы народов. Серия: Медицина. -2011. -№ 6. — С.386–392.
- Петров Ю. А. Специфика репродуктивного и контрацептивного поведения студентов медицинского университета //Валеология. -2016. -№ 2. –С.31–34
- Петров Ю. А., Байкулова Т. Ю. Клинические особенности течения беременности, родов и послеродового периода у первородящих повторнобеременых женщин//Международный журнал прикладных и фундаментальных исследований. -2016. -№ 8–5. –С.719–723.
источник
Причины нарушения работы гипофиза (ослабление образования гормонов): нарушения кровообращения головного мозга (инсульты); массивная кровопотеря; опухолевые процессы или метастазы; травмы черепа; оперативное лечение патологий головного мозга, лучевая терапия; тяжелое течение вирусных болезней, инфекций; энцефалит, менингит; поздний токсикоз беременности; аутоиммунное воспаление; врожденное недоразвитие гипофиза.
Главная причина усиленного образования гормонов – это аденома.
К нарушениям работы гипофиза может привести опухоль, сосудистые заболевания головного мозга, травмы, операции, кровопотери, врожденные аномалии развития. Они проявляются в виде недостаточного или избыточного образования гормонов. У пациентов изменяется рост, работа половых и щитовидной железы, почек, надпочечников, выделение молока, родовая деятельность у женщин. Мужчины страдают от импотенции, потери полового влечения.
В гипофизе есть две части – передняя (аденогипофиз) и задняя (нейрогипофиз). В первой образуется: пролактин, соматотропин, тиреотропин, адренокортикотропный, гонадотропные гормоны. В задней части накапливается вазопрессин, в промежуточных клетках синтезируется меланоцитостимулирующий фактор, отвечающий за цвет кожи и адаптацию глаз к темноте. Эти свойства тропных гормонов гипофиза относятся к главным. Недостаток или избыток любого из них вызывает цепь патологических реакций в организме. Нередко диагностируют бесплодие, исхудание или ожирение.
Симптомы нарушения работы гипофиза у женщин, мужчин отличается многообразием признаков. Все патологические состояния в зависимости от изменения функции делят на: со снижением образования гормонов:
- гипопитуитаризм (синдром Симмондса и Шихана), гипофизарный нанизм, несахарный диабет;
- с повышением гормонального синтеза: акромегалия, гигантизм, болезнь Иценко-Кушинга, гиперпролактинемия.
Диагностика состояния включает: анализ крови и мочи на гормоны, рентгенографию костей черепа, МРТ и КТ, ПЭТ головного мозга, ангиография для обнаружения сосудистых нарушений, пробы с либеринами гипоталамуса, так как они контролируют работу гипофиза.
ПЭТ КТ головного мозга с метионином
Чтобы оценить работу органов-мишеней, необходимо определение половых, тиреоидных гормонов, кортизола в крови.
При гормональной недостаточности используется заместительная терапия аналогами гипофизарных гормонов. При обнаружении опухоли может быть выбрано медикаментозное, лучевое или хирургическое лечение. Часто используют их в комплексе. Один из альтернативных методов – это замораживание части железы при помощи катетера, который проводится через клиновидную кость в основании черепа.
Читайте подробнее в нашей статье о нарушении работы гипофиза, вероятных заболеваниях, их признаках и лечении.
К ослаблению образования гормонов могут привести:
- нарушения кровообращения головного мозга – ишемический или геморрагический инсульт;
- массивная кровопотеря — в зоне риска женщины с частыми абортами, тяжелыми родами, пациенты с язвенными дефектами в желудке, кишечнике, перенесшие травмы или обширные операции;
- опухолевые процессы или метастазы;
- травмы черепа;
- оперативное лечение патологий головного мозга, лучевая терапия;
- тяжелое течение вирусных болезней, малярии, туберкулезных или сифилитических инфекций;
- энцефалит, менингит;
- поздний токсикоз беременности;
- аутоиммунное воспаление;
- врожденное недоразвитие гипофиза.
Главная причина усиленного образования гормонов – это аденома. Ее клетки способны к гормональной продукции, при этом остальные части гипофиза опухоль сдавливает, что приводит к значительному снижению других гипофизарных гормонов.
А здесь подробнее о диагностике и лечении гипотиреоза.
В гипофизе есть две части – передняя (аденогипофиз) и задняя (нейрогипофиз). В первой образуется:
- пролактин (стимулирует образование молока при лактации);
- соматотропин (регулирует рост);
- тиреотропин (обеспечивает синтез гормонов щитовидной железы);
- адренокортикотропный гормон (активирует кору надпочечников);
- гонадотропные – фолликулостимулирующий и лютеинизирующий (отвечают за образование половых гормонов, созревание яйцеклеток и сперматозоидов).
В задней части накапливается вазопрессин, он задерживает воду в организме и окситоцин, усиливающий сокращения матки и выделение молока. В промежуточных клетках синтезируется меланоцитостимулирующий фактор, отвечающий за цвет кожи и адаптацию глаз к темноте. Эти свойства тропных гормонов гипофиза относятся к главным. Помимо них они обладают множеством дополнительных функций. Недостаток или избыток любого из них вызывает цепь патологических реакций в организме.
При снижении образования у женщин слабо развиты грудные железы, уменьшается или прекращается выделение молока после родов. Патологическое увеличение образования гормона вызывает галакторею – истечение молока вне беременности и родов, сочетается с нарушением менструального цикла.
Дефицит гормона роста приводит к карликовости (гипофизарный нанизм), отставанию роста от возрастной нормы или гигантизму, акромегалии при избытке соматотропина.
При увеличении концентрации стимулирует образование и выделение в кровь тироксина и трийодтиронина щитовидной железой, приводя к гипертиреозу, тиреотоксикозу. Низкий уровень тиреотропного гормона вызывает гипотиреоз. Это состоянии встречается чаще, возникает при аденомах или разрушении клеток передней части гипофиза.
При его усиленной продукции увеличивается выделение гормона коркового слоя надпочечников (кортизола), половых гормонов (андрогенов, эстрогенов и прогестерона). Возникает синдром гиперкортицизма (болезнь Иценко-Кушинга). Низкое количество адренокортикотропного гормона (АКТГ) приводит к недостаточности надпочечников.
Так как АКТГ и кортизол находятся в обратной связи, то при первичном поражении надпочечников (синдром Иценко-Кушинга, раке) АКТГ ниже нормы.
Нарушение образования фолликулостимулирующего и лютеинизирующего гормона у женщин приводят к маточным кровотечениям и нарушениям менструального цикла, а у мужчин они провоцируют импотенцию и бесплодие, увеличение молочных желез (гинекомастию)
При его дефиците развивается несахарный диабет – обильно выделяется моча, избыток вазопрессина приводит к задержке жидкости в организме, нарастанию отеков.
Уменьшение синтеза гормона замедляет родовую деятельность, тормозит схватки, приводит к послеродовым кровотечениям из-за недостаточного сокращения матки, нарушает деятельность молочной железы при кормлении ребенка.
Клиническая симптоматика болезней гипофиза отличается многообразием признаков. Это связано с близостью клеток, отвечающих за разные параметры жизнедеятельности и важной ролью тропных гормонов в регуляции эндокринной системы.
Все патологические состояния в зависимости от изменения функции делят на:
- со снижением образования гормонов: гипопитуитаризм (синдром Симмондса и Шихана), гипофизарный нанизм, несахарный диабет;
- с повышением гормонального синтеза: акромегалия, гигантизм, болезнь Иценко-Кушинга, гиперпролактинемия.
Смотрите на видео о гормональном фоне и гипофизе:
Нарушается образование всех гипофизарных гормонов, что сопровождается развитием такого симптомокомплекса:
- резкое исхудание с утратой подкожного жира, объема мышечной ткани и снижением размеров внутренних органов;
- уменьшение выделения пота, сухая и сморщенная кожа серо-землистого цвета, синюшность пальцев;
- разрушаются зубы и выпадают волосы;
- у детей замедляется рост (карликовость), формирование половых признаков, умственное развитие;
- у мужчин – низкая потенция и половое влечение, выпадают волосы на подбородке, в области лобка, подмышек, уменьшается размер простаты, наружных половых органов;
- у женщин прекращаются месячные, атрофируются грудные железы, матка, исчезает пигментация сосков;
- из-за низкого уровня гормонов щитовидной железы появляется вялость, мышечная слабость, сонливость, запоры, замедляется пульс и падает давление, снижается температура тела;
- уменьшение АКТГ сопровождается гипотонией, слабым иммунитетом, падением концентрации сахара в крови;
- со стороны нервной системы – низкая двигательная и психическая активность, апатия, депрессивные реакции, быстрое старение, радикулиты с сильной болью, полиневриты, судороги.
Возникает после родов или абортов с тяжелой потерей крови. У пациенток прекращается выделение молока, уменьшаются или полностью исчезают менструации. Отмечается отечность тела, слабость, низкая активность, сонливость. Кожа теряет упругость, выпадают волосы, ногти становятся ломкими. Больные отмечают частые головокружения и обморочные состояния.
Нарушение образования соматотропина приводит к торможению роста и формирования внутренних органов. Сопровождается:
- отставанием в развитии мышечной и костной системы, максимальный рост больных достигает 120-130 см во взрослом возрасте;
- недоразвитием половых органов, сердца, легких, почек, печени;
- давление крови низкое, брадикардия;
- умственное развитие близко к норме, эмоциональная сфера приближена к юношеской.
У больных присутствует сильная жажда, обильное выделение мочи, что нарушает сон. Объем потерь жидкости может достигать 5-20 литров в сутки. Если пациент пытается пить меньше, столбы уменьшить мочеиспускание, то это приводит к тяжелому обезвоживанию.
Появляется у взрослых людей в виде укрупнения носа, ушей, нижней челюсти, губ, непропорционально больших рук и ног. Из-за высокого уровня гормона роста больные отмечают боли в костях и суставах, головные боли, нарушается зрение, работа сердца, легких, половых органов. У пациентов часто обнаруживают злокачественные и доброкачественные опухоли.
Если соматотропный гормон образуется в избытке до окончания окостенения скелета, то рост детей опережает сверстников и достигает более 2 метров в подростковом возрасте. Голова при этом кажется маленькой, а конечности – несоразмерно длинными. Больные имеют нарушения психики, обменных процессов, половой функции. Часто бесплодны.
Нарушение функций гипофиза (гигантизм)
Характерными проявлениями являются:
- красное лунообразное лицо;
- растяжки на коже;
- ожирение;
- повышенный рост волос на теле и лице;
- потемнение кожи в области локтей, шеи и мест трения одеждой;
- артериальная гипертензия;
- остеопороз с частыми переломами.
При увеличении образования пролактина у женщин нарушается менструальный цикл по типу скудных месячных (олигоменорея) или их отсутствия (аменорея). Вслед за этим начинают выделяться молокоподобные капли из молочных желез у нерожавших женщин, усиливается рост волос на теле, подбородке. Выделения из сосков также бывают и у мужчин. Для них характерна импотенция и низкое половое влечение, увеличение грудных желез. Избыток пролактина приводит к бесплодию у обоих полов.
Смотрите на видео о гиперпролактинемие:
Для обследования пациентов назначается:
- анализ крови и мочи на гормоны;
- рентгенография костей черепа;
- МРТ и КТ, ПЭТ головного мозга;
- ангиография для обнаружения сосудистых нарушений;
- пробы с либеринами гипоталамуса, так как они контролируют работу гипофиза.
Позитронно-эмиссионная томография головного мозга
Чтобы оценить работу органов-мишеней необходимо определение половых, тиреоидных гормонов, кортизола в крови.
При гормональной недостаточности используется заместительная терапия аналогами гипофизарных гормонов. При обнаружении опухоли может быть выбрано медикаментозное, лучевое или хирургическое лечение. Часто используют их в комплексе.
К нарушениям работы гипофиза может привести опухоль, сосудистые заболевания головного мозга, травмы, операции, кровопотери, врожденные аномалии развития. Они проявляются в виде недостаточного или избыточного образования гормонов.
У пациентов изменяется рост, работа половых и щитовидной железы, почек, надпочечников, выделение молока, родовая деятельность у женщин. Мужчины страдают от импотенции, потери полового влечения.
А здесь подробнее о диффузно-токсическом зобе.
Нередко диагностируют бесплодие, исхудание или ожирение. Для исследования функции гипофиза необходимо провести анализы крови и мочи на содержание гормонов, а также МРТ, КТ, ПЭТ головного мозга для исключения опухоли. Лечение болезней медикаментозное, при новообразованиях его сочетают с операцией и лучевой терапией.
Точных причин, почему может появиться аденома гипофиза, не выявлено. Симптомы опухоли головного мозга отличаются у женщин и мужчин в зависимости от того гормона, который лидирует. Прогноз при небольших благоприятный.
Довольно сложно выявить гипотиреоз, симптомы и лечение определит только опытный врач. Он бывает субклиническим, периферическим, зачастую скрытый до определенного момента. Например, у женщин может быть обнаружен после родов, у мужчин — после операции, травмы.
Довольно часто токсическая аденома на начальных этапах полностью скрыта. Симптомы появляются при разрастании узла увеличением глаз, перебоями ритма сердца и прочими. Изначально лечение проводится без операции, в случае отсутствия эффекта может быть использовано склерозирование этанолом.
Больные до конца не осознают, чем опасен может быть узловой зоб щитовидной железы. А ведь он имеет множество проявлений — диффузный, коллоидный, токсический, нетоксический. На первых стадиях симптомы могут быть скрыты. Лечение подбирает врач, иногда это полное удаление органа.
Зачастую диффузно-токсический зоб врожденный, но его провоцируют определенные факторы во взрослом возрасте. Симптомы зависят от степени поражения. Важный анализ — гормоны при болезни Грейвса. Диагностика включает УЗИ, КТ, биопсию и прочие, после назначается лечение.
источник
