Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
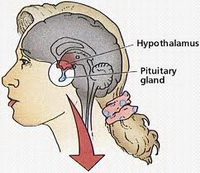
Гипогонадотропный гипогонадизм (ГГ) — заболевание, в основе которого лежит гипоталамо-гипофизарная недостаточность, сопровождающаяся задержкой полового развития центрального генеза, дефицитом эстрогенов.
Краткая информация о гипоталамусе, гипофизе и о механизмах работы данных органов изложена в статьях: «Бесплодный брак. Физиология женской репродуктивной системы» и «Бесплодный брак. Репродуктивная система женщины».
Данный вид бесплодия встречается в 15-20% случаев аменореи.
По времени развития различают врождённый и приобретённый ГГ.
По уровню повреждения различают гипоталамическую и гипофизарную формы.
По степени тяжести выделяют лёгкую, средней тяжести и тяжёлую формы.
Приобретённая недостаточность гонадотропинов — следствие воздействия внешних неблагоприятных факторов и может быть обратимой:
• аменорея (отсутствие менструации) при неврогенной анорексии (отказе от еды)
• при быстром снижении массы тела
• аменорея физической нагрузки – при чрезмерных физических нагрузках. Данное явления характерно для спортсменок.
• психогенная аменорея. Исчезновение месячных вследствие психического перенапряжения или стрессов
• послеродовый гипопитуитаризм (синдром Шиена). Как правило появляется вследствие обильной кровопотери в родах.
По причине недостаточности гипоталамо-гипофизарной системы отсутствует её циклическое стимулирующее влияние на яичники, развивается вторичная недостаточность яичников, обусловливающая отсутствие овуляции и дефицит эстрогенов. При этом анатомически и функционально яичники полноценны. Также изначально анатомически и функционально полноценны все половые органы женщины, но в условиях длительного состояния сниженного уровня эстрогенов органы репродукции претерпевают определенные дегенеративные изменения, несовместимые с наступлением беременности.
Бесплодие при ГГ относится к эндокринным формам. Основная причина бесплодия у женщин с ГГ — отсутствие роста фолликулов и овуляции. Это происходит из-за отсутствия стимулирующего влияния гонадотропинов (ФСГ, ЛГ) на фолликулярный аппарат яичников. Отсутствие гонадотропинов может быть обусловлено нарушением выработки гипофизом данных гормонов в условиях адекватной секреции Гн-РГ или отсутствием гипоталамической секреции Гн-РГ. Так же встречаются формы характеризующиеся дефектами гормонов Гн-РГ, ЛГ, ФСГ или дефектами их рецепторов на поверхности клеток мишеней.

Дефицит эстрогенов в организме женщины обусловливает характерные особенности внешности:
• Тип телосложения евнухоидный: высокий рост за счёт увеличения длины ног, увеличение длины рук, уменьшение поперечных размеров таза, увеличение ширины плеч.
• Вторичные половые признаки недоразвиты, реже отсутствуют, особенно это касается молочных желёз.
• Молочные железы у женщин с ГГ недоразвиты, иногда значительно, но могут быть нормально развиты, в зависимости от выраженности дефицита эстрогенов. При рентгенологическом или УЗИ исследовании часто выявляют полное замещение железистой ткани молочной железы жировой тканью с участками уплотненной соединительной ткани преимущественно в преареолярных (околососковых) областях. У части больных (18%) обнаруживают фиброзно-кистозную мастопатию.
• Оволосение в подмышечных впадинах и на лобке скудное или умеренное.
• Гинекологическое исследование выявляет гипоплазию наружных и внутренних половых органов. Слизистая оболочка влагалища тонкая, сухая, неэластичная. Шейка матки уменьшена, наружный зев точечный. Матка значительно уменьшенных размеров, иногда не удаётся прощупать матку отдельно от шейки. Яичники так же не прощупываются. Гипоплазия (недоразвитие) матки более выражена, чем недоразвитие яичников. Выраженное уменьшение размеров матки и яичников выявляют и при УЗИ органов малого таза.
Лабораторно инструментальные исследования
Основа диагностики ГГ, как и других форм эндокринного бесплодия, это гормональное исследование.
Характерные показатели при гипогонадизме:

1. Ввиду низкой эстрогенной насыщенности прогестероновая проба и проба с кломифеном у пациенток с ГГ отрицательная.
2. Циклическая гормональная проба — положительная.
Приведенные выше примеры лабораторной диагностики носят своей целью определение функционального состояния репродуктивной системы.
• ГГ с лёгкой степенью гипоталамо-гипофизарной недостаточности. При позднем наступлении менструации с нерегулярными скудными выделениями менструации исчезают вовсе. Телосложение пропорциональное. Молочные железы развиты с жировым замещением железистой ткани. Размеры матки и яичников соответствуют возрасту 12-13 лет. Уровни гонадотропинов в крови: ЛГ 5,8 МЕ/л (3,6-9,3 МЕ/л), ФСГ 2,6 МЕ/л (1,3-3,8 МЕ/л), эстрадиол — 50 пмоль/л (25,7-75,3 пмоль/л).
1. УЗИ органов малого таза для определения степени гипоплазии матки и яичников
2. липидограмма
3. исследование минеральной плотности костной ткани для выявления и профилактики возможных системных нарушений на фоне длительной гипоэстрогении
• ГГ с умеренной степенью гипоталамо-гипофизарной недостаточности. При наступлении менструации, но после 2-4 редких менструаций цикл исчезает. Телосложение диспропорциональное. Молочные железы недоразвиты, уменьшены в размере с жировым замещением железистой ткани. Размеры матки и яичников соответствуют возрасту 10-11 лет. Уровни гонадотропинов в крови: ЛГ 2,0 МЕ/л (1,7-2,5 МЕ/л), ФСГ 1,3 МЕ/л (1,1-1,6 МЕ/л), эстрадиол 30 пмоль/л (22,8-37,2 пмоль/л).
• ГГ с тяжёлой степенью гипоталамо-гипофизарной недостаточности. Полное отсутствие менструации, клинически больные характеризуются евнухоидными чертами телосложения. Молочные железы визуально отсутствуют или очень слабо развиты, с полным жировым замещением железистой ткани. Размеры матки и яичников женщины соответствуют таковым в возрасте 2-7 лет. Уровни гонадотропинов в крови: ЛГ 1,8 МЕ/л (1,3-2,4 МЕ/л), ФСГ ниже 1 МЕ/л, эстрадиол: ниже 30 пмоль/л.
Лечение бесплодия складывается из двух этапов: подготовительный этап и индукция овуляции.
1. На подготовительном этапе производят заместительную циклическую гормонотерапию последовательным назначением эстрогенов и гестагенов с целью коррекции гормонального статуса женщины. Так же производится стимулирование роста и развития женских половых органов: увеличения размеров матки, роста эндометрия, формирования рецепторного аппарата в органах-мишенях, что повышает эффективность последующей стимуляции овуляции. Длительность подготовительной терапии определяется в зависимости от выраженности гипогонадизма и составляет в среднем 3-12 месяцев.
2. Индукция овуляции производится гонадотропинами и преследует цель – осуществление овуляции. Адекватность назначенного лечения оценивается посредством УЗИ исследования фолликулов яичников. Адекватность дозы применяемых препаратов оценивают по динамике роста фоллликулов (в норме — 2 мм в сутки). При медленном росте фолликулов дозу увеличивают, при слишком быстром росте — снижают. Медикаментозное лечение продолжают до образования зрелых фолликулов диаметром 18-20 мм. Затем в/м однократно вводят определенную дозу хорионического гонадотропина (ХГЧ). Под контролем УЗИ наблюдают за овуляцией – отсутствие доминантного фолликула говорит о том, что произошла овуляция.
После констатации овуляции проводят поддержку лютеиновой фазы цикла препаратами из группы гестагенов.
Профилактика развития бесплодия при дефиците эстрогенов включает заместительную терапию. Исходя из механизме развития заболевания, общепризнанна необходимость проведения заместительной терапии женскими половыми гормонами — эстрогенами и гестагенами, цель которой — формирование женской внешности.
• В период полового созревания — для формирования женского типа телосложения, нормального развития половых органов, молочных желёз и вторичных половых признаков, а также для достижения нормальной массы костной ткани. Необходимы ранняя диагностика ГГ и своевременное назначение заместительной гормональной терапии (с 16-18 лет), продолжение её по возможности непрерывно до 20-23 лет.
• В репродуктивный период — перед индукцией овуляции в качестве подготовки к беременности желательна заместительная гормональная терапия в течение 3 месяцев. После беременности, родов и лактации необходима заместительная гормональная терапия виде длительных курсов минимум в течение 12 месяцев с целью профилактики остеопороза.
• В период после рождения ребенка — необходимы диагностика системных изменений, вызванных гормональными нарушениями и их коррекция с помощью заместительной гормональной терапии, фитотерапии и специфических препаратов для лечения остеопороза. Заместительную гормональную терапию при гипогонадотропном гипогонадизме у женщин можно продолжать до возраста естественной менопаузы (45-50 лет).
Автор: Ткач И.С. врач, хирург офтальмолог
источник
Аденома гипофиза – это доброкачественная опухоль гипофиза, исходящая из его передней части (аденогипофиза).
Вес всего гипофиза составляет примерно 1 г., но это главный дирижер всей эндокринной системы организма человека.
Поэтому, при возникновении в нем даже самой маленькой опухоли появляется эндокринно-обменный синдром, проявления которого зависят от повышенной продукции того или иного гормона гормонально-активной аденомой гипофиза.
Чаще всего (в 50% случаев) среди аденом гипофиза встречается пролактинома.
Пролактинома секретирует пролактин – лактотропный гормон, стимулирующий секрецию молока в молочных железах.
Рецепторы пролактина расположены во многих органах, не только в молочных железах: в матке, в яичниках, в надпочечниках, тимусе, печени и других.
И его повышение ( гиперпролактинемия ) вызывает нарушение менструального цикла, бесплодие , снижение либидо ( нежелание заниматься сексом) , депрессию, раздражительность.
Повышение пролактина в крови бывает не только при пролактиноме. Часто причинами гиперпролактинемии являются гипотериоз и другие заболевания, но аденома гипофиза – это основная причина.
В аденоме могут быть признаки кровоизлияний в опухоль, кистозные изменения, для пролактином характерны кальцификаты. Аденомы гипофиза редко переходят в рак (не имеют признаков злокачественности), но могут прорастать в твердую оболочку мозга и кости черепа.
Клинические симптомы аденомы зависят от активации органа – мишени и направления роста опухоли. При пролактиномах примерно у трети женщин наблюдаются гипертрихоз (избыточный рост волос на теле), умеренное ожирение, акне, себорея. Основным синдромом при пролактиноме является синдром галактореи — аменореи. Нередко бывает только галакторея или аменорея.
Чаще всего аденома гипофиза сопровождается тупой головной болью , не сопровождающейся тошнотой, и не снимающейся анальгетиками, офтальмоплегией (паралич мышц глаза из-за поражения черепно-мозговых нервов), диплопия (двоение в глазах). При росте опухоли книзу появляются заложенность носа и ликворея (истечение из носа цереброспинальной жидкости).
Методы лечения аденомы, пролактиномы в частности, обусловлены выраженностью клинических проявлений.
Пролактиномы любого размера сперва лечат консервативно агонистами дофаминовых рецепторов (парлодел, достинекс (каберголин), они принимаются только по назначению и под контролем врача). Нельзя заниматься самолечением и уповать на народные методы лечения аденомы гипофиза, это чревато негативными последствиями.
На фоне грамотного длительного лечения можно разрешить беременность, так как после родов опухоль может уменьшиться.
Но в период беременности рост опухоли может ускориться, что сопровождается усилением головной боли.
При аденоме больших размеров, ее резистентности к медикаментозному лечению и нарастании офтальмологических симптомов показано оперативное лечение опухоли.
Многие боятся операции, что естественно для любого человека, а не только для пациента с аденомой гипофиза, чья нервная система находится под влиянием измененного гормонального фона. Но удаление аденомы гипофиза чаще всего проводится микрохирургическим методом, и нестабильный эмоциональный фон после этого нормализуется.
Нейрохирургическая операция проводится при больших опухолях, и если врачи говорят, что делать ее надо, значит, это действительно так. Операция и последующее облучения позволят предотвратить дальнейшее распространение аденомы и ее малигнизацию.
При пролактиномах прогноз для жизни благоприятный. Более того, после удаления аденомы гипофиза, женщина сможет избавиться от бесплодия, если причиной было именно это заболевание.
Только не надо заниматься самодиагностикой, и приписывать себе все только что прочитанные описания болезней, как студенты-первокурсники в медицинском университете.
Диагноз «Аденома гипофиза» ставится только специалистами на основе комплексного обследования.
источник
В последние годы увеличивается число женщин, страдающих различными нарушениями менструальной функции, а также возрастает количество бесплодных браков, причем среди причин бесплодия доминирующую роль играют эндокринные факторы.
Гипоталамические и гипофизарные формы бесплодия у женщин; этиология и патогенез, клинико-лабораторные данные
В последние годы увеличивается число женщин, страдающих различными нарушениями менструальной функции, а также возрастает количество бесплодных браков, причем среди причин бесплодия доминирующую роль играют эндокринные факторы.
Этиология:
1. Патология гипофиза.
• Синдром Шихена (о. гипопитуитаризм).
• Гипофизарный гипогонадизм.
• Гиперпролактинемия (пролактинома, гипотиреоз, нейролептики ).
• Гипофизарный нанизм.
• Болезнь Иценко-Кушинга.
2. Патология гипоталамуса.
• Синдром Каллмена.
• Нейрогенная анорексия.
• Перетренированность, тяжелый физический и умственный труд.
• Синдром Бабинского-Фрелиха.
Патогенез:
Данные виды бесплодия являются гипогонадотропными формами гипогонадизма. Таким образом, имеются нарушения выработки гонадотропинов (ФСГ и ЛГ), что приводит в свою очередь к нарушению деятельность регулируемых ими яичников, а также снижению в крови содержания эстрогенов, прогестерона и в моче 17-КС. Таков механизм возникновения бесплодия при синдроме Шихена, гипофизарном нанизме и гипогонадизме, синдроме Каллмена, Бабинского-Фрелиха.
При болезни Иценко-Кушинга наблюдается недостаточная стимуляция яичников гонадотропинами за счет блокады зон аденогипофиза при гиперпродукции кортикотропина.
Особое внимание следует уделить патогенезу бесплодия при гиперпролактинемии. Увеличение выработки пролактина наблюдается при пролактиноме, гипотиреозе, а также применении нейролептиков. Различают следующие группы факторов, ведущих к гиперпролактинемии:
• операции на молочной железе и грудной клетке.
• стрессы.
• избыточная пальпация молочной железы.
• избыточное употребление пива.
• избыток жирной пищи.
Увеличенное количество пролактина вызывает блок выработки ФСГ и ЛГ, приводит к снижению количества эстрогенов, аменорее и атрофии половых органов, а также снижению выработки прогестерона. Увеличенное количество пролактина в крови, высокий уровень ТТГ и бесплодие могут свидетельствовать о развитии гипотиреоза.
Клинико-лабораторные проявления:
Диагностический поиск начинается с анализа жалоб и сбора анамнеза. Наиболее характерны жалобы на нарушение менструальной функции по типу олиго- или аменореи ( первичной или вторичной ), бесплодие ( первичное или вторичное ), иногда на выделения из сосков (галакторея). Особую группу составляют больные с жалобами на избыточный рост волос на лице и теле по мужскому типу ( гирсутизм ), вульгарные угри, жирную себорею, выпадение волос на голове (алопецию ) и др. Данный симптомокомплекс является отражением гиперандрогении и будет рассмотрен отдельно.
Клиническое обследование должно включать:
— оценку роста и массы тела с вычислением индекса массы тела;
— оценку фенотипа ( женский, мужской );
— оценку состояния кожи ( цвет, влажность или сухость, наличие стрий, себореи, вульгарных угрей, характер полового оволосения, состояние волос на волосистой части головы);
— оценка степени развития молочных желез, наличие или отсутствие галактореи, тяжистых или узловатых уплотнений;
— гинекологическое бимануальное исследование и осмотр шейки матки в зеркалах;
— оценку общего состояния ( заторможенность, отечность, артериальное давление, пульс, изменение черт лица, увеличение размера обуви и т.д. );
— регистрацию осмотических генетических стигм ( высокое небо, короткая шея, бочкообразная грудь и др.).
Кроме общеклинического исследования, применяются функциональные тесты — измерение базальной, или ректальной температуры в течение не менее 3-х месяцев, оценка состояния цервикальной слизи ( симптом «зрачка», симптом натяжения слизи, симптом арборизации), кольпоцитология вагинального мазка с подсчетом индекса созревания и кариопикнотического индекса.
При бесплодном браке обязательным является обследование мужа: (сперматограмма, посткоитальный тест, консультация андролога).
Для уточнения уровня нарушения репродуктивной и других систем используют весь спектр современных методов обследования, включающий ЭЭГ,РЭГ, рентгенологические методы, КТ,МРТ, УЗИ, лапароскопию, гистероскопию с морфологическим исследованием. Кроме того, в ряде случаев необходимо определение уровня гипофизарных ( ЛГ, ФСГ, ПРЛ, ТТГ, СТГ и АКТГ ) и стероидных гормонов — Э-2 и других фракций эстрогенов, прогестерона, тестостерона, андростендиона, дегидроэпиандростерона ( ДЭА ) и его сульфата, 17-гидроксипрогестерона, кортизола и т.п. При необходимости проводят генетическое обследование.
При одновременном снижении уровней Э-2, ЛГ и ФСГ на фоне нормального содержания пролактина речь идет о вторичной гипофункции яичников, обусловленной выпадением их стимуляции со стороны гипоталамо -гипофизарной системы, т.е. о гипогонадотропной гипофункции яичников.
К гипогонадотропной гипофункции яичников условно относят так называемую нормогонадотропную гипофункцию, при которой базальный уровень гонадотропных гормонов не снижен. Однако, при определении частоты и амплитуды секреторных импульсов ЛГ и ФСГ обнаруживают нарушение циклического ритма их секреции.
источник
Эндокринное бесплодие – комплекс гормональных нарушений, ведущих к нерегулярности овуляции или ее отсутствию у женщин и нарушению качества спермы у мужчин. В его основе могут лежать нарушения функций щитовидной железы, половых желез, гипоталамо-гипофизарной регуляции. Лечение эндокринного бесплодия заключается в устранении его причины, коррекции существующих нарушений и поддержании нормального гормонального фона. Нормализация нарушенных функций приводит к наступлению беременности в 70-80% случаев эндокринного бесплодия. В остальных случаях в настоящее время перспективным считается устранение эндокринного бесплодия методом ЭКО.
Эндокринное бесплодие – комплекс гормональных нарушений, ведущих к нерегулярности овуляции или ее отсутствию у женщин и нарушению качества спермы у мужчин. В его основе могут лежать нарушения функций щитовидной железы, половых желез, гипоталамо-гипофизарной регуляции. Нормализация нарушенных функций приводит к наступлению беременности в 70-80% случаев эндокринного бесплодия. В остальных случаях в настоящее время перспективным считается устранение эндокринного бесплодия методом ЭКО. У каждой третьей бесплодной женщины причина бесплодия кроется в патологии эндокринной системы.
Понятие «эндокринного бесплодия» является собирательным, включающим различные нарушения механизмов гормональной регуляции менструального цикла: на гипоталамо-гипофизарно-яичниковом уровне, в системах ТТГ-щитовидная железа, АКТГ — кора надпочечников и др. Независимо от причин эндокринного бесплодия, в основе его развития лежит нарушение функции яичников, проявляющееся стойкой ановуляцией (отсутствием овуляции) или ее нерегулярностью.
Ановуляция может возникать при заинтересованности центральной нервной и иммунной систем, желез внутренней секреции, репродуктивных органов-«мишеней». Ановуляция, ведущая к эндокринной форме бесплодия, может развиваться в результате:
Обычно наблюдается после черепно-мозговых травм и травм грудной клетки, при опухолях гипоталамо-гипофизарной области и сопровождается гиперпролактинемией. Увеличение секреции пролактина ведет к торможению циклической продукции ЛГ и ФСГ гипофизом, угнетению функций яичников, редким менструациям (по типу олиго- и опсоменореи), развитию стойкой ановуляции и эндокринного бесплодия.
- Гиперандрогении яичникового или надпочечникового генеза
Присутствие в организме женщины небольшого количества андрогенов – мужских половых гормонов необходимо для полового созревания и правильного функционирования яичников. Усиленная секреция андрогенов может осуществляться яичниками либо надпочечниками, а иногда обеими железами одновременно. Чаще всего гиперандрогения у женщин сопровождает синдром поликистозных яичников, вызывая эндокринное бесплодие, ожирение, гирсутизм, кровотечения, олиго- и аменорею, двустороннее поражение яичников с изменением их морфологической структуры.
Надпочечниковая гиперандрогения чаще развивается в результате гиперплазии коры надпочечников с вторичным вовлечением яичников (вторичный поликистоз яичников).
- Нарушений функции щитовидной железы
Течение гипотиреоза и диффузного токсического зоба нередко сопровождается ановуляцией, вторичной гиперпролактинемий, эндокринным бесплодием, невынашиванием беременности, аномалиями плода.
- Дефицита эстрогенов и прогестерона (при недостаточности лютеиновой фазы)
Недостаток женских половых гормонов вызывает неполноценную секреторную трансформацию эндометрия, изменение функции маточных труб, препятствует прикреплению плодного яйца в полости матки. Это приводит к невынашиванию беременности или эндокринному бесплодию.
- Тяжелых соматических патологий (цирроза, гепатитов с выраженным повреждением клеток печени, туберкулеза, аутоиммунных и системных заболеваний соединительной ткани, злокачественных новообразований различной локализации и т. д.).
- Ожирения или недостатка жировой ткани
Жировая ткань в организме также выполняет эндокринную функцию, оказывая влияние на метаболические процессы в тканях, в т. ч. репродуктивной системы. Избыток жировых отложений вызывает гормональный дисбаланс, нарушение менструальной функции и развитие эндокринного бесплодия. В то же время, ограничение потребления жиров или резкая потеря массы тела нарушают нормальное функционирование яичников.
В основе синдрома лежит нарушение гипофизарно-яичниковой связи — нечувствительность рецепторного аппарата яичников к гонадотропинам, стимулирующим овуляцию, что проявляется аменореей, эндокринным бесплодием при нормально развитых половых признаках и высоком уровне гонадотропных гормонов. Повреждение яичников могут вызывать инфицирование вирусами краснухи, гриппа, патология ранее развивавшейся беременности, авитаминоз, голодание, стрессовые ситуации.
- Преждевременной менопаузы (синдрома истощенных яичников)
Вторичная аменорея, возникающая у молодых женщин до 35 — 38 лет, вызывает характерные для климактерического синдрома изменения и ведет к эндокринному бесплодию.
- Заболевания, связанные с мутациями половых хромосом
При заболеваниях, вызванных хромосомными аномалиями, наблюдается недостаточность женских половых гормонов, половой инфантилизм, первичная аменорея и эндокринное бесплодие (синдромы Марфана, Тернера).
Основными проявлениями эндокринного бесплодие являются невозможность наступления беременности и отклонения в менструальном цикле. Менструации могут наступать с задержками различной выраженности (от недели до полугода), сопровождаться болезненностью и обильными выделениями либо отсутствовать совсем (аменорея). Нередко отмечаются мажущие кровянистые выделения в межменструальный период.
У 30% пациенток с эндокринной формой бесплодия менструальные циклы носят ановуляторный характер и по своей продолжительности соответствуют нормальному менструальному циклу (21-36 дней). В таких случаях речь идет не о менструации, а о менструальноподобном кровотечении.
У пациенток отмечаются боль в нижних отделах живота или пояснице, выделения из половых путей, диспареуния, циститы. Могут наблюдаться напряжение и тяжесть в молочных железах, галакторея (выделения молозива из сосков), связанные с повышением уровня пролактина. Характерен синдром предменструального напряжения – ухудшение состояния накануне менструации. При гиперандрогении, сопровождающей эндокринное бесплодие, развиваются акне, гирсутизм или гипертрихоз, алопеция. Наблюдаются колебания артериального давления, развитие ожирение или похудание, образование стрий на коже.
При сборе анамнеза у пациенток с эндокринным бесплодием уточняется время начала менструаций, их обильность, болезненность, наличие в анамнезе (в т. ч. матери пациентки) нарушений менструальной функции, наличие и длительность отсутствия беременностей, при наличии – исход и осложнения беременностей. Необходимо выяснить, проводились ли ранее гинекологические операции и манипуляции, тип и длительность использования контрацепции.
Общий осмотр включает оценку роста пациентки (менее 150 см или более 180 см), наличие ожирения, вирилизма, развития молочных желез и вторичных половых признаков. Проводится консультация гинеколога, в ходе которой при гинекологическом осмотре выясняют форму и длину влагалища и матки, состояние шейки матки, параметрия и придатков. По данным общего и гинекологического осмотров выясняются такие причины эндокринного бесплодия, как половой инфантилизм, поликистоз яичников и др. Оценку гормональной функции яичников и наличие овуляции при эндокринном бесплодии определяют с помощью функциональных тестов: построения и анализа базальной температурной кривой, мочевого теста на овуляцию, ультразвукового мониторинга созревания фолликула и контроля овуляции.
По графику базальной температуры определяется наличие или отсутствие свершения овуляции. Базальная температурная кривая отражает уровень постовуляторной выработки яичниками прогестерона, подготавливающего эндометрий матки к имплантации оплодотворенной яйцеклетки. Базальная кривая строится на основе показателей утренней температуры, измеряемой ежедневно в одно и то же время в прямой кишке. При овуляторном цикле график температуры двухфазный: в день овуляции ректальная температура падает на 0,2-0,3 °С, а во второй фазе цикла, продолжающейся от 12 до 14 дней, поднимается в сравнении с температурой первой фазы на 0,5-0,6 °С. Ановуляторный менструальный цикл характеризуется монофазной температурной кривой (стойко ниже 37 °С), а недостаточность лютеиновой фазы проявляется укорочением второй фазы цикла менее 11-12 дней.
Подтвердить или опровергнуть факт совершения овуляции можно с помощью определения уровня прогестерона в крови и прегнандиола в моче. При ановуляторном цикле эти показатели во второй фазе крайне низки, а при недостаточной лютеиновой фазе — снижены в сравнении с овуляторным менструальным циклом. Проведение теста на овуляцию позволяет определить увеличение концентрации ЛГ в моче за 24 часа до совершения овуляции. Ультразвуковой мониторинг фолликулогенеза дает возможность проследить созревание в яичнике доминантного фолликула и высвобождение из него яйцеклетки.
Отражением функционирования яичников служит состояние эндометрия матки. В соскобе или биоптате эндометрия, взятого за 2-3 дня до ожидаемой менструации, при ановуляции и эндокринном бесплодии обнаруживается гиперплазия разной степени выраженности (железисто-кистозная, железистая, полипоз, аденоматоз) или секреторная недостаточность.
Для выяснения причин эндокринного бесплодия определяют уровни ФСГ, эстрадиола, ЛГ, пролактина, ТТГ, тестостерона, Т3, Т4, ДЭА-С (дегидроэпиандростерон-сульфата) на 5-7-й день в течение нескольких менструальных циклов. Проведение гормональных проб позволяет уточнить состояние различных звеньев репродуктивной системы при эндокринном бесплодии. Механизм проведения данных проб заключается в измерении уровня собственных гормонов пациентки после приема определенных стимулирующих гормональных препаратов.
При необходимости уточнения причин эндокринного бесплодия проводится рентген черепа, УЗИ щитовидной железы, яичников, надпочечников, диагностическая лапароскопия. Диагноз эндокринного бесплодия женщине устанавливается только после исключения мужского фактора бесплодия (наличие нормальной спермограммы), а также патологии со стороны матки, иммунологической и трубной форм бесплодия.
Первый этап лечения эндокринного бесплодия включает нормализацию нарушенных функций эндокринных желез (коррекцию сахарного диабета, ожирения, деятельности надпочечников, щитовидной железы, удаление опухолей и т. д.). В дальнейшем проводится гормональная стимуляция созревания доминантного фолликула и овуляции. Для стимуляции овуляции назначается препарат кломифен цитрат, вызывающий увеличение секреции гипофизом фолликулостимулирующего гормона. Из наступивших после стимуляции кломифен цитратом беременностей 10% — многоплодные (чаще двойни и тройни).
В случае отсутствия беременности в течение 6 овуляторных циклов при стимуляции кломифен цитратом прибегают к лечению гонадотропинами: ЧМГ (человеческим менопаузальным гонадотропином), р-ФСГ (рекомбинантным фолликулостимулирующим гормоном), и ХГЧ (хорионическим гонадотропином человека). Лечение гонадотропинами повышает частоту наступления многоплодной беременности и развития побочных эффектов.
В большинстве случаев эндокринное бесплодие поддается гормональной коррекции, в остальных показано оперативное вмешательство. При синдроме поликистозных яичников прибегают к их клиновидной резекции лапароскопическим методом или лапароскопической термокаутеризации. После проведения лапароскопической термокаутеризации наблюдается наивысший процент наступления беременностей – от 80 до 90% случаев, т. к. исключается образование спаек в малом тазу.
При эндокринном бесплодии, отягощенном трубно-перитонеальным фактором или снижением фертильности спермы, показано проведение метода экстракорпорального оплодотворения (ЭКО) с пересадкой готовых к развитию эмбрионов в полость матки. Добиться наступления и вынашивания беременности у женщин с эндокринным бесплодием возможно только при комплексном решении данной проблемы.
Сегодня эндокринное бесплодие не является приговором. Современная гинекология и эндокринология совместными усилиями успешно лечат 80% пациенток, применяя только медикаментозные методы. Если произошло восстановление овуляции и нет других факторов бесплодия, более 50% женщин беременеет на протяжении первых шести циклов стимулирующей гормональной терапии. Менее благоприятные результаты от медикаментозной терапии при эндокринном бесплодии, вызванном дисфункцией гипоталамо-гипофизарной регуляции.
Сразу после наступления беременности устанавливается тщательный контроль за ее развитием, госпитализация пациентки проводится при признаках самопроизвольного прерывания беременности. Нередко отмечаются дискоординация и слабость родовой деятельности.
Заботиться о профилактике эндокринных форм бесплодия необходимо с детского возраста. Уменьшение и предупреждение детских инфекций, хронического тонзиллита, ревматизма, гриппа, токсоплазмоза в детском и подростковом возрасте позволит избежать нарушений функции яичников и процессов гипоталамо-гипофизарной регуляции.
Превентивное значение имеет правильное эмоциональное и физическое воспитание девочек, т. к. функция яичников нередко страдает вследствие умственного перенапряжения, психологических и сексуальных травм. Неоспорим тот факт, что часто эндокринное бесплодие развивается после патологических родов, прерывания беременности, интоксикаций, воспалительных инфекций женской репродуктивной сферы, поэтому следует уделять внимание профилактике данных состояний.
Правильное ведение беременности, разумное использование некоторых лекарственных средств, в особенности гормонов во время беременности, помогут избежать врожденной гипофункции яичников и гиперплазии коры надпочечников у девочек.
источник
Дата публикации: 20.04.2017 2017-04-20
Статья просмотрена: 2694 раза
Романенко В. А., Теплякова М. А., Шабаева В. И. Гормональные нарушения при аденоме гипофиза как причина бесплодия // Молодой ученый. 2017. №14.2. С. 36-39. URL https://moluch.ru/archive/148/41929/ (дата обращения: 18.07.2019).
Представлена информация об аденоме гипофиза и расстройствах менструального цикла, встречающихся при данном заболевании и приводящих к бесплодию. Особое внимание уделено современной классификации аденом гипофиза, их распространенности, рассмотрены варианты этой доброкачественной опухоли и клинические проявления, диагностика. Отмечены возможности и варианты лечения при каждом из них. Подробно описаны нарушения фертильности женщин при данной патологии.
Ключевые слова: аденома гипофиза, доброкачественная опухоль, фертильность, менструальный цикл, пролактинома, МРТ, соматотропинома, аменорея
Проблемы бесплодия продолжают будоражить умы людей, на первом месте идет стерильность воспалительного генеза [7,9,10,8,6], на втором гормональное бесплодие [11].
Влияние аденомы гипофиза на нарушения менструального цикла и репродуктивной функции остаётся актуальной проблемой современной гинекологии [12]. Аденома гипофиза — это доброкачественное новообразование, происходящее из железистой ткани аденогипофиза, явлениями чего будут возникновения гипер- или гипосекреция гормонов. Между всеми интракраниальными опухолями занимает третье место по встречаемости после глиом и менингиом [1]. Процент встречаемости данного заболевания между всеми первичными опухолями ЦНС составляет от 7,3 до 18 % и выявляется в возрасте от 20 до 50 лет. Чаще встречается у женщин 20–30 и 50–60 лет [2]. Помимо серьезных неврологических расстройств, данная патология может привести к не менее серьезным нарушениям репродуктивной функции женщин.
Целью нашей работы явилось изучение особенностей вариаций аденом гипофиза и нарушений менструального цикла при данной патологии.
Репродуктивная система женщины представлена по типу функциональной системы [11], в которой все компоненты взаимодействуют в целях обеспечения различных полезных адаптивных результатов (Анохин П. К., 1974). Менструальный цикл (МЦ) является неотъемлемой частью этой структуры, и его регуляция осуществляется по принципу обратной связи, которая обеспечивается правильным синхронным взаимодействием всех уровней [3]. Гипофиз, а точнее, его передняя доля — аденогипофиз, которая синтезирует гонадотропные гормоны, представляет собой третий уровень из пяти. Поэтому, функциональные и органические поражения этого органа получают отклик со стороны репродуктивной системы женщины в виде расстройств МЦ и половой функции, сложностей с зачатием, бесплодия.
Различат следующие классификации аденом гипофиза:
- По гормональной активности аденомы гипофиза делятся на гормонально активные (ГА) и гормонально неактивные (НАГ). Гормонально активные аденомы могут клинически себя никак не проявлять, если количество вырабатываемого гормона незначительно выше или ниже нормы, но если выработка или недостаток гормона усиливается, то появляется соответствующий симптом.
- По гистологическому критерию подразделяются на:
– микроаденома (не более 10мм);
Рассмотрим наиболее распространенные из них.
Пролактиномы наиболее часто встречаются среди аденом гипофиза и составляют 40–50 % от них. Это гормонально активная опухоль, секретирующая повышенное количество пролактина. Наблюдается у женщин детородного возраста в 6–10 раз чаще, чем у мужчин. В норме пролактин вместе с фолликулостимулирущим (ФСГ) и лютеинизирующим гормонами (ЛГ) оказывает регулирующее действие на фертильную функцию женщины. К функциям пролактина можно отнести:
– синхронизирует созревание фолликула и овуляцию совместно с ЛГ;
– поддерживает существование желтого тела и образование прогестерона через участие в синтезе холестерина;
– подготавливает молочные железы к лактации;
– регулирует объем и состав амниотической жидкости;
– стимулирует молокообразование в альвеолах молочных желез во время лактации [3].
Таким образом, пролактин — один из основных гормонов, необходимых для репродукции, от него зависит овуляция, лактация. Верхней границей нормы пролактина у женщин является 25нг/мл(500 мЕД/л), это значение необходимо для диагностики гипер- или гипопролактинемии.
По локализации в пределах гипофизарной ямки и своим размерам пролактиномы делятся на:
- Интрасселярные микропролактиномы (пролактинсекретирующие аденомы диаметром до 1 см, находящиеся в пределах турецкого седла);
- Экстрасселярные макропролактиномы (пролактинсекретирущие аденомы диаметром более 1 см, выходящие за пределы турецкого седла).Размеры опухоли во многом определяют симптоматику и выбор терапии [5].
В основе патогенеза лежит патологическое повышение в крови концентрации пролактина, которое ведет к:
– нарушению рецепции к ЛГ, препятствует секреции тестостерона гранулезными клетками фолликула,в результате чего эстрогенов становится меньше;
– нарушению фолликулогенеза и развитию желтого тела — овуляции;
– формированию стойкой гипофункции яичников, недостаточности лютеиновой фазы, ановуляторные циклы, олигоменореи, аменореи [3].
Клинические проявления пролактиномы обусловлены повышенной секрецией пролактина и сдавлением опухолью близлежащие ткани.
Основными симптомами будут:
– нарушения МЦ (цикл нерегулярный, удлинение цикла до 40 дней, отсутствие овуляции, аменорея). Аменорея (отсутствие менструаций) носит гипогонадотропный характер, обусловлена первичной недостаточностью гипофиза и вторичной яичниковой недостаточностью) [3,4];
– галакторея (выделение грудного молока из молочных желез, не связанное с послеродовым периодом). Молоко может выделяться по каплям при надавливании на сосок либо независимо от контакта. Так же сочетание галактореи и аменореи носит название синдрома Форбса-Олбрайта [3];
– так как отсутствует овуляция — невозможно забеременеть;
– дефицит эстрогенов приводит к увеличению массы тела, задержки жидкости в организме, утрате либидо (половое влечение), диспареунии (болезненный коитус).
Что касается неврологической симптоматики, то она будет представлена:
– головными болями, обычно постоянного характера (за счет сдавления опухолью диафрагмы турецкого седла, иннервируемого тройничным нервом);
– зрительными нарушениями — от снижения цветоощущения до гемианопсии и потери зрения (при супраселлярном распространении опухоли с компромацией перекреста зрительных нервов);
– офтальмоплегией, диплопией, птозом
– болевыми ощущениями кожи области нижнего века, латерального угла глаза, верхней части щеки (нейропатия второй ветви тройничного нерва) [5].
Диагностику пролактиномы можно представить следующими действиями:
- Данные анамнеза и осмотра;
- УЗИ;
- Исследование уровня пролактина;
- Рентгенография турецкого седла;
- Микроаденому позволяет обнаружить МРТ с введением контрастного вещества.
В анамнезе пациентка обычно указывает на нарушения менструального цикла, бесплодие, головные боли, выделение молозива из молочных желез.
На УЗИ можно обнаружить уменьшение матки и яичников, поликистозные изменения в яичниках.
Необходимо определить концентрацию пролактина в сыворотке крови. Взятие крови осуществляется в 8–9 утра (т.к выработка пролактина носит циркадный характер ритма), в начале первой фазы цикла [5]. Существуют определенные значения для микроаденом (1500–400 МЕ/л)- и макроаденом (>8000 МЕ/л).
Рентгенография позволяет выявить опухоль, но если это не микроаденома. Для более качественной и точной визуализации применяют МРТ с введением контрастного вещества, 83–87 % микроаденом гипофиза диагностируются именно этим методом.
При пролактиномах проводят медикаментозное (основное), хирургическое и лучевое лечение. Основные цели при консервативном лечении пролактином:
- Контроль над уровнем пролактина;
- Наблюдение за размерами опухоли с целью восстановления дефектов полей зрения и функции черепно-мозговых нервов;
- Сохранение или восстановление функции гипофиза;
- Предупреждение вероятности рецидива и прогрессирования болезни.
Медикаментозная терапия будет представлена препаратами из группы агонистов дофамина (бромокрипин, абергин, каберголин) [3].
Транссфеноидальная хирургия — метод выбора при хирургическом лечении.
Лучевая терапия применяется если выше перечисленные методы неэффективны или как дополнение к ним, основной метод — радиохирургия.
Соматотропинома — это аденома гипофиза, гиперпродуцирущая соматотропный гормон (гормон роста-ГР). Составляет 20–25 % от общего числа аденом гипофиза. Заболевание чаще развивается в зрелом возрасте, 30–50 лет. Данное расстройство отличается низким качеством жизни, ранней инвалидизацией и невысокой выживаемостью.
Основной клинический синдром — это акромегалия, то есть увеличение отдельных частей тела и внутренних органов (чаще нос, конечности, язык). Нарушения менструального цикла могут быть такими же, как и при пролактиноме. Так же присутствуют жалобы на повышенную потливость, сонливость, быструю утомляемость, непереносимость жары, боли в конечностях и суставах. Нервно-офтальмологический синдром аналогичен пролактиноме.
Диагностика представляет собой комплекс процедур как при диагностике пролактиноме, только в крови исследуют концентрацию соматотропина и инсулиноподобного ростового фактора-1 (ИРФ-1), а так же при отсутствии подавления уровня ГР в крови на фоне пищевой нагрузки с 75 г глюкозы (величина минимального уровня ГР (ГР-надир) > 0,4 нг/мл). Содержание в крови ИРФ-1 отражает суточный соматотропиновый секреторный статус и является базовым показателем для диагностики акромегалии.
Лечение больных затруднено из-за несвоевременной диагностики заболевания и представляет собой:
– резекцию опухоли гипофиза;
– уменьшение содержания соматотропина и ИРФ-1;
– ослабление выраженности симптомов заболевания.
Хирургический метод — основной, он представляет собой селективную аденомэктомию трансназальным транссфеноидальным доступом.
Тиреотропинома — разновидность аденомы гипофиза, характеризующаяся гиперсекрецией тиреотропного гормона(ТРТГ). Наименее распространенное новообразование — от 0,5 до 2 % среди всех опухолей гипофиза. Встречаются в любом возрасте, наиболее часто у лиц в возрасте 30–60 лет, с равной половой частотой.
Клинически проявляются синдромом тиреотоксикоза, при опухоли больших размеров выпадают поля зрения. Помимо этого часто нарушается репродуктивная функция и функции половых желез. У женщин это нарушения менструального цикла вплоть до аменореи.
Диагностируется при помощи УЗИ щитовидной железы и анализ крови на концентрацию ТРТГ (в норме 0,4 до 4 мкМЕ/мл). Целями лечения будет восстановление эутиреоза и удаление опухоли. Метод выбора — хирургический, представлен эндоскопической трансназальной либо транскраниальной аденомэктомии [6].
Таким образом, аденома гипофиза — серьезная требующая внимания и безотлагательных действий патология, охватывающая многие органы и системы, которая приводит к нарушению регуляции репродуктивной функции женщин. У пациенток может привести к различным нарушениям менструального цикла (аменореи, нерегулярность, ановуляторные циклы), которые могут значительно снизить качество жизни и привести к такой сложной медико-социальной проблеме как бесплодие. Эта патология остается актуальной и требует более тщательного обследования больных.
- Сытый В. П., Гончар А. А., Сытый Ю. В.. Аденомы гипофиза: история, распространенность, клиника, диагностика, лечение/ Журнал проблемы здоровья и экологии -2010-№ 3-с.41–50.
- Ребекевша В. Г. Оценка маркеров пролиферации в аденомах гипофиза у женщин с нарушением репродуктивной функции /Журнал акушерства и женских болезней -2010-№ 4-c.111–117.
- Радзинский, В.Е., Фукс. А. М. Гинекология. — М.; «Гэотар» — Медиа, 2014.-1000с.
- Эрол. Р. Норвиц, Джон О.Шордж. Наглядное акушерство и гинекология. –М.;«ГЭОТАР»-Медиа,2010,-160 с.
- Насыбуллина Ф.А., Вагапова Г.Р.. Проблемные вопросы диагностики и лечения пролактином/ журнал лечащий врач-2013-№ 3-с.23.
- Петров Ю. А. Современные подходы к лечению хронического эндометрита у женщин с ранними репродуктивными потерями //Владикавказский медико-биологический вестник. -2011. –Т.ХШ. -№ 20–21. –С.42–46.
- Петров Ю. А. Результаты иммуно-микробиологической составляющей в генезе хронического эндометрита //Вестник Волгоградского государственного медицинского университета. -2011. -№ 3. –С.50–53.
- Петров Ю. А. Роль иммунных нарушений в генезе хронического эндометрита //Вестник Российского университета дружбы народов. Серия: Медицина. -2011. -№ 6. — С.282–289.
- Петров Ю. А. Современный взгляд на лечение хронического эндометрита в когортах с ранними репродуктивными потерями // Вестник Российского университета дружбы народов. Серия: Медицина. -2011. -№ 6. — С.274–282.
- Петров Ю. А. К вопросам патогенеза хронического эндометрита //Вестник Российского университета дружбы народов. Серия: Медицина. -2011. -№ 6. — С.386–392.
- Петров Ю. А. Специфика репродуктивного и контрацептивного поведения студентов медицинского университета //Валеология. -2016. -№ 2. –С.31–34
- Петров Ю. А., Байкулова Т. Ю. Клинические особенности течения беременности, родов и послеродового периода у первородящих повторнобеременых женщин//Международный журнал прикладных и фундаментальных исследований. -2016. -№ 8–5. –С.719–723.
источник
Эндокринное бесплодие – это достаточно широкий термин. Сюда входит целая группа гормональных нарушений регуляции менструального цикла. Проблема может находиться на разных уровнях: гипоталамус-гипофиз-яичники, ТТГ-щитовидка, АКТГ-надпочечники и некоторые другие.
Но какой бы фактор не лежал в основе эндокринного бесплодия, в механизме развития патологии важнейшую роль всегда играет нарушенная работа яичников. А проявляется это либо полным отсутствием овуляции (ановуляция), либо нерегулярной овуляцией. Что касается статистики по такой форме бесплодия, то в зависимости от источника данные разняться, и его частота в структуре бесплодия женщин варьируется в пределах 4-100%.
Такое явление, как ановуляция обычно связано с работой нервной системы, иммунных механизмов, эндокринных или репродуктивных органов.
Ановуляция, вызывающая бесплодие, возникает чаще всего при наличии таких факторов:
• Гипоталамо-гипофизарная дисфункция. Имеет место у пациенток, перенесших травмы в области грудной клетки и головы. Может быть одним из проявлений опухолевого процесса. Она обычно сочетается с гиперпролактинемией. Производство пролактина растет. Из-за этого гипофиз замедляет циклическое производство ФСГ и ЛГ. Деятельность яичников угнетается. Менструации у женщины становятся редкими (олиго-, опсоменоре). В итоге формируется стойкая ановлуяция и далее можно говорить об эндокринном бесплодии.
• Гиперандрогения надпочечникового или яичникового характера. В организме женщины имеется определенное количество мужских гормонов. Они играют важную роль в половом созревании и регулируют работу яичников. Но их уровень должен быть очень небольшим. Но бывают случаи, когда надпочечники или яичники продуцируют слишком много этих гормонов. Иногда даже в процесс вовлекаются одновременно две этих железы. Такое часто наблюдается у женщин с поликистозом яичников, у них развивается ожирение, гирсутизм. Они склонны к кровотечениям, нарушениям цикла, у них отмечаются патологии обоих яичников, причем изменены их морфологические характеристики. Что касается надпочечников, то к гиперандрогени нередко приводит гиперплазия их коры. В патологический процесс вовлекаются и яичники, развивается вторичный поликистоз.
• Проблемы в работе щитовидки. У пациенток с токсическим зобом и гипотиреозом нередко наблюдается ановуляция. Такие женщины часто страдают гиперпролактинемий, у них развивается эндокринное бесплодие. Если наступает беременность, она может закончиться выкидышем. Нередко отмечаются нарушения в развитии плода.
• Нехватка женских гормонов (при недостаточности лютеиновой фазы). Если в организме снижен уровень прогестерона и эстрогенов, нарушается секреторная трансформация эндометрия. Маточные трубы не могут как положено выполнять свои функции. Создаются препятствия для закрепления плодного яйца в матке. Результатом такой патологии становится невозможность выносить беременности или же бесплодие.
• Тяжелые заболевания других органов. Так, овуляторная функция нарушается при сильных изменениях тканей печени, вызванных гепатитом или циррозом. Другими причинами являются аутоиммунные и злокачественные процессы в организме.
• Лишний вес. Как известно, жировая ткань обладает эндокринными свойствами. Она способна влиять на необменные процессы, регулируя деятельность репродуктивных органов. У женщин с ожирением неизбежно нарушается гормональный фон, наблюдаются сбои в менструальном цикле, что грозит эндокринным бесплодием.
• Дефицит жировой ткани. Недостаточный вес также опасен, как и лишние килограммы. Резкое похудение и нехватка жиров в рационе оказывают крайне негативное воздействие на работу яичников.
• Синдром Сэвижда (резистентность яичников). При этом состоянии разрушается механизм связи между гипофизом и яичниками. Их рецепторы теряют чувствительность к гонадотропинам. Поэтому стимулирования овуляции не происходит. У женщины начинается аменорея, развивается эндокринное бесплодие. Половые признаки при этом развиты хорошо, и уровень гонадотропных гормонов достаточен. Рецепторные нарушения в яичниках могут возникнуть как осложнение гриппа, краснухи. Также причинами могут стать хроническое недоедание, нехватка некоторых витаминов, нервный стресс, неблагополучное течение беременности.
• Ранняя менопауза (истощенные яичники). У женщин в возрасте 35-48 лет может возникнуть вторичная аменорея. Это состояние проявляется климактерическими изменениями и эндокринным бесплодием.
• Аномалии половых хромосом. У женщин, имеющих такие мутации, понижен уровень половых гормонов. Поэтому они страдают аменореей, эндокринным бесплодием, половым инфантилизмом. В качестве примера подобных состояний можно привести синдромы Тернера и Марфана.
Эндокринное бесплодие подозревают, прежде всего, при таких признаках – нарушения цикла и ненаступление беременности при регулярной половой жизни.
Менструальные нарушения проявляются в задержках. Причем их длина колеблется от нескольких дней до нескольких месяцев. Выделения могут очень обильными, сопровождаться болью, дискомфортом. У некоторых пациенток они отсутствуют совсем. Тогда говорят об аменорее. В промежутках между менструациями могут наблюдаться слабые мажущие выделения с кровью.
Почти у трети женщин, страдающих эндокринным бесплодием, наблюдаются ановуляторные циклы. Причем длительность таких циклов совпадает с нормальными показателями, т.е. составляет от 21 до 36 суток. При подобной патологии нельзя сказать, что имеют место менструации. Речь в этих случаях идет лишь о менструальноподобном кровотечении.
Женщины отмечают довольно много неприятных симптомов. У них болит поясница и низ живота, дают о себе знать цистит, диспареуния. Груди бывают напряженными, в них ощущается тяжесть. Из-за повышения пролактина часто возникает галакторея.
Очень явно выражен предменструальный синдром, когда накануне месячных значительно ухудшается самочувствие. У пациенток с гиперандрогенией появляется акне, они страдают гипертрихозом и гирсутизмом. Не исключена и алопеция. Такие женщины могут набрать лишние килограммы или, наоборот, похудеть, на коже у них появляются растяжки. К тому же они подвержены скачкам артериального давления.
Для выявления эндокринного бесплодия проводят следующие диагностические мероприятия.
1. Определение особенностей менструального цикла.
• Нормальный цикл. Месячные проходят регулярно, с промежутками от 21 до 35 суток. Но при этом нередко выясняется, что лютеиновая фаза неполноценна.
• Аменорея первичная. Угнетение функции яичников, что ведет к отсутствию, по крайней мере, одной спонтанной менструации.
• Аменорея вторичная. В этом случае месячные не наступают на протяжении полугода и дольше. Это состояние обусловлено хронической ановуляцией.
Если у женщин с первичной аменореей наблюдается двухфазный цикл, можно говорить об аномалиях влагалища и матки. А при вторичной аменорее такой цикл свидетельствует об атрезии цервикального канала или маточных синехиях.
• Опсоменорея. Увеличение промежутков между менструациями в пределах от 36 суток до полугода. В подобных случаях аменорея и НЛФ отмечаются с одинаковой частотой.
• Пройоменорея. Обратное состояние, когда менструации повторяются слишком часто. Интервал между ними меньше 21 дня.
• Гипоменорея. Слишком скудные выделения при месячных. Это происходит из-за нарушений в работе яичников или патологий эндометрия. Обычно является переходным этапом к аменорее.
• Гиперменорея – слишком сильные выделения.
• Олигоменорея. При этом состоянии месячные длятся меньше двух дней.
• Полименорея. Долгие месячные – неделя и дольше.
• Метроррагия. Полное отсутствие регулярного цикла. Выделения беспорядочны, имеют разную интенсивность и длительность. Это объясняется тем, что в эндометрии не происходят циклические изменения.
2. Исследование функции яичников и оценка овуляции
• Наблюдение за базальной температурой. При НЛФ 2-я фаза цикла становится короче. Температурная разница между фазами не достигает 0,6 градуса.
• Анализ крови на прогестерон, исследование экскреции прегнандиола с мочой. Процедуру назначают не раньше, чем на 4-й или 5-й день после того, как поднимется ректальная температура. Поскольку содержание прогестерона достигает своих максимальных значений через неделю после овуляции. При НЛФ выявляется нехватка прогестерона. Нормальный его показатель — 9—80 нмоль/л. Норма прегнандиола в моче – выше 3 мг/сут.
• Биопсия эндометрия. Ее выполняют за 2 или 3 суток перед месячными. При этом секреторная трансформация эндометрия бывает недостаточной.
• Цервикальное число. Оценивают объем слизи, ее консистенцию и кристаллизацию.
• Ультразвуковое динамическое наблюдение за ростом фолликулов и эндометрием в течение цикла.
Для исследования гормонального фона кровь на анализ берут утром в промежутке между 9 и 11 часами. Перед этим пациентка легко завтракает. Если цикл у женщины регулярный, проводят исследование на такие гормоны: кортизол, тестостерон, ЛГ, ФСГ, эстрадиол, дегидроэпиандростерона сульфат (5-7 день цикла), а также прогестерон и пролактин (через 6-7 дней после того, как повысится базальная температура). Кроме того, на 5-7 и 21-22 день цикла оценивают показатель 17-КС в моче.
Если имеют место такие нарушения цикла, как олигоменорея или аменорея, делают анализ крови на ФСГ, ЛГ, ТТГ, эстрадиол, кортизол, дегидроэпиандростерона сульфат, ТЗ, Т4тестостерон, кортизол. Также выясняют уровень 17-КС в суточной моче. При двухфазной кривой базальной температуры определяют уровень прогестерона.
Когда в крови повышен пролактин, анализ проводят повторно в период с 5-го по 7-й день цикла (это касается женщин с нормальным циклом или олигоменореей). Если же пациентка страдает аменореей, анализ повторяют через 7 дней.
Пробы (гормональные и функциональные)
Для диагностики стояний, связанных с эндокринным бесплодием, применяют такие пробы:
• Прогестероновая. Применяется при обследовании пациенток с аменореей. Заключается в оценке эстрогенной насыщенности, реакции эндометрия на прогестерон, исследовании особенностей его отторжения при нехватке прогестерона.
• Кломифеновая. Показана пациенткам с аменореей или нарушенным циклом. Перед ее проведением вызывают менструальноподобную реакцию. С помощью этого исследования можно определить уровень производства в фолликулах стероидных гормонов и оценить резервные возможности гипофиза.
• Дексаметазоновая. Ее проводят женщинам, которые страдают гирсутизмом. Она дает возможность точно определить природу гиперандрогении (яичниковая или надпочечниковая).
• С использованием церукала. Позволяет дифференцировать органическую и функциональную гиперпролактинемию.
• С использованием тиролиберина. Применяется для оценки работы щитовидной железы.
О наличии у пациентки ановуляции говорят по результатам функциональных тестов:
• Цервикальное число не достигает 10.
• Монофазная базальная температура.
• Эндометрий не подвергается секреторной трансформации.
• Показатель прогестерона падает до значений ниже 15 нмоль/л.
НЛФ диагностируется на основании таких результатов:
• Вторая фаза цикла слишком коротка — ее продолжительность составляет меньше 10 дней.
• Разница в базальной температуре между фазами цикла меньше 0, 4-0,6 градуса.
• Анализ крови показывает падение прогестерона во время расцвета желтого тела.
• Гистология показывает неполноценность фазы секреции в эндометрии.
Лютеинизация неовулировавшего фолликула определяется посредством ультразвукового метода и лапароскопической процедуры. С 9 по 11 день цикла можно заметить первые УЗИ-признаки увеличивающегося фолликула. Накануне овуляции он достигает размера 2 см. А если цикл был стимулирован, то его диаметр может быть до 3 см. Каждый день фолликул должен увеличиваться на 2-3 мм. Признаком состоявшейся овуляции является отсутствие его изображения посередине цикла. А при ЛНФ фолликул постепенно сморщивается. Лапароскопически это состояние проявляется в виде геморрагического тела с отсутствием овуляционной стигмы.
Лечение эндокринного бесплодия может быть оперативным или консервативным. Решение о том, к какому методу прибегнуть, принимает врач-эндокринолог. Этот же специалист назначает схему поддерживающего медикаментозного лечения с использованием того или иного препарата (левотироксин натрия, дексаметазон, бромокриптин). Курс гормонотерапии обычно длится несколько месяцев, обычно от 3 до 4. Если беременность не наступила, гормонотерапию дополняют препаратами, которые индуцируют овуляцию.
На первом этапе терапии необходимо привести в норму работу эндокринной системы. Сюда входят такие мероприятия, как борьба с ожирением, понижение уровня сахара, устранение опухолевых образований. Лечение патологий надпочечников и щитовидки.
Потом осуществляют мероприятия по гормональной стимуляции. Чтобы успешно стимулировать овуляцию, пациенткам назначают кломифен цитрат. Он обладает способностью воздействовать на работу гипофиза и повышать производство фолликулостимулирующего гормона. Особенностью такой терапии является повышенная вероятность многоплодной беременности. В 1 из 10 случаев пациентка вынашивает двойню или тройню.
Если через 6 циклов беременность не наступила, тактику терапии меняют. Женщине назначают курс гонадотропинов (ЧМГ, р-ФСГ, ХГЧ). После этого лечения увеличивается вероятность многоплодной беременности и повышается риск осложнений.
Шансы на успех гормональной коррекции довольно высоки. Но бывают случаи, когда пациенткам рекомендуют хирургическую процедуру. Так, женщинам с поликистозом выполняют клиновидную резекцию яичников, используя лапароскопические технологии. Наиболее эффективная методика – лапароскопическая термокаутеризация. Статистика наступления беременности после нее очень высока – до 90%. Это объясняется тем, что в малом тазу не происходит формирование спаек.
Если эндокринное бесплодие сопровождается отягощающими факторами (трубно-перитонеальная патология, недостаточная фертильность спермы), пациентке рекомендуют ЭКО.
Женщинам, страдающим эндокринным бесплодием, показаны такие методы физиотерапии:
• Квантовая терапия. Процедуру осуществляют таким образом. Перистальтическим насосом из вены забирают кровь в стерильную емкость, которая содержит 50 мл 0,9 % раствора натрия хлорида и 5000 ЕД гепарина. После воздействия на кровь КУФ-облучению ее возвращают в вену. Всего проводят несколько сеансов с интервалом 2 или 3 суток.
• Рефлексотерапия. Применение иглотерапии или воздействие током, теплом или лазером на акупунктурные точки. Такие процедуры избавляют пациентку от воспалений в придатках и улучшает перистальтику труб. Пациенткам с овариальной гипофункцией назначают воздействие гелий-неоновым лазером на биологически активные точки. Процедуры начинают с 5-го дня цикла. Полный курс состоит из 10 сеансов. При аменорее и редких менструациях лазер назначают на 5-е сутки после процедуры выскабливания.
• Сауна. Процедуры могут быть слабыми (при температуре 60 градусов) или умеренными (70 градусов). В первом случае относительная влажность достигает 10-20%, концентрация 02 – 26%. Во втором случае эти показатели достигают 10—18 % и 30 %. Саунные процедуры релаксируют, снимают стресс, улучшают работу иммунной системы, активируют экскреторную функцию, нормализуют терморегуляцию.
• Озонотерапия. Такие процедуры проводят через день в период с 3 по 11 день цикла. Для этого озонокислую газовую смесь на протяжении 15 минут пропускают чрез емкость, содержащую 0,9 % раствор хлорида натрия (200мл). Затем озонированный раствор вводят пациентке капельно.
Сегодня благодаря развитию медицинских технологий эндокринное бесплодие поддается лечению. Хороших результатов удается добиться у 80% только с помощью консервативной терапии.
При восстановлении овуляции и отсутствии других патологий зачатие происходит довольно скоро – в течение первых 6 циклов стимуляции.
Если бесплодие связано с гипоталамо-гипофизарным фактором, лекарственная терапия менее эффективна.
Когда пациентка беременеет, она должна находиться под строгим врачебным контролем. При малейших подозрениях на возможность выкидыша женщину госпитализируют. Довольно высока вероятность дискоординации, возможна слабость родовой деятельности.
Профилактика проблем эндокринного бесплодия начинается еще с детского возраста. Большую роль играет предупреждение и своевременное лечение гриппа, тонзиллита, ревматизма, токсоплазмоза и других заболеваний. Если этого не делать, может нарушиться функция яичников или механизм гипоталамо-гипофизарной регуляции.
Нельзя подвергать девочек стрессам или чрезмерным психическим нагрузкам, потому что функция яичников во многом зависит от психогенных факторов.
Кроме того, необходимо следить за женским здоровьем, вовремя пролечивать воспалительные заболевания половых органов. Также нужно учитывать, что факторами риска, определяющими возможность бесплодия в будущем, являются прерванные беременности и патологические роды.
Также имеет значение грамотное ведение беременности, правильное применение медикаментозных препаратов, прежде всего, гормональных. Это поможет не допустить патологий яичников и надпочечников у новорожденных девочек.
источник