Болезнь Альцгеймера является формой деменции, группы нейродегенеративных заболеваний, вызванных токсическими скоплениями дефектных белков. Известно, что прионы, которые являются «битыми» версиями белков, вызывают некоторые редкие формы деменции. Эти белки содержат ненормально свернутый белок, который заставляет нормально свернутые белки ненормально складываться и превращаться в аномальную форму приона. Эти новые аномально свернутые белки затем вызывают те же изменения в других белках и в конечном итоге образуют бляшки, которые препятствуют синаптической передаче в мозге (синапсы представляют собой химические соединения между соседними нервными клетками). Получающиеся в результате бляшки приводят к повреждению и гибели нервных клеток, что в конечном итоге приводит к нейродегенеративным заболеваниям, таким как деменция. Пациенты с прионными заболеваниями имеют широкий спектр симптомов: от нарушения работы мозга до изменений личности и трудностей с подвижностью.
Первый прионный белок был открыт в 1980-х годах Стэнли Прусинером, доктором медицины, который был старшим автором нового исследования. В его новой работе исследователи объединили два лабораторных теста для измерения уровня прионов в образцах тканей человека. Методы включают новую систему обнаружения Aβ, созданную в лаборатории Прусинера, и анализ на тау-прионы. Эти клеточные анализы могут измерять уровни инфекционных прионов за три дня, что значительно сокращает время, необходимое для проведения такого рода исследований и анализа. Они позволили исследователям быстро рассчитать количество прионов tau и Aβ в образцах мозга после смерти. Для исследования было проанализировано более 100 образцов вскрытой мозговой ткани, взятых у пациентов, умерших от болезни Альцгеймера, среди других типов нейродегенеративных состояний в США, Европе и Азии.
Результаты показали, что в 75 образцах ткани головного мозга людей, которые умерли от болезни Альцгеймера, Aβ и тау-приона, активность была высокой. 11 образцов от людей, которые умерли от церебральной амилоидной ангиопатии (CAA), содержали только прионы Aβ. 10 образцов лобно-височной долевой дегенерации с тау-патологией (FTLD) содержали только тау-прионы.
Было также обнаружено, что прионные формы тау и Aβ наиболее распространены у пациентов, которые унаследовали заболевание и умерли от него в более молодом возрасте. В резком контрасте с обычными паттернами, наблюдаемыми на пути болезни у пожилых пациентов, было также обнаружено, что прионные формы тау значительно снижались с увеличением возраста, а не увеличивались в более старшем возрасте.
Была обнаружена сильная корреляция между более молодым возрастом и более высоким уровнем тау-прионов. В среднем, у пациентов, которые скончались в возрасте 40 лет, уровни тау-приона в 32 раза выше, чем у пациентов, которые скончались в возрасте 90 лет. Соавтор исследования химик Уильям ДеГрадо принимал участие в разработке и анализе нового исследования. Он описал анализы как-то, что «изменит правила игры», сказав, что:
«Ранее исследование болезни Альцгеймера ступорилось, когда рассматривало сопутствующее повреждение в виде неправильно сложенных мертвых белков, которые образуют бляшки и треугольники. Теперь выясняется, что именно прионная активность связана с болезнью, а не количество бляшек во время вскрытия».
Встройте «Правду.Ру» в свой информационный поток, если хотите получать оперативные комментарии и новости:
Добавьте «Правду.Ру» в свои источники в Яндекс.Новости или News.Google
Также будем рады вам в наших сообществах во ВКонтакте, Фейсбуке, Твиттере, Одноклассниках.
источник
Если предположение исследователей верно, то амилоидный белок Aβ приобретает очень драматичный ореол: будучи предназначен для защиты нервных клеток от инфекции, при определённых условиях он сам становится хуже любой заразы.
Болезнь Альцгеймера — основную форму старческого слабоумия — связывают с небольшим белком Aβ (β-амилоидом), нерастворимые отложения которого в нервной ткани оказывают разрушительный эффект на высшую нервную деятельность. β-Амилоид образуется вследствие ферментативного расщепления гликопротеина APP, в норме всегда присутствующего в мембранах нейронов и других клеток. Нормальная физиологическая роль ни этого белка, ни его метаболита Aβ до недавнего времени была неизвестна. Исследователи из Массачусетского госпиталя нашли возможную функцию белка Aβ в норме. Обнаружено, что синтетические аналоги Aβ и препараты височной доли мозговой ткани альцгеймеровских больных обладают мощной антимикробной активностью, а животные с нарушенным синтезом Aβ страдают сниженным иммунитетом. Всё это позволяет предположить, что белок Aβ — часть системы врождённого иммунитета в нервной системе человека.
Рисунок 1. Августа Д., пациентка Алоиса Альцгеймера (в честь которого БА получила своё название), 1901 г.
Болезнь Альцгеймера (БА) считается бичом развитых стран, поскольку с увеличением продолжительности жизни вероятность развития этого вида старческой деменции возрастает многократно. Хотя механизм развития заболевания в общих чертах установлен, эффективного лечения, способного противостоять деградации нервной ткани и вследствие этого деградации самой личности больного, пока не существует. Амилоидная гипотеза, объясняющая причины возникновения БА, говорит, что первым этапом развития заболевания является повышенная продукция амилоидного белка Aβ (или β-амилоида), в определённых условиях (прежде всего, в высокой концентрации) претерпевающего конформационную перестройку: в его структуре начинают преобладать β-тяжи (кстати, отсюда и пошло название). «Перерождённый» Aβ, подобно прионам, образует нитевидные амилоидные агрегаты — нерастворимые жёсткие фибриллы больших размеров, обладающие токсическим действием и в прямом смысле разрушающие мозг. Кроме того, амилоидная форма Aβ конвертирует «нормальный» растворимый белок в токсичную конформацию.
Кстати, амилоидная форма Aβ становится токсичной ещё до полимеризации в фибриллы: токсический эффект появляется на стадии сферических агрегатов, построенных уже из «вредных» белковых молекул с повышенным содержанием β-структур [1]. Между прочим, недавно обнаружена прямая связь концентрации белкá Aβ в спинномозговой жидкости с циркадным ритмом и недосыпанием, которое может быть одним из факторов развития болезни Альцгеймера [2].
β-Амилоид образуется в результате протеолитического расщепления предшественника — мембранного гликопротеида APP (также обозначают ПБА — предшественник β-амилоида). В процессе участвуют два фермента — β- и γ-секретазы, — которые «выщепляют» β-амилоид (белок длиной 40 или 42 аминокислотных остатка) из состава предшественника и секретируют его во внеклеточную область. До недавнего времени нормальная физиологическая роль β-амилоида была неизвестна, и его можно было воспринимать как горький молекулярный курьёз, часто приводящий собственный организм к такому тяжёлому последствию, как болезнь Альцгеймера.
Американские исследователи из Массачусетского госпиталя, похоже, наконец-то установили нормальную функцию Aβ: скорее всего, он имеет отношение к врождённому иммунитету [3]. «Многие годы считалось, что β-амилоид — не более чем молекулярный мусор, весьма не безвредный, впрочем. Наши результаты говорят, что этот белок — нормальный компонент системы врождённого иммунитета мозга, — говорит Рудольф Танзи (Rudolph Tanzi), один из авторов работы. — В частности, факторы, „включающие“ врождённый иммунитет — не только инфекция, но и травма или инсульт, — способствуют развитию болезни Альцгеймера и отложению Aβ в мозгу» [4].
Рисунок 2. Интеллектуальная активность, в том числе увлечение игрой в шахматы, и регулярное общение коррелируют со сниженным риском развития болезни Альцгеймера, по данным эпидемиологических исследований, однако причинно-следственная связь пока не доказана
Этому открытию предшествовало наблюдение, что Aβ во многом напоминает антимикробные пептиды (АМП) [5], являющиеся основой врождённого иммунитета большинства многоклеточных организмов, — в частности, пептид LL-37 человека, относящийся к группе кателицидинов. Кроме них, у человека есть ещё две группы АМП, участвующих в формировании врождённого антибактериального иммунитета, — дефензины и гистатины. От антител (лежащих в основе приобретённого, или специфического, иммунитета) их отличает то, что они могут действовать в нервной ткани и в мозгу, куда антитела «не добираются», и защищают человека от, например, менингита и нейрокандидоза. Ещё одна мишень действия этих пептидов — это вирусы и даже раковые клетки.
Схожесть некоторых физико-химических и биологических свойств β-амилоида и пептида LL-37 подтолкнула учёных изучить антимикробную активность Aβ, которой никто ранее не занимался. Результаты превзошли ожидания: синтетические аналоги Aβ40 и Aβ42 ингибировали развитие восьми из 15 исследованных микроорганизмов с активностью, равной или даже превышающей активность LL-37. Среди микроорганизмов, ингибируемых амилоидом, — грибок Candida albicans, кишечная палочка E. coli, три разновидности стафилококка, внутриклеточная паразитическая бактерия листерия и другие.
Чтобы удостовериться в том, что токсичность для бактерий не является следствием реактивов белковой химии, которые могли остаться после очистки белкóв, в следующем эксперименте изучили способность препарата ткани височной доли мозга (а именно там сильнее всего депонируется амилоид) ингибировать рост грибка Candida; в качестве контроля использовали препараты ткани не болевших пациентов того же возраста, а также образцы из других участков мозга, в которых не наблюдается существенных отложений Aβ. (Поскольку исследование проводилось в крупной больнице, недостатка в материале для исследования — мозговой ткани умерших пациентов — не было.) Эксперимент полностью подтвердил гипотезу, и, более того, антитела к β-амилоиду возвращали грибок «к жизни», подтверждая, что это именно белок Aβ ингибировал рост микроорганизмов.
Кроме того, оказалось, что трансгенные мыши с инактивированным геном одной из секретаз, генерирующих белок Aβ, сильнее подвержены влиянию различных патогенов; то же самое можно сказать и про людей, в ходе клинических испытаний получавших препарат, снижающий уровень Aβ42. Кстати, уменьшение концентрации хорошо изученного АМП LL-37 тоже увеличивает заболеваемость, но и чрезмерно высокая его доза не хороша, потому что приводит к отложению бляшек, подобных атеросклеротическим. Склонность к образованию фибрилл, подобных амилоидным, есть и у других АМП: хорошо известный антимикробный белок лактоферрин образует нерастворимые агрегаты при желатинозной дистрофии роговицы.
Изучение действия β-амилоада на бактерии показало, что он связывается с мембранами микроорганизмов, несмотря на то, что, по сравнению с подавляющим большинством АМП, имеет отрицательный, а не положительный заряд, — то есть, одного знака с мембранами бактерий. Возможно, эта на первый взгляд невыгодная организация необходима для преодоления специальных защитных систем бактерий, нейтрализующих катионные (положительно заряженные) пептиды. Ещё одним тяжело объяснимым качеством Aβ является его токсичность по отношению к собственным клеткам, что и приводит в ряде случаев к серьёзным расстройствам. Одно из возможных объяснений этому — что β-амилоид является также «оружием» против раковых клеток своего организма, но, даже если это и так, никаких подробностей процесса пока не известно, так же как и не известно толком, что вызывает повышение его продукции при БА.
Рисунок 3. Чарлтон Хестон и Рональд Рейган на встрече в Белом Доме, 1981 год. Оба к концу жизни заболели болезнью Альцгеймера.
«Необходимо выяснить, что же запускает врождённый иммунитет, к которому принадлежит альцгеймеровский пептид, в пожилом возрасте, и какие гены управляют этими процессами, — говорит Роберт Муар (Robert Moir), другой руководитель исследования. — Если удастся это установить, мы сможем разработать варианты предотвращения этой ненужной активации или даже научиться управлять ей» [4].
источник
Экология потребления. Здоровье: Хотя болезнь Альцгеймера активно исследуют на протяжении многих лет, механизмы ее возникновения остаются неясными.
Хотя болезнь Альцгеймера активно исследуют на протяжении многих лет, механизмы ее возникновения остаются неясными.
Обычно появление основных симптомов болезни связывали с отложениями в головном мозге белка бета-амилоида – так называемыми амилоидными бляшками.
Авторы нового исследования полагают, что ключевую роль играют другие образования, которые обнаруживаются в мозге больных – нейрофибриллярные клубки, состоящие из тау-белка. Хотя пока среди ученых нет единства по поводу сравнительного вклада бета-амилоида и тау-белка в развитие болезни, полученные результаты, возможно, помогут разработке новых препаратов для ее лечения.
Скопления амилоидных бляшек при болезни Альцгеймера были открыты уже довольно давно. Они обнаруживались как при посмертном исследовании мозговой ткани, так и у живых больных – при помощи позитронно-эмиссионной томографии. Для этого в организм вводят радиоактивный изотоп, который образует соединение с интересующим веществом (в данном случае – с бета-амилоидом). Когда скопления целевого вещества оказываются “помечены”, их распределение в организме отслеживают по гамма-квантам, возникающим при позитронном распаде.
Но тут же возникала загадка: медикам было известно немало случаев, когда у пациентов, мозг которых был полон амилоидных бляшек, не было никаких признаков болезни Альцгеймера. Число таких людей в некоторых исследованиях достигало 30 %. Данный факт заставил ученых подозревать, что другая аномальная белковая структура – нейрофибриллярные клубки из тау-белка может быть фактором, важным для развития болезни.
Обычно тау-белок в организме участвует в образовании микротрубочек – важного элемента цитоплазматической структуры клеток. Но у пациентов с болезнью Альцгеймера, а также после черепно-мозговых травм обнаруживаются скопления тау-белка, к молекулам которого присоединено большое количество фосфатных групп. Из-за них белок переходит в нерастворимую форму, и его клубок остается прикрепленным к нейронам головного мозга.
Влияние нейрофибриллярных клубков на здоровье до конца не изучено. До недавнего времени единственным методом исследования, доступным в данном случае, было измерение уровня тау-белка в ткани головного мозга после смерти больного или же у живого пациента в спинномозговой жидкости. Позитронно-эмиссионная томография не могла помочь, так как не располагала радиоизотопами, которые подходили бы для того, чтобы пометить тау-белок в организме.
Теперь эта проблема решена и соответствующие препараты найдены.
Поэтому невролог Бо Ансес (Beau M. Ances) и его коллеги из Университета Вашингтона в Сент-Луисе смогли впервые провести исследование распределения нейрофибриллярных клубков в головном мозге у живых пациентов. Одновременно они использовали и радиопрепарат для отображения бета-амилоида. Таким образом, ученые получили картину одновременного распределения в мозге двух связанных с болезнью Альцгеймера белков.
В исследовании участвовали десять пациентов с легкой степенью болезни Альцгеймера и 36 здоровых. Как показали ученые, чем больше у человека отложений тау-белка в височной доле мозга, тем сильнее у него проявляются нарушения памяти и внимания, характерные для болезни Альцгеймера.
Аналогичного соотношения для бета-амилоида не обнаружилось. Исследователи пришли к выводу, что позитронно-эмиссионную томографию, направленную на обнаружение амилоида, можно использовать для выявления самых ранних стадий болезни Альцгеймера. Тогда как тот же метод, но с использованием веществ, нацеленных на тау-белок, будет эффективен при выявлении перехода от ранних, несимптоматических стадий к легкой степени болезни Альцгеймера.
Бо Ансес подозревает, что решающим в развитии болезни становится совместное влияние на нервную ткань скоплений амилоида и тау-белка. Пока в мозге накапливаются только амилоидные бляшки, он еще в состоянии частично компенсировать их воздействие, но появление нейрофибриллярных клубков становится ключевым фактором, и симптомы болезни начинают нарастать.
Одновременно ученые проверили содержание тау-белка в спинномозговой жидкости участников исследования и обнаружили корреляцию его уровня с количеством тау-белка в височной доли головного мозга. Следовательно, анализ спинномозговой жидкости может служить методом диагностики.
Пока удалось отметить связь уровня тау-белка с симптомами болезни Альцгеймера в один момент времени. Как отмечает, комментируя результаты данного исследования, невропатолог Педро Роза-Нето из Университета Макгилла в Монреале, в будущем еще предстоит определить, существует ли связь изменения содержания тау-белка в мозге с нарастанием симптомов с течением времени. Бо Ансес говорит, что подобные исследования уже ведутся, и выражает надежду, что со временем исследователи смогут определять стратегию лечения болезни Альцгеймера, основываясь на том, какова биохимическая ситуация в мозге пациента в конкретный момент. опубликовано econet.ru
Понравилась статья? Тогда поддержи нас, жми:
источник
Основной злодей в болезни Альцгеймера — ß-амилоид, фрагмент белка, который может неправильно сворачиваться и образовывать бляшки вокруг нейронов мозга.
Теперь, новое исследование на мышах и червях выдвигает спорную гипотезу о том, что бляшки не очень-то и вредны. Тенденция ß-амилоида душить нейроны может быть связана с древней эволюционной миссией – защитить мозг от патогенов.
Некоторые говорят, что работа может открыть новые возможности для лечения и профилактики смертельного дегенеративного заболевания, но многие, кто занимается болезнью Альцгеймера, по-прежнему скептически относятся к исследованиям, в которых использовались животные, генетически модифицированные с целью произвести человеческий ß-амилоид. Хотя новые данные «потрясают, они остаются весьма надуманными в том смысле, что они не имеют прямое отношения к тому, что мы видим у человека», — говорит Колин Мастерс, нейробиолог из Университета Мельбурна в Австралии.
«β-амилоидные отложения могут повредить многие органы помимо мозга, в том числе сердце, печень и почки», — говорит нейробиолог Рудольф Танзи из больницы Массачусетса в Бостоне, руководитель нового исследования. Возникает недоуменный вопрос: если белок так вреден, почему животное, которое жило 400-миллионов лет назад – рыба латимерия таксона – вырабатывала его. «Среди млекопитающих ген, который кодирует белок, от которого ß-амилоид происходит «почти одинаков» у разных видов, — говорит Хара Клаудио Сото, нейробиолог из Университета Техаса в Хьюстоне. – У собаки, например, вырабатываются β-амилоидные бляшки подобные Альцгеймерским и симптомы слабоумия вместе с тем, как они стареют.
Шесть лет назад, Танци и нейробиолог Роберт Мойр, также из больницы Массачусетс в Бостоне, решили проверить догадку, что ß-амилоид ведет себя аналогично к классу белков с известными полезными свойствами, называемые антимикробными пептидами или AMPs. Некоторые AMPs также формируют волокна вокруг клеток, но они используют их, чтобы убивать микробы по всему телу. Чтобы понять, является ли ß-амилоид настолько же смертельным, команда протестировала его в лаборатории на набор разных микробов, в том числе дрожжей Candida albicans и бактерий, таких как кишечная палочка и несколько различных штаммов Стрептококка. Оклеветанный белок был так же токсичен для многих патогенов, как АMPs. «На самом деле, в отношении некоторых микробов он был в 100 раз более смертоносным, чем пенициллин», — говорит Мойр.
Мойр и Танци предположили, что ß-амилоид имеет древнюю роль в организме, защищая от инородных захватчиков. Мало кто воспринимал их всерьез, поскольку не было доказано, что эти молекулы убивают микробы в организме животных. Мойр говорит, что они столкнулись с серьезным сопротивлением тех, кто поддерживает общепринятый подход к производству препаратов от болезни Альцгеймера. «На протяжении десятилетий фармацевтические компании относились к ß-амилоиду как «уроду», в котором нет ничего полезного, и сосредотачивали все свои силы на поиск лекарства, которое устранило бы эти молекулы», — говорит он. У этих компаний, по мнению Мойра, «все, что ß-амилоид делает – это плохо. И все, что вам надо сделать – это избавиться от него, и все будет «чики-чики».
«Новое исследование является «подтверждением концепции» на животных, что ß-амилоид действительно защищают от патогенов», — говорит Танзи. Во-первых, исследователи использовали мышей, которые были генетически модифицированы, чтобы производить избыточное количество человеческой версии ß-амилоида — модель распространения болезни Альцгеймера. Затем они вводили в мозг грызунов бактерии Сальмонеллы, чтобы вызвать инфекцию и наблюдали, справлялись ли мыши с лишними амилоидами с инфекцией лучше, чем обычные мыши. Все мыши умерли в течение 96 часов, но те, у которых были человеческие амилоиды потеряли меньше веса, у них было меньше бактерий в мозгу, и они жили примерно на 30 часов дольше, чем контрольные мыши. Такие результаты были опубликованы сегодня в Science Translational Medicine.
Потом ученые проверили свою гипотезу на червях Caenorhabditis elegans и обнаружили, что черви со штаммом, генетически спроектированным, чтобы производить избыток амилоида в их кишечнике, жили до 3 дней дольше после воздействия Сальмонеллы и дрожжей, чем обычные черви.
«Обобщенные данные исследований на животных позволяют предположить, что различные микроорганизмы могут вызывать амилоидные бляшки», — говорит Танзи. «Самое поразительные, — говорит он, — результаты от мышей, модифицированных для выработки ß-амилоида человека. В нормальной жизни грызуны не вырабатывают амилоидные бляшки до старости, но молодые особи образовывали бляшки сразу после инъекции сальмонеллы, что доказывает, что инфекция и бляшки связаны между собой», — говорит Танзи.
«Тот факт, что амилоид может вести себя как антимикробный пептид «удивителен», после этого открытия можно по-новому взглянуть на болезнь Альцгеймера», — говорит Сото Хара. «Но все-таки, — говорит он, — работа высоко спекулятивна на данный момент».
Танци признает это. «Мы не говорим, что любой из этих микробных патогенов вызывает болезнь Альцгеймера у людей, — отмечает он. — Для расследования этого ученые должны изучить ткани мозга многих людей, которые умерли от болезни Альцгеймера, глядя на разные возбудители и были ли окружены микробы амилоидными бляшками». «Несмотря на десятки предыдущих исследований, которые искали инфекции, которые могут вызвать болезнь Альцгеймера, они не были достаточно систематическими, чтобы выявить виновника», — говорит Танзи. «Новый проект, в который инвестировано полмиллиона долларов Фондом Альцгеймера скоро возьмет эту задачу на себя», — добавляет он.
«Если ученые докажут, что определенные микробы вызывают амилоидные отложения в мозге человека, — Танзи предполагает, — может быть возможным разработать антитела, которые будут атаковать их и предотвращать такую реакцию. Кроме того, если ß-амилоида играет важную защитную роль в мозге, возможно, имеет смысл относиться к нему больше, как холестерину, который необходим для всех клеток, но опасен в большой концентрации, чем как к тому, что должно быть полностью ликвидировано, — говорит Танзи — замедлить его распространение — да, но не уничтожить его».
источник
Болезнь Альцгеймера представляет собой нейродегенеративное заболевание, которое проявляется слабоумием. Чаще всего болезнь Альцгеймера встречается у людей старше 65 лет, хотя не исключено её развитие и в молодом возрасте. На сегодняшний день нельзя определенно точно назвать причину развития патологии. Основной особенностью болезни Альцгеймера являются отложения белка бета-амилоида в виде бляшек и нейрофибриллярных клубков из тау-протеина в тканях головного мозга. Они нарушают связи между нейронами и приводят к гибели клеток.
В Юсуповской больнице работают высококвалифицированные неврологи, доктора наук, которые имеют большой опыт успешной терапии болезни Альцгеймера. Неврологи используют новейшие методы лечения, которые позволяют максимально облегчить состояние больного и улучшить качество его жизни насколько это возможно.
Несмотря на то, что в настоящее время болезнь Альцгеймера активно исследуются, современная медицина не имеет полного представления о механизме развития заболевания. Выделяют несколько теорий возникновения болезни Альцгеймера, к которым относится и тау-гипотеза.
Ранее было выявлено, что развитие болезни Альцгеймера сопровождается образованием амилоидных бляшек в головном мозге. Данная аномалия фиксировалась во время диагностики больных. Однако у некоторых пациентов с большим количеством амилоидных бляшек в головном мозге не было никаких клинических проявлений болезни Альцгеймера. Это дало повод заподозрить, что существует еще одна структура, которая влияет на развитие болезни.
Исследования показали, что у пациентов с болезнью Альцгеймера также присутствуют нейрофибриллярные клубки – аномальное соединение тау-протеина. В норме тау-протеин участвует в формировании микротрубочек – важного элемента клеток. У пациентов с болезнью Альцгеймера происходит чрезмерное накопление тау-протеина, к которому присоединяются фосфатные группы. Из-за них протеин не растворяется и остается в нейронах виде клубков.
Наличие амилоидных бляшек и нейрофибриллярных клубков обнаруживается у пожилых людей, что считается нормальным признаком старения. У пациентов с болезнью Альцгеймера данных структур будет намного больше. Чаще всего в начале развития заболевания бляшки и клубки тау-протеина формируются в областях мозга, которые отвечают за память и обучение. В дальнейшем они распространяются на другие участки мозга. Нейрофибриллярные клубки тау-протеина блокируют связи между клетками головного мозга и нарушают их активность, важную для функционирования клеток.
Наличие тау-протеина в клетках головного мозга является диагностическим фактором для определения болезни Альцгеймера. Коварство заболевания заключается в том, что его очень трудно диагностировать на ранних стадиях. В начале заболевания у пациента могут не проявляться в значительной мере когнитивные нарушения, хотя процесс нейродегенерации уже идет. Если при обследовании у пациента выявляют амилоидные бляшки и нейрофибриллярные клубки тау-протеина, появляется основание устанавливать диагноз «болезнь Альцгеймера».
Для определения биомаркеров тау-протеина проводят исследование спинномозговой жидкости. При наличии болезни Альцгеймера показатели общего тау-протеина в спинномозговой жидкости будут значительно превышать норму. Показатель является критерием для постановки диагноза, даже если симптоматически болезнь еще не дает о себе знать. Увеличение количества общего тау-протеина будет говорить о прогрессировании заболевания.
Другим методом определения тау-протеина является позитронно-эмиссионная томография. Во время диагностики в организм пациента вводят специальный препарат, который вступает во взаимодействие с белком. Препарат выступает в роли своеобразного маячка, с помощью которого можно отслеживать изменения в клетках головного мозга. Позитронно-эмиссионная томография позволяет одновременно оценить и наличие амилоидных бляшек. Таким образом, оба ключевых компонента для постановки диагноза складываются в одну картину.
Для правильной и своевременной постановки диагноза следует обращаться только к квалифицированному неврологу, который знаком с современными методами диагностики. В Юсуповской больнице представлена качественная специализированная аппаратурой от мировых производителей, с помощью которой неврологи больницы могут провести диагностику любой сложности. В клинике выполняют разнообразные исследования: от стандартных лабораторных анализов до позитронно-эмиссионной томографии и фармакогенетических исследований.
Открытие тау-протеина играет важную роль в лечении болезни Альцгеймера. Сегодня не существует способа полностью избавить человека от патологии. Все методы терапии направлены на снижение симптомов и улучшение качества жизни пациента. Данные о нейрофибриллярных клубках тау-протеина позволяют ученым создавать новые медикаменты для лечения пациентов.
Для терапии болезни Альцгеймера применяют препараты, улучшающие работу клеток головного мозга и замедляющие когнитивные нарушения. В качестве успокоительных используют седативные средства и антидепрессанты. К лекарственной терапии дополнительно назначают немедикаментозные процедуры: лечебная физкультура, массажи, физиотерапия, психотерапия и другие методики.
Лечение пациента может проходить в комфортном стационаре Юсуповской больницы или на дому. Все будет зависеть от состояния пациента и его пожеланий (или его близких в случае, когда пациент не может принимать рациональные решения). В стационаре круглосуточно предоставляется профессиональное медицинское обслуживание, постоянный контроль лечащего невролога за состоянием пациента. Для лечения больного на дому его родственники (или те люди, которые будут осуществлять уход) получают детальную инструкцию проведения терапии. В случае необходимости можно получить консультацию доктора удаленно, по телефону. Важно полностью соблюдать рекомендации врача и регулярно посещать невролога для оценки результатов терапии. Родственники пациента могут получить психологическую поддержку специалистов и научиться основам правильного ухода за пациентами с болезнью Альцгеймера.
Обратиться за помощью, записаться на прием и получить консультацию специалистов можно по телефону Юсуповской больницы.
источник
Научные специалисты решили проверить, может ли болезнь передаться при трансплантации нервных тканей. 60 лет назад детей с задержкой роста начали лечить гормоном роста, который получали из гипофиза умерших людей. Сейчас ученым получилось раздобыть образцы гормона, которые когда-то вводили детям. В них обнаружились белки, вызывающие болезнь Альцгеймера. И исследователи решили проверить, может ли болезнь передаться при трансплантации нервных тканей.
В 1958 году медики придумали, как помочь детям с задержкой развития вырасти быстрее. Им начали вводить донорский гормон роста, который выделяли из гипофиза умерших людей. Процедура действительно способствовала росту детей, но вызывала и побочные эффекты. Как выяснилось через 25 лет, таким образом можно заразить ребенка прионным заболеванием — поражением головного мозга, в ходе которого в нервной ткани и сосудах накапливаются неправильно свернутые белки-прионы.
Самое известное такое заболевание, болезнь Крейцфельда-Якоба, как правило, возникает самопроизвольно, в итоге мутаций — или передается при каннибализме.
Тем не менее история на этом не заканчивается. Прионные заболевания часто развиваются медленно. Требуется время, чтобы первый белок вызвал изменения в структуре других белков и запустил цепную реакцию неправильного свертывания. Инкубационный период у «инфекции» может составлять десятки лет, и пациенты, получившие «зараженный» гормон роста в детстве, заболевали уже во взрослом возрасте. Поэтому на то, чтобы распознать проблему и запретить такое лечение, ушло целых 30 лет. За это время по всему миру умерли более двухсот бывших пациентов, а у кого-то симптомы продолжают возникать и до сих пор.
Три года назад международная группа ученых исследовала фрагменты мозга восьми людей, которые в детстве получали инъекции гормона роста, а в 36−51 год скончались от болезни Крейцфельда-Якоба. И у четверых из них, кроме прионных белков, нашли скопления бета-амилоида — белка, который характерен для болезни Альцгеймера, а у больных прионными заболеваниями обычно не встречается. При этом никаких внешних симптомов, характерных для болезни Альцгеймера, у пациентов при жизни не было. И оставалось непонятным, откуда бета-амилоид возник в мозге пациентов, и связано ли это как-то с их прионной болезнью. Но совсем недавно тем же ученым получилось раздобыть и проанализировать остатки гормона роста, который вводили этим людям десятки лет назад.
Для начала они проверили проверили наличие других белков в образце «лекарства». Кроме, собственно, гормона роста, они нашли там две разновидности бета-амилоидов и тау-белков (которых тоже подозревают в развитии болезни Альцгеймера).
Затем они решили выяснить, может ли инъекция этих белков вызывать болезнь Альцгеймера у мышей. Они использовали линию модифицированных мышей, которым свойственно экспрессировать и накапливать человеческий бета-амилоид. Эти мыши имеют предрасположенность к заболеванию, но проявляется оно после первых шести месяцев жизни. Выяснилось, что инъекция «зараженного» гормона роста мышам вызывает заболевание раньше, чем положено, и в более агрессивной форме. Иными словами, запускает накопление белков в сосудах и разрушение нервной ткани. Инъекции чистого гормона роста или физраствора подобной реакции у мышей не вызывали.
Попадая в мозг, бета-амилоид донора может провоцировать накопление бета-амилоида реципиента. И если бы исследуемые пациенты не скончались от прионной болезни, у них впоследствии могли бы проявиться в полной мере симптомы болезни Альцгеймера.
Тем не менее в повседневной жизни нам беспокоиться не о чем: чтобы подобное заражение произошло, бета-амилоид должен попасть из нервной ткани или мозговых сосудов донора в кровоток реципиента. Вероятность такого события возникает только при трансплантациях — и мы знаем похожие случаи заражения Альцгеймером при пересадках мозговых оболочек.
Тем не менее, эта поучительная история призывает нас тщательнее относиться к подбору донора в операциях, соединенных с нервной системой, и, вероятно, поможет нам подробнее разобраться в происхождении болезни Альцгеймера.
источник
Человеческие антитела против патогенного белка, вызывающего болезнь Альцгеймера, уничтожают опасные белковые отложения в мозге больных.
Болезнь Альцгеймера, как и прочие нейродегенеративные заболевания, начинается из-за того, что в нервных клетках мозга появляется слишком много белковых молекул в неправильной пространственной конформации, которые из-за своей неправильности слипаются вместе и образуют нерастворимые комплексы, вредящие нейрону и, в конце концов, доводящие его до гибели. Патогенным оказывается не всякий белок; в случае болезни Альцгеймера это бета-амилоид и тау-белок, и один из характерных признаков заболевания – так называемые амилоидные бляшки, скопления бета-амилоидных пептидов, которые появляются в мозге больного. Пока ещё не вполне понятно, как именно подобные белки вредят нейронам, однако несомненно, что они действительно вредят.
Очевидно, что лекарства против нейродегенеративных болезней должны, с одной стороны, подавлять появление патогенных белков и их взаимодействие между собой, с другой – уничтожать уже сформировавшиеся отложения, то есть те самые пресловутые бляшки. Многие здесь делают ставку на иммунотерапию: антитела, специфично связывающиеся с молекулами бета-амилоида, могли бы предотвратить их слипание и спровоцировать уничтожение уже сформировавшихся амилоидных отложений. Однако до поры до времени особых прорывов тут не происходило: иммунотерапевтические методы давали в лучшем случае лишь весьма умеренный эффект. Но с антителами, полученными сотрудниками биотехнологической компании Biogen, Inc., дела обстоят совершенно иначе.
Как известно, антитела синтезируют В-лимфоциты. Джефф Севиньи (Jeff Sevigny) и его коллеги нашли среди В-лимфоцитов человека те, что производят иммуноглобулины против бета-амилоидного пептида – препарат таких антител получил название адьюканумаб (aducanumab). Эксперименты с трансгенными мышами, у которых в мозге формировались отложения из человеческого амилоида, показали, что введённые в кровь антитела проникают в мозг животных, связываются с нитчатыми амилоидными скоплениями, переводя их в растворимое состояние, и активируют клетки микроглии, которые представляют собой мозговой отдел иммунной системы. (Обычные иммунные клетки, блуждающие по нашему телу, в мозг проникнуть не могут.) Активированная микроглия начинает в буквальном смысле поглощать амилоиды, которые стали растворимыми благодаря препарату адьюканумабу.
Но это животные, к тому же трансгенные, а что же люди? Для участия в клинических испытаниях пригласили 165 пациентов в возрасте от 50 до 90 лет, у которых синдром Альцгеймера либо присутствовал в мягкой форме, либо находился в так называемом продромальном периоде, когда некоторые симптомы уже указывают на болезнь, но клинически она ещё никак не проявляется. Некоторые из участников эксперимента получали плацебо, в других же четырёх группах использовали препарат антител в разных концентрациях. Иммуноглобулины вводили раз в месяц, и таких введений было четырнадцать. По ходу дела сорок пациентов по разным причинам выбыли из исследования, так что в результате в каждой из пяти групп осталось от 21 до 32 человек. Состояние мозга оценивали с помощью позитронно-эмиссионной томографии и специального радиоактивно меченого вещества, оседавшего в амилоидных отложениях и тем самым делавшего их видимыми для томографа.
В общем и целом, как пишут авторы работы в Nature, альцгеймерические бляшки у людей заметно уменьшались, и это уменьшение даже назвали «беспрецедентным» – по сравнению с другими попытками такого рода. Исчезновение амилоидных отложений происходило тем активнее, чем выше была доза экспериментального лекарства. Некоторые когнитивные тесты показали, что у тех пациентов, которые получали препарат антител, умственные способности слабели не так быстро, как у тех, которые получали плацебо, и что тут опять же всё зависело от дозы препарата. В то же время стоит отметить, что другие тесты никаких когнитивных различий не обнаружили. С другой стороны, некоторые специалисты, в частности, Рональд Петерсен (Ronald Petersen) из Клиники Мейо, говорят, что пока не стоит придавать большое значение оценкам когнитивного состояния – чтобы они стали достоверными, нужно больше испытуемых и больше времени на исследования.
Сейчас идёт очередной этап клинических испытаний, в котором участвует больше людей. Исследователи надеются, что им удастся не только подтвердить первоначальные результаты, но и понять, что делать с побочным эффектом, который особенно заметно проявлялся у некоторых пациентов, получавших наибольшую дозу препарата – томография показала, что у них в некоторых участках мозга возникали небольшие отёки и микроскопические кровоизлияния, приводившие к головной боли. Одно из объяснений состоит в том, что амилоидные отложения порой формируются вплотную к кровеносным сосудам, и, когда эти отложения начинают растаскивать антитела, то сосуды реагируют на их работу несколько болезненно. Но, повторим, хотелось бы надеяться, что в дальнейших клинических экспериментах побочные эффекты удастся преодолеть.
источник
В основе болезни Альцгеймера могут лежать изменения лишь в одной аминокислоте небольшого белка Aβ42. К такому выводу пришли ученые из МГУ имени М.В. Ломоносова, Института молекулярной биологии имени В. А. Энгельгардта и Института биофизики клетки, о своих результатах они сообщили на страницах журнала Scientific Reports.
Болезнь Альцгеймера – комплексное нейродегенеративное заболевание, причины которого в большинстве случаев остаются непонятными. Многочисленные исследования показывают, что при болезни Альцгеймера в клетках мозга происходит целый ряд серьезных системных нарушений. В ходе развития заболевания в нейронах появляются токсичные формы небольшого белка бета-амилоида, образующие скопления – амилоидные бляшки. Также в клетках больного формируются нейрофибриллярные клубки, содержащие тау-белок с повышенным уровнем фосфорилирования (присоединения остатков фосфорной кислоты). В результате нарушается нервная проводимость, а нейроны погибают. Этим объясняются симптомы заболевания, главный из которых – расстройство кратковременной памяти.
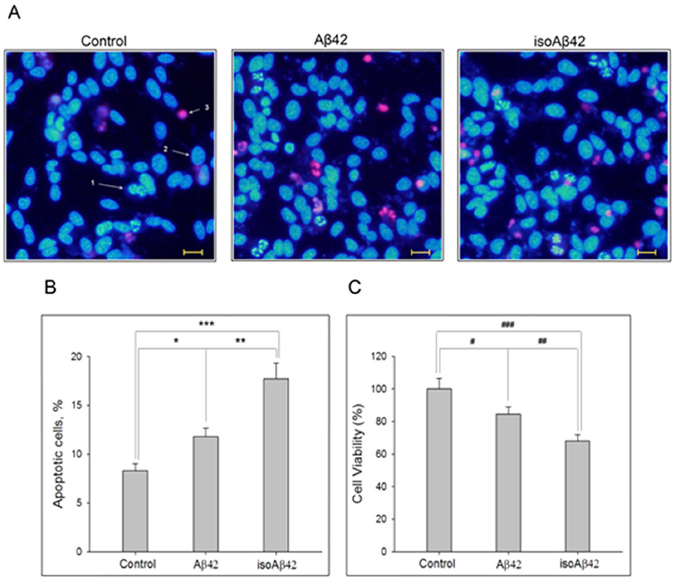
Биологи изучили белок из семейства бета-амилоидов – Aβ42 (буквы – сокращение от «амилоид бета», а 42 – количество аминокислотных остатков – «звеньев» в его цепи). Этот небольшой белок присутствует в нервной ткани здоровых людей, где он участвует в нервной проводимости и регулирует обмен холестерина. Aβ42 может подвергаться ряду химических модификаций, которые могут изменять его свойства. Внимание российских ученых привлекла форма isoAβ42 с изомеризированным остатком аспарагиновой кислоты в положении 7 (изомерами называют химические вещества с тем же количеством атомов разных элементов, но имеющих иную пространственную конфигурацию). Ранее эта же группа ученых показала, что isoAβ42 может выступать в качестве «затравки» для Aβ42, что приводит к образованию амилоидных бляшек.
Ученые из Института молекулярной биологии им. Энгельгардта РАН решили проверить, каким образом эта модификация бета-амилоида влияет на метаболические процессы в клетках. Для этого использовался химически синтезированный isoAβ42. Интактный (то есть нетронутый) белок Aβ42 (без изомеризованного остатка аспарагиновой кислоты) и isoAβ42 добавили к культуре клеток нейробластомы человека SH-SY5Y. Эту клеточную линию ученые получили из опухоли четырехлетней девочки, но уже несколько десятков лет выращивается в лаборатории для изучения нейродегенеративных заболеваний. Третья группа клеток была контрольной, и белков к ней не добавляли.
Через сутки после введения белков часть клеток стала гибнуть путем апоптоза (аналог клеточного «самоубийства»). При этом под действием isoAβ42 клеток погибало в два раза больше, чем под действием Aβ42. Изучив изменения в клеточной культуре, биологи установили, что isoAβ42 также снижает уровень тау-белка в клетках. Кроме того, оказалось, что isoAβ42 резко повышает фосфорилирование тау-белка, тубулинов и матрина-3. Именно чрезмерное фосфорилирование этих белков – характерный признак нервной ткани, пораженной болезнью Альцгеймера. Тау-белок помогает поддерживать стабильность микротрубочек. Микротрубочки играют роль «скелета» клетки, определяя ее механическую устойчивость и форму, а также участвуют в транспорте частиц внутри клетки. Тау-белок с повышенным уровнем фосфорилирования больше не может связываться с микротрубочками, что вызывает нарушения в функционировании клетки.
Таким образом, российские ученые впервые показали, что токсический эффект isoAβ на клеточных культурах нейробластомы человека связан с его способностью вызывать фосфорилирование тау-белка и некоторых других белков в гораздо большей степени, чем обычный Aβ42. Повреждение нейронов белком isoAβ42 похоже на то, которое наблюдается в нейронах пациентов с болезнью Альцгеймера, что свидетельствует о критической роли isoAβ42 в развитии этой патологии.
источник
Новое исследование показало, что знаменитый белок долголетия klotho улучшает состояние грызунов, страдающих болезнями Альцгеймера и Паркинсона.
Полученные данные открывают новые возможности в лечении этих и других нейродегенеративных заболеваний.
Руководила исследованием доктор Дена Дубаль (Dena Dubal), преподаватель неврологии в Университете Калифорнии в Сан-Франциско. Детали публикуются в Cell Reports.
Работа американских ученых была построена на предыдущих выводах их коллег о возможной связи между протеином klotho и умственной деятельностью. Опыты на мышах демонстрируют, что генетически модифицированные животные с повышенным уровнем данного протеина оказываются значительно умнее и способнее своих «нормальных» сородичей.
«Новые сведения добавили нам понимание того, как можно использовать белок долголетия в лечении когнитивных нарушений у субъектов с низким уровнем klotho, нормальным уровнем или нейродегенеративными заболеваниями. По мере старения населения планеты проблема когнитивной дисфункции становится одной из первоочередных, и пока не существует эффективных методов ее решения», — говорит доктор Дубаль.
Прежде чем говорить о лечебном потенциале чудо-белка, разберемся с ним подробнее.
Klotho – это протеин, который синтезируется в человеческом организме почками и головным мозгом. В дальнейшем он циркулирует в крови и действует на разные органы и ткани, как гормон.
Как пояснили авторы, белок klotho участвует в регуляции роста фибробластов и выработке коллагена, контролирует активность инсулина. Предполагается его роль в других биологических процессах, но пока молекула представляет большую загадку для медицины. Повышенная экспрессия протеина ассоциируется с долголетием не только человека, но и животных. И наоборот, недостаточная выработка этой молекулы сокращает продолжительность жизни – отсюда и громкое название, которое дали ей западные СМИ.
С возрастом продукция klotho неумолимо сокращается, что ассоциируется с окислительным стрессом, накоплением свободных радикалов и риском развития дегенеративных заболеваний.
Наблюдения за добровольцами говорят, что природная, врожденная гиперэкспрессия klotho позволяет поддерживать головной мозг в хорошей форме, независимо от возраста. У таких людей синаптические связи между нейронами сильнее, а ионотропные NDMA-рецепторы в нервной системе функционируют значительно эффективнее.
Означает ли это, что белок долголетия можно использовать в лечении нейродегенеративных заболеваний? Доктор Дубаль абсолютно уверена в этой возможности.
Ученые вводили молодым и старым мышам (18 месяцев для грызунов равны 65 годам для человека) фрагмент белка под названием αKL-F, который очень похож на выделяемый гормон.
Также были выведены генетически модифицированные мыши с избытком альфа-синуклеина – протеина, отвечающего за развитие болезни Альцгеймера и Паркинсона. Эти животные получали инъекции αKL-F и наблюдались отдельно от здоровых сородичей.
Проведенные тесты, включая водный лабиринт Морриса и Y-лабиринт, позволили авторам оценить умственные способности и память каждой группы животных. Согласно результатам эксперимента, молодые мыши через 4 дня после инъекции αKL-F проявляют невероятную сообразительность и память. Эффект продолжается более 2 недель.
У старых животных когнитивные улучшения наблюдаются уже через 2 дня после инъекции.
Наконец, после нескольких инъекций протеина мыши с нейродегенеративными заболеваниями чувствуют себя гораздо лучше: улучшается мышление, уменьшается моторный дефицит.
«После терапии фрагментом klotho нормализуется работа NMDA-рецепторов, усиливаются синаптические связи между нервными клетками в гиппокампе – зоне мозга, которая отвечает за обучение и запоминание информации», — поясняет доктор Дубаль.
Klotho помогает противостоять действию патологических протеинов и обращает вспять нейродегенеративные процессы – таков основной вывод исследователей.
источник
Причины болезни Альцгеймера могут крыться в процессах естественного старения мозга
Исследователям удалось обнаружить один из возможных триггеров воспалительного процесса, предшествующего развитию болезни Альцгеймера и других нейродегенеративных заболеваний. В обзоре Currais et al. Intraneuronal protein aggregation as a trigger for inflammation and neurodegeneration in the aging brain, опубликованном в онлайн-версии издания The FASEB Journal, указывается, что воспаление может возникать как ответ на увеличение количества повреждённых агрегированных белков в нейронах. При этом сам процесс накопления этих белков в клетках является естественной составляющей старения головного мозга.
«Мы надеемся, что в будущем медики разработают такие лекарства, которые будут предотвращать накопление повреждённых белков в нейронах стареющего мозга или удалять уже сформировавшиеся белковые скопления. Люди зрелого возраста смогут вести полноценную жизнь, сохраняя свои когнитивные способности, – рассказывает соавтор работы Антонио Курраис (Antonio Currais), старший научный сотрудник Института биологических исследований Солка (Salk Institute for Biological Studies). – Наша лаборатория активно занимается поиском способов лечения нейродегенеративных заболеваний через управление патологическими процессами, развивающимися по мере старения. Мы полагаем, что эти процессы и являются основной причиной болезней. Наш подход отличается от подхода фармацевтических компаний, разрабатывающих препараты для лечения редких генетических форм нейродегенеративных заболеваний и при этом игнорирующих процессы старения».
В статье учёные утверждают, что, поскольку нервные клетки не способны делиться, они не могут распределить накопленные повреждённые белки между двумя новыми клетками. Белки накапливаются и становятся токсичными, приводя к развитию воспалительных реакций внутри самих нейронов. Это также позволяет предположить, что связь между агрегацией повреждённых белков и запуском воспалительного процесса существует не только в головном мозге, нечто подобное может развиваться и в других органах и тканях по мере старения. Лекарственные средства, которые обеспечат выведение агрегированных белков из клеток, будут обладать большим потенциалом в плане профилактики и лечения многих нейродегенеративных заболеваний: болезней Альцгеймера, Паркинсона и Хантингтона и даже инсульта.
Авторы обзора подчёркивают, что речь идёт не о внеклеточных скоплениях или «бляшках» бета-амилоидного белка, активно изучаемых в контексте развития и течения болезни Альцгеймера. К описываемым белкам они отнесли не только уже известный бета-амилоид, который можно обнаружить внутри нейронов задолго до появления клинических признаков заболевания, но и деформированные версии белков, в норме выполняющих какие-либо функции в нейронах. Однако по мере старения мозга «укладка» молекул белков нарушается, и внутри клеток образуются нерастворимые белковые скопления, которые и провоцируют воспаление. Важно, что ранее эти белки не рассматривались как ассоциированные с какими-либо заболеваниями, и в какой-то степени это справедливо, но лишь в отношении «нормальных» молекул, растворимых и не образующих скопления в нейронах.
«Этот углублённый обзор, первый в соответствующей серии публикаций, сочетает в себе результаты собственных исследований авторов и работы других команд. Он указывает на важную роль воспалительных процессов при болезни Альцгеймера. Воспаление может быть либо причиной её развития, либо ответной реакцией на какой-то другой триггер, запускающий заболевание. Этот аспект болезни Альцгеймера не должен игнорироваться», – отметил Тору Педерсон (Thoru Pederson), главный редактор издания FASEB Journal.
источник
Связанный с болезнью Альцгеймера белок может перемещаться из крови в мозг и накапливаться там, впервые показали эксперименты на мышах.
«Результаты, опубликованные в «Молекулярной психиатрии», свидетельствуют о том, что белок амилоид-бета вне мозга — может способствовать развитию болезни Альцгеймера внутри него», говорит Матиас Юкер, нейробиолог из Университета Тюбингена в Германии.
Этот взгляд на болезнь может побудить ученых разрабатывать методы лечения, которые нацелены на части тела, и которые проще, чем доступ к мозгу.
Эксперименты не предполагают, что люди могут заразиться болезнью Альцгеймера от крови другого человека.
«Суть в том, что это исследование заставляет задуматься, но не должно вызывать тревоги», — говорит невролог Джон Коллинг из Университетского колледжа Лондона. «На самом деле нет никаких доказательств того, что вы можете передать болезнь Альцгеймера переливанием крови».
Но исследователи задавались вопросом, может ли со временем А-бета вырасти в мозгу, переместившись туда из крови, где его обычно обнаруживают в небольших количествах. Ранние исследования на животных показали, что А-бета может перемещаться в мозг, если он вводится в кровоток, но ученые не знали, достаточно ли А-бета из крови, чтобы образовать бляшки в мозге.
Изменения в мозгу при Альцгеймере. Красные точки — скопления амилоида-бета
Чтобы проверить это, исследователи использовали форму предельного разделения крови в эксперименте. Шесть пар мышей — с одной мышью, мутированной для получения доз человеческого A-бета и одной нормальной — были хирургически соединены в течение года, в результате чего смешивание крови было намного более обширным, чем при переливании крови. Через год мозги мышей, несущих мутации, были заполнены A-бета, как и ожидалось. Но эти бляшки были также и внутри мозгов нормальных мышей в соединенных парах.
Мозги мышей, мутировавшие от получения большого количества бляшек из амилоида бета (справа). Мыши, которые делили кровь с этими мутантными мышами, также имели бляшки (средние), тогда как у контрольных мышей бляшек не было (слева).
У присоединенных нормальных мышей уровень А-бета был не таким высоким, как у мутировавших мышей, но тот факт, что они существовали, был заметным. Несвязанные контрольные мыши без мутации не показали накопления A-бета.
Мозги присоединенных мышей также показали другие признаки ухудшения. Исследователи наблюдали воспаление, крошечные области кровотечения и опасный тип белка тау в мозге нормальных мышей, которые были подвергнуты воздействию крови, полной А-бета. У людей болезнь Альцгеймера часто отмечена как A-бета, так и путаницами тау.
Результаты не означают, что болезнь Альцгеймера преимущественно вызвана белковыми факторами в крови.
«Мы все еще думаем о болезни Альцгеймера как о расстройстве мозга, — говорит профессор Сонг. Но факторы в крови, в некоторых случаях, могут иметь силу подталкивать болезнь, свидетельствуют результаты».
А-бета производится клетками в головном мозге, а также тромбоцитами крови, клетками кожи, мышцами и другими частями тела. Как правило, есть баланс между А-бетами внутри и снаружи мозга. Но когда этот баланс отбрасывается, например, когда организм заполнен белком или когда гематоэнцефалический барьер (блокада, которая удерживает потенциальные опасности для мозга) ухудшается с возрастом, мозг может получить дополнительные дозы. Поправляя этот баланс, возможно, что препараты или методы лечения, которые уменьшают A-бета в организме, могут помочь замедлить или предотвратить болезнь Альцгеймера.
Доказано, что A-бета может вести себя как прион, неправильно скопившийся белок, который может подстрекать нормально сложенные белки становиться изгоями. В данных экспериментах не рассматривается вопрос о том, может ли A-бета из крови вести себя как прион, и побудить образовывать бляшки уже существующий A-бета в мозге. Скопления белка в мозгу у обычных мышей, по-видимому, были построены из человеческого белка А-бета, и единственным источником этого была кровь мутантной мыши-партнера.
источник
После десятилетий неудачных попыток найти лекарство от болезни Альцгеймера, кажется, у ученых появилась новая зацепка. Убедительные доказательства того, что эту болезнь вызывает бактерия, могут радикально изменить подходы к разгадке величайшей тайны медицины нашего времени и привести к появлению эффективных лекарств от нее, возможно, даже вакцины. Автор одного из самых популярных в мире журналов о науке и технологиях New Scientist Дебора Маккензи раскрывает подробности последних исследований. А сайт СПИД.ЦЕНТР переводит ее материал, чтобы эти открытия стали доступны и российскому читателю.
По мере того, как население планеты стареет, резкий рост заболеваемости старческой деменцией сделал эту болезнь пятой по распространенности причиной смерти в мире. И около 70 % из всех этих случаев приходятся именно на Альцгеймера. За 10 лет у пациента происходит прогрессирующая потеря памяти и когнитивной функции, выматывающая не только самих больных, но и их родных. В то же время до сих пор остается загадкой, что является причиной ее возникновения.
Известно, что в результате заболевания в мозге пациента накапливаются два типа белка: амилоид и тау-белок. И поскольку этот показатель входит в число самых ранних физических признаков недуга, ведущей гипотезой с 1984 года служило предположение, что болезнь вызывает недостаточный контроль уровня указанных веществ, особенно амилоида, который имеет свойство откладываться в мозге в виде огромных липких сгустков.
До сих пор основная часть научных исследований в области изучения и лечения болезни Альцгеймера была сосредоточена вокруг этой так называемой «амилоидной гипотезы». В эксперименты на генетически модифицированных мышах по выращиванию амилоидных бляшек и разработке лекарств, блокирующих или уничтожающих амилоидные белки, а иногда и нейрофибриллярные клубки тау-белка, оказалось вложено немало средств.
И все впустую. Только в 2018 году Национальные институты здоровья США потратили 1,9 миллиарда долларов на изучение болезни Альцгеймера. Однако согласно недавнему исследованию, показатель неудачных попыток создания лекарства от болезни Альцгеймера по-прежнему составляет 99 %.
Нет ничего странного в том, что некоторые ученые со временем стали сомневаться в верности амилоидной гипотезы. Тем паче отсутствие положительных результатов усугубилось открытием того факта, что у людей, включая 90-летних стариков с исключительной памятью, в мозге, как и у больных Альцгеймером, могут присутствовать сгустки и клубки белка, но при этом деменции не случается.
В своем прошлогоднем исследовании Брайс Виссел из Технологического университета Сиднея (Австралия) так и заключил: чтобы полагать, что именно «амилоид играет центральную или единственную роль в развитии болезни Альцгеймера», данных пока недостаточно.
Кроме того, в 2016 году ученые обнаружили, что скопления амилоида имеют интересную функцию — защиты мозга от бактерий. Неожиданно выяснилось, что этот белок обладает антимикробным действием и способен уничтожать враждебные микроорганизмы. Так, когда ученые ввели бактерии в мозг трансгенным мышам, производящим белки, характерные для болезни Альцгеймера, вокруг бактериальных клеток стремительно образовывались именно эти сгустки.
Совершенно новая гипотеза
В то время, по словам исследователей, они все еще считали, что повреждения мозга при болезни Альцгеймера вызывает сам амилоид, а не бактерии. Но центром целого ряда их последующих исследований стало изучение связанных с появлением сгустков микробов, которые могут быть обнаружены в мозге людей с болезнью Альцгеймера. Они ли вызвали болезнь или же просто сумели проникнуть в мозг, поврежденный вследствие болезни, оставалось неясным. Но одна из таких бактерий, она называется порфиромонасгингивалис (P. gingivalis), вызывающая различные болезни десен, и ранее была известна как фактор риска развития Альцгеймера.
На данный момент очевидно, что P. gingivalis захватывает и поражает именно те области мозга, которые страдают при болезни Альцгеймера; а заболевания десен ухудшают симптомы болезни у трансгенных мышей с Альцгеймером. Более того, у здоровых мышей бактерия вызывает воспаления мозга, похожие на воспаления при болезни Альцгеймера, нейрональные повреждения и образование тех самых амилоидных бляшек.
Что такое болезнь Альцгеймера?
Существует множество видов и причин деменции, но ее наиболее распространенной формой является болезнь Альцгеймера, встречающаяся в 60—70 % случаев.
Обычно в число ранних симптомов болезни Альцгеймера входят потеря краткосрочной памяти, апатия и подавленное настроение, но данные симптомы часто проявляются и в процессе обычного старения, что затрудняет диагностирование болезни на начальных стадиях.
Врачи диагностируют болезнь Альцгеймера на основе медицинского обследования, истории болезни пациента и когнитивных тестов, для исключения других видов деменции может использоваться визуализация. Однако точный диагноз ставится только после смерти больного, когда исследование тканей мозга может показать наличие отложений амилоида и тау-белка, которые характерны для этого заболевания.
Большинству людей диагноз болезнь Альцгеймера ставят после 65 лет, но сгустки амилоида могут начать формироваться в мозге за 15—20 лет до проявления первых симптомов. Все давно ждут появления диагностических тестов и анализов, с помощью которых можно было бы обнаруживать болезнь до смерти пациента и распознавать проявления болезни до того, как повреждения в мозге приобретут огромные масштабы.
«Когда ученые из многих независимых лабораторий приходят к одним и тем же выводам, это выглядит весьма убедительно», — говорит Кейси Линч из сан-францисской фармацевтической компании Cortexyme. И неспроста.
Именно исследователи из Cortexyme, как и их коллеги из нескольких других университетов, обнаружили в 99 % и 96 % случаев из 54 проб головного мозга людей с болезнью Альцгеймера, взятых из гоппокампа, участка, важного для механизмов памяти, токсичные энзимы, за счет которых P. gingivalis живет в человеческих тканях.
Эти протеазы, которые называются гингипаинами, оказались найдены также в больших количествах в тканях мозга с повышенным содержанием фрагментов тау-белка при сильном снижении когнитивных способностей. Кроме того, ученые нашли генетический материал бактерии P. gingivalis в коре головного мозга — области, отвечающей за образное мышление, — во всех трех исследованных экземплярах мозга, пораженных болезнью Альцгеймера.
«Это первый отчет, в котором демонстрируется наличие ДНК P. gingivalis в человеческом мозге и сопутствующих ему гингипаинов, сгруппированных с белковыми сгустками», — рассказывает Сим Синграо из Университета Центрального Ланкашира (Великобритания), которая не принимала участия в вышеупомянутом исследовании, но с группой других ученых обнаружила ранее, что порфиромонасгингивалис активно захватывает мозг мышей с инфекциями десен.
Рассмотрев пробы головного мозга людей, не болевших болезнью Альцгеймера, Линч с коллегами обнаружили и у некоторых из них и P. gingivalis, и скопления белков, но в небольших количествах.
Как известно, амилоид и тау-белок могут накапливаться в мозге в течение 10—20 лет, прежде чем проявятся какие-либо симптомы болезни. А стало быть, по словам ученых, это указывает на то, что P.gingivalis попадает в мозг не в результате болезни Альцгеймера, но, возможно, является ее возбудителем.
Так, когда ученые заразили мышей пародонтитом, вызванным бактерией P.gingivalis, это привело к инфекции головного мозга, образованию амилоида, клубков тау-белка и нейрональным повреждениям в тех областях мозга и нервной системы, которые обычно затрагивает болезнь Альцгеймера. И, как убеждена Линч, у этих двух феноменов, определенно, есть связь.
Она добавляет, что наличие в мозге больных Альцгеймером пациентов бактерии порфиромонасгингивалис соответствует ряду критериев, по которым болезни обычно увязываются учеными с конкретными патогенами. Эти условия называются постулатами Коха в честь Роберта Коха, основателя микробной теории инфекционных заболеваний.
По законам Коха
«Исследование полностью отвечает большинству постулатов Коха, теперь, чтобы результаты были более убедительными, речь может идти об изучении того же феномена на человеке», — говорит Роберт Дженко из Университета штата Нью-Йорк в Буффало (США).
Как именно бактерия P. gingivalis проникает в мозг — неизвестно, но существует несколько весьма правдоподобных предположений о том, какими путями она это делает.
Как правило, ротовая полость заселена разнообразными и относительно стабильными сообществами бактерий, не представляющих большой опасности для организма. Но когда под краем десен образуется зубной налет, в карманах десны возникает воспаление, где успешно размножается, выпуская токсины, тот самый порфиромонасгингивалис.
Воспаление может привести к хроническому пародонтиту и выпадению зубов. Некоторые исследования уже показали, что люди с меньшим количеством зубов, более склонны к деменции. А сами токсины, производимые P. gingivalis, могут, повреждая слизистую рта, попасть в кровь и затем в другие органы.
«Даже если у вас нет болезней десен, временные повреждения слизистой во время приема пищи или чистки зубов могут привести к проникновению бактерий в кровь», — объясняет Линч.
Обычно от проникновения микробов мозг защищает гемоэнцефалический барьер, но бактерия P. gingivalis способна поражать лейкоциты и клеточный покров кровяных сосудов, таким образом все-таки проникая в мозг, объясняет ученый.
Кроме того, бактерия способна проникать в черепные нервы, расположенные около рта, а после распространяться от клетки к клетке по направлению к мозгу в течение нескольких лет.
Есть два варианта того, каким образом P. gingivalis вызывает деменцию после проникновения. Во-первых, она способна запустить процесс образования амилоида — таким способом мозг пытается бороться с инфекцией — в результате чего начинают гибнуть нейроны. Во-вторых, непосредственно вредить этому органу.
Уже известно, что при болезни Альцгеймера происходит воспаление, то есть чрезмерная реакция иммунной системы, которая заканчивается уничтожением нейронов вместо их защиты. Точно так же, как P. gingivalis вызывает воспаление в тканях десен, она может вызвать именно такое воспаление и в головном мозге.
Скорость повреждений
У новой гипотезы уже есть свои противники. В ответ на новые данные Дэвид Рейнольдс из британской благотворительной организации Alzheimer’s UK, например, выражает свое сомнение в том, что причиной болезни Альцгеймера является P. gingivalis, ведь важную роль в развитии болезни, как известно, играет генетическая наследственность человека.
«Есть убедительные доказательства того, что кроме бактериальных инфекций на развитие болезни Альцгеймера большое влияние оказывают генетические факторы, поэтому все новые данные необходимо рассматривать в контексте уже существующих исследований», — убежден ученый.
Впрочем, бактериальная гипотеза возникновения болезни Альцгеймера не противоречит данным генетики. Склонность человеческого организма к воспалениям бывает разной в зависимости от генетических вариаций, которые оказывают влияние на иммунную систему. Именно от этого может зависеть, насколько сильно P. gingivalis способна навредить поражаемому им органу.
Самым большим генетическим фактором риска болезни Альцгеймера является наличие у человека определенной мутации гена, содержащего иммунный белок AпoE (аполипопротеин Е).
В прошлом году группа ученых из Швеции обнаружила, что гингипаины, выделяемые бактерией P. gingivalis, разбивают белок AпoE на частицы, расщепляя его на месте определенной аминокислоты внутри белка. Эти частицы, в свою очередь, могут повреждать нервы.
Изоформа AпoE4, о которой идет речь, содержит большее количество этой аминокислоты, и, возможно, люди с этой изоформой более подвержены развитию у них болезни Альцгеймера, потому что вредоносные уровни частиц AпoE образуются в их мозге быстрее, чем в мозге других людей.
Скорость, с которой накапливается повреждение, является ключевым фактором течения болезни.
Несмотря на то, что P. gingivalis присутствует в полости рта многих людей, только некоторые из них заболевают Альцгеймером. Поскольку до того, как у них проявятся первые симптомы, может пройти не один десяток лет, а сама болезнь может просто не успеть захватить весь мозг пациента до его смерти от другой причины.
«Болезнь Альцгеймера поражает тех людей, у которых гингипаины и повреждения мозга накапливаются достаточно быстро для того, чтобы симптомы болезни проявились в течение жизни», — говорит Линч. Она утверждает, что их открытие — это «универсальная гипотеза патогенеза», полностью объясняющая причины болезни Альцгеймера.
Брайс Виссел из Технологического университета Сиднея (Австралия), слова которого мы уже цитировали выше, напоминает, что болезнь Альцгеймера — это сложное заболевание: «Вряд ли у нее всего лишь одна причина. А стало быть, мы должны быть внимательны». «И тем не менее новые данные очень впечатляют», — соглашается он.
«Болезнь Альцгеймера встречается у людей пожилого возраста настолько часто, что вполне может быть результатом и какого-то врожденного свойства мозга, и инфекции», — считает этот ученый.
Надежда на излечение
Главное: если новая гипотеза подтвердится, возможно, в обозримом будущем будут найдены эффективные лекарства от болезни.
И хотя существует множество способов самостоятельно снизить риск заболевания болезнями десен, ученые из Cortexyme надеются создать средство, способное остановить или вызвать обратное развитие болезни Альцгеймера, на основе разработанных ими молекул, блокирующих выработку гингипаинов.
источник