Болезнь Альцгеймера обычно развивается у пожилых людей. Типичными признаками патологии являются ухудшение памяти и снижение интеллектуальных способностей.
Человек, страдающий от этого недуга, плохо ориентируется в пространстве. Больной нуждается в помощи близких. Причины, вызывающие развитие патологии, до конца не изучены.
Невропатологи предполагают, что патологические изменения вызваны накоплением веществ. Их отложение в головном мозге при болезни Альцгеймера происходит постепенно.
Эта теория объясняет, почему патология непрерывно прогрессирует, а симптоматика усиливается. На первых этапах болезнь сложно диагностировать. При умеренной деменции признаки выражаются ярче. На поздних стадиях больной уже не может самостоятельно передвигаться и обслуживаться себя. Развитие патологии связано с нарушением работы головного мозга. Первые изменения начинаются уже на этапе ранней деменции.
Основными среди них являются:
- наличие болезни у родственников;
- возраст старше 65 лет;
- черепно-мозговые травмы;
- патологии щитовидной железы;
- влияние электромагнитных полей.
Кроме этого, учёные доказали, что существует высокая вероятность развития болезни Альцгеймера у пациентов с диагностированным синдромом Дауна. При этом заболевании геном человека содержит лишнюю хромосому. Медики называют данную патологию трисомия 21. Именно эта лишняя хромосома является источником опасного вещества, формирующего отложения. Высока вероятность развития деменции в относительно молодом возрасте. Болезнь Альцгеймера начинает прогрессировать по достижению 40 лет.
Нарушение нормального функционирования головного мозга связано с изменением его структуры. При этом формируются фибриллы. Они представлены скоплением большого количества гликопротеида. Это вещество не растворяется в воде и биологических жидкостях. Его невозможно удалить из тканей головного мозга. Такие изменения носят необратимый характер. По этой причине болезнь Альцгеймера не поддаётся лечению.
Фибриллы представляют собой жёсткие структуры. Они не только деформируют ткани головного мозга, лишая человека привычных навыков и способностей. Эти конгломераты оказывают токсическое действие на нервные клетки.
Однозначной версии, объясняющей развитие деменции в пожилом возрасте, не существует. Невропатологи склоняются к амилоидной гипотезе. Версия была выдвинута в 1991 году. Согласно этой теории, в головном мозге пациентов накапливается особое вещество – амилоид.
Данная структура представляет собой белок. Он образуется при расщеплении гликопротеидов под действием ряда ферментов.
Исходное вещество в норме всегда присутствует в мембранах нервных клеток здорового человека.
Амилоид является нерастворимым соединением. Он постепенно накапливается в тканях головного мозга. Эти отложения инициируют процессы необратимых изменений. По сути, начинается разрушение центральной нервной системы.
Со временем в нервной ткани накапливается всё больше опасного белка. Это объясняет непрерывное развитие болезни Альцгеймера. Приостановить отложение амилоида невозможно. Пациент при этом будет отмечать ухудшение памяти и умственных способностей. Постепенно теряются и двигательные навыки.
Следует отметить, что учёные обнаружили полезную роль амилоида и его предшественника относительно недавно. Прежде предполагалось, что эти вещества не нужны человеческому организму. Сейчас известно, что гликопротеид, являющийся предшественником амилоида, обладает противомикробными свойствами. Это открытие позволило предположить, что наличие указанных гликопротеидов обеспечивает иммунный ответ организма. Таким способом частично формируется врождённая защита от бактерий.
При определённых условиях необходимый для поддержания иммунитета амилоид видоизменяется. Вещество становится опасным для организма. Меняется сама химическая структура белка. Нитевидные молекулы формируют крупные нерастворимые скопления – фибриллы. Запускается процесс разрушения тканей головного мозга.
Постепенно весь амилоид, имеющийся на мембранах нейронов, переходит в патологически изменённую форму. К этому моменту человек уже утрачивает часть функций. Симптомы болезни Альцгеймера проявляются чётко. Невропатологи безошибочно диагностируют деменцию.
Учёные до сих пор не выяснили, что именно инициирует перерождение гликопротеида на мембранах. Эти знания смогут поспособствовать новым открытиям. В частности, появится возможность управлять процессами синтеза амилоида. На данный момент известно, что процесс его образования протекает при участии двух ферментов из класса секретаз.
Болезнь Альцгеймера долгое время может маскироваться. Начальные симптомы болезни Альцгеймера — забывчивость, рассеянность внимания — часто остаются незамеченными, что откладывает начало лечения, тем самым отягощая прогноз.
Хотите знать, передается ли болезнь Альцгеймера по наследству? Читайте эту статью.
Следующая информация будет полезна для всех: http://neuro-logia.ru/zabolevaniya/bolezn-alcgejmera/test.html. В статье представлены простые тесты для диагностики болезни Альцгеймера.
Болезнь Альцгеймера проявляется снижением интеллектуальных способностей, а также ухудшением памяти и способности ориентироваться в пространстве и времени.
Дегенеративные изменения связаны с появлением особого вещества – амилоида. Этот белок перерождается и начинает оказывать отравляющее действие на клетки головного мозга.
Токсичный гликопротеид опасен сам по себе. Нейроны мозга не могут полноценно функционировать. При этом амилоид постоянно накапливается в тканях. Образуются сгустки крупного размера – фибриллы, состоящие из аминокислотных последовательностей.
Такие конгломераты окружены единичными нитевидными молекулами амилоида. Они способны объединяться в кластеры. Это небольшие олигомеры, свободно перемещающиеся в тканях мозга. Кластеры, в отличие от фибрилл, растворяются в воде. Именно такие олигомеры, образованные из амилоидных бляшек, обладают наибольшей токсичностью. Они непосредственно нарушают работу всей нервной системы.
Подобные кластеры являются липкими структурами. Они располагаются между нейронами головного мозга. Их основой являются амилоидные бляшки. Между собой кластеры соединяются с помощью микротрубочек. Это нарушает течение нормальных обменных процессов в организме пациента, страдающего болезнью Альцгеймера. Затрудняется транспортировка питательных веществ к структурам головного мозга.
Кластеры способны продуцировать новые молекулы амилоида. Специалисты называют этот процесс вторичной нуклеацией. Количество опасного гликопротеида непрерывно растёт. Вместе с тем начинается массовая гибель нейронов.
Болезнь Альцгеймера – это разновидность необратимой деменции. Утраченные двигательные функции или когнитивные способности не возвращаются. Причиной патологических изменений становятся отложения амилоида в мозге больного. Учёные не знают, каким способом можно влиять на процесс изменения гликопротеидов на мембранах. По этой причине специфического медикаментозного лечения болезни Альцгеймера не существует.
Так, ряд специалистов предполагает, что деменцию провоцируют геномные нарушения.
Согласно существующей тау-гипотезе, патология развивается из-за нарушения структуры самих клеток мозга.
Болезнь поражает разные участки головного мозга. Максимальная концентрация амилоида обнаруживается в височной, теменной и лобных долях. Сначала появляется лёгкая рассеянность, которая со временем перерастает в серьёзные умственные расстройства.
До 45% случаев сенильной деменции приходится на болезнь Альцгеймера. Профилактика болезни Альцгеймера у мужчин и женщин направлена на активизацию физической и умственной деятельности.
Чем характеризуется тяжелая деменция и каков прогноз для жизни таких больных, вы узнаете, прочитав эту информацию.
источник
Под деменцией понимают выраженное нарушение когнитивных функций на фоне полного сохранения сознания. Самая частая причина деменции — болезнь Альцгеймера (БА), которой страдают 5% людей в возрасте 70 лет и 20% в возрасте 80 лет. На пациентов с БА приходится 20% госпитализаций в психиатрические стационары.
При МРТ обычно обнаруживают выраженную атрофию коры больших полушарий с расширением борозд и увеличением желудочков. Как показано на рисунке ниже, поражение медиальной височной доли (гиппокампальный комплекс и энторинальная кора) происходит в большей степени, чем других отделов. Первичная чувствительная кора и двигательная кора, а также верхние участки префронтальной коры остаются относительно сохраненными.
При посмертном исследовании коры больших полушарий обнаруживают следующие изменения:
• Массивная гибель пирамидных нейронов.
• Амилоидные бляшки и нейрофибриллярные клубки, преимущественно в гиппокампе и миндалевидном теле. Бляшки начинают скапливаться в стенках мелких кровеносных сосудов. Их появление можно объяснить разрушением определенного фермента с последующей гиперпродукцией белка β-амилоида. Клубки состоят из скоплений микротрубочек, которые связаны с патологической формой белка, ассоциированного с микротрубочками (θ-белок). Клубки постепенно замещаются амилоидом.
• Гибель более 50% холинергических нейронов базального ядра Мейнерта и области перегородки мозга, а также их волокон, идущих через неокортекс и мезокортекс. Было также показано, что гибель АХ-нервных окончаний провоцирует образование нейрофибриллярных клубков в височной доле.
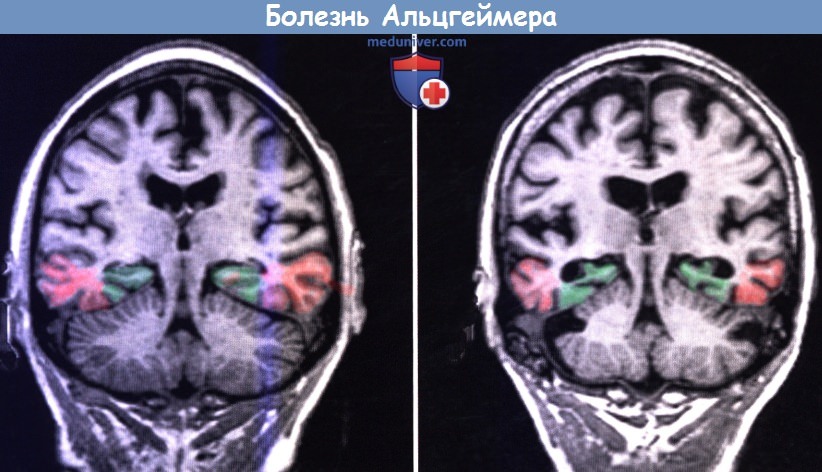
(А) В норме. (Б) Пациент с болезнью Альцгеймера.
Добавлены цвета: зеленый — гиппокамп; красный — энторинальная кора.
При помощи ПЭТ-исследования, направленного на определение скорости метаболизма глюкозы, определяют признаки гипометаболизма. Снижение метаболизма связано с гибелью пирамидных нейронов и (частично) с нарушением холинергической иннервации оставшихся пирамидных клеток. На мембранах здоровых пирамидных нейронов расположены возбуждающие АХ-рецепторы.
Несмотря на то, что процесс гибели нейронов в каждом случае протекает по-разному, чаще всего он начинается в медиальной височной доле, а затем распространяется наверх и вперед. Это может объяснить следующую последовательность развития симптомов.
• Снижение функции гиппокампа. Возникают антероградная амнезия и забывчивость, пациент не может вспомнить о произошедшем с ним событии даже спустя несколько минут (нарушение текущей эпизодической памяти). Пациент перестает ориентироваться на знакомых улицах, совершает опасные ошибки при управлении автомобилем (работа гиппокампа необходима для поддержки чувства пространства, за которое отвечает теменная доля). Нарушается внимание, пациенту становится сложно переключиться с одной задачи на другую.
• Снижение функции затылочно-височной коры. Повреждение поля 37 приводит к неспособности читать и писать. Повреждение височного полюса приводит к развитию крайне неприятного симптома—пациент перестает узнавать лица родственников и друзей. При вовлечении в процесс надкраевой и угловой извилин пациент не может писать.
• Снижение функции лобной коры. Примерно через три года после начала заболевания пациент просто «выпадает» из жизни, он может смотреть в стену и не понимать, что происходит вокруг. Подобное состояние «пустоты» обычно продолжается 5-6 лет до смерти.
Существует также редкий вариант болезни Альцгеймера с ранним началом, который наследуют по аутосомно-доминантному типу. Заболевание обычно возникает в возрасте 30-40 лет. Хромосомный анализ позволил установить, что за развитие болезни отвечает мутация на длинном плече хромосомы 21, которая нарушает действие гена, кодирующего синтез белка-предшественника амилоида. Эту мутация часто также обнаруживают у лиц с синдромом Дауна. У большинства лиц с синдромом Дауна, доживающих до зрелого возраста, развивается болезнь Альцгеймера.
Редактор: Искандер Милевски. Дата публикации: 25.11.2018
источник
В пожилом возрасте человека настигает большое количество различных возрастных заболеваний. Возникают нарушения работы внутренних органов, головного мозга. Большой проблемой XXI века стала старческая деменция (слабоумие). Часто проявляющимся видом старческого слабоумия является болезнь Альцгеймера – страшное прогрессирующее заболевание с неблагоприятным исходом.
Алоис Альцгеймер выделил это заболевание в отдельный вид деменции по соответствующим изменениям, происходящим в коре головного мозга. Было установлено, что у людей, страдающих болезнью Альцгеймера, между нервными клетками головного мозга скапливался токсичный белок β-амилоид. В самих нейронах происходит скопление другого вида белка (тау-белка).
Амилоидные бляшки нарушают связь между нейронами, что вызывает гибель нервных клеток. Тау-белок, находящийся в них, завершает процессы разрушения нейронов. В первую очередь происходит разрушение нервных клеток височной доли коры головного мозга. Постепенно происходит разрушение нервных клеток всего головного мозга.
Точная причина, происходящих в головном мозге дегенеративных изменений, до сих пор не выявлена. Выделено несколько факторов риска, которые могут способствовать развитию болезни Альцгеймера.
Старшая возрастная категория людей – основной фактор риска. Однозначно можно сказать, что болезнью Альцгеймера страдают люди в основном после 60 лет, чем старше становится человек, тем больше возрастает риск заболевания. Болезнь Альцгеймера в молодом возрасте встречается очень редко.
Однако все больше фиксируются случаи заболевания и у более молодого поколения людей, которые чаще всего диагностируются очень поздно, в запущенных случаях. Болезнь Альцгеймера у молодых возрастает с каждым годом, к сожалению, хотя это маленький процент, но это пока ничем нельзя приостановить и предугадать.
Наследственный фактор играет не последнюю роль в развитии болезни. Ученые выделили связь в том, что болезнь Альцгеймера часто встречается у людей с отягощенной наследственностью по данному заболеванию. То есть, если среди кровных родственников есть такие больные, то риск заболеть возрастает в несколько раз. Но эта теория не находит разумного подтверждения и до сих пор не ясно каким образом происходит наследственная связь. Предполагается, что здесь играет роль стиль и образ жизни людей. Чаще у родственников он схож.
Генные мутации. Это более современный взгляд на развитие болезни Альцгеймера. В настоящее время выделено несколько генов, а точнее их три, так называемые гены риска, мутации которых приводят к болезни Альцгеймера. Выявлено, что чаще всего к болезни Альцгеймера приводят изменения в 1-ой паре хромосом, также в 14-ой, 19-ой и 21-ой паре хромосом.
Умеренные нарушения умственного развития. Доказано, что люди с низким интеллектом более подвержены развитию болезни Альцгеймера. Считается, чтолюди с более высокими интеллектуальными способностями, те, чья деятельность связана с умственной работой, читающие люди, тренирующие свою память, ограждены от страшного диагноза болезнь Альцгеймера. Это связано с тем, что постоянная мозговая работа укрепляет связи между нейронами, улучшается мозговая деятельность.
Однако известно много случаев, когда высокоинтеллектуальные весьма известные люди с болезнью Альцгеймера не смогли справиться. Категорию умственно развитых людей так же может настичь болезнь Альцгеймера, но разрушительные процессы в головном мозге у них происходят медленнее и наступают значительно позже.
Принадлежность к женскому полу. Существует статистика, что женщины страдают болезнью Альцгеймера намного чаще, чем мужчины. В первую очередь, это связано с тем, что средняя продолжительность жизни женщин выше, чем у представителей мужского пола, то есть мужчины не доживают до того критического возраста. Во-вторых, у представительниц женского пола, после 50 лет начинается сильная гормональная перестройка, у мужчин она незначительная. Этот фактор ученые так же выделили, как фактор риска.
Черепно-мозговые травмы. В группе риска находятся спортсмены, люди, получающие травмы головы с потерей сознания, памяти. У такой категории людей может развиться болезнь Альцгеймера.
Большие психологические потрясения и стрессы. Любое волнение и стресс сказывается на психическом состоянии человека. Длительный стресс приводит к образованию большого количества кортизола в организме, который губительно действует на нейронные связи и на весь организм в целом.
Нарушения, связанные с работой сердечнососудистой системы. Головной мозг и его здоровое состояние напрямую зависят от состояния сердечнососудистой системы. Сердце как большой насос подает, насыщенную кислородом и питательными веществами, кровь в головной мозг и другие органы.
Если имеются сбои в работе сердца, то могут возникнуть проблемы в головном мозге, например, недостаточное поступление кислорода, и вследствие этого недостаточная передача импульсов через нейронные связи. Такой фактор в развитии болезни Альцгеймера так же не исключается учеными.
Другие нарушения, приводящие к кислородному голоданию клеток головного мозга. К таким нарушениям относятся: сахарный диабет, болезни дыхательной системы, атеросклероз сосудов головного мозга, гиперлипидэмия (высокая концентрация липидов в крови), курение, артериальная гипертония. Своевременное лечение и предотвращение таких нарушений значительно снижает риск развития болезни Альцгеймера.
Таким образом, точные причины возникновенияболезни Альцгеймера пока не выявлены. Генетическая теория происхождения болезни считается наиболее оправданная.
Установление диагноза требует комплексного обследования. Врач может без труда выявить имеющуюся деменцию, но точно диагностировать ее тип бывает сложно. Ранний тип начала болезни Альцгеймера вызывает частые ошибки в постановке диагноза.
В методы комплексного исследования входят:
- Выявление наследственного, генетического фактора.
- Обследование неврологического состояния.
- Оценка памяти, оценка мыслительных, умственных способностей при помощи когнитивных тестов.
- Анализы крови для исключения других возможных патологий. На данном этапе проводят исследование цереброспинальной жидкости для выявления разрушительных процессов.
- Нейровизуализация – несколько видов методов, позволяющих получить визуальную структуру, функциональные характеристики мозга, а также биохимические процессы, происходящие в ней.
Здесь применяются следующие методы: компьютерная томография, электроэнцефалография, магнитно-резонансная томография, позитронно-эмиссионная томография с контрастом, однофотонная эмиссионная томография.
Есть доказанные факты, что развитие болезни Альцгеймера и, вызываемые ею, дегенеративные нарушения начинаются задолго до проявления явных клинических симптомов. Поэтому, очень сложно выявить точное клиническое начало болезни. Такое скрытое состояние назвали предеменция. В общем течении выделяют следующие стадииболезни Альцгеймера.
Первая ранняя стадия: на данном этапе никаких симптомов тревоги нет, память не нарушена, никаких отклонений не выявляется.
Вторая начальная стадия: начинаются ухудшения памяти, не отмеченные посторонними людьми.
Третья стадия у людей, страдающих болезнью Альцгеймера, проявляется умеренными, замечаемыми посторонними людьми, нарушениями памяти. У больного отмечается рассеянность, он не помнит, куда положил ту или иную вещь, путается в именах. На третьей стадии врач еще не может с уверенностью поставить точный диагноз.
На четвертой стадии происходит выраженное нарушение памяти. Больные забывают имена близких родственников, путают события, появляются некие провалы в памяти. Больные на данном этапе уже не могут справиться со счетом, возникают сложности при выборе.
На пятой стадии заболевание характеризуется очень сильными мозговыми нарушениями. Пациенты забывают адрес места жительства, не могут вести счет дням, не помнят месяцы и время года. На данной стадии болезни Альцгеймера больные еще узнают своих близких, могут самостоятельно обслуживать себя: принимать пищу и совершать гигиенические мероприятия по собственному уходу.
На шестой стадии недуга наблюдается сильное прогрессирование нарушений памяти. Несмотря на то, что больные узнают своих близких, они не могут вспомнить их имена. Такие пациенты забывают часть своего прошлого, не могут подобрать себе одежду. Начинаются проблемы со стулом, возникает недержание мочи, они не могут самостоятельно сходить в туалет и ухаживать за собой.
Больные на шестой стадии заболевания становятся очень мнительными, недоверчивыми. Нередки случаи галлюцинаций. Такого пациента опасно оставлять без присмотра.
Седьмая стадия характеризуется полной утратой способности к самообслуживанию. Больные не могут сидеть без помощи посторонних, утрачивают способность передвигаться, принимать пищу, часто отказываются от еды. Характерна несвязная речь, чаще какие-либо отдельные фразы, слова и слоги. Самая тяжелая стадия для самого пациента и для его родственников.
Перечисленные стадии выделяются условно. У каждого человека симптомы болезни Альцгеймера могут проявляться по-разному. Все зависит от индивидуальных особенностей и продолжительности течения заболевания.
Часто родственники больных и сами пациенты пытаются выяснить у специалистов, можно ли вылечить болезнь Альцгеймера. Несмотря на высокие медицинские технологии, заболевание неизлечимо. Никакие факторы не могут прервать начавшиеся разрушительные процессы в головном мозге.
Исход заболевания всегда летальный, но, сколько живут с болезнью Альцгеймера, никто не может сказать точно. Этому способствуют разные факторы, но раннее выявление заболевания и своевременная терапия могут значительно улучшить состояние пациентов. Принято считать, что средняя продолжительность жизни при болезни Альцгеймера составляет 8 лет.
При появлении нарушений памяти и других сомнительных симптомов, обязательно нужно обращаться к врачу. Некоторая категория людей совершенно не любит обращаться в лечебное учреждение и не знает, какой специалист может помочь при изменениях памяти, какой врач лечит болезнь Альцгеймера. Для начала необходимо проконсультироваться с терапевтом.
При выявлении признаков деменции, он направит к неврологу и психиатру. Именно эти специалисты знают, как лечить болезнь Альцгеймера, вернее, как смягчить ее симптоматические проявления. Психиатр лечит глубокую деменцию.
Хотя заболевание относится к категории неизлечимых болезней, поддерживающая терапия помогает смягчить симптомы и замедлить процессы разрушения головного мозга. В лечении болезни Альцгеймера применяют два принципа лечения.
Направлено на улучшение памяти и восстановление интеллектуальных способностей человека. Так же ведется борьба с основными признаками заболевания: депрессией, галлюцинацией, возбуждением. Применяются следующие группы лекарственных препаратов:
- Ингибиторы холинэстеразы – основная группа препаратов, использующихся в лечении деменции. Они способствуют накоплению вещества ацетилхолина, он улучшает и контролирует процессы запоминания. На начальных стадиях заболевания эффективно используются Ривастигмин и Галантамин. На поздних стадиях, с более глубокими нарушениями назначают Донепезил.
- Мемантин – препарат, широко применяющийся в лечении болезни Альцгеймера. Он уменьшает разрушающее действие глутамата на кору головного мозга. Под действием этого лекарственного препарата у больных надолго сохраняется способность к самообслуживанию. Чаще Мемантин назначают на более поздних стадиях заболевания.
- Психотропные лекарственные препараты. Эта группа назначается в тех случаях, когда у больных появляются проблемы со сном или депрессивные состояния. Для устранения этих симптомов назначают нейролептики или транквилизаторы.
- Транквилизаторы назначают для смягчения эмоционального напряжения. Они обладают расслабляющим эффектом и используются как противосудорожные лекарственные средства.
- Антидепрессанты избавляют пациентов от патологической тревожности.
- Нейролептики назначают при психозах.
- Антиоксиданты увеличивают продолжительность самообслуживания.
Дополняют терапию лекарственными препаратами. Такой подход позволяет пациентам адаптироваться к заболеванию на ранних стадиях. С больными проводится терапия общением, работают с воспоминаниями, выполняют интеллектуальные задания. Индивидуальные и групповые занятия приводят к хорошим результатам.
Кроме перечисленных методов терапии уделяется внимание диетотерапии. Из рациона больных исключаются жирные, сладкие продукты питания, острые приправы. Ограничивают употребление мучных изделий. Мнение, что возможно эффективное лечение болезни Альцгеймера народными средствами, к сожалению неверное. Заболевание считается необратимым, можно лишь замедлить его течение.
источник
В статье обсуждается значение сосудистых нарушений в патогенезе болезни Альцгеймера у пожилых. Приводятся эпидемиологические данные, свидетельствующие о том, что различные сосудистые факторы риска, включая артериальную гипертензию, сахарный диабет, фибри
В статье обсуждается значение сосудистых нарушений в патогенезе болезни Альцгеймера у пожилых. Приводятся эпидемиологические данные, свидетельствующие о том, что различные сосудистые факторы риска, включая артериальную гипертензию, сахарный диабет, фибрилляцию предсердий, инфаркт миокарда в анамнезе, могут быть связаны с повышенным риском возникновения болезни Альцгеймера. Рассматриваются причины возникновения капилляропатии, оксидантного стресса при болезни Альцгеймера. Подчеркивается тот факт, что нарушения церебральной гемодинамики, особенно на микрососудистом уровне, могут способствовать реализации нейродегенеративного процесса.
Болезнь Альцгеймера в последние годы приобретает все большее медико-социальное значение. Это заболевание считается наиболее распространенной причиной деменции в пожилом и старческом возрасте [1, 3, 4, 6]. Затраты общества, связанные с болезнью Альцгеймера, сопоставимы с суммарными затратами на онкологические и кардиологические заболевания [31]. Предполагается, что в настоящее время во всем мире болезнью Альцгеймера страдает от 17 до 25 млн больных, а к 2050 году их число может увеличиться в 4 раза [24].
Ведущая роль в патогенезе болезни Альцгеймера придается изменениям со стороны нейротрансмиттерных систем, особенно ацетилхолинергической. Наблюдается соответствие между тяжестью деменции и центральным холинергическим дефицитом — холинергической деафферентацией коры, при этом снижение уровня ацетилхолина выявляется в гиппокампе, средневисочной, теменной, лобной и орбитофронтальной коре, но отсутствует в стволе мозга, таламусе, прецентральной и постцентральной извилинах, затылочной коре и мозжечке [9]. Степень холинергического дефицита в корковых отделах тесно связана с уменьшением количества нейронов в базальных отделах головного мозга, особенно в области базального ядра Мейнерта, где располагаются нейроны, продуцирующие ацетилхолин. Кроме того, современные данные свидетельствуют о том, что, помимо ацетилхолинергической системы, определенные изменения отмечаются и со стороны других нейротрансмиттерных систем, в частности, активно изучаются глутаматергические расстройства [2; 10; 18].
За последние десятилетия было предложено несколько различных теорий, авторы которых делали попытки объяснить этиологию этого заболевания. К определенным факторам риска возникновения болезни Альцгеймера принято относить возраст, отягощенный по этому заболеванию семейный анамнез и наличие аллели аполипопротеина Е e4. Наследственным аутосомно-доминантным заболеванием болезнь Альцгеймера является в менее чем 5% случаев.
В настоящее время существует мнение, что болезнь Альцгеймера гетерогенна по своему происхождению: в одних случаях она носит наследственный характер, в других — возникает спорадически. Это заболевание может быть результатом сочетанного действия различных факторов, приводящих в конечном итоге к сходным клиническим и патоморфологическим изменениям [25].
В связи с этим в последнее время в патогенезе болезни Альцгеймера определенное значение стало придаваться сосудистым изменениям, однако клиническое значение этих изменений требует изучения [3]. R. Kalaria [21] считает, что цереброваскулярные нарушения имеются примерно у трети пациентов с болезнью Альцгеймера. Риск возникновения этого заболевания возрастает после острых эпизодов нарушений мозгового кровообращения. В частности, значительное по своему объему исследование (около 2000 лиц без деменции, все — выходцы из Японии), проведенное в США A. Graves и соавт. [20], показало, что возникновение транзиторных ишемических атак увеличивает риск развития в последующем болезни Альцгеймера.
В своем обзоре, посвященном сосудистым факторам риска при деменциях, R. Schmidt и соавт. [30] отмечают, что имеется прямая связь между болезнью Альцгеймера и системным атеросклерозом. При этом подчеркивается, что в настоящее время нельзя определить, прослеживается ли эта связь случайно, вследствие использования несовершенных диагностических критериев болезни Альцгеймера, либо она служит отражением особенностей патогенеза этого заболевания, в определенной степени связанных с сосудистыми нарушениями.
Эпидемиологические данные свидетельствуют о том, что различные сосудистые факторы риска, включая артериальную гипертензию, сахарный диабет и фибрилляцию предсердий, могут быть связаны с повышенным риском возникновения болезни Альцгеймера [21–24; 30; 33]. В частности, у больных с фибрилляцией предсердий почти в два раза повышается риск возникновения этого заболевания, а у пациентов, перенесших в прошлом клинически бессимптомный инфаркт миокарда, этот риск оказывается выше в три раза [22]. J. Blass и соавт. [8] высказывают предположение, что в основе каузальной связи между аритмиями и риском возникновения болезни Альцгеймера лежат нарушения, обусловленные феноменом реперфузии — после кратковременного падения мозгового кровотока при аритмиях, и связанный с этим оксидантный стресс.
Адекватное лечение артериальной гипертензии у лиц пожилого возраста сопровождается снижением риска возникновения деменции, включая болезнь Альцгеймера [23; 24; 35], хотя с этим согласны и не все исследователи [33].
M. Kivipelto и соавт. [23] показали, что наличие артериальной гипертензии (особенно повышенного систолического артериального давления) и гиперхолестеринемии у лиц средней возрастной группы в последующем увеличивает у них риск возникновения болезни Альцгеймера. В отзывах на результаты этой работы, размещенных на сайте опубликовавшего статью British Medical Journal, подтверждалось, что гиперхолестеринемия и микроциркуляторные расстройства могут иметь значение в патогенезе этого заболевания. Следует заметить, что наличие гиперхолестеринемии может являться одним из патогенетических факторов первичного нейродегенеративного процесса, поскольку аполипопротеин Е участвует в метаболизме липидов (кодирование холестеролтранспортирующего липопротеина), а сам по себе холестерол стимулирует образование простагландинов Е2 и F2a и вызывает вазоконстрикцию [34].
В редакционной статье в Journal of Neurology Neurosurgery & Psychiatry R. Stewart [33], рассматривая имеющиеся данные, свидетельствующие о связи артериальной гипотензии с болезнью Альцгеймера, подчеркивает, что характер данной связи требует уточнения. В частности, само по себе наличие деменции сопровождается снижением общего метаболизма, одним из проявлений которого и является пониженное артериальное давление.
Повышение уровня гомоцистеина является одним из сосудистых факторов риска, на фоне гиперцистеинемии возрастает риск тромбозов, окклюзирующих поражений сосудов и инсульта. В последнее время было показано, что гиперцистеинемия отмечается как при сосудистой деменции, так и при болезни Альцгеймера, что приводит к активации механизмов воспаления, сопровождающихся нейротоксичностью, амилоидогенезом и микроваскулярными расстройствами [3].
Между отложением амилоида и цереброваскулярными нарушениями прослеживается взаимосвязь, в основе которой может лежать поражение эндотелия, в частности, вырабатываемым эндотелием токсическим фактором (англ. — endothelial-derived toxic factor), который образуется при ингибировании фермента протеинкиназы С, и истончение базальной мембраны при характерной для болезни Альцгеймера активации микроглии. Также имеет значение нарушение гематоэнцефалического барьера.
Значимость сосудистых нарушений в патогенезе болезни Альцгеймера подтверждается и патоморфологическими данными. Примерно у 40 — 50% больных с первоначально диагностированной болезнью Альцгеймера на аутопсии находят сочетанную, сосудистую и несосудистую (в частности, болезнь диффузных телец Леви) патологии [35]. Следует заметить, что сосудистые очаги выявляются у 20 — 40% пациентов с болезнью Альцгеймера [35]. Наличие легких альцгеймеровских изменений коры головного мозга само по себе (до определенного момента) не сопровождается грубым когнитивным дефектом, однако в случае возникновения церебральных инфарктов в белом веществе полушарий головного мозга и базальных ганглиях может приводить к деменции. У больных с клинической картиной деменции плотность нейрофибриллярных клубочков может быть почти в два раза меньше, чем при «чистой» болезни Альцгеймера, если одновременно имеются субкортикальные сосудистые очаги [35].
У больных с тяжелой ишемической болезнью сердца сенильные бляшки, одно из основных патоморфологических проявлений болезни Альцгеймера, выявляются в большем количестве, чем в контрольной группе, а у пациентов с артериальной гипертензией отмечается увеличение не только числа сенильных бляшек, но и нейрофибриллярных клубочков [33]. M. Smith и соавт. [32] показали, что при болезни Альцгеймера наличие сопутствующих сосудистых изменений приводит к более значительному накоплению гиперфосфорилированного тау-протеина в области CA1 гиппокампа.
Рассматривая взаимосвязь болезни Альцгеймера и сосудистых изменений, следует учитывать также роль характерной для этого заболевания церебральной амилоидной ангиопатии. Она может приводить не только к лобарным кровоизлияниям (что хорошо известно), но также к поражению мелких церебральных — кортикальных и лептоменингеальных — сосудов с возникновением небольших завершенных и незавершенных инфарктов [28; 33].
Взаимосвязь сосудистых факторов риска с возникновением болезни Альцгеймера в настоящее время довольно трудно объяснить только теми процессами, которые происходят на клеточном уровне. Поэтому J. C. de la Torre и G. B. Stefano [11–14] придают особое значение в патогенезе этого заболевания патологии капилляров, приводящей к церебральной гипоперфузии. По данным целого ряда патоморфологических исследований [11 — 16], при болезни Альцгеймера отмечаются выраженные изменения капилляров в виде истончения базальной мембраны, дегенерации перицитов, отложения коллагена, изменений эндотелиальных клеток. Любопытно заметить, что результаты патоморфологического исследования E. Farkas и соавт. [15; 16] свидетельствуют о выраженных изменениях капилляров не только при болезни Альцгеймера, но и при болезни Паркинсона.
Поражение капилляров в силу законов гидродинамики приводит к нарушениям ламинарного тока крови и церебральной гипоперфузии. Как результат, страдает внутриклеточный метаболизм, возникает целый каскад изменений в нейронах, связанный с процессами эксайтотоксичности и оксидантного стресса, что, в свою очередь, стимулирует амилоидогенез. Экспериментально было показано, что длительно существующее состояние гипоперфузии приводит к гиппокампальным нарушениям. Этот процесс сопровождается нарушениями памяти, структурным изменением капилляров в области гиппокампа, нарушением обмена глюкозы и белков, отложением β-амилоида, активацией глиальной ткани, гибелью нейронов гиппокампа [11 — 14].
Помимо капилляропатии, приводящей к нарушениям церебральной перфузии, вторым важным фактором в патогенезе болезни Альцгеймера, по мнению J. C. de la Torre и G. B. Stefano [11 — 14], является старение и связанное с этим процессом снижение мозгового кровотока. Авторы высказывают весьма смелое предположение о сосудистом характере этиологии болезни Альцгеймера. Действительно, наличие заболеваний, приводящих к снижению церебрального кровотока, увеличивает риск возникновения болезни Альцгеймера, а прогрессирование когнитивного дефекта сопровождается снижением регионарного мозгового кровотока в височно-теменных отделах и нарушением метаболизма глюкозы. Кроме того, отмечается дефицит транспортера глюкозы I, локализованного в эндотелиальных клетках [21]. Однако первостепенное значение J. C. de la Torre и G. B. Stefano [12 — 14] придают тому, что регионарный гипометаболизм, выявляемый у пациентов с болезнью Альцгеймера, является не первично-дегенеративным, а сосудистым по своему происхождению, поскольку, по мнению авторов, он предшествует возникновению первично-дегенеративных изменений. При этом важно еще раз подчеркнуть значение второго фактора — старения, поскольку наличие сосудистых нарушений у лиц среднего возраста не приводит к увеличению риска возникновения болезни Альцгеймера.
Это любопытное предположение о сосудистом генезе болезни Альцгеймера нуждается в одном крайне важном уточнении, а именно: о какой болезни Альцгеймера идет речь? Проблема нозологической самостоятельности болезни Альцгеймера являлась (и является) предметом дискуссий около 100 лет. Вероятно, в ряде случаев (возможно, у значительного процента больных, особенно у пациентов старших возрастных групп) генез мнестико-интеллектуальных расстройств обусловлен не столько первично-дегенеративными, сколько сосудистыми изменениями, особенно на уровне микроциркуляторного русла. Таким образом, эта деменция по своему происхождению является смешанной и крайне сложно вычленить ее первично-дегенеративный или сосудистый компонент. Данная проблема имеет очень четкую практическую направленность, поскольку констатация причины заболевания обусловливает выбор адекватного лечения.
Рассматривая этиопатогенетическое значение капилляропатии и хронической церебральной гипоперфузии при болезни Альцгеймера, следует учитывать и тот факт, что поражение капилляров может возникать вследствие характерных для этого заболевания первично-дегенеративных изменений. Так, под действием токсических агентов, в том числе β-амилоида или свободных радикалов, может страдать метаболизм эндотелиальных клеток и нарушаться синтез компонентов стенки капилляров [15; 16; 21]. β-амилоид обладает вазоактивными свойствами — он способен вызывать вазоспазм даже в низких концентрациях [28]. Учитывая вазоконстрикторное действие β-амилоида, можно предположить, что под его влиянием происходит сужение церебральных сосудов, в свою очередь приводящее к гипоперфузии, нарушению метаболизма нейронов и формированию избыточного количества свободных радикалов.
Высказанное J. C. de la Torre и G. B. Stefano [11–14] предположение отнюдь не бесспорно. В одной из своих статей J. C. de la Torre [11] рассматривает результаты исследований (в основном относящихся к 70–80-м годам прошлого века), в ходе которых при болезни Альцгеймера не было выявлено хронической церебральной гипоперфузии, и подчеркивает, что эта проблема требует дальнейшего изучения. Таким образом, ключевым является вопрос о времени возникновения капилляропатии и связанной с ней гипоперфузии — предшествует ли она собственно альцгеймеровским изменениям на молекулярном/клеточном уровне или развивается позже, под действием первично-дегенеративных процессов? Окончательного ответа на этот вопрос пока нет.
Можно предположить, что нарушения церебральной гемодинамики, особенно на микрососудистом уровне, способствуют реализации нейродегенеративного процесса (не только при болезни Альцгеймера, но и при ряде других нейродегенеративных заболеваний, включая болезнь Паркинсона). Подобные предположения, подтвержденные патоморфологическими данными, высказываются и в литературе [15; 16]. В пользу этих, полученных при патоморфологическом исследовании данных свидетельствуют и результаты функциональной нейровизуализации. K.Nagata и соавт. [27], используя возможности ПЭТ, выявили у пациентов с болезнью Альцгеймера признаки синдрома «нищенской перфузии» в теменно-височных отделах. По мнению авторов, в основе этих сосудистых расстройств лежат изменения на уровне капилляров. J. Blass и соавт. [8] считают, что возникновению болезни Альцгеймера способствуют цереброваскулярные расстройства в сочетании с врожденными нарушениями окислительных систем нейронов головного мозга. При этом следует учитывать и тот факт, что ацетилхолинергическая система, синапсы, цитоскелет, структуры, которые наиболее значительно страдают при болезни Альцгеймера, оказываются особенно чувствительны к нарушениям окислительных процессов и оксидантному стрессу [8]. Поэтому предположение о том, что цереброваскулярные нарушения, являясь своеобразным катализатором, могут провоцировать прогрессирование первично-дегенеративного патологического процесса [26], который до определенного момента протекал субклинически, представляется правомочным. Однако роль сосудистых нарушений в возникновении болезни Альцгеймера, как отмечалось выше, до сих пор не доказана, в связи с чем эта проблема требует дальнейшего изучения.
Разумеется, что в основе оксидантного стресса при болезни Альцгеймера могут лежать и иные механизмы. В частности, точечная мутация в 21-й хромосоме может повышать подверженность митохондриальной ДНК различным повреждениям. Этот процесс носит селективный характер — наиболее значительные нарушения митохондриальной дыхательной цепи отмечаются в области гиппокампа и височной коре.
Роль оксидантного стресса с образованием продуктов перекисного окисления липидов в патогенезе болезни Альцгеймера в настоящее время больших сомнений не вызывает [7; 19]. Головной мозг обладает повышенной чувствительностью к оксидантному стрессу, что связано с высокой метаболической активностью, значительным количеством ненасыщенных жирных кислот, легко подверженных действию свободных радикалов, относительно низким, по сравнению с другими органами, уровнем антиоксидантов (витаминов А, Е, β-каротина в сыворотке крови; глутатионтрансфераза в цереброспинальной жидкости) [5; 29]. Исследование, проведенное C. J. Foy и соавт. [17], показало, что у пациентов с деменцией сосудистого и первично-дегенеративного генеза имеет место снижение ряда антиоксидантов, особенно витаминов A, C и E, в сыворотке крови.
Увеличение образования свободных радикалов происходит и под воздействием внешних факторов. Рассматривая механизмы оксидантного стресса, K. N. Prasad и соавт. [29] высказывают предположение, согласно которому наследственно детерминированная патология мембран митохондрий представляет собой один из ключевых моментов этого процесса. Оксидантный стресс может нарушать метаболизм белка предшественника β-амилоида, а отложение β-амилоида в стенках церебральных артерий и капилляров является одним из характерных проявлений болезни Альцгеймера и вследствие нейротоксичности само по себе может приводить к увеличению образования свободных радикалов.
Следует заметить, что сосудистые нарушения могут иметь патогенетическое значение не только при болезни Альцгеймера, но и при деменциях иного происхождения — при деменции с тельцами Леви, болезни Паркинсона, мультисистемной атрофии, прогрессирующем надъядерном параличе и деменции при алкоголизме.
Таким образом, наличие сосудистых нарушений при болезни Альцгеймера в настоящее время не вызывает особых сомнений, особенно когда речь идет о больных пожилого и старческого возраста. В пользу этой гипотезы свидетельствует целый ряд фактов, выявленных в ходе эпидемиологических, экспериментальных и клинических исследований. Так, сосудистые факторы риска значимы не только при сосудистой деменции, но и при первично-дегенеративных деменциях. Как отмечалось выше, выраженность клинических нарушений при болезни Альцгеймера в немалой степени зависит от сопутствующей сосудистой патологии. При этом частота встречаемости «чистой» сосудистой деменции у пациентов пожилого и старческого возраста низка, чаще отмечается сочетание сосудистых и первично-дегенеративных изменений. Важно также, что целый ряд лекарственных препаратов показал одинаковую эффективность при болезни Альцгеймера и при сосудистой деменции. Все вышесказанное, разумеется, не является основанием для того, чтобы отнести болезнь Альцгеймера, особенно у пациентов пожилого и старческого возраста, к группе цереброваскулярных расстройств, однако может рассматриваться как свидетельство актуальности изучения этиологических, патогенетических, клинических и терапевтических аспектов смешанной деменции.
По вопросам литературы обращайтесь в редакцию
И. В. Дамулин, доктор медицинских наук
ММА им. И. М. Сеченова, Москва
источник
Несмотря на то, что научное общество до сих пор не может прийти к единому мнению относительно гипотезы возникновения болезни Альцгеймера, морфологические изменения, возникающие при данной патологии, изучены достаточно тщательно. Знание механизмов развития заболевания и отдельных его проявлений необходимо для своевременной диагностики сенильной деменции альцгеймеровского типа. Понимание патогенеза играет важную роль и в создании новых направлений терапии.
Что происходит с мозгом при болезни Альцгеймера на молекулярном уровне?
Все начинается с нарушения метаболизма. В нормальных условиях предшественник бета-амилоида расщепляется ферментом на одинаковые по размеру непатогенные пептиды. При дефекте ферментной системы или самого белка в результате указанной реакции получаются разные по длине фрагменты.
Нерастворимые длинные молекулы начинают откладываться в стенках сосудов и веществе головного мозга, затем объединяются между собой в бета-амилоидную структуру. Получившийся белок обладает токсичным воздействием на нейроны. Он способствует развитию оксидативного стресса, активирует медиаторы воспаления — вещества, поддерживающие воспалительную реакцию. Все эти процессы приводят к повреждению и смерти нервных клеток.
В свою очередь, из-за гибели нейронов базального ядра снижается концентрация ацетилтрансферазы, фермента, катализирующего образование ацетилхолина, одного из главных возбуждающих нейромедиаторов. Ацетилхолин отвечает за передачу нервного импульса: снижение его количества негативно отражается на когнитивных функциях и ведет к нарушению регуляции процессов памяти.
По мере накопления бета-амилоида происходит гиперактивация механизмов, направленных на защиту тканей. Они «отключают» синтез протеинов, необходимых для нормальной работы головного мозга и тем самым запускают процессы дегенерации, которые приводят к деменции.
Какие изменения характеризуют головной мозг при болезни Альцгеймера на клеточном уровне? Самыми главными являются появление сенильных бляшек и нейрофибриллярных сплетений, а также массовая гибель клеток вещества головного мозга.
Под этим термином подразумевают локальные внеклеточные скопления бета-амилоида различного размера в мозговом веществе. В первую очередь гибнут нейроны, окружающие именно «гнездные» отложения токсичного белка, поэтому на периферии бляшек всегда находятся поврежденные клетки.
Зрелой бляшке предшествует преамилоидное отложение. Стандартная «созревшая» бляшка состоит из четырех компонентов:
- центральное ядро — очаговое скопление бета-амилоида;
- клеточное окружение из микроглии, в этой же зоне изредка встречаются астроциты;
- аксоны и дендриты, находящиеся в стадии дегенерации;
- отростки нейронов, которые уже наполнены плотными тельцами.
Мозг больного Альцгеймером содержит сенильные бляшки в гиппокампе, миндалевидном теле, во всех отделах коры головного мозга, кроме чувствительных и двигательных зон.
Это внутриклеточные включения, основной составляющей которых считается гиперфосфорилированнный белок под названием тау-протеин. Они выглядят как узелки, либо клубочки, и представлены спиралевидными скрученными попарно филаментами.
Тау-протеин предназначен для стабилизации микротрубочек, органелл, отвечающих за создание цитоскелета и транспортировку веществ внутри клетки. Гиперфосфорилирование белка тау приводит к нарушению его связей с микротрубочками, что в итоге вызывает гибель нейрона.
Пораженные клетки уменьшаются в объеме, их цитоплазма вакуолизируется. В ней часто обнаруживают агрофильные гранулы.
| Свойства/Патоморфологический элемент | Сенильные бляшки | Нейрофибриллярные сплетения |
|---|---|---|
| внешний вид | скопления разных размеров овальной формы | узелки или клубочки из филаментов |
| локализация по отношению к клетке | внеклеточное пространство | внутри клетки, на внутренней стороне мембраны нейрона |
| локализация в головном мозге | гиппокамп, амигдала, кора | гиппокамп, амигдала, кора, базальное ядро Мейнерта |
Нейрофибриллярные сплетения локализуются там же, где сенильные бляшки, а также в базальном крупноклеточном ядре переднего мозга. К патоморфологическим элементам, схожим с ними по происхождению, относятся скопления актиновыхфиламентов или тельца Хирано, которые располагаются в нейронах гиппокампа и проксимальных дендритах.
Выраженность когнитивных нарушений при данной патологии не коррелирует с концентрацией двух предыдущих элементов (бляшек и нейрофибриллярных сплетений), зато напрямую зависит от того, насколько поврежден мозг при болезни Альцгеймера, и количества связей между нервными клетками. Чем меньше синапсов, тем тяжелее выражены нарушения.
Головной мозг при Альцгеймере страдает неоднородно. Массовую гибель нейронов отмечают на следующих участках:
- гиппокампе, отвечающем за консолидацию памяти;
- медиобазальных участках лобных долей;
- глубинных отделах височных долей;
- кореатрофичных долей головного мозга.
Нейробиологи из Университета штата Аризона во время испытаний обнаружили, что изменения в мозге при болезни Альцгеймера на клеточном уровне включают в себя также некроптоз. При изучении посмертных образцов в тканях мозга были обнаружены белки, являющиеся маркерами этого программируемого процесса. Поэтому некроптоз можно отнести к одному из механизмов развития нейродегенерации.
Гистологические исследования показывают, что вышеуказанные процессы приводят к постепенной атрофии ткани головного мозга, значительному уменьшению числа нейронов гиппокампа (особенно на уровне крючка), коры, подкорковых структур.
Отмечаются дегенеративные изменения дендритов, белого вещества, накопление бета-амилоида и нейрофибриллярных сплетений. Вместе с гибелью нейронов нарушаются синаптические связи. Сильнее всего эти изменения заметны в височной коре, базальных ядрах, гиппокампе, поясной извилине и в медиобазальных участках коры больших полушарий мозга.
Важно! У многих людей в пожилом возрасте в веществе мозга обнаруживаются сенильные бляшки и клубки из филаментов. Однако при Альцгеймере они распределяются неравномерно, преимущественно в определенных областях (например, в височных долях).
Скопления бета-амилоида выявляются не только во внеклеточном пространстве, но и в церебральных сосудах, а также в сосудистых сплетениях. Возможна дистрофия (иногда избыточная пролиферация) глии.
Мозг человека с болезнью Альцгеймера характеризуется следующими признаками:
- диффузной атрофией вещества, преимущественно височных, теменных и затылочных долей;
- сужением извилин;
- углублением борозд;
- асимметрией гиппокампов;
- расширением желудочков;
- расширением субарахноидальных пространств;
- уменьшением общей массы и объема;
Из-за атрофии коры и уменьшения общего объема мозга развивается компенсаторная гидроцефалия — ликвор постепенно заполняет образующиеся в белом веществе полости. Истончается дно III желудочка. Результатом этого является поражение области гипоталамуса и нарушение метаболизма вплоть до серьезных эндокринных сдвигов (яркий пример — прогрессирующая кахексия).
Немалый вклад в изучение патогенеза и проявлений данного заболевания внесли методы нейровизуализации: КТ, МРТ, ПЭТ, ОФЭКТ и т.д. Большое значение в диагностике Альцгеймера придается методу магнитно-резонансной томографии. Изменения на МРТ при болезни Альцгеймера позволяют учитывать возрастную инволюцию и упрощают дифференциальный диагноз с другими, схожими по клиническим проявлениям патологиями.
Магнитно-резонансную томографию проводят минимум два раза. Интервал между исследованиями должен составлять не меньше месяца — для оценки наличия и динамики дегенеративного процесса. При анализе учитывают возрастные изменения, церебральную атрофию и компенсаторную гидроцефалию.
Уже для ранних стадий заболевания характерно уменьшение объема медиальных участков височных долей. Наиболее точно дифференцировать возрастную норму от Альцгеймера удается благодаря измерению гиппокампа и энториальной коры: степень дегенерации гиппокампа у больных сенильной деменцией больше примерно в два раза. То же самое можно сказать о размерах височного рога.
Мозг больного Альцгеймером на МРТ на более поздних стадиях имеет следующие признаки:
- наличие включений (крупных очагов-бляшек и нейрофибриллярных сплетений);
- уменьшение массы и объема церебрального вещества;
- расширение желудочков;
- нарушение метаболизма в мозговом веществе.
У пациентов с БА на МРТ чаще выявляется поражение белого вещества в форме лейкоареоза. Особое значение имеют перивентрикулярные гиперинтенсивные очаги, в то время как глубокие поражения не имеют особой корреляции с сенильной деменцией.
В 60% случаев обнаруживаются изменения в подкорковых структурах в виде лакунарных кист, не прозвучавших клинически корковых инсультов, изолированных очагов.
Помимо обычного МРТ, в диагностику иногда включают перфузионную МРТ, диффузионно-взвешенную и спектроскопию.
Перфузионная МРТ — методика получения изображения после внутривенного введения специального вещества. Благодаря ей можно измерить гемодинамические параметры мозга. Ряд исследований выявил снижение объема гемоперфузии у пациентов с Альцгеймером почти на 20% по сравнению с нормой.
Спектроскопия — позволяет получить информацию о химическом составе тканей.
Важно! Большинство назначаемых методик исследования, даже МРТ, не всегда позволяет однозначно вынести вердикт о наличии болезни Альцгеймера на ступени ранней деменции. Поэтому при изучении изменений в церебральном веществе следует принимать во внимание все виды диагностики, не отдавая приоритет какому-либо из них.
Болезнь Альцгеймера на МРТ головного мозга с участием спектроскопии демонстрирует подъем уровня холина, что отражает разрушение миелиновых оболочек нервных волокон, подъем уровня мио-инозитола, что показывает аномалию цитоскелета. У пациентов с БА регулярно выявляются оба признака. Уровень других метаболитов, таких как креатин, N-ацетиласпартат, коррелируют с тяжестью деменции при Альцгеймере.
Если МРТ покажет болезнь Альцгеймера точно, то с компьютерной томографией все сложнее. Чувствительность компьютерного томографа по сравнению с ЯМР намного ниже, на КТ видны лишь значительные поражения вещества мозга.
| Изменения/метод исследования | КТ | МРТ |
|---|---|---|
| атрофия вещества мозга | при выраженных изменениях | на ранних стадиях |
| расширение желудочков | да | да |
| гидроцефалия | да | да |
| бляшки в сосудах | с контрастированием | да |
| очаги лейкоареоза | да | да |
| изменения размеров гиппокампа | при выраженных изменениях | да |
| изучение оболочек мозга | нет | да |
| изучение мягкого вещества | средняя точность | высокая точность |
| исследование структуры нервных волокон | нет | да |
На срезах КТ хорошо заметна атрофия коркового вещества, расширение субарахноидальных пространств и желудочков мозга, а также компенсаторная гидроцефалия, характерные для Альцгеймера. Видны будут и небольшие зоны лейкоареоза, а КТ с внутривенным введением контраста помогает обнаружить и амилоидные отложения в церебральных сосудах и сосудистых сплетениях.
Хотя все эти признаки и повторяют МР-симптоматику для сенильной деменции альцгеймеровского типа, но они становятся заметны только на поздних стадиях и нужны лишь для подтверждения уже поставленного диагноза. Если болезнь Альцгеймера МРТ покажет в стадии ранней деменции, то разрешающая способность компьютерного томографа попросту не позволит этого сделать.
источник
Существуют нейродегенеративные заболевания, для которых характерна постепенно развивающаяся дегенерация различных структур мозга, вызванная массовой гибелью нейрональных и глиальных клеток, что сопровождается существенным нарушением всех сторон деятельности ЦНС. Многие из этих заболеваний встречаются редко, протекают длительно, медленно прогрессируя. Вовлечение в патологический процесс все новых структур, когда симптомы заболевания становятся все более выраженными и разнообразными, приводит в конечном итоге к смерти.
Одно из нейродегенеративных заболеваний — болезнь Альцгеймера (сенильная деменция) — распространено, по некоторым данным, среди около 10% населения в возрасте 65 лет, и эта цифра удваивается среди 80-летних. Однако есть случаи более раннего проявления болезни. У четверти молодых (моложе 40 лет) дементных больных слабоумие развивается по альцгеймеровскому типу.
К характерным симптомам заболевания относят ухудшение памяти, особенно на недавние события, а по мере его прогрессирования и тотальное ее снижение; проблемы с речью; дезориентацию во времени и пространстве; расстройства эмоциональной сферы в виде депрессии, которая может сменяться агрессией; нарушение когнитивных, двигательных функций. Постепенно больной становится прикованным к постели инвалидом, неспособным обслуживать себя. В таком состоянии он продолжает существовать еще несколько лет.
При исследовании мозга умерших пациентов выявляется атрофия в виде расширения борозд, сужения извилин, особенно в ассоциативных зонах коры головного мозга, атрофия гиппокампальных структур, а также заметное расширение боковых желудочков. Однако общепринятыми маркерами заболевания служат: а) многочисленные внеклеточные амилоидные отложения сферической формы (сенильные бляшки) и б) интранейрональные нейрофибриллярные сплетения. Основной компонент сенильных бляшек — полипептид Р-амилоид (P-А). Сенильные бляшки, образующиеся около дегенерирующих аксонов и дендритов, свидетельствуют о гибели нейронов. Они выявляются преимущественно в коре, особенно в гиппокампе и фронтальных областях неокортекса. Кроме того, амилоидные отложения наблюдаются в стенках кровеносных сосудов мозга. Сенильные бляшки характерны также и для мозга больных синдромом Дауна, иногда обнаруживаются в норме в стареющем мозге. (В экспериментах длительное введение р-амилоида в желудочки мозга крыс приводило к нарушению обучения и памяти.)
Нейрофибриллярные сплетения образуются в результате цитоплазматического поражения преимущественно пирамидных клеток гиппокампа и фронтальной области коры. Они состоят из т-белка (тау-), который в норме способствует полимеризации микротрубочек, поддерживающих структуру клетки, однако по некоторым причинам он депонируется в виде сплетенных спиральных волокон, которые нарушают функции нейрона.
Р-Амилоид образуется при протеолитическом расщеплении (протеолизе) более крупного трансмембранного белка-предшественника (АРР). Функциональная роль АРР до конца не установлена, однако известно, что его взаимодействие с Gg-белком приводит к активации гуанилатциклазы и повышению уровня цГМФ, что замедляет поступление ионов кальция через Са2+-каналы. Снижением притока Са2+ в клетку объясняется способность АРР препятствовать проявлению эксайтотоксичности возбуждающих аминокислот.
В норме в результате протеолиза трансмембранного белка АРР образуются три растворимых фрагмента. При некоторых обстоятельствах (болезнь Альцгеймера) протеолиз АРР идет альтернативным путем, в результате образуются два растворимых и один нерастворимый 42-43-аминокислотный фрагмент, который агрегирует в амилоидные волокна.
В регуляции протеолиза АРР принимают участие М,-холиноре-цепторы. Их активация запускает фосфоинозитидный каскад, в результате возрастает активность протеинкиназы С, что приводит к фосфорилированию АРР. Реакция фосфорилирования АРР служит триггером протеолитического расщепления этого белка. Снижение активности М-холинорецепторов приводит к торможению фосфорилирования АРР, нарушению процесса его протеолитического расщепления и увеличению выхода фрагментов р-амилоида.
К факторам, приводящим к неспецифическому протеолизу АРР, относятся также генные мутации в четырех генах, расположенных в хромосомах 1,14,19,21. Так, при синдроме Дауна (трисомия 21-й пары хромосом) в 1,5 раза повышена скорость образования АРР, в больших количествах накапливаются продукты его протеолиза. Слабоумие у этих больных развивается к 30-40 годам и ранее.
Ускоренное образование р-А отмечено при травмах головного мозга, инсультах, судорогах. Более 15% ушибов головы ведет к болезни Альцгеймера с деменцией, и это заболевание часто встречается среди боксеров (dementia pugilistic). Эти наблюдения позволяют рассматривать травмы головного мозга и инсульты как возможные причины развития впоследствии болезни Альцгеймера.
Причина гибели нейронов при болезни Альцгеймера точно не известна, однако использование экспериментальных моделей заболевания дает возможность приблизиться к ее пониманию, выявить ряд механизмов, через которые могут реализоваться токсические эффекты р-амилоида и гибель нейрональных клеток.
1. Повышение токсичности возбуждающих аминокислот (эксай-тотоксичности глутамата и аспартата). В развитии эксайтотоксич-ности глутамата важную роль играет повышение активации глута-матергической системы. Высвобождение большого количества этих нейромедиаторов в синаптическую щель приводит к гиперактивации NMDA-глутаматных рецепторов, в результате возрастает поток ионов Са2+ в клетку. Увеличение внутриклеточной концентрации Са2+ способствует повышению осмотического давления в клетке, что ведет к набуханию и гибели нейронов. Кроме того, повышение уровня Са2+ сопровождается активацией киназ и фосфолипаз, участвующих в процессах дегенерации и лизиса клеток. Наряду с «острой» описан механизм медленной «метаболической» эксайтотоксичности глутамата. Эта форма дегенерации развивается на фоне нормальных концентраций глутамата, но при сниженном энергетическом статусе клетки. В этом случае патологический процесс начинается с нарушения функций митохондрий и уменьшения синтеза АТФ, что вызывает снижение активности АТФ-зависимых ферментов, ответственных за поддержание мембранного потенциала клетки. В результате медленно деполяризуются мембраны, снимается магниевый блок с NMDA-глута-матных рецепторов и резко увеличивается поток ионов Са2+ в клетки, что запускает каскад дегенеративных процессов.
2. Накопление р-А в нейронах вызывает резкое нарушение гомеостаза Са2+. Так, на искусственных фосфолипидных мембранах показана способность агрегированной формы р-А формировать собственные («экзогенные») Са2+-каналы и непосредственно вызывать Са2+-индуцированную гибель клеток. В одной из наследуемых форм болезни Альцгеймера имеются мутации в гене белка пресенилина определяющие изменение в регуляции кальциевого гомеостаза эн-доплазматическим ретикулумом в ответ на различные воздействия. Патологические изменения в клетке, вызванные увеличением концентрации ионов Са2+, дополняются активацией фермента калпаи-на, основным субстратом которого являются нейрофибриллярные белки клетки. При этом происходит разрушение цитоскелета нейрона и формирование нейрофибриллярных сплетений. Приведенные данные подтверждают перспективность использования препаратов, стабилизирующих гомеостаз кальция в нейронах. Так, нимодипин и нифедипин, блокаторы L-типа Са2+-каналов, обладают когнитивно-стимулирующими и нейропротекторными свойствами.
3. Чрезмерное образование нерастворимого р-амилоида, который агрегирует в амилоидные волокна, может стимулировать фосфори-лирование белка х, что ведет к образованию нейрофибриллярных сплетений. Недавно обнаружен специфический фермент (протеин-киназа), вызывающий гиперфосфорилирование белка х, как и при болезни Альцгеймера. Причем фермент активируется при недостатке АТФ в клетках. Поэтому к развитию этой болезни приводит ухудшение энергетического обмена клеток в результате нарушения микроциркуляции и недостаточности мозгового кровообращения (возрастного характера или имеющего место при травмах, инсультах).
4. Усиление свободнорадикалъных процессов. Для болезни Альцгеймера характерно накопление в белках значительно большего количества карбонильных групп, чем при обычном старении, а это результат свободнорадикального повреждения белков. В инициации свободнорадикальных реакций имеет значение прямое повреждающее действие агрегатов рамилоида на плазматические мембраны, что приводит к усилению перекисного окисления липидов и лавинообразному накоплению в клетках свободных радикалов. Определенное влияние на стимуляцию свободнорадикальных процессов клетки имеет повышение внутриклеточной концентрации Са2+, что вызывает активацию фермента NO-синтазы и образование свободных радикалов (N0 ). Поэтому для профилактики и лечения болезни Альцгеймера весьма перспективно использование препаратов, обладающих антиоксидантными свойствами, или веществ, способных повышать эффективность собственных антиоксидантных защитных систем клетки. Антиоксидантными свойствами обладают а-токоферол (витамин Е), нейроактивные стероиды (в частности, производные эстрогенов), гормон эпифиза мелатонин, способный нормализовать когнитивные процессы.
5. Гибель нейрональных клеток может быть вызвана и усилением апоптоза (программированная гибель клеток). Агрегированный р-А сам обладает способностью инициировать эти процессы. Большинство исследователей считают, что одним из первых этапов апоптоза может быть вызванное значительным повышением концентрации ионов Са2+ в цитозоле необратимое открытие «митохондриальных пор», через которые из митохондрий выходят ионы Са2+ и ряд высокомолекулярных соединений, в том числе эндогенных регуляторов апоптоза. В результате активируются нелизосомные эндогенные эндонуклеазы, которые фрагментируют ядерную ДНК, что характерно для апоптоза.
Трудно отдать предпочтение какому-то одному из перечисленных механизмов патогенеза болезни Альцгеймера. Многие исследователи полагают, что эта болезнь, а также ряд других нейродегенеративных заболеваний могут иметь описанные механизмы. Относительная роль каждого из них определяется индивидуальными особенностями организма и стадией патологического процесса.
Глубокие дегенеративные повреждения мозговых структур при болезни Альцгеймера сопровождаются нарушением функционирования нейротрансмиттерных систем.
При сенильной деменции значительно выражено поражение холинергической системы. Иммунохимическими методами установлено снижение плотности Mt- и М2-холинорецепторов, с помощью специфических лиганд — преимущественное уменьшение пресинапти-ческих М-холинорецепторов. Методом позитронно-эмиссионной томографии выявлено, что в коре мозга больных существенно замедлен выброс ацетилхолина из везикул в синаптическую щель, а также процесс обратного захвата холина. Показано 50%-ное снижение уровня холинацетилтрансферазы — фермента, ответственного за синтез ацетилхолина, в гиппокампе и фронтальной области коры головного мозга. При исследовании (post mortem) отмечена достоверная корреляция между снижением уровня холинацетилтрансферазы в этих структурах мозга и увеличением числа сенильных бляшек и нейро-фибриллярных сплетений, а также выраженностью интеллектуальных нарушений за шесть месяцев до смерти.
В связи с тем что ацетилхолин синтезируется в терминали, снижение уровня холинацетилтрансферазы во фронтальной коре может означать разрушение терминалей аксонов холинергических нейронов. Так как в коре присутствует незначительное количество холинергических нейронов, это могут быть окончания аксонов холинергических нейронов базальных отделов переднего мозга. При болезни Альцгеймера ядро Мейнерта поражается наиболее сильно: на поздних ее стадиях оказываются разрушенными почти 90% нейронов. Однако снижение уровня холинацетилтрансферазы в коре более значительно, чем разрушение холинергических нейронов этой структуры. В связи с чем полагают, что дегенеративный процесс начинается в области терминалей аксонов и продолжается ретроградно до тел нейронов.
Так как ацетилхолин играет важную роль в процессах памяти, а его концентрация в соответствующих структурах мозга при болезни Альцгеймера значительно снижается, использование в клинике обратимых антихолинэстеразных препаратов (такрин, велнакрин, фи-зостигмин), способствующих замедлению расщепления ацетилхолина, облегчает состояние больных на ранних этапах заболевания.
Определенную роль в проявлении симптомов болезни Альцгеймера играют нарушения глутаматергической передачи. Общее снижение уровня глутамата при этом не выявлено, за исключением гиппокампа, где в норме плотность глутаматных нервных окончаний очень высока. Однако в некоторых неокортикальных областях, а также в гиппокампе обнаружено снижение количества глутаматных NMDA-рецепторов, коррелирующее с тяжестью заболевания, а именно эти рецепторы играют важную роль в процессах обучения и памяти. Кроме того, некоторые симптомы болезни похожи на те, что проявляют пациенты с нарушением взаимодействия различных кортикальных областей при поражении корковых ассоциативных волокон, большая часть которых, как полагают, являются глутаматергическими. К таким симптомам относятся трудности узнавания известных объектов (например, на ощупь), т.е. агнозии; непонимание написанных или произнесенных слов (афазии); а также трудности организации и выполнения произвольных движений (апраксии). Все эти проявления — результат не столько потери памяти, сколько нарушения взаимодействия различных кортикальных областей.
Выраженные нарушения глутаматергической трансмиссии при болезни Альцгеймера позволяют использовать для улучшения когнитивных процессов лекарственные вещества, регулирующие функции глутамата. Например, мемантин, сочетающий свойства неконкурентного антагониста NMDA-подтипа и агониста АМРА-подтипа глутаматных рецепторов; димебон, агонист NMDA-рецепторов и ингибитор аце-тилхолинэстеразы, обладающий выраженными когнитивно-стимули-рующими свойствами. Однако применение таких препаратов сопряжено с некоторыми трудностями, так как повышенная активация глутаматных рецепторов не только улучшает функции соответствующих нейронов, но и может способствовать развитию эксайтотоксич-ности. В опытах аппликация агонистов NMDA-рецепторов к коре мозга крысы вызывала ретроградную дегенерацию холинергических нейронов базальных структур переднего мозга, в то время как антаголисты NMDA-рецепторов предотвращали поражение мозговой ткани кроликов, вызванное цереброваскулярными нарушениями.
Если бы даже восстановление нарушенных функций холинерги-ческой и глутаматергической систем было бы достаточно эффективно для терапии болезни Альцгеймера, важнее все-таки остановить дегенеративные процессы в мозге. И перспективы в этом направлении уже намечаются. В частности, длительная обработка клеток холинергичес-кими агонистами усиливает протеолиз молекул АРР по естественному пути и, следовательно, снижает продукцию р-амилоида.
Определенные успехи сделаны при поиске веществ, замедляющих агрегацию секретированного р-амилоида в фибриллярную ци-тотоксическую форму. Так, молекулы красителя конго-рот предотвращают агрегацию синтезированного р-А-пептида в высокомолекулярные комплексы.
Еще один путь терапевтической стратегии основан на использовании противовоспалительных препаратов, которые могут влиять на процесс созревания амилоидных бляшек. Выявлено протективное действие нестероидных противовоспалительных средств (аспирин) против болезни Альцгеймера, что связано, как полагают, с их анти-оксидантным эффектом.
Проголосовало: 5
источник

