Экология потребления. Здоровье: Хотя болезнь Альцгеймера активно исследуют на протяжении многих лет, механизмы ее возникновения остаются неясными.
Хотя болезнь Альцгеймера активно исследуют на протяжении многих лет, механизмы ее возникновения остаются неясными.
Обычно появление основных симптомов болезни связывали с отложениями в головном мозге белка бета-амилоида – так называемыми амилоидными бляшками.
Авторы нового исследования полагают, что ключевую роль играют другие образования, которые обнаруживаются в мозге больных – нейрофибриллярные клубки, состоящие из тау-белка. Хотя пока среди ученых нет единства по поводу сравнительного вклада бета-амилоида и тау-белка в развитие болезни, полученные результаты, возможно, помогут разработке новых препаратов для ее лечения.
Скопления амилоидных бляшек при болезни Альцгеймера были открыты уже довольно давно. Они обнаруживались как при посмертном исследовании мозговой ткани, так и у живых больных – при помощи позитронно-эмиссионной томографии. Для этого в организм вводят радиоактивный изотоп, который образует соединение с интересующим веществом (в данном случае – с бета-амилоидом). Когда скопления целевого вещества оказываются “помечены”, их распределение в организме отслеживают по гамма-квантам, возникающим при позитронном распаде.
Но тут же возникала загадка: медикам было известно немало случаев, когда у пациентов, мозг которых был полон амилоидных бляшек, не было никаких признаков болезни Альцгеймера. Число таких людей в некоторых исследованиях достигало 30 %. Данный факт заставил ученых подозревать, что другая аномальная белковая структура – нейрофибриллярные клубки из тау-белка может быть фактором, важным для развития болезни.
Обычно тау-белок в организме участвует в образовании микротрубочек – важного элемента цитоплазматической структуры клеток. Но у пациентов с болезнью Альцгеймера, а также после черепно-мозговых травм обнаруживаются скопления тау-белка, к молекулам которого присоединено большое количество фосфатных групп. Из-за них белок переходит в нерастворимую форму, и его клубок остается прикрепленным к нейронам головного мозга.
Влияние нейрофибриллярных клубков на здоровье до конца не изучено. До недавнего времени единственным методом исследования, доступным в данном случае, было измерение уровня тау-белка в ткани головного мозга после смерти больного или же у живого пациента в спинномозговой жидкости. Позитронно-эмиссионная томография не могла помочь, так как не располагала радиоизотопами, которые подходили бы для того, чтобы пометить тау-белок в организме.
Теперь эта проблема решена и соответствующие препараты найдены.
Поэтому невролог Бо Ансес (Beau M. Ances) и его коллеги из Университета Вашингтона в Сент-Луисе смогли впервые провести исследование распределения нейрофибриллярных клубков в головном мозге у живых пациентов. Одновременно они использовали и радиопрепарат для отображения бета-амилоида. Таким образом, ученые получили картину одновременного распределения в мозге двух связанных с болезнью Альцгеймера белков.
В исследовании участвовали десять пациентов с легкой степенью болезни Альцгеймера и 36 здоровых. Как показали ученые, чем больше у человека отложений тау-белка в височной доле мозга, тем сильнее у него проявляются нарушения памяти и внимания, характерные для болезни Альцгеймера.
Аналогичного соотношения для бета-амилоида не обнаружилось. Исследователи пришли к выводу, что позитронно-эмиссионную томографию, направленную на обнаружение амилоида, можно использовать для выявления самых ранних стадий болезни Альцгеймера. Тогда как тот же метод, но с использованием веществ, нацеленных на тау-белок, будет эффективен при выявлении перехода от ранних, несимптоматических стадий к легкой степени болезни Альцгеймера.
Бо Ансес подозревает, что решающим в развитии болезни становится совместное влияние на нервную ткань скоплений амилоида и тау-белка. Пока в мозге накапливаются только амилоидные бляшки, он еще в состоянии частично компенсировать их воздействие, но появление нейрофибриллярных клубков становится ключевым фактором, и симптомы болезни начинают нарастать.
Одновременно ученые проверили содержание тау-белка в спинномозговой жидкости участников исследования и обнаружили корреляцию его уровня с количеством тау-белка в височной доли головного мозга. Следовательно, анализ спинномозговой жидкости может служить методом диагностики.
Пока удалось отметить связь уровня тау-белка с симптомами болезни Альцгеймера в один момент времени. Как отмечает, комментируя результаты данного исследования, невропатолог Педро Роза-Нето из Университета Макгилла в Монреале, в будущем еще предстоит определить, существует ли связь изменения содержания тау-белка в мозге с нарастанием симптомов с течением времени. Бо Ансес говорит, что подобные исследования уже ведутся, и выражает надежду, что со временем исследователи смогут определять стратегию лечения болезни Альцгеймера, основываясь на том, какова биохимическая ситуация в мозге пациента в конкретный момент. опубликовано econet.ru
Понравилась статья? Тогда поддержи нас, жми:
источник
Если предположение исследователей верно, то амилоидный белок Aβ приобретает очень драматичный ореол: будучи предназначен для защиты нервных клеток от инфекции, при определённых условиях он сам становится хуже любой заразы.
Болезнь Альцгеймера — основную форму старческого слабоумия — связывают с небольшим белком Aβ (β-амилоидом), нерастворимые отложения которого в нервной ткани оказывают разрушительный эффект на высшую нервную деятельность. β-Амилоид образуется вследствие ферментативного расщепления гликопротеина APP, в норме всегда присутствующего в мембранах нейронов и других клеток. Нормальная физиологическая роль ни этого белка, ни его метаболита Aβ до недавнего времени была неизвестна. Исследователи из Массачусетского госпиталя нашли возможную функцию белка Aβ в норме. Обнаружено, что синтетические аналоги Aβ и препараты височной доли мозговой ткани альцгеймеровских больных обладают мощной антимикробной активностью, а животные с нарушенным синтезом Aβ страдают сниженным иммунитетом. Всё это позволяет предположить, что белок Aβ — часть системы врождённого иммунитета в нервной системе человека.
Рисунок 1. Августа Д., пациентка Алоиса Альцгеймера (в честь которого БА получила своё название), 1901 г.
Болезнь Альцгеймера (БА) считается бичом развитых стран, поскольку с увеличением продолжительности жизни вероятность развития этого вида старческой деменции возрастает многократно. Хотя механизм развития заболевания в общих чертах установлен, эффективного лечения, способного противостоять деградации нервной ткани и вследствие этого деградации самой личности больного, пока не существует. Амилоидная гипотеза, объясняющая причины возникновения БА, говорит, что первым этапом развития заболевания является повышенная продукция амилоидного белка Aβ (или β-амилоида), в определённых условиях (прежде всего, в высокой концентрации) претерпевающего конформационную перестройку: в его структуре начинают преобладать β-тяжи (кстати, отсюда и пошло название). «Перерождённый» Aβ, подобно прионам, образует нитевидные амилоидные агрегаты — нерастворимые жёсткие фибриллы больших размеров, обладающие токсическим действием и в прямом смысле разрушающие мозг. Кроме того, амилоидная форма Aβ конвертирует «нормальный» растворимый белок в токсичную конформацию.
Кстати, амилоидная форма Aβ становится токсичной ещё до полимеризации в фибриллы: токсический эффект появляется на стадии сферических агрегатов, построенных уже из «вредных» белковых молекул с повышенным содержанием β-структур [1]. Между прочим, недавно обнаружена прямая связь концентрации белкá Aβ в спинномозговой жидкости с циркадным ритмом и недосыпанием, которое может быть одним из факторов развития болезни Альцгеймера [2].
β-Амилоид образуется в результате протеолитического расщепления предшественника — мембранного гликопротеида APP (также обозначают ПБА — предшественник β-амилоида). В процессе участвуют два фермента — β- и γ-секретазы, — которые «выщепляют» β-амилоид (белок длиной 40 или 42 аминокислотных остатка) из состава предшественника и секретируют его во внеклеточную область. До недавнего времени нормальная физиологическая роль β-амилоида была неизвестна, и его можно было воспринимать как горький молекулярный курьёз, часто приводящий собственный организм к такому тяжёлому последствию, как болезнь Альцгеймера.
Американские исследователи из Массачусетского госпиталя, похоже, наконец-то установили нормальную функцию Aβ: скорее всего, он имеет отношение к врождённому иммунитету [3]. «Многие годы считалось, что β-амилоид — не более чем молекулярный мусор, весьма не безвредный, впрочем. Наши результаты говорят, что этот белок — нормальный компонент системы врождённого иммунитета мозга, — говорит Рудольф Танзи (Rudolph Tanzi), один из авторов работы. — В частности, факторы, „включающие“ врождённый иммунитет — не только инфекция, но и травма или инсульт, — способствуют развитию болезни Альцгеймера и отложению Aβ в мозгу» [4].
Рисунок 2. Интеллектуальная активность, в том числе увлечение игрой в шахматы, и регулярное общение коррелируют со сниженным риском развития болезни Альцгеймера, по данным эпидемиологических исследований, однако причинно-следственная связь пока не доказана
Этому открытию предшествовало наблюдение, что Aβ во многом напоминает антимикробные пептиды (АМП) [5], являющиеся основой врождённого иммунитета большинства многоклеточных организмов, — в частности, пептид LL-37 человека, относящийся к группе кателицидинов. Кроме них, у человека есть ещё две группы АМП, участвующих в формировании врождённого антибактериального иммунитета, — дефензины и гистатины. От антител (лежащих в основе приобретённого, или специфического, иммунитета) их отличает то, что они могут действовать в нервной ткани и в мозгу, куда антитела «не добираются», и защищают человека от, например, менингита и нейрокандидоза. Ещё одна мишень действия этих пептидов — это вирусы и даже раковые клетки.
Схожесть некоторых физико-химических и биологических свойств β-амилоида и пептида LL-37 подтолкнула учёных изучить антимикробную активность Aβ, которой никто ранее не занимался. Результаты превзошли ожидания: синтетические аналоги Aβ40 и Aβ42 ингибировали развитие восьми из 15 исследованных микроорганизмов с активностью, равной или даже превышающей активность LL-37. Среди микроорганизмов, ингибируемых амилоидом, — грибок Candida albicans, кишечная палочка E. coli, три разновидности стафилококка, внутриклеточная паразитическая бактерия листерия и другие.
Чтобы удостовериться в том, что токсичность для бактерий не является следствием реактивов белковой химии, которые могли остаться после очистки белкóв, в следующем эксперименте изучили способность препарата ткани височной доли мозга (а именно там сильнее всего депонируется амилоид) ингибировать рост грибка Candida; в качестве контроля использовали препараты ткани не болевших пациентов того же возраста, а также образцы из других участков мозга, в которых не наблюдается существенных отложений Aβ. (Поскольку исследование проводилось в крупной больнице, недостатка в материале для исследования — мозговой ткани умерших пациентов — не было.) Эксперимент полностью подтвердил гипотезу, и, более того, антитела к β-амилоиду возвращали грибок «к жизни», подтверждая, что это именно белок Aβ ингибировал рост микроорганизмов.
Кроме того, оказалось, что трансгенные мыши с инактивированным геном одной из секретаз, генерирующих белок Aβ, сильнее подвержены влиянию различных патогенов; то же самое можно сказать и про людей, в ходе клинических испытаний получавших препарат, снижающий уровень Aβ42. Кстати, уменьшение концентрации хорошо изученного АМП LL-37 тоже увеличивает заболеваемость, но и чрезмерно высокая его доза не хороша, потому что приводит к отложению бляшек, подобных атеросклеротическим. Склонность к образованию фибрилл, подобных амилоидным, есть и у других АМП: хорошо известный антимикробный белок лактоферрин образует нерастворимые агрегаты при желатинозной дистрофии роговицы.
Изучение действия β-амилоада на бактерии показало, что он связывается с мембранами микроорганизмов, несмотря на то, что, по сравнению с подавляющим большинством АМП, имеет отрицательный, а не положительный заряд, — то есть, одного знака с мембранами бактерий. Возможно, эта на первый взгляд невыгодная организация необходима для преодоления специальных защитных систем бактерий, нейтрализующих катионные (положительно заряженные) пептиды. Ещё одним тяжело объяснимым качеством Aβ является его токсичность по отношению к собственным клеткам, что и приводит в ряде случаев к серьёзным расстройствам. Одно из возможных объяснений этому — что β-амилоид является также «оружием» против раковых клеток своего организма, но, даже если это и так, никаких подробностей процесса пока не известно, так же как и не известно толком, что вызывает повышение его продукции при БА.
Рисунок 3. Чарлтон Хестон и Рональд Рейган на встрече в Белом Доме, 1981 год. Оба к концу жизни заболели болезнью Альцгеймера.
«Необходимо выяснить, что же запускает врождённый иммунитет, к которому принадлежит альцгеймеровский пептид, в пожилом возрасте, и какие гены управляют этими процессами, — говорит Роберт Муар (Robert Moir), другой руководитель исследования. — Если удастся это установить, мы сможем разработать варианты предотвращения этой ненужной активации или даже научиться управлять ей» [4].
источник
Новое исследование показало, что знаменитый белок долголетия klotho улучшает состояние грызунов, страдающих болезнями Альцгеймера и Паркинсона.
Полученные данные открывают новые возможности в лечении этих и других нейродегенеративных заболеваний.
Руководила исследованием доктор Дена Дубаль (Dena Dubal), преподаватель неврологии в Университете Калифорнии в Сан-Франциско. Детали публикуются в Cell Reports.
Работа американских ученых была построена на предыдущих выводах их коллег о возможной связи между протеином klotho и умственной деятельностью. Опыты на мышах демонстрируют, что генетически модифицированные животные с повышенным уровнем данного протеина оказываются значительно умнее и способнее своих «нормальных» сородичей.
«Новые сведения добавили нам понимание того, как можно использовать белок долголетия в лечении когнитивных нарушений у субъектов с низким уровнем klotho, нормальным уровнем или нейродегенеративными заболеваниями. По мере старения населения планеты проблема когнитивной дисфункции становится одной из первоочередных, и пока не существует эффективных методов ее решения», — говорит доктор Дубаль.
Прежде чем говорить о лечебном потенциале чудо-белка, разберемся с ним подробнее.
Klotho – это протеин, который синтезируется в человеческом организме почками и головным мозгом. В дальнейшем он циркулирует в крови и действует на разные органы и ткани, как гормон.
Как пояснили авторы, белок klotho участвует в регуляции роста фибробластов и выработке коллагена, контролирует активность инсулина. Предполагается его роль в других биологических процессах, но пока молекула представляет большую загадку для медицины. Повышенная экспрессия протеина ассоциируется с долголетием не только человека, но и животных. И наоборот, недостаточная выработка этой молекулы сокращает продолжительность жизни – отсюда и громкое название, которое дали ей западные СМИ.
С возрастом продукция klotho неумолимо сокращается, что ассоциируется с окислительным стрессом, накоплением свободных радикалов и риском развития дегенеративных заболеваний.
Наблюдения за добровольцами говорят, что природная, врожденная гиперэкспрессия klotho позволяет поддерживать головной мозг в хорошей форме, независимо от возраста. У таких людей синаптические связи между нейронами сильнее, а ионотропные NDMA-рецепторы в нервной системе функционируют значительно эффективнее.
Означает ли это, что белок долголетия можно использовать в лечении нейродегенеративных заболеваний? Доктор Дубаль абсолютно уверена в этой возможности.
Ученые вводили молодым и старым мышам (18 месяцев для грызунов равны 65 годам для человека) фрагмент белка под названием αKL-F, который очень похож на выделяемый гормон.
Также были выведены генетически модифицированные мыши с избытком альфа-синуклеина – протеина, отвечающего за развитие болезни Альцгеймера и Паркинсона. Эти животные получали инъекции αKL-F и наблюдались отдельно от здоровых сородичей.
Проведенные тесты, включая водный лабиринт Морриса и Y-лабиринт, позволили авторам оценить умственные способности и память каждой группы животных. Согласно результатам эксперимента, молодые мыши через 4 дня после инъекции αKL-F проявляют невероятную сообразительность и память. Эффект продолжается более 2 недель.
У старых животных когнитивные улучшения наблюдаются уже через 2 дня после инъекции.
Наконец, после нескольких инъекций протеина мыши с нейродегенеративными заболеваниями чувствуют себя гораздо лучше: улучшается мышление, уменьшается моторный дефицит.
«После терапии фрагментом klotho нормализуется работа NMDA-рецепторов, усиливаются синаптические связи между нервными клетками в гиппокампе – зоне мозга, которая отвечает за обучение и запоминание информации», — поясняет доктор Дубаль.
Klotho помогает противостоять действию патологических протеинов и обращает вспять нейродегенеративные процессы – таков основной вывод исследователей.
источник
Основной злодей в болезни Альцгеймера — ß-амилоид, фрагмент белка, который может неправильно сворачиваться и образовывать бляшки вокруг нейронов мозга.
Теперь, новое исследование на мышах и червях выдвигает спорную гипотезу о том, что бляшки не очень-то и вредны. Тенденция ß-амилоида душить нейроны может быть связана с древней эволюционной миссией – защитить мозг от патогенов.
Некоторые говорят, что работа может открыть новые возможности для лечения и профилактики смертельного дегенеративного заболевания, но многие, кто занимается болезнью Альцгеймера, по-прежнему скептически относятся к исследованиям, в которых использовались животные, генетически модифицированные с целью произвести человеческий ß-амилоид. Хотя новые данные «потрясают, они остаются весьма надуманными в том смысле, что они не имеют прямое отношения к тому, что мы видим у человека», — говорит Колин Мастерс, нейробиолог из Университета Мельбурна в Австралии.
«β-амилоидные отложения могут повредить многие органы помимо мозга, в том числе сердце, печень и почки», — говорит нейробиолог Рудольф Танзи из больницы Массачусетса в Бостоне, руководитель нового исследования. Возникает недоуменный вопрос: если белок так вреден, почему животное, которое жило 400-миллионов лет назад – рыба латимерия таксона – вырабатывала его. «Среди млекопитающих ген, который кодирует белок, от которого ß-амилоид происходит «почти одинаков» у разных видов, — говорит Хара Клаудио Сото, нейробиолог из Университета Техаса в Хьюстоне. – У собаки, например, вырабатываются β-амилоидные бляшки подобные Альцгеймерским и симптомы слабоумия вместе с тем, как они стареют.
Шесть лет назад, Танци и нейробиолог Роберт Мойр, также из больницы Массачусетс в Бостоне, решили проверить догадку, что ß-амилоид ведет себя аналогично к классу белков с известными полезными свойствами, называемые антимикробными пептидами или AMPs. Некоторые AMPs также формируют волокна вокруг клеток, но они используют их, чтобы убивать микробы по всему телу. Чтобы понять, является ли ß-амилоид настолько же смертельным, команда протестировала его в лаборатории на набор разных микробов, в том числе дрожжей Candida albicans и бактерий, таких как кишечная палочка и несколько различных штаммов Стрептококка. Оклеветанный белок был так же токсичен для многих патогенов, как АMPs. «На самом деле, в отношении некоторых микробов он был в 100 раз более смертоносным, чем пенициллин», — говорит Мойр.
Мойр и Танци предположили, что ß-амилоид имеет древнюю роль в организме, защищая от инородных захватчиков. Мало кто воспринимал их всерьез, поскольку не было доказано, что эти молекулы убивают микробы в организме животных. Мойр говорит, что они столкнулись с серьезным сопротивлением тех, кто поддерживает общепринятый подход к производству препаратов от болезни Альцгеймера. «На протяжении десятилетий фармацевтические компании относились к ß-амилоиду как «уроду», в котором нет ничего полезного, и сосредотачивали все свои силы на поиск лекарства, которое устранило бы эти молекулы», — говорит он. У этих компаний, по мнению Мойра, «все, что ß-амилоид делает – это плохо. И все, что вам надо сделать – это избавиться от него, и все будет «чики-чики».
«Новое исследование является «подтверждением концепции» на животных, что ß-амилоид действительно защищают от патогенов», — говорит Танзи. Во-первых, исследователи использовали мышей, которые были генетически модифицированы, чтобы производить избыточное количество человеческой версии ß-амилоида — модель распространения болезни Альцгеймера. Затем они вводили в мозг грызунов бактерии Сальмонеллы, чтобы вызвать инфекцию и наблюдали, справлялись ли мыши с лишними амилоидами с инфекцией лучше, чем обычные мыши. Все мыши умерли в течение 96 часов, но те, у которых были человеческие амилоиды потеряли меньше веса, у них было меньше бактерий в мозгу, и они жили примерно на 30 часов дольше, чем контрольные мыши. Такие результаты были опубликованы сегодня в Science Translational Medicine.
Потом ученые проверили свою гипотезу на червях Caenorhabditis elegans и обнаружили, что черви со штаммом, генетически спроектированным, чтобы производить избыток амилоида в их кишечнике, жили до 3 дней дольше после воздействия Сальмонеллы и дрожжей, чем обычные черви.
«Обобщенные данные исследований на животных позволяют предположить, что различные микроорганизмы могут вызывать амилоидные бляшки», — говорит Танзи. «Самое поразительные, — говорит он, — результаты от мышей, модифицированных для выработки ß-амилоида человека. В нормальной жизни грызуны не вырабатывают амилоидные бляшки до старости, но молодые особи образовывали бляшки сразу после инъекции сальмонеллы, что доказывает, что инфекция и бляшки связаны между собой», — говорит Танзи.
«Тот факт, что амилоид может вести себя как антимикробный пептид «удивителен», после этого открытия можно по-новому взглянуть на болезнь Альцгеймера», — говорит Сото Хара. «Но все-таки, — говорит он, — работа высоко спекулятивна на данный момент».
Танци признает это. «Мы не говорим, что любой из этих микробных патогенов вызывает болезнь Альцгеймера у людей, — отмечает он. — Для расследования этого ученые должны изучить ткани мозга многих людей, которые умерли от болезни Альцгеймера, глядя на разные возбудители и были ли окружены микробы амилоидными бляшками». «Несмотря на десятки предыдущих исследований, которые искали инфекции, которые могут вызвать болезнь Альцгеймера, они не были достаточно систематическими, чтобы выявить виновника», — говорит Танзи. «Новый проект, в который инвестировано полмиллиона долларов Фондом Альцгеймера скоро возьмет эту задачу на себя», — добавляет он.
«Если ученые докажут, что определенные микробы вызывают амилоидные отложения в мозге человека, — Танзи предполагает, — может быть возможным разработать антитела, которые будут атаковать их и предотвращать такую реакцию. Кроме того, если ß-амилоида играет важную защитную роль в мозге, возможно, имеет смысл относиться к нему больше, как холестерину, который необходим для всех клеток, но опасен в большой концентрации, чем как к тому, что должно быть полностью ликвидировано, — говорит Танзи — замедлить его распространение — да, но не уничтожить его».
источник
Амилоидные бляшки в мозге пациента с болезнью Альцгеймера (бляшки на изображении напоминают соцветия лука)
Ученые нашли способ диагностировать раннюю стадию болезни Альцгеймера по анализу крови. Исследователи продемонстрировали в статье в Nature, что соотношение фрагментов разных типов бета-амилоида в плазме крови коррелирует со степенью нейродегенерации и выраженности когнитивных нарушений пациентов.
Патогенез болезни Альцгеймера определяется постепенным накоплением в мозге агрегатов бета-амилоидного белка (Aβ), которое со временем приводит к деградации нервной ткани. Накопление бета-амилоида можно зарегистрировать задолго до того, как у человека начнет проявляться основной симптом болезни — когнитивные нарушения и деменция.
Так как современные способы терапии могут только затормозить наступление деменции, но не обратить ее, людям, входящим в группу риска (например, с генетической предрасположенностью к развитию заболевания) имело бы смысл, начиная с определенного возраста, проходить профилактические обследования. Однако простых и дешевых тестов для выявления патологических процессов в мозге в настоящее время нет. Самые надежные способы диагностики накопления амилоидных бляшек на сегодняшний день это позитронно-эмиссионная томография мозга (ПЭТ) и анализ спинно-мозговой жидкости на наличие фрагментов бета-амилоида.
Японские исследователи совместно с коллегами из Австралии разработали тест, который позволяет детектировать фрагменты бета-амилоида в плазме крови, и проверили его на двух выборках пациентов с заболеванием на разной стадии. Предыдущие попытки выявить в плазме бета-амилоид при помощи стандартного метода ELISA были безуспешны, однако авторы работы использовали иммунопреципитацию (осаждение антителами) с последующей MALDI-TOF масс-спектрометрией для количественного определения соотношения разных фрагментов амилоидного белка. Оказалось, что эти соотношения служат хорошими биомаркерами накопления бета-амилоида в мозге.
Условия диагностики ученые оптимизировали на выборке из 121 пациента отделения исследования деменции Национального центра гериатрии и геронтологии в Японии и выборке участников национального австралийского исследования биомаркеров старения (AIBL), куда вошло 252 человека. Возраст участников составлял от 60 до 90 лет, они делились на три группы — люди без когнитивных нарушений, с умеренными нарушениями, и с выраженными когнитивными нарушениями.
Накопление амилоидных бляшек в мозге у пациентов сначала детектировали при помощи ПЭТ. Кроме того, для австралийской выборки были доступны данные по анализу спинно-мозговой жидкости. Соотношение фрагментов двух различных форм амилоидного белка в плазме крови достоверно коррелировало как с данными биохимического анализа, так и с данными ПЭТ. Таким образом, анализ крови надежно отражал состояние центральной нервной системы пациентов.
Тем не менее, авторы замечают, что перед масштабным введением метода в клиническую практику требуется проделать еще много технической работы. В частности, метод нужно проверить на участниках клинических испытаний препаратов против болезни Альцгеймера, для того, чтобы понять, изменяется ли концентрация биомаркеров в плазме в ходе терапии.
Ранее ученые предлагали использовать для ранней диагностики болезни Альцгеймера лазерную офтальмоскопию, чтобы выявлять скопления бета-амилоида в сетчатке глаза. А в эксперименте на модельных мышах исследователи показали, что первые признаки заболевания сопровождаются изменением химического состава мочи.
источник
В основе болезни Альцгеймера могут лежать изменения лишь в одной аминокислоте небольшого белка Aβ42. К такому выводу пришли ученые из МГУ имени М.В. Ломоносова, Института молекулярной биологии имени В. А. Энгельгардта и Института биофизики клетки, о своих результатах они сообщили на страницах журнала Scientific Reports.
Болезнь Альцгеймера – комплексное нейродегенеративное заболевание, причины которого в большинстве случаев остаются непонятными. Многочисленные исследования показывают, что при болезни Альцгеймера в клетках мозга происходит целый ряд серьезных системных нарушений. В ходе развития заболевания в нейронах появляются токсичные формы небольшого белка бета-амилоида, образующие скопления – амилоидные бляшки. Также в клетках больного формируются нейрофибриллярные клубки, содержащие тау-белок с повышенным уровнем фосфорилирования (присоединения остатков фосфорной кислоты). В результате нарушается нервная проводимость, а нейроны погибают. Этим объясняются симптомы заболевания, главный из которых – расстройство кратковременной памяти.
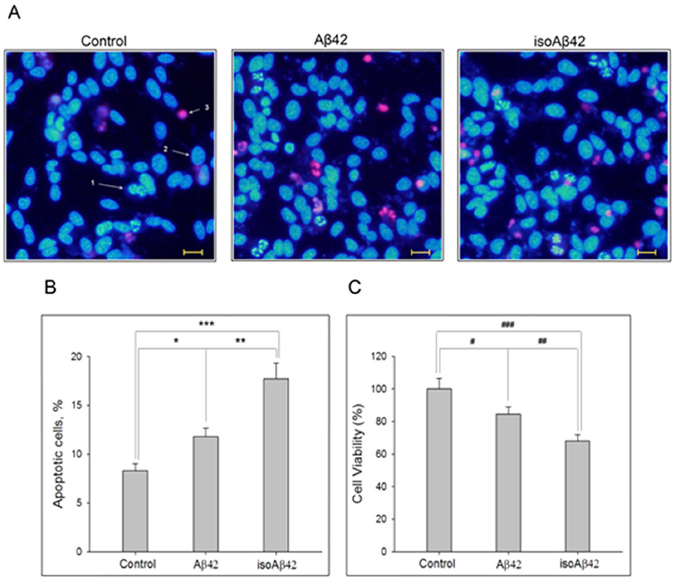
Биологи изучили белок из семейства бета-амилоидов – Aβ42 (буквы – сокращение от «амилоид бета», а 42 – количество аминокислотных остатков – «звеньев» в его цепи). Этот небольшой белок присутствует в нервной ткани здоровых людей, где он участвует в нервной проводимости и регулирует обмен холестерина. Aβ42 может подвергаться ряду химических модификаций, которые могут изменять его свойства. Внимание российских ученых привлекла форма isoAβ42 с изомеризированным остатком аспарагиновой кислоты в положении 7 (изомерами называют химические вещества с тем же количеством атомов разных элементов, но имеющих иную пространственную конфигурацию). Ранее эта же группа ученых показала, что isoAβ42 может выступать в качестве «затравки» для Aβ42, что приводит к образованию амилоидных бляшек.
Ученые из Института молекулярной биологии им. Энгельгардта РАН решили проверить, каким образом эта модификация бета-амилоида влияет на метаболические процессы в клетках. Для этого использовался химически синтезированный isoAβ42. Интактный (то есть нетронутый) белок Aβ42 (без изомеризованного остатка аспарагиновой кислоты) и isoAβ42 добавили к культуре клеток нейробластомы человека SH-SY5Y. Эту клеточную линию ученые получили из опухоли четырехлетней девочки, но уже несколько десятков лет выращивается в лаборатории для изучения нейродегенеративных заболеваний. Третья группа клеток была контрольной, и белков к ней не добавляли.
Через сутки после введения белков часть клеток стала гибнуть путем апоптоза (аналог клеточного «самоубийства»). При этом под действием isoAβ42 клеток погибало в два раза больше, чем под действием Aβ42. Изучив изменения в клеточной культуре, биологи установили, что isoAβ42 также снижает уровень тау-белка в клетках. Кроме того, оказалось, что isoAβ42 резко повышает фосфорилирование тау-белка, тубулинов и матрина-3. Именно чрезмерное фосфорилирование этих белков – характерный признак нервной ткани, пораженной болезнью Альцгеймера. Тау-белок помогает поддерживать стабильность микротрубочек. Микротрубочки играют роль «скелета» клетки, определяя ее механическую устойчивость и форму, а также участвуют в транспорте частиц внутри клетки. Тау-белок с повышенным уровнем фосфорилирования больше не может связываться с микротрубочками, что вызывает нарушения в функционировании клетки.
Таким образом, российские ученые впервые показали, что токсический эффект isoAβ на клеточных культурах нейробластомы человека связан с его способностью вызывать фосфорилирование тау-белка и некоторых других белков в гораздо большей степени, чем обычный Aβ42. Повреждение нейронов белком isoAβ42 похоже на то, которое наблюдается в нейронах пациентов с болезнью Альцгеймера, что свидетельствует о критической роли isoAβ42 в развитии этой патологии.
источник
Рубрика: Медицина и фармацевтика
Научный журнал «Студенческий форум» выпуск №8(29)
Биохимия болезни Альцгеймера
Болезнь Альцгеймера (болезнь альцгеймеровского типа) является наиболее распространенной формой первичных дегенеративных деменций позднего возраста.
Структура заболеваемости
Возраст, лет
Процент заболевших
К проявлениям данного заболевания относится:
• Больные не могут вспомнить нужное слово и заменяют его другим, не вполне подходящим по смыслу
• Больной не ориентируется на местности, не узнает знакомых, не может определить время по часам
• Больной путается во времени
• Больные теряют способность к самообслуживанию и нуждаются в уходе
Объяснение возможных причин развития Болезни Альцгеймера отражено в трёх гипотезах:
1. Холинергическая гипотеза
Первой мы рассмотрим холинергическую теорию.
Наблюдается корреляция между выраженностью деменции и центральным холинергическим дефицитом — холинергической деафферентацией коры.
Степень холинергического дефицита в корковых отделах связана с уменьшением количества нейронов в базальных отделах головного мозга, где располагаются нейроны, которые продуцируют ацетилхолин.
Помимо ацетилхолинергической системы, некоторые изменения наблюдаются со стороны других нейротрансмиттерных систем, например, сейчас интенсивно изучаются глутаматергические расстройства.
Поддержка этой гипотезы ослабла, так как лекарственные средства, направленные на корректировку дефицита ацетилхолина, имеют слабую эффективность.
Далее остановимся на амилоидной теории.
Более 20 лет основной гипотезой в области исследования болезни Альцгеймера оставалась амилоидная гипотеза.
Аβ образуется из белка АРР (англ. Amyloid precursor protein) путем воздействия двух ферментов β- и γ-секретаз.
Считается, что к избыточному накоплению амилоида приводят ошибки фолдинга. Фолдинг – это процесс самопроизвольного скручивания полипептидной цепи в уникальную нативную пространственную структуру.
Новое исследование, которые было проведено в Калифорнийском университете в Сан-Диего, показывает, что бета-амилоид разрушает один из белков-антиоксидантов и предлагает способ защиты этого белка от повреждающего воздействия амилоида.
Установлено, что бета-амилоид и антиоксидантный фермент каталаза взаимодействуют. Их взаимодействие повреждает каталазу так, что она не становится неспособна выполнять свою физиологическую функцию – разложение перекиси водорода на кислород и воду.
При покрытии амилоида низкомолекулярным соединением, которое предотвращает его взаимодействие с другими белками, активность каталазы восстановилась, и уровень перекиси водорода вернулся к нормальным показателям.
Покрытие, использованное для исследования взаимодействия между амилоидом и каталазой, является кандидатом на роль лекарственного препарата. Это один из классов молекул, разработанных в лаборатории профессора Янга.
Тау-белок – это белок ассоциированный с микротрубочками, функиця которого состоит в стабилизации структур микротрубочек клетки. Синтез его происходит преимущественно в нейронах. При некоторых патологических процессах этот белок может вступать в процессы агрегации. При образовании таких агрегатов нарушается функция нейронов.
Рисунок 1. Структура тау-белка в здоровой и пораженном нейроне
В 17 хромосоме человека содержится ген тау-белка, который содержит 16 экзонов. Из этого следует, что альтернативный сплайсинг способствует образованию изоформ этого белка.
После синтеза молекула белка входит в посттрансляционный процессинг. Фосфорилирование (осуществляемое ферментом киназы гликогенсинтазы 3) в данном процессе благоприятствует взаимодействию тау-белка с тубулином и стабилизации микротрубочек.
Взаимодействия тау-белка и Аβ:
Результаты нового исследования, которые были опубликованы в журнале Neurobiology of Aging, предполагают вероятность того, что патологические формы двух белков, тау-белка и бета-амилоида, которые являются признаками патологии мозга при болезни Альцгеймера – бляшки и нейрофибриллярные клубки – могут действовать совместно, при этом повреждая митохондрии и, следовательно, снижая выживаемость нейронов.
Клетка с поврежденными митохондриями не может продуцировать необходимое количество энергии для поддержания своей жизнедеятельности, не способна поддержать нужный уровень кальция и, как следствие, вырабатывает повышенное количество повреждающих ее молекул-окислителей.
Самые сильные изменения в митохондриях наблюдались, когда бета-амилоид и процессированный тау находились в клетке вместе. В присутствии усеченного тау и бета-амилоида они слипались в частях нейронов и не могли попасть в синапсы, как это должно происходить без патологии.
На основании этих данных можно сделать следующие выводы:
1. Несмотря на огромную работу, проделанную учеными в данном направлении, механизм биохимических процессов болезни Альцгеймера по-прежнему неясен, однако наиболее вероятная теория связана со взаимодействием патологических форм тау-белка и Аβ.
2. Не установлена взаимосвязь между нейродегенеративными изменениями Аβ и гиперфосфорилированными тау-белком, если она имеется.
источник
Световые импульсы определённой частоты уменьшают уровень патогенных белков, запускающих нейродегенеративные процессы.
Болезнь Альцгеймера, как и другие нейродегенеративные заболевания, возникает оттого, что в нейронах мозга скапливаются нерастворимые белковые комплексы, токсичные для клеток. Со временем в нервной ткани формируются характерные крупные отложения, так называемые амилоидные бляшки, состоящие из бета-амилоида – одного из патогенных альцгеймерических белков.
Если бы удалось как-то избавиться от этих нерастворимых комплексов, или хотя бы просто затормозить их появление, болезнь удалось бы усмирить. Не так давно мы писали об экспериментах сотрудников биотехнологической компании Biogen Inc., которые нашли способ уничтожать опасные белковые отложения с помощью специальных антител, которые растворяют амилоидные скопления и помогают иммунным клеткам в буквальном смысле их съесть. Вообще говоря, исследователи по всему миру давно стараются привлечь к борьбе с нейродегенеративными болезнями иммунотерапевтические методы, и, по-видимому, здесь действительно можно надеяться на некоторый успех.
Но можно пойти и другим путём – как это сделали Ли-Хуэй Цзай (Li-Huei Tsai), Эмери Браун (Emery N. Brown) и их коллеги из Массачусетского технологического института. Известно, что один из характерных признаков болезни Альцгеймера – нарушения в гамма-ритмах мозга, необходимых для памяти, внимания, восприятия; если мозг не может генерировать гамма-волны, значит, у него плохо с высшими когнитивными функциями. У мышей, которые генетически предрасположены к синдрому Альцгеймера, проблемы с гамма-ритмами возникают ещё до того, как в мозге появляются амилоидные бляшки – когда мышь пытается выучить дорогу в лабиринте, по электрической активности мозга можно заметить, что он у неё работает не совсем так, как надо.
Исследователи решили выяснить, что произойдёт, если у мышей, предрасположенных к синдрому Альцгеймера, искусственно сгенерировать правильные гамма-волны. Для этого использовали оптогенетические методы, которые позволяют включать и выключать группы генетически модифицированных нейронов с помощью световых импульсов, подаваемых в мозг по оптоволокну.
Оказалось, что если клетки гиппокампа (одного из основных центров памяти в мозге) в течение часа стимулировать на частоте 40 Гц, то уровень опасного бета-амилоида в нейронах гиппокампа уменьшается на 40–50%. Причём частота должна быть именно в 40 Гц: хотя гамма-ритмы варьируют от 25 до 80 Гц, стимуляция на других частотах в гамма-диапазоне такого эффекта на давала. Стоит также добавить, что нейробиологи действовали на определённые клетки, называемые интернейронами – считается, что они помогают синхронизировать гамма-активность в других нервных клетках.
Иными словами, если заставить нервные клетки генерировать правильные гамма-ритмы, то опасного альцгеймерического белка станет меньше, и вероятность заболевания, возможно, тоже уменьшится. Но оптогенетика – всё-таки не клинический инструмент, и, если говорить о медицинских перспективах, то тут нужен метод, который позволял бы обойтись без генетических модификаций и без введения в мозг оптоволокна или чего-то подобного.
И тут выяснилось, что с тем же эффектом можно использовать световые импульсы. В статье в Nature авторы работы пишут, что мерцающие с частотой 40 Гц светодиоды так же помогали мозгу генерировать гамма-ритмы, в результате чего количество бета-амилоида в зрительной коре мышей с ранней стадией заболевания падало вдвое – правда, в течение суток уровень опасного белка поднимался обратно.
Похожий эксперимент провели с животными, у которых болезнь Альцгеймера продвинулась дальше, и в мозге уже начали появляться характерные бляшки. Таких мышей обрабатывали световыми импульсами по часу в день в течение недели – в результате у них не только уменьшалось количество свободно плавающего, пока ещё растворимого бета-амилоида, но и уже готовые бляшки тоже делались меньше и росли медленнее. Как известно, при болезни Альцгеймера в мозге, кроме бета-амилоидных отложений, появляются ещё и комплексы тау-белка, приобретающего патогенную форму. Так вот, с помощью световых импульсов удалось подействовать и на тау-белок – его тоже становилось меньше.
В норме мозг сам очищает себя от опасных молекул, для этого у него есть особые клетки, называемые микроглией – их задача защищать нервную ткань от возможных инфекций и своевременно убирать разнообразный мусор: остатки погибших клеток, вышедшие из строя биомолекулы и т. д.
Но при синдроме Альцгеймера микроглия работает плохо, её клетки синтезируют воспалительные сигналы и выделяют из себя разные токсичные вещества, которые не только не препятствуют болезни, но даже помогают ей. «Светотерапия» же нормализует работу микроглии, которая начинает активно поедать бета-амилоид. То есть стимуляция гамма-ритмов действует двояко: с одной стороны, нейроны производят меньше опасного белка, с другой, его активно истребляют мусороуборочные клетки.
Мы знаем, что активность различных генов в нейронах зависит от активности самих нервных клеток, и можно предположить, что принудительная работа в «гамма-режиме» включает некие молекулярные механизмы, которые помогают противостоять нейродегенеративным процессам; однако как именно это происходит, станет ясно после дополнительных исследований.
Хотелось бы надеяться, что такой до странного простой способ борьбы с синдромом Альцгеймера действительно окажется эффективным с клинической точки зрения. Однако для начала нужно сделать так, чтобы эффект от подобной терапии длился дольше – выше мы говорили, что уровень патогенного белка поднимался обратно спустя сутки после световой обработки. (Возможно, что проблему можно решить, просто увеличив длительность «лечебного курса» – чтобы нейроны и микроглия привыкли держать бета-амилоид в узде.)
С другой стороны, необходимо удостовериться, что световые импульсы тормозят развитие болезни не только в зрительной коре, но и в других участках мозга. Впрочем, авторы работы утверждают, что так оно и есть: пока что неопубликованные результаты самых последних опытов говорят о том, что очищение от альцгеймерического белка происходит и в других зонах мозга, а не только в тех, которые непосредственно воспринимают зрительную информацию.
Ну и, наконец, нужно убедиться, что у нас при этом исчезают не только молекулярные признаки болезни, но внешние, когнитивно-поведенческие – что память, внимание и прочие высшие когнитивные функции, пусть не улучшаются, но уж точно не становятся хуже.
источник
Болезнь Альцгеймера представляет собой нейродегенеративное заболевание, которое проявляется слабоумием. Чаще всего болезнь Альцгеймера встречается у людей старше 65 лет, хотя не исключено её развитие и в молодом возрасте. На сегодняшний день нельзя определенно точно назвать причину развития патологии. Основной особенностью болезни Альцгеймера являются отложения белка бета-амилоида в виде бляшек и нейрофибриллярных клубков из тау-протеина в тканях головного мозга. Они нарушают связи между нейронами и приводят к гибели клеток.
В Юсуповской больнице работают высококвалифицированные неврологи, доктора наук, которые имеют большой опыт успешной терапии болезни Альцгеймера. Неврологи используют новейшие методы лечения, которые позволяют максимально облегчить состояние больного и улучшить качество его жизни насколько это возможно.
Несмотря на то, что в настоящее время болезнь Альцгеймера активно исследуются, современная медицина не имеет полного представления о механизме развития заболевания. Выделяют несколько теорий возникновения болезни Альцгеймера, к которым относится и тау-гипотеза.
Ранее было выявлено, что развитие болезни Альцгеймера сопровождается образованием амилоидных бляшек в головном мозге. Данная аномалия фиксировалась во время диагностики больных. Однако у некоторых пациентов с большим количеством амилоидных бляшек в головном мозге не было никаких клинических проявлений болезни Альцгеймера. Это дало повод заподозрить, что существует еще одна структура, которая влияет на развитие болезни.
Исследования показали, что у пациентов с болезнью Альцгеймера также присутствуют нейрофибриллярные клубки – аномальное соединение тау-протеина. В норме тау-протеин участвует в формировании микротрубочек – важного элемента клеток. У пациентов с болезнью Альцгеймера происходит чрезмерное накопление тау-протеина, к которому присоединяются фосфатные группы. Из-за них протеин не растворяется и остается в нейронах виде клубков.
Наличие амилоидных бляшек и нейрофибриллярных клубков обнаруживается у пожилых людей, что считается нормальным признаком старения. У пациентов с болезнью Альцгеймера данных структур будет намного больше. Чаще всего в начале развития заболевания бляшки и клубки тау-протеина формируются в областях мозга, которые отвечают за память и обучение. В дальнейшем они распространяются на другие участки мозга. Нейрофибриллярные клубки тау-протеина блокируют связи между клетками головного мозга и нарушают их активность, важную для функционирования клеток.
Наличие тау-протеина в клетках головного мозга является диагностическим фактором для определения болезни Альцгеймера. Коварство заболевания заключается в том, что его очень трудно диагностировать на ранних стадиях. В начале заболевания у пациента могут не проявляться в значительной мере когнитивные нарушения, хотя процесс нейродегенерации уже идет. Если при обследовании у пациента выявляют амилоидные бляшки и нейрофибриллярные клубки тау-протеина, появляется основание устанавливать диагноз «болезнь Альцгеймера».
Для определения биомаркеров тау-протеина проводят исследование спинномозговой жидкости. При наличии болезни Альцгеймера показатели общего тау-протеина в спинномозговой жидкости будут значительно превышать норму. Показатель является критерием для постановки диагноза, даже если симптоматически болезнь еще не дает о себе знать. Увеличение количества общего тау-протеина будет говорить о прогрессировании заболевания.
Другим методом определения тау-протеина является позитронно-эмиссионная томография. Во время диагностики в организм пациента вводят специальный препарат, который вступает во взаимодействие с белком. Препарат выступает в роли своеобразного маячка, с помощью которого можно отслеживать изменения в клетках головного мозга. Позитронно-эмиссионная томография позволяет одновременно оценить и наличие амилоидных бляшек. Таким образом, оба ключевых компонента для постановки диагноза складываются в одну картину.
Для правильной и своевременной постановки диагноза следует обращаться только к квалифицированному неврологу, который знаком с современными методами диагностики. В Юсуповской больнице представлена качественная специализированная аппаратурой от мировых производителей, с помощью которой неврологи больницы могут провести диагностику любой сложности. В клинике выполняют разнообразные исследования: от стандартных лабораторных анализов до позитронно-эмиссионной томографии и фармакогенетических исследований.
Открытие тау-протеина играет важную роль в лечении болезни Альцгеймера. Сегодня не существует способа полностью избавить человека от патологии. Все методы терапии направлены на снижение симптомов и улучшение качества жизни пациента. Данные о нейрофибриллярных клубках тау-протеина позволяют ученым создавать новые медикаменты для лечения пациентов.
Для терапии болезни Альцгеймера применяют препараты, улучшающие работу клеток головного мозга и замедляющие когнитивные нарушения. В качестве успокоительных используют седативные средства и антидепрессанты. К лекарственной терапии дополнительно назначают немедикаментозные процедуры: лечебная физкультура, массажи, физиотерапия, психотерапия и другие методики.
Лечение пациента может проходить в комфортном стационаре Юсуповской больницы или на дому. Все будет зависеть от состояния пациента и его пожеланий (или его близких в случае, когда пациент не может принимать рациональные решения). В стационаре круглосуточно предоставляется профессиональное медицинское обслуживание, постоянный контроль лечащего невролога за состоянием пациента. Для лечения больного на дому его родственники (или те люди, которые будут осуществлять уход) получают детальную инструкцию проведения терапии. В случае необходимости можно получить консультацию доктора удаленно, по телефону. Важно полностью соблюдать рекомендации врача и регулярно посещать невролога для оценки результатов терапии. Родственники пациента могут получить психологическую поддержку специалистов и научиться основам правильного ухода за пациентами с болезнью Альцгеймера.
Обратиться за помощью, записаться на прием и получить консультацию специалистов можно по телефону Юсуповской больницы.
источник
Бельгийские исследователи определили функциональное предназначение белка, найденного в мозге пациентов с болезнью Альцгеймера
Мозг пациентов с болезнью Альцгеймера насыщен так называемыми амилоидными бляшками. Это накопления свободного белка, основной компонент которого — β-пептид амилоида, образующийся из белка-предшественника амилоида. Исследователи десятилетиями пытались понять нормальную физиологическую роль этого белка.
Команда ученых из Исследовательского центра Католического Университета Лювена во главе с профессорами Йорисом де Витом и Бартом Де Струпером обнаружила, что белок-предшественник амилоида влияет на передачу сигнала в мозге, активируя специфический рецептор GABA-BR1a.
Возможность влияния на этот процесс может помочь в лечении болезни Альцгеймера и других заболеваний головного мозга. Результаты работ опубликованы в известном журнале Science.
В 80-х годах прошлого века сразу несколько исследовательских групп обнаружили, что пептид в амилоидных бляшках образуется из более крупного белка, который они назвали белком-предшественником амилоида. Различные ферменты могут расщеплять длинный белок-предшественник на многочисленные мелкие фрагменты.
Затем исследователи сосредоточились на процессе расщепления, который приводит к образованию β-пептида амилоида и последующей агрегации его в бляшках, в надежде найти новые способы борьбы с болезнью Альцгеймера.
При этом очень важный вопрос так и остался без ответа. А именно: Какова реальная роль самого белка-предшественника амилоида? Что он делает в нашем мозге в своем первоначальном виде (когда он не разрезан на фрагменты амилоида-β)?
Чтобы ответить на этот вопрос, доктор Хизер Райс, исследователь в лаборатории Йориса де Вита и Барта де Струпера в Центре исследования мозга Католического Университета Лювена, сосредоточилась на поиске рецептора, с которым связывается белок-предшественник амилоида.
«Мы знали, что белок-предшественник амилоида играет свою роль через фрагмент белка, который выделяется вне клетки, поэтому, чтобы понять его функцию, нам пришлось искать белки на поверхности нейронов», — объясняет Райс.
В итоге исследователи натолкнулись на рецептор GABA-BR1a в синапсах головного мозга (структуры, через которые две разные клетки мозга контактируют друг с другом для передачи сигналов).
«Мы обнаружили, что высвобождаемая часть белка-предшественника амилоида связывается с этим рецептором, в результате чего связь между клетками мозга в синапсе подавляется», — говорит Райс.
«Хотя все редкие наследственные формы болезни Альцгеймера сопровождаются образованием β-пептида амилоида, мы на самом деле не знаем, способствуют ли другие фрагменты белка-предшественника развитию болезни Альцгеймера», — говорит Барт Де Струпер.
Он считает, что результаты исследования открывают совершенно новую перспективу: «Новая роль белка-предшественника амилоида может объяснить аномалии, которые мы видим в сетях клеток мозга на мышиной модели болезни Альцгеймера, а также в начальном периоде заболевания у людей. Возможно, препараты, которые будут влиять на этот рецептор, могут ограничить эти проблемы у людей с болезнью Альцгеймера ».
Йорис де Вит добавляет: «Возможности влияния на GABA-BR1a выходят далеко за рамки болезни Альцгеймера. Результаты нашего исследования интересны тем, что передача сигнала через этот рецептор играет роль в широком спектре неврологических и психических расстройств, включая эпилепсию, депрессию, наркоманию и шизофрению».
Теперь, когда ученые знают, как белок-предшественник амилоида может влиять на связь между нейронами, они планируют разработать новые типы препаратов, которые смогут восстанавливать передачу сигнала через рецептор GABA-BR1a при различных заболеваниях ЦНС.
Конечно, прорыв в биохимических исследованиях — это не то же самое, что прорыв в медицине. Достижения исследователей могут стать лишь основой для новых методов лечения, разработка которых может занять годы. Однако, это уже реальная надежда многих людей на то, что лекарство от болезни Альцгеймера наконец-то появится.
источник
Правда ли, что их нельзя предотвратить или замедлить
Текст: Наталия Закураева
Сейчас в мире более пятидесяти миллионов людей с деменцией, и риск повышается по мере роста продолжительности жизни: после 65 лет он каждую пятилетку удваивается. Диагноз деменции означает нарушение функций головного мозга с постепенной утратой знаний и навыков — и он есть у каждого шестого человека старше 80 лет, у каждого третьего старше 85, у каждого второго после 90 лет. Предполагается, что через десять лет будет более 80 миллионов людей с деменцией, а ещё через тридцать — 152 миллиона. В США эта болезнь каждый год уносит больше жизней, чем рак груди и рак предстательной железы, вместе взятые. При этом за самим диагнозом тянется шлейф домыслов и мифов — разбираемся в самых распространённых.
В действительности деменция — это синдром (то есть комбинация симптомов), у которого может быть множество причин, и одна из них — болезнь Альцгеймера. Именно этой болезнью объясняется до 70 % всех случаев деменции. Реже к ухудшению когнитивной функции могут приводить нарушения мозгового кровообращения, болезнь Паркинсона, снижение функции щитовидной железы, хронические инфекции головного мозга и даже приём некоторых лекарств. Это ещё не всё: иногда под деменцию маскируется глубокая депрессия, а в других случаях депрессия — один из симптомов деменции. Такая путаница, конечно, затрудняет диагностику.
О болезни Альцгеймера сейчас известно, что она возникает из-за аномального накопления определённых белков в клетках мозга и межклеточном пространстве. Один из этих белков — амилоид, который откладывается в виде бляшек вокруг нервных клеток. Второй — так называемая аномальная белковая структура тау, или тау-белок, которая видна в виде клубков в самих нервных клетках. В норме тау-белок должен стабилизировать микротрубочки (компоненты каркаса, поддерживающего клетки целыми), но при болезни Альцгеймера этот белок меняет свою структуру. Пока неизвестно, почему это происходит — но учёные уже знают, что эти изменения начинаются за много лет до появления первых симптомов. Такое накопление белков в клетках мозга и вокруг них меняет биохимические свойства этих клеток и не даёт им нормально работать — нарушается передача сигналов между ними. Первыми обычно поражаются участки головного мозга, ответственные за память.
Хотя возраст и правда является серьёзным фактором риска, деменция встречается и у молодых людей. При этом человек постепенно теряет накопленные за жизнь навыки, скорость мышления, смекалку, речь, возможность управлять настроением и телом — а причинами могут стать злоупотребление алкоголем, пристрастие к наркотикам, опухоли мозга, черепно-мозговые травмы или инфекции. Образование амилоидных бляшек также характерно для синдрома Дауна, то есть у людей с ним вероятность деменции повышена. У болезни Альцгеймера тоже есть ранние формы, когда диагноз ставят в возрасте около сорока лет. Каждый двадцатый пациент с болезнью Альцгеймера ещё не перешёл рубеж шестидесяти пяти лет.
Ген повышенной предрасположенности к болезни действительно обнаружен, он называется APOE epsilon 4 — но даже среди людей с этим геном лишь у половины к девяноста годам развивается деменция. Консультация генетика может быть полезной тем, у кого деменция встречалась в нескольких поколениях семьи — существуют, например, семейные формы болезни Альцгеймера, но они достаточно редкие. И хотя точные причины деменции и болезни Альцгеймера не установлены, уже понятно, что гены — не главное. В частности, фактическое увеличение риска из-за генетических поломок намного ниже, чем из-за сидячего образа жизни.
Выявленные факторы риска — это возраст старше 65 лет, черепно-мозговые травмы и заболевания сердечно-сосудистой системы. Врачи методично призывают бороться с курением, ожирением, артериальной гипертензией и повышенным уровнем холестерина — это факторы, способствующие не только инфарктам миокарда, инсультам, некоторыми злокачественным опухолям, но и развитию болезни Альцгеймера. Кроме того, последние исследования показывают важность других факторов, косвенно отвечающих за развитие болезни. Это потеря слуха, невылеченная депрессия, социальная изоляция и сидячий образ жизни.
Если вы регулярно пытаетесь вспомнить, выключен ли утюг и закрыта ли дверь на замок — не паникуйте. Небольшое ухудшение памяти может быть связано с возрастными изменениями, стрессом на работе или недостатком сна. Хотя нарушение кратковременной памяти действительно может быть самым ранним проявлением надвигающейся болезни Альцгеймера, обычно это ухудшение как минимум более выражено, чем можно ожидать для возраста пациента. Другие типичные для начальной стадии деменции признаки — это трудности с отсчётом времени, нарушение ориентации в собственной квартире, проблемы с речью и задачами вроде оплаты счетов.
Чтобы диагностировать деменцию и определить её тип, врачу нужно поговорить с пациентом и членами его семьи — в том числе действительно провести тесты, помогающие оценить память, мышление и уровень отклонений. Но причиной деменции может быть, например, инфекция, опухоль, травма или заболевание щитовидной железы. Поэтому обследование должно включать анализы крови, подробный расспрос и, возможно, МРТ головного мозга. Существуют строгие диагностические критерии деменции и болезни Альцгеймера, описанные в руководствах для врачей.
Иммунотерапия — применение препаратов, помогающих активировать собственную иммунную систему против вредоносных клеток или веществ — произвела революцию в нескольких областях онкологии (например, у некоторых пациентов она позволила устранить все проявления меланомы, ранее смертельной в 100 % случаев). Предполагается, что иммунотерапевтические средства могут перевернуть и лечение деменции — и сейчас несколько таких препаратов находятся в разработке. Исследования занимают много лет, и некоторые потенциальные лекарства уже сошли с дистанции. И всё же как минимум три иммунотерапевтических антитела (гантенерумаб, кренезумаб и BAN2401) изучаются или вот-вот начнут изучаться в исследованиях третьей фазы, в том числе у людей с ранней стадией болезни.
Результаты исследования второй фазы BAN2401 были представлены в июле 2018 года: пациенты с ранней стадией болезни Альцгеймера, получавшие лекарство, значительно лучше справлялись с когнитивным тестом, чем те, кто получал плацебо. Также было зарегистрировано уменьшение количества амилоида в головном мозге. Результаты сохранялись через шесть и двенадцать месяцев и были признаны обнадёживающими. Возможно, в ближайшие годы начнётся следующая фаза исследований, BAN2401 обретёт полноценное название и, если всё пройдёт хорошо, будет зарегистрирован.
Уже есть лекарства, способные контролировать отдельные проявления болезни Альцгеймера. При нарушениях памяти используют ингибиторы холинэстеразы (донепезил, ривастигмин, галантамин) — подавляя фермент холинэстеразу, они повышают уровень ацетилхолина, вещества, которое помогает нейронам взаимодействовать друг с другом. Раньше эти лекарства назначали только на ранних стадиях, но недавно была подтверждена их эффективность и при тяжёлых стадиях деменции. Ещё один препарат (мемантин) несколько отличается по механизму действия и может назначаться в комбинации с ними. В зависимости от сопутствующих деменции проблем используются антидепрессанты, противотревожные, снотворные препараты.
Отдельные симптомы болезни поддаются нефармакологической поведенческой терапии. Это может быть когнитивно-стимулирующая терапия, которая предполагает групповые упражнения, направленные на улучшение памяти и навыков решения проблем. Врач может посоветовать поощрение физической активности, исключение триггеров плохого настроения (например, убрать с видного места определённую фотографию), общение с приятными людьми. Ещё один метод лечения — использование феномена реминисценции в цифровой или реальной версии. Он основан на разговоре о предметах или событиях из прошлого. Это обсуждение фотографий, памятных вещей или музыки, помогающих улучшить настроение и самочувствие.
К сожалению, нет гарантии, что тренировки мозга и изменения образа жизни предотвратят все виды деменции — но это не повод не попробовать. Есть способы, которые снижают риск болезни или отодвигают её начало — они могут быть скучными, банальными и трудоёмкими, но зато работают. Суть в том, чтобы не позволять головному мозгу бездействовать: нужно тренировать кратковременную память, внимание, речь, логику, время реакции, координацию рук и глаз.
Работе мозга способствуют новые впечатления — поэтому стоит научиться хотя бы размешивать сахар в кофе левой рукой (или правой, если вы левша). Изучение новых языков, заучивание стихов, запоминание списка дел на день, новая музыка, рисование, лекции в ближайшем институте или онлайн-курсы, волонтёрство — всё это обогащает нас новыми впечатлениями, а значит, тренирует мозг. Кроме того, стоит поддерживать вес в пределах медицинской нормы, разнообразно питаться, высыпаться, побольше двигаться и бросить курить.
источник