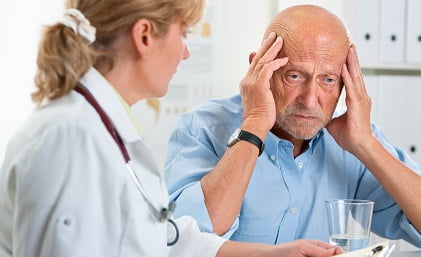
Как полагают авторы нового исследования, болезнь Альцгеймера в будущем можно будет идентифицировать только посмотрев в глаза больному. Ученые обнаружили, что слабоумие оставляет в глазах пациентов особый отпечаток.
Они полагают, что изучение глаза на наличие белка, который также аккумулируется в головном мозге, может стать простым способом ранней диагностики заболевания. Таким образом, диагностирование заболевания на ранней стадии может оказать существенное влияние на результат лечения.
Ученые пришли к такому открытию после того, как изучали пациентов с синдромом Дауна, у которых зачастую проявляются симптомы болезни Альцгеймера в возрасте около 30 лет. Ход болезни ускоряется у людей с подобным синдромом, так как в их организме присутствует дополнительная копия ключевых генов, активных при данном заболевании.
Специалисты обнаружили, что следы токсичного белка амилоид-бета можно обнаружить в глазах людей с синдромом Дауна на самых ранних стадиях развития болезни Альцгеймера. Наличие данного белка также связано с развитием катаракты, но ранее не было известно, содержит ли он компонент амилоид-бета, при этом ученые уже давно обнаружили связь между белком и функционированием организма людей с синдромом Дауна.
В настоящее время исследователи работают над тем, чтобы обнаружить мельчайшие следы этого бела в глазах обычных людей, страдающих болезнью Альцгеймера. «Сейчас мы работаем над созданием особого глазного сканера, который сможет определить содержится ли данный компонент в глазу пациента или нет», — отметил ведущий специалист группы исследователей доктор Ли Гольдштейн из Бостонского медицинского университета США.
«Этот подход сможет обеспечить нас возможностью раннего диагностирования и мониторинга патологий головного мозга», — добавил он.
«Глаз – это окно в мозг, но он не может сам по себе выработать или избавиться от белка в отличие от мозга. Полученные нами данные свидетельствуют о том, что те же белки с амилоид-бета компонентом, которые вырабатываются в мозгу, также аккумулируются и в области глаза, что и приводит к такой необычной форме катаракты, которая наблюдается у пациентов с синдромом Дауна», — рассказывает соавтор исследования Джульетта Монкастер.
Исследования проводились на глазах у умерших людей, поэтому пока неизвестно применимы ли полученные результаты к живым людям. По оценкам в Великобритании около 820 тысяч людей страдают от слабоумия, большинство из которых поразила болезнь Альцгеймера.
«Последние полученные результаты могут быть использованы в комплексе со всеми проводимыми ранее исследованиями на эту тему, которые пришли к выводу, что изучение глаза на наличие токсичного амилоидного белка может когда-нибудь сыграть свою роль при диагностике болезни Альцгеймера. Мы отчаянно нуждаемся в разработке быстрой и эффективной методики диагностирования болезни Альцгеймера на ранних стадиях, так как это, безусловно, поможет выработать более верный курс лечения, а также даст возможность людям подготовится к будущему», — говорит Ребекка Вуд, исполнительный директор исследовательского фонда Альцгеймера.
«Это исследование первое в своем роде, которое связало катаракту, развивающуюся у пациентов с синдромом Дауна с изменениями, происходящими в мозге в результате его поражения болезнью Альцгеймера. Исследования подобные этому, дают надежду на поиск новых путей ранней диагностики слабоумия», — отметила руководитель одной из общественных организаций Сьюзан Соренсен.
«Это очень поможет в разработке вакцины, которая сможет преобразовать жизнь людей».
источник
Некоторые болезни считаются уделом исключительно пожилых людей. Но, к сожалению, юный возраст не является гарантией богатырского здоровья. Медики отмечают, что в последние годы многие старческие «болячки» начали стремительно молодеть. Ниже – семь диагнозов, от которых никто не застрахован, сообщает The Mirror.
Повышенное кровяное давление. Риск заполучить гипертонию увеличивается с возрастом, но этот диагноз может быть поставлен и в молодости, и даже в детстве.
Статистика гласит, что каждая десятая женщина из поколения двадцатилетних подвержена риску инфаркта, инсульта и заболеваний почек. Эта цифра может вырасти из-за эпидемии ожирения. Дети с лишним весом в три раза больше рискуют заполучить гипертонию, чем их сверстники с нормальной массой тела.
Что делать: лучшей профилактикой повышенного давления является здоровый образ жизни. Медики рекомендуют избегать жареного и жирного, сократить употребление соли и спиртных напитков, больше заниматься спортом.
Болезнь Альцгеймера. Большинство людей считает, что деменция поражает лишь дряхлых стариков. Но только в Великобритании насчитывается порядка 40 000 пациентов моложе 65 лет. Болезнь Альцгеймера не является частью естественного процесса старения – это результат физического расстройства, поражающего мозг, говорят эксперты.
Молодым пациентам приходится даже сложнее. Как правило, у них еще достаточно маленькие дети, нуждающиеся в заботе. Врачи могут поставить им неверный диагноз, ориентируясь на возраст. Кроме того, существующая система ухода рассчитана исключительно на стариков.
Симптомы болезни Альцгеймера – проблемы с памятью, спутанность сознания и дезориентация, расстройства поведения, апатия, депрессия или потеря доверия.
Диабет второго типа. Как и гипертония, это заболевание тесно связано с лишним весом. Оно все чаще поражает детей и подростков. Только за последний год за врачебной помощью обратился 621 житель Великобритании моложе 25 лет.
Первые симптомы диабета могут быть не слишком выражены, и люди часто не придают значения жажде и учащенному мочеиспусканию. Диагноз порой ставится случайно, во время планового обследования. Пациенты также могут жаловаться на чувство усталости, постоянные инфекционные болезни, возможно проявление сопутствующих заболеваний: повышенного давления, холестерина, поликистоза яичников (у женщин).
Что делать: даже здоровым людям рекомендуется избегать тяжелой пищи и большого количества сахара, поддерживать вес в норме и уделять физкультуре хотя бы 60 минут в день.
Облысение. Выпадение волос, как у мужчин, так и у женщин – яркий признак старения. Но иногда это случается и с молодыми людьми. Облысение не опасно для здоровья, но причиняет человеку сильный психологический дискомфорт. Иногда оно обусловлено генетикой, но существуют и другие факторы: стресс, дефицит витаминов, токсины, загрязнение окружающей среды.
Что делать: исключить возможные медицинские причины. Если организм в норме, то можно прибегнуть к косметологическим процедурам.
Выпадение зубов. Лишиться зубов можно не только в старости, но и в молодые годы. Возможные причины (если не учитывать травмы, от которых никто не застрахован): диета с высоким содержанием сахара, пародонтит, отсутствие правильного ухода за полостью рта. При появлении таких симптомов, как опухание и кровоточивость десен, неприятный запах изо рта, шатание зубов, нужно обратиться к специалисту.
Катаракта. Заболевание связано с помутнением хрусталика глаза и вызывает нарушения зрения, вплоть до полной его потери. Обычно диагностируется в возрасте 70-80 лет, но может поразить молодых людей и даже младенцев. Эксперты отмечают, что на зрении могут негативно отразиться такие факторы, как курение, избыточный вес, врожденные дефекты, травмы. Также в группе риска – диабетики и люди, в течение долгого времени принимающие стероидные препараты.
Остеопороз. Это заболевание крайне нетипично для пациентов моложе 30 лет, так как именно на этот возраст приходится пик прочности костной ткани. Но, тем не менее, это иногда происходит. Остеопороз может проявиться в любом возрасте, особенно при наличии наследственной предрасположенности. Другие факторы риска: нехватка питательных веществ в рационе, в редких случаях – беременность, прием стероидных препаратов (например, при астме), пониженный уровень гормона эстрогена.
источник
Академический редактор: Тори Л. Шефер
Болезнь Альцгеймера (AD) является наиболее распространенной формой деменции, патологически характеризующейся осаждением мозгового амилоида-бета (Aβ). Ранняя и точная диагностика заболевания по-прежнему остается большой проблемой. Имеются данные о том, что агрегация Аβ начинает происходить за несколько лет до появления симптомов. Неинвазивный мониторинг бляшек Aβ имеет решающее значение как для ранней диагностики, так и для прогноза AD. В настоящее время предпринимаются серьезные усилия по поиску недорогой технологии, способной диагностировать AD путем обнаружения присутствия Aβ. Исследования показывают, что AD является системным, а не мозговым ограничением фокус-заболеваний, и агрегация белков, вызывающих болезнь, также происходит в линзах, кроме мозга. Существует возможная связь между AD и конкретным подтипом возрастной катаракты (надядерная катаракта). Если в линзе присутствуют подобные аномальные отложения белка, это облегчит неинвазивный диагноз и мониторинг прогрессирования болезни. Тем не менее, существуют разногласия по вопросам, связанным с производительностью и валидацией осаждения Aβ в линзе в качестве биомаркеров для раннего выявления AD. Здесь мы рассмотрим недавние данные об отложениях Aβ в линзах пациентов с АД и оценим, может ли окулярная линза обеспечить биомаркер AD.
Болезнь Альцгеймера (AD) является прогрессирующим и смертельным нейродегенеративным расстройством и ведущей причиной деменции во всем мире [1]. Диагноз определенного AD основан на наличии характерных признаков, включая бета-амилоидные (Aβ) бляшки, выполненные посмертно [2-4]. Пептид Aβ, продуцируемый эндопротеолитическим расщеплением белка-предшественника β-амилоида (β-APP), состоит из 39-43 аминокислотных остатков [5]. Исследования показывают, что скорость отложения Aβ связана со значительным снижением памяти и прогрессированием заболевания у пациентов с AD [6]. Отложение Aβ начинает происходить за несколько лет до церебральной атрофии и когнитивного снижения [6-8], поэтому это потенциально дает широкое временное окно для вмешательства с анти-А-терапией. Однако ранняя и точная диагностика AD по-прежнему остается большой проблемой, и отсутствие надежного метода для ее ранней диагностики серьезно препятствует эффективному развитию наркотиков.
В настоящее время предпринимаются значительные усилия для изучения перспективных новых подходов к ранней диагностике AD, выявляя присутствие и накопление белка Aβ. Мозговые сканы, такие как магнитно-резонансная (МР) микроскопия [9], позитронно-эмиссионная томография (ПЭТ), трассеры [10-12], и тесты спинальной жидкости [13] в настоящее время используются исследователями для оценки связанных с Альцгеймером изменений и мониторинга курса болезни в живущих пациентов с АД и моделей на животных, но они являются дорогостоящими и непрактичными для широкого скрининга, и ни один из них не был одобрен для рутинного использования [14, 15]. Существует явная потребность в поиске недорогой технологии, способной обнаруживать состояние до появления симптомов с высокой чувствительностью и спецификой разрешения, что обеспечивает простоту использования во время теста.
AD был идентифицирован как одно из конформационных заболеваний, чья этиология включает в себя агрегацию несогласованного белка в мозге, например, осаждение пептидов Aβ в головном мозге AD [16]. AD — системное, а не ограниченное мозгом заболевание фокуса [17]. В дополнение к мозгу агрегация Aβ также была обнаружена в глазных структурах, особенно в линзах [18-20]. Конформационное изменение в белках линз может индуцировать образование катаракты [21, 22]. Малейшая непрозрачность в любой области хрусталика может быть признаком системных расстройств [23]. Исследования предполагают возможную связь между AD и конкретным подтипом возрастной катаракты (супрануклеарная катаракта) [19] и существование пути, ведущего к AD-связанной патологии в головном мозге и линзе [24]. Более того, частота деменции у пациентов с катарактой выше, чем у пациентов без катаракты [25]. Поэтому предполагается, что катаракту можно рассматривать как окно, указывающее на наличие системных расстройств. В настоящее время модель окулярных линз в качестве биомаркера применительно к диагностическому тестированию находится под интенсивным исследованием. Тем не менее, существуют неопределенности и противоречия по вопросам, связанным с эксплуатацией и валидацией осаждения Aβ в линзе в качестве биомаркера для раннего выявления AD. Здесь мы рассмотрим недавние исследования по осаждению Aβ в линзах пациентов с АД и оценим, может ли окулярная линза обеспечить биомаркер для пациентов, страдающих от AD.
Глаз — это «окно» в мозг. Учитывая прямую связь глазных тканей с мозгом, глаз станет привлекательным местом для ранней диагностики и мониторинга нейродегенеративных заболеваний. Линза представляет собой уникальную иммунно-привилегированную ткань, содержащую прозрачные клетки, и считается идеальной средой для агрегации белка [26]. Человеческая линза чувствительна к возрастным дегенеративным изменениям и демонстрирует прогрессирующее осаждение нерастворимого белка, что вызывает образование катаракты [27]. Существует множество высокочувствительных неинвазивных оптических методов для глаз, включая исследование щелевой лампы и оптическую когерентную томографию. Катаракту можно легко обнаружить и отслеживать с помощью неинвазивных и высокочувствительных оптических методов, поэтому объектив обеспечит идеальное «окно» для мониторинга молекулярной прогрессии AD. Малейшая непрозрачность в любой области хрусталика может быть признаком системных расстройств.
Чтобы определить, является ли это катарактой Альцгеймера, исследователи могут вводить специальные флуоресцентные капли, которые связывают белки Aβ с глазом [1]. Важно отметить, что как объектив, так и мозг происходят из эпителиальных тканей (поверхностная эктодерма и нейроэктодерма, соответственно), а окулярная линза сохраняет популяцию стволовых клеток, которая размножается и дифференцируется на протяжении всей жизни. Он не разрушает старые клетки апоптозом, но использует молодые стволовые клетки, чтобы постоянно воспитывать старые клетки. Благодаря долговечному характеру терминальных дифференцированных типов клеток линза обеспечивает запись истории жизни человека от эмбриона до старости [24]. Долговечность выраженного Aβ в клетках линзового волокна, неэффективная способность к обращению белка в зрелых клетках линзового волокна и оптическая доступность линзы свидетельствуют о том, что катаракта, вызванная агрегацией Aβ, обнаруживается на протяжении всего AD. Такие тесты будут способствовать развитию новых методов лечения AD и максимизировать терапевтический потенциал новых лекарств.
Текущие исследования были сфокусированы на обнаружении Aβ в линзах, чтобы помочь в диагностике AD; однако результаты различны (Таблица 1).
Было отмечено, что патофизиология болезни Альцгеймера способствует образованию катаракты [28]. Исследование Голдштейна и др. Было первым, кто обнаружил признаки связанной с AD патологии вне мозга. Они продемонстрировали регионально-специфические отложения Aβ в надядерной области глазных линз пациентов с AD, у которых Aβ было подтверждено аутопсией, но не у пациентов без расстройства [19]. Супрануклеарная катаракта представляет собой особый необычный фенотип катаракты чуть выше центра (ядра) линзы. Большинство возрастных катаракты проявляются как ядерный склероз или катаракта коры. Ядерный склероз — наиболее распространенный тип катаракты, который включает центральную или «ядерную» часть линзы. Корковые катаракты вызваны помутнением коры линзы (наружный слой) [29]. Супрануклеарная катаракта отличается от тех, которые обычно связаны с возрастом, катаракты и, по-видимому, специфичны для AD. Внутри цитоплазмы экваториальных супрануклеарных линзовых волоконных клеток обнаружен Aβ-гетероолигомерный агрегат [19]. Подобные результаты были также обнаружены у пациентов с синдромом Дауна (DS) (трисомия 21) с ранним началом AD [30]. Комплексный фенотипический комплекс DS — это состояние с особенностями преждевременного старения, высокой частоты AD и характерными раннеспецифическими катарактами неизвестной этиологии [31, 32]. Исследование выявило характерную картину супрануклеарной помутнения в линзах DS, сопровождающихся ускоренными надядерными осаждениями Aβ и агрегатами цитоплазматической А-клетки, идентичными патологии хрусталика, идентифицированной в AD [30]. Эти данные подтвердили, что классическая патология амилоидов, которая продолжается в головном мозге, также встречается в линзе. А бляшка в линзах является причиной катаракты у этих пациентов. Более того, увеличение накопления Aβ является ключевым патогенным детерминантом, связывающим линзу и патологию мозга как в AD, так и в DS [19, 30]. Кроме того, концентрации Aβ в линзе человека и водном юморе сравнимы с концентрациями в коре головного мозга головного мозга и спинномозговой жидкости соответственно [19, 33]. В дополнение к установлению колокализации Aβ с определенным типом катаракты у пациентов с АД, как упоминалось ранее [19], модели трансгенных мышей AD развивали большую катаракту с повышенной иммунореактивностью Aβ, чем мыши дикого типа [18, 20]. Кроме того, осаждение Aβ также было обнаружено в линзах крыс, обезьян и мышиных моделей синдрома Дауна (трансгенных мышей-предшественников белка амилоида-β-белка) [28, 34]. Взятые вместе, эти открытия предполагают возможную перекрывающуюся AD-ассоциированную патологию Aβ в линзе и мозге. AD — более глобальная, системная болезнь, а не одна, ограниченная мозгом. Исходя из этих данных, а также эктодермального эмбриологического происхождения как хрусталика, так и мозга, а также долгоживущего характера терминальных дифференцированных клеточных типов, пораженных AD-патологией в линзе [24], существует вероятность того, что глазной биомаркер для AD может существовать в линзе и возлагает надежды на простые офтальмологические испытания.
Недавно Kerbage et al. что если система SAPPHIRE (комбинация флуоресцентного лиганда и лазерного сканирующего устройства) может помочь диагностировать вероятный AD, обнаружив присутствие Aβ in vivo человеческой линзы. В исследовании мазь помещалась в глаз и связывалась с отложениями Aβ для получения флуоресцентного сигнала, видимого при лазерном сканировании. Результаты показали, что специфическая флуоресцентная подпись отмеченной лигандом Aβ в надъядерных областях была выше среди пациентов с АД по сравнению с нормальным контролем, и серьезных серьезных побочных эффектов не наблюдалось. Средний сигнал, обнаруженный у пациентов с АД, был примерно в два раза выше, чем у контрольного, а более глубокая надядерная область обнаруживала более высокий сигнал по сравнению с другими областями надъядерного [1]. Результаты обнадеживают с точки зрения биодоступности лиганда в переднем сегменте глаза и чувствительности устройства, чтобы отличить пациентов АД от здорового контроля. Более того, он дополняет предыдущее исследование Goldstein et al. для обнаружения бляшки Aβ в надядерной области линз у субъектов AD.
В то время как клинические испытания проводятся, другим исследователям не удалось воспроизвести оригинальную публикацию. Недавнее исследование Майкла и его коллег, которые исследовали ткань линзы 21 донора с AD (17 пациентов с клинически диагностированным AD, четыре невропатологически подтвержденных пациента с AD), не смогли найти никаких признаков Aβ в образцах линз с использованием иммуногистохимических и амилоидных пятен [35]. Те же результаты были найдены в другом независимом исследовании, проведенном Ho et al. Они сообщили, что в линзах или других структурах в глазах пациентов с АД не было обнаружено амилоидного осадка, в то время как бляшки с сильным окрашиванием Aβ присутствовали в мозге этих пораженных субъектов [36]. Эти новые данные ставят под сомнение полезность объектива как раннего индикатора для AD и поднимают вопросы о надежности и надежности его для широкого использования.
Причины этих противоречивых находок не совсем ясны. Сравнивая эти исследования, мы обнаруживаем, что, по-видимому, существуют существенные различия в качестве окрашенных изображений между ними, что указывает на то, что причины лежат частично в процедурах окрашивания (техника Беннхольда, используемая Голдштейном и др. По сравнению с методикой Пухтлера, используемой Майклом и др. al., который также использовал другое антитело для иммуноокрашивания). Кроме того, различия в посмертном интервале, типах катаракты, первичной фиксации линз, замороженных тканей и целых крепежных препаратов также могут объяснять некоторые из этих расхождений. Кроме того, катаракта, как другое конформационное заболевание, также зависит от многих других сложных факторов, и механизм образования бляшек Aβ в линзе неизвестен. Что более важно, неизвестно, предшествуют ли Aβ отложения в объективе симптомов AD. Подводя итог, все еще неопределенно и противоречиво, если осаждение Aβ в линзе может обеспечить биомаркер AD.
В настоящее время окончательный антитромный диагноз АД затруднен и до сих пор нет лекарств от этого заболевания. Доказательства указывают на то, что невропатологические аномалии, связанные с AD, особенно накопление Aβ, могут возникать во время продромальной фазы, столько же, сколько за десятилетия до появления первых когнитивных симптомов [37]. Разработка надежной, практичной и рентабельной диагностической методологии для AD будет способствовать ее ранней диагностике, ускорению доклинического обнаружения лекарств и, следовательно, позволит раннее эффективное вмешательство с новыми лекарственными средствами, с тем чтобы задержать начало заболевания, предотвратить нейродегенерацию или изменить ход ОБЪЯВЛЕНИЕ. В этом отношении однозначная идентификация специфических бляшек Аβ формируется в линзах пациентов с АД и обменивается свойствами с теми, которые находятся в головном мозге, особенно на ранней стадии, и неинвазивное обнаружение in vivo индивидуального осаждения бляшек в линзах у пациентов с АД может развиться специфические биологические биомаркеры для диагностики раннего AD, оценки прогноза и ответа на терапию. Кроме того, понимание влияния процесса AD на визуальную систему может привести к более эффективному общению с членами многопрофильной группы AD.
Несмотря на то, что МР-томография и ПЭТ-трассеры стали обычным явлением во многих больницах, никогда нелегко оценивать агрегацию белков Аβ в ЦНС неинвазивным образом. Если AD-связанная патология линзы действительно отражает изменения в мозге, мониторинг нейродегенерации в мозге может быть простой задачей. Несмотря на большой прогресс в этой области, по-прежнему остаются важные вопросы. Во-первых, бляшки Аβ были обнаружены только в объективах человеческих субъектов АД в трех независимых исследованиях [1, 19, 30], поэтому результаты должны быть дополнительно подтверждены. Во-вторых, нет данных, свидетельствующих о том, что патология линз предшествует патологии мозга. В будущем широкомасштабные хорошо спланированные испытания включают большее число участников, которые необходимы для определения конкретных механизмов, лежащих в основе предполагаемой связи AD-патологии в этих двух анатомических отделениях, и для проверки линзы Aβ в качестве вероятного диагностического инструмента для AD. Кроме того, разработка более чувствительных технологий позволит выявить самые ранние стадии Aβ в линзе. Кроме того, модели на животных способствовали и будут по-прежнему вносить вклад в ключевое понимание нейродегенеративных заболеваний, несмотря на анатомические и физиологические различия [18, 20, 34, 38]. Изучение взаимосвязи между глазными структурами и AD является более простой задачей на животных моделях, чем у людей. Время и стоимость значительно снижаются по сравнению с изучением отношений у людей и, следовательно, увеличивают вероятность того, что будет установлена правильная связь между катарактой и AD. Определение правильного механизма и связи между ними приведет к новому направлению исследований в лечении, вмешательстве и раннем выявлении AD или катаракты.
В настоящее время серьезной проблемой является ранний и точный предсимптоматический диагноз АД. Предполагается, что объектив станет новым, доступным биомаркером AD для изучения накопления протеинов с учетом оптических испытаний и, следовательно, может обеспечить новую количественную диагностическую технологию AD. Исследования, связанные с эффективностью и верификацией осаждения Aβ в линзе для проведения диагностических тестов, подвергаются интенсивному исследованию. Однако результаты отличаются друг от друга. Пока неясно, может ли окулярная линза обеспечить биомаркер для раннего выявления АД. Потенциально важные технические различия могут лежать в основе отсутствия репликации в этих исследованиях.
Чувствительный неинвазивный тест для AD ускорит доклиническое обнаружение лекарств и облегчит диагностику и мониторинг прогрессирования. Уход за пациентами будет значительно усилен ранней диагностикой, началом ранней терапии, мониторингом процесса заболевания и оценкой терапевтического эффекта. Модель объектива по-прежнему многообещающая, но для получения информации о том, что изменения в объективе предшествуют симптомам AD, требуется больше данных о предполагаемых испытаниях на проверку достоверности данных в больших образцах, и если система SAPPHIRE может служить полезным диагностическим инструментом для обнаружения AD на на ранней стадии.
Это исследование было поддержано фондами из Национального фонда естественных наук Китая (№ Гранта: 81301087), Китайского научного фонда по докторантуре (грант №: 2013M540574) и проекта молодежных инновационных фондов Первой аффилированной больницы, Чжэнчжоуского университета (до Тянь Тянь и Чжаомин Ли).
Авторы заявляют, что не существует конфликта интересов в отношении публикации этого документа.
Исследования по обнаружению Aβ в линзах пациентов с AD.
источник
Парадоксы зрения и спасение в жёлтых очках
Марина Муравьёва, STRF.ru
Новые методы диагностики и профилактики распространённых глазных болезней – катаракты и дегенеративных заболеваний сетчатки – разрабатывают учёные академического Института биохимической физики под руководством академика РАН Михаила Островского.
История изучения механизмов зрения – это сама история развития науки, история любопытства учёных, говорит академик Островский, заведующий лабораторией физико-химических основ рецепции Института биохимической физики РАН имени академика Н.М. Эмануэля: «Со времён древних греков учёные пытаются ответить на, казалось бы, простой вопрос: каким образом свет превращается в зрение. Ответ на него есть, и он, собственно говоря, был всегда, но только на том уровне знаний, на котором в тот или иной период времени находилась сама наука».
Огромный вклад в изучение механизмов зрения внесли физики. Так, ещё в XVII веке астроном и физик Иоганн Кеплер описал глаз как «камеру-обскуру», где хрусталик – фокусирующая линза, создающая на сетчатке уменьшенное и перевёрнутое изображение. «Я оставляю будущим натурфилософам задачу понять, каким образом мы видим мир неперевёрнутым», – писал Кеплер. Над загадкой зрения работали и другие великие учёные. Достаточно назвать Юнга, Максвелла, Гельмгольца.
В первой половине ХХ века из работ российских физиков – академика Юлия Харитона, а чуть позже академика Сергея Вавилова стало ясно, что зрительная клетка – это своего рода живой фотоумножитель, способный детектировать всего лишь один квант света. За последние два-три десятилетия было определено, как именно работает этот фотоумножитель, как он усиливает в сто или даже в миллион раз полученный им световой сигнал величиной всего в один квант. Чтобы человек что-то увидел – даже самую слабую световую вспышку, его сетчатке достаточно поглотить всего 15-20 квантов.
Российский академик Михаил Островский, перенявший эстафету исследований механизмов зрения от своих предшественников, изучает явление, которое он называет «фотобиологический парадокс зрения». За многолетние фундаментальные исследования процессов зрения он удостоен высшей награды физиологов – золотой медали имени И. М. Сеченова Российской академии наук.
«Свет – не только носитель зрительной информации, но и потенциально опасный фактор, способный повредить структуры глаза, – говорит академик Островский. – Зрение, вернее, способность самых первых примитивных организмов использовать свет в качестве источника информации, возникло на заре эволюции животного мира, то есть около 600 миллионов лет назад. И одновременно появились механизмы, предотвращающие опасность повреждающего действия света. Конечно, за последующие миллионы лет эволюции зрительный аппарат совершенствовался. И на каждой последующей ступени эволюции фотобиологический парадокс зрения разрешался всё более эффективно. Те организмы, которые не сумели приспособиться, погибли. В этом принцип дарвиновского отбора. В нашем случае выживает зрячий».
Компоненты молекулярной «машинерии» зрения крайне уязвимы для повреждающего действия света, если их не защитить, то они могут сгореть от света. Особенно опасны для них ультрафиолет и фиолетово-синяя часть солнечного спектра. Дело в том, что в зрительных клетках сетчатки и в клетках лежащего за ней пигментного эпителия накапливаются вредные вещества, которые эффективно поглощают синий свет. В результате этого они способны образовывать свободные радикалы – активные и токсичные формы кислорода, которые могут приводить к разрушительным последствиям. К таким вредным веществам относится так называемый «пигмент старости» – липофусцин, который с возрастом накапливается в клетках пигментного эпителия. До исследований академика Островского и его сотрудников (начало 90-х годов) считалось, что липофусцин – это всего лишь инертные шлаки внутри клетки. Но выяснилось, что они далеко не инертны, а под действием синего света становятся активными источниками разрушающих свободных радикалов. Более того, развитие тяжелейших заболеваний сетчатки, приводящих к частичной, а иногда и полной потери зрения сопровождается массированным накоплением в этих клетках именно «пигмента старости». Более чем вероятно, что хорошо известное офтальмологам усугубляющее действие света при таких заболеваниях сетчатки, как раз связано с накоплением «пигмента старости».
Фотобиологический парадокс зрения благополучно разрешила сама же природа. За миллионы лет эволюции возникли системы защиты. По крайней мере, их три. Первая и наиболее эффективная – светочувствительные части зрительной клетки, в которых и происходит преобразование света в зрительный сигнал, обновляются примерно каждые 10-12 дней. Вторая – так называемые антиоксиданты, которых в зрительных клетках гораздо больше, чем во всех других клетках организма, и которые защищают их от фотоокисления, от повреждающего действия света и кислорода. Это витамины Е и С, а также комплекс антиоксидантных ферментов. И, наконец, третья – это оптическая система, в которой ключевую роль играет хрусталик. Хрусталик – это не только фокусирующая линза, обеспечивающая чёткое (и перевёрнутое) изображение на дне глазного яблока, но и весьма эффективный светофильтр, который отсекает области оптического спектра.
С возрастом хрусталик желтеет, поэтому у пожилых людей цветоразличение становится хуже, особенно плохо они различают синие цвета – желтеющий хрусталик частично «закрывает» сине-чувствительные колбочки (французский художник и скульптор Анри Матисс (1869-1954) в старости активно использовал синие краски). Если у детей хрусталик прозрачный и бесцветный, то у пожилых людей – прозрачный (если нет катаракты) и жёлтоватый, бывает даже с коричневым оттенком.
Медики считали, что эта желтизна сопутствует старости, вроде морщин или седины, что, в принципе, верно. «Но вместе с тем, – отмечает Михаил Островский, – это ещё и приспособительная реакция глаза, физиологический смысл которой отсечь от стареющей сетчатки опасную часть солнечного спектра – не только ультрафиолетовую, но и частично синюю».
К тому моменту (начало 1980-х годов), когда на основании результатов фундаментальный исследований учёные поняли, что искусственный хрусталик, который вставляют в глаз после удаления катарактального, должен быть не бесцветный, а желтоватый, как и нормальный хрусталик 45-50-летнего человека, в мире имплантирвали бесцветные искусственные хрусталики. Их делали из пластмассы – полиметилметакрилата. Попросту говоря, это плексиглас. Иногда в него добавляли поглотитель ультрафиолетовых лучей, поскольку хорошо знали, что ультрафиолет опасен для сетчатки. Но обычно в оргстекло ничего не добавляли, и оно пропускало к сетчатке все лучи солнечного спектра, начиная от жёсткого ультрафиолета. В результате у пациентов наблюдался побочный эффект – осложнения в виде «ожога» сетчатки. Группа Островского предложила химикам ввести в плекс краску (технически это несложно) и сделать искусственный хрусталик желтоватого цвета. Первым такие хрусталики начал имплантировать в фёдоровском офтальмологическом центре – МНТК «Микрохирургия глаза» профессор Линник. Начиная с 1986 года, успешно проведено более одного миллиона трёхсот тысяч операций. В результате чего количество осложнений сетчатки снизилось, по данным МНТК «Микрохирургия глаза», почти в 10 раз.
Как отмечает академик Островский, для его коллег – физиологов идея жёлтого хрусталика была очевидной, тогда как для офтальмологов – открытием. Не так давно известная американская фирма Alcon создала мягкие искусственные хрусталики такого же цвета. Но впервые до этого додумались российские учёные. Они с 20-летним опережением создали новое поколение искусственных хрусталиков глаза, надёжно защищающих сетчатку от опасности светового повреждения. В 2005 году за работу «Разработка, научное обоснование и внедрение в офтальмологическую практику фотопротекторных искусственных хрусталиков с естественной спектральной характеристикой» академику РАН Михаилу Островскому (руководитель работы), Павлу Заку, профессору. Леониду Линнику и профессору. Христо Тахчиди была присуждена премия Правительства РФ в области науки и техники.
Продолжая начатые в 80-х годах исследования, коллектив академика Островского планировал создать фотохромные хрусталики, которые были бы как хамелеон: в темноте – бесцветными, а на улице – жёлтыми. Но оказалось, что химики решить проблему пока не могут: фотохромные вещества, которые меняют цвет, работают только в стекле или очень твёрдом полимере, а хрусталики из стекла делать нельзя. Поэтому учёные приступили к созданию фотохромных очков. Работы проводятся совместно с академиком Минкиным из Южного Научного Центра в Ростове и академиком Алдошиным из Института проблем химической физики РАН в Черноголовке. В настоящее время учёные подбирают спектры, определяют, какие нужны фотохромные красители. Очки эти должны в сумерках или при неярком освещении быть бесцветными, а на ярком свете приобретать цвет янтаря – от светлого до тёмного, в зависимости от интенсивности освещения. Такие очки будут не только защищать глаза, но и улучшать качество зрительного восприятия. Впрочем, то, что жёлтые светофильтры, уменьшая хроматическую аберрацию, улучшают качество изображения, хорошо известно профессиональным фотографам: они часто используют такие светофильтры, чтобы кадр получился более чётким. Такие очки нужны людям, у которых имеются проблемы с сетчаткой, а это, как правило, слабовидящие, или те, кому после удаления катаракты имплантированы бесцветные искусственные хрусталики. Кроме того, фотохромные очки необходимы пожилым людям, у которых повышен риск светового повреждения хрусталика и сетчатки. Эти работы проводятся в рамках проекта, поддержанного ФЦП «Исследование и разработки».
В поисках «пигмента старости»
Ещё одно направление проекта – разработка и усовершенствование новых методов диагностики старческих изменений и дегенеративных заболеваний сетчатки. В частности, есть очень тяжёлое и распространённое заболевание – возрастная макулярная дегенерация сетчатки, которое может приводить к полной слепоте. Эффективных способов его лечения пока не создано. Если хрусталик можно заменить, то сетчатку – нет. Как сказал в начале прошлого века испанский учёный Рамон-и-Кахал, «сетчатка – это часть мозга, помещённая в глаз». И как нельзя заменить мозг, так и нельзя заменить сетчатку глаза, добавляет академик Островский.
Сетчатка, как пирожное «наполеон», состоит из многих слоёв, самый наружный – это слой зрительных клеток. За ними лежит так называемый пигментный эпителий, прилежащий к сетчатке. Поскольку светочувствительная часть зрительной клетки постоянно обновляется, то обломки этой части попадают и перевариваются в клетках пигментного эпителия. С возрастом эти обломки перевариваются всё хуже, и потому накапливаются в этих клетках. Такие «недопереваренные» обломки образуют «пигмент старости». При заболеваниях сетчатки «пигмента старости» накапливается огромное количество. Этому пигменту присущи два свойства. Во-первых, он фототоксичен, и, во-вторых, он сильно флуоресцирует. Именно потому, что «пигмент старости» фототоксичен, от него необходимо отсечь ультрафиолетовый и фиолетово-синий свет, который этот пигмент эффективно поглощает и который для старческой или больной сетчатки особенно опасен. Флуоресценция «пигмента старости» позволяет оценить, много ли его накопилось в пигментном эпителии. Для этого сравнительно недавно был разработан очень дорогой прибор – конфокальный сканирующий лазерный офтальмоскоп. Он позволяет неинвазивно – и это принципиально важно, «ловить» эту флуоресценцию. Чем больше флуоресценция, тем больше «пигмента старости» («липофусцин»). По степени и локализации флуоресценции глазного дна можно определить стадии и тяжесть заболевания сетчатки.
«Это флуоресцентная неинвазивная диагностика исключительно эффективна и совершенно безвредна, и не надо вводить ничего в кровь, чтобы потом увидеть флуоресценцию, как это делают сейчас, – говорит Михаил Островский. – Далеко не во всех офтальмологических центрах мира есть такие приборы, они очень дорогие, и не везде умеют на них грамотно работать. Нужно понять, о чём именно говорит эта неинвазивная флуоресценция глазного дна. Этим мы и занимаемся, чтобы усовершенствовать, как говорится «довести до ума», этот новый метод диагностики. Чем раньше и достовернее врачи будут определять болезнь, тем легче будет защитить больную сетчатку, например, от усугубляющего болезнь действия света, или тем эффективнее могут быть способы лечения, которые существуют и применяются в настоящее время».
Академик Островский подчёркивает, как важно, что они – физиологи – тесно сотрудничают с физиками и химиками. Именно понимание необходимости такого сотрудничества привело в своё время академика, лауреата Нобелевской премии Н.Н. Семёнова – основателя Института химической физики, и ученика – академика Н.М. Эмануэля, основателя Института биохимической физики, к тому, что они активно собирали в стенах одного института учёных разных специальностей. И это оказалось исключительно плодотворным. Успехи лаборатории академика Островского в области фундаментальных и прикладных исследований первичных механизмов зрения – наглядное тому свидетельство.
источник
Ученые ИЦиГ СО РАН предложили средство профилактики болезни Альцгеймера
В начале прошлого века немецкий психиатр и невропатолог Алоис Альцгеймер впервые описал странную форму деменции (приобретенного слабоумия), которая сопровождалась не только потерей памяти, но и дезориентацией, галлюцинациями, агрессией и в конечном счёте вела к смерти. Но потребовалось еще более полувека, чтобы объединить разные формы заболевания в одно и назвать болезнью Альцгеймера.
В отличие от онкологии, депрессии или ВИЧ, эта болезнь не претендует на звание «чумы XXI века», но в мире насчитывается около двадцати пяти миллионов людей, страдающих этим недугом. Впрочем, по мнению ряда экспертов, на самом деле их может быть намного больше, ведь в ряде стран (включая Россию) часто при этом заболевании ставят другой диагноз – старческая деменция. В любом случае, сегодня болезнь Альцгеймера является самым распространенным нейродегенеративным заболеванием в мире, и ее заболеваемость растёт по мере увеличения продолжительности жизни и старения населения развитых и развивающихся стран. А вот эффективных средств лечения и профилактики болезни на рынке пока нет. Хотя над их созданием уже работают во многих мировых исследовательских центрах, включая ФИЦ «Институт цитологии и генетики СО РАН».
– Как и у многих нейродегенеративных заболеваний, у болезни Альцгеймера есть две формы возникновения – наследственная и спорадическая, — рассказывает ст. научный сотрудник лаборатории молекулярных механизмов старения, д.б.н. Наталья Стефанова. – На сегодня мы знаем, что наследственную форму вызывают мутации в трех генах, а вот со спорадической (на которую приходится 95 % случаев) все сложнее, причины, которые ее вызывают, достоверно не установлены, а потому – нет моделей, на которых ее можно было бы изучать.
И здесь исследователям помогла уникальная линия крыс OXYS, созданная в Институте цитологии и генетики СО РАН. Ее вывели еще в 70-х гг. прошлого века для изучения катаракты при помощи специальной диеты, насыщенной галактозой. По всей видимости, нагрузка галактозой сыграла роль мутагена, и у этих крыс, помимо катаракты, спонтанно развивался целый комплекс старческих заболеваний: остеопороз, артериальная гипертензия и ускоренное старение мозга с развитием ключевых признаков болезни Альцгеймера. Таким образом, линия крыс OXYS оказалась максимально близкой к модели спорадического развития болезни Альцгеймера, что само по себе вызывает повышенный интерес к ней ученых разных стран.
Многолетняя работа по изучению крыс принесла немало важных результатов. В частности, еще в 1990-е, группа исследователей ИЦиГ под руководством д.б.н. Натальи Колосовой выявила нарастающие с возрастом дисфункции митохондрий (основной источник энергии клеток), которые рассматриваются как одна из наиболее вероятных причин преждевременного старения крыс. И, как оказалось, не только старения.
– Уже вышел ряд работ, убедительно доказывающих, что дисфункция митохондрий может становиться одним из ключевых факторов риска развития болезни Альцгеймера, а также ряда других нейродегенеративных заболеваний, что очень важно, — отмечает Наталья Стефанова. – А у нас есть ряд перспективных наработок как раз в области восстановления функций митохондрий.
На протяжении ряда лет сотрудники ИЦиГ изучали мелатонин (основа препарата «Мелаксен») и убедились, что он действительно замедляет развитие признаков болезни, в том числе и за счёт восстановления функций митохондрий.
Другим препаратом, который исследовали в лаборатории молекулярных механизмов старения, стал антиоксидант SkQ1, или ионы Скулачёва.
Еще в прошлом году сотрудники лаборатории доказали, что антиоксидант вместе с пищей проникает в мозг и накапливается в митохондриях, улучшает их функции и тем самым оказывает нейропротекторный эффект в целом. В частности, у крыс OXYS с признаками болезни Альцгеймера наблюдалось улучшение памяти и способности к обучению.
А теперь получен новый, не менее значимый результат (опубликованный в Current Alzheimer Research). Если в прошлых работах воздействие препарата на крыс изучали с возраста, когда у них начинает накапливаться бета-амилоид – основной маркер болезни, то в этот раз его начали применять к крысам, у которых патология приобрела ярко-выраженный характер. А также – к нормально стареющим крысам линии Wistar.
Как оказалось, антиоксидант замедляет прогрессию признаков болезни Альцгеймера и на более поздних стадиях. Но еще более заметный результат (по восстановлению работы митохондрий) наблюдался у нормально стареющих крыс. По мнению ученых, это говорит о том, что антиоксидант SkQ1 может служить действенным средством профилактики, причем, не только этого заболевания. Сотрудники лаборатории предполагают, что дисфункция митохондрий может лежать в основе развития целого ряда нейродегенеративных заболеваний, таких как болезни Альцгеймера, Паркинсона, Хантингтона.
– Конечно, пока это только предположение, — подчеркивает Наталья Стефанова, — Но оно основывается на многолетней исследовательской работе.
Суть нашей гипотезы в следующем: изначально у пациента возникает именно дисфункция митохондрий нейронов головного мозга, нарушается их энергетический баланс, а затем, в зависимости от «бэкграунда» — генетических особенностей, среды обитания, состояния организма в целом – эта дисфункция выливается в одно из вышеперечисленных заболеваний. Если наше предположение подтвердится, это откроет новые возможности для профилактики и ранней диагностики целого ряда опасных болезней.
Работа ученых ИЦиГ в данном направлении продолжается, и одним из главных источников новых перспективных результатов остается уникальная линия крыс OXYS, позволяющая моделировать развитие многих заболеваний, возникающих у людей в преклонном возрасте.
источник
Болезнь Альцгеймера — одна из наиболее частых причин деменции (слабоумия) в пожилом и старческом возрасте. Деменция характеризуется выраженным упадком интеллектуальных функций человека с нарушением способности к правильному пониманию окружающей обстановки и самостоятельным действиям.
Заболевание названо по имени А. Альцгеймера, описавшего эту форму болезни в 1906 году. При отсутствии лечения болезнь неуклонно прогрессирует и приводит к разрушению всех психических функций.
Причины болезни Альцгеймера окончательно не выяснены. Имеется много данных, свидетельствующих о наследственной природе заболевания. Однако встречаются случаи, не связанные с наследственным предрасположением, особенно при более позднем начале болезни. Болезнь Альцгеймера может начаться в возрасте старше 50 лет, но чаще возникает после 70 и особенно после 80 лет.
Болезнь Альцгеймера — это неврологическое заболевание, которое является наиболее распространенной причиной деменции, составляет более 65 % деменции у пожилых людей. Недуг вдвое чаще встречается у женщин, чем у мужчин, что отчасти связано с большей продолжительностью жизни у женщин.
Болезнь Альцгеймера считается самой распространенной причиной слабоумия в пожилом возрасте. Так, более 65 % случаев деменции у стариков связано именно с этим заболеванием. Нужно сказать, что его чаще диагностируют у женщин, нежели у мужчин. Зачастую это связано с тем, что у женщин больше продолжительность жизни.
Около 4 % людей в возрасте от 65 до 74 лет страдают этим нарушением. У людей старше 85 лет это заболевание диагностируют значительно чаще – приблизительно у 30 %. При этом количество больных преобладает в развитых странах, поскольку там люди живут дольше.
Продолжительность жизни людей с этим заболеванием в среднем составляет 8-10 лет. В редких случаях человек может прожить до 14 лет. При этом в России около 90 % случаев патологии не диагностируют, так как многие люди расценивают ее симптомы как особенности возрастных изменений.
Болезнь Альцгеймера что это такое остается загадкой даже для столь развитой медицины. К сожалению, современные технологии не сильно повлияли на объяснение происхождения страшного недуга.
На эту тему у большинства исследователей продолжаются споры и единственно верного ответа не существует. Однако получилось вывести пока что три предположения о причинах болезни Альцгеймера:
- Новейшая ТАУ-гипотеза – это кардинально отличающееся предположение, которое повествует о том, что ТАУ-белок, находящийся в составе нейронов, с возрастом способен образовать в нервных клетках так называемые конгломераты, которые нарушают их нормальное функционирование и могут привести к гибели нейрона.
- Амилоидная гипотеза – считает причиной возникновения симптомов болезни Альцгеймера накопление амилоида в тканях головного мозга. Ученые ставили опыты на мышах с помощью препарата способного «растворить» амилоидные отложения в мозгу, которые показали успешные результаты, однако на лечение людей особого влияния они не оказали.
- Устаревшая холинергическая гипотеза – основывается на возрастном снижении уровня ацетилхолина в человеческом организме. Ацетилхолин – это нейромедиаторное вещество, благодаря которому происходит передача нервного импульса между нейронами. Это предположение малоактуальное, потому что уже не один раз пациентам от Альцгеймера вводились корректирующие препараты, способные восполнить недостаток этого вещества и это лечение никак не помогало.
Десятилетние исследования американских ученых болезни Альцгеймера привели к выводу, что для раннего диагностирования заболевания Альцгеймера нужно периодически посещать офтальмолога. Болезнь имеет предвестника — Катаракта. Узнав о помутнении хрусталика можно предположить о возможном риске и с помощью специалиста постараться отсрочить первые проявления симптомов Альцгеймера.
Начальные признаки Альцгеймера нередко связывают с возрастом, другой сосудистой патологией или просто стрессовой ситуацией, случившейся за некоторое время до начала клинических проявлений.
Человек на первых порах всего лишь показывает какие-то до сих пор не свойственные ему странности, поэтому вряд ли близким людям приходит в голову, что у него начальная стадия сенильной деменции альцгеймеровского типа – предеменция.
Узнать ее можно по таким симптомам:
- Сначала отмечается потеря способности выполнять работу, требующую особого внимания, сосредоточенности и определенных умений;
- Пациент не может вспомнить, что делал вчера и, тем более, позавчера, принимал ли он лекарство (хотя у многих здоровых такие моменты тоже, бывает, проходят мимо) — это повторяется все чаще, поэтому становится очевидным, что подобные дела ему лучше не доверять;
- Попытка выучить куплет из песни или часть стихотворения особого успеха не приносит, да и любая другая новая информация не может храниться в голове нужное время, что становится непреодолимой проблемой;
- Больному тяжело сосредоточиться, планировать что-то и в соответствии с этим производить какие-то сложные действия;
- «Ты ничего не слышишь (не воспринимаешь), тебе ничего нельзя сказать…» — такие фразы все чаще звучат в адрес человека, с которым «что-то не то» — потеря мыслей, отсутствие гибкости мышления и связи с оппонентом лишают возможности вести с больным продуктивный диалог. Такого человека вряд ли можно назвать интересным собеседником, что удивляет людей, знающих его умным и рассудительным;
- Становится проблемой для больного и уход за собой: он забывает помыться, переодеться, убрать. Непонятно откуда взявшаяся неряшливость у человека, ранее любившего порядок и чистоту, тоже относится к признакам приближающегося слабоумия.
Считается, что перечисленные симптомы на стадии предеменции можно распознать за 8 лет до наступления настоящих проявлений болезни Альцгеймера.
Прогрессирующее ухудшение памяти приводит к настолько выраженным симптомам ее нарушения, что относить их к процессам обычного старения становиться невозможно. Как правило, это и является поводом для предположения диагноза «болезнь Альцгеймера». При этом различные виды памяти нарушаются в различной степени.
Больше всего страдает краткосрочная память — способность запоминать новую информацию или недавние события. Мало страдают такие аспекты памяти, как неосознанная память заученных ранее действий (имплицитная память), воспоминания отдаленных событий жизни (эпизодическая память) и выученных когда-то давно фактов (семантическая память). Расстройства памяти зачастую сопровождаются симптомами агнозии — нарушениями слухового, зрительного и тактильного восприятия.
У отдельных пациентов на первый план в клинике ранней деменции выходят расстройства исполнительных функций, апраксия, агнозия либо нарушения речи. Последние характеризуются преимущественно снижением темпа речи, обеднением словарного запаса, ослаблением способности письменно и устно выражать свои мысли. Однако на этой стадии во время общения пациент вполне адекватно оперирует несложными понятиями.
Из-за расстройств праксиса и планирования движений при выполнении задач с применением тонкой моторики (рисование, шитье, письмо, одевание), пациент имеет неуклюжий вид. В стадии раней деменции больной еще способен независимо выполнять многие простые задачи. Но в ситуациях, требующих сложных когнитивных усилий, он нуждается в помощи.
Прогрессирующая болезнь Альцгеймера проявляет такие симптомы болезни как ярко выраженные речевые нарушения и минимальный запас слов. Пациент утрачивает способность к чтению и письму. Прогрессирование нарушения координации влечет к осложнению выполнения привычных действий (переодевание, регулировка температуры воды, открытие дверей ключом). Не только ухудшается состояние кратковременной памяти, но и начинает страдать долговременная. На этом этапе Альцгеймера может быть проявление таких симптомов, что больной может не признавать родственников и напрочь забыть моменты молодости, которые отчетливо раньше помнил.
Психоэмоциональное расстройство усиливается, проявляется в бродяжничестве, эмоциональной лабильности, раздражительности, обидчивости, особенно с наступлением вечера. Больной Альцгеймера может стать беспричинно агрессивным или плаксивым, у некоторых даже начинается бредовое состояние, начинает сопротивление при любых попытках помочь.
Возможно, недержание мочи, к которому человек относится безразлично, т.к. понятие личной гигиены ему становится чуждо.
На этой стадии болезни Альцгеймера пациенты полностью зависят от помощи окружающих, им жизненно необходим уход. Речь почти полностью утрачивается, иногда сохраняются отдельные слова или короткие фразы.
- Больные понимают обращенную к ним речь, могут отвечать если не словами, то проявлением эмоций. Иногда еще может сохраняться агрессивное поведение, но, как правило, преобладают апатия и эмоциональное истощение.
- Человек практически не передвигается, из-за этого мышцы его атрофируются, а это ведет к невозможности произвольных действий, пациенты не могут даже встать с постели.
Даже для самых простых задач им требуется помощь постороннего человека. Погибают такие люди не из-за самой болезни Альцгеймера, а из-за осложнений, развивающихся при постоянном постельном режиме, например, пневмония или пролежни.
Лечение этого заболевания очень сложно, поскольку болезнь Альцгеймера затрагивает затылочную область мозга, где находятся центры зрения, осязания, слуха, отвечающие за принятие решений.
Такие же изменения происходят в лобных долях, которые ответственны за способности к музыке, языкам, расчетам. Все, о чем переживаем, думаем, чувствуем — находится в энторинальной коре. Что нас глубоко волнует, а также кажется нам неинтересным или скучным, вызывая у нас радость или грусть — происходит здесь. Не существует одного лекарства, которое способно излечить человека. В лечении когнитивных нарушений используют ингибиторы холинэстеразы – Ривастигмигн, Донепезил, Галантамин и NMDA-антагонист — Мемантин.
Как лечить болезнь Альцгеймера? В комплексном лечении эффективны вещества и антиоксиданты, улучшающие микроциркуляцию, кровоснабжение мозга, гемодинамику, а также снижающие уровень холестерина. Медицинские препараты назначают врачи – неврологи, а также психиатры. Психиатры лечат заболевшего исходя из симптомов.
Родственникам приходится тяжелее всего, им необходимо понять, что поведение больного спровоцировано болезнью. С их стороны по отношению к больному важно терпение, уход. Последняя стадия болезни Альцгеймера наиболее тяжела в уходе: больному необходимо создать безопасность, обеспечить питание, профилактику инфекций и пролежней. Важно упорядочить режим дня, рекомендовано сделать надписи-напоминания для больного, а в повседневной жизни оградить его от стрессовых ситуаций.
Стимулирующими методами лечения выступают: арт-терапия, музыкотерапия, разгадывание кроссвордов, общение с животными, физические упражнения. Родственники должны как можно дольше поддерживать физическую активность больного человека.
Основную заботу о пациенте обычно берёт на себя супруг или близкий родственник, тем самым взваливая на себя тяжелую ношу, поскольку уход требует физической нагрузки, финансовых затрат, отражается на социальной стороне жизни и психологически очень тягостен. И пациенты, и родственники обычно предпочитают уход на дому. При этом возможно отложить либо вовсе избежать необходимости в более профессиональном и дорогостоящем уходе, однако две трети жильцов в домах престарелых всё же страдают от деменции.
- Среди лиц, заботящихся о дементном больном, отмечается высокий уровень соматических заболеваний и расстройств психики. Если они живут под одной крышей с больным, если больной — супруг или супруга, если больной впадает в депрессию, ведет себя неадекватно, галлюцинирует, страдает от нарушений сна и не в состоянии нормально передвигаться — все эти факторы, по данным исследований, связаны с повышенным числом психосоциальных проблем.
- Заботящийся о больном также вынужден проводить с ним в среднем 47 часов в неделю, зачастую за счёт рабочего времени, при этом затраты на уход высоки. Прямые и косвенные расходы по уходу за пациентом в США составляют в среднем от 18000$ до 77500$ в год, по данным разных исследований.
По данным исследований, психологическое здоровье лиц, заботящихся о больных, можно укрепить методами когнитивной поведенческой терапии и обучением стратегиям противодействия стрессу, как индивидуально, так и в группах.
Диета для человека, пострадавшего от болезни Альцгеймера, практически так же важна, как и фармакологические препараты. Правильный выбор составляющих меню позволяет активизировать память, повысить способность к концентрации внимания, положительно сказывается на мозговой деятельности.
Правильное питание, основы которого предлагаются ниже, может рассматриваться и как инструмент профилактики деменции:
- Омега-3 – самые эффективные липиды для восстановления процессов кроветворения. Также эти вещества положительно сказываются на состоянии памяти и приостанавливают разрушение интеллекта. Получать ценные элементы можно из оливкового масла, грецкого ореха, морепродуктов. Полезно будет периодическое выдерживание средиземноморской диеты, основанной именно на дарах моря.
- Антиоксидантны включаются в рацион в виде кукурузы, сельдерея, шпината, также полезен мед. Сильный эффект (антиоксидантный, иммуностимулирующий, противовоспалительный) оказывает куркумин, который добывается из индийской специи куркумы.
- Продукты, предназначенные для нормализации деятельности кишечника, также очень важны. В меню следует обязательно включить нежирное мясо, яйца, печень и злаки.
- Аминокислоты способствуют восстановлению работы мозга и улучшению состояния нервных клеток. В особенности важно регулярное снабжение организма триптофаном и фенилаланином. Их поставщиками являются свежие фрукты и овощи, орехи, зелень и молочные продукты.
- Жирное мясо;
- Мучное;
- Сахар;
- Острые приправы и соусы.
Грамотный питьевой режим также играет роль. Нехватка жидкости отрицательно сказывается на состоянии головного мозга. Человек с болезнью Альцгеймера должен употреблять минимум 2 литра чистой воды в день. Желательно добавить в рацион зеленый чай, полезны свежевыжатые соки.
На ранних стадиях болезнь Альцгеймера плохо поддаётся диагностике. Определённый диагноз обычно ставится, когда когнитивные нарушения начинают отражаться на повседневной активности человека, хотя сам больной может быть ещё способен жить независимой жизнью. Постепенно лёгкие проблемы в когнитивной сфере сменяются нарастающими отклонениями, как когнитивными, так и иными, и этот процесс неумолимо переводит человека в зависимое от чужой помощи состояние.
- Продолжительность жизни в группе больных снижена, а после постановки диагноза они живут в среднем около семи лет. Менее 3 % пациентов остаются в живых более четырнадцати лет. С повышенной смертностью ассоциированы такие признаки, как повышенная тяжесть когнитивных нарушений, сниженный уровень функционирования, падения, отклонения при неврологическом осмотре. Другие сопутствующие нарушения, например, кардиологические проблемы, диабет, история злоупотреблений алкоголем, также связаны со сниженным выживанием. Чем раньше началась болезнь Альцгеймера, тем больше лет в среднем удаётся прожить пациенту после диагноза, но при сравнении со здоровыми людьми общая продолжительность жизни такого человека особенно низка. Прогноз по выживаемости у женщин более благоприятен, чем у мужчин.
Смертность у пациентов в 70 % случаев обусловлена самой болезнью, при этом чаще всего непосредственными причинами являются пневмония и обезвоживание организма. Рак при болезни Альцгеймера отмечается реже, чем в общей популяции.
Многие люди, наслышанные о болезни Альцгеймера, обнаружив у себя (или у родственника) ее признаки (проблемы с запоминанием недавно заученного и увиденного), пытаются предотвратить или остановить процесс.
Во-первых, в таких случаях нужно знать, что это действительно данное заболевание, а, во-вторых, особых мер профилактики сенильной деменции альцгеймеровского типа как бы и нет.
- Между тем некоторые утверждают, что усиление интеллектуальной активности поможет спасти положение: нужно срочно начинать играть в шахматы, разгадывать кроссворды, заучивать стихи и песни, учиться играть на музыкальных инструментах, изучать иностранные языки.
- Другие склоняются к соблюдению специальной диеты, направленной на снижение риска и смягчение симптомов деменции и состоящей из овощей, фруктов, круп, рыбы, красного вина (в умеренных дозах) и оливкового масла.
Можно предположить, что правы и те, и другие, ведь тренировка для ума и отдельные продукты питания могут действительно положительно влиять на мыслительную деятельность. Так почему бы не попробовать, ведь хуже точно не будет?
Вот на что точно следует обратить внимание людей, которые на старости лет очень боятся «не помнить себя» и пытающихся предотвратить слабоумие, описанное Альцгеймером, так это на профилактику сосудистой патологии. Дело в том, что такие факторы риска сердечно-сосудистых заболеваний, как холестеринемия, сахарный диабет, артериальная гипертензия, вредные привычки заодно повышают и риск развития самой болезни, и вероятность ее более тяжелого течения.
источник