Исследователи обнаружили, что существует прямая связь между потерей части сетчатки глаза и началом развития болезни Альцгеймера.
По результатам недавно проведенных в США и Китае исследований, болезнь Альцгеймера можно диагностировать по глазам человека, так как они связаны непосредственно с мозгом и с его наиболее важными функциями. В статье мы представим вам более полную информацию по данной теме, которая вас наверняка удивит.
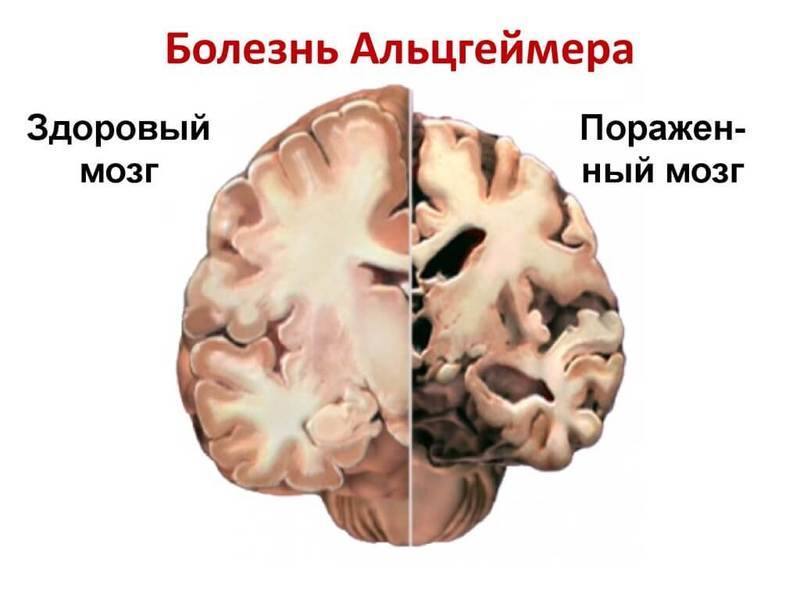
Болезнь Альцгеймера — это заболевание, которое поражает мозг и нарушает его функции, в первую очередь когнитивные и поведенческие. Именно поэтому ее относят к нейродегенеративным заболеваниям. В основном от этой болезни страдают люди в возрасте старше 65 лет.
Одним из наиболее распространенных симптомов болезни Альцгеймера является неспособность усваивать новую информацию и получать новые знания, а также неспособность задействовать свою память. Таким образом, эта болезнь вызывает постепенную потерю кратковременной памяти и других умственных способностей. В настоящее время болезнь Альцгеймера является самой распространенной формой слабоумия. К сожалению, она может только прогрессировать и не поддается лечению. Как правило, с момента диагностирования этого заболевания, человек может прожить еще около десяти лет.
Исследователи из Медицинского центра при университете в Джорджтауне (США) и из Университета Гонконга (Китай) в результате проведения экспериментов на крысах обнаружили, что существует прямая связь между потерей части сетчатки глаза и началом развития болезни Альцгеймера.
Если говорить в общих чертах, то целью исследования было проанализировать сетчатку глаз вышеупомянутых грызунов, которых искусственно «заразили» болезнью Альцгеймера (модификация генов). В отличие от других исследований, проводимых ранее, ученые решили измерить толщину сетчатки глаза у животных, включая внутренний слой и слой ганглиозных клеток.
Таким образом им удалось установить, что у крыс с болезнью Альцгеймера наблюдалось значительное уменьшение толщины анализируемых слоев. В то же время у здоровых крыс каких-либо изменений в сетчатке глаз выявлено не было.
Разумеется, эти исследования еще не окончательные, так как остается еще очень много, что необходимо изучить. И тем не менее, возможно, они уже смогут пролить свет на это заболевание и дать возможность его диагностировать по состоянию глаз.
Но как бы там ни было, лучше следовать простым рекомендациям, которые помогут предотвратить или хотя бы отсрочить развитие болезни Альцгеймера.
К ним относятся:
- вести здоровый образ жизни,
- регулярно выполнять физические упражнения
- и, главное, поддерживать активность своего мозга. Ученые уже доказали, что с помощью тренировки мозга можно победить когнитивные расстройства.
Под «тренировкой» подразумевается чтение книг, изучение чего-то нового (иностранных языков, к примеру, или литературы, связанной с вашей трудовой деятельностью). Рекомендуется постоянно анализировать то, что представляется вам интересным, заниматься художественной деятельностью или спортом, а также записывать свои мысли и наблюдения.
Выполняя эти несложные действия регулярно, можно значительно снизить вероятность возникновения проблем со здоровьем в будущем. Желательно, чтобы они стали вашей ежедневной привычкой.
Если вы или ваши близкие уже можете отнести себя к людям за 65, то очень важно вовремя диагностировать болезнь Альцгеймера, если она имеется. Даже если это так, существует несколько вариантов, которые хотя и не смогут полностью исцелить вас от этой болезни, но позволят поддерживать лучшее качество жизни, насколько это возможно в данной ситуации. Существуют и государственные программы, информирующие пациентов и их родственников о возможных способах лечения болезни Альцгеймера. опубликовано econet.ru .
P.S. И помните, всего лишь изменяя свое сознание — мы вместе изменяем мир! © econet
Понравилась статья? Тогда поддержи нас, жми:
источник
Гость Редактор: Б. О. Попеску
Эти авторы внесли одинаковый вклад.
В качестве модели болезни лабораторная крыса в течение многих лет внесла огромный вклад в исследования нейронауки. Он также был популярной моделью животного для болезни Альцгеймера, но ее популярность уменьшилась в течение последнего десятилетия, поскольку методы генетической манипуляции у крыс отставали от мышей. В последние годы крыса делает возвращение в качестве модели болезни Альцгеймера, и появление растущего числа трансгенных крыс станет долгожданным и ценным дополнением к существующим моделям мыши. В этом обзоре обобщены вклад и текущий статус крысы в качестве животной модели болезни Альцгеймера.
Крысиные модели холинергической функции
Тройная трансгенная крыса
Трансгенные крысы APP21 и APP31
Трансгенные крысы — сводка
Вирулярно индуцированные модели AD
Болезнь Альцгеймера (AD) характеризуется прогрессирующим когнитивным снижением, когда память о последних фактах, пространственной ориентации, внимания и исполнительных функциях являются первыми затронутыми. За этим следуют речевые и поведенческие проблемы, которые влияют на повседневную жизнь [1]. Патологические изменения в головном мозге, которые определяют заболевание, представляют собой обильные внеклеточные амилоидные бляшки и внутриклеточные нейрофибриллярные клубочки (NFT), сопровождающиеся синаптической и нейронной потерей и воспалением головного мозга [2-5]. Амилоидные бляшки состоят в основном из агрегированного амилоида-β-пептида (Aβ) [6, 7], который получают путем протеолитического расщепления из белка предшественника амилоида (APP) [8]. Пептид Aβ может состоять из 39-43 аминокислотных остатков, но две основные формы: Aβ40, составляющие
90% всех Aβ, высвобождаемых из клеток, и более длинный Ap42 составляет всего
10%. Ap42 является более гидрофобным и более склонным к агрегации, чем Aβ40 [9], и является преобладающей формой, обнаруженной в амилоидных бляшках AD [10]. NFT состоят из агрегированной формы гиперфосфорилированного микро-tubule-ассоциированного белка, tau [11].
Хотя причина AD по-прежнему является предметом значительных дебатов, так называемая гипотеза амилоидного каскада остается наиболее определенной и наиболее изученной концептуальной основой болезни [12]. Эта гипотеза основана на патологических характеристиках и генетике болезни [13, 14]. На сегодняшний день в генах, кодирующих APP, пресенилин 1 (PS1) и пресенилин 2 (http://www.molgen.ua.ac), обнаружено около 200 мутаций, вызывающих наследственную раннюю начальную форму AD (семейный AD; FAD) . be / ADMutations). Пресенилины участвуют в обработке APP, и мутации во всех трех белках приводят к изменению продуцирования Aβ. Хотя детали гипотезы амилоидного каскада развивались с момента ее первого предложения, ее основной принцип остается по существу неизменным в том, что Ap-пептиды являются основной причиной AD. Поэтому неудивительно, что многие антиамилоидные и другие нейропротекторные терапевтические подходы в настоящее время изучаются [15].
Модели животных предлагают ценные инструменты для оценки новых терапевтических стратегий лечения заболеваний человека, а также для изучения патологических механизмов, связанных с болезненными процессами. Из-за отсутствия полного понимания этиологии AD все имеющиеся модели имеют ограничения, которые необходимо тщательно учитывать при их использовании. Нет никаких естественных моделей AD, поэтому большая часть исследований проводится с использованием моделей, имитирующих фенотипы болезни путем активных манипуляций с животными, или совсем недавно с использованием трансгенных моделей животных. Для моделирования различных аспектов АД использовались многочисленные виды животных. Первоначально крыса была предпочтительным видом, но в течение последнего десятилетия растущее знание передовых генетических методов, разработанных у мышей, в дополнение к обнаружению генных мутаций, вызывающих семейные формы AD, позволило генерировать все большее число трансгенных мышь. Достаточно полный список моделей трансгенных мышей, актуальных для AD, постоянно обновляется на домашней странице Исследовательского форума Alzheimer (http://www.alzforum.org/res/com/tra/default.asp). Но в последние годы крыса возвращается в качестве модели AD. Этому есть несколько причин. секвенирование генома крысы, последние разработки в области технологий для борьбы с геномом крыс и слабой прогностической мощи моделей мыши для эффективности лекарств у людей.
Крыса была первым видом млекопитающих, одомашненным для научных исследований более 180 лет назад [16]. С тех пор он был одним из наиболее изученных модельных организмов, особенно в исследованиях сердечно-сосудистой, онкологической, токсикологической, поведенческой, нейродегенерации и старения [17]. Селективное размножение привело к созданию более 200 инбредных штаммов крыс, моделирующих различные аспекты заболеваний человека [18]. Вклад крысы в здоровье человека нельзя переоценить [16], и он был организмом выбора для большинства физиологических и поведенческих исследований на протяжении десятилетий. Поведенческие ученые предпочитают крысу, потому что это умный и быстрый ученик, тогда как физиологи используют тот факт, что физиологические процессы похожи на крыс и людей. Кроме того, крысы достаточно велики для удобных физиологических измерений [19]. Генетики, с другой стороны, предпочитают мышь, которая меньше и легче манипулирует генетически [20]. Поскольку мышь оказалась легче манипулировать генетически, чем крыса, она стала наиболее распространенным модельным организмом млекопитающих в области трансгенных исследований. Но, что мышь генетически генетически, они часто испытывают недостаток в физиологическом понимании, причем исследователи часто экстраполируют данные крыс [21].
Одной из важнейших особенностей животной модели AD является способность анализировать память и познание в поведенческих тестах. Различия между поведением крыс и мышей намного больше, чем многие люди понимают, хотя большинство задач могут выполняться обоими видами [22]. По сравнению с крысой мышь демонстрирует более простой поведенческий репертуар и гораздо меньшую гибкость при работе с новыми ситуациями. Поэтому мышь создает проблему для нейроповеденческих исследований, так как это вид, функционирующий на низком уровне сложности по сравнению с крысой [23]. Недавно было показано, что крысы могут принимать адаптивные решения о будущем поведении, зависящем от имеющихся в настоящее время знаний. Эта способность, чтобы отразиться на собственных психических процессах, называется метапознанием и ранее считалась уникальной для приматов [24, 25]. В исследованиях нейронауки крыса предлагает хорошие технологические возможности для нейрохирургических / стереотаксических манипуляций, нейровизуализации, гистопатологии, электрофизиологических записей или серийного отбора проб спинномозговой жидкости. Было показано, что в случае гипертонии, атеросклероза, патологии ВИЧ, болезни Хантингтона или моделирования активации системы комплемента, модели крысы более точно представляют человеческую патологию, чем аналогичные модели мыши [26-30].
Некоторые из вкладок, которые сделала крыса в область исследований AD, приведены ниже, и обсуждаются недавно доступные трансгенные крысы.
Ранние открытия 1960-х годов, демонстрирующие вредные эффекты лекарств, которые блокируют холинергическую активность, такие как атропин и скополамин, на память у крыс, а также параллельные доказательства холинергической дисфункции в AD, впоследствии привели к формулировке «холинергической гипотезы о гериатрической дисфункции памяти» [31, 32]. С того времени для изучения роли холинергической системы в когнитивной функции использовались различные подходы к индуцированию холинергических поражений у крыс [33, 34]. Наиболее часто используемые нейротоксины включают в себя нейротрансмиттеры возбуждающих аминокислот, такие как глутамат и его аналоги (иботенат, N-метил-d-аспартат [NMDA], каинат, квинквалат и альфа-амино-3-гидрокси-5-метил-4-изокс- азопропионовая кислота [AMPA]), токсин AF64A, специфичный для холинергических нейронов, или антагонисты мускариновых рецепторов скополамина и атропина [35]. В 1990 году для моделирования медленной эволюции нейродегенеративных заболеваний, в том числе AD [36, 37], была разработана хроническая модель крысы с непрерывным внутричерепно-мозговым вливанием хинолиновой кислоты. Непрерывная инфузия хинолиновой кислоты при низких дозах в боковой желудочек вызывает снижение активности гиппокампа и кортикальной холиновой ацетилтрансферазы у крыс. Поскольку некоторые из ранних пораженных нейронов в головном мозге AD являются холинергическими нейронами базального переднего мозга [38, 39], генерация иммунотоксина 192IgG-сапорина, который специфически нацеливается на рецептор с низким сродством нейротропина крысы p75, экспрессирующий холинергические клетки базального ядра Meynert (или крысиное эквивалентное ядро basalis magnocellularis) и медиальная перегородка, позволили более адекватное моделирование заболевания [40, 41]. Аналогичным образом, выборочное разрушение зависимых от холинергических нейронов перегородки нервного роста (NGF), обусловленное холинергическими нейронами перегородки, достигалось путем прямой интрасекционной инфузии антител против NGF [42]. Дефицит памяти, полученный во всех этих моделях, был аналогичен дефициту памяти, наблюдаемому в AD, поддерживая представление о том, что функциональные холинергические пути важны для памяти и познания и прокладывают путь для лечения холинергической терапии для AD. После первоначальных неудачных испытаний с предшественниками ацетилхолина холин и лецитин ингибиторами ацетилхолинэстеразы (донепезил, ривастигмин, галантамин) стали широко используемые препараты для симптоматического лечения этого заболевания [32, 43].
Открытие того, что Aβ является основной составляющей характерных амилоидных бляшек в мозге пациентов с АД [6, 7] и токсично для нейронов [44, 45], привело к in vivo исследованиям влияния Aβ в головном мозге. Острый нейродегенеративный эффект Aβ и амилоидных сердечников из головного мозга пациентов с AD был продемонстрирован in vivo уже в 1991 году, когда эти вещества были введены в мозг двух разных моделей крыс [46, 47]. В обоих случаях значительная индукция аномального тау-фосфорилирования наблюдалась в непосредственной близости от иммунореактивных сайтов Aβ. В последующие годы несколько лабораторий сообщали о противоречивых результатах острой инъекции или непрерывных вливаниях Aβ непосредственно в мозг крысы. В то время как многие группы продемонстрировали нейротоксичность, AD-подобный астроглиоз, гиперфосфорилирование тау [48-53] и / или снижение памяти в экспериментальных моделях [51, 53-57], другие не показали значительного влияния пептидов [58-60]. Аналогичным образом, противоречивые результаты были получены в аналогичных экспериментах, выполненных на макаках-резусах [61, 62]. Большая часть дисперсии полученных результатов зависела от природы пептида (фибриллированного или растворимого А) или используемого растворителя, концентрации раствора и способа введения (одиночные инъекции или непрерывные вливания в разные периоды времени в желудочки крыс, гиппокамп или септум), возраст обработанных животных (молодые против старых) и временные рамки, когда оценивались эффекты (немедленные или долгосрочные эффекты). Больше моделей, демонстрирующих ухудшающееся действие Aβin vivo, последовало в 2000-х годах, доказывая, что это по-прежнему жизнеспособный подход для моделирования различных аспектов патологии AD. Эти модели, например, использовались для тестирования защитных эффектов экстрактов гинкго билоба, докозагексаеновой кислоты (ДГК), женьшеня, эстрадиолов, зеленого чая, синтетических когнитивных энхансеров или антиоксидантов [63-70] и ухудшающихся эффектов хронического стресса [ 71] на память у крыс, которым вводили / инфузировали Aβ. В 2007 году Takata и др. [72] показали, что экзогенные микроглии, трансплантированные в мозг крыс, микроинъектированных Aβ, участвуют в очистке Aβ.
Недавно сообщалось об изменении модели инфузии Aβ [73]. В этой модели Аβ объединяли с индукторами окислительного стресса, чтобы индуцировать гибель нейронов, отложения амилоидов, глиоз и нарушение памяти после 4-недельного внутрибрюшечно-желудочкового вливания. Окислительный стресс индуцировали с использованием прооксидативного катиона Fe2 + и ингибитора синтеза глутатиона бутионинсульфоксимина (BSO). Эта модель теперь доступна через коммерческого поставщика.
Первые трансгенные модели AD, укрывающие человеческий APP с FAD-каузативными мутациями, появились более десяти лет назад [74, 75]. Эти модели были созданы у мышей, но одновременно были предприняты безуспешные попытки разработать AD-трансгенных крыс [76, 77]. Сегодня многие линии трансгенных мышей показывают присутствие амилоидных отложений, которые прогрессируют с возрастом. Synaptic и потеря нейронов значительно отличаются между различными линиями и поведенческим тестированием также подвергаются различной степени дефицита в ссылках и задачу работе памяти [78, 79]. Общей чертой этих моделей является отсутствие NFT; только мыши, выражающие мутированный человеческий тау, развивают патологию путаницы. Несмотря на то, что у пациентов с AD не было зарегистрировано никаких тау-мутаций, они также вызывают другие нарушения деменции, такие как лобно-временная деменция, связанная с хромосомой 17 (FTDP-17), доказывая, что тау-дисфункция может вызвать ухудшение памяти. Данные этих моделей позволили лучше понять биофизические и патологические свойства тау-полимеров при деменции [80, 81]. В целом, модели трансгенных мышей внесли большой вклад в наше понимание патогенеза AD и исследований возможных терапевтических стратегий.
В последние годы были созданы несколько генетически манипулируемых линий мыши: не только трансгенные, но и нокаутированные, нокаутированные и условные мутантные штаммы (в которых гены могут быть удобно отключены и включены). До недавнего времени это было невозможно для крыс из-за невозможности выделения эмбриональных стволовых клеток крыс, которые обычно использовались для генетических манипуляций [19]. Тем не менее, возрастающая эволюция методов трансгенного, целевого мутагенеза и клонирования открыла путь для генерации генетически управляемых линий крыс [82, 83]. В то время как первая трансгенная крыса появилась уже в 1990 году, трансгенные модели крыс нейродегенеративных заболеваний человека начали появляться только в 2000-х годах, и первое заражение нокаутом крыс было зарегистрировано в 2003 году [30, 84-87]. В течение последних нескольких лет появились несколько моделей с одним и несколькими трансгенами крысы (таблица 1). Будучи доступным в течение более короткого времени, трансгенные модели крыс AD еще не так хорошо характеризуются как многие линии мыши в отношении патологии и ухудшения памяти, но они предлагают многообещающую новую эру для фармакологических исследований AD. Ниже приведен краткий обзор моделей трансгенной крысы APP, которые были опубликованы до настоящего времени.
Модели трансгенных крыс болезни Альцгеймера
APPswe, APP с «шведской» мутацией K670N / M671L; APPind, мутация V717F ‘Индиана’; PS1 Finn, PS1 с финской мутацией M146L; hTau усечен, человеческий тау усечен в положениях аминокислот 151-391; PDGF, фактор роста тромбоцитов; PrP, промотор прионов; Thy1, промотор антигена 1 дифференцировки тимоцитов; P-тау, фосфорилированная тау иммунореактивность; SHR, спонтанно гипертензивная крыса; Nr, не сообщается.
Первой трансгенной крысой APP, которая должна быть опубликована, была крыса TgAPPswe от Ruiz-Opazo et al. в 2004 году [88]. Эти крысы Fisher-344 чрезмерно экспрессировали конструкцию миниген-кДНК с человеческим APP, содержащим шведскую мутацию AD (K670N, M671L), приводимую промотором фактора роста тромбоцитов (PDGF). Увеличение экспрессии APP было низким, только 56,8% на уровне мРНК. Уровни Aβ в головном мозге были увеличены на 21% для Aβ42 и 6% для Aβ40 в возрасте 12 месяцев. У этих животных не было обнаружено патологий, связанных с AD, до возраста 18 месяцев. Удивительно, но крысы TgAPPswe значительно улучшились в водном лабиринте Морриса, чем контрольные группы в возрасте 6 и 12 месяцев. Хотя крысы TgAPPswe не являются образцом AD, результаты, несомненно, вызывают вопросы, касающиеся физиологической роли APP и его производных в учебе и функциях памяти.
В том же году, что и крыса TgAPPswe, была опубликована серия статей о двойной трансгенной линии крыс Wistar UKUR25 [89-92]. Крысы UKUR25 выражают человеческий APP, содержащий мутации в Швеции и Индиане (V717F), и мутировали PS1 (M146L). Обе конструкции были инициированы промотором PDGF. Главным патологическим признаком в мозге этих животных, видимым после 6-месячного возраста, было накопление Aβ внутриклеточно в нейронах гиппокампа и коры. Однако уровни Aβ в головном мозге не сообщаются. У этих животных до 24-месячного возраста не наблюдалось внеклеточного амилоида. Поведенческий анализ 7- и 16-месячных крыс UKUR25 показал умеренное ухудшение в обучении по приобретению у 16-месячных самцов крыс. После изучения обучения платформа была перемещена, и крысы должны были изучить новое место. Не было существенной разницы между трансгенциями и элементами управления в этой задаче. В возрасте 9 месяцев наблюдалось увеличение активного фосфо-ERK2 в мозге крысы UKUR25, что сопровождалось увеличением уровней тау-фосфорилирования на сайтах S396 и S404 ERK2 (признанных антителом PHF-1). Отсутствие какой-либо внеклеточной патологии вместе с мягким поведенческим фенотипом может ограничить использование этой трансгенной крысы в исследовании AD.
В 2007 году Folkesson et al. [93], опубликованном на трансгенной линии крыс Tg6590, которая экспрессирует APP человека с помощью шведской мутации, вызванной промотором ubiquitin. Линия крыла Tg6590 показывает главным образом нейронную экспрессию белка APP человека с самыми высокими уровнями, обнаруженными в коре, гиппокампе и мозжечке. Эти крысы развивали умеренную внеклеточную иммунореактивность Aβ, но не имели компактных зрелых амилоидных отложений. Уровни Ap42 и Aβ40 увеличены до такой же степени, как и ожидалось из-за используемой мутации [94]. Уровни обоих видов Aβ увеличены на 65% в гиппокампе и 40% в коре 11-месячных животных. Крысы Tg6590 демонстрируют дефицит обучения и памяти в водном лабиринте Морриса в возрасте 9 месяцев и изменяют спонтанное поведение, измеряемое в открытом поле [94]. Как и в некоторых моделях мыши APP, эти изменения поведения наблюдаются до появления каких-либо амилоидных отложений. Подобно линии UKUR25, наблюдается очевидное увеличение фосфорилированного тау на участке PHF-1 в мозге крысы Tg6590, но увеличение не достигает статистической значимости. Культурные первичные нейроны гиппокампа из этой линии показывают сложные изменения гомеостаза кальция, которые потенциально могут играть роль в нарушениях обучения и памяти, наблюдаемых у этих животных [95, 96]. Хотя линию Tg6590 необходимо охарактеризовать в терминах возникновения и прогрессирования поведенческих фенотипов, она представляет собой перспективную модель для передовых исследований поведения.
К концу 2007 года Flood et al. [97] опубликовал статью о новых линиях трансгенных крыс, которые были разработаны в Cephalon, Inc. и впервые были описаны в реферате в 2003 году [98]. В этой статье были скрещены две линии крыс Sprague-Dawley с трансгенами, экспрессирующими APP человека. Линия Tg478 выражает человеческий APP со шведской мутацией, управляемой промотором синапсина крысы. Линия Tg1116 выражает человеческий APG-миниген, содержащий мутацию со шведской мутацией и семейными мутациями AD. Полученные двойные гомозиготные крысы продуцируют достаточное количество Aβ для осаждения амилоида в возрасте 17-18 месяцев. Это уменьшалось до 7-месячного возраста путем скрещивания в третьей линии трансгенных крыс с переносчиком PS-1 человека с семейной мутацией AD M146V (Tg11587). Тройную гомозиготную трансгенную крысу Tg478 / Tg1116 / Tg11587 также называют крысой PSAPP Tg [99]. Амилоидные отложения в этой модели аналогичны тем, которые наблюдаются в некоторых моделях мыши, и обнаруженные компактные амилоидные отложения связаны с активированными микроглиями, реактивными астроцитами и фосфорилированной тау-иммунореактивностью [99]. Эти тройные трансгенные животные проявляли дефицит в задачах лабиринта Морриса с 7-месячного возраста, но как в поведенческих тестах с открытым полем, так и при повышении плюс лабиринта тройная трансгенция не отличалась от контролей [99]. Это первая трансгенная крыса для развития обширных амилоидных отложений, но грубая избыточная экспрессия нескольких трансгенов ставит чрезмерную нагрузку на организм, и эта линия крысы, как было показано, подвержена преждевременной смерти из-за проблем со здоровьем, таких как хронические заболевания почек, гипертония и иммуносупрессия [100].
В прошлом году сообщалось о двух дополнительных трансгенных крысах APP [101]. Эти линии были получены путем лентивирусной векторной инфекции зиготов Фишера 344. Полученные трансгенные линии крыс, APP21 и APP31, экспрессируют человеческую APP двойную мутантную конструкцию, содержащую мутанты AD из Швеции и Индианы, приводимые в действие промотором ubiquitin-C. Сообщается, что трансген APP экспрессируется в мозге, в нейронных, но не глиальных клетках. Патологические или поведенческие исследования еще не опубликованы.
Подобно моделям AD для мыши, трансгенные крысы APP или APP / PS1 не показывают NFT. Единственной моделью грызунов с тау-патологией, специально относящейся к AD, является трансгенная крыса, разработанная группой Новака [102]. В отличие от многих моделей мышиного тау, которые переносят tau мутации, характерные для других заболеваний деменции, чем AD, эта трансгенная крыса выражает усеченную форму белка тау человека (усеченного в положениях аминокислоты 151-391), который находится в мозге спорадических пациентов с АД. Интересно, что усеченный тау индуцирует нейрофибриллярную агрегацию и уменьшает продолжительность жизни животных, не вызывая каких-либо измеримых потерь нейронов в гиппокампе или стволе головного мозга [102, 103]. Это отсутствие потери нейронов может быть объяснено неадекватно долгой продолжительностью жизни животного. Эти трансгенные крысы показывают измененную пространственную навигацию в водном лабиринте Морриса, в то время как спонтанная двигательная активность и беспокойство в открытом поле не затрагиваются. Тем не менее, испытание лучевой ходьбы указывает на развитие прогрессирующих сенсомоторных нарушений, связанных с возрастом животного [104]. Насколько нам известно, интересный крест между этими трансгенными крысами тау и трансгенной крысой APP еще не сделан.
В общем, линии трансгенных крыс APP показывают более низкие уровни экспрессии трансгена APP, чем мышиные AD-модели, и в большинстве случаев только умеренное или отсутствие отложения Aβ в головном мозге, что может указывать на то, что обработка APP под более строгим контролем у крыс по сравнению для мыши, и, возможно, более эффективный клиренс Aβ. Чтобы получить обширные внеклеточные амилоидные отложения в модели крысы, было необходимо введение двух мутантных APP-конструкций и одного мутированного PS1 [97]. Как и у мышей, отложение амилоида, по-видимому, не является необходимым условием нарушения памяти у трансгенных крыс. Как UKUR25, так и двойные трансгенные APP / PS1 [91] и одиночные APP трансгенные линии Tg6590 крысы [93] показывают ухудшение обучения и памяти в отсутствие грубой патологии амилоидов (таблица 1). Даже упомянутая выше тройная трансгенная крыса показывает нарушения памяти до появления амилоидных бляшек [99]. Эти результаты согласуются с растущим представлением о том, что олигомеры Aβ могут быть злодеем в процессе болезни; также растворимый Aβ лучше коррелирует с ухудшением памяти в AD, чем его агрегированные формы [105].
Независимость от деления Aβ и дефицита памяти Aβ была рассмотрена в двух новых моделях крыс AD, в которых вирус-опосредованный перенос генов был использован для индукции экспрессии APP со шведской мутацией или фрагментами Aβ выборочно в гиппокампе взрослых крыс. Гонг и др. [106] продемонстрировали, что шведские мутированные APP трансфецированные крысы, демонстрирующие иммунореактивность Aβ42 в непосредственной близости к местам инъекции, но без бляшек или признаков нейротоксичности до 15 месяцев после трансфекции, нарушали удержание памяти в пробной фазе задачи Морского водного лабиринта. В другой вирально индуцированной модели крысы кДНК, кодирующие слияние между человеческим Aβ40 или Aβ42 и белком BRI, который участвует в отложении амилоида в британской и датской семейной деменции, были введены в гиппокамп взрослых животных [107]. Только введенные животные BRI-Aβ42 показали диффузные структуры, подобные бляшке, в гиппокампе через 3 месяца после инфузии, но не выявили ухудшения в тестах на открытом поле или в лабиринте воды. С другой стороны, животные, введенные как BRI-Aβ42, так и BRI-Aβ40, проявляли умеренные изменения поведения, но не показали внеклеточных отложений Aβ, подтверждающих данные, показывающие, что осаждение Aβ не требуется для поведенческих нарушений в моделях грызунов.
Крыса является одним из наиболее часто используемых экспериментальных видов животных в биомедицинских исследованиях, и из-за ее значимости для физиологии человека крыса может обеспечить очень предсказуемые модели исследований и фармацевтической промышленности [108]. Наличие новых генетических исследовательских инструментов у крыс дает значительные успехи в областях, где широко используются крысы. В исследовании AD крыса десятилетиями была очень важной моделью, например, в исследованиях по холинергической дисфункции и нарушениях памяти, которые сыграли решающую роль в разработке препаратов ингибитора холинэстеразы, которые в настоящее время используются. Привлекательность крысы как экспериментальной модели на животных была еще более увеличена за счет наличия данных генома крыс и технологий, позволяющих генетическую манипуляцию у крыс. В последние годы сообщается о нескольких трансгенных крысах в качестве моделей для AD и разрабатываются новые модели. Мы считаем, что в ближайшие годы трансгенные крысы станут долгожданным и ценным дополнением к доступным моделям мыши в исследованиях AD.
источник
Автореферат и диссертация по медицине (14.03.03) на тему: Исследование крыс OXYS как модели болезни Альцгеймера. Патогенетические механизмы развития
Автореферат диссертации по медицине на тему Исследование крыс OXYS как модели болезни Альцгеймера. Патогенетические механизмы развития
СТЕФАНОВА Наталья Анатольевна
ИССЛЕДОВАНИЕ КРЫС ОХУв КАК МОДЕЛИ БОЛЕЗНИ АЛЬЦГЕЙМЕРА. ПАТОГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ РАЗВИТИЯ
14.03.03 — патологическая физиология
АВТОРЕФЕРАТ диссертации на соискание ученой степени доктора биологических наук
Работа выполнена в Федеральном государственном бюджетном научном учреждении «Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения Российской академии наук», г. Новосибирск.
доктор биологических наук, профессор,
академик РАН, доктор биологических наук, профессор, научный руководитель ФГБНУ «Научно-исследовательский институт молекулярной биологии и биофизики»
доктор биологических наук ведущий научный сотрудник лаб. функциональной биохимии нервной системы Ф1БУН Институт выси.’ей червной деятельности и нейрофизиологии >.’.Ч
доктор биологических наук главный научный сотрудник лаб. экспериментальных моделей патологии когнитивной деятельности ФГЬНУ «Научно-исследоззтельский институт физиологии и фундаментальней медицины»
Колосова Наталия Гориславовна Ляхович Вячеслав Валентинович
Онуфриев Михаил Валерьевич Лоскутона Лилия Владимировна
Ведущая организации: ГБОУ ВПО Первый Московский государственный медицинский университет имени И.М. Сеченова Министерства здравоохранения Российской Федерации
С диссертацией можно ознакомиться в библиотеке НИИЭКМ и на сайте http://centcrceTn.ru/nauchnaya с1еуа1е1по51/с1158еПасюппу; яоуеЬ’
Ученый секретарь диссертационного совета, д.б.н.
/С&Я-, Пальчикова Наталья Александрозна
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Болезнь Альцгеймера (БА) — самое распространенное нейродегенеративное заболевание, которое становится причиной деменции на фоне атрофнческих изменений мозга и, в конечном счете, смерти в течение 3-9 лет после установления диагноза (0иегйи1Ь, ЬаРег1а, 2010). Эффективных способов профилактики и лечения БА нет, заболеваемость растет по мере увеличения продолжительности жизни и постарения населения развитых и развивающихся стран. По данным ВОЗ, в мире более 35 миллионов человек страдают БА, а к 2050 году, по прогнозам, таких больных будет >115 миллионов (Мог1еу е1 а1., 2012). В этой связи исследования фундаментальных механизмов БА и разработка основанных на их знании способов профилактики и лечения заболевания приобрели особую актуальность.
Согласно доминирующей гипотезе «амилоидного каскада» центральным событием в патогенезе БА становится накопление нейротоксических форм пептида: амилоида-р (АР), приводящее к образованию амилоидных бляшек, гиперфосфорилированию тау-белка и формированию нейрофибриллярных клубков, синаптической недостаточности, гибели нейронов, воспалению, митохондриальной дисфункции и окислительному стрессу (Мог1еу е1 а1., 2012). Однако в последние годы растет количество аргументов в пользу того, что в патогенезе наиболее распространенной спорадической формы БА (-95% всех случаев заболевания) гиперпродукция АР не выступает в роли инициирующего фактора (Кге^с, Кпиеве1, 2013). Более того, приводятся убедительные доказательства того, что механизмы патогенеза ранней — наследственной формы — и поздней — спорадической формы БА -могут быть различными (51ипоЬага е1 а1., 2014). Так, если причиной токсического накопления Ар в мозге больных наследственной формой, БА становится нарушение процессинга белка предшественника амилоида-р (АРР), то у больных спорадической формой БА накопление Ар может быть опосредовано синаптическими процессами.
Механизмы старения и патогенез нейродегенеративных заболеваний, в том числе БА, тесно связаны с митохондриальной дисфункцией и окислительным стрессом —, нарушением баланса в системах генерации и детоксикации активных форм кислорода (АФК). Более того, дисфункция митохондрий рассматривается как один из ключевых, факторов, инициирующих развитие БА. Согласно гипотезе «мигохондриального каскада» (8\уеп11о\у, КаЬп, 2004), снижение синтеза АТФ и окислительный стресс приводят к чрезмерной продукции АР, который, в свою очередь, может напрямую оказывать токсическое действие на митохондрии, усугубляя нейродегенеративные процессы. Запуск «порочного круга» нейродегенерации приводит к гиперфосфорилированию тау-белка, дисфункции синапсов, воспалению, апоптозу и становится маркерным, финальным событием в патогенезе БА.
Снижение клеточных функций при старении и развитии БА сопряжено с изменением экспрессии многочисленных генов. Обнаружение мутаций генов АРР, РЯЕЫ! и Р5£Л’2 определило значительный успех в изучении патогенеза наследственной формы БА, на которую приходится около 5% всех случаев заболевания. Несмотря на выявленные ассоциации с полиморфизмами в ряде генов, конкретные молекулярно-генетические механизмы развития спорадической формы БА, перехода физиологических возрастных изменений мозга в патологический процесс, остаются не ясными. Такая ситуация обусловлена невозможностью
исследовать эти вопросы на людях, тем более — ранние доклинические стадии развития БД, а также отсутствием адекватных биологических моделей заболевания. Лавинообразно нарастает количество генетических моделей БА, среди которых доминируют моногенные: это или трансгенные, или животные с нокаутом генов, или животные с определенными мутациями. Такой подход приближает к пониманию вклада крнкретногЬ гена в развитие наследственной формы БА, но не воспроизводит все фенотипические проявления спорадической формы БА — комплексного заболевания полигенной природы.
Степень разработанности проблемы. Уникальной генетической моделью преждевременного старения и связанных с ним заболеваний является линия крыс ОХУБ, созданная в ИЦиГ СО РАН селекцией и инбридингом крыс Вистар, чувствительных к катарактогенному эффекту галактозы. В 5-ти первых поколениях развитие катаракты провоцировали нагрузкой галактозой, в дальнейшем отбор вели по ранней спонтанной катаракте, сцепленно с которой животные унаследовали комплекс признаков преждевременного старения, в том числе — ускоренное старение мозга (КоЫоуа с1 а]., 2009; Колосова и др., 2014; ЯГеГапоуа Л а1., 2010). На фенотипическом уровне оно проявляется формированием уже к возрасту 3 мес. пассивного типа поведения, повышенной тревожности, нарушением способности к обучению на фоне нейродегенеративных изменений, выявленных методами магниторезонансной томографии (Колосова и др., 2011). О снижении когнитивных функций у молодых крыс . ОХУЭ свидетельствует и нарушение формирования длительной лосттетанической потенциации (Береговой и др., 2011). Механизмы ускоренного старения мозга крыс ОХУБ остаются неясными, но комплексное проявление признаков преждевременного старения и развитие возрйстзависимых заболеваний уже в молодом возрасте предполагает общие молекулярно-генетические основы. Методом С?ТЬ-анализа были выявлены локусы, ассоциированные с развитием у крыс ОХУБ катаракты, ретинопатии и особенностей поведения (КогЬоНпа е1 а1., 2012). Функциональная аннотация локусов выявила «обогащение» района генами, связанными с нейродегенерацией, в том числе — с метаболическим путем БА. Это обстоятельство наряду с характерными для крыс ОХУЯ фенотип ическими проявлениями послужило основанием для изучения в настоящей работе механизмов ускоренного старения мозга этих животных и анализа возможной их связи с патогенезом БА. Их знание является необходимым условием доказательства соответствия линии критериям модели спорадической формы БА и перспективности ее использования для исследования патогенеза заболевания и поиска новых терапевтических мишеней для профилактики БА. Как перспективный нейропротектор, потенциально способный влиять на «горячие точки» патогенеза БА, нами был исследован антиоксидант пластохинонил-децил-трифенилфосфоний (БкСМ, «ионы Скулачева»), эффективность которого доказана в профилактике и лечении целого ряда ассоциированных со старением заболеваний (Бакеева и др., 2008; Нероев и др, 2008-Уаув (й а1., 2014).
Цель исследования — изучить механизмы ускоренного старения мозга крыс ОХУ5, их возможную связь с патогенезом болезни Альцгеймера и оценить эффекты антиоксиданта вкС?! на некоторые функции мозга у этих животных.
Для достижения цели исследования были поставлены следующие задачи:
1. Изучить связь манифестации фенотипических проявлений ускоренного старения мозга крыс ОХУв (поведенческих, нарушения способности к обучению и
памяти) с изменениями структурно-функциональных параметров пирамидных нейронов и синапсов гиипокампа и префронтальной коры головного мозга. ,
2. Определить уровень и локализацию маркеров болезни Альцгеймера в гиппокампе и префронтальной коре крыс ОХУБ и Вистар (контроль) разного возраста: Ар пептида, его предшественника белка АРР, тау-белка и его фосфорилированной формы.
3. Провести сравнительное ультраструкгурное исследование гиппокампа.крыс ОХУЯ и Вистар разного возраста, определить активность цитохром с оксидазы как маркера активности IV комплекса дыхательной цепи для оценки вклада изменений структурно-функционального состояния митохондрий мозга в развитие нейродегенеративных изменений.
4. Исследовать методом массового параллельного секвенирования (RNA-seq) изменения транскриптома префронтальной коры мозга крыс ОХУЭ и Вистар с возрастом и определить межлинейные различия в экспрессии генов.
5. Провести функциональную аннотацию дифференциально экспрессирующихся генов и выявить вероятные метаболические пути, с изменениями которых ассоциировано ускоренное старение мозга крыс ОХУБ. , .
6. Исследовать влияние приема антиоксиданта 8кС>1 на развитие и прогрессию, нейродегенеративных процессов у крыс ОХУБ.
Научная новизна. Впервые установлено, что ускоренное старение мозга крыс ОХУв ассоциировано с развитием ключевых патогенетических и «клинических» признаков спорадической формы Б А. Показано, что формирование пассивного типа поведения, повышенной тревожности и снижение способности, к обучению у крыс ОХУБ к возрасту 3-4 мес. по времени совпадает с развитием в гиппокампе и префронтальной коре деструктивных изменений нейронов, синаптической . недостаточности, дисфункции митохондрий и гиперфосфорилирования тау-белка. , Нарушения поведения и когнитивных способностей у крыс ОХУв с возрастом усиливаются на фоне прогрессии деструктивных изменений нейронов и их гибели, снижения плотности синапсов и активных зон их контактов, дисфункции митохондрий, гиперфосфорилирования тау-белка, повышения к возрасту 12 мес. уровня АРиз в гиппокампе и префронтальной коре и образования амилоидных бляшек в мозге. При этом усиленное накопление Ар в мозге с возрастом становится, вторичным событием при развитии у крыс ОХУв признаков БА.
Впервые методом массового параллельного секвенирования (1ША-5еч) исследован профиль экспрессии генов в префронтальной коре крыс ОХУв., На основании сравнения транскриптома коры мозга крыс Вистар и ОХУБ разного возраста определены гены, экспрессия которых изменяется с возрастом и при . развитии признаков БА у крыс ОХУв. Установлено, что развитие признаков БА у. крыс ОХУБ происходит на фоне изменения уровня мРНК более 900; генов, их прогрессия — более 2000 генов, основная часть которых связана с нейрональной пластичностью, фосфорилированием белка, Са2* гомеостазом, гипоксией, иммунными процессами и апоптозом. С возрастом в префронтальной коре крыс Вистар изменяется экспрессия 499 генов, в то время как у крыс ОХУ8 — более чем 5500 генов, включая 333 гена, общих для крыс ОХУБ и Вистар. Функциональная. аннотация изменения экспрессии генов в префронтальной коре крыс ОХУв с возрастом выявила их «обогащение» 85 генами из метаболического пути БА, связанными с процессингом
АРР, агрегацией и деградацией Ар, регуляцией тау-белка, функциями митохондрий, синаптическими процессами.
Впервые установлено, что способность антиоксиданта SkQl не только предупреждать и замедлять формирование фенотипических проявлений ускоренного старения мозга (нарушения поведения и снижение когнитивных функций), но и снижать их выраженность на стадии активной прогрессии у крыс OXYS связана с его влиянием на ключевые признаки БА. Показано, что SkQl предупреждает и/или замедляет деструктивные изменения нейронов, снижение плотности синапсов, гиперфосфорилирование тау-белка и усиленное накопление Ар в мозге крыс OXYS, существенно улучшая структурно-функциональные параметры митохондрий.
Теоретическая и практическая значимость работы определяется доказательством соответствия линии крыс OXYS критериям модели спорадической формы болезни Апьцгеймера, возможности её использования для исследования этиологии и патогенеза связанных с заболеванием нейродегенеративных процессов, в том числе на ранних доклинических стадиях их развития, а также для корректной оценки эффективности терапевтических воздействий, направленных на лечение и профилактику возрастных нарушений функций мозга и развития БА. Выявленные в работе эффекты SkQl на крысах OXYS и Вистар демонстрируют высокий нейропротекгорный потенциал антиоксиданта, перспективность его использования в профилактике старения мозга и развития характерных для болезни Апьцгеймера нейродегенеративных процессов.
Положения, выносимые на защиту:
1. Линия крыс OXYS соответствует основным критериям модели спорадической формы болезни Апьцгеймера и может быть рекомендована для исследований этиологии и патогенеза этого заболевания, а также для изучения эффективности терапевтических воздействий, направленных на его лечение и профилактику.
2. Развитие патогенетических признаков болезни Апьцгеймера у крыс OXYS происходит на фоне изменения уровня мРНК более 900 генов, их прогрессия — более чем 2000 генов, основная часть которых связана с нейрональной пластичностью, фосфорилированием белка, Са2+ гомеостазом, гипоксией, иммунными процессами и апоптозом. Как и у людей с болезни Альцгеймера, развитие признаков заболевания у крыс OXYS ассоциировано с изменением в префронтальной коре мозга активности метаболического пути болезни Альцгеймера — экспрессии 85 вовлеченных в него генов.’
3. Антиоксидант SkQl способен замедлять развитие и снижать выраженность ключевых признаков болезни Альцгеймера у крыс OXYS, существенно снижая выраженность деструктивных изменений митохондрий мозга.
Апробация результатов. Результаты, полученные при выполнении диссертационного исследования, представлены и обсуждены на: 2-ой Международной конференции «Homo sapiens liberatus» (Москва, 2015), 9th International Conférence on Bioinformatics of Genome Régulation and Structure/System Biology (BGRS\SB-2014: Новосибирск, 2014), Всероссийской конференции с международным участием «Фундаментальные проблемы геронтологии и гериатрии» (Санкт-Петербург, 2014), llth International Conférence AD/PD (Флоренция, Италия, 2013), FENS Featured Régional Meeting (Прага, Чехия, 2013), FEBS Congress (Санкт-Петербург, 2013), «Фундаментальные науки — медицине» (Новосибирск, 2012, 2013), 2nd international
conference «Genetics of Aging and Longevity» (Москва, 2012), 7-м Сибирском физиологическом съезде (Красноярск, 2012), III съезде геронтологов и гериатров России (Новосибирск, 2012), Ш международной научно-практической конференции «Постгеномные методы анализа в биологии, лабораторной и клинической медицине» (Postgenome-2012: Казань, 2012), 8th FENS Forum of Neuroscience (Барселона, Испания, 2012).
Публикации. По материалам диссертации опубликовано 19 статей в научных журналах, рекомендованных ВАК при Минобрнауки России для публикации результатов диссертационных исследований.
Структура н объем работы. Диссертация состоит из введения, обзора литературы, описания материала и методов, результатов, обсуждения, заключения, выводов и списка цитируемой литературы, содержащей 534 источника (из них 29 отечественных и 505 иностранных). Работа изложена на 262 страницах машинописного текста, содержит 19 таблиц, 59 рисунков и 2 приложения.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена на базе ЦКП «Генофонды экспериментальных животных» ИЦиГ СО РАН на крысах-самцах линий OXYS и Вистар в возрасте от 20 дней до 24 мес. в соответствии с «Правилами проведения работ с использованием лабораторных животных». Профилактический прием SkQl (250 нмоль/кг массы тела 6 раз в неделю) оценивали на крысах OXYS и Вистар (п=30) с возраста 1,5 до 23 мес. В 3 мес. исследовали поведение, а в 4 мес. часть крыс (п=15) — забита для гистологических и молекулярных исследований. В 13-15 мес. оценивали поведение крыс. В 23 мес. оставшиеся крысы (п=12-15) забиты для молекулярных исследований. Лечебный прием (250 нмоль/кг 6 раз в неделю) оценивали на крысах OXYS и Вистар (п=20-25) с возраста 12 до 18 мес.
Исследование поведения крыс проводили в стандартных тестах «открытое поле» и «приподнятый крестообразный лабиринт» (моторно-исследовательская активность, тревожность), «восьмирукавный радиальный лабиринт» и водный тест Морриса (способность к обучению, память).
Методы гистологического исследования. Мозг фиксировали в 10% р-ре формалина на фосфатном буфере (PBS), pH 7.4 (24 ч), обезвоживали в спиртах, заливали в парафин. Сагиттальные срезы мозга (5 мкм) окрашивали 0,1% крезиловым фиолетовым. В CAI, САЗ, зубчатой извилине гиппокампа подсчитывали нейроны с очаговым, тотальным хроматолизом, гиперхромные сморщенные нейроны, гиперхромные без сморщивания. Данный фрагмент работы выполнен с участием аспиранта кафедры гистологии, эмбриологии и цитологии ГБОУ ВПО СибГМУ Минздрава России К.Ю. Максимовой.
Методы электронно-микроскопического исследования. Кусочки гиппокампов фиксировали в р-ре параформальдегида (4%) и глютаральдегида (0,5%) на основе 0,2 М какодилатного буфера (pH 7,4); постфиксировали в 2% р-ре четырехокиси осмия на холоде (3 ч), обезвоживали в спиртах, ацетоне, пропиленоксиде и заливали в эпон-812. Полутонкие срезы окрашивали толуидиновым синим. Ультратонкие серебристые и бледно-золотистые срезы наносили на сетки-подложки, контрастировали уранилацетатом и цитратом свинца. С помощью сетки Автандилова определяли удельную площадь органелл в нейронах (в % от общей площади цитоплазмы). Для оценки плотности синапсов (плоских, положительно и отрицательно искривленных,
гипертрофированных и перфорированных) фотографировали по 15 полей зрения (50 мк м2) пирамидного слоя CAI поля с 5 срезов. Разделяли синапсы по длине активной зоны контакта на очень мелкие (100-200 нм), мелкие (200-300 нм), средние (300-500 нм), крупные (500-700 нм) и очень крупные (> 700 нм). Данный фрагмент работы выполнен с участием аспиранта кафедры гистологии, эмбриологии и цитологии ГЪОУ ВПО СибГМУ Минздрава России К.Ю. Максимовой и ведущего научного сотрудника лаборатории морфологии и функции клеточных структур ИЦиГ СО РАН к.б.н. Е.В. Киселевой.
Иммуногистохимические методы. Мозг фиксировали в 4% параформальдегиде на PBS, pH 7.4 (48 ч), затем — в 30% р-ре сахарозы (
48 ч) при 4°С и хранили при -80°С. Сагиттальные срезы мозга (20 цш) изготавливали в криостате при -20°С. Срезы монтировали на предметные стекла, инкубировали с первичными антителами к Synapsin I, PSD95, Aßl-42, АРР, Tau, Tau [Т181] (Abeam, США) при +4°С (16 ч) и со вторичными антителами (1 ч), промывали в PBS, наносили монтирующую среду с DAPI для окрашивания ядер. Препараты анализировали с помощью оптического микроскопа AXIOPLAN 2 (Zeiss, Германия).
Исследования методами вестерн-блот анализа, дот-блот анализа и нммунно-ферментного анализа. Гиппокампы и префронтальную кору выделяли на льду, хранили при — 80°С. Белок выделяли лизирующим буфером (50 мМ Tris-HCl pH 7.4; 150 мМ NaCl; 1% Triton х-100; 1% Sodium deoxycholate; 0.1% SDS; 1 мМ EDTA, ингибиторы протеаз) в соотношении 1/4. Для саркозил-растворимой и нерастворимой фракций образцы гомогенизировали в буфере (100 мМ MES pH 6.8; 750 мМ NaCl; 1 мМ EGTA; 0,5 мМ MgS04; 1 M дитиотреитола, ингибиторы протеаз), центрифугировали (11000 g, 20 мин). Супернатант центрифугировали (100000 g, 1 ч). Осадок инкубировали в 1% р-ре саркозила (30 мин), центрифугировали (100000 g, 30 мин). Нерастворимый осадок ресуспензировали в буфере для экстракции (10 мМ Tris-HCl pH 7.4; 10% сахарозы; 850 мМ NaCl; 1 мМ EGTA) в соотношении 1/10, центрифугировали (15000 g, 20 мин). Супернатанты инкубировали в 1% р-ре саркозила (1 ч), центрифугировали (100000 g, 45 мин). Осадки (саркозил-нерастворимые белки) ресуспендировали в 50 мМ Tris-HCl pH 7.4. Концентрацию белка определяли по методу Бредфорда. Белки разделяли электрофорезом в 10-12% ПААГ в трис-глициновом буфере (25 мМ Tris, 190 мМ глицин, 0,1% SDS), переносили на нитроцелюлозную мембрану. После блокирования 5% обезжиренным молоком (1 ч), мембраны инкубировали 1 ч с первичными антителами к Synapsin I, PSD95, ßActin (Abeam, США), МОАВ-2 (Millipore, США) или 16 ч — к AßW2, АРР, Tau, Tau [Т181] (Abeam, США) и 30 мин — со вторичными антителами (Abeam, США). Интенсивность свечения оценивали с помощью ImageJ. Содержание Aß оценивали иммуноферментным анализом (ИФА), используя наборы human/rat Aß (1-42) и Aß (140) ELISA kit Wako (Wako, Япония). Данный фрагмент работы выполнен с участием научного сотрудника сектора молекулярных механизмов старения ИЦиГ СО РАН к.б.н. H.A. Муралевой.
Исследование активности фермента цитохром-С оксидазы. Образцы ткани в буфере (250 мМ сахарозы, 1мМ ЭДТА, 70мМ KCl в PBS, ингибиторы протеаз) гомогенизировали, центрифугировали (800 g, 10 мин). Супернатант центрифугировали (15000 g, 20 мин), осадок (митохондриальная фракция) ресуспендировали в буфере (50 мМ Tris pH 7.4, 150 мМ NaCl, 2 мМ EDTA, 0,2% Triton-X, 0,3% NP-40), хранили при -80°С. Активность цитохром с оксидазы определяли набором Complex IV Assay Kit
(Abeam, США) согласно протоколу производителя. Данный фрагмент работы выполнен с участием научного сотрудника сектора молекулярных механизмов старения ИЦиГ СО РАН к.б.н. Н.А. Муралевой.
Исследование методом массового параллельного секвенирования (RNA-seq). RNA-seq проводили на крысах OXYS и Вистар в возрасте 5 и 18 мес. Приготовление кДНК библиотек и секвенирование на платформе Illumina Genome Analyzer Пх проведено в соответствии с протоколами Illumina для RNA-seq (ОАО «Геноаналитика»). Для каждого образца было получено -40 млн прочтений (ридов) длиной 50 пуклеотидов. Риды картировали на референсный геном Rattus norvégiens (версии Rnor_5.0.76) с помощью программы TopHat (v2.0.10) (Trapnell et al., 2012). Функциональную аннотацию групп ДЭГ проводили с помощью Web-инструмента DAVID и WebGestalt при порогах значимости обогащения (EASE) р 1 крыс ОХУ8, как и у контрольных и принимавших его крыс Вистар, процент ошибки достоверно снижался к 2-4 дням обучения. Число входов в рукава -показатель моторно-исследовательской активности — было меньше у крыс ОХУ8 во все дни обучения, а прием 8кС>1 не влиял на него у крыс обеих линий.
Рис. 19. Влияние приема 8кС>1 с 1,5 до 3 мес. на
обучению и память крыс ОХУ8 и Вистар в восьмирукавном радиальном лабиринте. (А)
референтной памяти (%) и (Б) число входов в рукава. * -межлинейные различия.
В водном тесте Морриса 16-мес. крысы ОХУ8 обучались хуже, чем крысы Вистар. В первые три дня на нахождение невидимой платформы — показатель пространственной памяти — крысы ОХУЭ затрачивали больше времени, а на 4-й и 5-й день обучения они уже не отличались от крыс Вистар. вкСН не повлиял на способность к обучению крыс Вистар, которая у них оставалась такой же, как в возрасте 3 мес. 8к(>1 не повлиял значимо и на способность к обучению крыс ОХУв, но на фоне его приема латентный период нахождения ими невидимой платформы достоверно не отличался от такового у крыс Вистар.
Таким образом, профилактический прием 8к ОХУ5 Вистар ОХУБ
Рис. 20. Прием вк01 с 1,5 до 23 мес. замедлил накопление с возрастом АРР и АРм2 в гиппокампе и префронтальной коре крыс ОХУ8 и Вистар. Уровень АРР в гиппокампе (А) и коре (Б) 23-мес. контрольных и получавших БкСН крыс ОХУБ и Вистар (п= 6) по данным вестерн-блот анализа. Уровень А|3|_42 в гиппокампе (В) и коре (Г) 23-мес. контрольных и получавших 8кС)1 крыс ОХУв и Вистар (п= 10) по данным ИФА. # -межлинейные различия, * достоверный эффект препарата.
Таким образом, впервые показана способность БкСН замедлять накопление с возрастом АРР и АР|_42 в мозге крыс как при
«физиологическом» старении крыс
Вистар, так и при развитии признаков БА у крыс ОХУЭ.
Содержание тау-белка и его фосфорилированной формы. Уровень тау-белка и его фосфорилированной формы Т181 (фосфо-Т181) в гиппокампе и префронтальной коре 23-мес. контрольных и принимавших с 1,5 до 23 мес. 8к(31 крыс ОХУ8 и Вистар. Уровень тау-белка и фосфо-Т181 в гиппокампе и коре был выше у крыс ОХУ8. Прием 8кС>1 замедлил повышение с возрастом уровня тау-белка и фосфо-Т181 в гиппокампе и коре только крыс ОХУ8 до уровня у крыс Вистар.
Таким образом, профилактический прием 8к 1 на содержание Армо и АР]^ в гиппокампе и префронтальной коре крыс ОХУв и Вистар. Содержание АР|.40 и АЭ1-42 в гиппокампе и коре крыс ОХУЭ было больше, чем у крыс Вистар (табл. 7). 8ку 1 не влиял на содержание Армо в гиппокампе крыс Вистар и снизил его у крыс ОХУЭ до уровня первых. Содержание Ар,_42 в гиппокампе и коре принимавших 8кС)1 18-месячных крыс Вистар и ОХУ8 было меньше, чем у контрольных крыс соответствующей линии (см. табл. 7). Иммуногистохимческий анализ подтвердил эти результаты: интенсивность сигнала Ар|^2 в гиппокампе принимавших 8кС>1 18-мес. крыс ОХУ8 и Вистар была ниже, чем в контрольных группах.
источник
Фотографии Ильнара Салахиева
Болезнь Альцгеймера не претендует на звание чумы XXI века, тем не менее в мире насчитывается более двадцати пяти миллионов больных. А к середине столетия их число может увеличиться вчетверо. Старший научный сотрудник сектора молекулярных механизмов старения Института цитологии и генетики СО РАН Наталья Стефанова рассказала корреспонденту Сиб.фм о гипотезах развития болезни Альцгеймера, сложностях постановки диагноза, особенностях выведенной модели крыс OXYS, комплексе признаков старческих заболеваний у них и перспективах исследований в этой области.
Несмотря на огромное количество новостей о болезни Альцгеймера, в том числе около- или псевдонаучных, в России ей пока уделяют недостаточное внимание. А количество больных увеличивается с каждым годом. Пока механизмы заболевания до конца не изучены, гипотез появляется много — но это в научных кругах. Если с болезнью сталкиваются родственники, то возникают этические сложности.
Примеров вокруг, оказывается, достаточно, но не все готовы об этом говорить. Что вполне понятно.
Исследования, которые ведутся для поиска причины развития болезни, разработки эффективных методов диагностики на ранних стадиях и лечения, дорогостоящи и трудоёмки. Больше возможностей имеют зарубежные учёные. Но и в Новосибирске есть небольшая группа учёных, которая изучает механизмы развития болезни Альцгеймера на крысах и получает впечатляющие результаты, наравне с коллегами из других стран.
Коллектив сектора молекулярных механизмов старения Института цитологии и генетики СО РАН любит своё дело и своих уникальных крыс.
Это видно по тому, как они ласково называют их «крысиками». Именно «крысики» помогают людям в поисках причин развития болезни Альцгеймера.
О работе сектора рассказала Наталья Стефанова. Её докторская диссертация как раз была посвящена характеристике крыс OXYS как модели болезни Альцгеймера.
Деменция — приобретённое слабоумие: снижение познавательной деятельности, утрата усвоенных знаний и затруднение или невозможность приобретения новых
Болезнь Альцгеймера по сути можно назвать одним из видов старческой деменции. Именно из-за этого сейчас, как и в начале XX века, когда болезнь только установили, иногда возникают сложности с постановкой диагноза?
Да. Немецкий психиатр и невропатолог Алоис Альцгеймер в 1907 году выступил со знаменитой лекцией о том, что у одной из его пациенток развивалась странная форма деменции, которая сопровождалась не только потерей памяти, но и дезориентацией, галлюцинациями, агрессией и в конечном счёте привела к смерти. Постмортальное исследование её мозга показало наличие «особенной субстанции» в виде бляшек и нейрофибриллярных клубков.
Позже по фамилии этого психиатра назвали заболевание, которое развивалось у людей рано — до 65 лет, чаще до 40–50 лет; случаи заболеваемости этой формы деменции были крайне редки. Если люди были старше этого возраста, то говорили просто о старческой деменции. Только в 1976 году из-за сходности клинических и нейропатологических проявлений было предложено объединить эти две формы заболевания в одно и назвать болезнью Альцгеймера, несмотря на возраст больных.
Но всё равно и сейчас из-за сложности диагностирования болезни такой диагноз ставят в редких случаях, наиболее распространено понятие старческой деменции.
Принципиально важно, что в отличие от многих других нейродегенеративных заболеваний, проблемы раннего диагностирования болезни Альцгеймера обусловлены прежде всего сходством проявлений снижения памяти у людей при нормальном старении и при наличии заболевания. Так, незначительные нарушения памяти на недавние события, трудности в запоминании новой информации — это ранние симптоматические проявления болезни Альцгеймера. Прогрессирующее ухудшение памяти, интеллекта в течение последующих лет, протекающие на фоне атрофии мозга, приводят к полному распаду личности и фатальному исходу, как правило, от различного рода осложнений, например, лёгочной пневмонии.
Количество людей с болезнью Альцгеймера с каждым годом растёт, но, к сожалению, пока наука немного отстаёт. Причины заболевания всё ещё не известны, верно?
Да, это самое распространённое нейродегенеративное заболевание в мире. Эффективных способов профилактики и лечения болезни Альцгеймера нет, заболеваемость растёт по мере увеличения продолжительности жизни и старения населения развитых и развивающихся стран. К концу первой декады этого века, по данным ВОЗ, болезнью Альцгеймера в мире болели более 35 миллионов человек, в 2015 году — уже 51 миллион.
И, по прогнозам, к 2050 году количество таких больных удвоится.
66 лет прожил писатель Терри Пратчетт. В 2007 году ему диагностировали редкую форму болезни Альцгеймера — заднюю кортикальную атрофию, от которой он впоследствии и скончался
Механизмы болезни стали исследовать не так давно — в начале 90-х годов, когда были выявлены мутации сначала в одном гене, потом ещё в двух.
Различают две формы заболевания — наследственную и спорадическую. На сегодня известно, что мутации в трёх генах становятся причиной развития наследственной формы. 95 % случаев в мире — это спорадическая форма, а моделей, которые бы позволяли её изучать, нет. Принципиальным фактором риска в таком случае становится пожилой возраст, но причины появления спорадической формы остаются не известны.
Известно, за что отвечают три гена, мутации в которых являются причиной появления наследственной формы болезни?
О накоплении «особенной субстанции» в виде бляшек в мозге, в частности на стенках мозговых сосудов, людей с деменцией было известно с конца 20-х годов XX века, однако вплоть до 80-х неизвестному пептиду отводили лишь роль вторичного продукта при нарушениях функций иммуноглобулинов.
Только в 1984 году было обнаружено, что основными в составе «особенной субстанции» становятся маленькие пептиды.
Учёные предположили, что пептид, названный бета-амилоидом, является продуктом большого белка предшественника, который вскоре был идентифицирован (amyloid precursor protein, АРР).
Было обнаружено, что уровень и молекулярный состав бета-амилоида в мозге людей с болезнью Альцгеймера и когнитивно здоровых людей различен. На основании этого было выдвинуто предположение, что изменение содержания бета-амилоида в мозге может быть ассоциировано с болезнью Альцгеймера. Прорывом в понимании этиологии заболевания явилось использование генетических подходов. В 1991 году было обнаружено, что раннее наследственное развитие болезни Альцгеймера у пациентов из шести семей характеризуется наличием мутации гена на хромосоме 21. Было выявлено, что этот ген кодирует белок АРР, маленькие белки которого (бета-амилоид) составляют основу сенильных бляшек.
Пресенилины — семейство белков, составляющих часть протеазного комплекса γ-секретазы. В геноме позвоночных содержатся два гена, кодирующих пресенилины. Оба гена эволюционно консервативны — отмечены лишь небольшие отличия между пресенилинами крысы и человека
Не менее значительным событием в начале 90-х годов стало обнаружение также у больных с ранним началом наследственной формы заболевания — мутаций в генах, получивших название генов-пресенилинов, PSENs, которые становятся причиной увеличения продукции бета-амилоида и развития болезни. Физиологические функции белка АРР до сих пор остаются недостаточно изученными, однако считается, что он необходим для нормального развития нервной системы млекопитающих, выживания и восстановления нейронов после повреждений. Функции белков пресенилинов в норме и в результате мутаций кодирующих их генов остаются мало изученными.
Мутации в генах изучали на мышах и крысах?
На основании выявленных генетических факторов развития болезни Альцгеймера для раскрытия молекулярно-генетических механизмов заболевания в течение 90-х годов начали интенсивно создаваться линии трансгенных мышей — моделей наследственной формы заболевания с мутациями в трёх генах. У этих животных развивались амилоидные бляшки в мозге, нарастающие с возрастом нарушения поведения и снижение популяции нейронов в гиппокампе. На крысах такие исследования практически не проводились.
Моделей спорадической формы болезни Альцгеймера практически нет, а наша линия крыс именно такая. Это очень важно.
Как была создана линия крыс, с которой вы работаете?
Линию крыс OXYS создали в нашем Институте цитологии и генетики СО РАН. Её история берёт начало в 70-е годы ХХ века, когда у крыс с нормальным темпом старения моделировали наследственную галактоземию. Для этого в пяти первых поколениях развитие катаракты вызывали обогащённой галактозой диетой. В дальнейшем уже без нагрузки галактозой, сыгравшей, по-видимому, роль мутагена, у крыс, помимо катаракты, спонтанно развивались кардиомиопатия, сколиоз, эмфиземы, предраковые состояния и некоторые биохимические признаки галактоземии. Но анализ развития этих признаков был выполнен в основном на фоне нагрузки галактозой в ближайших либо последующих поколениях животных.
Интерес к линии возрос в 90-х, в том числе благодаря тому, что руководителем нашей группы стала Наталия Гориславовна Колосова, и уже под её началом были выявлены нарастающие с возрастом дисфункции митохондрий, которые рассматриваются как одна из наиболее вероятных причин преждевременного старения крыс OXYS. В то же время оказалось, что не все заявленные ранее свойства у крыс OXYS проявляются.
В первый раз крысы-альбиносы попали в лаборатории и были использованы в 1828 году в экспериментах по изучению голодания. Следующие 30 лет крысы участвовали в нескольких других экспериментах и в итоге стали первыми животными, одомашненными исключительно для исследовательских целей
Так, не было обнаружено признаков галактоземии, достаточно поздно развивалась катаракта. Для стабилизации фенотипических признаков нами в 58-м—63-м поколениях крыс OXYS было проведено усиление отбора по признаку ранней спонтанной катаракты, что привело к её развитию уже в молодом возрасте. Результатом усиления отбора явилось устойчивое спонтанное проявление комплекса признаков преждевременного старения в последующих поколениях. Сегодня мы имеем 112-е поколение крыс OXYS.
То есть отбор этой линии ведётся только по катаракте, а вообще у этих крыс развивается целый комплекс старческих заболеваний?
Да, у этих крыс развивается целый комплекс старческих заболеваний: например, помимо катаракты, развиваются ретинопатия, аналогичная возрастной макулярной дегенерации у людей, остеопороз, артериальная гипертензия, ускоренное старение мозга с развитием ключевых признаков болезни Альцгеймера — одно из них. Ещё раз подчеркну: именно спорадическая форма, по которой мы получаем ряд крайне интересных результатов на наших крысах.
Самое интересное: сегодня результаты исследований в мире находят всё больше и больше подтверждений тому, что механизмы наследственной и спорадической форм болезни Альцгеймера развиваются по-разному. Если для наследственной формы инициирующими факторами становятся именно мутации в трёх названных генах, которые приводят к чрезмерной продукции токсических форм бета-амилоида, то у спорадической формы, скорее всего, — нарушение межнейронных взаимоотношений, передача токсических белков от нейрона к нейрону, то есть такое распространение патологии.
Алоис Альцгеймер — немецкий психиатр и невролог, автор множества статей по таким проблемам, как алкогольный психоз, шизофрения, эпилепсия, сифилис мозга, хорея Хантингтона, артериосклеротическая атрофия мозга, пресенильный психоз
В потоке гипотез, публикаций и новостей, связанных с болезнью Альцгеймера, сложно не заблудиться. Это происходит из-за того, что область остаётся до конца не исследованной. Вы постоянно следите за зарубежными исследованиями?
Конечно. Гипотез развития заболевания достаточно много. Зачастую встречаются нетривиальные, неординарные. Я, помню, была на зарубежной конференции в Чехии в 2014 году, на которой выступал докладчик, говоривший не в ключе общего мышления, видения этого заболевания и его развития. Это связано с постепенно прогрессирующим с возрастом снижением функций иммунной системы центральной нервной системы. Он говорил о том, что нейродегенеративные изменения при болезни Альцгеймера являются результатом потери нейропротекторных свойств микроглии — ключевого клеточного элемента иммунной системы мозга.
После моего возвращения мы начали исследовать этот вопрос. Сделали первые наработки: действительно, так оно и есть.
Ваши исследования механизмов болезни Альцгеймера на крысах полезны в первую очередь для какого этапа: диагностики, лечения или предотвращения?
На всех этапах. Конечно же, главная цель — выявление предикторов. Нужно разобраться, что предшествует заболеванию. Болезнь Альцгеймера по сути — спящее заболевание. Некоторые исследователи говорят, что оно появляется раньше — за 10 или даже 20 лет до симптоматики. Кроме того, очень важно диагностирование на самых ранних сроках развития заболевания и способы замедлить или остановить его с помощью эффективной терапии, когда болезнь уже прогрессирует.
Какой предиктор наиболее вероятен, на ваш взгляд?
Линия крыс OXYS отличается преждевременным старением. Для них характерны ускоренная инволюция тимуса, сниженная реактивность клеточного звена иммунной системы, повышенное артериальное давление, раннее развитие остеопороза и изменения в когнитивной и эмоциональной сферах
До того, как мы стали прицельно изучать ускоренное старение мозга на наших крысах, уже было известно, что одним из наиболее ранних событий в развитии их преждевременного старения становится дисфункция митохондрий, которая была обнаружена в сетчатке, мышцах, миокарде. Теперь мы уже знаем, что, конечно же, и в мозге. Cейчас всё больше и больше появляется работ, убедительно доказывающих, что дисфункция митохондрий может становиться одним из ключевых факторов риска развития болезни Альцгеймера, а также ряда других нейродегенеративных заболеваний, что очень важно.
С чем может быть связана дисфункция митохондрий — какие есть версии?
Не знаю. Я могу только предполагать. Когда мы приступили к исследованиям, связанным с болезнью Альцгеймера, работали на взрослых и старых крысах, поскольку главный фактор риска развития этого заболевания — пожилой возраст. В ходе наших исследований было обнаружено, что симптоматическому периоду проявлений признаков болезни Альцгеймера у крыс OXYS предшествуют изменения функций митохондрий.
Поэтому сейчас мы начинаем работать, в том числе, с ранним периодом.
И, кстати, в мире это направление набирает обороты.
Очень многие заболевания связывают с различными неблагоприятными факторами, которые происходили в раннем возрасте, в том числе перенесённые инфекции.
Среди тестируемых вами препаратов есть важные при болезни Альцгеймера?
— На самом деле эффективных препаратов от Альцгеймера собственно и нет.
Но в то же время последние несколько лет мы изучаем мелатонин — препарат «Мелаксен». По мелатонину у нас интересные результаты получаются: действительно работает. Замедляет развитие и прогрессию признаков болезни, в том числе и за счёт восстановления функций митохондрий.
Мелатонин не только при Альцгеймере хорошо себя показал, а также при ретинопатии, возрастной макулярной дегенерации. Большая часть этих данных нами опубликована. Сейчас готовится к публикации ещё ряд интересных результатов.
В исследованиях по катаракте и ретинопатии вы сотрудничаете с офтальмологом, а по болезни Альцгеймера предполагается взаимодействие с кем-то?
Мне бы хотелось, конечно. Особенно хотелось бы иметь доступ к исследованиям на человеческих образцах мозга. К сожалению, в России это слабо развито — во всяком случае, в Сибири. Даже по этическим соображениям: родственники не дают согласия, чтобы образцы мозга умерших с болезнью Альцгеймера использовали в исследованиях.
Плюс ко всему — сложность с диагностированием. До сих пор ставят диагноз «старческая деменция», а 100-процентный диагноз «болезнь Альцгеймера» могут поставить только постмортально — по наличию патоморфологических признаков, если такие исследования будут проводиться.
За рубежом финансирование по нейродегенеративным заболеваниям, особенно по Альцгеймеру, очень мощное, поэтому там активно работают с человеческими образцами. Забор образцов происходит максимально быстро. Всё оперативно, налажено.
Я надеюсь, что и у нас появится возможность проводить клинико-экспериментальные исследования.
Пока у этой группы учёных нет таких возможностей, как у зарубежных коллег, но с ограниченными ресурсами они получают ценные результаты. Учёные делают всё возможное, чтобы понять механизмы развития болезни Альцгеймера и предотвратить её. После интервью Наталья показала нам виварий, в котором содержатся лабораторные крысы.
30 линий мышей, восемь линий крыс и одну линию хомяков использует ИЦиГ СО РАН для лабораторных исследований
В виварии нас встречает бригадир Галина Петрова, которая ухаживает за животными и кормит их.
Самое главное — крыс сфотографировать. Меня не надо, я не фотогеничная, — сразу предупреждает Галина и выбирает модель для нас, рассказывая о крысах с особым трепетом. — Когда глаза закапываем, они ведут себя очень спокойно, уже знают, чего хотим. Крысы очень умные.
Крысы OXYS — небольшие по размеру, — держа в руке одного представителя, говорит Наталья. — Маленькие, деликатные, красивые. Жёлтые метки на шерсти у каждого индивидуальные — это их фамилия, имя и отчество. Чтобы знать и отслеживать, что и как с ними происходило в ходе эксперимента.
Ну что вы одного фотографируете? Давай большого, Наташа, покажем? — спрашивает Галина и достаёт нам более крупную модель.
Ещё нам показывают крыс Вистар, от которых произошла линия крыс OXYS и которых используют в качестве контроля в исследованиях. Они намного крупнее, восьмимесячных самцов Галина сравнивает с кроликами.
У наших крыс в этом возрасте масса меньше на треть — не 600, а 400 граммов, — поясняет Наталья и продолжает. — Галина Николаевна, давай ещё деток покажем, как матери гнёзда делают.
Сейчас не делают — тепло, — поясняет Галина.
— Видите, просто сложила всех в кучу. В клетке здесь папа с мамой и дети. Не будем их пугать.
Новорождённые крысы ещё слепые. Услышав щелчки затвора объектива, мамочка начинает прятать своих детёнышей. Все крысы в виварии — альбиносы: у них красные глаза.
Их кормят специальной едой для грызунов, а мамочек подкармливают кашей.
Я туда творожок кладу, капусту, морковку, пшеничку проращиваю, а основа — это перловая каша, — делится своим рецептом Галина.
Когда проводят эксперименты, — а они могут длиться месяцами — кормить крыс или давать им препараты нужно в определённое время, поэтому сотрудники вивария могут прийти и в восемь вечера, и в выходные дни, и в праздничные. Наверное, эти любовь и забота играют не последнюю роль в научной деятельности, которая приносит хорошие результаты.
источник