Рубрика: Медицина и фармацевтика
Научный журнал «Студенческий форум» выпуск №8(29)
Биохимия болезни Альцгеймера
Болезнь Альцгеймера (болезнь альцгеймеровского типа) является наиболее распространенной формой первичных дегенеративных деменций позднего возраста.
Структура заболеваемости
Возраст, лет
Процент заболевших
К проявлениям данного заболевания относится:
• Больные не могут вспомнить нужное слово и заменяют его другим, не вполне подходящим по смыслу
• Больной не ориентируется на местности, не узнает знакомых, не может определить время по часам
• Больной путается во времени
• Больные теряют способность к самообслуживанию и нуждаются в уходе
Объяснение возможных причин развития Болезни Альцгеймера отражено в трёх гипотезах:
1. Холинергическая гипотеза
Первой мы рассмотрим холинергическую теорию.
Наблюдается корреляция между выраженностью деменции и центральным холинергическим дефицитом — холинергической деафферентацией коры.
Степень холинергического дефицита в корковых отделах связана с уменьшением количества нейронов в базальных отделах головного мозга, где располагаются нейроны, которые продуцируют ацетилхолин.
Помимо ацетилхолинергической системы, некоторые изменения наблюдаются со стороны других нейротрансмиттерных систем, например, сейчас интенсивно изучаются глутаматергические расстройства.
Поддержка этой гипотезы ослабла, так как лекарственные средства, направленные на корректировку дефицита ацетилхолина, имеют слабую эффективность.
Далее остановимся на амилоидной теории.
Более 20 лет основной гипотезой в области исследования болезни Альцгеймера оставалась амилоидная гипотеза.
Аβ образуется из белка АРР (англ. Amyloid precursor protein) путем воздействия двух ферментов β- и γ-секретаз.
Считается, что к избыточному накоплению амилоида приводят ошибки фолдинга. Фолдинг – это процесс самопроизвольного скручивания полипептидной цепи в уникальную нативную пространственную структуру.
Новое исследование, которые было проведено в Калифорнийском университете в Сан-Диего, показывает, что бета-амилоид разрушает один из белков-антиоксидантов и предлагает способ защиты этого белка от повреждающего воздействия амилоида.
Установлено, что бета-амилоид и антиоксидантный фермент каталаза взаимодействуют. Их взаимодействие повреждает каталазу так, что она не становится неспособна выполнять свою физиологическую функцию – разложение перекиси водорода на кислород и воду.
При покрытии амилоида низкомолекулярным соединением, которое предотвращает его взаимодействие с другими белками, активность каталазы восстановилась, и уровень перекиси водорода вернулся к нормальным показателям.
Покрытие, использованное для исследования взаимодействия между амилоидом и каталазой, является кандидатом на роль лекарственного препарата. Это один из классов молекул, разработанных в лаборатории профессора Янга.
Тау-белок – это белок ассоциированный с микротрубочками, функиця которого состоит в стабилизации структур микротрубочек клетки. Синтез его происходит преимущественно в нейронах. При некоторых патологических процессах этот белок может вступать в процессы агрегации. При образовании таких агрегатов нарушается функция нейронов.
Рисунок 1. Структура тау-белка в здоровой и пораженном нейроне
В 17 хромосоме человека содержится ген тау-белка, который содержит 16 экзонов. Из этого следует, что альтернативный сплайсинг способствует образованию изоформ этого белка.
После синтеза молекула белка входит в посттрансляционный процессинг. Фосфорилирование (осуществляемое ферментом киназы гликогенсинтазы 3) в данном процессе благоприятствует взаимодействию тау-белка с тубулином и стабилизации микротрубочек.
Взаимодействия тау-белка и Аβ:
Результаты нового исследования, которые были опубликованы в журнале Neurobiology of Aging, предполагают вероятность того, что патологические формы двух белков, тау-белка и бета-амилоида, которые являются признаками патологии мозга при болезни Альцгеймера – бляшки и нейрофибриллярные клубки – могут действовать совместно, при этом повреждая митохондрии и, следовательно, снижая выживаемость нейронов.
Клетка с поврежденными митохондриями не может продуцировать необходимое количество энергии для поддержания своей жизнедеятельности, не способна поддержать нужный уровень кальция и, как следствие, вырабатывает повышенное количество повреждающих ее молекул-окислителей.
Самые сильные изменения в митохондриях наблюдались, когда бета-амилоид и процессированный тау находились в клетке вместе. В присутствии усеченного тау и бета-амилоида они слипались в частях нейронов и не могли попасть в синапсы, как это должно происходить без патологии.
На основании этих данных можно сделать следующие выводы:
1. Несмотря на огромную работу, проделанную учеными в данном направлении, механизм биохимических процессов болезни Альцгеймера по-прежнему неясен, однако наиболее вероятная теория связана со взаимодействием патологических форм тау-белка и Аβ.
2. Не установлена взаимосвязь между нейродегенеративными изменениями Аβ и гиперфосфорилированными тау-белком, если она имеется.
источник
источник
Если предположение исследователей верно, то амилоидный белок Aβ приобретает очень драматичный ореол: будучи предназначен для защиты нервных клеток от инфекции, при определённых условиях он сам становится хуже любой заразы.
Болезнь Альцгеймера — основную форму старческого слабоумия — связывают с небольшим белком Aβ (β-амилоидом), нерастворимые отложения которого в нервной ткани оказывают разрушительный эффект на высшую нервную деятельность. β-Амилоид образуется вследствие ферментативного расщепления гликопротеина APP, в норме всегда присутствующего в мембранах нейронов и других клеток. Нормальная физиологическая роль ни этого белка, ни его метаболита Aβ до недавнего времени была неизвестна. Исследователи из Массачусетского госпиталя нашли возможную функцию белка Aβ в норме. Обнаружено, что синтетические аналоги Aβ и препараты височной доли мозговой ткани альцгеймеровских больных обладают мощной антимикробной активностью, а животные с нарушенным синтезом Aβ страдают сниженным иммунитетом. Всё это позволяет предположить, что белок Aβ — часть системы врождённого иммунитета в нервной системе человека.
Рисунок 1. Августа Д., пациентка Алоиса Альцгеймера (в честь которого БА получила своё название), 1901 г.
Болезнь Альцгеймера (БА) считается бичом развитых стран, поскольку с увеличением продолжительности жизни вероятность развития этого вида старческой деменции возрастает многократно. Хотя механизм развития заболевания в общих чертах установлен, эффективного лечения, способного противостоять деградации нервной ткани и вследствие этого деградации самой личности больного, пока не существует. Амилоидная гипотеза, объясняющая причины возникновения БА, говорит, что первым этапом развития заболевания является повышенная продукция амилоидного белка Aβ (или β-амилоида), в определённых условиях (прежде всего, в высокой концентрации) претерпевающего конформационную перестройку: в его структуре начинают преобладать β-тяжи (кстати, отсюда и пошло название). «Перерождённый» Aβ, подобно прионам, образует нитевидные амилоидные агрегаты — нерастворимые жёсткие фибриллы больших размеров, обладающие токсическим действием и в прямом смысле разрушающие мозг. Кроме того, амилоидная форма Aβ конвертирует «нормальный» растворимый белок в токсичную конформацию.
Кстати, амилоидная форма Aβ становится токсичной ещё до полимеризации в фибриллы: токсический эффект появляется на стадии сферических агрегатов, построенных уже из «вредных» белковых молекул с повышенным содержанием β-структур [1]. Между прочим, недавно обнаружена прямая связь концентрации белкá Aβ в спинномозговой жидкости с циркадным ритмом и недосыпанием, которое может быть одним из факторов развития болезни Альцгеймера [2].
β-Амилоид образуется в результате протеолитического расщепления предшественника — мембранного гликопротеида APP (также обозначают ПБА — предшественник β-амилоида). В процессе участвуют два фермента — β- и γ-секретазы, — которые «выщепляют» β-амилоид (белок длиной 40 или 42 аминокислотных остатка) из состава предшественника и секретируют его во внеклеточную область. До недавнего времени нормальная физиологическая роль β-амилоида была неизвестна, и его можно было воспринимать как горький молекулярный курьёз, часто приводящий собственный организм к такому тяжёлому последствию, как болезнь Альцгеймера.
Американские исследователи из Массачусетского госпиталя, похоже, наконец-то установили нормальную функцию Aβ: скорее всего, он имеет отношение к врождённому иммунитету [3]. «Многие годы считалось, что β-амилоид — не более чем молекулярный мусор, весьма не безвредный, впрочем. Наши результаты говорят, что этот белок — нормальный компонент системы врождённого иммунитета мозга, — говорит Рудольф Танзи (Rudolph Tanzi), один из авторов работы. — В частности, факторы, „включающие“ врождённый иммунитет — не только инфекция, но и травма или инсульт, — способствуют развитию болезни Альцгеймера и отложению Aβ в мозгу» [4].
Рисунок 2. Интеллектуальная активность, в том числе увлечение игрой в шахматы, и регулярное общение коррелируют со сниженным риском развития болезни Альцгеймера, по данным эпидемиологических исследований, однако причинно-следственная связь пока не доказана
Этому открытию предшествовало наблюдение, что Aβ во многом напоминает антимикробные пептиды (АМП) [5], являющиеся основой врождённого иммунитета большинства многоклеточных организмов, — в частности, пептид LL-37 человека, относящийся к группе кателицидинов. Кроме них, у человека есть ещё две группы АМП, участвующих в формировании врождённого антибактериального иммунитета, — дефензины и гистатины. От антител (лежащих в основе приобретённого, или специфического, иммунитета) их отличает то, что они могут действовать в нервной ткани и в мозгу, куда антитела «не добираются», и защищают человека от, например, менингита и нейрокандидоза. Ещё одна мишень действия этих пептидов — это вирусы и даже раковые клетки.
Схожесть некоторых физико-химических и биологических свойств β-амилоида и пептида LL-37 подтолкнула учёных изучить антимикробную активность Aβ, которой никто ранее не занимался. Результаты превзошли ожидания: синтетические аналоги Aβ40 и Aβ42 ингибировали развитие восьми из 15 исследованных микроорганизмов с активностью, равной или даже превышающей активность LL-37. Среди микроорганизмов, ингибируемых амилоидом, — грибок Candida albicans, кишечная палочка E. coli, три разновидности стафилококка, внутриклеточная паразитическая бактерия листерия и другие.
Чтобы удостовериться в том, что токсичность для бактерий не является следствием реактивов белковой химии, которые могли остаться после очистки белкóв, в следующем эксперименте изучили способность препарата ткани височной доли мозга (а именно там сильнее всего депонируется амилоид) ингибировать рост грибка Candida; в качестве контроля использовали препараты ткани не болевших пациентов того же возраста, а также образцы из других участков мозга, в которых не наблюдается существенных отложений Aβ. (Поскольку исследование проводилось в крупной больнице, недостатка в материале для исследования — мозговой ткани умерших пациентов — не было.) Эксперимент полностью подтвердил гипотезу, и, более того, антитела к β-амилоиду возвращали грибок «к жизни», подтверждая, что это именно белок Aβ ингибировал рост микроорганизмов.
Кроме того, оказалось, что трансгенные мыши с инактивированным геном одной из секретаз, генерирующих белок Aβ, сильнее подвержены влиянию различных патогенов; то же самое можно сказать и про людей, в ходе клинических испытаний получавших препарат, снижающий уровень Aβ42. Кстати, уменьшение концентрации хорошо изученного АМП LL-37 тоже увеличивает заболеваемость, но и чрезмерно высокая его доза не хороша, потому что приводит к отложению бляшек, подобных атеросклеротическим. Склонность к образованию фибрилл, подобных амилоидным, есть и у других АМП: хорошо известный антимикробный белок лактоферрин образует нерастворимые агрегаты при желатинозной дистрофии роговицы.
Изучение действия β-амилоада на бактерии показало, что он связывается с мембранами микроорганизмов, несмотря на то, что, по сравнению с подавляющим большинством АМП, имеет отрицательный, а не положительный заряд, — то есть, одного знака с мембранами бактерий. Возможно, эта на первый взгляд невыгодная организация необходима для преодоления специальных защитных систем бактерий, нейтрализующих катионные (положительно заряженные) пептиды. Ещё одним тяжело объяснимым качеством Aβ является его токсичность по отношению к собственным клеткам, что и приводит в ряде случаев к серьёзным расстройствам. Одно из возможных объяснений этому — что β-амилоид является также «оружием» против раковых клеток своего организма, но, даже если это и так, никаких подробностей процесса пока не известно, так же как и не известно толком, что вызывает повышение его продукции при БА.
Рисунок 3. Чарлтон Хестон и Рональд Рейган на встрече в Белом Доме, 1981 год. Оба к концу жизни заболели болезнью Альцгеймера.
«Необходимо выяснить, что же запускает врождённый иммунитет, к которому принадлежит альцгеймеровский пептид, в пожилом возрасте, и какие гены управляют этими процессами, — говорит Роберт Муар (Robert Moir), другой руководитель исследования. — Если удастся это установить, мы сможем разработать варианты предотвращения этой ненужной активации или даже научиться управлять ей» [4].
источник
Экология потребления. Здоровье: Хотя болезнь Альцгеймера активно исследуют на протяжении многих лет, механизмы ее возникновения остаются неясными.
Хотя болезнь Альцгеймера активно исследуют на протяжении многих лет, механизмы ее возникновения остаются неясными.
Обычно появление основных симптомов болезни связывали с отложениями в головном мозге белка бета-амилоида – так называемыми амилоидными бляшками.
Авторы нового исследования полагают, что ключевую роль играют другие образования, которые обнаруживаются в мозге больных – нейрофибриллярные клубки, состоящие из тау-белка. Хотя пока среди ученых нет единства по поводу сравнительного вклада бета-амилоида и тау-белка в развитие болезни, полученные результаты, возможно, помогут разработке новых препаратов для ее лечения.
Скопления амилоидных бляшек при болезни Альцгеймера были открыты уже довольно давно. Они обнаруживались как при посмертном исследовании мозговой ткани, так и у живых больных – при помощи позитронно-эмиссионной томографии. Для этого в организм вводят радиоактивный изотоп, который образует соединение с интересующим веществом (в данном случае – с бета-амилоидом). Когда скопления целевого вещества оказываются “помечены”, их распределение в организме отслеживают по гамма-квантам, возникающим при позитронном распаде.
Но тут же возникала загадка: медикам было известно немало случаев, когда у пациентов, мозг которых был полон амилоидных бляшек, не было никаких признаков болезни Альцгеймера. Число таких людей в некоторых исследованиях достигало 30 %. Данный факт заставил ученых подозревать, что другая аномальная белковая структура – нейрофибриллярные клубки из тау-белка может быть фактором, важным для развития болезни.
Обычно тау-белок в организме участвует в образовании микротрубочек – важного элемента цитоплазматической структуры клеток. Но у пациентов с болезнью Альцгеймера, а также после черепно-мозговых травм обнаруживаются скопления тау-белка, к молекулам которого присоединено большое количество фосфатных групп. Из-за них белок переходит в нерастворимую форму, и его клубок остается прикрепленным к нейронам головного мозга.
Влияние нейрофибриллярных клубков на здоровье до конца не изучено. До недавнего времени единственным методом исследования, доступным в данном случае, было измерение уровня тау-белка в ткани головного мозга после смерти больного или же у живого пациента в спинномозговой жидкости. Позитронно-эмиссионная томография не могла помочь, так как не располагала радиоизотопами, которые подходили бы для того, чтобы пометить тау-белок в организме.
Теперь эта проблема решена и соответствующие препараты найдены.
Поэтому невролог Бо Ансес (Beau M. Ances) и его коллеги из Университета Вашингтона в Сент-Луисе смогли впервые провести исследование распределения нейрофибриллярных клубков в головном мозге у живых пациентов. Одновременно они использовали и радиопрепарат для отображения бета-амилоида. Таким образом, ученые получили картину одновременного распределения в мозге двух связанных с болезнью Альцгеймера белков.
В исследовании участвовали десять пациентов с легкой степенью болезни Альцгеймера и 36 здоровых. Как показали ученые, чем больше у человека отложений тау-белка в височной доле мозга, тем сильнее у него проявляются нарушения памяти и внимания, характерные для болезни Альцгеймера.
Аналогичного соотношения для бета-амилоида не обнаружилось. Исследователи пришли к выводу, что позитронно-эмиссионную томографию, направленную на обнаружение амилоида, можно использовать для выявления самых ранних стадий болезни Альцгеймера. Тогда как тот же метод, но с использованием веществ, нацеленных на тау-белок, будет эффективен при выявлении перехода от ранних, несимптоматических стадий к легкой степени болезни Альцгеймера.
Бо Ансес подозревает, что решающим в развитии болезни становится совместное влияние на нервную ткань скоплений амилоида и тау-белка. Пока в мозге накапливаются только амилоидные бляшки, он еще в состоянии частично компенсировать их воздействие, но появление нейрофибриллярных клубков становится ключевым фактором, и симптомы болезни начинают нарастать.
Одновременно ученые проверили содержание тау-белка в спинномозговой жидкости участников исследования и обнаружили корреляцию его уровня с количеством тау-белка в височной доли головного мозга. Следовательно, анализ спинномозговой жидкости может служить методом диагностики.
Пока удалось отметить связь уровня тау-белка с симптомами болезни Альцгеймера в один момент времени. Как отмечает, комментируя результаты данного исследования, невропатолог Педро Роза-Нето из Университета Макгилла в Монреале, в будущем еще предстоит определить, существует ли связь изменения содержания тау-белка в мозге с нарастанием симптомов с течением времени. Бо Ансес говорит, что подобные исследования уже ведутся, и выражает надежду, что со временем исследователи смогут определять стратегию лечения болезни Альцгеймера, основываясь на том, какова биохимическая ситуация в мозге пациента в конкретный момент. опубликовано econet.ru
Понравилась статья? Тогда поддержи нас, жми:
источник
В основе болезни Альцгеймера могут лежать изменения лишь в одной аминокислоте небольшого белка Aβ42. К такому выводу пришли ученые из МГУ имени М.В. Ломоносова, Института молекулярной биологии имени В. А. Энгельгардта и Института биофизики клетки, о своих результатах они сообщили на страницах журнала Scientific Reports.
Болезнь Альцгеймера – комплексное нейродегенеративное заболевание, причины которого в большинстве случаев остаются непонятными. Многочисленные исследования показывают, что при болезни Альцгеймера в клетках мозга происходит целый ряд серьезных системных нарушений. В ходе развития заболевания в нейронах появляются токсичные формы небольшого белка бета-амилоида, образующие скопления – амилоидные бляшки. Также в клетках больного формируются нейрофибриллярные клубки, содержащие тау-белок с повышенным уровнем фосфорилирования (присоединения остатков фосфорной кислоты). В результате нарушается нервная проводимость, а нейроны погибают. Этим объясняются симптомы заболевания, главный из которых – расстройство кратковременной памяти.
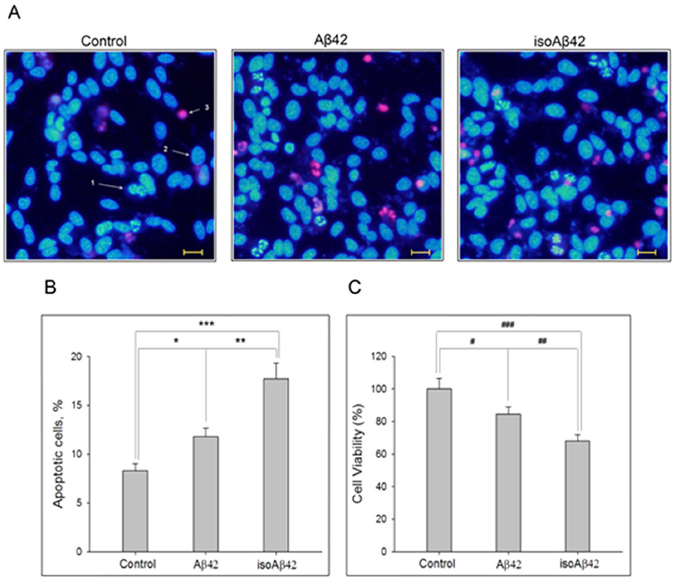
Биологи изучили белок из семейства бета-амилоидов – Aβ42 (буквы – сокращение от «амилоид бета», а 42 – количество аминокислотных остатков – «звеньев» в его цепи). Этот небольшой белок присутствует в нервной ткани здоровых людей, где он участвует в нервной проводимости и регулирует обмен холестерина. Aβ42 может подвергаться ряду химических модификаций, которые могут изменять его свойства. Внимание российских ученых привлекла форма isoAβ42 с изомеризированным остатком аспарагиновой кислоты в положении 7 (изомерами называют химические вещества с тем же количеством атомов разных элементов, но имеющих иную пространственную конфигурацию). Ранее эта же группа ученых показала, что isoAβ42 может выступать в качестве «затравки» для Aβ42, что приводит к образованию амилоидных бляшек.
Ученые из Института молекулярной биологии им. Энгельгардта РАН решили проверить, каким образом эта модификация бета-амилоида влияет на метаболические процессы в клетках. Для этого использовался химически синтезированный isoAβ42. Интактный (то есть нетронутый) белок Aβ42 (без изомеризованного остатка аспарагиновой кислоты) и isoAβ42 добавили к культуре клеток нейробластомы человека SH-SY5Y. Эту клеточную линию ученые получили из опухоли четырехлетней девочки, но уже несколько десятков лет выращивается в лаборатории для изучения нейродегенеративных заболеваний. Третья группа клеток была контрольной, и белков к ней не добавляли.
Через сутки после введения белков часть клеток стала гибнуть путем апоптоза (аналог клеточного «самоубийства»). При этом под действием isoAβ42 клеток погибало в два раза больше, чем под действием Aβ42. Изучив изменения в клеточной культуре, биологи установили, что isoAβ42 также снижает уровень тау-белка в клетках. Кроме того, оказалось, что isoAβ42 резко повышает фосфорилирование тау-белка, тубулинов и матрина-3. Именно чрезмерное фосфорилирование этих белков – характерный признак нервной ткани, пораженной болезнью Альцгеймера. Тау-белок помогает поддерживать стабильность микротрубочек. Микротрубочки играют роль «скелета» клетки, определяя ее механическую устойчивость и форму, а также участвуют в транспорте частиц внутри клетки. Тау-белок с повышенным уровнем фосфорилирования больше не может связываться с микротрубочками, что вызывает нарушения в функционировании клетки.
Таким образом, российские ученые впервые показали, что токсический эффект isoAβ на клеточных культурах нейробластомы человека связан с его способностью вызывать фосфорилирование тау-белка и некоторых других белков в гораздо большей степени, чем обычный Aβ42. Повреждение нейронов белком isoAβ42 похоже на то, которое наблюдается в нейронах пациентов с болезнью Альцгеймера, что свидетельствует о критической роли isoAβ42 в развитии этой патологии.
источник
Сегодня все слышали о болезни Альцгеймера. Однако широкая общественность не всегда хорошо информирована, и болезнь по-прежнему является предметом многих заблуждений. Происхождение, развитие, симптомы, лечение, риски, профилактика…
В этой статье вы найдите всю необходимую информацию, чтобы лучше понять болезнь Альцгеймера.
Болезнь Альцгеймера (также называемый сенильной деменцией альцгеймеровского типа) является нейродегенеративным заболеванием, которое медленно и постепенно разрушает клетки нашего мозга. Его открыл Алоис Альцгеймер, невропатолог, который первым в 1906 году диагностировал это заболевание у одного из своих пациентов.
В настоящее время врачи до сих пор не понимают, как именно и почему развивается болезнь Альцгеймера. Так или иначе, в разных частях мозга повреждаются и гибнут клетки. Повреждения головного мозга содержат аномалии, называемые бета-амилоидными бляшками и нейрофибриллярными клубками (тау-белками).
Гибель клеток головного мозга приводит к деменции у пожилых (слабоумию), характеризующейся потерей памяти, ухудшением интеллектуальных способностей, дезориентацией, изменениями настроения и поведения.
По мере прогрессирования заболевания человек теряет контроль над речью, мочевым пузырем и кишечником. В большинстве случаев пациенты умирают от таких инфекционных заболеваний, как пневмония или других болезней. Большинство людей с Альцгеймером живут примерно 8-10 лет после постановки диагноза, но некоторые из них доживают и до 20 лет.
Каждый случай болезни Альцгеймера затрагивает, по крайней мере, две жизни: жизнь пациента и жизнь супруга или ребенка, которые должны постепенно брать на себя всё бремя пациента по мере прогрессирования заболевания.
Уход за больным сенильной деменцией альцгеймеровского типа очень требователен и отнимает много сил и нервов. В конечном итоге многие лица, осуществляющие уход, вынуждены принять непростое решение поместить своего близкого человека в учреждение по уходу.
В 1906 году Алоис Альцгеймер открыл болезнь, которая теперь носит его имя. Это состояние вызывает постепенное исчезновение нейронов в областях нашего мозга, которые управляют определенными способностями, такими как память, речь, рассудок или внимание.
Исчезнув, нейроны больше не могут эффективно программировать определенное количество действий. Результат: некоторые способности ослабевают и постепенно снижают самостоятельность человека. И если болезнь Альцгеймера чаще встречается у пожилых людей, это не является нормальным следствием старения!
Болезнь Альцгеймера часто ассоциируется с потерей памяти. И действительно, в первую очередь страдают нейроны, расположенные в области гиппокампов, центра памяти. Но это не просто болезнь памяти.
По мере своего развития могут пострадать и другие участки мозга, что усложняет общение, выполнение нескольких действий одновременно и повседневных задач.
Болезнь вызывает два типа повреждения центральной нервной системы:
- Дисфункцию белка, необходимого для нейронов, называемую «тау».
- Появление так называемых «старческих» бляшек связанного с другим белком (бета-амилоидом), который откладывается вне нейронов.
Постепенно эти поражения распространяются и поражают верхние отделы мозга. Болезнь становится все более заметной.
Каждый случай специфичен, поэтому стадии болезни Альцгеймера ощущаются для всех с разной скоростью. Тем не менее, можно выделить три основных этапа при развитии заболевания:
- Легкая стадия: приблизительно 25% гиппокампа уменьшается в объеме, и связь между кратковременной и долговременной памятью становится более сложной. У человека наблюдается легкое забывчивость имен или недавних событий, которые усиливаются с течением времени.
- Умеренная стадия: поражаются другие участки мозга, что вызывает расстройства речи, жестов и распознавания. Человеку нужна помощь в определенных видах деятельности (передвижение, управление бюджетом, оплатой счетов, приготовление пищи…).
- Тяжелый этап: прогрессирование поражений и восстановление информации практически невозможно: прошлые события и информация исчезают из памяти. Человек теряет самостоятельность почти во всех повседневных делах.
«У меня часто бывает потеря памяти, у меня болезнь Альцгеймера?»
Это вопрос, который многие люди задают себе … и ответ – нет!
Иногда забывчивость о встречах, имя коллег или номера телефона является довольно распространенным явлением. При болезни Альцгеймера сочетаются несколько расстройств, такие как расстройства речи, внимания, а также памяти.
«Болезнь Альцгеймера не является наследственной патологией в 99% случаев»
Как уже было упомянуто сегодня точное происхождение заболевания остается малоизвестным, но исследователи выделили обстоятельства, способствующие развитию болезни Альцгеймера. Они связаны с генетической предрасположенностью и множественными факторами окружающей среды, называемыми «факторами риска».
Факторы риска, которые могут привести к заболеванию:
- возраст: страдаю более пожилые люди (в основном старше 65 лет);
- пол: риск развития заболевания выше у женщин после 80 лет;
- предрасположенность к сосудистым заболеваниям;
- черепно-мозговая травма: исследования показали, что люди, перенесшие сотрясение мозга, чаще страдают от данного заболевания;
- сахарный диабет, липидные расстройства, высокое кровяное давление, курение;
- семейный анамнез: заболевание наследственно только в 1% случае.
Однако, даже если ни у кого в вашей семье нет болезни Альцгеймера, у вас она все равно может развиться.
Болезнь Альцгеймера может проявляться у разных людей по-разному. Как и его развитие. Существует много разговоров об изменениях в так называемых когнитивных функциях, включая память, однако эмоции и поведение также могут быть затронуты болезнью.
Слово «когнитивный» является медицинским термином для всего, что относится к интеллекту и познанию.
Конкретно, так называемые когнитивные симптомы связаны с памятью, речью, распознаванием, суждением, рассуждением или пониманием.
Поэтому распространенное заблуждение о том, что болезнь Альцгеймера влияет только на память, ошибочно: оно гораздо шире.
«Память — это первое очевидное расстройство.»
Это первое очевидное расстройство, отсюда и популярность у широкой публики. В начале болезнь затрагивает так называемую эпизодическую память: забывание недавних событий, встреч…
Впоследствии затрагиваются другие типы памяти; рабочая память, семантическая память, процедурная память… Результат: становится трудно сразу сохранить информацию, запоминать новые имена, истории или местность.
Наиболее серьезными, после нарушений памяти, являются речевые расстройства. Они приводят к трудностям в общении и постепенному непониманию сказанного в разговоре.
Речевые расстройства регрессируют в 3 этапа:
- Сокращается словарный запас, человек долго вспоминает слова, использует одно и тоже слово, повторяется.
- Человек произносит только одно слово или издает один звук, или использует жаргон, который не имеет смысла.
- Человек больше не говорит.
Обычные жесты в повседневной жизни становятся трудно выполнимыми. Расстройство начинается со сложных задач, таких как письмо, а затем распространяется на простые задачи, такие как жевание или проглатывание пищи. Именно это расстройство является причиной потери самостоятельности больного человека.
Нарушения распознавания, или “агнозия”, не позволяют больному человеку в полной мере осознать, что перед ним находиться. Эти трудности чаще всего визуальные, но также могут быть связаны с обонянием, слухом и даже осязанием.
Для контроля и выполнения сложных или новых задач необходимы так называемые «исполнительные» функции. Это умение планировать, рассуждать, фокусироваться. С прогрессированием болезни Альцгеймера, эти функции перестают работать.
В результате человек склонен отказываться от сложных задач, таких как управление бюджетом, оплата счетов, организация поездок, встреча с друзьями… В конце, и к неспособности делать две вещи одновременно.
- Человек испытывает необоснованную тревогу или страх. Больной человек выражает новые опасения по поводу вещей, которые его раньше не беспокоили, таких как его финансы или будущее.
- Апатия или потеря мотивации. Человек теряет интерес ко всему или почти ко всему, даже к определенным задачам, которые подпадают под самостоятельность. Эмоции тоже притуплены. Человек становимся более безразличными к тому, что окружает. Это наиболее распространенное эмоциональное расстройство, однако оно часто остается незамеченным, потому что человек изолируется.
- Раздражительность или изменчивое настроение. Это приводит к внезапным истерикам или к вспышкам гнева при задержках или ожиданиях.
- Эйфория или неконтролируемая радость. Счастье без видимой причины является неожиданным, но дестабилизирующим аспектом Альцгеймера. Больной может находить забавные вещи там, где они неуместны.
- Депрессия или мрачные мысли. Иногда это проявляется различными формами: грусть, пессимизм, девальвация… Больной человек обескуражен, плачет, думает, что у него нет будущего, что он является обузой для любимых и близких, и его даже посещают мыли о самоубийстве.
«Такое поведение часто является реакцией страха»
- Агрессия или волнение. Она проявляется в насильственных словах и действиях, отказе от еды, мытье, отхода ко сну ночью… Такое поведение часто является реакцией на страх и непонимание.
- Неадекватное поведение. Под этим мы подразумеваем бродяжество, навязчивую проверку вещей.
- Расстройства сна и питания. Бессонница, инверсия дневного-ночного ритма… Сон часто нарушен. С точки зрения питания, болезнь может привести к потере аппетита, изменению пищевых привычек и, следовательно, к снижению веса.
- Дезингибирование. Человек допускает неподобающее поведение и/или высказывания в обществе.
- Заблуждения и галлюцинации. У больного могут быть бредовые заблуждения, например, что люди хотят его обидеть или похитить. Также могут возникнуть галлюцинации: больной видит, слышит или чувствует то, чего не существует.
Первое, что нужно сделать: проконсультироваться с врачом общей практики и рассказать ему о признаках, которые вы, возможно, заметили. Именно он сможет провести первую оценку ситуации и направить вас к более специализированному врачу.
«Чтобы поставить точный диагноз, используются несколько методов обследования»
Диагностика болезни Альцгеймера является длительным и сложным процессом, особенно из-за прогрессирующего развития симптомов.
Иногда бывает трудно отличить доброкачественное от того, что связано с заболеванием, а затем, на втором этапе, выявить его причину (депрессивный синдром, проблема щитовидной железы или нейродегенеративное заболевание). Этот шаг важен, потому что некоторые причины могут быть излечимы.
Чтобы поставить точный диагноз, используют несколько методов обследования.
Нейропсихологическая оценка:
- Метод: серия тестов, адаптированных под пациента в форме вопросов или простых задач для выполнения.
- Цель: оценить когнитивные расстройства пациента (память, речь, мышление и т. д.) и выявить симптомы как можно скорее.
Визуализация мозга:
- Метод: использование МРТ (магнитно-резонансная томография) или КТ для наблюдения за общим видом и объемом определенных областей мозга.
- Цель: распознать проблемы в определенных частях мозга и отсутствие других заболеваний.
Неврологическое обследование:
- Метод: врач просит пациента выполнить какие либо движения, согнуться, скорчить лицо и т. д.
- Цель: выявить у человека возможные неврологические проблемы влияющие на ходьбу, речь и т. д.
Общая медицинская оценка:
- Метод: полное обследование пациента, включая лабораторные анализы.
- Цель: убедиться, что у пациента нет другого заболевания или состояния головного мозга или нервной системы, которое требует иной терапии.
Пока нет лекарств, которые могли бы вылечить болезнь Альцгеймера. В настоящее время лечение только замедляет прогрессирование заболевания.
Однако для улучшения качества жизни пациентов разработаны различные терапевтические меры, в том числе и препараты улучшающие состояние больных.
На рынке доступно четыре препарата ингибиторов, предназначенных для замедления развития болезни и снижения некоторых поведенческих проблем.
Эффект виден: и родственники, и врачи отмечают «умеренное, но значительное» улучшение повседневной деятельности, речи, рассудка, памяти…
В некоторых случаях наблюдается даже длительное улучшение внимания и самостоятельности!
- Арисепт – ингибитор, применяющийся во время легкой и средней форме болезни. Средство, воздействующее на организм во время сна, употребляется дозой не более 10 миллиграмм. Оно противопоказано страдающим ишемической болезнью сердца, астматикам и язвенникам. Побочными эффектами применения могут быть обморочные состояния, головные боли, головокружения, тошнота, бессонница, диспепсия.
- Реминил – ингибитор общего спектра действия. Применяется для лечения легкой и средней тяжести заболевания. Он предназначен для лечения пациентов с проблемами сосудистой системы и недостаточным кровообращением в центральном нервной системе. Средство противопоказано больным почечной недостаточностью, хроническими заболеваниями печени. Побочными эффектами могут быть головокружение, тошнота, снижение массы тела, бессонница, обморочные состояния.
- Экселон – ингибитор, оказывающий блокирующее действие на несколько ацетилхолиновых ферментов, влияющих на развитие слабоумия и потери памяти. Ингибитор предназначен для больных с выраженной степенью деменции. Средство противопоказано больным потерей памяти в юном возрасте, не назначается в комплексе с другими лекарственными средствами. Побочными эффектами являются тошнота, рвота, бессонница, судороги, стенокардия, снижение массы тела, язвенная болезнь желудка, панкреатит.
- Мемантин – средство, предназначенное для лечения тяжелой степени деменции. Лекарство противопоказано беременным и кормящим, а также лицам до 18 лет. Побочными эффектами являются грибковые инфекции, головокружение, сонливость, галлюцинации, тромбоэмболия.
Лекарства ингибиторы делятся на несколько групп в зависимости от действующего вещества. При плохой переносимости или серьезных противопоказаниях препарат сменяется на другой, с группы этого же типа.
Эффект от применения лекарственного средства наступает на 7-8 неделю регулярного приема с нормированной дозой. Если результатов от приема лекарственного средства нет, назначается препарат другой группы.
Передозировка лекарством может привести к:
- инфаркту миокарда;
- эпилептическому припадку;
- бронхоспазмам;
- паркинсонизму;
- моторной дисфункции;
- летальному исходу.
Противопоказания к применению препаратов-ингибиторов:
- хронические, тяжело протекающие заболевания дыхательной системы бронхиальная астма, пневмония, туберкулез);
- эпилептические припадки;
- затруднение проводимости мочевыводящих путей;
- спаечная болезнь кишечника;
- тяжело текущие заболевания сердца.
- По проведенным исследованиям ясно, что побочными эффектами от приема лекарств чаще страдают женщины, нежели мужчины.
- Препараты – ингибиторы имеют больший эффект на ранних стадиях.
- Передозировка препаратами может привести к усугублению течения болезни.
- Регулярный прием ингибиторов может спровоцировать тяжелую форму депрессии.
«Препараты отпускаются по рецепту.»
Потеря памяти, развитие слабоумия, искажение собственного «Я» — это те проблемы, которые больному тяжело перенести в одиночку.
Чтобы оградиться от заболевания рекомендуем следующие меры:
- Соблюдение здорового образа жизни. При нарушениях когнитивных процессов в организме стоит навсегда позабыть о курении, наркотиках, чрезмерном потреблении алкоголя. Пристрастие к алкоголю провоцирует мозговые изменения негативного характера. Извилины мозга сглаживаются, повреждаются мозговые сосуды. При частом курении и употреблении наркотиков сосудистая система органа мышления сжимается, ослабляется активность нервных клеток, воспаляются стволы периферической нервной системы.
- Избегание травм головного мозга. После тяжелых травм образуются белковые бляшки, из-за которых изменяется мышление, деформируется память.
- Правильное питание. Сбалансированный рацион с употреблением в пищу продуктов, обогащенных витаминами и микроэлементами, положительно влияет на организм. Орган мышления человека начинает работать активнее. Происходит это из-за значительного снижения уровня холестерина. Стенки сосудов головного мозга укрепляются, повышается эластичность.
- Активная деятельность мозга. При регулярном чтении, заучивании, изучении языков, разгадывании кроссвордов, вязании и ведении полезного досуга орган мышления находится в процессе постоянной работы, а значит активно кровоснабжается и наполняется кислородом. Как ни странно, меньше шансов заболеть деменцией у людей с наличием высшего образования. Такие личности постоянно питаю свой мозг полезной информацией.
- Занятия спортом. Такие виды активного отдыха как плавание, бег, прогулки пешком нормализуют артериальное давление, психологически разряжают, укрепляют сосудистую систему.
Если болезнь все-таки наступила пожилому человеку противопоказано оставаться в одиночестве. Из-за кратковременных прерываний памяти человек впадает в панику, не имея ответов на элементарные вопросы, кто он и что делать.
Не стоит заводить новые знакомства: нового человека больной не запомнит, а психологическую и эмоциональную нагрузку получит. Вследствие этого могут начаться панические атаки.
Если даже сегодня болезнь Альцгеймера более известна и изучена, многие заблуждения все еще распространены…
- Это естественное следствие старости.
Неправильно! Это очень специфическая болезнь, и сегодня она неизлечима. Это вызывает медленное и постепенное исчезновение нейронов.
- Ей болеют только пожилые люди.
Ложь. Процент больных с возрастом больше, однако заболевание также поражает более 50 000 человек в мире в возрасте до 65 лет!
- Мой член семьи болен, поэтому у меня тоже будет болезнь.
Ложь. Только 1% случаев являются «наследственными», то есть когда заболевание было передано родителями.
- Я решаю кроссворды и судоку каждый день… Я защищен!
Ложь. Хотя они отлично развивают головной мозг, нет ни одно исследование доказывающего, что такие упражнения защищают от болезни Альцгеймера. С другой стороны, они могут замедлить его развитие!
- Близки больного особенно тяжко, потому что больной человек ничего не осознает.
Неправильно! Болезнь прогрессирует, и больные люди часто, по крайней мере, время от времени, осознают потерю памяти и свои неудачи. Это часто вызывает много беспокойства.
- Сегодня это заболевание легко диагностируется.
Ложь. Процесс постановки диагноза сложный и долгий. Врач общей практики, т. е. личный терапевт часто играет важную роль: именно он может обнаружить появление первых признаков.
- В случае болезни Альцгеймера я все равно вылечусь!
Верно/Неверно. На сегодняшний день нет лекарство, способного излечить болезнь! Другие решения в виде лекарств, помогают лишь облегчить определенные симптомы. Наконец, немедикаментозная терапия (психосоциальная помощь) помогает больным адаптироваться к жизни с этой болезнью.
источник