Под деменцией понимают выраженное нарушение когнитивных функций на фоне полного сохранения сознания. Самая частая причина деменции — болезнь Альцгеймера (БА), которой страдают 5% людей в возрасте 70 лет и 20% в возрасте 80 лет. На пациентов с БА приходится 20% госпитализаций в психиатрические стационары.
При МРТ обычно обнаруживают выраженную атрофию коры больших полушарий с расширением борозд и увеличением желудочков. Как показано на рисунке ниже, поражение медиальной височной доли (гиппокампальный комплекс и энторинальная кора) происходит в большей степени, чем других отделов. Первичная чувствительная кора и двигательная кора, а также верхние участки префронтальной коры остаются относительно сохраненными.
При посмертном исследовании коры больших полушарий обнаруживают следующие изменения:
• Массивная гибель пирамидных нейронов.
• Амилоидные бляшки и нейрофибриллярные клубки, преимущественно в гиппокампе и миндалевидном теле. Бляшки начинают скапливаться в стенках мелких кровеносных сосудов. Их появление можно объяснить разрушением определенного фермента с последующей гиперпродукцией белка β-амилоида. Клубки состоят из скоплений микротрубочек, которые связаны с патологической формой белка, ассоциированного с микротрубочками (θ-белок). Клубки постепенно замещаются амилоидом.
• Гибель более 50% холинергических нейронов базального ядра Мейнерта и области перегородки мозга, а также их волокон, идущих через неокортекс и мезокортекс. Было также показано, что гибель АХ-нервных окончаний провоцирует образование нейрофибриллярных клубков в височной доле.
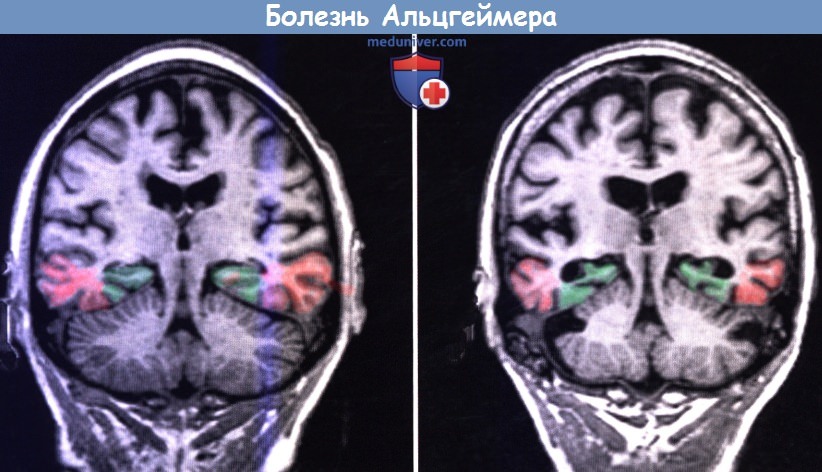
(А) В норме. (Б) Пациент с болезнью Альцгеймера.
Добавлены цвета: зеленый — гиппокамп; красный — энторинальная кора.
При помощи ПЭТ-исследования, направленного на определение скорости метаболизма глюкозы, определяют признаки гипометаболизма. Снижение метаболизма связано с гибелью пирамидных нейронов и (частично) с нарушением холинергической иннервации оставшихся пирамидных клеток. На мембранах здоровых пирамидных нейронов расположены возбуждающие АХ-рецепторы.
Несмотря на то, что процесс гибели нейронов в каждом случае протекает по-разному, чаще всего он начинается в медиальной височной доле, а затем распространяется наверх и вперед. Это может объяснить следующую последовательность развития симптомов.
• Снижение функции гиппокампа. Возникают антероградная амнезия и забывчивость, пациент не может вспомнить о произошедшем с ним событии даже спустя несколько минут (нарушение текущей эпизодической памяти). Пациент перестает ориентироваться на знакомых улицах, совершает опасные ошибки при управлении автомобилем (работа гиппокампа необходима для поддержки чувства пространства, за которое отвечает теменная доля). Нарушается внимание, пациенту становится сложно переключиться с одной задачи на другую.
• Снижение функции затылочно-височной коры. Повреждение поля 37 приводит к неспособности читать и писать. Повреждение височного полюса приводит к развитию крайне неприятного симптома—пациент перестает узнавать лица родственников и друзей. При вовлечении в процесс надкраевой и угловой извилин пациент не может писать.
• Снижение функции лобной коры. Примерно через три года после начала заболевания пациент просто «выпадает» из жизни, он может смотреть в стену и не понимать, что происходит вокруг. Подобное состояние «пустоты» обычно продолжается 5-6 лет до смерти.
Существует также редкий вариант болезни Альцгеймера с ранним началом, который наследуют по аутосомно-доминантному типу. Заболевание обычно возникает в возрасте 30-40 лет. Хромосомный анализ позволил установить, что за развитие болезни отвечает мутация на длинном плече хромосомы 21, которая нарушает действие гена, кодирующего синтез белка-предшественника амилоида. Эту мутация часто также обнаруживают у лиц с синдромом Дауна. У большинства лиц с синдромом Дауна, доживающих до зрелого возраста, развивается болезнь Альцгеймера.
Редактор: Искандер Милевски. Дата публикации: 25.11.2018
источник
При изучении человеческого головного мозга ученые установили, что даже самый мощный компьютер не может сравниться с этой частью человеческого тела. Исследователи обратили особое внимание на небольшую структуру мозга, называемую гиппокампом .
Гиппокамп расположен в нижней средней части мозга, известной как височная доля, с двух стороны. Размер гиппокампа составляет 1/100 размера коры головного мозга и состоит из трех слоев с характерными пирамидальными клетками.
Люди знали о гиппокампе в течение 4-х веков, что делает его одним из наиболее изученных участков головного мозга. Его основные функции включают обучение и память.
В 1950-е годы одному больному с эпилепсией, которому не помогло лечение, решили провести операцию на головном мозге. Часть мозга, которая, казалось, вызывала эпилептические припадки, была удалена. Это были гиппокампы.
Пациент восстановился после операции, но у него появились серьезные проблемы с памятью. Он помнил свое раннее детство, но не мог вспомнить, сколько ему лет. Что еще более важно, он не мог вспомнить новые события или слова. Больной даже забывал, что он недавно говорил. После его смерти в 2008 году ученым удалось значительно расширить понимание памяти и болезни мозга.
Гиппокамп является частью лимбической системы, которая включает в себя область головного мозга, связанную с чувствами и реакцией. Расположенная на периферии коры, лимбическая система включает в себя гипоталамус и миндалину. Эти структуры помогают контролировать различные функции тела, такие как эндокринная система.
Гиппокамп участвует в двух определенных видах памяти: декларативная память и пространственная память.
Декларативная память связана с фактами и событиями. Изучение того, как запоминать речь или линию в игре, является хорошим примером декларативной памяти в действии.
Пространственная память связана с запоминанием маршрута, например, когда водитель такси может помнить маршрут города. Исследователи теперь могут сказать, что пространственная память сохраняется в правом гиппокампе.
Гиппокамп также играет другую важную роль в памяти. Это место, где краткосрочные воспоминания превращаются в долгосрочные, а затем сохраняются в другой области головного мозга. Раньше считалось, что новые нервные клетки развиваются только в эмбрионах или у детей младшего возраста, но новые исследования показали, что нервные клетки развиваются в течение всей взрослой жизни. Гиппокамп является одним из немногих мест в головном мозге, где образуются новые нервные клетки.
При повреждении гиппокампа, вызванного заболеваниями или травмами, у человека могут появиться проблемы с памятью. Они не могут вспомнить недавние события, но помнят о событиях, которые произошли давно.
Транзиторная глобальная амнезия является специфической формой потери памяти, которая развивается внезапно, казалось бы, сама по себе. У большинства пациентов с транзиторной глобальной амнезией память восстанавливается, но исследователям не совсем ясно, почему это происходит.
источник
Опубликовано пт, 02/02/2018 — 10:10
Патология гиппокампа занимает центральное место в патогенезе и патологической анатомии болезни Альцгеймера (AD) и других форм деменции, например, таких, как лобно-височная деменция (FTLD). Исследования, проведенные с помощью аутопсии тканей мозга показали, , что некоторые отделы гиппокампа более уязвимы к патологическим процессам , наблюдающимся при AD и FTLD, в частности subiculum ( основание аммонова рога) и cornu ammonis 1 (CA1) (аммонов рог; cornu ammonis; по имени древнеегипетского бога Аммона, изображавшегося с бараньей головой).
Гиппокамп можно разделить анатомически по-разному. В грубых анатомических терминах можно выделить три области: головку гиппокампа (HH), которая является самой передней его частью, тело (HB) и хвост (HT), а на основании цитоархитектуры гиппокамп можно разделить на субрегионы cornu ammonis (CA1-4), зубчатую извилину (DG) и субикулум. Подразделение из трех частей также возможно с функциональной или молекулярно — генетической точки зрения, согласно которой структуру гиппокампа можно разделить на переднюю, промежуточную и заднюю его секции. Передний гиппокамп связан с регуляцией аффекта, стресса и эмоций, а задняя часть — с когнитивными функциями, такими как память и пространственное обучение. Была идентифицирована промежуточная часть гиппокампа , но ее конкретные функции менее понятны. Каждая часть гиппокампа также имеет свою уникальную «схему подключения». Передний гиппокамп связан с миндалиной и медиальной префронтальной корой, регионами, ответственными за генерацию и регуляцию эмоционального ответа. Задний гиппокамп имеет связи с подкорковыми ядрами, связанными с пространственным обучением. Однако, в отличие от грубого анатомического деления, это функциональное подразделение не имеет четких границ; вместо этого изменения связи постепенно перемещаются из передней к задней части гиппокампа.
Из-за своей центральной роли в консолидации памяти и эмоциональной обработки информации , ее уязвимости при различных деменциях части ( образования) гиппокампа широко изучались с помощью структурной магнитно-резонансной томографии (MRI). Поскольку патология гиппокампа рассматривается как центральное звено патогенеза болезни Альцгеймера (AD), он также используется в качестве диагностического биомаркера в клинической практике.
При болезни Альцгеймера ( AD) большинство исследований показали снижение объема гиппокампа в субикулуме и CA1. Лобно — височная лобарная деменция (FTLD) с неврологической точки зрения является «зонтичным термином», охватывающим несколько различных патологических процессов, которые приводят к общим клиническим фенотипам. Тем не менее, различные неврологические варианты могут разделяться и некоторыми сайтами патологии гиппокампа, а именно CA1, субикулум и DG ( дентальная извилина).
Клинические критерии FTLD включают в себя три синдрома: лобно-височная деменция (FTD), (прогрессирующая афазия с отсутствием плавности речи) (PNFA) и семантическая деменция (SD). FTD диагностируется в первую очередь на основе раннего снижения ( изменения ) межличностного поведения, раннего эмоционального притупления и ранней утраты понимания или беспокойства по поводу таких изменений. Эта трансформация характера болезни должна быть доминирующей чертой в начале и на протяжении всего ее течения. Диагноз (PNFA) ставится пациентам, которые отличаются «пассивной речью» с аграматизмом (модель упрощенной структуры предложения), фонологическими парафазиями или аномией. Апраксия речи является общей чертой этого синдрома деменции , в то время как словосочетание и соразмерность речи сохраняются здесь на начальном этапе течения болезни. SD, напротив, определяется беглой, но «пустой» спонтанной речью, аномалиями в сочетании слов с нарушением понимания слова и ассоциативной агнозии или просопагнозии. Поверхностная алексия и поверхностная аграфия могут возникать у пациентов, которые используют так называемые «алфавитные сценарии».
Объемные данные показывают атрофию гиппокампа при всех типах деменции с левой стороны, тогда как только два подтипа FTLD (SD и FTD) демоснтрируют атрофию с правой стороны.
С грубой анатомической точки зрения у пациентов с FTD наблюдается атрофия левой передней части головки гиппокампа (HH).
У пациентов с SD наблюдается выраженная атрофическая деформация во всем левом гиппокампе, а у больных с PNFA отмечается деформация в левой HH и HB ( тело гиппокампа). Ранние исследования, посвященные SD показали ограниченную атрофию, особенно в HT. Последние работы продемонстрировали более позднюю патологию гиппокампа при SD, включая левый HT, что могло быть следствием прогрессирования болезни.
Болезнь Альцгеймера (AD), наконец, проявляет более выраженную деформацию левого HB и некоторые небольшие пятна в HH.
Сходство в морфологии гиппокампа между клиническими подтипами FTLD и AD может потенциально быть обусловлено наличием AD-патологии в этих подтипах. PNFA подтип FTLD, который показал наибольшее сходство морфологии гиппокампа с AD. Как AD, так и PNFA показывают деформацию медиальной части HH и боковой части HB. В исследовании клинически диагностированных пациентов с FDLL около 44% случаев FTLD имели патологию, согласующуюся с патологией AD, тогда как это число было намного меньше при SD (10%) и FTD (7%) ( Alladi et al., 2007) . При AD левый гиппокамп проявляет более выраженную патологию, тогда как правый гиппокамп проявляет атрофию в медиальной части головы гиппокампа. Патологические исследования AD свидетельствуют о том, что атрофия начинается в регионе интраминальной области.
источник
Описанный в статье вид деменции — LATE-энцефалопатия — не зря так назван. Он поражает людей в возрасте 80 лет и старше. По предположению ученых, вклад LATE-энцефалопатии в заболеваемость деменцией может быть серьезно недооценен.
Рабочая группа по LATE-энцефалопатии выпустила отчет, в котором обобщила клинические, генетические и нейровизуализационные признаки этой болезни. LATE-энцефалопатия известна с середины 2000-х годов, но только сейчас накопленные сведения позволили с уверенностью выделить ее в отдельное заболевание. В этом материале «Биомолекула» рассказывает о содержании отчета.
LATE-энцефалопатия (limbic-predominant age-related TDP-43 encephalopathy, LATE; связанная с возрастом TDP-43-энцефалопатия с преимущественным поражением гиппокампа) — это поражение головного мозга, связанное с накоплением белка TDP-43 в нейронах и глиальных клетках. В норме этот белок расположен в ядрах клеток. Он регулирует трансляцию и транскрипцию многих белков в центральной нервной системе, в частности, тех, которые вовлечены в процессы аутофагии и очистки клеток от поврежденных элементов. Кроме этого, TDP-43 участвует в организации движения молекул внутри аксона. При LATE-энцефалопатии TDP-43 фосфорилируется, что приводит к образованию агрегатов белка [1]. Массивы измененного белка накапливаются в цитоплазме клеток и начинают нарушать их работу. Кроме этого, скопления протеина обнаруживают при болезни Альцгеймера (БА) [2] и лобно-височной деменции (ЛВД).
Выделение учеными LATE-энцефалопатии в отдельное заболевание стало ответом на сложности, возникшие с БА. Существует доказанная корреляция между когнитивным снижением у пожилых людей и нейродегенеративными изменениями по альцгеймеровскому типу (накоплением бета-амилоида [3] и тау-белка в нервных клетках). Чем сильнее были эти изменения, тем выраженнее нарушались когнитивные функции. При более внимательном взгляде на проблему оказалось, что у людей в возрасте старше 80 лет такая связь прослеживается не настолько явно, и это требовало объяснения. «Альцгемейровские» изменения не соответствовали когнитивному снижению: они оказались менее выраженными, чем ожидалось при таких когнитивных нарушениях. В итоге сложилось впечатление, что параллельно с «альцгеймеровскими» процессами в нервной ткани проходят еще какие-то, но ученые не могли их зафиксировать.
Ответ на вопрос пришел из исследований уже известных неврологических заболеваний — бокового амиотрофического склероза (БАС — заболевания, которым страдал Стивен Хокинг) и ЛВД. В 2006 году описали белок TDP-43, который в фосфорилированном виде играет большую роль в патогенезе этих расстройств [4]. Через год обнаружили, что фосфорилированный TDP-43 накапливается в клетках головного мозга у людей старше 80 лет, которые не страдают ни БАС, ни ЛВД, но при этом обнаруживают клиническую картину деменции, схожую с БА [5]. У таких пациентов значительно ухудшалась память: в первую очередь эпизодическая (кратковременная). Научные наблюдения следующих лет позволили выделить когнитивное снижение при накоплении TDP-43 в отдельное заболевание с рядом специфических черт.
В ходе исследований обнаружили пять генов, которые связаны с возникновением LATE-энцефалопатии. При этом нейродегенеративном заболевании зафиксированы мутации в генах GRN (на 17-й хромосоме) и TMEM106B (на 7-й хромосоме) [6]. Мутации в этих же генах сопровождают лобно-височную деменцию и склероз гиппокампа. О последнем состоянии мы еще поговорим, но сейчас важно обратить внимание на то, что на генетическом уровне существует пересечение между ЛВД и LATE-энцефалопатией. Мы уже знаем, что между ними есть общность в виде отложений фосфорилированного TDP-43, но теперь мы видим и генетическую связь этих заболеваний. Кроме упомянутых двух генов с развитием LATE-энцефалопатии связаны гены ABCC9 (на 12-й хромосоме), KCNMB2 (на 3-й хромосоме) и APOE (на 19-й хромосоме) [6]. Последний хорошо известен тем, что увеличивает риск развития БА.
Основной морфологический субстрат новой деменции — это накопление фосфорилированного TDP-43. Отложение протеина происходит во многих отделах головного мозга. Агрегаты TDP-43 обнаруживают в лимбической системе, обонятельных луковицах, коре головного мозга, базальных ганглиях и стволе (рис. 1) [7].
Рисунок 1. Включения TDP-43 (коричневый цвет) при лобно-височной дегенерации в различных отделах головного мозга. Голубым цветом окрашен коллаген 4-го типа.
На основании материалов вскрытий пациентов с LATE-энцефалопатией ученые выяснили этапность поражения головного мозга при этом расстройстве. На первом этапе изменению подвергаются миндалевидные тела, затем патологический процесс захватывает гиппокамп. Завершающие процессы происходят в средней лобной извилине. Для посмертной диагностики LATE-энцефалопатии рекомендовано проводить иммуногистохимическое исследование тканей из этих трех областей мозга.
Из-за сложностей нейровизуализации заболевание, к сожалению, обнаруживают уже на стадии структурных нарушений в гиппокампе. Способы нейровизуализации, которые широко доступны врачам и ученым, не обладают достаточной чувствительностью для выявления изменений в миндалевидных телах при LATE-энцефалопатии. Поэтому гиппокамп, лучше доступный для визуализации, получил особое внимание специалистов.
Очень важно было найти разницу между изменениями в гиппокампе при LATE-энцефалопатии, при болезни Альцгеймера и при гиппокампальном склерозе как отдельном состоянии.
Склеротические нарушения в структуре гиппокампа — первое обнаруженное, но не единственное отличие LATE-энцефалопатии от БА. Склероз гиппокампа — это потеря нервных клеток в основании гиппокампа и в области CA1 с последующим замещением глиальной тканью (рис. 2). Этот процесс не совпадает по объему с поражением гиппокампа при БА, которое имеет более обширный характер.
Рисунок 2. Анатомия гиппокампа. Гиппокамп — это сложно устроенная часть головного мозга, которая скрыта под толщей больших полушарий. При гиппокампальном склерозе патологический процесс затрагивает основание гиппокампа и область CA1.
Также необходимо отделить нарушения структуры гиппокампа при LATE-энцефалопатии от гиппокампального склероза. Склероз гиппокампа как самостоятельное структурное изменение встречается при эпилепсии, нейроинфекциях и некоторых нейродегенеративных заболеваниях. Существует два принципиальных различия между этими типами изменений гиппокампа:
- Поражение лимбических структур (гиппокампа и миндалевидных тел) при LATE-энцефалопатии происходит в большей степени, чем при гиппокампальном склерозе. При этомчем выраженнее структурные нарушения в миндалевидных телах, тем сильнее когнитивное снижение у пациента [8].
- Поражение гиппокампа, вызванное отложениями фосфорилированного TDP-43, всегда двустороннее, в отличие от гиппокампального склероза, который может быть односторонним.
Самостоятельный гиппокампальный склероз также может сопровождать LATE-энцефалопатию, и в этом случае прогрессирование деменции будет быстрым (рис. 3).
Рисунок 3. TDP-43-протеинопатия, или LATE-энцефалопатия (зеленый круг), и гиппокампальный склероз (розовый круг) — это самостоятельные заболевания. При сочетании этих патологий у пациентов ппоисходит быстрое прогрессирование деменции. Часть случаев LATE-энцефалопатии сопровождается частичным или односторонним гиппокампальным склерозом (розово-зеленая зона на границе розового круга).
Ключевой признак LATE-энцефалопатии — нарушение эпизодической памяти у лиц старше 80 лет. Этот симптом сближает LATE-энцефалопатию с БА, и дифференциальный диагноз между ними — это сложная и не решенная до конца задача. Клинически LATE-энцефалопатия сопровождается преимущественным поражением памяти без нарушений настроения и поведения. Также при LATE-энцефалопатии в отличие от БА не возникает афазии (нарушений речи) и психотических симптомов (бреда и галлюцинаций). В этом свете течение LATE-энцефалопатии можно назвать доброкачественным, хотя сложно использовать это слово в отношении непрерывно прогрессирующего неврологического заболевания, приводящего к потере самостоятельности.
Куда более заметные различия можно обнаружить между LATE-энцефалопатией и лобно-височной деменцией, при которых происходит отложение TDP-43 в нервных клетках. LATE-энцефалопатия начинается в возрасте 80 лет и старше, а ЛВД поражает людей меньшего возраста, иногда даже в 50 лет. Последняя сопровождается эмоциональными изменениями, такими как уплощение эмоций или их огрубление и стереотипизацию. При ЛВД можно обнаружить нарушение социальной дистанции или сексуальную расторможенность. LATE-энцефалопатия не сопровождается подобными симптомами. При ней развивается деменция с преимущественным поражением памяти. Нейровизуализация при LATE-энцефалопатии обнаруживает также поражение лимбической системы мозга, чего не происходит при ЛВД. Лобно-височная деменция, в свою очередь, вызывает более обширные и выраженные изменения в коре головного мозга, чем LATE-энцефалопатия.
Авторы отчета признают, что определение LATE-энцефалопатии как отдельного заболевания — это только начало пути. Впереди еще много исследований, которые должны пролить свет на возникновение и течение заболевания, а также открыть путь к его лечению. Однако признание LATE-энцефалопатии уже дало многое.
Сейчас в клинических исследованиях фиксируют большое количество пациентов пожилого возраста, которые демонстрируют признаки когнитивного снижения с преимущественным поражением памяти и атрофией гиппокампа, но при исследованиях у них не обнаруживают характерный для БА амилоидоз. Доля таких пациентов достигает 15-30% от числа людей, включенных в исследование [9]. Что с ними происходит? Чем они болеют? LATE-энцефалопатия становится ответом на этот вопрос.
Часть случаев деменции, которая диагностирована как проявление БА, может оказаться вызвана совсем не ею, а нейродегенеративным заболеванием, описанным в отчете. Это касается людей в возрасте 80 лет и старше — той возрастной группы, число представителей которой постепенно увеличивается благодаря достижениям медицины. К сожалению, пока не существует достоверных биомаркеров LATE-энцефалопатии за исключением определения отложений TDP-43 в нервных и глиальных клетках. Мы не можем брать биопсию головного мозга у всех пациентов с подозрением на LATE-энцефалопатию. По этой причине придется придумывать пока что-то более безопасное, чем инвазивное вмешательство.
Решением может стать внедрение системы ATN, которая помогает отделить случаи деменции при БА от других деменций с «альцгеймеровской» симптоматикой (рис. 4). При помощи различных способов нейровизуализации мы можем определить, есть ли у пациента бета-амилоид (A) и тау-протеин (Т), а также идет ли в мозге человека процесс нейродегенерации (N).
Рисунок 4. Система ATN для дифференциальной диагностики болезни Альцгеймера и других нейродегенеративных заболеваний у пожилых людей. На панели а видны результаты сканирования мозга при разных методах нейровизуализации у пациентки с подозрением на БА. ПЭТ (позитронно-эмиссионная томография) для выявления бета-амилоида (А) и тау-протеина (Т) не дает положительного результата. МРТ для выявления нейродегенеративного поражения (N) дает положительный результат. В последующем при вскрытии у пациентки диагностирована LATE-энцефалопатия. На панели б мы видим результаты сканирования мозга другого пациента с подтвержденной БА. ПЭТ на бета-амилоид и тау-протеин дает положительный ответ, как и МРТ, нацеленная на поиск нейродегенеративных изменений.
Те случаи, когда есть клиника альцгеймеровской деменции, но структурные и молекулярные изменения не соответствуют ей, формируют пул SNAP (Suspected Non-Alzheimer’s Pathology). Это деменции с патогенезом, отличным от патогенеза БА. Различия в патогенезе требуют разных подходов к лечению заболеваний. В последнее время амилоидная гипотеза БА получает серьезные удары: лекарства, нацеленные на уничтожение бета-амилоида или предотвращение его отложения, не показывают эффективности в клинических исследованиях. Основная причина, которую обсуждают специалисты, заключается в том, что отложение бета-амилоида не причина БА, а сопутствующий процесс. Мы еще не смогли обнаружить основной процесс патогенеза, а значит, не можем в него вмешаться. Описанная LATE-энцефалопатия дает второй, альтернативный ответ на вопрос «Почему при БА не эффективны препараты против амилоида?». Этот ответ звучит следующим образом: возможно, у кого-то из пациентов вовсе не болезнь Альцгеймера, а LATE-энцефалопатия. Если это окажется так, нам нужно будет разрабатывать новые методы лечения, отличные от уже известных способов терапии деменции.
источник
… появление методов нейровизуализации позволило значительно улучшить диагностику заболеваний, приводящих к деменции.
Болезнь Альцгеймера (БА) по мере прогрессирования сопровождается церебральной атрофией (макроскопически размер головного мозга пациента становится меньше), Проявляется это при компьютерной ( КТ ) или магнитно-резонансной томографии ( МРТ ) как увеличение желудочковой системы и борозд полушарий головного мозга. Стандартная МРТ при БА (и др. деменции) обычно использует импульсные последовательности быстрого спинового эха (fast spin echo – FSE) для получения Т1-взвешенных изображений (Т1ВИ) и Т2-взвешенных изображений (Т2ВИ), а также последовательность инверсии-восстановления в модификации FLAIR. Для БА при проведении МРТ с использованием количественной методики (линейные и объемные измерения желудочков, объемные измерения ликворных пространств, серого и белого вещества) характерно уменьшение объема медиальных отделов височных долей, особенно энторинальной коры и гиппокампа ( [. ] уменьшение их объема характерно уже для ранних проявлений БА, но следует помнить, что атрофия гиппокампа хоть и ранний, но не абсолютно специфичный маркер БА). Необходимо изучение динамики этих изменений. Так, например, если через полгода отмечается нарастание церебральной атрофии, включая атрофию височных долей и гиппокампа, то это свидетельствует о прогрессировании БА. [. ] Необходимо помнить, что наружная и внутренняя гидроцефалия как проявление атрофии может быть связана не только с БА, но и с другими дегенеративными заболеваниями позднего возраста, сопровождающимися деменцией (болезнью Пика, болезнью Паркинсона, амилоидной ангиопатией, хореей Генингтона, и др.), а также может быть следствием травмы, лучевой терапии. Кроме того, расширение ликворных пространств наблюдается также при ряде физиологических и патологических процессов (алкоголизме, менингите, голодании) и является обратимым. Запомните : наличие единичных мелких сосудистых очагов или ограниченного перивентрикулярного лейкоареоза не исключает диагноз БА.
Если обычные КТ и МРТ выявляют структурные изменения, характерные для БА только на стадиях продвинутой деменции, функциональные методы могут иметь большее значение для выявления мягких изменений на ранних стадиях заболевания. Функциональные методы так же имеют значение для разграничения БА от сосудистой деменции, лобно-височной деменции, деменции с тельцами Леви или депрессии. Функциональными радиоизотопными методами являются однофотонная эмиссионная компьютерная томография (ОФЭКТ), позитронная эмиссионная томография (ПЭТ), функциональная МРТ (фМРТ), перфузионная МРТ (пМРТ), диффузионно-взвешенная МРТ (двМРТ), МР-спектроскопия (МРс).
ОФЭКТ при исследовании головного мозга используется для оценки регионарного мозгового кровотока. При БА обычно выявляется снижение гемоперфузии в теменно-височной области. Величина гемоперфузии коррелирует с тяжестью когнитивных нарушений. Использование этого метода позволяет повысить точность клинической диагностики БА, и дифференцировать ее от других видов деменции. Снижение перфузии в лобных долях происходит при лобно-височной деменции. При деменции с тельцами Леви гипоперфузия наблюдается в затылочных долях, что отличает ее от БА.
ПЭТ позволяет оценить активность метаболических изменений в тех или иных зонах головного мозга (уровень метаболизма глюкозы в головном мозге после внутривенного введения радиофармпрепарата, обычно флюоро-2-деоксиглюкозы ([ФДГ]), что также важно, поскольку БА сопровождается гибелью нейронов. ПЭТ проводится как в покое, так и при выполнении когнитивных тестов (при исследовании кровотока и метаболизма глюкозы во время выполнения когинитивных тестов было выявлено, что уровень ответа у пациентов с болезнью Альцгеймера ниже, чем у пациентов контрольной группы). По мере прогрессирования заболевания при ПЭТ отмечается нарастание дефекта [снижение уровня] метаболизма в теменно-височных отделах. Величина этого дефекта [снижения] коррелирует со степенью когнитивного снижения. Уровень метаболизма глюкозы в базальных ганглиях, мозжечке, первичной сенсомоторной коре обычно не изменен. ПЭТ может использоваться при дифференциальной диагностике БА с другими видами деменций. Показано, что при лобно-височной деменции снижен уровень метаболизма глюкозы в лобных долях, передних и медиальных отделах височных долей, при деменции с тельцами Леви – в теменных, височных, затылочных долях и мозжечке. У пациентов с депрессией уровень метаболизма глюкозы не изменен. При сосудистой деменции снижение уровня метаболизма глюкозы имеет пятнистый характер. Новые достижения в области ПЭТ позволяют увидеть β-амилоид в головном мозге [. ] .
фМРТ – это мощный исследовательский метод, позволяющий выявлять области нейрональной активации в ответ на действие определенных раздражителей или в момент выполнения когнитивных тестов. При БА методом фМРТ выявляется снижение нейрональной активации в лобных и височных долях. В рутинной работе с пациентами, страдающими нарушениями памяти, этот метод не используется, но он имеет потенциальные возможности при ранней идентификации пациентов с продоромальной деменцией.
пМРТ – это метод МРТ, при котором получение изображений осуществляется при внутривенном введении болюса парамагнитного вещества. Он позволяет измерять несколько гемодинамических параметров, а именно локальный объем кровозаполнения, локальный мозговой кровоток, время распространения контрастного вещества по сосудистой системе. Показано, что измерения кровотока, проводимые при пМРТ, коррелируют с церебральным метаболическим отношением глюкозы, потребляемым по данным ПЭТ при БА, при этом пМРТ дешевле ПЭТ и может быть ему альтернативой.
двМРТ – это метод, чувствительный к микроскопическому движению молекул воды в тканях. При проведении исследовании пыла показана статистически достоверная разница измерений диффузии при БА и в норме в нескольких областях мозга, особенно гиппокампе, поясной извилине, белом веществе височных и теменных долей.
МРс (протонная магнитнорезонансная спектроскопия) дает возможность получить неинвазивно информацию о химическом составе исследуемой ткани. Протонная МРс позволяет in vivo оценить содержание в головном мозге N-ацетиласпартата (NAA), глютамина и глутамата, глицина, холина, креатина и фосфокреатина, липидов, лактата, мио-инозитола. При исследовании пациентов с БА было показано снижение NAA в височных и теменных долях. Уровень метаболитов, таких как мио-инозитол, NAA, креатин, коррелирует с тяжестью деменции.
1. «Болезнь Альцгеймера: диагностические подходы и тактика ведения больных» профессор кафедры нервных болезней Первого МГМУ им. И.М.Сеченова Игорем Владимировичем Дамулиным (журнал «Consilium Medicum» Неврология и ревматология, №02 2012.
2. статья «Магнитно-резонансная томография подкоркового поражения головного мозга при болезни Альцгеймера». Божко О.В., Научный центр психического здоровья РАМН, поликлиника ОАО «Газпром» (статья опубликована в Вестнике Российского Научного Центра Рентгенорадиологии, выпуск №7, 2007).
3. статья «Болезнь Альцгеймера: перспективы диагностики и лечения» Воробьева А.А., Васильев А.В.; Статья опубликована в РМЖ «Неврология. Психиатрия» 12 мая 2009 г., №11
источник
Медиальная временная атрофия — это хорошо зарекомендовавший себя маркер болезни Альцгеймера (AD). Однако из-за нормального изменения размеров медиальных временных структур и изменчивости того, как радиологи интерпретируют изображения, использование клинических данных при установлении наличия патологической атрофии является неточным. Ограничением исследований магнитно-резонансной томографии (МРТ) в AD является диагностическая неопределенность, поскольку она может быть неизвестна, если до или ранние симптоматические субъекты продолжают развиваться, и большинство испытуемых не проходят аутопсийную проверку диагноза. У лиц с риском или из-за риска развития AD из-за полностью проникающих аутосомно-доминантных мутаций в генах PSEN1 и APP диагноз или дальнейшее развитие AD могут быть предсказаны с практически 100-процентной точностью. Мы использовали эту предсказуемость для оценки способности радиологов обнаруживать атрофию гиппокампа (HA) у лиц, предназначенных для развития AD. Корональные T1-взвешенные МРТ-сканирований из 39 человек, страдающих от (n = 4) или риска для наследования (n = 35). Мутации PSEN1 или APP были независимо оценены двумя радиологами и определено наличие или отсутствие НА. Из 39 субъектов 26 были FAD мутационными носителями. Пятнадцать из 28 бессимптомных лиц, подверженных риску, были переносчиками мутаций FAD, и четыре из них были оценены как имеющие атрофию для чувствительности 27% и специфичность 85%. Среди семи умеренно затронутых, но не страдающих депрессией субъектов атрофия была обнаружена у трех, а у четырех сумасшедших субъектов ХА была идентифицирована пополам. Наши результаты показывают, что способность радиологов обнаруживать НА у лиц, у которых диагноз зарождающегося АД определен, является субоптимальной, и необходимы количественные методы МРТ или другие биологические маркеры заболевания.
Прогрессивная атрофия головного мозга и, в частности, медиальная атрофия височной доли, давно признаны характерной для болезни Альцгеймера (AD). Степень такой атрофии может быть тонкой или отсутствующей в начале и особенно при предсимптоматическом заболевании, но увеличивается с тяжести заболевания. Существует значительная межличностная вариация в объеме медиальной структуры височной доли, которая возрастает с возрастом, а достоверность суждения медианного размера височной доли не зависит от наблюдателя [24]. Поэтому клиницисту может быть непросто сделать вывод о том, является ли сканирование мозга с помощью магнитного резонанса (МРТ) данного индивидуума нормальной степенью атрофии или если оно указывает на патологический процесс, такой как AD. Предварительное исследование показало, что визуальное определение атрофии медиальной височной доли у лиц с умеренным когнитивным расстройством независимо предсказало прогрессирование деменции, но между теми, кто прогрессировал, и теми, кто этого не сделал, произошло значительное совпадение [7]. Количественные объемные методы могут быть использованы для дифференциации пациентов с АД от контролей, основанных на размерах медиальной структуры височной доли [6]. Однако такие методы еще не попали в основную клиническую нейрорадиологию, и неврологи обычно зависят от собственных показаний или радиологов, чтобы оценить степень, в которой данный размер мозга представляет патологическую атрофию.
Одна из проблем, связанных с выяснением того, насколько хорошо наблюдаемый размер структур головного мозга, оцененный визуально рентгенологом, связан с клиническим диагнозом в раннем или предсимптоматическом АД, затрудняет определение того, что такое патологический диагноз в каждом случае. Для предсимптоматической популяции субъектам необходимо много лет прослеживать, чтобы определить, кто будет и не будет развиваться клинические симптомы. Даже в установленном AD диагностическая точность может достигать 75% [8], и поэтому, если не получить невропатологическую проверку диагноза, существует некоторая неопределенность в отношении этиологии, лежащей в основе клинических симптомов. В аутосомно-доминантном преобладании AD молодого начала (семейного AD или FAD) из-за мутаций в генах PSEN1 и APP конечное развитие AD может быть предсказано с практически 100-процентной достоверностью. Таким образом, лица, подверженные риску наследования этих мутаций, предоставляют модель, в которой чувствительность радиологической оценки атрофии головного мозга к наличию зарождающегося AD может быть надежно проверена.
В этом исследовании два опытных нейрорадиолога (авторы NS и WP) оценивали T1-взвешенные структурные МРТ-сканирование 39 сумасшедших (n = 4), слабо симптоматических (n = 7) или бессимптомных (n = 28) членов из 13 семей, несущих известных APP (n = 2) или PSEN1 (n = 11). Среди семейств с мутациями PSEN1 был L235V [5], один G206A [2], один S212Y (неопубликованный, новый вариант), а восемь — замена A431E. Подмена A431E в гене PSEN1 представляет собой эффект основателя, происходящий в штате Халиско в Мексике [12, 17]. У двух семейств с мутациями APP оба были замещены V717I, которые были описаны в различных популяциях во всем мире [11]. Хотя изменения S212Y PSEN1 ранее не сообщалось, имеются существенные доказательства его патогенности. Было также продемонстрировано, что один предмет, включенный в это исследование, с ним был клинически затронут деменцией, и ее аналогично затронутый брат (диагноз AD был подтвержден на вскрытии). Кроме того, было обнаружено, что незатронутая старшая сестра не унаследовала его.
Клинический статус определяли с использованием оценки клинической деменции (оценка CDR, 0 = бессимптомная, 0,5 = умеренно симптоматическая, но не сумасшедшая, 1 = умеренно, 2 = умеренно и 3 = сурово сумасшедшая) шкала [10]. Субъекты также прошли всестороннее нейропсихологическое тестирование, и было определено, соответствовали ли они критериям умеренного когнитивного расстройства [13] с использованием ранее опубликованных методов [15]. Все сумасшедшие и слегка симптоматические субъекты были носителями мутаций. Из семи умеренно симптоматических (CDR баллов = 0,5) субъектов, шесть встретились с нейропсихологическими критериями для умеренных когнитивных нарушений. Из 28 бессимптомных (CDR баллов = 0) субъектов 15 переносили патогенные APP или PSEN1 мутации, а остальные 13 пациентов были не мутациями, несущими членов семьи. Один носитель мутации с оценкой CDR 0 соответствовал нейропсихологическим критериям для MCI. Хронологические возрасты варьировались от 19 до 59. Поскольку возраст начала может быть последовательным в семьях с этими генами, для каждого испытуемого был рассчитан возраст семьи, относящийся к возрасту типичного диагноза деменции («относительный возраст»). Относительный возраст варьировался от 35 лет до 18 лет после типичного возраста диагноза деменции в семье.
источник
Несмотря на то что функция памяти не локализована в каком-то определенном участке мозга, некоторые его области играют ключевые роли в функционировании памяти. Главными из них являются гиппокамп и кора височной доли.
Гиппокамп — это важнейший элемент нервной системы (включая префронтальную кору), участвующий в процессах памяти. Неудивительно, что ученые, исследующие умеренные когнитивные нарушения (УКН), в первую очередь обратили внимание на структуру и активность гиппокампа Основной вопрос, которым они задаются, звучит так: повреждается ли гиппокамп при УКН и изменяются ли процессы его функционирования?
Рис. 13. Расположение гиппокампа в мозге
Гиппокамп состоит из миллионов мозговых клеток. МРТ, измеряющая количество серого вещества, может показать нам, существует ли связь между сокращением объема гиппокампа и болезнью Альцгеймера.
Одна недавняя научная работа объединила в себе результаты шести длительных исследований, в рамках которых отслеживалось уменьшение объема гиппокампа у пациентов с умеренными когнитивными нарушениями с течением времени. При этом у кого-то из них развилась болезнь Альцгеймера, а у некоторых нет.
Ученые также обращали внимание на другие структуры мозга, но гиппокамп и окружающая его кора головного мозга оказались единственными областями, демонстрировавшими прямую связь с умеренными когнитивными нарушениями и, позже, с болезнью Альцгеймера.
Таким образом, результаты МРТ позволяют утверждать:
уменьшение объема серого вещества в гиппокампе коррелирует с развитием болезни Альцгеймера спустя несколько лет.
Лондонский институт психиатрии провел исследование с участием 103 пациентов, страдающих УКН. Ученых интересовал не объем гиппокампа, а его форма. Изменения в мозговой ткани, вызываемые болезнью Альцгеймера, влияли на форму гиппокампа, которую измеряла специальная компьютерная программа.
В 80% случаев у пациентов с аномальной формой гиппокампа в течение года развивалась болезнь Альцгеймера.
Помимо серых и белых клеток в нашем мозге существуют и другие виды вещества, играющие важную роль в обмене веществ и передаче нервных стимулов. Магнитно-резонансная спектроскопия (МРС) позволяет ученым измерять концентрацию таких веществ. Вместе с моим коллегой я провел сравнительный анализ результатов всех МРС-исследований с участием пациентов с УКН и их здоровых сверстников. Мы обнаружили, что сокращение объема гиппокампа происходит в связи с потерей материи, отвечающей за эффективный обмен веществ. Как уже говорилось выше, у людей с болезнью Альцгеймера сокращение объема выражено куда более явно.
Другая группа исследователей доказала, что с возрастом в нашем организме замедляется выработка важного нейротрансмиттера — ацетилхолина. Ацетилхолин играет роль не только в процессах запоминания и обучения, но и в активации мышц.
При болезни Альцгеймера нейроны, производящие ацетилхолин, повреждаются, что значительно ухудшает функционирование нейротрансмиттера. Соответственно, лекарства против болезни Альцгеймера должны имитировать свойства ацетилхолина.
Еще одно важное изменение, происходящее со стареющим мозгом, — это формирование «клубков» или «бляшек» в мозговой ткани.
Как можно понять из названий, клубки — это перекрученные нефункциональные транспортные белки (которые выглядят как нити и находятся в нейронах), а бляшки состоят из нерастворимых компонентов белков.
При болезни Альцгеймера такие белки становятся аномальными и повреждают мозг Мы пока не уверены, как именно это происходит, но уже знаем, что наследственность играет в этом определенную роль.
На рисунке внизу показано, как бляшки, клубки и снижение числа нейронов выглядят при здоровом старении, при УКН (предвестнике болезни Альцгеймера) и непосредственно при болезни Альцгеймера.
В мозге здорового молодого человека отсутствуют клубки и бляшки; при нормальном старении их количество немного возрастает; у пациентов с УКН оно увеличивается еще больше, в основном в височной доле; а у пациентов с болезнью Альцгеймера клубки и бляшки распространяются по всему мозгу
Изображение в правом верхнем углу показывает мозг 80-летнего человека, не страдающего от когнитивных расстройств; в левом нижнем — пациента, испытывающего трудности с памятью, но не страдающего деменцией; а в правом нижнем — пациента с деменцией.
Здесь следует отметить следующие особенности.
- Чем сильнее проявляется спад когнитивной функции, тем больше бляшек, клубков и областей с отмирающими нейронами обнаруживается в мозге.
- Бляшки и клубки располагаются по-разному. У человека с УКН сильнее всего страдает гиппокамп, а у пациентов с болезнью Альцгеймера поражается куда большая часть мозга.
- При болезни Альцгеймера часто возникает воспаление мозговой ткани, не характерное для нормального старения.
Логично было бы предположить, что наличие белковых бляшек указывает на снижение когнитивных функций. То есть чем больше бляшек образуется в мозге, тем хуже у человека становятся память и внимание.
Однако здесь стоит задать важный вопрос. Верно ли это только для пациентов с деменцией или также и для людей с другими формами белковых образований, часто встречающихся у вполне здоровых пожилых людей? До последнего времени проблема состояла в том, что определить количество и состав таких образований можно было только в результате вскрытия.
Процесс их формирования нереально было отследить по мере старения человека К счастью, сегодня разработаны специальные технологии сканирования мозга, позволяющие измерить уровень протеиновой аккумуляции. Исследователи из Национального института старения США применили эту технологию для изучения мозга 57 человек в возрасте около 80 лет. Для этих испытуемых также были доступны результаты тестов на когнитивные способности, проведенных одиннадцатью годами ранее.
Исследования показали, что чем старше человек, тем больше белковых образований накапливается в его мозге, и объем таких образований коррелирует со степенью снижения когнитивных способностей за одиннадцать лет.
Исследование доказало, что не только значительное увеличение числа белковых образований (как при болезни Альцгеймера) ведет к ухудшению умственных способностей. Небольшое количество накопленного белка тоже влияет на здоровье, хотя и в меньшей степени. Такая форма может проявляться у здоровых пожилых людей, и, вероятно, именно она ответственна за незначительное ухудшение функций мозга.
В ближайшие несколько лет нейрофизиологи собираются еще тщательнее проанализировать данные исследований мозга. Вопрос в том, целесообразно ли сканировать мозг людей, жалующихся на когнитивные проблемы, чтобы определить, кто из них имеет риск развития деменции.
Если ответ окажется положительным, то врачи смогут выписывать таким пациентам определенные упражнения, процедуры и режимы питания, чтобы предотвратить наступление деменции.
См. в разделе «Библиотека»: Андре Алеман. Мозг на пенсии.
источник
Гиппокамп головного мозга, назван так потому, что его форма отдаленно напоминает форму морского конька. Он отвечает за кодирование долговременных воспоминаний и помогает в пространственной навигации.
Известно, что гиппокамп связан с консолидацией эпизодических воспоминаний, которые являются воспоминаниями о пережитых личностью событиях и связанных с ними эмоциях. В отличие от семантических воспоминаний об абстрактных фактах и их ассоциациях, эпизодические воспоминания могут быть представлены в виде историй.
Гиппокамп также известен как одна из наиболее структурированных и изученных частей мозга, поэтому он был выбран для эмуляции протеза. Хотя точные нейронные алгоритмы не известны, они были смоделированы полностью. Поскольку гиппокамп очень старый, он был значительно оптимизирован эволюцией и в основном одинаков для всех видов млекопитающих. Вот почему удалось спроектировать протез гиппокампа с помощью исчерпывающего исследования гиппокампа крысы, суспендированного в спинномозговой жидкости.
Для навигации гиппокамп содержит «клетки места», которые активируются в зависимости от предполагаемого местоположения животного. Можно привести веские аргументы в пользу того, что эти клетки существуют в гиппокампе, поскольку необходимо использовать память для определения текущего местоположения по более фундаментальным переменным, таким как ориентация и скорость.
Активация этих мест наблюдалась у людей, путешествующих по городам виртуальной реальности. Неповрежденный гиппокамп требуется для многих задач пространственной навигации. Первоначально гиппокамп был неправильно связан с обонянием, которое фактически обрабатывается обонятельной корой.
Гиппокамп — это область мозга, расположенная только под медиальными височными долями и по обе стороны от мозга выше ушей. По форме она похожа на морского конька.
Некоторые исследования также показали, что гиппокамп важен не только для формирования новых воспоминаний, но и для извлечения старых воспоминаний.
Интересно, что гиппокамп на левой стороне часто имеет большую функцию в памяти и языке, чем тот, что находится на правой стороне.
Исследование показало, что одной из первых областей в мозге, пораженной болезнью Альцгеймера, является гиппокамп. Ученые коррелировали атрофию (усадку) областей гиппокампа с наличием болезни Альцгеймера. Атрофия в этой области мозга помогает объяснить, почему одним из ранних симптомов болезни Альцгеймера часто является нарушение памяти, особенно формирование новых воспоминаний.
Атрофия гиппокампа также коррелирует с наличием белка Тау, который накапливается по мере прогрессирования болезни Альцгеймера.
Таким образом, размер и объем гиппокампа явно зависит от болезни Альцгеймера.
Исследования показали, что атрофия гиппокампа также коррелирует со слабым когнитивным нарушением. На самом деле, размер гиппокампа и скорость его усадки, как было показано, позволяют прогнозировать, прогрессирует ли МКН до болезни Альцгеймера или нет.
Меньший объем гиппокампа и более высокая скорость или усадка коррелируют с развитием деменции.
В нескольких исследованиях был измерен объем гиппокампа и проанализировано, как он относится к другим типам деменции. Одна из возможностей заключалась в том, что врачи могли использовать степень атрофии в области гиппокампа, чтобы четко определить, какой тип деменции присутствует.
В одном исследовании, опубликованном в журнале Neurodegenerative Diseases, отмечено, что уменьшенный размер гиппокампа происходит при сосудистой деменции, в том числе.
Второе исследование показало, что уменьшение размера гиппокампа также коррелирует с лобно-височной деменцией.
Однако ученые обнаружили существенную разницу при сравнении деменции тела Леви с болезнью Альцгеймера. Леви деменция показывает гораздо меньшую атрофию областей гиппокампа в головном мозге, которая также совпадает с менее значительным воздействием на память, особенно на ранних стадиях деменции Леви.
источник
Теперь расскажу о том, как проводят диагностику болезни Альцгеймера и как её лечат. На первый взгляд, казалось бы — да какая разница? Особенно если пациента привели, как это чаще всего бывает, уже с заметными нарушениями памяти. Тем не менее, разница есть: например, ряд подходов для лечения той же сосудистой деменции или Корсаковского синдрома будут отличаться.
Итак, что касается диагностики. Есть несколько признаков, которые позволяют сходу исключить болезнь Альцгеймера. Во-первых, это внезапное и резкое начало деменции. При болезни Альцгеймера так не бывает: она начинается постепенно, исподволь, с плавным нарастанием симптоматики. Во-вторых — это если, помимо собственно деменции, есть признаки так называемой очаговой неврологической симптоматики: к примеру, частичный или полный паралич руки и ноги с одной стороны, либо руки с одной и ноги с противоположной, или нарушение походки и координации движений, или выпадение определённых полей зрения — то есть, признаки, говорящие за то, что в мозге имеются довольно чётко очерченные и ограниченные очаги поражения. В-третьих, это появление на ранних этапах заболевания эпиприпадков: это для болезни Альцгеймера также нехарактерно, и надо искать другую причину.
Вы спросите — а какие, собственно, причины вызывают болезнь Альцгеймера? Скажу честно: никто толком пока не знает. Нет, копают, конечно, грызут гранит и гранты, строят теории — но фактов и результатов исследования, которые могли бы позволить свести все предположения воедино и отмести самые бредовые, всё ещё недостаточно. Тем не менее, большинство учёных склоняются к тому, что это заболевание генетически обусловлено. Нет, случаев семейной передачи не так много, менее 10%, но именно такие случаи наиболее злокачественны и съедают человека быстрее. Видимо, там в процесс вовлечено большее количество генов, виновных в развитии болезни. Кстати, таковых пока вывлено четыре. Хотя. есть и доказанные случаи болезни Альцгеймера, при которых у человека не найдено ни одного из этих коварных генов.
Не буду мучить вас подробностями того, что же происходит в ткани мозга — скажу лишь, что там, в этой ткани, нарушается обмен и правильное расщепление предшественника амилоидного белка. И образуются нерастворимые скопления, под микроскопом похожие на бляшки: между клетками мозга, в стенках мелких сосудов. Позже вступает в разрушительную работу другой агент — тау-белок. Он накапливается уже внутри самих нервных клеток и в итоге убивает их. Процесс гибели нервных клеток идёт по всей поверхности коры, но больше всего при нём страдают отделы лобных долей, гиппокамп, а также определённые зоны височных и теменных долей, ответственные за ассоциации.
Что же, собственно, подтверждает диагноз? В той клинической картине, которая видна невооружённым глазом, это несколько обязательных признаков. Во-первых, это собственно наличие деменции или преддеменции — в виде нарушений памяти. Во-вторых, это плавное, постепенно прогрессирующее от того момента, как его заметили, снижение памяти. В-третьих, возраст от сорока до девяноста лет. В-четвёртых, отсутствие связи деменции с другими причинами — травмами, инсультами, алкоголизмом или другими хроническими отравлениями, а также прочими чёткими причинами. В-пятых, это отсутствие нарушений сознания.
Может дополнительно помочь — а кое-кого из вас реально успокоить — исследование памяти у грамотного клинического психолога. Для болезни Альцгеймера на её ранних этапах будут характерны нарушения эпизодической, или же автобиографической, что одно и то же, памяти. Причём эти нарушения не будут исправляться посказками или предоставлением множественного выбора: мол, что я просил вас запомнить — яблоко или грушу?
Теперь об инструментальных методах исследования. Сейчас одним из основных является МРТ, или магнитно-резонансная томография — но томограф должен быть по возможности помощнее. При болезни Альцгеймера МРТ как раз и выдаст картину атрофии коры в лобных, теменных и височных долях, особенно в срединном отделе височной, который называют гиппокампом. Но, как сами понимаете, изменения можно будет увидеть, когда процесс уже начался.
А что насчёт ранней диагностики, ещё до явных симптомов? Почему не используется какой-нибудь скрининг-тест для тотальной проверки всех и вся? Да потому что, к стыду медицины, и не только отечественной, это жутко дорого. Нет, конечно, тесты у клинического психолога смогут выявить характерные нарушения памяти, за которые как раз и отвечает сбой в работе гиппокампа. И это пока лучший вариант ранней диагностики. Но ведь в идеале надо, чтобы найти всё ещё до момента снижения памяти. А это целых два исследования: спинномозговая пункция с взятием на анализ спинномозговой жидкости, чтобы найти там нарушение соотношения амилоида и тау-белка, это позитронно-эмиссионная томография, или ПЭТТ, да не простая, а прицельно отслеживающая накопление бета-амилоида и снижение обмена глюкозы.
Теперь о том, как и чем лечат болезнь Альцгеймера. Вот как раз для неё список основных лекарств невелик, и ограничен он двумя направлениями. В первую очередь — это попытка заставить работать оставшиеся клетки. Здесь на первом месте стоят две группы препаратов. Первая — это те лекарства, которые позволяют поддерживать в головном мозге нужный уровень ацетилхолина, не давая его концентрации сильно падать. Потому что нейрофизиологи заметили довольно чёткую взаимосвязь между низким уровнем этого нейромедиатора (перевожу: посредника в передаче нервных импульсов) и многими симптомами деменции. И выяснилось, что поддержать этот уровень легче и безопаснее не накачкой организма ацетилхолином напрямую, а хитрым политическим ходом: блокадой фермента, который это вещество расщепляет (ацетилхолинэстераза этот фермент называется, если кому интересно). Вещество, которое этот фермент блокирует, называется, соответственно, ингибитором ацетилхолинэстеразы (это я не ругаюсь, а информирую).
В лечении пациентов используют три вида таких веществ: донепезил, галантамин и ривастигмин.
Вторая группа (состоит она пока из одного представителя) — это вещество, которое словно консервирует и сохраняет работоспособными клетки коры, не давая им зачахнуть и самоуничтожиться. Даже если человек их не включает в активный мыслительный процесс. Называется это вещество мемантина гидрохлорид. А если кто будет ворчать, что словосочетание сложно произносится, я открою страшную тайну: этот мемантина гидрохлорид — на самом деле неконкурентный антагонист N-метил-D-аспартат (NDMA)-рецепторов, вот!
Лекарства из обеих групп используют либо изолированно, либо сочетая: одно из первой, другое — из второй. Эффект (или его отсутствие, если процесс зашёл слишком далеко) можно оценить далеко не сразу — обычно не раньше третьего-четвёртого месяца лечения, а давать лекарство, если видно улучшение, придётся пожизненно. Но если у пациента к моменту начала лечения достаточное количество нервных клеток, способных откликнуться и начать работать — будет видно, что память стала лучше (или перестала ухудшаться). А сам человек стал вести себя более упорядоченно. Правда, стоит признать, что оба эти лекарства не излечивают, а лишь останавливают на время и до определённого уровня деменцию.
С остальными симптомами — той же тревогой, депрессией, бессонницей или бредом — справляются по мере их возникновения.
Есть и ещё одно направление, пока экспериментальное: вот уже несколько лет ведутся работы по получению вакцин и сывороток, способных и уменьшить симптомы уже начавшегося заболевания, и остановить ещё не развившееся. Но когда будет доведен до ума, обнародован и запущен в серию конечный продукт — пока неизвестно.
источник
