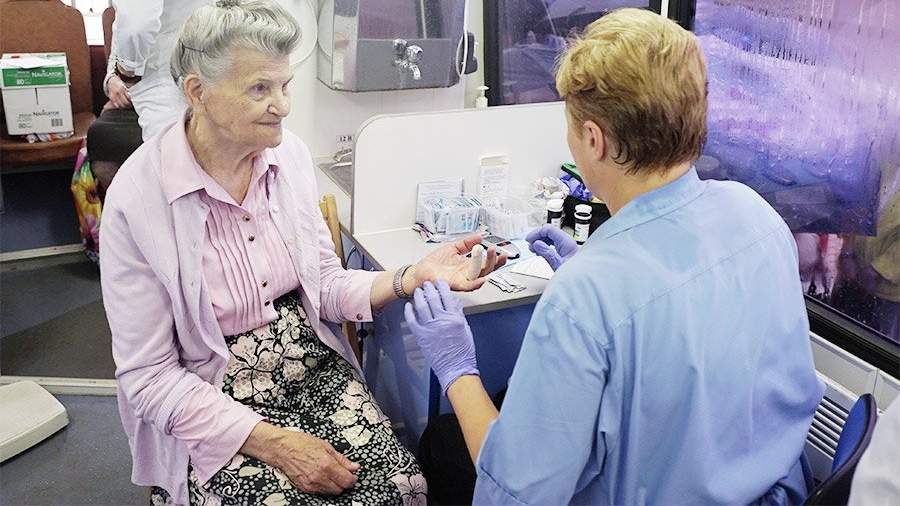
Ученые Курчатовского института разрабатывают методику раннего выявления болезни Альцгеймера. Она основана на исследовании иммунитета и позволит ставить диагноз по анализу крови. Больным не придется делать дорогую и травматичную спинномозговую пункцию. Ранняя диагностика даст пациентам возможность быстрее начать лечение и тем самым максимально отсрочить наступление слабоумия. Сегодня в России болезнью Альцгеймера страдает более 1,5 млн человек. Чаще всего ее выявляют на такой стадии, когда остановить или замедлить развитие недуга уже невозможно.
Сотрудники лаборатории иммунологии и вирусологии НИЦ «Курчатовский институт» обнаружили связь между болезнью Альцгеймера на начальной стадии и изменениями иммунитета. Это позволит проводить диагностику по анализу крови.
— Головной мозг человека имеет свою иммунную систему для защиты от инфекций и измененных клеток. При болезни Альцгеймера иммунные клетки мозга (микроглия, Т-лимфоциты) активируются, возникает нейровоспаление, — рассказал научный сотрудник лаборатории Сергей Крынский.
По его словам, это приводит к накоплению в мозге патологических белков, нарушению синтеза ростовых факторов — нейротрофинов, необходимых для выживания нейронов, повреждению и гибели нервных клеток.
Эти изменения видны при проведении специального анализа крови. Как пояснили ученые, существующие способы обследования (например, спинномозговая пункция) травматичны и дороги.
— Очевидное преимущество нашего метода — простая процедура забора биоматериала и техническая возможность воспроизведения необходимых исследований во всех лечебно-профилактических учреждениях, — отметил сотрудник лаборатории Даниил Огурцов.
По новой методике, учитывающей показатели иммунитета, уже успешно обследовано более сотни пациентов с начальной стадией болезни Альцгеймера. Лаборатория Курчатовского института работает в сотрудничестве с отделом гериатрической психиатрии Научного центра психического здоровья РАН.
Исследования продолжаются, чтобы применить результаты в клинической практике, потребуется еще несколько лет. Предварительные результаты опубликованы в журнале Neuroscience and Behavioral Physiology.
Главный внештатный гериатр Минздрава Ольга Ткачева рассказала «Известиям», что с каждым годом количество пациентов с болезнью Альцгеймера растет, так как население стареет. В нашей стране по приблизительным расчетам более 1,5 млн таких больных.
— К сожалению, на момент постановки диагноза у пациентов чаще всего уже выявляется деменция средней степени тяжести, — пояснила Ольга Ткачева.
По словам гериатра, детальное исследование связи иммунных изменений и болезни Альцгеймера позволит расширить знания об этом недуге и поможет разработке современных методов диагностики.
По данным специалистов Курчатовского института, болезнь Альцгеймера — самая частая причина приобретенного слабоумия, сейчас в мире ею страдают более 35 млн человек. К 2030 году их число, по прогнозам, увеличится до 66-70 млн. Остановить или задержать развитие болезни возможно только на ее ранней стадии, но диагностика на этом этапе пока затруднена.
Болезнь Альцгеймера возникает в результате дегенерации нервных клеток. Она в первую очередь затрагивает области мозга, отвечающие за память, а затем структуры, обеспечивающие другие когнитивные функции: внимание, распознавание информации, контроль поведения. Симптомы обычно возникают постепенно, нарастают с годами. Усиливается забывчивость, человек перестает ориентироваться в пространстве и узнавать окружающих.
источник
В лаборатории нейробиологии программирования действий в Институте мозга человека им. Н.П. Бехтеревой РАН занимаются поиском предикторов когнитивных расстройств, в том числе болезни Альцгеймера. Над этим работает мультидисциплинарная команда под руководством доктора биологических наук, профессора Юрия Дмитриевича Кропотова, куда входят нейрофизиологи, психологи, физики, математики, психиатры.
Материал опубликован в июльском выпуске журнала «В мире науки»
— Юрий Дмитриевич, сегодня в мире тысячи лабораторий пытаются найти разгадку появления болезни Альцгеймера, ищут эффективные средства лечения, по этой теме ежегодно публикуются сотни и сотни научных статей, но серьезного прорыва не происходит. Где корни этой проблемы, на ваш взгляд?
— Мне кажется, прорыв происходит как раз сейчас, на наших глазах. Попытаюсь объяснить свою точку зрения. Проблема упирается в развитие исследований человеческого мозга в целом. Напомню, что 90-е гг. ХХ в. были официально названы «декадой мозга», — именно тогда были сформулированы новые концепции функционирования мозга, основанные на результатах многолетних предшествующих исследований. Были разработаны также новые методологические подходы для создания технологий фиксации локальных очагов активности мозга.
Начало ХХI в. (2000–2015) может быть определено как «декада открытий», когда мы научились чувствовать, фиксировать более тонкую настройку человеческого мозга. Например, мы стали понимать, что представляют собой нейронные сети при правильном и измененном, патологическом функционировании мозга. Как результат появилась возможность воздействовать на эту «тонкую настройку» с помощью различных немедикаментозных методов лечения — электрической, магнитной стимуляции и других.
Сейчас «декада открытий» сменяется «декадой расшифровки», когда мы начинаем использовать в клинике различные нейромаркеры при большинстве психических заболеваний, чтобы обеспечить не только раннюю диагностику и профилактику, но и персонализированное лечение конкретного пациента. Ранняя диагностика с помощью нейромаркеров потребует в свою очередь развития превентивных, профилактических вмешательств.
— Насколько быстро эти исследования приходят в клинику? Вопрос касается не только болезни Альцгеймера, но и широкого ряда психических и когнитивных расстройств. Часто ли психиатры используют при диагностике новейшие инструментальные методы?
Профессор Ю.Д. Кропотов, заведующий лабораторией нейробиологии программирования действий в Институте мозга человека им. Н.П. Бехтеревой РАН
— Далеко не всегда. Например, если кардиолог видит пациента с болью в груди, он обязательно сделает ему ЭКГ, то есть «запишет» электрическую активность сердца. Эта информация нужна, чтобы напрямую измерить степень и регулярность сердцебиения, узнать о наличии повреждения. ЭКГ может дать ответ на вопрос, есть ли у больного инфаркт. Психиатр же в большинстве случаев, наблюдая пациента, скажем, с симптомами шизофрении, не прибегает к электроэнцефалографии (ЭЭГ) как к обязательному методу обследования, несмотря на установленный факт, что ЭЭГ регистрирует электрические импульсы мозга и теоретически могла бы рассказать гораздо больше, нежели просто внешние симптомы. Отсюда вопрос: почему мы повсеместно используем ЭКГ при диагностике заболеваний сердца и не используем аналогичный метод в психиатрии?
По нескольким причинам. Прежде всего, из-за разной сложности объектов. В подавляющем большинстве случаев для постановки диагноза необходимо анализировать ограниченное количество параметров ЭКГ. Это всего лишь пять видов волн, которые легко идентифицировать и расшифровать. Напротив, число параметров, которые фиксирует современная мультиканальная ЭЭГ, неизмеримо больше. А если мы используем метод регистрации вызванных потенциалов (ERPs), то количество анализируемых параметров возрастает в несколько раз.
Во-вторых, параметры волн ЭЭГ и вызванных потенциалов сильно варьируют, они нестабильны. Более того, они очень чувствительны к колебаниям, отклонениям, «шуму». Опираясь на эти параметры, можно сказать, что популяция здоровых людей неоднородна с точки зрения функционирования мозга.
Нужно принять во внимание гетерогенность диагностических категорий психических заболеваний, трудности в дифференцировке, нужно отделить пациентов с определенным диагнозом от здоровой контрольной группы. В-третьих, процедура записи и расшифровки ЭКГ полностью стандартизована. В ЭЭГ же стандартизовано только положение электродов. Другие параметры, особенно связанные с записью вызванных потенциалов, не подчиняются стандартизации. Как следствие — сильно ограничена возможность создания баз данных в клинической практике.
Ну и, наконец, сердце при всей его сложности все же устроено существенно проще, чем мозг, который традиционно называют самым сложным объектом во Вселенной. Кардиолог в клинической практике опирается на существующую теорию работы сердца. Но общепринятой теории функционирования мозга до сих пор нет.
— И все-таки исследователи пытаются справиться с этими сложностями и зафиксировать эту «тонкую настройку», найти объективные биомаркеры, с помощью которых можно измерить различные психические и когнитивные нарушения. Об этом и ваша книга «Функциональные нейромаркеры для психиатрии», которая только что вышла на английском языке в издательстве Elsevier Academic Press. В ней вы анализируете работы зарубежных коллег в данной области и исследования вашей лаборатории. Какие сегодня существуют подходы к раннему выявлению деменции?
— Развитие деменции можно предсказать, причем задолго до проявления клинических симптомов, с помощью той же ЭЭГ. ЭЭГ, как известно, бывает двух видов: спонтанная (измерение электрической активности мозга в покое) и вызванные потенциалы (измерение электрической активности в ответ на определенные стимулы). Спонтанные осцилляции вызываются различными механизмами саморегуляции. В коре и в мозге существует много таких механизмов, и они выражаются в колебаниях. Нарушение механизмов кортикальной регуляции — это нейромаркер: значит, что-то не так. По этому поводу было много исследований у нас и за рубежом. Были обнаружены определенные нейромаркеры, которые возникают лет за десять до появления клинических симптомов. Один из них — появление медленноволновой активности в лобных отделах коры, которую можно зафиксировать при помощи ЭЭГ. Когда мы смотрели пациентов с болезнью Альцгеймера, то видели появление такой медленноволновой активности уже не только в лобных, но и в височных отделах коры.
Далее. Мозг человека воспроизводит альфа-ритм, у 90% людей он существует в диапазоне 8–12 Гц, и его исчезновение — тоже нейромаркер. Правда, для того чтобы принять этот нейромаркер во внимание, нужно быть уверенным, что у данного пациента изначально существовал альфа-ритм, поскольку примерно 10% людей просто не имеют альфа-ритма и это их врожденная особенность, никак не связанная с заболеванием.
Значит, второй нейромаркер относительный, а первый, о котором я упоминал, — абсолютный. Эти изменения в ЭЭГ наблюдаются гораздо раньше морфологических изменений в мозге, на основании которых уже ставится диагноз заболевания. Почему они возникают? Потому что мозг «умный», и он, фиксируя самые первые признаки нарушений, пытается адаптироваться к ним при помощи этой «тонкой настройки».
Биомаркер болезни Альцгеймера. A. Потенциалы мозга здоровых испытуемых и пациентов с болезнью Альцгеймера в ответ на игнорируемые стимулы и стимулы, требующие ответной реакции. Показана волна П300, записанная с электрода Pz (теменная область). B. Зависимость латентности волны П300 от степени когнитивных нарушений. При болезни Альцгеймера время реакции мозга значительно увеличивается.
Мозг вообще быстро адаптируется. Например, мы знаем, что с возрастом замедляется скорость процессов переработки информации. Знаем и можем наблюдать, что нейронов становится меньше, амплитуда вызванных потенциалов уменьшается. Но мы можем также видеть, что мозг компенсирует эти изменения. Уменьшение вызванных потенциалов происходит в основном в задних отделах коры, а активность лобных долей, наоборот, увеличивается. Но когда компенсации недостаточно, возникают серьезные нарушения.
Основной принцип, на котором строятся исследования вызванных потенциалов мозга, следующий: человеку предъявляются различные стимулы (звуки, вспышки света), а ему надо отреагировать на них, нажав на кнопку, — например, когда в ряду коротких звуковых сигналов вдруг зазвучит длинный тон. Такие стимулы вызывают в мозге достаточно бурную реакцию, которая приводит к тому, что возникает волна определенной амплитуды, которая называется П300. Амплитуда и латентный период (время ожидания) определяют, как быстро мозг человека реагирует на новый стимул. Согласно исследованиям, которые проводились в течение последних 20–30 лет, изменения волны П300 происходят гораздо раньше клинических симптомов.
Есть и другие подходы — о них, собственно, моя книга, — которые позволяют повысить точность диагностики. Но основная идея такова: мозг начинает реагировать на развитие дегенеративных процессов раньше появления клинических симптомов, поскольку адаптируется и пытается компенсировать изменения.
— Вы упоминали и другие методы диагностики — функциональный магнитный резонанс, позитронно-эмиссионный томограф. Можно ли что-то увидеть с их помощью?
— Эти методы в настоящее время широко применяются в клинике. Они вошли в обязательные протоколы обследований при различных заболеваниях. Однако для исследований в области психиатрии, где важную роль играет тонкая настройка различных мозговых процессов, отношение сигнала к «шуму» в этих методах недостаточное. Но теоретически, если хорошо настроить метод, найти соответствующие рецепторы, ПЭТ может дать многое. Можно увидеть скопления пептидов, которые тоже представляют собой биомаркеры — предшественники нейродегенеративных заболеваний. А в диагностике различных видов деменций уже сейчас ПЭТ и фМРТ занимают далеко не последнее место.
В нашей лаборатории мы используем ЭЭГ и вызванные потенциалы, о которых я рассказал подробно. Нас интересует поиск ранних нейромаркеров — предвестников не только болезни Альцгеймера, но и ряда других психических и неврологических заболеваний.
— А как можно использовать эти знания практически? Что делать человеку, у которого обнаружены ранние предвестники?
— Развитие заболевания можно замедлить, используя различные методы: физические занятия, аэробику и пр., укрепление социальных контактов, соответствующее питание плюс специальные когнитивные упражнения. Не будем забывать, что мозг способен компенсировать нарушения, поэтому период компенсации можно продлить и дать человеку порядка десяти дополнительных лет. Это довольно много, учитывая развитие науки.
— Но мы ведь знаем примеры больных, у которых была очень насыщенная жизнь, высочайшая интеллектуальная и физическая нагрузка, хорошее питание: Рональд Рейган, Айрис Мердок. Все это не уберегло их.
— На этот вопрос ответа нет. Конечно, есть что-то еще, кроющееся в генах, белковых реакциях. На данный момент медицинская наука не располагает убедительными доказательствами того, что стиль жизни, особенности диеты, общие показатели здоровья и даже лекарства могли бы предотвратить болезнь Альцгеймера. Однако учеными разных стран проводятся широкомасштабные исследования, и определенные закономерности все-таки удается выявить. Например, люди, придерживающиеся так называемой средиземноморской диеты, подвергаются на 28% меньшему риску развития умеренных когнитивных нарушений, причем у 48% больных с умеренными когнитивными нарушениями болезнь Альцгеймера не развивается.
— Известно, что в сотрудничестве с психиатрами, в том числе зарубежными, ваша лаборатория разрабатывает и апробирует новые методы профилактики и лечения подобных расстройств. Каковы результаты?
— Общее название этих методов — методы нейромодуляции. Например, микрополяризация мозга при помощи накожных электродов. Обследовав больного посредством перечисленных методов, мы можем выстроить его «микротопографию» и определить точки, куда ставить электроды. Лечение заключается в активации определенных зон мозга. Электроды накладываются на поверхность головы, и через них в течение часового сеанса пропускаются слабые токи, больной ничего не чувствует. Нужно как минимум десять таких сеансов. Через какое-то время повторить обследование, и если потребуется — назначить дополнительное лечение.
Хочу добавить, что сейчас активно исследуются и развиваются подобные нефармакологические методы лечения. Отчасти это происходит потому, что попытки найти или синтезировать эффективные препараты для лечения определенных психических заболеваний, например шизофрении, пока не привели к успеху. Причинами тому — ограниченная эффективность, сильные побочные явления, недостаточная изученность механизмов действия самих веществ, трудоемкий скрининг.
Достаточно эффективными оказались нефармакологические методы: транскраниальная магнитная стимуляция (TMS), транскраниальная стимуляция постоянным током (tDCS), стимуляция глубоких структур головного мозга (DBS). С их помощью (предположительно) можно модулировать нейронные сети мозга.
Другой новый подход — оптогенетика. Она заключается во введении в мозг нейронов при помощи транспортного вируса, содержащего генетическую информацию для светочувствительных белков. Эти клетки можно контролировать, используя вспышки света, который пропускается по встроенным фиброоптическим волокнам. Хотя метод пока был опробован только на животных, есть надежда, что он появится в клинике в течение ближайших нескольких лет.
Юрий Дмитриевич Кропотов
Заведующий лабораторией нейробиологии программирования действий Института мозга человека им. Н.П. Бехтеревой РАН, доктор биологических наук, профессор.
Разработал теорию программирования действий, объясняющую нейронные механизмы когнитивного контроля в норме и при психических заболеваниях у человека. На ее основе создал новую методологию оценки функциональных нейромаркеров здорового головного мозга человека и впервые в мире сформировал международную нормативную базу данных. За последние 15 лет им открыты функциональные нейромаркеры мозговых дисфункций при синдроме нарушения внимания, шизофрении, навязчивых состояниях и депрессии.
Читает курсы лекций по разработанной методологии в СПБГУ, в Норвежском университете естественных и технических наук, в Краковской академии им. А.Ф. Моджевского.
Лауреат Государственной премии СССР, профессор Норвежского университета естественных и технических наук, президент Европейского общества нейрорегуляции, лауреат премии Коперника Польского нейропсихологического общества, почетный доктор наук Гданьского университета, редактор международного журнала Neurotherapy (США), а также Acta Neuropsychologica, Frontiers in Aging Neuroscience.
источник
Вылечить болезнь Альцгеймера, Хаттингтона и Пика: истории шести учёных, которые исследуют человеческий мозг
Конспект статьи издания Popular Mechanics — о том, как в Сиэтле составляют атлас мозга, а в Нью-Йорке распутывают белковые клубки.
В 1984 году Эл Гарднер и его шурин своими руками построили двухэтажный дом с тремя спальнями и верандой. Гарднер с детства любил технику, долгие годы работал на стройках.
Теперь Эл с трудом поднимается на второй этаж, потому живёт на первом. Он истощал, его лицо осунулось, речь стала непонятной. Шесть лет назад у Эла обнаружили прогрессирующий супрануклеарный парез взора (ПСПВ) — клетки в отделах его мозга, отвечающих за движение, равновесие и мышление, постепенно разрушаются. С таким диагнозом живут около семи лет.
Причины развития ПСВП до сих пор точно неизвестны, как не известны и методы его лечения — препараты, облегчающие симптомы болезни Паркинсона, в случае Эла не работают. Кроме аспирина, антацидов и таблеток для контроля мочевого пузыря он ничего не принимает.
Со временем Эл потерял способность моргать и двигать глазами, и ему приходится постоянно носить солнцезащитные очки. Но общаться он ещё может — с помощью белой доски с маркерами.
Жена Эла, Фрэн, активно участвует в жизни сообщества больных ПСВП. «Повезло, что у нас было всё это время, — признаётся она корреспонденту на втором этаже, откуда Эл её не услышит. — Могло быть гораздо хуже».
Каждый год в США проходит конференция Американского общества нейронаук, на которую съезжается более 30 тысяч профессоров, докторов, аспирантов и исследователей из более чем 80 стран, чтобы обсудить будущее человеческого мозга.
Среди приглашённых лекторов — нейробиолог из Мюнхенского университета Магдалена Гётц. Она будет рассказывать о лечении травм мозга у мышей.
Механизм возникновения болезней, подобных ПСВП, сводится к одному — нейроны не восстанавливаются. Клетки мозга, ответственные за обработку информации, погибают (за некоторым исключением).
Поэтому сегодня у врача, столкнувшегося с нейродегенеративным расстройством, выбор невелик: или постараться сохранить как можно больше нейронов, или заставить работать повреждённые секторы. Если бы учёные смогли вынудить нейроны самопроизвольно срастаться, это стало бы одним из самых невероятных достижений нейронауки. Пока же такое невозможно.
Гётц, однако, не изучает нейроны, по крайней мере, не в первую очередь. Она работает с другой группой клеток — нейроглией. На глию, от греческого «клей», приходится минимум половина клеток мозга, но в течение пятидесяти лет учёные считали, что она служит лишь каркасом для нейронов.
Тем не менее в 1990 году стэнфордский исследователь Стивен Смит обнаружил: особый тип глии, клетки в форме звезды, названные астроцитами, могут общаться между собой. С тех пор учёные пытаются выяснить, на что ещё они способны. Список растёт.
«При травме мозга в дело вступают астроциты», — рассказывает Гётц. Они могут как поразить ещё больше нейронов, так и поддерживать их жизнь, регулировать соединение нейронных сетей после их разрыва или образовать шрам. Астроциты играют важную роль в жизнедеятельности, после повреждений мозга главный врач — именно они.
Гётц и её команде в Мюнхене удалось с помощью определённых белков, факторов транскрипции, полностью изменить функции астроцитов после травмы. Вместо формирования рубцовой ткани астроциты Гётц превращаются в новые нейроны, заменяющие утраченные.
Учёной удалось проделать подобное с человеческими клетками в пробирке и с живой крысой. Через год после выступления в Вашингтоне, она опубликовала совместную обзорную статью с врачом, который занимается больными с Паркинсоном, и работает над оральными способами доставки белков в мозг, вместо того чтобы вводить их напрямую.
«Прогнозы относительно того, через сколько лет технология будет применима в лечении человека, совершенно сбивают с толку, — отмечает Гётц. — Первые успешные эксперименты с живыми животными мы провели в 2005 году, и тогда это считалось чем-то совершенно невероятным. Лишь спустя 15 лет мы добрались до уровня, когда нами заинтересовались лечащие врачи».
В операционной медицинского центра Харборвью работает Джеффри Ожманн, потомственный нейрохирург. На столе — девушка 23 лет. Она, вероятнее всего, в сознании: Ожманн часто будит пациентов в этой части операции и воздействует током на мозг, пока они называют объекты на картинках. Хирург не хочет случайно удалить невосстановимую группу нейронов на пути к эпилептическому очагу, который вызывал приступы.
Ожманн делает надрез в височной доле, над ухом, избегая элоквентных зон — частей мозга, отвечающих за движение, слух, зрение и речь. Постепенно он заходит глубже, подбираясь к очагу — Ожманн постарается удалить как можно меньше.
Всё это время за дверьми операционной ждёт научный сотрудник Тамара Каспер. Тут выходит медсестра и отдаёт ей банку с чем-то огненно-красным внутри. Это ткань мозга, которую Ожманну пришлось удалить, чтобы добраться до очага.
Каспер кладёт банку в сумку-холодильник и отдаёт курьеру — через 15 минут посылка прибудет в Алленовский институт головного мозга, основанный Полом Алленом, одним из создателей Microsoft. Там частички мозга, присланные Каспер, станут постоянной частью первой в мире карты нейронов человеческого мозга.
Многие думают: если хирурги способны делать операции на мозге, значит, должна быть какая-то карта его устройства. Это верно лишь отчасти. Структурная диаграмма мозга появилась ещё в начале прошлого века; она описывает отделы, состоящие из разных клеток.
Но большая часть из того, что известно докторам о работе того или иного участка, обнаруживается благодаря воздействию током или функциональной МРТ, показывающей изменения в кровотоке. Многому учатся врачи, случайно удаляя те области, которые трогать не следовало.
Тем не менее пробелов на карте всё ещё много. Если сравнить изученность мозга с изученностью других частей тела, то мозг окажется вовсе не исследованным.
В 2003 году Аллен узнал, что у его матери развивается болезнь Альцгеймера, после чего пожертвовал $100 млн на открытие научного института, где можно было бы проводить всесторонние и трудоёмкие исследования мозга.
За годы работы Алленовский институт составил несколько генетических атласов головного и спинного мозга. В соответствии с распоряжением Аллена, все собранные данные находятся в открытом доступе. Впрочем, даже этого недостаточно, чтобы объяснить, как мозг обрабатывает информацию. В конечном счёте сотрудники института задались вопросом: а не поможет ли исследователям периодическая таблица всех клеток мозга? Сколько их типов вообще существует?
Судя по всему, больше тысячи. Уже три года институт работает над первым в своём роде каталогом клеток мозга, разделяя их по электрической активности, экспрессии генов и морфологии.
Начав с клеток мозга мыши (их проще достать), учёные не так давно перешли к человеческому мозгу; они объединились с шестью местными врачами и собирают образцы, оставшиеся после операций, которые бы в противном случае попросту выкинули.
Определение клеточного типа станет необходимым, обязательным шагом в понимании того, кто мы есть.
После прибытия образца из клиники Харборвью начинают работу команды исследователей: на анализ у них есть не больше трёх дней, а то и нескольких часов — клетки быстро погибают. Кто-то, проводя анализы, засидится в лаборатории до глубокой ночи. Однако образцы человеческого мозга приходят в институт не так часто — 40 раз в год — и каждый делится между шестью исследовательскими группами.
Каталогизация клеток не единственный амбициозный проект, которым занимается институт. Несколькими этажами ниже группа ультрамикроскопии делит кубический миллиметр мышиного мозга на 25 тысяч кусочков и, сняв 250 млн фотографий этих частиц, загружает изображения в программу, похожую на Google Street View, которая позволит учёным отследить миллиарды связей между сотней тысяч нейронов.
Команда уже создала первый прототип — по нажатию нейрон увеличивается, показывая как и с чем он соединён. Среди спонсоров проекта — IAPRA, агентство в подчинении Национальной разведки, и Google.
Глядя на работу исследователей, видишь будущее, где библиотека клеток, дополненная интерактивными картами, позволит проводить клеточные операции, менять структуру коры и даже восстанавливать повреждённые отделы мозга с помощью, например, разработок Гётц.
Управлять дельфином непросто — начать движение можно покачиванием руки, но он тут же переворачивается. Рука идёт по кругу — дельфин отдаляется. Волнообразное движение плечами — дельфин подплывает к рыбке и проглатывает её. И это самый простой вариант игры. «Всего в ней 110 уровней, на некоторых появляются акулы, а рыбка становится умнее», — говорит разработчик Промит Рой.
Рой, прежде работавший в Microsoft и Nvidia, — один из основателей студии Kata при Госпитале Джонса Хопкинса и одноимённом университете. Вместе с ним работают Омар Ахмад со степенью по информатике и Джон Кракауэр, глава университетской лаборатории мозга, обучения, анимации и движения. Совместными усилиями они создали одну из самых продвинутых терапевтических видеоигр.
Сейчас лечение травм мозга сводится к тому, чтобы терапией побудить его к самостоятельному восстановлению нейронных связей. Реабилитация — процесс долгий, сложный и скучный настолько, что нередко пациенты впадают в депрессию.
Рой, Ахмад и Кракауэр считают мотивацию главной проблемой: если пациент уверен, что ему предстоит «приблизительная» жизнь, когда он не сможет даже поднести кружку ко рту, а этот навык нередко отрабатывают на трудовой терапии, зачем ему вообще тратить силы на восстановление? Перенёсшим инсульт нужна терапия насколько занимательная, что они будут обращаться к ней снова и снова, какой бы сложной и длинной она ни была, пока не выполнят задание.
«Больным мы говорим: съешьте рыбу. И всё, больше никаких инструкций», — рассказывает Рой. Называется игра I Am Dolphin, в ней нужно управлять животным, двигая повреждённой частью тела (инсульт — это нарушение кровотока в мозгу, зачастую в одной его половине, поэтому двигать противоположной частью тела становится тяжело).
«Начиная игру, больной не знает, как двигается дельфин — нужно выяснить. Он не замечает, что он в больнице, что он болен, а только и думает: как бы съесть эту мелочь», — уверены Рой и его коллеги.
Учиться двигаться заново, притворяясь мультяшным персонажем, движения которого не ограничены человеческими, оказалось результативно. Пробный пациент Kata Дэвид Стивенсон был парализован с левой стороны. С помощью I Am Dolphin и системы утяжелителей он разработал руку до такой степени, что её движения почти неотличимы от движений здорового человека.
И хотя команда всё ещё обрабатывает данные, предварительные результаты показывают, что I Am Dolphin эффективнее, чем методы традиционной терапии. Вместе с тем уже сейчас разрабатывается вторая версия игры, более красочная, с мультиплеером. Возможно, больничные будни вскоре превратятся в виртуальный семейный футбол. Самим весельем, пожалуй, и объясняется действенность задумки Kata.
Большинство нейродегенеративных заболеваний, включая болезни Альцгеймера, Хантингтона и Пика, деменцию, ПСВП, латеральный склероз и хроническую травматическую энцефалопатию, связаны со скоплением в мозге различных белков, или нейрофибриллярными клубками.
Причины их появления неизвестны. Неизвестно, вызывают ли расстройство эти самые белки или что-то другое. Однако ясно, что их появление что-то значит. Вне зависимости от типа белка результат один — мозг путается в складках бесполезных белков.
Болезнь Альцгеймера — один из самых сложных случаев, так как путаются сразу два белка: предшественник бета-амилоида и тау-белок. Лекарств, предотвращающих спутывание, несмотря на все попытки, создать не удалось.
Спутанными белками и занимается биофизик из Колумбийского университета Энтони Фитцпатрик. Его подход к изучению клубков выглядит так: сначала он их замораживает, а затем с помощью мощного микроскопа делает снимки с разных углов. После учёный, используя компьютеры и свои знания по химии, пытается понять, как именно слиплись белки, почему и какими препаратами процесс можно исправить.
Недавно Фитцпатрик совершил настоящий переворот в исследовании болезни Альцгеймера, став первым, кому удалось заморозить белок из мозга недавно умершей от этого недуга женщины и создать его морфологическую карту. Начал он с тау-белка.
Складываясь правильно, тау-белок включается в структуры, стабилизирующие микротрубочки, поддерживающие аксоны, по которым идут нервные импульсы. Запутавшись, тау-белок не способен выполнять свои функции. Кроме того, он заставляет путаться и другие белки.
Недавние исследования показали, что ухудшение когнитивных способностей у людей с болезнью Альцгеймера тесно связано с распространением именно тау-белков, а не бета-амелоидов, как считалось прежде. ПСВП, которым страдает Эл Гарднер, и ряд других заболеваний считаются чистой таупатией. Именно их в первую очередь и надеется излечить Фитцпатрик.
Всего насчитывается шесть типов тау-белков разной длины и девять вариантов таупатии; учёный стремится выяснить, один ли тип вызывает все болезни. Тау-белок из мозга женщины, страдавшей Альцгеймером, сложился иначе, чем белок, изученный в лаборатории ранее.
Может быть, вся разница между болезнью Альцгеймера, ПСВП и хронической травматической энцефалопатией зависит от нарушений в тау-белке определённого типа? Можно ли, выяснив причину одного заболевания, установить её для всех остальных?
Единственный способ выяснить — составить карты слипшихся тау-белков, чем и занимается Фитцпатрик.
Долгое время Полина Аникеева занималась оптоэлектроникой. Среди её проектов, например, работа над технологией квантовых точек, которые можно встретить в дисплеях телевизоров.
Однако изменения в этой сфере происходят медленно, а Аникеевой хотелось изобретать невиданные прежде вещи. Нейробиология — молодая наука. Она оказалась подходящим полем для экспериментов, и постдок-программу Аникеева прошла в нейробиологической лаборатории Стэнфорда.
Как-то раз Аникеева, любительница гор, отправилась в поход, и одна из её подруг сорвалась со скалы, повредив позвоночник. Половина её тела полностью потеряла чувствительность, а пару позвонков врачи соединили большими титановыми болтами.
«Они даже не пытались провести функциональную стимуляцию или соединить хоть часть нервов», — комментирует Аникеева лечение подруги. Терапия тоже шла как обычно. Исследовательнице, которая много лет занималась совершенствованием полупроводниковых нанокристаллов для экранов, показалось, что для тех, кто учится заново ходить, делается недостаточно.
Мозговая стимуляция применяется в медицине с 1970 годов и за это время существенно улучшилась — во многом благодаря появлению механизмов обратной связи, обучающих алгоритмы систем. По словам издания, интерфейс по-прежнему оставляет желать лучшего, поскольку мозг, консистенция которого напоминает пуддинг, меняет форму с каждым ударом сердца. Напрямую присоединить к нему провод всё равно что царапать его ножом.
По этой причине Аникеева решила создать гибкие волокна, способные встраиваться в нервную систему, не вредя ей. Её последний прототип состоит из провода, по которому бежит ток, небольшой капсулы для доставки лекарств или других химических веществ и отражающего канальца, опсина, передающего свет.
Опсины — основа молодой науки, оптогенетики. Встраивая в нейроны гены белков, реагирующих на свет, учёные могут изучать принципы работы нервных клеток.
Аникеева и её коллеги изобрели биологические кабели, толщиной с волос — связки отдельных каналов (для света, жидкости и электричества), окружённые чистым композитом. Аникеева придумала водорастворимую оболочку, которая скрепляет волокна на время установки.
В будущем волокна Аникеевой могут стать основой для устройств, предназначенных для точной мозговой терапии. Уже сейчас коллеги исследовательницы тестируют провода на мышах с повреждённым спинным мозгом. Через подобные волокна можно подключать даже компьютерные интерфейсы, способные управлять телом пациента с Паркинсоном за него самого.
«Технически это реализуемо уже сегодня, — делится с изданием Аникеева, — но больным разработка сможет помочь в лучшем случае лет через десять». Впереди остаётся много работы: безопасность, улучшение алгоритмов, оценивающих нервную активность, диагностика заболеваний.
На территории Военного медицинского центра имени Уолтера Рида разместился Национальный центр передового опыта (NICoE). Его цель — дать пациентам покой. Персонал, передвигаясь по коридорам, общается шёпотом.
«Более 80% раненых в зарубежных конфликтах за последние 15 лет получили взрывные травмы, — приводит статистику Луи Френч, заместитель директора NICoE. — Самое ужасное здесь то, что взрыв ранит с головы до ног».
Ударная волна может привести к скручиванию или растягиванию аксонов, через которые общаются нейроны. Подобные повреждения не всегда видны на МРТ, и многие солдаты по возвращении домой страдают от необъяснимых неврологических и психических проблем. В 2007 году Конгресс США решил, что таким людям нужно место, где их будут обследовать и лечить. Так и появился NICoE.
И хотя нейроны сами по себе не восстанавливаются, можно научить мозг компенсировать потери, что и доказала команда Kata. В Бетесде делают нечто похожее: в рамках собственной программы центра, рассчитанной на четыре недели стационара, пациентов сначала обследуют, а затем отправляют на терапию.
71% военных, прошедших курс, замечают улучшения в качестве жизни. И это показатель в Центре Уолтера Рида, где обычно занимаются самыми сложными случаями.
И всё же работу врачей могло бы облегчить устройство, которое бы точно указало на те участки мозга, где аксоны повреждены. Сегодня большинство пациентов приходят в NICoE со сложными изменениями в поведении, причины которых могут крыться и в психологии, и в неврологии. Кроме того, как же вылечить орган, когда не видно, что с ним не так?
Пока наиболее эффективное такое устройство — магнитоэнцефалография (МЭГ). В клиниках США таких устройств всего девять. Они способны измерять мозговую активность «в прямом эфире» и давать врачам точные сведения о нарушениях работы мозга. Точность МЭГ позволяет врачам ставить диагнозы наверняка.
Так, например, пострадавший солдат не мог принимать решения на основе письменного текста. Врачи заключили, что у него есть нарушения исполнительных функций. Однако с ними было всё в порядке. Благодаря МЭГ доктора поняли: из-за травмы он просто не мог читать достаточно быстро, чтобы принимать решения, — и назначили правильное лечение.
Никто наверняка не знает, сколько осталось Элу Гарднеру. Но когда он мог ещё разговаривать с женой, ясно дал понять: его мозг достанется исследователям. ПСВП — болезнь, ключ к лечению которой может открыть путь к лечению десятка других.
источник
PET-сканирование мозга при болезни Альцгеймера демонстрирует угасание активности в височных долях
(иллюстрация US National Institute on Aging, Alzheimer’s Disease Education and Referral Center).
Болезнь Альцгеймера впервые была описана более века назад, однако до сих пор наука не смогла найти эффективного лечения для неё.
В последние несколько десятилетий генетические и биохимические исследования показали обширную сеть молекулярных взаимодействий в патогенезе болезни. То есть для лечения болезни Альцгеймера, возможно, нужен более широкий терапевтический подход, а не один единственный препарат, направленный на одну цель.
Даже несмотря на то, что обширные доклинические исследования в многочисленных лабораториях выявляли единичные патогенетические цели для потенциального вмешательства, в ходе экспериментов на людях терапия, направленная на одиночную цель, не оправдала ожиданий.
Как известно, состояние пациентов с хроническими заболеваниями вроде сердечно-сосудистых заболеваний, рака или ВИЧ может быть существенно улучшено с помощью комплексной терапии. Однако влияние комплексных комбинированных препаратов на болезнь Альцгеймера ранее на было изучено.
Новое исследование в этой области проводилось специалистами Центра исследований болезни Альцгеймера имени Мэри Истон при Калифорнийском университете в Лос-Анджелесе и Исследовательского института по проблемам старения Бака.
У 9 из 10 пациентов потерю памяти удалось обратить с помощью 36-ступенчатой терапевтической программы, которая включает комплексные изменения питания, стимуляцию мозга, физические упражнения, оптимизацию сна, определённые препараты и витамины, а также несколько дополнительных шагов, которые влияют на химию мозга.
Специалисты лаборатории Дэйла Бредесена (Dale Bredesen), профессора неврологии, ранее выяснили, что болезнь Альцгеймера обусловлена дисбалансом в передаче сигналов между нервными клетками. В нормальном мозге память оптимизируются таким образом, что неактуальная информация забывается. Но при болезни баланс нарушается, нервные связи подавляются и забываются многие необходимые воспоминания.
Такая модель в некотором смысле противоречит теории о том, что болезнь Альцгеймера обусловлена накоплением бляшек в сигнальной сети головного мозга. Однако Бредесен уверен: бета-амилоидные пептиды являются обычной частью любого мозга и при заболевании просто становятся составляющей частью более широкого набора молекул, дезактивирующих нервные связи.
Учитывая всё это, Бредесен и пришёл к выводу, что необходимо использовать не один целевой агент, а системный подход из множества компонентов. Он предлагает представить болезнь крышей с 36 отверстиями: если одним способом можно заделать одну дыру, остаётся ещё 35, так что существенных изменений не происходит.
Терапевтическое вмешательство Бредесен выбирает, основываясь на персональных характеристиках пациента. В качестве примера он приводит тяжёлый случай, при котором больная даже забывала дорогу домой. Её терапевтическая программа включала:
— ликвидацию всех простых углеводов, что привело к потере десяти килограммов веса;
— устранение клейковины и переработанных продуктов питания из рациона, увеличение количества овощей, фруктов, рыбы;
— йога для уменьшения стресса;
— 20 минут медитации ежедневно;
— приём мелатонина каждый вечер;
— увеличение часов сна с 4-5 до 7-8 в сутки;
— приём метилкобаламина;
— приём витамина D3;
— приём рыбьего жира ежедневно;
— приём кофермента Q10 ежедневно;
— оптимизация гигиены полости рта;
— восстановление заместительной гормональной терапии, прекращённой ранее;
— перерыв между ужином и завтраком – не менее 12 часов, а также как минимум три часа между ужином и сном;
— физические упражнения в течение как минимум 30 минут, 4-6 дней в неделю.
Это не все компоненты системы, но результат оказался положительным не только у несчастной женщины, но и у 9 из 10 пациентов, которые испробовали новую комплексную методику лечения. Субъективное и объективное улучшение было зафиксировано спустя 3-6 месяцев после начала применения терапии. Но улучшения оказались долгосрочными и при поддержании терапии сохранились больше двух лет.
Отметим, что десять пациентов, принимавших участие в исследовании, страдали потерей памяти из-за болезни Альцгеймера, амнезии, умеренных когнитивных нарушений или субъективных когнитивных нарушений. У пациента, состояние которого так и не улучшилось, наблюдалась поздняя стадия болезни Альцгеймера.
При этом шесть пациентов, которым пришлось прекратить профессиональную деятельность, смогли вернуться на свои рабочие места и даже продолжить работу с улучшившимися характеристиками. С момента лечения на сегодняшний день прошло уже два с половиной года, так что учёные могут судить о долгосрочных положительных результатах терапии.
«Выводы нашего исследования являются весьма обнадёживающими, хотя результаты неоднородные и ещё не было обширных клинических испытаний, – рассказывает Бредесен, один из авторов вышедшей недавно статьи. – В случае с болезнью Альцгеймера нет ни одного препарата, который мог бы остановить или хотя бы замедлить прогрессирующее заболевание: все лекарства лишь немного смягчают симптомы. Только за последнее десятилетие были проведены сотни клинических испытаний общей стоимостью более миллиарда долларов США, но безуспешно».
Недостаток новой программы — в её сложности. Ей нелегко следовать, медицинскому персоналу приходится постоянно следить за пациентами. Многие больные жалуются на изменение образа жизни и диету, а также большое количество таблеток. Однако у такой системы практически нет побочных эффектов, разве что улучшение здоровья и оптимизация массы тела.
Теперь система Бредесена должна пройти более обширное тестирование. В настоящее время по всему миру около 30 миллионов человек страдают от болезни Альцгеймера. Без эффективной профилактики и лечения перспективы достаточно мрачные: прогнозируется, что к 2050 году болезнь затронет уже 150 миллионов человек во всём мире.
источник
Под болезнью Альцгеймера, в медицине подразумевается комплекс нарушений в деятельности мозга в возрасте старше 65-70 лет: слабоумие, потеря памяти и других интеллектуальных способностей. Заболевание это коварно.
Оно подкрадывается незаметно, маскируясь поначалу под признаки, характерные для нормального старения. На ранних стадиях постепенно ослабевает память, особенно на последние события, утрачиваются инициатива, радостное отношение к жизни, интерес к привычным занятиям, в дальнейшем к этому добавляются нарушение ориентации в пространстве, а на поздних стадиях проявляется деградация психики. При этом заболевании разрушаются клетки головного мозга и неминуемо возникают проблемы с памятью, в мышлении и поведении человека.
Причины заболевания до сих пор неизвестны, несмотря на множество научных исследований. Одни ученые считают важнейшими генетические нарушения, другие присоединяют к ним сниженный синтез нейромедиатора ацетилхолина. Многие отдают приоритет длительным психоэмоциональным стрессам, нарушениям гормонального фона, травмам головы, хроническим заболевания мозга, нарушениям мозгового кровообращения и даже особенностям личности. При всем многообразии гипотез установлено, что при болезни Альцгеймера внутри и снаружи нейронов накапливаются нерастворимые образования ненормально свернутого белка – амилоида, из-за чего нарушаются связи между нейронами, нервные клетки гибнут, ткани мозга атрофируются.
Болезнь Альцгеймера считается «возрастным» недугом: до 70 % случаев заболевания характеризуются именно старческим слабоумием, при котором мозг перестает качественно функционировать, просто потому что постарел и «износился». Оставшиеся 30% — это виды слабоумия, которое возникает из-за патологии сосудов и клинических поражений мозга, не связанных с процессом старения: предрасполагает нелеченная гипертоническая болезнь, сахарный диабет, ожирение, малоподвижный образ жизни и недостаточная интеллектуальная активность в молодом и среднем возрасте.
В основе болезни Альцгеймера лежит постепенная атрофия (уменьшение в размерах) головного мозга. Это приводит к прогрессирующей потери памяти, причём вначале страдает память на недавние события, в то время как воспоминания юности и детства длительное время остаются сохранными. Постепенно к нарушениям памяти присоединяются трудности пространственной ориентировки, интеллектуальных операций, иногда страдает понимание речи. Развивается слабоумие, пациенты начинают нуждаться в посторонней помощи в быту и при самообслуживании.
Болезнь Альцгеймера – это прогрессирующее заболевание. Обычно от первых признаков забывчивости до глубокого слабоумия проходит 5-10 лет. Однако иногда (приблизительно 20% случаев) темп прогрессирования достаточно медленный и пациенты могут длительное время сохранять независимость и самостоятельность в повседневной жизни. Возможны и длительные остановки течения заболевания – периоды времени без видимого нарастания симптомов. Конечно, многое зависит от вовремя начатого лечения.
Диагноз болезни Альцгеймера устанавливается неврологом или психиатром на основании характерных симптомов и наличии признаков атрофии головного мозга по данным магнитно-резонансной или компьютерной томографии. Существуют методы эффективной терапии. Они не всегда могут остановить прогрессирование слабоумия, но замедляют его темп, уменьшают выраженность симптомов, благоприятно влияют на поведение, снижают потребность в посторонней помощи и уходе. Лечение наиболее эффективно на ранних стадиях заболевания.
СЕМЬ РАННИХ ПРИЗНАКОВ БОЛЕЗНИ АЛЬЦГЕЙМЕРА:
Национальный Институт старения (США) выделил семь ранних признаков возможной болезни Альцгеймера:
Повторение одного и того же вопроса.
Многократное повторение одного и того же рассказа, слово в слово.
Утрата повседневных навыков, таких как приготовление пищи или уборка квартиры.
Утрата способности вести финансовые дела, например, расплачиваться по счетам.
Неспособность ориентироваться в знакомом месте или расставлять обычные объекты домашнего обихода на их привычные места.
Пренебрежение личной гигиеной, утверждения типа «я и так чистый».
Поручение кому-либо принятия решения в жизненных ситуациях, с которыми раньше человек справлялся самостоятельно.
СТАДИИ БОЛЕЗНИ АЛЬЦГЕЙМЕРА:
*** РАННЯЯ ДЕМЕНЦИЯ ***
По мере прогрессирования болезни продолжается снижение памяти и других познавательных способностей. Симптомы на этой стадии обычно следующие:
Человек не может вспомнить, где находится, найти привычную дорогу.
Затруднения в обращении с деньгами, оплатой счетов.
Тратится больше времени на выполнение обычной повседневной деятельности.
Неверная или затрудненная оценка событий.
Потеря вещей или их расстановка в необычные места.
Изменения поведения и личности.
У большинства пациентов первые симптомы болезни Альцгеймера обычно проявляются в возрасте 60 лет. Чаще всего диагноз ставят именно на стадии ранней деменции.
*** УМЕРЕННАЯ ДЕМЕНЦИЯ ***
На стадии умеренной деменции повреждаются области мозга, контролирующие речь, интеллект, обработку внешней информации (например, зрительной и слуховой), осознанное мышление. Наиболее распространенные симптомы на этой стадии:
Прогрессивная потеря памяти и общая спутанность сознания.
Проблемы с узнаванием родных и близких.
Неспособность к обучению новым навыкам и умениям.
Трудности в выполнении многошаговых задач, таких как одевание.
Неспособность справиться с новой ситуацией.
Бредовые идеи и мания преследования.
*** ТЯЖЕЛАЯ ДЕМЕНЦИЯ ***
Пациенты с тяжелой деменцией не могут общаться и полностью зависят от посторонней помощи. Большую часть времени пациент проводит в постели. Наиболее распространенные симптомы на этой стадии:
Неспособность узнавать себя, знакомых людей, даже близких родственников.
В некоторых случаях судороги.
Неспособность контролировать мочевой пузырь и кишечник.
Галлюцинации, бредовые идеи;
Проблемы с движением (хождением), которые постепенно переходят в «шаркающую походку»;
Наиболее частой причиной смерти при болезни Альцгеймера является пневмония. Этот тип пневмонии развивается, когда пациент испытывает затруднения с глотанием, и частицы пищи или жидкость случайно попадают в легкие.
ПРОФИЛАКТИКА
Врачи утверждают, что возрастному слабоумию можно противостоять, оказалось, что все-таки есть определенные рекомендации, позволяющие во много раз снизить риск заболеть с возрастом этим заболеванием.
Вот какие профилактические меры они предлагают применять в течение жизни.
- Здоровый образ жизни. Существенное значение имеют особенности образа жизни человека. В принципе, все, что способствует здоровью мозга, может отстрочить наступление деменции. Поддерживать навыки самообслуживания. Необходимо также тренировать с пожилым человеком навыки самообслуживания, чтобы он привыкал к своему настоящему состоянию и был менее зависим от вас. Обычно отрабатывают навыки одевания и раздевания, приема пищи, туалета. Боритесь с невнимательным отношением его к себе. Обычно неопрятность и безразличие к своему виду проявляются на поздних стадиях заболевания. В любом случае нужно бороться с таким отношением. Убеждайте своего подопечного, что необходимо поддерживать гигиену, иначе возникнут другие проблемы со здоровьем. Следует установить режим и стараться всегда его придерживаться. Это поможет ему чувствовать уверенность и защищенность, а также облегчит ваш уход за ним.
- Психологическая поддержка. Измените свое отношение. Поскольку болезнь Альцгеймера неизлечима и постепенно сводит на нет, лишает заболевшего человека способности заботиться о себе, уход за ним фактически составляет основу терапии. Опыт показывает: если создать необходимую психоэмоциональную обстановку, применять специальные методы обучения и тренировки, то можно успешно поддерживать те функции, которыми больной еще владеет и во многих случаях избежать тяжелой деградации его личности. Прежде всего, вам нужно изменить свое отношение к болезни родственника. Ни в коем случае не впадайте в уныние относительно перспектив его лечения и, разумеется, никогда не показывайте свои сомнения. Не загадывайте, что случится в будущем, не истязайте себя заранее. Вместо этого живите днем сегодняшним, отмечая каждое действие, которое ваш подопечный смог выполнить сам или успешно повторил за вами. Вам нужно убедить престарелого в необходимости лечения и в том, что его состояние не так уж плохо. Расскажите ему о других людях, которые оказались в более худшем положении, чем он. Поощряйте чувство самоуважения. Очень важно принимать во внимание индивидуальные особенности пожилого человека, его интересы, запросы и пожелания. Выберите вместе с ним подходящее занятие. Это может быть все, что угодно – от ухода за домашним питомцем, уход и выращивание цветов до изготовления поделок для внуков. Главное, чтобы такое занятие вызывало у него приятные эмоции. Поощряйте физические упражнения, гуляйте с ним. По возможности учитывайте и разумные «не хочу!» престарелого. Не забывайте, что вы ухаживаете за человеком, которого могут обидеть неосторожные слова и поступки. Также нужно позаботиться о безопасности. Желательно не оставлять одного дома, так как его поведение часто бывает непредсказуемым: он может включить газ, поранить себя ножом, выйти на улицу и заблудиться, открыть дверь незнакомым посторонним. Любые острые или колющие предметы не должны лежать на видном месте. Рекомендуется также ограничить доступ к розеткам, водопроводным и газовым кранам, спичкам, замкам, балконам, окнам.
- Избегайте стрессов. Хронический стресс приводит к ухудшению памяти. Согласно результатам исследований, поддержание на протяжении нескольких дней высокого уровня кортизола (гормон стресса) негативно влияет на когнитивные процессы. Кроме того, хронический стресс способствует развитию тревожно-депрессивных расстройств, приводящих к нарушению памяти. Поэтому так важны правильная организация труда и отдыха, умение избегать стрессов.
- Высыпайтесь. Полноценный сон очень полезен для мозга — он не дает токсичным протеинам накапливаться в мозговых клетках. В частности, подсчитано, что, если спать только 4 часа в сутки, уровень смертельных протеинов повышается на 25 процентов.
- Занимайтесь физкультурой! Физическая активность улучшает мозговой кровоток, что, в свою очередь, способствует росту нервных клеток и стимулирует мыслительные функции. В процессе выполнения физических упражнений улучшается кровоток к мозгу; также активизируются клеточные механизмы, которые улучшают функцию мозга. Это доказано в исследованиях как на животных, так и с участием людей. Регулярные тренировки. По словам ученых Вашингтонского университета, регулярные физические тренировки помогают снизить риск развития болезни Альцгеймера на 40 процентов. Специалисты пришли к выводу, что у пожилых людей, которые тренировались три часа в неделю в течение десяти лет, в головном мозге оказалось больше кровеносных сосудов по сравнению с теми, кто был менее активен. Для профилактики болезни Альцгеймера очень важны кардиоупражнения, которые помогают лучше качать кровь, питающую мозговые клетки: 30 секунд ускорения – затем 90 секунд медленной расслабленной ходьбы.
- Употребляйте пищу, богатую витаминами. Употребление в пищу большого количества жиров и углеводов повышает риск развития атеросклероза и сахарного диабета, которые являются «благоприятной почвой» для возникновения нарушения мозгового кровообращения, а соответственно и деменции. Что же касается полиненасыщенных жирных кислот, то они, а также антиоксиданты, прежде всего витамины С и Е, оказывают протекторное действие в отношении головного мозга. Ешьте куркуму. В приправе куркума содержится куркумин – ингредиент, помогающий предохранять клетки головного мозга от образования бляшек. Вместе с витамином D куркумин стимулирует иммунную систему очищать мозг от опасного бета-амилоида – протеина, формирующего кровяные бляшки, считающиеся признаком болезни Альцгеймера.
- Думать полезно. Тренировать память и познавательные процессы. Мозг без регулярного использования начинает терять свою силу. В каком бы тяжелом состоянии ни находился заболевший, нужно тренировать его внимание, память и мышление. Если этого не делать, недуг будет развиваться быстрее и «смерть мозга» наступит преждевременно. Нейробика — зарядка для мозга. Ученые Университета Северной Каролины рекомендуют умственную разминку под названием “нейробика”. У людей интеллектуально активных по сравнению с неактивными риск развития болезни Альцгеймера гораздо ниже. Чем выше уровень образования, чем интенсивнее умственная нагрузка на протяжении жизни, тем больше нейронов обнаруживается при исследованиях в гиппокампе и центрах памяти. В пенсионном возрасте поддерживать умственную активность можно посредством решения логических задач, разгадывания кроссвордов, заучивание небольших стихотворений, после прочтение недлинных рассказов их пересказывание и т.п. Или попробуйте, например, одеться с закрытыми глазами или во время еды держать вилку другой рукой. Еще пример: просите престарелого пересказывать какой-то материал – от газетных статьей, коротких текстов до пересказа разговоров, которые человек слышал или в которых участвовал. Попробуйте вспомнить с ним навыки счета, таблицу умножения или алфавит, писать цифры, буквы. Можно периодически спрашивать, сколько ему лет, в каком году родился, как его полное имя и фамилия, какой адрес, где он живет, сколько лет ему было, когда у него родилась внучка или дочка. Обязательно просите это повторить, закрепить то, что вы ему подсказали. Хорошо тренировать способность подопечного ориентироваться во времени и окружающем пространстве: спрашивайте, например, какой сейчас год, число, день недели, месяц, время года, в каком городе живет, как пройти на кухню или в ванную, как дойти до магазина. Можно повесить прямо над кроватью пожилого человека календарь и ежедневно заострять его внимание на дате или придумать другие способы тренировки памяти. Доказано, что после подобных занятий у престарелых наступает улучшение общей ориентировки.
Такие нехитрые упражнения заряжают мозг активностью и пробуждают «заснувшие» клетки.
- Учите язык. Интенсивная умственная деятельность является отличной профилактикой болезни Альцгеймера. Ученые рекомендуют в течение всей жизни стремится к знаниям – постоянно изучать что-то новое для себя, получать дополнительное образование. Также можно начать учить второй иностранный язык. Канадские ученые утверждают, что изучение второго иностранного языка задерживает развитие болезни на несколько лет. Причем, если, к примеру, начать изучать его в среднем возрасте, то шанс развития болезни Альцгеймера снижается в три раза.
- Берегите голову. Вероятность формирования болезни Альцгеймера в 2 раза выше у пациентов, перенесших черепно-мозговую травму с потерей сознания более 1 ч, а также у курильщиков. Поэтому необходимо избегать травм головы при занятиях спортом или выполнении работы, связанной с повышенным риском травматизма. Прекращение курения в любом возрасте позволяет снизить вероятность развития деменции.
- Обеспечьте больше общения. Круг общения у всех пожилых людей естественно сужается, а больного знакомые и подавно забывают. Поэтому старайтесь больше общаться с вашим подопечным, причем на равных, в процессе доверительной беседы. Лучше говорить медленно, отчетливо, глядя ему в глаза. Не сдерживайте своих чувств: не стесняйтесь обнять и погладить его. Для облегчения понимания используйте слова-подсказки и вспомогательные жесты. Не оставляйте человека в роли пассивного слушателя, а напротив – обсуждайте с ним события или ситуации, спрашивайте совета. От такого общения он получит гораздо больше удовольствия, чем от простого выслушивания.
Есть данные, демонстрирующие, что люди с болезнью Альцгеймера, живущие самостоятельно (в одиночестве), имеют гораздо меньше шансов выжить, чем те, кто живет со своей семьей. Поэтому помните, что жизнь вашего родственника зависит от вас.
Попробуйте соблюдать эти нехитрые правила, и вы, возможно, почувствуете, что некоторые ваши проблемы разрешились.
источник